Effect of nitrate and phosphate concentration on growth of Microcystis wesenbergii and Scenedesmus obliquus
-
摘要:
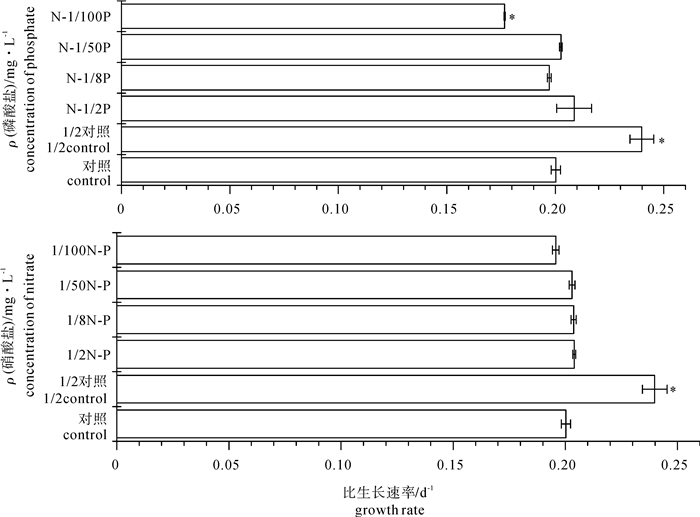
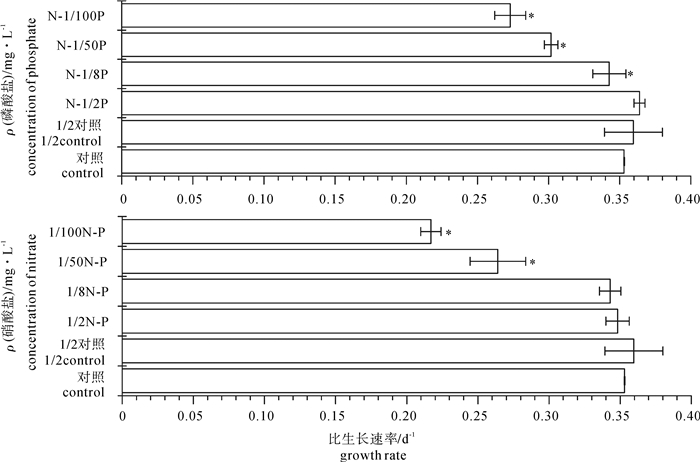
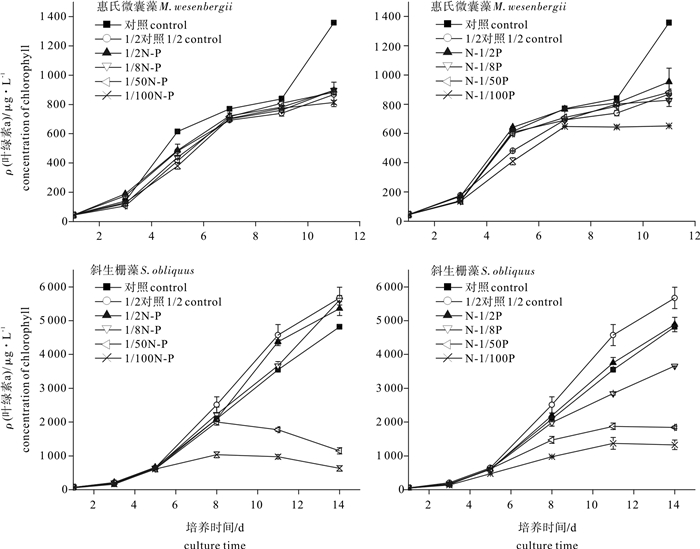
以惠氏微囊藻(Microcystis wesenbergii)和斜生栅藻(Scenedesmus obliquus)为研究对象,对比研究了氮(N)或磷(P)营养盐的相对限制对种群增长的影响。结果表明,培养11 d后,氮限制对惠氏微囊藻比生长速率、生物量、叶绿素浓度的最大抑制效应分别为2.25%、2.75%和40.01%;而对斜生栅藻的抑制效应分别为38.56%、58.64%和72.51%。磷限制对惠氏微囊藻比生长速率、生物量、叶绿素浓度的最大抑制效应分别为11.79%、10.94%和51.94%;对斜生栅藻的抑制效应分别为22.69%、49.62%和26.87%。氮磷营养盐起始浓度与2种微藻比生长速率、生物量之间多呈线性或指数型正相关关系。氮或磷单一营养盐处于富营养状态时,磷或氮营养盐浓度降低,惠氏微囊藻的生长仍能够维持在较高的水平,而斜生栅藻的生长则表现出显著的抑制效应。惠氏微囊藻对氮、磷限制的低敏感性是其获得种间竞争优势的生理学基础。
Abstract:Taking Microcystis aeruginosa and Scenedesmus obliquus as samples, we investigated the effect of concentration of nitrate and phosphate on algal growth. The results show that the maximum inhibitory rates of nitrate limitation on algal growth rate, biomass and chlorophyll content of M.wesenbergii were 2.25%, 2.75% and 40.01%, respectively, while those of S.obliquus were 38.56%, 58.64% and 72.51%, respectively. The maximum inhibitory rates of phosphate limitation on algal growth rate, biomass and chlorophyll content of M.wesenbergii were 11.79%, 10.94% and 51.94%, respectively, while those of S.obliquus were 22.69%, 49.62% and 26.87%, respectively. The positive correlation was observed among nitrate, phosphorus concentrations and algal growth rate, biomass both in linear or exponential types. Growth of S.obliquus was inhibited seriously compared with that of M.wesenbergii at nitrate or phosphate limitation. Lower sensitivity to nitrate or phosphate limitation of M.wesenbergii might support the priority of algal growth and competition.
-
Keywords:
- Microcystis wesenbergii /
- Scenedesmus obliquus /
- nitrate /
- phosphate
-
克氏原螯虾(Procambarus clarkii)俗称小龙虾,2017年我国克氏原螯虾的产量达到112.97×104 t[1],连续两年成为甲壳类淡水养殖第一品种。苗种运输是克氏原螯虾养殖生产过程中的重要环节,实际养殖生产中克氏原螯虾以干法运输为主[2]。干法运输即无水运输,它利用了克氏原螯虾抗缺水能力较强的特点。
在干法运输过程中,克氏原螯虾离开水体处于干露状态,随着时间的延长会对机体造成干露胁迫。目前已有对三疣梭子蟹(Portunus trituberculatus)、日本囊对虾(Penaeus japonicus)、脊尾白虾(Exopalaemon carinicauda)等甲壳动物干露方面的研究[3-5],而关于克氏原螯虾干露方面的研究尚未见报道。研究表明干露条件下,低氧、盐度、pH、失水等环境胁迫因子的联合作用引发了水产动物强烈的应激反应[4]。Omori等[6]认为蟹类的干露耐受能力由鳃的保水能力所决定,姜令绪等[3]研究表明三疣梭子蟹干露耐受性取决于温、湿度条件和幼体的发育阶段。在运输过程中,水生动物会通过调节血糖升高以适应各种胁迫[7],随着干露时间的延长,无氧代谢参与其中导致体内乳酸浓度上升[8]。姜娜等[4]发现干露胁迫下,三疣梭子蟹肝胰腺的总抗氧化能力(T-AOC)和机体胁迫程度有显著相关性;段亚飞等[9]认为谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和丙二醛(MDA)可作为日本囊对虾干露胁迫下的免疫监测指标。本文主要研究了不同干露时间胁迫和再入水过程中,克氏原螯虾血糖、肌肉乳酸、SOD、CAT、T-AOC、MDA和死亡率的变化,旨在选出与克氏原螯虾干露耐受性相关的健康指标,为干法运输改良和养殖监测提供理论参考。
1. 材料与方法
1.1 实验材料
克氏原螯虾幼虾取自上海海洋大学崇明基地,体质量为(8.7±0.4) g。幼虾暂养于循环水族缸(180 cm×180 cm×80 cm)中,时间为1周。养殖水温为(20±1) ℃、pH为7.6±0.3、光暗周期为14 h∶10 h、持续充氧,每天投喂配合饲料(浙江欣欣饲料有限公司)。干露容器为450 mL的PP塑料盒(8.8 cm×6.3 cm×12.0 cm)。
1.2 实验设计
克氏原螯虾幼虾干露实验在室内进行,配备了空调和抽湿机,温度为(20±1) ℃,相对湿度(relative humidity, RH)为(50±5)%。根据预实验的结果设4个干露时间组(6 h、12 h、18 h和24 h)和1个对照组(无干露处理),每组80尾幼虾,干露结束后记录各组成活率并在存活个体中随机抽取6尾用于酶活等指标测定,再将各组剩余的幼虾进行再入水处理,分别在第1、第6和第12小时随机抽取6尾幼虾用于酶活等指标测定并记录各组成活率。
1.3 实验方法
克氏原螯虾置于解剖盘上,用吸水纸擦干体表,将1 mL的注射器针头插入幼虾的附肢关节膜,抽取血液于2 mL的离心管中。剪开头胸甲和腹部取出肝胰腺和肌肉,用2 mL的离心管分装完后立即放入液氮里冻存,最后均保存于−80 ℃冰箱中待测。
肌肉和肝胰腺粗酶液的制备:取肝胰腺或肌肉样品称质量,移液枪取9倍于组织块的预冷匀浆介质,用电动匀浆器冰浴匀浆,充分匀浆后用4 ℃低温离心机8 000 r·min−1离心10 min,取上清液即为粗酶液,之后放入−80 ℃冰箱保存备用,用于组织酶活力的测定。
血清的制备:取出冻存的血淋巴样品,待样品融化后,用电动匀浆器冰浴匀浆,充分匀浆后用4 ℃低温离心机10 000 r·min−1离心10 min,取上清液即为血清待测液。
1.4 指标测定
T-AOC、SOD、CAT和MDA均采用苏州科铭生物技术有限公司试剂盒进行测定。T-AOC的单位定义为37 ℃条件下,样品组织使反应体系的吸光度(OD)每增加0.066时,为1个总抗氧化能力单位(U·g−1)。SOD活力测定采用NBT法,单位定义为在反应体系中抑制百分率为50%时,反应体系中的SOD酶活力定义为1个酶活力单位(U·g−1)。CAT酶活的单位定义为每克组织每分钟催化1 mol的H2O2降解定义为1个酶活力单位。MDA质量摩尔浓度(nmol·g−1)采用硫代巴比妥酸(TAB)法测定。血糖(μmol·mL−1)和乳酸(μmol·g−1)采用苏州科铭生物技术有限公司的试剂盒进行测定,具体方法按照试剂盒说明书进行。
1.5 数据分析
实验数据均以“平均值±标准差(
$\overline X \pm {\rm{SD}}$ )”表示,结果用SPSS 17.0软件进行单因素方差分析(One-Way ANOVA)和Duncan检验进行多重比较,P<0.05表示有显著性差异。2. 结果
2.1 干露胁迫和再入水对死亡率的影响
不同干露时间胁迫下克氏原螯虾累积成活率见图1。干露6 h和12 h组的幼虾成活率均为100%,干露过程中大部分时间表现为静止状态,身体蜷缩,用镊子触碰后立即张开螯足,作防御姿态,活力正常。18 h组的幼虾无个体死亡,但在干露过程中会有间歇性“躁动”现象:尝试从容器中爬出,触碰后反应迟钝。24 h组幼虾开始出现死亡(成活率为53.3%),表现为第二触角的顶端会明显卷曲,咀嚼器附近分泌出许多泡沫。
4个干露时间组的幼虾再入水成活率均为100%,其中12 h、18 h和24 h组的幼虾入水时会漂浮于水面,约2 min后再完全沉入水体。
2.2 干露胁迫和再入水对血糖浓度的影响
克氏原螯虾血糖浓度随着干露时间的延长逐渐升高(图2-a)。干露第6小时血糖浓度显著上升(P<0.05),之后持续升高,在第24 小时达到最高值(4.08 μmol·mL−1),是对照组(0.54 μmol·mL−1)的7.5倍,而且各处理组之间差异显著(P<0.05)。
![]() 图 2 干露胁迫下 (a) 和入水条件下 (b) 克氏原螯虾血糖浓度的变化不同字母表示在同一时间组的显著性相关(P<0.05),后图同此Figure 2. Change of blood glucose content of P. clarkii after desiccation stress (a) and resubmersion (b) treatmentDifferent letters indicate significant difference at the same time (P<0.05); the same case in the following figures.
图 2 干露胁迫下 (a) 和入水条件下 (b) 克氏原螯虾血糖浓度的变化不同字母表示在同一时间组的显著性相关(P<0.05),后图同此Figure 2. Change of blood glucose content of P. clarkii after desiccation stress (a) and resubmersion (b) treatmentDifferent letters indicate significant difference at the same time (P<0.05); the same case in the following figures.再入水阶段(图2-b),干露6 h组入水第1小时血糖浓度显著上升(P<0.05),第6小时略有下降,入水第12小时达到峰值(1.15 μmol·mL−1)。干露12 h组的血糖浓度呈下降趋势,第12小时达到最低值(0.94 μmol·mL−1),但仍显著高于对照组(P<0.05)。干露18 h组的血糖浓度呈下降趋势,入水1 h后显著高于对照组,入水第6小时开始降低,但仍显著高于对照组,入水第12小时又有所回升。干露24 h组入水第1小时血糖浓度显著高于对照组水平,入水第6小时达到峰值(1.05 μmol·mL−1),入水第12小时又有所下降。
2.3 干露胁迫和再入水对肌肉乳酸浓度的影响
克氏原螯虾干露后肌肉乳酸浓度见图3-a。与对照组(1.67 μmol·mL−1)相比,干露第6小时幼虾乳酸浓度(4.75 μmol·mL−1)显著升高(P<0.05)。在干露第12和第18小时,乳酸浓度一直维持在较高水平,和对照组有显著性差异。干露第24 小时达到最高(5.2 μmol·mL−1),但各组之间没有显著差异(P>0.05)。
干露6 h组和12 h组入水第1小时乳酸浓度即降低到对照组水平(图3-b),在入水第6和第12小时略有升高,但与对照组相比无显著差异(P>0.05)。干露18 h和24 h组的乳酸浓度呈逐渐下降的趋势,入水第1小时显著高于对照组(P<0.05),入水第6和第12小时略有下降,但仍显著高于对照组(P<0.05)。
2.4 干露胁迫和再入水对CAT活力的影响
克氏原螯虾肝胰腺中CAT活力随着干露时间的延长逐渐升高(图4-a)。CAT活力从干露第12小时开始显著高于对照组(P<0.05),之后维持此水平至第18小时。干露第24小时CAT活力达到最高[190 nmol·(min·g)−1],是对照组[37 nmol·(min·g)−1]的5倍,且CAT活力显著高于其他3个处理组(P<0.05)。
克氏原螯虾干露后入水阶段肝胰腺CAT活力见图4-b。干露6 h组入水后CAT活力一直维持较高水平,显著高于对照组(P<0.05)。干露12 h组在入水第6小时CAT活力达到最大值,在入水第12小时恢复至对照组水平。干露18 h组CAT活力逐渐下降,在入水第12小时恢复到对照组水平。干露24 h组CAT活力随着入水时间的延长逐渐升高,在入水第12小时达到最大值。
2.5 干露胁迫和再入水对SOD活力的影响
克氏原螯虾肝胰腺SOD活力的变化见图5-a。与对照组相比,干露第6小时SOD活力显著下降(P<0.05),之后一直维持较低水平,在干露第24小时有明显上升,但仍显著低于对照组水平。
干露6 h组在入水第1小时SOD活力显著低于对照组(P<0.05),入水第12小时酶活力达到最高(243 U·g−1),但仍显著低于对照组水平。12 h组再入水阶段SOD活力显著低于对照组水平(P<0.05),呈逐渐下降的趋势。干露18 h组入水第1小时SOD活力显著低于对照组,入水第6小时略有下降,在第12小时明显升高,酶活力达到峰值(371 U·g−1),但仍显著低于对照组水平(466 U·g−1)。干露24 h组SOD活力在入水第6小时(389 U·g−1)升高到对照组水平,之后在第12小时又明显降低,显著低于对照组(图5-b)。
2.6 干露胁迫和再入水对T-AOC水平的影响
与对照组相比,克氏原螯虾肝胰腺中T-AOC水平随着干露时间的延长无显著性变化(P>0.05),而且各组之间也无显著性差异(图6-a)。
干露6 h组T-AOC水平在入水阶段有逐渐上升的趋势(图6-b),入水第6小时开始显著高于对照组(85 U·g−1),在第12小时达到最高值(132 U·g−1)。干露12 h组T-AOC水平呈先下降再升高的趋势,在入水第1小时显著高于对照组,第6小时又下降到对照组水平,之后在第12小时又显著上升(P<0.05)到最大值(127 U·g−1)。干露18 h组T-AOC水平在入水第1小时显著高于对照组(P<0.05),之后一直维持较高水平,在入水第12小时达到最大值(137 U·g−1)。干露24 h组T-AOC水平入水第1小时显著升高(P<0.05),随后开始下降,在入水第12 小时降至对照组水平。
2.7 干露胁迫和再入水对MDA质量摩尔浓度的影响
干露胁迫对克氏原螯虾肝胰腺MDA质量摩尔浓度的影响见图7-a。MDA质量摩尔浓度随着干露时间的延长整体呈上升趋势。与对照组相比,前3个处理组的MDA质量摩尔浓度均无显著性差异(P>0.05)。干露第24小时达到最大值(31 nmol·g−1),且显著高于对照组(18 nmol·g−1)。
干露6 h组MDA质量摩尔浓度在再入水阶段呈先升高再下降的趋势(图7-b),入水第6 小时达到最大值(25 nmol·g−1),但与对照组之间无显著差异(P>0.05)。干露12 h和18 h组入水后MDA质量摩尔浓度逐渐上升,但与对照组相比无显著性差异。干露24 h组MDA质量摩尔浓度呈逐渐下降的趋势,入水第1小时显著升高(P<0.05),并达到最大值(30 nmol·g−1),入水第6小时略有下降,但仍显著高于对照组,入水第12小时降低到对照组水平。
3. 讨论
3.1 干露胁迫和再入水对克氏原螯虾成活率的影响
在本实验的温、湿度(20 ℃,50% RH)条件下,克氏原螯虾干露18 h的成活率为100%,干露24 h成活率降为53.3%。说明克氏原螯虾幼虾具有一定的干露耐受能力,但干露时间不宜超过18 h。实验中观察到,当幼虾的第二触角开始卷曲,咀嚼器附近有泡沫液体分泌时,幼虾会在短时间内死亡,这可能是幼虾遭受严重胁迫的信号。有研究认为蟹类干露后再入水过程中会排出体内代谢物,重新建立酸碱平衡,鳃小节体液再灌注,恢复至正常水平[10]。但是当再入水阶段发生氧化应激,一些重要的血淋巴物质超过了机体耐受,就会造成机体死亡[11-12]。值得注意的是,本实验中即使干露24 h组的幼虾死亡率已接近50%,入水成活率仍达到100%。说明克氏原螯虾对于干露再入水时的氧化应激有较强的抵抗能力。
3.2 干露胁迫和再入水对克氏原螯虾抗氧化能力的影响
动物机体的抗氧化水平,一定程度上反映了机体的健康状况。氧自由基(ROS)是机体代谢过程中排出外源物质和抗应激反应时的产物[13],包括超氧离子自由基(
$ {\rm{O}}_2^ {-} $ )、羟自由基(•OH)和过氧化氢(H2O2)。当机体内的抗氧化酶系统不能及时清除过量的ROS,就会造成氧化损伤[14]。肝胰腺作为甲壳动物氧化代谢的主要场所,抗氧化酶的水平较高,也是产生大量ROS的器官[15]。因此,本实验主要通过肝胰腺抗氧化酶活的变化来评估幼虾干露胁迫和再入水阶段的健康状况。总抗氧化能力(T-AOC)主要包括机体内的抗氧化酶体系和抗氧化物质体系,也是衡量机体抗氧化系统功能状况的综合性指标[16]。SOD是
$ {\rm{O}}_2^ {-}$ 主要的清除剂,可以与$ {\rm{O}}_2^ {-}$ 发生歧化反应,生成H2O2和O2,CAT再将H2O2分解生成H2O和O2,2种酶之间相互协同,抑制细胞膜脂氧化,减少氧化损伤[13]。本实验发现,SOD活力在干露阶段始终维持较低水平,分析可能是干露引起幼虾机体内产生了过量的ROS,SOD被用来还原$ {\rm{O}}_2^ {-}$ 导致SOD急剧减少[17-18]。CAT活力随着干露时间的延长逐渐上升,说明机体由于胁迫生成的H2O2引起了CAT酶活的显著升高,机体需要提高抗氧化酶活来适应这种胁迫环境。而T-AOC一直维持对照组水平,表明在干露阶段幼虾总的抗氧化能力没有明显下降。MDA是细胞脂类过氧化作用的产物,其浓度反映了细胞的受损伤程度[14]。干露第24小时MDA开始显著升高,说明此时幼虾体内的ROS不能被及时清除,过量的ROS对机体造成了氧化损伤甚至导致死亡(46.7%),同时CAT活力在干露第24小时达到了峰值,2种指标表现出较好的相关性。干露再入水阶段,各处理组的SOD活力始终低于对照组,CAT活力则明显高于对照组,说明机体在入水阶段内发生了氧化应激反应,产生了大量的ROS。干露18 h和24 h组的SOD活力在入水第6和第12小时明显升高,可能是因为干露时间更长,需要更多的SOD来清除体内的ROS。再入水过程中各处理组的CAT活力呈现波动性变化,没有明显的规律,这可能是机体应激反应中的“应激适应”和“应激损伤”造成的[19]。各处理组的T-AOC整体在对照组水平之上,而抗氧化酶体系中的主要组成SOD一直处于较低水平,表明再入水阶段机体内的抗氧化酶被大量消耗,当机体不能提供足够的抗氧化酶时,需要更多的抗氧化物质来抵抗氧化应激,维持ROS的平衡。干露24 h组的MDA质量摩尔浓度在入水第12小时能够降低到对照组水平,入水成活率同样也保持在100%,说明克氏原螯虾有较强的抗氧化应激和再入水恢复能力。
3.3 干露胁迫和再入水对克氏原螯虾血糖和乳酸浓度的影响
有报道称“高血糖”是甲壳动物典型的应激反应标志[20]。本实验中,血糖浓度在干露后呈阶梯式上升,显著高于对照组。这是由于在干露胁迫下机体需要消耗大量的能量,葡萄糖是水生动物血液中的主要糖类,糖原被迅速降解释放大量的ATP来供能[7, 21],导致血糖在短时间内大量增加。同时干露胁迫会导致鳃功能受损,进一步造成缺氧或低氧[22],无氧代谢加强,乳酸浓度随之升高[23]。本研究显示,干露后肌肉乳酸浓度显著升高,表明此阶段幼虾进行了无氧代谢,机体处于缺氧状态。而在干露6 h后肌肉乳酸浓度并没有持续增加,推测是肌肉中的乳酸及时释放到了血液里[24]。而释放到血液中的乳酸也可以作为糖异生原料合成葡萄糖[25],从而导致机体内的血糖升高。
干露再入水阶段,各处理组的血糖浓度明显高于对照组,说明干露后再入水过程中幼虾长时间处于胁迫应激状态,需要更多的能量来抵抗这种应激。干露6 h和12 h组的幼虾入水后,肌肉乳酸被迅速清除体外,恢复到对照组水平。而18 h和24 h组的幼虾干露时间更长,乳酸浓度也明显高于对照组,说明干露时间越短,肌肉乳酸的清除速率越快。整个再入水阶段,受乳酸转化葡萄糖维持酸碱平衡及葡萄糖供应的影响[26],只有干露6 h和12 h组的乳酸浓度恢复到了对照组水平,表明血糖比乳酸的恢复速率慢。
综上所述,干露胁迫时间对克氏原螯虾幼虾抗氧化系统有显著影响,幼虾的干法运输时间不宜超过18 h。抗氧化能力指标中,CAT和SOD对干露胁迫的反应更敏感,干露胁迫对血糖、肌肉乳酸也有显著影响,其中血糖的变化表现出明显的时间效应,可作为干露阶段幼虾健康状况的参考指标。MDA、血糖和肌肉乳酸浓度的变化能够更灵敏地反映出机体再入水阶段的健康状况。
-
表 1 氮磷浓度对微藻生长影响实验的浓度设置
Table 1 Concentration of nitrogen and phosphorus
组别group 磷浓度/μmol·L-1
Cp (N/P)氮磷比-磷(rP) 组别group 氮浓度/μmol·L-1 CN (N/P) 氮磷比-氮(rN) 对照control 17.6/0.29 60.69 对照control 17.6/0.29 60.69 1/2对照1/2 control 8.8/0.145 60.69 1/2对照1/2 control 8.8/0.145 60.69 N-1/2P 17.6/0.145 121.38 1/2N-P 8.8/0.29 30.34 N-1/8P 17.6/0.036 485.52 1/8N-P 2.2/0.29 7.59 N-1/50P 17.6/0.005 8 3 034.5 1/50N-P 0.352/0.29 1.21 N-1/100P 17.6/0.002 9 6 069 1/100N-P 0.176/0.29 0.61 表 2 不同氮磷起始浓度下微藻的生物量
Table 2 Effect of nitrogen/phosphorus concentration on biomass of algae
mg·L-1 组别group 惠氏微囊藻(M.wesenbergii) 斜生栅藻(S.obliquus) 对照control 161±5.9 472±6.2 1/2对照1/2 control 201±6.8* 531±9.5* N-1/2P 168±7.7 494±17.5 N-1/8P 158±10.7 422±23.4* N-1/50P 162±1.7 292±10.3** N-1/100P 143±3.1* 238±18.6** 1/2N-P 163±4.5 538±31.9* 1/8N-P 164±1.1 507±31.1 1/50N-P 162±1.0 261±24.3** 1/100N-P 157±1.1 195±6.4** 注:对照组为正常BG-11培养基;数字代表实验组氮或磷浓度与对照组浓度的比值;N.硝酸盐;P.磷酸盐;*.显著性相关(P<0.05);**.极显著性相关(P<0.01)
Note:The control treatment used BG-11 medium;the numbers represent the ratio of N or P concentration in different treatments compared with that of control;N. nitrate;P. phosphate;*. significant difference at 0.05 level (P<0.05);**. very significant difference at 0.01 level (P<0.01)表 3 氮磷浓度、氮磷比与惠氏微囊藻微藻比生长速率和生物量的相关关系拟合曲线
Table 3 Relationship between initial nitrogen, phosphorus concentration and growth rate, biomass of M.wesenbergii
方程equation 指标index 关系式relations 线性方程linear 氮磷比-磷rp 比生长速率μ=-5.22×10-6rP+0.21,R2=0.744 8,P=0.038 指数方程exponential 磷浓度Cp 干质量DW=-2 239.48×e(-Cp/0.000 59)+160.46,R2=0.967 4,P<0.01 线性方程linear 氮磷比-磷rp 干质量DW=-0.003 2r+163.21,R2=0.824 6,P=0.021 指数方程exponential 氮浓度CN 干质量DW=-76.07×e(-CN/0.07)+163.17,R2=0.721 5,P<0.01 指数方程exponential 氮磷比-氮rN 干质量DW=-79.31×e(-rN/0.24)+163.21,R2=-0.761 2, P<0.01 注:CN和CP表示实验设计的氮或磷浓度;rN和rP表示实验设计的氮或磷浓度变化产生的氮磷比检验;后表同此。
Note:CN and CP represent concentrations of nitrate and phosphate,respectively;rN and rP represent the N/P ratio varied with nitrate and phosphate,respectively;the same case in the following table.表 4 氮磷浓度、氮磷比与斜生栅藻比生长速率和生物量的相关关系拟合曲线
Table 4 Relationship between initial nitrogen, phosphorus concentration and growth rate, biomass of S.obliquus
方程equation 指标index 关系式relations 指数方程exponential 磷浓度Cp 比生长速率μ=-0.12×e(-CP/0.006 7)+0.35,R2=0.902 3,P=1 线性方程linear 氮磷比-磷rp 比生长速率μ=-1.55×10-5rP+0.35,R2=0.908 9,P<0.01 指数方程exponential 磷浓度Cp 干质量DW=-291×e(-CP/0.012 3)+472,R2=0.990 6,P<0.01 线性方程linear 氮磷比-磷rp 干质量DW=-0.049rP+474.94,R2=0.931 6,P<0.01 指数方程exponential 氮浓度CN 比生长速率μ=-0.17×e(-CN/0.692)+0.35,R2=0.994 1,P=1 指数方程exponential 氮磷比-氮rN 比生长速率μ=-0.17×e(-rN/2.382)+0.35,R2=0.940 0,P=1 指数方程exponential 氮浓度CN 干质量DW=-385.77×e(-CN/0.532)+472.00,R2=0.995 7,P<0.01 指数方程exponential 氮磷比-氮rN 干质量DW=-387.37×e(-rN/1.820)+472.00,R2=-0.996 1,P<0.01 -
[1] O′NEIL J M, DAVIS T W, BURFORD M A, et al.The rise of harmful cyanobacteria blooms:the potential roles of eutrophication and climate change[J].Harmful Algae, 2012, 14(SI):313-334. https://www.sciencedirect.com/science/article/pii/S1568988311001557
[2] DAVIDSON K, GOWEN R J, TETT P, et al.Harmful algal blooms:how strong is the evidence that nutrient ratios and forms influence their occurrence?[J].Est Coast Shelf Sci, 2012, 115(SI):399-413. https://www.sciencedirect.com/science/article/pii/S0272771412003782
[3] LU S H, HODGKISS I J.Harmful algal bloom causative collected from Hong Kong waters[J].Hydrobiologia, 2004, 512(1/2/3):231-238. doi: 10.1007/978-94-007-0944-7_30.pdf
[4] 徐宁, 吕颂辉, 段舜山, 等.营养物质输入对赤潮发生的影响[J].海洋环境科学, 2004, 23(2):20-24. doi: 10.3969/j.issn.1007-6336.2004.02.006 [5] 周名江, 朱明远, 张经.中国赤潮的发生趋势和研究进展[J].生命科学, 2001, 13(2):54-59, 53. http://www.doc88.com/p-21797645270.html [6] HEISLER J, GLIBERT P M, BURKHOLDER J M, et al.Eutrophication and harmful algal blooms:a scientific consensus[J].Harmful Algae, 2008, 8(1):3-13. doi: 10.1016/j.hal.2008.08.006
[7] ANDERSON D M, GLIBERT P M, BURKHOLDER J M.Harmful algal blooms and eutrophication:nutrient sources, composition, and consequences[J].Est Coast, 2002, 25(4):704-726. doi: 10.1007/BF02804901
[8] XIE L, XIE P, LI S, et al.The low TN:TP ratio, a cause or a result of Microcystis blooms?[J].Water Res, 2003, 37(9):2073-2080. doi: 10.1016/S0043-1354(02)00532-8
[9] KUNIYOSHI T M, SEVILLA E, BES M T, et al.Phosphate deficiency (N/P 40:1) induces mcyD transcription and microcystin synthesis in Microcystis aeruginosa PCC7806[J].Plant Physiol Biochem, 2013, 65:120-124. doi: 10.1016/j.plaphy.2013.01.011
[10] AMANO Y, SAKAI Y, SEKIYA T, et al.Effect of phosphorus fluctuation caused by river water dilution in eutrophic lake on competition between blue-green alga Microcystis aeruginosa and diatom Cyclotella sp.[J].J Environ Sci, 2010, 22(11):1666-1673. doi: 10.1016/S1001-0742(09)60304-1
[11] 陈建中, 刘志礼, 李晓明, 等.温度、pH和氮、磷含量对铜绿微囊藻(Microcystis aeruginosa)生长的影响[J].海洋与湖沼, 2010, 41(5):714-718. doi: 10.11693/hyhz201005008008 [12] LI J, GLIBERT P M, ALEXANDER J A, et al.Growth and competition of several harmful dinoflagellates under different nutrient and light conditions[J].Harmful Algae, 2012, 13:112-125. doi: 10.1016/j.hal.2011.10.005
[13] 许海, 朱广伟, 秦伯强, 等.氮磷比对水华蓝藻优势形成的影响[J].中国环境科学, 2011, 31(10):1676-1683. http://manu36.magtech.com.cn/Jweb_zghjkx/CN/abstract/abstract... [14] 代瑞华, 刘会娟, 曲久辉, 等.氮磷限制对铜绿微囊藻生长和产毒的影响[J].环境科学学报, 2008, 28(9):1739-1744. http://www.oalib.com/paper/4345022 [15] DYHRMAN S T, CHAPPELL P D, HALEY S T, et al.Phosp-honate utilization by the globally important marine diazotroph Triehodesmium[J].Nature, 2006, 439:25-26. doi: 10.1038/439025a
[16] GLIBERT P M, BURKHOLDER J M, KANA T M.Recent insights about relationships between nutrient availability, forms, and stoichiometry, and the distribution, ecophysiology, and food web effects of pelagic and benthic Prorocentrum species[J].Harmful Algae, 2012, 14(SI):231-259.
[17] HORST G P, SARNELLE O, WHITE J D, et al.Nitrogen availability increases the toxin quota of a harmful cyanobacterium, Microcystis aeruginosa[J].Water Res, 2014, 54:188-198. doi: 10.1016/j.watres.2014.01.063
[18] 丰茂武, 吴云海, 冯仕训, 等.不同氮磷比对藻类生长的影响[J].生态环境, 2008, 17(5):1759-1763. http://www.cnki.com.cn/Article/CJFDTOTAL-TRYJ200805010.htm [19] 万蕾, 朱伟, 赵联芳.氮磷对微囊藻和栅藻生长及竞争的影响[J].环境科学, 2007, 28(6):1230-1235. http://industry.wanfangdata.com.cn/yj/Detail/Periodical?id=... [20] 刘莲, 周小玉, 赵良杰, 等.氮磷比率对两种蓝藻和两种绿藻生长的影响[J].上海海洋大学学报, 2014, 23(4):573-581. http://www.cnki.com.cn/Article/CJFDTOTAL-SSDB201404014.htm [21] SUN K F, LIU W J, LIU L L, et al.Ecological risks assessment of organophosphorus pesticides on bloom of Microcystis wesenbergii[J].Int Biodeter Biodegr, 2013, 77:98-105. doi: 10.1016/j.ibiod.2012.11.010
[22] 郑朔方, 杨苏文, 金相灿.铜绿微囊藻生长的营养动力学[J].环境科学, 2005, 26(2):152-156. doi: 10.3321/j.issn:0250-3301.2005.02.031 [23] LEE J, PARKER A E, WILKERSON F P.Uptake and inhibition kinetics of nitrogen in Microcystis aeruginosa:results from cultures and field assemblages collected in the San Francisco Bay Delta, CA[J].Harmful Algae, 2015, 47:126-140. doi: 10.1016/j.hal.2015.06.002
[24] KANEKO T, NAKAJIMA N, OKAMOTO S, et al.Complete genomic structure of the bloom-forming toxic cyanobacterium Microcystis aeruginosa NIES-843[J].DNA Res, 2007, 14(6):247-256. doi: 10.1093/dnares/dsm026
[25] FRANGEUL L, QUILLARDET P, CASTETS A M, et al.Highly plastic genome of Microcystis aeruginosa PCC 7806, a ubiquitous toxic freshwater cyanobacterium[J].BMC Genomics, 2008, 9:274-293. doi: 10.1186/1471-2164-9-274
[26] SMITH V H.Low nitrogen to phosphorus ratios favor dominance by blue-green algae in lake phytoplankton[J].Science, 1983, 221(4611):669-671. doi: 10.1126/science.221.4611.669
[27] SCHINDLER D W.Evolution of phosphorus limitation in lakes[J].Science, 1977, 195:260-262. doi: 10.1126/science.195.4275.260
-
期刊类型引用(26)
1. 初建松,郑卫东,孙利元,彭道民,索安宁,朱玉贵. 基于生物资源的万山海洋牧场生境适宜性评估. 海洋科学. 2024(01): 75-84 .  百度学术
百度学术
2. 汪慧娟,徐姗楠,张文博,黄洪辉,齐占会,程琪,刘华雪. 基于碳氮稳定同位素的珠江口南沙海域渔业生物群落营养结构研究. 生态科学. 2024(02): 42-50 .  百度学术
百度学术
3. 王颤. 珠江入海口空间生态性水体变化对鱼类多样性的影响. 湖北农业科学. 2024(04): 127-135 .  百度学术
百度学术
4. 田思泉,柳晓雪,花传祥,王寅,杜涣洋. 南海渔业资源状况及其管理挑战. 上海海洋大学学报. 2024(03): 786-798 .  百度学术
百度学术
5. 马菁菁,陈海刚,张喆,田斐,唐振朝,熊倩,张林宝. 2018—2023年珠江口鱼类群落结构变化及其与环境因子的关系. 南方水产科学. 2024(06): 62-73 .  本站查看
本站查看
6. 谢雨芳,吴鹏,刘永,肖雅元,唐广隆,王腾,林琳,李纯厚. 珠江河口凤鲚的栖息地适宜性评价. 南方水产科学. 2023(01): 22-29 .  本站查看
本站查看
7. 刘文瑜,黄建强,戴国贤,刘国强,雷学铁,周永东,叶永昌. 珠江口伶仃洋春季鱼类群落结构及其与环境因子的RDA分析. 渔业信息与战略. 2023(01): 32-41 .  百度学术
百度学术
8. 裴精花,陈清华,范金金,刘伟杰,郭照良,隋昊志. 珠江口海域游泳动物群落结构及多样性特征. 南方农业学报. 2023(12): 3727-3738 .  百度学术
百度学术
9. 蒋佩文,李敏,张帅,陈作志,徐姗楠. 基于线粒体COI和12S rDNA基因构建珠江河口鱼类DNA宏条形码数据库. 南方水产科学. 2022(03): 13-21 .  本站查看
本站查看
10. 唐广隆,刘永,吴鹏,孙典荣,肖雅元,王腾,谢雨芳,李纯然,石娟,钟智辉,李纯厚. 珠江口万山群岛海域春季渔业资源群落结构特征及其与环境因子的关系. 中国水产科学. 2022(08): 1198-1209 .  百度学术
百度学术
11. 李雷,马波,金星,金洪宇,吴松,陈中祥,程磊,王念民,郝其睿. 西藏雅鲁藏布江大峡谷墨脱江段鱼类群落结构及多样性的空间分布特征. 中国水产科学. 2022(09): 1326-1336 .  百度学术
百度学术
12. 蒋佩文,李敏,张帅,陈作志,徐姗楠. 基于环境DNA宏条码和底拖网的珠江河口鱼类多样性. 水生生物学报. 2022(11): 1701-1711 .  百度学术
百度学术
13. 周卫国,丁德文,索安宁,何伟宏,田涛. 珠江口海洋牧场渔业资源关键功能群的遴选方法. 水产学报. 2021(03): 433-443 .  百度学术
百度学术
14. 徐鹏,谢木娇,周卫国,孙英婷,丁德文,索安宁. 近30年珠江口海域游泳动物经济物种群落结构变化特征. 应用海洋学学报. 2021(02): 239-250 .  百度学术
百度学术
15. 熊朋莉,陈作志,侯刚,张帅,邱永松,范江涛,徐姗楠. 珠江河口棘头梅童鱼生物学特征的年代际变化. 南方水产科学. 2021(06): 31-38 .  本站查看
本站查看
16. 于南京,俞存根,菅康康,许永久,孙蓓蓓,张佩怡,刘坤,王慧君. 嵊泗列岛邻近海域鱼类种类组成及多样性分析. 渔业研究. 2020(04): 293-301 .  百度学术
百度学术
17. 李嘉盛,刘复荣,刘明珠,张宏刚,崔金明,蒙海林. 珠江口水产源乳酸菌资源库的构建及优良乳酸菌的高通量筛选. 食品安全质量检测学报. 2020(16): 5627-5634 .  百度学术
百度学术
18. 林坤,麦广铭,王力飞,王学锋. 2015—2018年珠江口近岸海域鱼类群落结构及其稳定性. 水产学报. 2020(11): 1841-1850 .  百度学术
百度学术
19. 李娟,朱勤东. 福建省县域渔业地理时空格局演变研究. 测绘与空间地理信息. 2019(03): 47-52+57 .  百度学术
百度学术
20. 刘岩,吴忠鑫,杨长平,单斌斌,刘胜男,孙典荣. 基于Ecopath模型的珠江口6种增殖放流种类生态容纳量估算. 南方水产科学. 2019(04): 19-28 .  本站查看
本站查看
21. 应锐,蒋力,尹芳敏,黄建荣,黎祖福,王英永,冯建祥. 基于刺网、地笼的考洲洋游泳动物群落结构和多样性分析. 南方水产科学. 2019(04): 1-10 .  本站查看
本站查看
22. 郭建忠,陈作志,田永军,张魁,许友伟,徐姗楠,李纯厚. 胶州湾海域鱼类群落种类组成及多样性. 生态学报. 2019(19): 7002-7013 .  百度学术
百度学术
23. 蔡研聪,徐姗楠,陈作志,许友伟,江艳娥,杨长平. 南海北部近海渔业资源群落结构及其多样性现状. 南方水产科学. 2018(02): 10-18 .  本站查看
本站查看
24. 曾雷,陈国宝,于杰. 南澳岛海域渔业资源声学评估与空间分布. 南方水产科学. 2018(02): 26-35 .  本站查看
本站查看
25. 谢志超,孙典荣,刘永,林琳,王腾,肖雅元,李纯厚. 江门海域游泳动物群落组成及其多样性初步分析. 南方水产科学. 2018(05): 21-28 .  本站查看
本站查看
26. 黄卉,杨丽芝,杨贤庆,李来好,郝淑贤,魏涯,王锦旭. 南海鸢乌贼墨汁多糖分离纯化及组分分析. 食品科学. 2017(24): 118-123 .  百度学术
百度学术
其他类型引用(11)





 下载:
下载:










 粤公网安备 44010502001741号
粤公网安备 44010502001741号
