Effects of polysaccharide from Endothelium corneum gigeriae galli on growth, digestive, intestinal antioxidant capacity and serum biochemical indices of Lates calcarifer
-
摘要: 该研究探讨了鸡内金多糖 (Polysaccharide from Endothelium corneum gigeriae galli, PEGG) 对尖吻鲈 (Lates calcarifer) 幼鱼生长、消化、肠抗氧化能力和血清生化指标的影响,以为PEGG 在尖吻鲈健康养殖中的应用提供参考依据。在饲料中添加0 (对照组)、5 (低剂量组)、20 (中剂量组) 和80 g·kg−1 (高剂量组) 的PEGG饲喂体质量 (11.85±1.66) g的尖吻鲈幼鱼8周。结果表明,相较于对照组,拌喂PEGG能:1) 明显提高尖吻幼鱼终末体质量、增重率和特定生长率,且高剂量组差异显著 (P<0.05);2) 显著提升胃肠道中消化酶活性 (P<0.05);3) 改善肠道组织结构,皱襞高度、肌层厚度和皱襞宽度显著增加 (P<0.05);4) 提升肠道抗氧化能力,超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)、谷胱甘肽过氧化物酶活性 (GSH-Px)、谷胱甘肽 (GSH) 浓度和总抗氧化能力 (T-AOC) 显著升高,丙二醛 (MDA) 浓度显著下降 (P<0.05);5) 改善血清学指标,其中,各处理组胆固醇浓度显著降低,中剂量组谷丙转氨酶 (ALT) 和谷草转氨酶 (AST) 活性明显下降 (P<0.05)。综上,拌喂PEGG能够显著提升尖吻鲈幼鱼的消化和肠道抗氧化能力、改善血清生化水平,进而促进生长性能。在该实验条件下,PEGG最适添加量为20 g·kg−1。Abstract: To investigate the effects of dietary polysaccharide from Endothelium corneum gigeriae galli (PEGG) supplementation on the growth, digestive, intestinal antioxidant capacity and serum biochemical indices of Lates calcarifer and to provide references for the application of PEGG in healthy culture of L. calcarifer, we had fed juvenile L. calcarifer [Body mass of (11.85±1.66) g] by basal diets with PEGG at 0 (Control group), 5 (Low-dose group), 20 (Medium-dose group) and 80 g·kg−1 (High-dose group) for eight weeks. The results show that compared with the control group, PEGG supplementation groups could: 1) increase the final body mass, weight gain rate and specific growth rate of juvenile L. calcarifer, and the difference was significant in the high-dose group (P<0.05); 2) increase the digestive enzyme activity significantly (P<0.05); 3) improve the histological structure of intestine significantly, indicating that PEGG increased the fold height, fold width and muscular thickness significantly (P<0.05); 4) enhance the antioxidant capacity significantly. The superoxide dismutase (SOD), catalase (CAT), glutathione peroxidase (GSH-Px) activity, concentration of glutathione (GSH) and total antioxidant capacity (T-AOC) increased in the PEGG supplementation groups, while malondialdehyde (MDA) concentration decreased significantly (P<0.05); 5) improve the serum biochemical indices. Cholesterol in all the treatment groups decreased significantly, while ALT and AST in the medium-dose group decreased significantly (P<0.05). In conclusion, dietary PEGG can improve the digestive capacity, antioxidant capacity and serum biochemical indices of juvenile L. calcarifer, and promote the growth performance. The optimal PEGG supplementation level is 20 g·kg−1.
-
尖吻鲈 (Lates calcarifer) 属尖吻鲈科、尖吻鲈属,又名金目鲈、盲鰽,广泛分布于琉球至印度洋海域,具有生长快、广盐性、养殖成活率高、肉质鲜美、适应能力强等优点,颇受养殖户和消费者青睐[1-2]。广东珠三角地区是我国尖吻鲈主养区域,在追求集约化、高效益的同时亦伴随着诸多问题。高密度养殖系统中,由于较高的投放密度、单一的人工饲料投喂、较为简单的生态系统以及过低的环境承载力极易造成水质恶化、病害频发,其中消化道疾病一直是近年来的主要病症之一[3-6]。
天然中草药的多功能性、无毒副作用等优点使其作为水产饲料添加剂越来越受到重视[7]。鸡内金 (Endothelium corneum gigeriae galli) 为脊索动物门雉科动物家鸡 (Gallus gallus domesticus) 的干燥砂囊内壁,即鸡的胃内膜,其富含蛋白质、氨基酸、多糖等生物活性物质,具有消食健胃、固精止遗和通淋化石等一系列药食两用功能[8-9]。鸡内金多糖 (Polysaccharide from E. corneum gigeriae galli, PEGG) 为鸡内金经一系列工艺提取而成,大量研究表明绝大多数天然多糖在抗氧化、抗衰老、降血脂、提高机体免疫力等方面疗效显著[10-13]。蒋长兴等[14]发现PEGG能够调节高脂血症大鼠 (Rattus norvegicus) 的代谢紊乱,提高其机体脂代谢能力,改善血液流变学指标和缓解氧化应激水平。目前,有关PEGG在水产动物中的应用研究尚未见报道,本研究探讨了PEGG对尖吻鲈幼鱼生长性能、消化能力、肠道抗氧化能力和血清生化指标的影响,以期为PEGG在尖吻鲈健康养殖中的应用提供参考依据。
1. 材料与方法
1.1 饲料制备
实验所用PEGG购自湖北天门恒昌化工有限公司 (纯度35%)。基础饲料为鲈膨化配合饲料 (珠海海龙生物科技有限公司),营养成分 [质量分数:粗蛋白质≥41.0%、粗纤维≤3.0%、粗灰分≤18.0%、总磷≥1.20%、粗脂肪≥5.0%、赖氨酸≥2.10%、钙 (Ca) 0.80%~4.00%、水分≤10.0%]。将PEGG溶于蒸馏水配置成母液,按0、5、20和80 g·kg−1 PEGG设4个梯度,高压喷壶均匀喷涂于饲料表面,经30 ℃鼓风干燥箱完全烘干后,4 ℃冷藏备用。
1.2 实验设计与实验管理
实验鱼取得、暂养和实验开展均在广东珠海德洋水产养殖有限公司进行。实验鱼先于室内方形水泥池 (4 m×2.5 m×1 m) 中暂养14 d,期间每天07:00和18:00饱食投喂2次基础饲料,日换水1次,换水率30%。暂养期间水温 (30±1) ℃、盐度≤3、溶解氧质量浓度≥7 mg·L−1、自然光周期。暂养结束后,随机选取体表无损伤、规格相近的健康尖吻鲈幼鱼[(11.85±1.66) g]共240尾,分为4组,即对照组 (0 g·kg−1)、低剂量 (5 g·kg−1)、中剂量 (20 g·kg−1) 和高剂量组 (80 g·kg−1)。每组4个重复,每个重复15尾,养殖于16个玻璃纤维黑桶中 (300 L)。分别投喂对应剂量饲料,日投喂2次 (7:00和18:00),日投饵量为鱼体质量的1%~3%,并根据实际情况进行调整。养殖实验持续8周,日常管理和环境参数与暂养期间相同。
1.3 样品采集
分别在第0、第4和第8周取样,取样前停喂1 d,每个重复组随机取1尾实验鱼,合计每个实验组共4尾鱼。实验鱼经200 mg·L–1 MS-222浸泡麻醉后,测其体质量和体长,再经1.5 mL无菌注射器尾静脉取血,全血样品在4 ℃下静置1 h,待血液分层后,3 000 r·min–1离心10 min,收集血清于1.5 mL离心管,−80 ℃保存。实验鱼采血后,置于冰盘上解剖,称量内脏团质量,取肠道和胃于2 mL离心管中,−80 ℃保存。
1.4 指标测定
1.4.1 生长性能指标测定
根据以下公式计算增重率 (WGR)、特定生长率 (SGR)、脏体比 (VSI)、肥满度 (CF):
$$ {{\rm{WGR}} = ({W_{\rm{t}}}-{W_0})/{{{W}}_0} \times 100 \text{%}} $$ (1) $$ {{\rm{SGR}} = ({\rm{ln}}{W_{\rm{t}}}{\rm{ - ln}}{W_0})/t \times 100{\text{%}} } $$ (2) $$ {{\rm{VSI}} = {W_{\rm{v}}}/W \times 100{\text{%}} } $$ (3) $$ {\rm{CF = }}{W_{\rm{t}}}/{L^3} \times 100{\text{%}} $$ (4) 其中Wt、W0分别为实验尖吻鲈幼鱼的终末体质量和初始体质量,Wv为鱼的内脏团质量;t为实验天数 (56 d);L为鱼体长 (cm)。
1.4.2 肠道组织切片制备及观察
肠道组织切片制作与HE染色参照魏杰等[15]方法进行。将肠道分为前、中、后3段于4%多聚甲醛中固定24 h,经流水冲洗、梯度乙醇脱水和二甲苯透明,然后进行石蜡切片,厚度为5~7 μm,HE染色,中性树脂封片,于显微镜观察并拍照后,测量皱襞长度、皱襞宽度和肌层厚度,每张切片随机选择5个以上的长直皱襞进行长度和宽度测量,取平均值为每个重复样品的测定值。肌层厚度测量与统计方法同上。
1.4.3 抗氧化指标和消化酶活性测定
肠道中超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)、谷胱甘肽过氧化物酶 (GSH-Px)、谷胱甘肽 (GSH)、总抗氧化能力 (T-AOC) 和丙二醛 (MDA) 及胃肠道中胃蛋白酶 (Pep)、胰蛋白酶 (Tryp)、脂肪酶 (LPS) 和淀粉酶 (AMS) 的测定均采用商业试剂盒 (南京建成生物工程研究所),具体方法参照说明书。
1.4.4 血清生化指标测定
血清中总蛋白 (TP)、总胆固醇 (TC)、甘油三酯 (TG)、血糖 (GLU)、谷丙转氨酶 (ALT) 和谷草转氨酶 (AST) 等指标,采用商业试剂盒 (深圳迈瑞生物医疗电子股份有限公司) 全自动生化分析仪 (BS200) 检测。
1.5 数据统计与分析
实验数据以“平均值±标准差 (
$ \overline X \pm {\rm{SD}} $ ) ”表示,采用SPSS 22.0软件进行单因素方差分析 (One-way ANOVA),若组间存在显著差异,则采用Duncan's法进行多重比较,显著性水平设置为P<0.05。2. 结果
2.1 PEGG对尖吻鲈幼鱼生长性能的影响
与对照组相比,各处理组尖吻鲈幼鱼终末体质量、增重率和特定生长率均有升高。其中,高剂量组差异显著 (P<0.05);中剂量组肥满度显著高于对照组 (P<0.05)。各处理组的脏体比均有提高,但无显著性差异 (P>0.05,表1)。
表 1 饲料中添加鸡内金多糖对尖吻鲈幼鱼生长性能的影响Table 1. Effect of dietary PEGG level on growth performance of juvenile L. calcarifer项目
Item对照组
Control group低剂量组 (5 g·kg−1)
Low-dose group中剂量组 (20 g·kg−1)
Medium-dose group高剂量组 (80 g·kg−1)
High-dose group初始体质量 Initial body mass/g 11.85±1.66 11.85±1.66 11.85±1.66 11.85±1.66 终末体质量 Final body mass/g 44.67±2.02a 49.88±8.76a 56.26±7.81ab 63.71±6.71b 增重率 WGR/% 276.96±17.05a 320.91±73.93a 374.77±65.95ab 437.64±56.70b 特定生长率 SGR/% 2.37±0.08a 2.55±0.31a 2.77±0.25ab 3.00±0.18b 脏体比 VSI/% 9.95±1.00 10.97±0.24 11.03±0.26 11.28±1.26 肥满度 CF/(g·cm−3) 2.17±0.23a 2.14±0.02a 3.07±0.85b 2.29±0.29ab 注:同行数据上标字母不同表示差异显著 (P<0.05),表2同此 Note: The values with different superscript letters within the same row indicate significant difference (P<0.05). The same case in Table 2. 2.2 PEGG对尖吻鲈幼鱼消化能力的影响
2.2.1 PEGG对肠道组织形态的影响
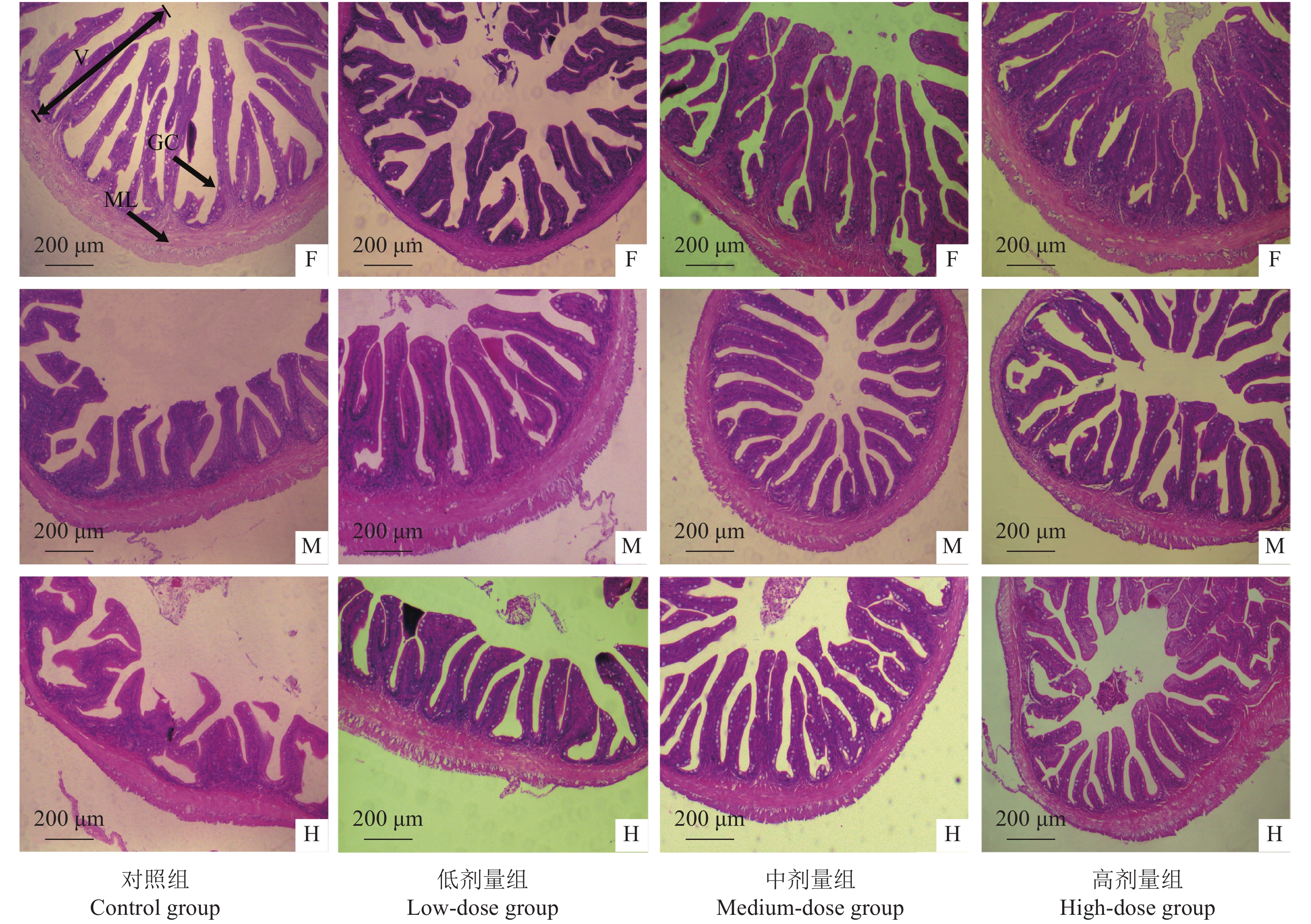
与对照组相比,各处理组肠道完整性增加,肠绒毛排列更加完整致密,杯状细胞分布规律,且以中剂量组最佳 (图1);各处理组前中肠皱襞高度、前肠皱襞宽度和肌层厚度均显著增加,中剂量和高剂量组后肠皱襞高度和肌层厚度显著提高 (P<0.05,图2)。
![]() 图 2 第8周饲料中添加鸡内金多糖对尖吻鲈幼鱼肠皱襞长宽和肌层厚度的影响相同横坐标点上不同字母表示差异显著 (P<0.05);后图同此Figure 2. Effects of dietary PEGG level on intestinal fold height, fold width and muscular thickness of L. calcarifer on 8th weekValues with different letters for the same abscissa point have significant difference (P<0.05). The same case in the following figures.
图 2 第8周饲料中添加鸡内金多糖对尖吻鲈幼鱼肠皱襞长宽和肌层厚度的影响相同横坐标点上不同字母表示差异显著 (P<0.05);后图同此Figure 2. Effects of dietary PEGG level on intestinal fold height, fold width and muscular thickness of L. calcarifer on 8th weekValues with different letters for the same abscissa point have significant difference (P<0.05). The same case in the following figures.2.2.2 PEGG对消化酶活性的影响
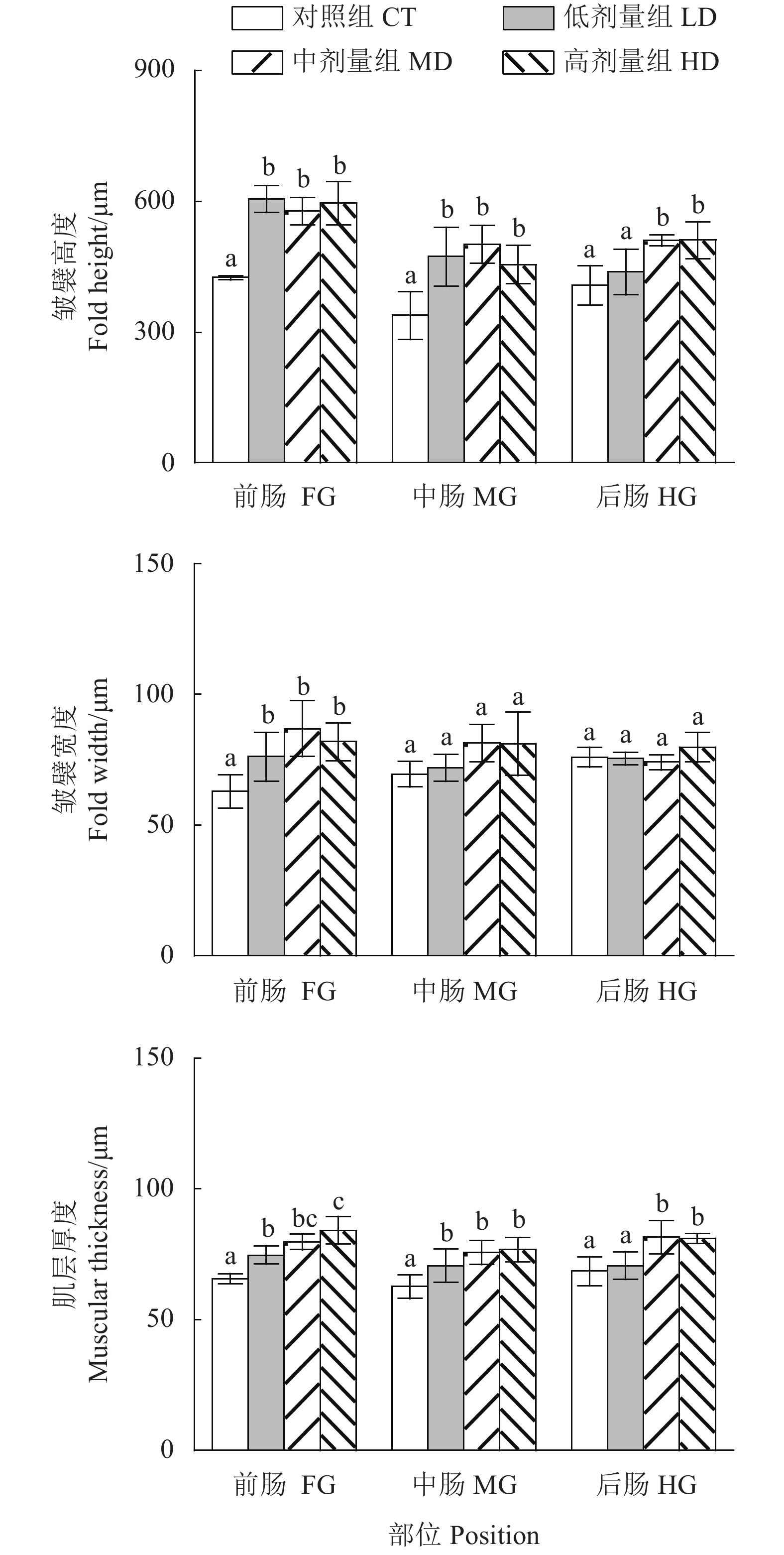
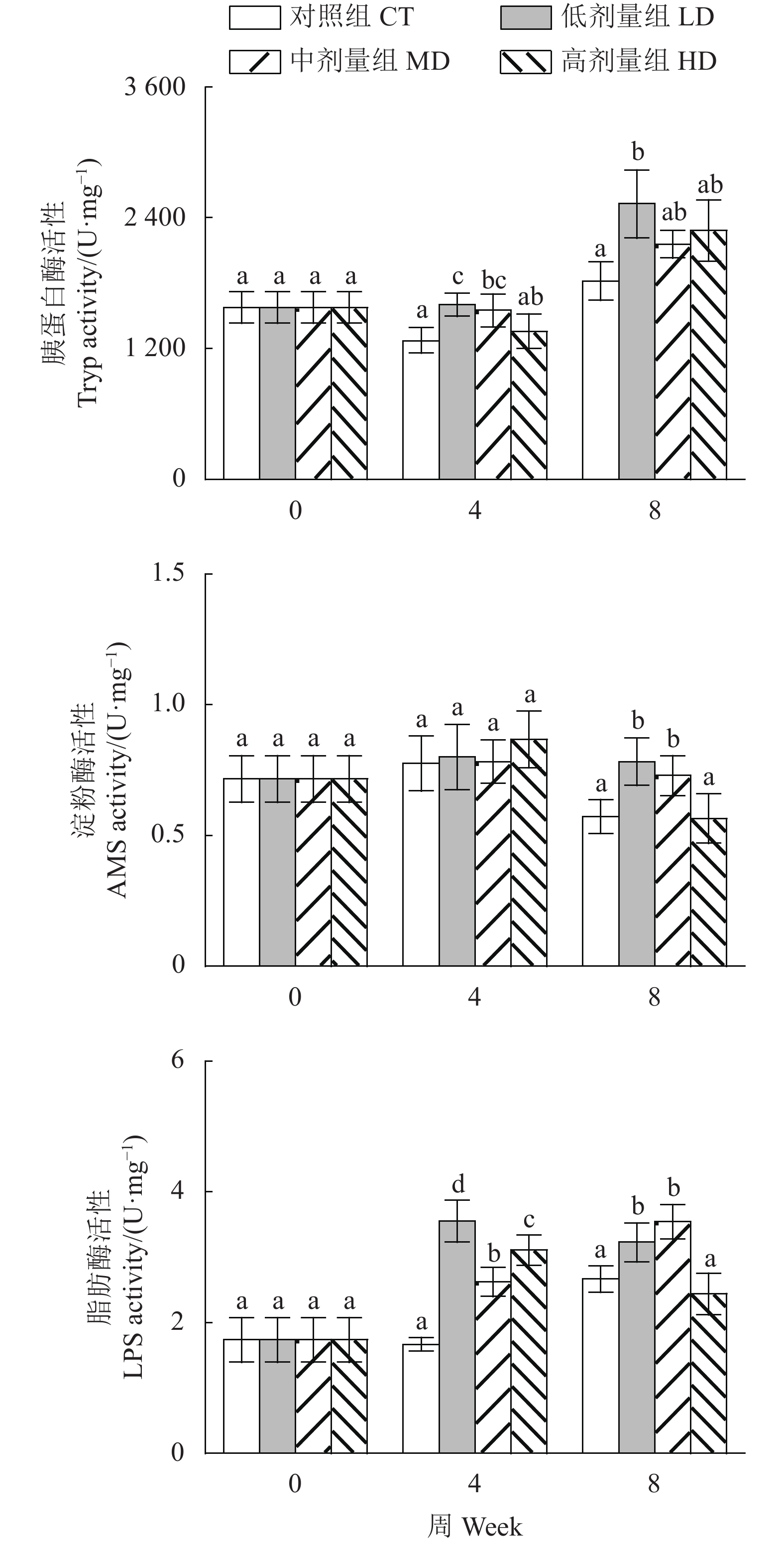
与对照组相比,处理组尖吻鲈幼鱼胃组织消化酶活性均显著升高 (图3)。其中,低剂量组的Pep和胃LPS在第4周、中剂量组和高剂量组Pep和胃LPS在第8周显著升高 (P<0.05);低剂量和中剂量组AMS活性在第4周显著高于其他组,各处理组AMS在第8周显著升高,以中剂量组最高 (P<0.05)。
与对照组相比,各处理组尖吻鲈幼鱼肠道消化酶活性均有提升 (图4),其中,低剂量和中剂量组Tryp在第4周显著升高,低剂量和高剂量组Tryp在第8周显著升高 (P<0.05);低剂量和中剂量组AMS在第8周显著升高;各处理组LPS在第4周显著升高,低剂量和中剂量组LPS在第8周显著升高 (P<0.05)。
2.3 PEGG对尖吻鲈幼鱼肠道抗氧化能力的影响
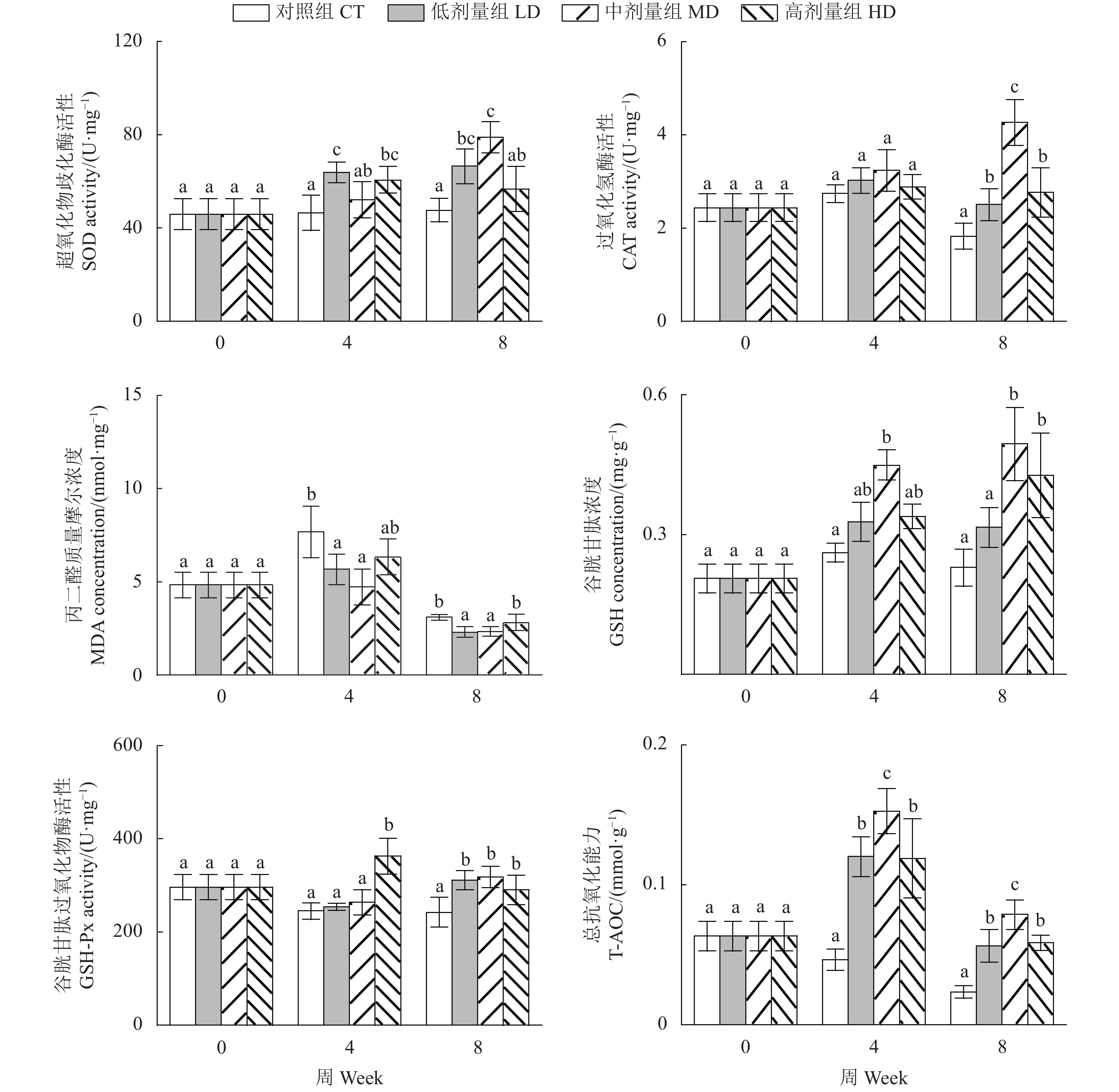
与对照组相比,拌喂PEGG后各处理组尖吻鲈肠道中CAT、SOD、GSH-Px的活性、GSH的浓度和T-AOC较对照组均显著上升 (P<0.05)。其中,低剂量组SOD和高剂量组GSH-Px在第4周最高,随着PEGG添加量的增加,第4周中CAT、GSH、T-AOC和第8周中各抗氧化指标呈先增加后下降的趋势,其中中剂量组最高;低剂量和中剂量组MDA浓度较对照组显著降低 (P<0.05,图5)。
2.4 PEGG对尖吻鲈幼鱼血清生化指标的影响
各处理组的血清TC浓度显著低于对照组 (P<0.05,表2),其中以高剂量组最低;中剂量组ALT活性显著低于对照组 (P<0.05);低剂量和中剂量组的AST活性显著低于对照组;低剂量和高剂量组的GLU浓度显著高于对照组;各组间TP和TG浓度无显著性差异 (P>0.05)。
表 2 第8周饲料中添加鸡内金多糖对尖吻鲈幼鱼血清生化指标的影响Table 2. Effect of dietary PEGG level on serum biochemical indices of juvenile L. calcarifer on 8th week项目
Item对照组
Control group低剂量组 (5 g·kg−1)
Low-dose group中剂量 (20 g·kg−1)
Medium-dose group高剂量组 (80 g·kg−1)
High-dose group总蛋白 TP/(g·L–1) 59.28±5.92 55.9±2.78 54.53±3.51 57.73±4.40 血糖 GLU/(mmol·L–1) 1.72±0.13a 3.25±0.26b 2.53±0.17ab 4.67±1.42c 总胆固醇 TC/(mmol·L–1) 4.18±0.53c 3.38±0.21b 3.48±0.73bc 2.47±0.23a 甘油三酯 TG/(mmol·L–1) 3.34±0.88 3.63±1.60 3.46±1.60 3.65±0.54 碱性磷酸酶 ALP/(U·L−1) 23.00±0.82 27.33±2.49 27.25±6.18 26.33±4.78 谷丙转氨酶 ALT/(U·L−1) 86.33±5.19b 73.67±14.70b 38.00±9.93a 75.00±15.12b 谷草转氨酶 AST/(U·L−1) 214.67±48.61b 130.33±23.84a 81.75±32.98a 206.67±24.61b 3. 讨论
多糖是由多个单糖通过糖苷键相连形成的大分子化合物,存在于动物、植物和微生物中。大量研究表明多糖具有促进鱼类生长的作用,饲料中添加一定的枸杞多糖能够显著提高黄颡鱼 (Pelteobagrus fulvidraco) [16]的增重率,添加黄芪多糖能够增加杂交鳢 (Channa maculate♀×C. argus♂) [17]的增重率和齐口裂腹鱼 (Schizothorax prenanti) [18]的生长性能。本研究中,各处理组的终末体质量、增重率和特定生长率均高于对照组,其中高剂量组差异显著 (P<0.05),表明PEGG对尖吻鲈幼鱼生长性能具有一定的促进作用。
肠道的发育状况和完整性是肠道健康和消化能力的直观反映[19]。有研究表明,配合饲料会对鱼类肠道组织形态造成一定损伤[20-21]。本研究通过对肠组织形态的分析,发现对照组绒毛排列疏短,破损脱落,而各处理组尖吻鲈肠道完整性增加,肠绒毛和杯状细胞排列更加规律整齐,且肠道各部位的皱襞长度、皱襞宽度和肌层厚度均有不同程度改善。迟玉森等[22]发现鸡内金提取物能够促进小鼠肠道蠕动,说明PEGG可能通过促进消化,增加肠道蠕动,使得尖吻鲈肠道的皱襞和肌层厚度上升,从而增强鱼体肠道的消化屏障。
此外,饲料中的营养成分能够改变鱼类消化道中消化酶的特性和浓度[23]。刘成荣[24]发现枇杷多糖能够显著提升金鱼 (Carassius auratus) 消化酶活性;Chen和Zhang[25]发现在饲料中添加适量的海带多糖能够增加草鱼 (Ctenopharyngodon idella) 消化酶活性。本研究处理组胃中Pep、AMS、LPS活性和肠中Tryp、AMS、LPS活性均有提高,其中,中剂量组的消化酶活性提升最大 (P<0.05),表明拌喂一定剂量的PEGG能够提高尖吻鲈幼鱼的消化能力,这可能与鸡内金中的活性物质如胃激素、类角蛋白和胃蛋白酶等[26]能够促进消化有关。
PEGG具有清除自由基、螯合Fe2+和抑制脂质过氧化的功能[27]。Xiong等[28]发现PEGG灌胃能够提升小鼠 (Mus musculus) 心肌组织中的SOD活性,同时降低MDA浓度;蒋长兴等[14]亦发现PEGG能够显著提升高脂血症大鼠的总抗氧化能力。SOD和CAT是抗氧化酶系统中的2种关键酶,较高的SOD和CAT活性水平意味着细胞具备较高的自由基清除能力[29-30],MDA是脂质过氧化最主要的标志物[31]。本研究显示,低剂量和中剂量组肠道SOD的活性均显著高于对照组,各处理组CAT活性显著高于对照组 (P<0.05),而低剂量和中剂量组MDA浓度显著低于对照组 (P<0.05),说明PEGG可以消除肠道中的自由基并抑制脂质过氧化。GSH是细胞中重要的非酶抗氧化剂,可以中和自由基或氧化剂;GSH-Px也在清除自由基、活性氧 (ROS) 和减少脂质过氧化等方面发挥着重要作用[32-34];T-AOC从总体上反映了机体对自由基和活性氧类物质抵抗能力。本研究中处理组GSH、GSH-Px和T-AOC显著高于对照组 (P<0.05),表明PEGG可以提高尖吻鲈肠道的抗氧化能力。
血清生化指标是反映机体健康、营养和代谢的重要指标[35-36]。血清TC和TG浓度能够反映机体的脂类代谢程度[37]。蒋长兴等[14]发现PEGG灌胃能够降低高脂血症大鼠血清TG和TC的浓度。本研究中各实验组间TG浓度无显著差异,而拌喂PEGG组中血清TC浓度显著低于对照组,其中高剂量组最低 (P<0.05),表明PEGG对尖吻鲈幼鱼具备一定降血脂的功能,TG浓度无显著性变化可能与实验对象不同有关。鱼类GLU浓度在一定范围内升高表示鱼体消化吸收作用加强[38]。本研究中各处理组GLU浓度均有显著升高 (P<0.05)。血清ALT和AST是临床上普遍接受的分析肝脏健康的标志酶,而AKP在碱性条件下分解各种磷酸酯,其活性与细胞损伤有关[39-40]。本研究表明,适量的PEGG可以降低尖吻鲈血清中ALT和AST活性且不改变AKP活性,表明饲料中添加适量PEGG有利于肝脏健康,但过量添加又会导致ALT和AST活性升高,说明多糖的添加量并不是越高越好,这与谭连杰等[41]和汪成竹等[42]的研究结果相似。
综上,PEGG本身具备一定的促进消化能力,其抗氧化功能起到改善肠道的作用,此外PEGG还有一定护肝和降血脂功效。拌喂适量的PEGG能显著增强尖吻鲈幼鱼的消化能力和肠道抗氧化能力,并改善血清生化指标,提高尖吻鲈幼鱼生长性能。在本实验条件下,PEGG的最适拌喂量为20 g·kg−1。
-
图 2 第8周饲料中添加鸡内金多糖对尖吻鲈幼鱼肠皱襞长宽和肌层厚度的影响
相同横坐标点上不同字母表示差异显著 (P<0.05);后图同此
Figure 2. Effects of dietary PEGG level on intestinal fold height, fold width and muscular thickness of L. calcarifer on 8th week
Values with different letters for the same abscissa point have significant difference (P<0.05). The same case in the following figures.
表 1 饲料中添加鸡内金多糖对尖吻鲈幼鱼生长性能的影响
Table 1 Effect of dietary PEGG level on growth performance of juvenile L. calcarifer
项目
Item对照组
Control group低剂量组 (5 g·kg−1)
Low-dose group中剂量组 (20 g·kg−1)
Medium-dose group高剂量组 (80 g·kg−1)
High-dose group初始体质量 Initial body mass/g 11.85±1.66 11.85±1.66 11.85±1.66 11.85±1.66 终末体质量 Final body mass/g 44.67±2.02a 49.88±8.76a 56.26±7.81ab 63.71±6.71b 增重率 WGR/% 276.96±17.05a 320.91±73.93a 374.77±65.95ab 437.64±56.70b 特定生长率 SGR/% 2.37±0.08a 2.55±0.31a 2.77±0.25ab 3.00±0.18b 脏体比 VSI/% 9.95±1.00 10.97±0.24 11.03±0.26 11.28±1.26 肥满度 CF/(g·cm−3) 2.17±0.23a 2.14±0.02a 3.07±0.85b 2.29±0.29ab 注:同行数据上标字母不同表示差异显著 (P<0.05),表2同此 Note: The values with different superscript letters within the same row indicate significant difference (P<0.05). The same case in Table 2. 表 2 第8周饲料中添加鸡内金多糖对尖吻鲈幼鱼血清生化指标的影响
Table 2 Effect of dietary PEGG level on serum biochemical indices of juvenile L. calcarifer on 8th week
项目
Item对照组
Control group低剂量组 (5 g·kg−1)
Low-dose group中剂量 (20 g·kg−1)
Medium-dose group高剂量组 (80 g·kg−1)
High-dose group总蛋白 TP/(g·L–1) 59.28±5.92 55.9±2.78 54.53±3.51 57.73±4.40 血糖 GLU/(mmol·L–1) 1.72±0.13a 3.25±0.26b 2.53±0.17ab 4.67±1.42c 总胆固醇 TC/(mmol·L–1) 4.18±0.53c 3.38±0.21b 3.48±0.73bc 2.47±0.23a 甘油三酯 TG/(mmol·L–1) 3.34±0.88 3.63±1.60 3.46±1.60 3.65±0.54 碱性磷酸酶 ALP/(U·L−1) 23.00±0.82 27.33±2.49 27.25±6.18 26.33±4.78 谷丙转氨酶 ALT/(U·L−1) 86.33±5.19b 73.67±14.70b 38.00±9.93a 75.00±15.12b 谷草转氨酶 AST/(U·L−1) 214.67±48.61b 130.33±23.84a 81.75±32.98a 206.67±24.61b -
[1] GUIGUEN Y, CAUTY C, FOSTIER A, et al. Reproductive cycle and sex inversion of the seabass, Lates calcarifer, reared in sea cages in French Polynesia: histological and morphometric description[J]. Environ Biol Fishes, 1994, 39(3): 231-247. doi: 10.1007/BF00005126
[2] 赵旺, 江淼, 陈明强, 等. 离岸养殖与陆基养殖尖吻鲈形态性状与体质量的相关性研究[J]. 海洋学报, 2018, 40(8): 53-62. [3] 王思芦, 王红明, 赵艮勇, 等. 鸡枞菌多糖对鲫的生长性能、抗氧化及免疫功能的影响[J]. 淡水渔业, 2019, 49(1): 87-91. doi: 10.3969/j.issn.1000-6907.2019.01.016 [4] CABELLO F C. Heavy use of prophylactic antibiotics in aquaculture: a growing problem for human and animal health and for the environment[J]. Environ Microbiol, 2006, 8(7): 1137-1144. doi: 10.1111/j.1462-2920.2006.01054.x
[5] KROGDAHL Å, BAKKE-MCKELLEP A M, BAEVERFJORD G. Effects of graded levels of standard soybean meal on intestinal structure, mucosal enzyme activities, and pancreatic response in Atlantic salmon (Salmo salar L.)[J]. Aquacult Nutr, 2003, 9(6): 361-371. doi: 10.1046/j.1365-2095.2003.00264.x
[6] SAHLMANN C, SUTHERLAND B J G, KORTNER T M, et al. Early response of gene expression in the distal intestine of Atlantic salmon (Salmo salar L.) during the development of soybean meal induced enteritis[J]. Fish Shellfish Immunol, 2013, 34(2): 599-609. doi: 10.1016/j.fsi.2012.11.031
[7] 钟小庆. 论中草药在水产养殖中的运用[J]. 渔业致富指南, 2019(5): 57-58. [8] 王宝庆, 郭宇莲, 练有扬, 等. 鸡内金化学成分及药理作用研究进展[J]. 安徽农业科学, 2017, 45(33): 137-139. doi: 10.3969/j.issn.0517-6611.2017.33.046 [9] 王鹏飞, 高慧敏, 邹忠梅, 等. 药食两用中药鸡内金的研究概况[J]. 中国药学杂志, 2017, 52(7): 535-538. [10] 赵玉红, 金秀明, 韩睿. 鹿茸多糖分离纯化及抗氧化活性研究[J]. 食品工业科技, 2012, 33(12): 155-158. [11] 周文丽. 东海厚壳贻贝多糖的抗衰老生物学活性研究[D]. 上海: 第二军医大学, 2009: 17-42. [12] DONG Y, QI Y, LIU M, et al. Antioxidant, anti-hyperlipidemia and hepatic protection of enzyme-assisted Morehella esculenta polysaccharide[J]. Int J Biol Macromo, 2018, 120: 1490-1499. doi: 10.1016/j.ijbiomac.2018.09.134
[13] YANG Y, PARK J, YOU S G, et al. Immuno-stimulatory effects of sulfated polysaccharides isolated from codium fragile in olive flounder, Paralichthys olivaceus[J]. Fish Shellfish Immunol 2019, 87: 609-614.
[14] 蒋长兴, 蒋顶云, 熊清平, 等. 鸡内金多糖对高脂血症大鼠血脂、血液流变学及氧化应激指标的影响[J]. 中药药理与临床, 2012, 28(5): 75-78. [15] 魏杰, 曹希全, 任永丽, 等. 宽口裂腹鱼消化系统解剖和组织学观察[J]. 南方水产科学, 2020, 16(1): 120-126. [16] 吴旋. 四种中草药多糖对黄颡鱼生长、体成分及部分生理生化指标的影响[D]. 天津: 天津农学院, 2011: 13-41. [17] 王煜恒, 徐孝宙, 王会聪, 等. 黄芪多糖对杂交鳢生长性能、免疫能力、抗氧化能力和抗病力的影响[J]. 动物营养学报, 2018, 30(4): 1447-1456. [18] 向枭, 陈建, 周兴华, 等. 黄芪多糖对齐口裂腹鱼生长、体组成和免疫指标的影响[J]. 水生生物学报, 2011, 35(2): 291-299. [19] BUREAU D P. Nutrition and feeding of fish and crustaceans[J]. Aquaculture, 2002, 212(1/2/3/4): 404-405.
[20] 欧红霞, 王广军, 李志斐, 等. 不同饲料对大口黑鲈肠道组织结构的影响[J]. 水产科学, 2020, 39(6): 902-907. [21] 牟明明, 蒋余, 罗强, 等. 配合饲料和冰鲜鲢对大口黑鲈生长、血浆生化指标、抗氧化能力和组织学的影响[J]. 水产学报, 2018, 42(9): 1408-1416. [22] 迟玉森, 马成印, 邵允琪, 等. 鸡内金有效成分的提取及其改善肠道保健功能的研究[J]. 食品工业科技, 1999(4): 3-5. [23] DEBNATH D, PAL A K, SAHU N P, et al. Digestive enzymes and metabolic profile of Labeo rohita fingerlings fed diets with different crude protein levels[J]. Comp Biochem Physiol B, 2007, 146(1): 107-114. doi: 10.1016/j.cbpb.2006.09.008
[24] 刘成荣. 枇杷多糖对金鱼消化特性及生长的影响[J]. 福建农业科技, 2016(5): 3-6. [25] CHEN L, ZHANG Y P. The growth performance and nonspecific immunity of juvenile grass carp (Ctenopharyngodon idella) affected by dietary Porphyra yezoensis polysaccharide supplementation[J]. Fish Shellfish Immunol, 2019, 87: 615-619. doi: 10.1016/j.fsi.2019.02.013
[26] 孙爱萍, 袁波, 杨玉军, 等. 鸡内金炮制的现代研究进展[J]. 中南药学, 2018, 16(6): 807-811. [27] XIONG Q, LI X, ZHOU R, et al. Extraction, characterization and antioxidant activities of polysaccharides from E. corneum gigeriae galli[J]. Carbohydr Polym, 2014, 108: 247-256. doi: 10.1016/j.carbpol.2014.02.068
[28] XIONG Q, JING Y, LI X, et al. Characterization and bioactivities of a novel purified polysaccharide from Endothelium corneum gigeriae Galli[J]. Int J Biol Macromol, 2015, 78: 324-332. doi: 10.1016/j.ijbiomac.2015.04.015
[29] FAWOLE F J, ADEOYE A A, TIAMIYU L O, et al. Substituting fishmeal with Hermetia illucens in the diets of African catfish (Clarias gariepinus): effects on growth, nutrient utilization, haemato-physiological response, and oxidative stress biomarker[J]. Aquaculture, 2020, 518: 734849. doi: 10.1016/j.aquaculture.2019.734849
[30] LIU Y, MIAO Y, XU N, et al. Effects of dietary Astragalus polysaccharides (APS) on survival, growth performance, activities of digestive enzyme, antioxidant responses and intestinal development of large yellow croaker (Larimichthys crocea) larvae[J]. Aquaculture, 2020, 517: 734752. doi: 10.1016/j.aquaculture.2019.734752
[31] LEI Y, SUN Y, WANG X, et al. Effect of dietary phosphorus on growth performance, body composition, antioxidant activities and lipid metabolism of juvenile Chinese mitten crab (Eriocheir sinensis)[J]. Aquaculture, 2021, 531: 735856. doi: 10.1016/j.aquaculture.2020.735856
[32] 王文豪, 董宏标, 孙彩云, 等. 石菖蒲挥发油和水溶性氮酮对鱼用麻醉剂的促皮渗透效果研究[J]. 南方水产科学, 2020, 16(4): 62-68. [33] HUSSAIN S, SLIKKER Jr W, ALI S F. Role of metallothionein and other antioxidants in scavenging superoxide radicals and their possible role in neuroprotection[J]. Neurochem Int, 1996, 29(2): 145-152. doi: 10.1016/0197-0186(95)00114-X
[34] 张林宝, 陈海刚, 田斐, 等. 三唑磷对翡翠贻贝神经毒性与氧化损伤效应的性别差异研究[J]. 南方水产科学, 2020, 16(6): 75-80. [35] 韩娜娜, 史成银. 血液指标在鱼类学研究中的应用[J]. 安徽农业科学, 2010, 38(33): 18877-18880. doi: 10.3969/j.issn.0517-6611.2010.33.099 [36] 吴凡, 蒋明, 文华, 等. 饲料碳水化合物与脂肪比例对吉富罗非鱼成鱼生长、体成分和血清生化指标的影响[J]. 南方水产科学, 2019, 15(4): 53-60. [37] 李宁宇, 刘利平, 华雪铭, 等. 豆粕影响日本鳗鲡黑仔鳗饲料中发酵豆粕对鱼粉的替代效果: 生长、抗氧化能力以及生化指标[J]. 海洋渔业, 2020, 42(3): 352-364. [38] 聂国兴, 明红, 郑俊林, 等. 木聚糖酶对尼罗罗非鱼血液生理生化指标的影响[J]. 大连水产学院学报, 2007, 22(5): 361-365. [39] GHOURI N, PREISS D, SATTAR N. Liver enzymes, nonalcoholic fatty liver disease, and incident cardiovascular disease: a narrative review and clinical perspective of prospective data[J]. Hepatology, 2010, 52(3): 1156-1161. doi: 10.1002/hep.23789
[40] GHELICHPOUR M, MIRGHAED A T, HOSEINI S M, et al. Plasma antioxidant and hepatic enzymes activity, thyroid hormones alterations and health status of liver tissue in common carp (Cyprinus carpio) exposed to lufenuron[J]. Aquaculture, 2020, 516: 734634. doi: 10.1016/j.aquaculture.2019.734634
[41] 谭连杰, 林黑着, 黄忠, 等. 当归多糖对卵形鲳鲹生长性能、抗氧化能力、血清免疫和血清生化指标的影响[J]. 南方水产科学, 2018, 14(4): 72-79. doi: 10.3969/j.issn.2095-0780.2018.04.009 [42] 汪成竹, 姚鹃, 吴凡, 等. 免疫多糖(酵母细胞壁)对中华鳖非特异性免疫功能的影响[J]. 华中农业大学学报, 2006, 5(4): 421-425. doi: 10.3321/j.issn:1000-2421.2006.04.020 -
期刊类型引用(11)
1. 肖佳程,赵一方,石耀华,顾志峰. 养殖密度对宝蓝鹦鹉鱼生长、生理与繁殖的影响. 热带生物学报. 2025(02): 304-311 .  百度学术
百度学术
2. 汪海燕,张永明,靳桂双,赵璐. 植物多糖的生物学功能及其在水产养殖中的应用. 饲料研究. 2024(09): 173-177 .  百度学术
百度学术
3. 高建伟,汪东升,邵锋锋. 加减大柴胡汤对胆总管结石患者湿热证候及肝功能的影响. 中医药临床杂志. 2024(06): 1144-1148 .  百度学术
百度学术
4. 夏伦斌,马龙龙,乔德亮,何燕飞,蒋平. 三角帆蚌多糖对肉仔鸡生长性能、抗氧化及免疫功能的影响. 浙江农业学报. 2023(03): 547-555 .  百度学术
百度学术
5. 田瑜,揭育鵾,曾祥兵,乐燕,刘广鑫,程长洪,马红玲,郭志勋. 密度对拟穴青蟹抗氧化、非特异性免疫能力的影响. 南方水产科学. 2023(03): 60-67 .  本站查看
本站查看
6. 刘清豪,张丹,陈卓,韦婉婷,王城城,金言,修彦凤. HPLC法同时测定炮制前后鸡内金中6种黄酮类成分. 中成药. 2023(08): 2618-2622 .  百度学术
百度学术
7. 李成辉,董宏标,郑晓婷,桂福坤,曾祥兵,明俊超,陈飞,陈健,张家松. 春砂仁精油对尼罗罗非鱼幼鱼生长、消化、抗氧化能力和血清生化指标的影响. 南方水产科学. 2023(06): 51-59 .  本站查看
本站查看
8. 黄健彬,迟艳,周传朋,黄小林,黄忠,虞为,荀鹏伟,吴杨,张宇,林黑着. 褐藻寡糖对卵形鲳鲹幼鱼生长性能、抗氧化能力和免疫功能的影响. 南方水产科学. 2022(03): 118-128 .  本站查看
本站查看
9. 贾慧凝,侍苗苗,卞永乐,侍崇敬,刘恒蔚,宋学宏,秦粉菊. 纳米硒对低氧胁迫下中华绒螯蟹免疫保护和抗氧化能力的影响. 南方水产科学. 2022(06): 100-109 .  本站查看
本站查看
10. 张慧,董宏标,孙彩云,陈健,黄聪灵,李勇,段亚飞,张家松. 饲料中添加月桂酸单甘酯对尖吻鲈脂质代谢与肝脏功能的影响. 海洋渔业. 2022(06): 736-746 .  百度学术
百度学术
11. 范思远,张海瑜,周永雨,尹秀雯,刘紫嫣,魏峰. 香菇菌丝体多糖对肉鸡生长性能、免疫功能及抗氧化性能的影响. 饲料研究. 2021(23): 41-44 .  百度学术
百度学术
其他类型引用(6)



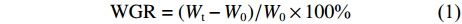
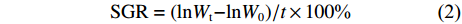
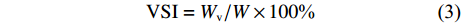
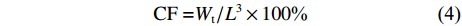
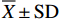
 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
