Seasonal variability in mixed layer depth in Nansha area in 2013
-
摘要:
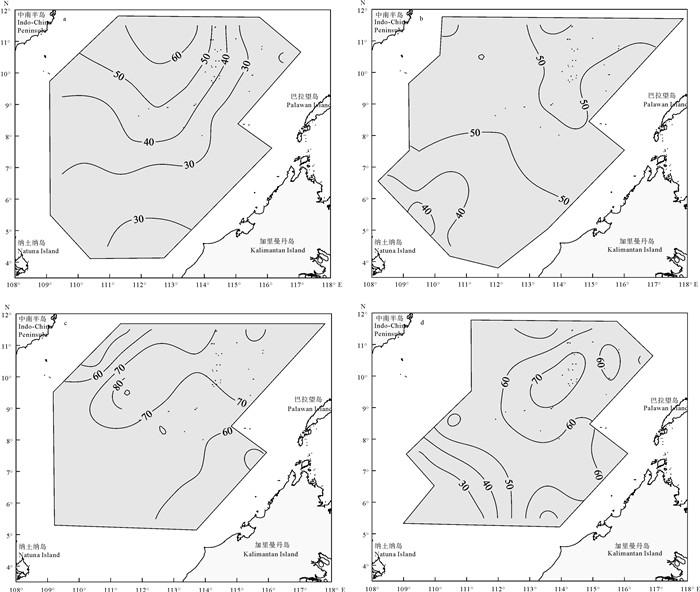
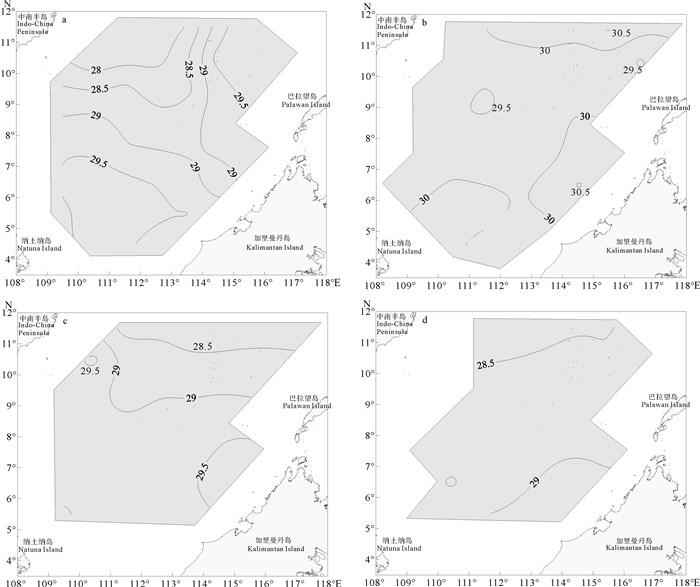
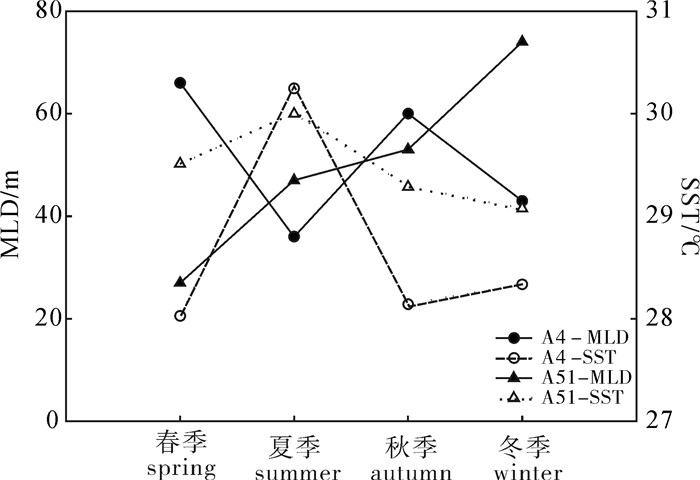
基于2013年在南沙海域开展的4个航次生态环境综合调查的实测资料,研究了该海域混合层深度(MLD)的季节变化特征。结果表明,南海南部海域MLD季节变化明显,海域均值以秋季最深(65 m),冬季次之(54 m),夏季居第3位(49 m),春季最浅(37 m),主要受季风、环流和海面净热通量的影响。其中春季时中南半岛对开的海域MLD较深,夏季时整个海域MLD分布较均匀,秋季时海域中部MLD最深,冬季时高值区出现在海域东北部。Ekman输运导致水体在巴拉望岛西侧、南沙南部以及加里曼丹岛西北侧产生的堆积作用,以及9°N以北海域冬季存在的失热效应,是MLD存在区域差异的可能原因。南海南部海域混合层水温始终大于27 ℃,其中夏季大于28 ℃,混合层内水温的季节变化很小。海表温度(SST)区域差异大时,MLD空间差异亦大;MLD与SST的关系在调查海域的南部和北部存在差异,代表性站位的研究结果显示,海域北部MLD与SST的变化刚好相反,而海域南部由于靠近赤道太阳辐射全年变化小致使SST变化亦小,SST与自春向冬急速加深的MLD关系不明显。
Abstract:Based on the observed data during four comprehensive investigations on ecological environment of Nansha area in 2013,we investigated the seasonal variability in mixed layer depth (MLD) in that area. Significant seasonal variability in MLD in that area was observed. In autumn,the MLD reached its maximum (65 m),followed by winter (54 m),summer (49 m) and spring (37 m). These seasonal variabilities were closely related with variations in monsoon,ocean current and sea surface heat flux. The MLD in the southeast area to the Indo-China Peninsula was deeper in spring;the MLD distribution was uniform in summer;the deepest MLD appeared in the central area in autumn;high value appeared in the northeastern area in winter. Ekman transport led to the effects of accumulation of water in the west Palawan Island,the south Nansha area and northwest Kalimantan Island,as well as heat lost effect on north of 9°N area in winter,which might be the reason for regional difference of MLD. Moreover,the water temperature of mixed layer in that area was always over 27 ℃ (more than 28 ℃ in summer),and seasonal change of water temperature in the mixed layer was very little. When the regional difference of sea surface temperature (SST) was huge,so was the space difference of MLD. Difference was found in relationship between MLD and SST between north and south in the surveyed area. Representative stations results reveal that MLD was contrary to the change of SST in the northern area,while in the southern area,the relationship between SST and MLD was not obvious. Since the southern area is near the equator,the change of solar radiation was little throughout the year which led to the little SST change. MLD rapidly deepened from spring to winter,which was not obviously related with SST.
-
Keywords:
- Nansha area /
- mixed layer depth /
- seasonal variability /
- water temperature
-
黄鳍金枪鱼 (Thunnus albacares) 隶属于鲭科、金枪鱼属,是一种喜集群的大洋性洄游鱼类,因背鳍、臀鳍及小鳍同为橘黄色,又名黄鳍鲔[1]。广泛分布于太平洋、大西洋、印度洋的热带和亚热带海域[2]。众所周知,金枪鱼具有生长速度快、粗蛋白和不饱和脂肪酸含量高的特点,深受消费者喜爱[3]。金枪鱼的丰度还可以支持珊瑚礁、沿海渔业和海水养殖等产业的可持续开发和利用[4]。其种群是组成远洋生态系统的关键部分,也是世界上最大和最有价值的渔业之一[5]。
对水生动物来说,pH是一个重要的环境因子,其极细微的变化也会产生深远影响[6];从而引起生态系统内一系列的化学变化,影响大多数水产生物的生长、繁殖、代谢与生存[7]。当水体pH下降到一定程度,超过机体的最大调控范围,就会出现细胞内酸中毒和环境高碳酸血症[8]。二氧化碳 (CO2)排放过量引起的海洋酸化改变了海洋环境,扰乱了海洋动物机体的新陈代谢、酸碱平衡和生物体内多种酶的活性[9]。有研究表明,水体酸化会使金头鲷 (Sparus aurata) 的抗氧化能力受到抑制[10];过酸的养殖水体会显著影响脊尾白虾 (Exopalaemon carinicauda) 的非特异性免疫力[11];酸化导致了青鳉 (Oryzias melastigm) 幼鱼脂质代谢紊乱[12];严重的酸化条件与舌齿鲈 (Dicentrarchus labrax) 显著升高的最大代谢率有关[13];海洋酸化会导致金枪鱼的生物量减少[14]。
大气中过多的CO2被海水吸收后形成碳酸,增加了海水酸度,然而少有酸化胁迫对黄鳍金枪鱼幼鱼生理特性影响的报道。随着捕捞量的增加,金枪鱼的资源量急剧下降,无法满足市场需求。本研究通过测定相关酶活性,评估海水酸化胁迫对黄鳍金枪鱼幼鱼抗氧化防御系统和免疫功能的影响,为海洋生态环境和金枪鱼野生种群的保护提供参考。
1. 材料与方法
1.1 实验材料
黄鳍金枪鱼幼鱼平均体长为 (18.21±1.09) cm、平均体质量为 (354.98±149.77) g,由中国水产科学研究院南海水产研究所热带水产研究开发中心提供。实验用水为砂滤后的自然海水,水温 (22.5±1.0) ℃,溶解氧质量浓度 (7.5±0.5) mg·L−1,盐度 (33.00±0.80)‰,氨氮质量浓度 <0.05 mg·L−1,亚硝酸盐质量浓度 <0.05 mg·L−1。
1.2 实验设计
正式实验开始前,先将金枪鱼幼鱼在驯养池中暂养7 d,期间投喂冰鲜杂鱼。随机挑选72尾行为活泼、体表健康的幼鱼,在直径和水深均为1.5 m的圆形钢化桶中进行48 h的酸化胁迫实验,暂养期间与正式实验期间水质保持一致。实验共设置4组,以自然海水pH 8.1为对照组,pH 7.6、7.1、6.6为实验组,每组设3个重复,每个重复6尾鱼。实验期间金枪鱼幼鱼处于停食状态。并通过1.0 mmol·L−1的氢氧化钠 (NaOH) 溶液或1.0 mmol·L−1的盐酸 (HCl) 溶液调节海水pH。使用pH分析仪 (PH848) 测定海水酸度,每2 h矫正1次,使pH变化幅度保持在 ±0.1。实验至第48小时,统计死亡的幼鱼数量 (以鱼体侧躺、沉入水底不再游动为准),计算成活率。
1.3 样品采集与处理
实验结束后每组随机选取6尾黄鳍金枪鱼幼鱼,经丁香酚麻醉后进行解剖,解剖全程在冰盒上进行。分别采集肝、鳃、红肌、皮肤组织于2 mL无菌冻存管中,置于液氮中冷冻,之后保存在−80 ℃冰箱中用于后续免疫和代谢酶的测定。准确称取组织0.1~0.2 g,加入9倍体积的0.9% (w) 盐水,冰水浴条件下机械匀浆后,3 000 r·min−1离心10 min,取上清液测定相关酶活性和总蛋白含量。选取丙二醛 (MDA) 为抗氧化物质的标志物;超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)、谷胱甘肽过氧化物酶 (GSH-Px) 和过氧化物酶 (POD) 作为抗氧化防御系统的标志物;酸性磷酸酶 (ACP)、碱性磷酸酶 (AKP)、溶菌酶 (LZM) 作为免疫系统的标志物。上述所有检测均使用南京建成生物工程研究所试剂盒,所有指标的测定严格按照说明书进行操作。采用酶标仪 (SYNERGY-HT) 或分光光度计 (UV-1800BPC) 测定各项指标。
1.4 数据处理
采用Excel 2010软件整理数据,以“平均值±标准差 ($\overline { x}\pm s $) ”表示 (n=3)。实验结果通过SPSS 25.0软件进行单因素方差分析 (One-way ANOVA),并用邓肯检验法分析组间差异性,显著性水平α为0.05。使用Origin 2022软件作图。
2. 结果
实验至第48小时,仅pH 6.6处理组的幼鱼出现死亡,成活率为83%。各组之间无显著性差异 (P>0.05,图1)。
2.1 酸化胁迫对黄鳍金枪鱼幼鱼抗氧化能力的影响
与对照组相比,各实验组皮肤的MDA含量均有所下降,红肌和鳃的MDA含量均有所上升。除对照组外,相同pH下肝脏中的MDA含量均显著高于其他组织 (P<0.05),且随着pH的降低呈上升趋势,在pH 6.6时含量最高 (图2)。
随着pH的降低,皮肤中的SOD活性呈先下降再上升的趋势,肝中的SOD活性呈下降趋势,二者均在pH 8.1时达到最高。红肌中的SOD活性在pH 7.6时最高。鳃中的SOD活性在pH 7.1时达到最高,且随着pH的降低呈先上升后下降的趋势;除对照组外,相同pH下鳃中的SOD活性均显著高于其他组织 (P<0.05,图3-a)。
![]() 图 3 酸化胁迫对黄鳍金枪鱼幼鱼超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和过氧化物酶活性的影响注:相同pH下不同字母表示不同组织间差异显著 (P<0.05)。Figure 3. Effects of acidification stress on SOD, CAT, GSH-Px and POD activities of juvenile yellowfin tunaNote: Different letters represent significant differences among different tissues with the same pH (P<0.05).
图 3 酸化胁迫对黄鳍金枪鱼幼鱼超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和过氧化物酶活性的影响注:相同pH下不同字母表示不同组织间差异显著 (P<0.05)。Figure 3. Effects of acidification stress on SOD, CAT, GSH-Px and POD activities of juvenile yellowfin tunaNote: Different letters represent significant differences among different tissues with the same pH (P<0.05).随着pH的降低,皮肤中的CAT活性呈下降趋势,在pH 8.1时活性最高。鳃和红肌中的CAT活性呈先上升再下降的趋势,在pH 7.1时达到最高;除对照组外,相同pH下鳃中的CAT活性均显著高于其他组织 (P<0.05)。肝中的CAT活性变化平稳,在pH 6.6时达到最高。相同pH下,肝和鳃中的CAT活性均显著高于皮肤和红肌 (P<0.05,图3-b)。
随着pH的降低,皮肤、红肌和鳃中的GSH-Px活性变化相似,均呈先上升后下降的趋势,且均在pH 7.1时达到最高,此时皮肤中的GSH-Px活性显著高于其他组织 (P<0.05)。肝中的GSH-Px活性呈上升趋势,在pH 6.6时达到最高 (图3-c)。
随着pH的降低,皮肤中的POD活性呈下降趋势,在pH 8.1时活性最高。红肌中各实验组的POD活性均高于对照组,在pH 6.6时达到最高。鳃中的POD活性呈先上升后下降的趋势,在pH 7.1时达到最高;相同pH下鳃中的POD活性均显著高于其他组织 (P<0.05)。肝中的POD活性呈先下降再上升的趋势,在pH 8.1时活性最高。除对照组外,相同pH下红肌和鳃中的POD活性均显著高于皮肤和肝 (P<0.05,图3-d)。
2.2 酸化胁迫对黄鳍金枪鱼幼鱼免疫酶活性的影响
随着pH的降低,肝和皮肤各实验组的ACP活性与对照组相比均有所下降;相同pH下肝中的ACP活性均显著高于其他组织 (P<0.05)。红肌中的ACP活性呈先上升后下降再上升的趋势,在pH 7.6时达到最高;鳃中的ACP活性呈先上升后下降的趋势,在pH 7.1时达到最高。相同pH下鳃中的ACP活性均显著低于其他组织 (P<0.05,图4-a)。
随着pH的降低,鳃、红肌和皮肤中的AKP活性呈先下降后上升的趋势,均在pH 8.1时最高。肝中的AKP活性呈上升趋势,在pH 7.1时达到最高。相同pH下红肌中的AKP活性均显著低于其他组织 (P<0.05,图4-b)。
随着pH的降低,皮肤中的LZM活性呈先上升后下降的趋势,在pH 7.1时达到最高。鳃和红肌中的LZM活性呈上升趋势,均在pH 6.6时达到最高;相同pH下鳃中的LZM活性均显著高于其他组织 (P<0.05)。肝中的LZM活性在pH 7.1时达到最高 (图4-c)。
3. 讨论
3.1 环境胁迫对水产动物不同组织抗氧化能力的影响
MDA是脂质过氧化的重要产物[15],反映机体受氧化损伤的程度[16],其含量随着机体氧化应激水平升高而增加,含量越高表明鱼体所受的压力越大[17]。肝脏有排泄、解毒等多种功能,可清除外来有害物质和机体产生的有害废物[18];且含有大量与免疫相关的细胞,具有重要的免疫调节功能,在机体的免疫应答中发挥重要作用[19]。本研究中肝脏的MDA含量随海水酸度升高呈上升趋势,且累积含量显著高于其他组织。可能是由于金枪鱼处于应激状态,体内产生大量的活性氧自由基,脂质过氧化水平升高,机体出现了氧化损伤,与克氏原螯虾 (Procambarus clarkii)[20]的结果相似。
SOD和CAT活性的变化可在一定程度上反映出机体受环境胁迫时免疫机能的变化[21]。GSH-Px在清除过氧化氢 (H2O2)、把脂质过氧化物还原成无毒产物方面起着至关重要的作用[22],其与CAT在清除自由基方面既是互补也是竞争关系[23]。SOD、CAT和GSH-Px协同作用,是抗氧化系统的重要组成部分[24]。POD和生物应激相关,可水解H2O2,对细胞起保护作用[25]。
鳃是鱼类主要的呼吸和免疫器官,表面积大且与水体直接接触,易受有害物质伤害[26];其黏膜中含有丰富的免疫分子,在抵御外界侵袭中发挥重要作用[27]。本研究中,各处理组鳃中的SOD、CAT和POD活性显著高于其他组织,且在pH 7.1时达到最高。说明酸性胁迫下金枪鱼组织中的活性氧自由基含量升高,诱导SOD、CAT和POD的活性升高,鱼体通过激活抗氧化酶系统促进蛋白质合成,改善代谢产物,保护细胞不受损伤,从而使鱼体能够适应低pH环境,达到新的动态平衡。但水体酸度过高时,鱼体会产生过量的氧自由基 (·O2−),机体无法产生足够的SOD和CAT来清除 ·O2−,且动物机体在受到环境胁迫时,SOD和CAT可能会发生抑制的应激变化[28],因此本研究鳃中的CAT活性在pH 6.6时有所回落。与沙塘鳢 (Odontobutis potamophila)[29]、瓦氏黄颡鱼 (Pelteobagrus vachelli)[30]和方斑东风螺 (Babylonia areolata)[31]的研究结果相似。
鱼类皮肤的腺层内含有丰富的腺细胞,分泌的黏液中含有丰富的免疫因子,如溶菌酶、补体类物质等[32],构成了机体的第一道防线[33]。本研究中,皮肤的GSH-Px活性在pH 7.1时达到最高,显著高于其他组织,而CAT活性低于其他组织,可能是由于H2O2没有被CAT及时分解,诱导机体生成更多的GSH-Px来清除多余的H2O2。GSH-Px的活性升高,谷胱甘肽 (GSH) 等抗氧化物质就会消耗过大,可能导致机体受到损伤[34]。本研究中皮肤的GSH-Px活性在pH 7.1时大幅上升,推测此时鱼体无法适应过酸的海水,机体出现了损伤。与尖吻鲈 (Lates calcarifer) 幼鱼[35]和点篮子鱼 (Siganus guttatus) 幼鱼[36]的表现类似。
3.2 环境胁迫对水产动物不同组织免疫酶的影响
磷酸酶又称正磷酸单酯水解酶,可以催化各种含磷化合物的水解,根据他们的特性 (即起催化作用的最适pH),可分为ACP和AKP两类[37],前者主要起催化效果,后者主要起调理和调节的作用[38]。当水体中溶解氧含量低于正常水平时,鱼体发生应激反应,并通过提高AKP和ACP的活性来增强非特异性免疫力[39]。
本研究中,肝脏的ACP活性显著高于其他组织,且随着pH的降低呈下降趋势;但AKP活性呈上升趋势,可能因为二者在肝脏中的作用不同。分析出现上述结果的原因,可能是海水酸度过高,机体为了维持酸碱和离子平衡而采取的一种调节措施,是生物体主动防御的表现。类似的报道还有脊尾白虾[11]和栉孔扇贝 (Chlamys farreri)[21]。鳃中的ACP和AKP变化不一致,可能是此时的环境pH影响了鳃细胞参与免疫的水解酶活性。类似的结果还见于翘嘴鳜 (Siniperca chuatsi) 幼鱼[40]和缢蛏 (Sinonovacula constricta) 成贝[41]。
LZM是衡量鱼类非特异性免疫的指标之一[42],在面对外界环境胁迫时,其活性会升高[43],活性越强,机体的非特异性免疫力就越强[44]。鳃中的LZM活性显著高于其他组织,且随海水酸度的升高呈上升趋势。可能是由于海水酸度的增加使金枪鱼处于应激状态,鱼体通过增加LZM的活性以抵抗外源环境的压力,属于自身的应急保护反应。
4. 结论
本研究通过设置4组酸化梯度 (pH 8.1、7.6、7.1、6.6) 对黄鳍金枪鱼幼鱼进行48 h的环境胁迫,结果显示,酸化胁迫对黄鳍金枪鱼幼鱼的免疫功能和抗氧化防御系统影响显著。抗氧化物质在pH 6.6时达到最高;抗氧化酶的活性多数在pH 7.1时达到最高;非特异性免疫酶变化不一,不同酶的活性因组织不同而呈类似或不同的变化趋势。提示黄鳍金枪鱼幼鱼在pH大于7.1的酸化环境中有一定的调节能力,pH小于7.1时免疫系统发生紊乱。整体而言,肝脏和鳃中的酶活性高于红肌和皮肤,这表明在面对海水酸度升高时,肝脏和鳃中的抗氧化酶和免疫酶能更好地表达,二者抗氧化酶和免疫酶的变化可以代表黄鳍金枪鱼幼鱼机体免疫功能和抗氧化防御系统的变化。
致谢: 农业部财政重大专项“南海渔业资源调查与评估”(NFZX2013)课题组成员在海上调查方面提供了大力的支持和帮助,谨此致谢! -
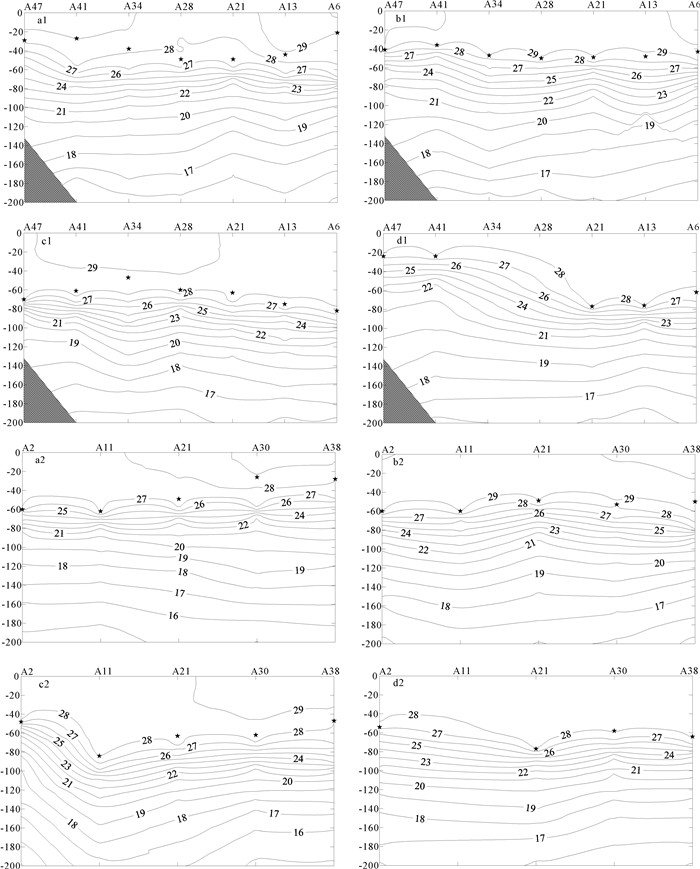
图 3 A47、A2断面四季混合层特征
a1/b1/c1/d1分别为A47断面的春/夏/秋/冬,a2/b2/c2/d2分别为A2断面的春/夏/秋/冬;
★表示MLD,冬季时缺A34、A28、A11的数据Figure 3. Mixed layer features in A47 and A2 section in four seasons
a1/b1/c1/d1 are spring/summer/autumn/winter of A47 section,and a2/b2/c2/d2 were spring/summer/autumn/winter of A2 section;
★indicates MLD;data of A34,A28 and A11 in winter were lacked. -
[1] LIM S H,JANG C J,PARK J J. Climatology of the mixed layer depth in the East/Japan Sea[J].J Mar Syst,2012,96:1-14. doi: 10.1016/j.jmarsys.2012.01.003
[2] 范聪慧. 多因素对海洋上混合层深度影响的数值模拟[D]. 北京: 中国科学院研究生院, 2007. https://xueshu.baidu.com/usercenter/paper/show?paperid=6e3a500b4c5a942eba179b5c7ec41c7c&site=xueshu_se&hitarticle=1 [3] 施平, 杜岩, 王东晓, 等. 南海混合层年循环特征[J]. 热带海洋学报, 2001, 20(1): 10-16. doi: 10.3969/j.issn.1009-5470.2001.01.002 [4] KUMAR S P, NARVEKAR J. Seasonal variability of the mixed layer in the central Arabian Sea and its implication on nutrients and primary productivity[J]. Deep Sea Res Ⅱ, 2005, 52(14): 1848-1861. doi: 10.1016/j.dsr2.2005.06.002
[5] PERALTA-FERRIZ C, WOODGATE R A. Seasonal and interannual variability of pan-Arctic surface mixed layer properties from 1979 to 2012 from hydrographic data, and the dominance of stratification for multiyear mixed layer depth shoaling[J]. Prog Oceanogr, 2015, 134: 19-53. doi: 10.1016/j.pocean.2014.12.005
[6] AYOUB N K, LUCAS M, de MEY P. Estimating uncertainties on a Gulf Stream mixed-layer heat budget from stochastic modeling[J]. J Mar Syst, 2015, 150: 66-79. doi: 10.1016/j.jmarsys.2015.04.008
[7] HOUPERT L, TESTOR P, de MADRON X D, et al. Seasonal cycle of the mixed layer, the seasonal thermocline and the upper-ocean heat storage rate in the Mediterranean Sea derived from observations[J]. Prog Oceanogr, 2015, 132: 333-352. doi: 10.1016/j.pocean.2014.11.004
[8] SWART S, THOMALLA S J, MONTEIRO P M S. The seasonal cycle of mixed layer dynamics and phytoplankton biomass in the sub-antarctic zone: a high-resolution glider experiment[J]. J Mar Syst, 2015, 147: 103-115. doi: 10.1016/j.jmarsys.2014.06.002
[9] MIZOBATA K, SHIMADA K. East-west asymmetry in surface mixed layer and ocean heat content in the Pacific sector of the Arctic Ocean derived from AMSR-E sea surface temperature[J]. Deep Sea Res Ⅱ, 2012, 77: 62-69. doi: 10.1016/j.dsr2.2012.04.005
[10] ZG KMEN T M, POJE A C, FISCHER P F, et al. Large eddy simulations of mixed layer instabilities and sampling strategies[J]. Ocean Model, 2011, 39(3): 311-331. doi: 10.1016/j.ocemod.2011.05.006
[11] HALKIDES D, LEE T. Mechanisms controlling seasonal mixed layer temperature and salinity in the southwestern tropical Indian Ocean[J]. Dynam Atmos Oceans, 2011, 51(3): 77-93. doi: 10.1016/j.dynatmoce.2011.03.002
[12] 唐峰华, 崔雪森, 杨胜龙, 等. 海洋环境对中西太平洋金枪鱼围网渔场影响的GIS时空分析[J]. 南方水产科学, 2014, 10(2): 18-26. doi: 10.3969/j.issn.2095-0780.2014.02.003 [13] 陈春光, 张敏, 邹晓荣, 等. 东南太平洋智利竹筴鱼中心渔场的月间变动研究[J]. 南方水产科学, 2015, 10(5): 60-67. doi: 10.3969/j.issn.2095-0780.2014.05.009 [14] 江艳娥, 陈作志, 林昭进, 等. 南海中部海域鸢乌贼耳石形态特征分析[J]. 南方水产科学, 2014, 10(4): 85-90. doi: 10.3969/j.issn.2095-0780.2014.04.014 [15] EGGERT A, SCHNEIDER B. A nitrogen source in spring in the surface mixed-layer of the Baltic Sea: evidence from total nitrogen and total phosphorus data[J]. J Mar Syst, 2015, 148: 39-47. doi: 10.1016/j.jmarsys.2015.01.005
[16] BAG IEN E, MELLE W, KAARTVEDT S. Seasonal development of mixed layer depths, nutrients, chlorophyll and Calanus finmarchicus in the Norwegian Sea: a basin-scale habitat comparison[J]. Prog Oceanogr, 2012, 103: 58-79. doi: 10.1016/j.pocean.2012.04.014
[17] ROUSSEAUX C S G, LOWE R, FENG M, et al. The role of the Leeuwin Current and mixed layer depth on the autumn phytoplankton bloom off Ningaloo Reef, Western Australia[J]. Cont Shelf Res, 2012, 32: 22-35. doi: 10.1016/j.csr.2011.10.010
[18] WANG J J, TANG D L, SUI Y. Winter phytoplankton bloom induced by subsurface upwelling and mixed layer entrainment southwest of Luzon Strait[J]. J Mar Syst, 2010, 83(3): 141-149. doi: 10.1016/j.jmarsys.2010.05.006
[19] RYABOV A B, RUDOLF L, BLASIUS B. Vertical distribution and composition of phytoplankton under the influence of an upper mixed layer[J]. J Theor Biol, 2010, 263(1): 120-133. doi: 10.1016/j.jtbi.2009.10.034
[20] ZHAI L, PLATT T, TANG C, et al. Seasonal and geographic variations in phytoplankton losses from the mixed layer on the Northwest Atlantic Shelf[J]. J Mar Syst, 2010, 80(1): 36-46. doi: 10.1016/j.jmarsys.2009.09.005
[21] FRANTS M, GILLE S T, HATTA M, et al. Analysis of horizontal and vertical processes contributing to natural iron supply in the mixed layer in southern Drake Passage[J]. Deep Sea Res Ⅱ, 2013, 90: 68-76. doi: 10.1016/j.dsr2.2012.06.001
[22] TAILLANDIER V, D′ORTENZIO F, ANTOINE D. Carbon fluxes in the mixed layer of the Mediterranean Sea in the 1980s and the 2000s[J]. Deep Sea ResⅠ, 2012, 65: 73-84. doi: 10.1016/j.dsr.2012.03.004
[23] NARVEKAR J, KUMAR S P. Seasonal variability of the mixed layer in the central Bay of Bengal and associated changes in nutrients and chlorophyll[J]. Deep Sea ResⅠ, 2006, 53(5): 820-835. doi: 10.1016/j.dsr.2006.01.012
[24] 何有海, 关翠华, 王盛安, 等. 南海南部热结构和水温的垂直分布[C]//南沙群岛海区物理海洋学研究论文集Ⅰ. 北京: 海洋出版社, 1994: 10-27. [25] 杜岩. 南海混合层和温跃层的季节动力过程[D]. 青岛: 青岛海洋大学, 2002. https://xueshu.baidu.com/usercenter/paper/show?paperid=8b3a3544379327f927e77e28e018ba22&site=xueshu_se&hitarticle=1 [26] 刘秦玉, 贾旭晶, 孙即霖, 等. 1998年夏季风爆发前后南海上混合层的特征及成因[J]. 气候与环境研究, 2000, 5(4): 469-481. doi: 10.3969/j.issn.1006-9585.2000.04.012 [27] 刘辉, 江丽芳, 齐义泉, 等. 南沙群岛海域混合层深度季节变化特征[J]. 海洋科学进展, 2007, 25(3): 268-279. doi: 10.3969/j.issn.1671-6647.2007.03.003 [28] LUKAS R, LINDSTROM E. The mixed layer of the western equatorial Pacific Ocean[J]. J Geophys Res, 1991, 96: 3343-3357. doi: 10.1029/90JC01951
[29] 贾旭晶, 刘秦玉, 孙即霖. 1998年5-6月南海上混合层、温跃层不同定义的比较[J]. 海洋湖沼通报, 2001(1): 1-6. doi: 10.3969/j.issn.1003-6482.2001.01.001 [30] De BOYER MONT GUT C, MADEC G, FISCHER A S, et al. Mixed layer depth over the global ocean: an examination of profile data and a profile-based climatology[J]. J Geophys Res: Oceans (1978-2012), 2004, 109(C12): doi: 10.1029/2004JC002378.
[31] KARA A B, ROCHFORD P A, HURLBURT H E. An optimal definition for ocean mixed layer depth[J]. J Geophys Res: Oceans (1978-2012), 2000, 105(C7): 16803-16821. doi: 10.1029/2000JC900072
[32] BRAINERD K E, GREGG M C. Surface mixed and mixing layer depths[J]. Deep Sea ResⅠ, 1995, 42(9): 1521-1543. doi: 10.1016/0967-0637(95)00068-H
[33] HUANG R X, QIU B. Three-dimensional structure of the wind-driven circulation in the subtropical North Pacific[J]. J Phys Oceanogr, 1994, 24(7): 1608-1622. doi: 10.1175/1520-0485(1994)024<1608:TDSOTW>2.0.CO;2
[34] 关皓, 周林, 施伟来, 等. 热带太平洋-印度洋上层海温、热含量和混合层深度的年变化特征[J]. 海洋预报, 2006, 23(增): 47-59. https://xueshu.baidu.com/usercenter/paper/show?paperid=a6082c73ac75a9147507d984806e9afe [35] 邱章, 徐锡祯, 龙小敏. 1994年9月南沙群岛调查海区的跃层特征[J]. 热带海洋, 1996, 15(2): 61-67. [36] HAYES S P, CHANG P, MCPHADEN M J. Variability of the sea surface temperature in the eastern equatorial Pacific during 1986-1988[J]. J Geophys Res: Oceans (1978-2012), 1991, 96(C6): 10553-10566. doi: 10.1029/91JC00942
[37] 方文东, 郭忠信, 黄羽庭. 南海南部海区的环流观测研究[J]. 科学通报, 1997, 42(21): 2264-2271. doi: 10.1360/csb1997-42-21-2264 [38] CHU P C, CHANG C P. South China Sea warm pool in boreal spring[J]. Adv Atmos Sci, 1997, 14(2): 195-206. doi: 10.1007/s00376-997-0019-8
-
期刊类型引用(11)
1. 肖佳程,赵一方,石耀华,顾志峰. 养殖密度对宝蓝鹦鹉鱼生长、生理与繁殖的影响. 热带生物学报. 2025(02): 304-311 .  百度学术
百度学术
2. 汪海燕,张永明,靳桂双,赵璐. 植物多糖的生物学功能及其在水产养殖中的应用. 饲料研究. 2024(09): 173-177 .  百度学术
百度学术
3. 高建伟,汪东升,邵锋锋. 加减大柴胡汤对胆总管结石患者湿热证候及肝功能的影响. 中医药临床杂志. 2024(06): 1144-1148 .  百度学术
百度学术
4. 夏伦斌,马龙龙,乔德亮,何燕飞,蒋平. 三角帆蚌多糖对肉仔鸡生长性能、抗氧化及免疫功能的影响. 浙江农业学报. 2023(03): 547-555 .  百度学术
百度学术
5. 田瑜,揭育鵾,曾祥兵,乐燕,刘广鑫,程长洪,马红玲,郭志勋. 密度对拟穴青蟹抗氧化、非特异性免疫能力的影响. 南方水产科学. 2023(03): 60-67 .  本站查看
本站查看
6. 刘清豪,张丹,陈卓,韦婉婷,王城城,金言,修彦凤. HPLC法同时测定炮制前后鸡内金中6种黄酮类成分. 中成药. 2023(08): 2618-2622 .  百度学术
百度学术
7. 李成辉,董宏标,郑晓婷,桂福坤,曾祥兵,明俊超,陈飞,陈健,张家松. 春砂仁精油对尼罗罗非鱼幼鱼生长、消化、抗氧化能力和血清生化指标的影响. 南方水产科学. 2023(06): 51-59 .  本站查看
本站查看
8. 黄健彬,迟艳,周传朋,黄小林,黄忠,虞为,荀鹏伟,吴杨,张宇,林黑着. 褐藻寡糖对卵形鲳鲹幼鱼生长性能、抗氧化能力和免疫功能的影响. 南方水产科学. 2022(03): 118-128 .  本站查看
本站查看
9. 贾慧凝,侍苗苗,卞永乐,侍崇敬,刘恒蔚,宋学宏,秦粉菊. 纳米硒对低氧胁迫下中华绒螯蟹免疫保护和抗氧化能力的影响. 南方水产科学. 2022(06): 100-109 .  本站查看
本站查看
10. 张慧,董宏标,孙彩云,陈健,黄聪灵,李勇,段亚飞,张家松. 饲料中添加月桂酸单甘酯对尖吻鲈脂质代谢与肝脏功能的影响. 海洋渔业. 2022(06): 736-746 .  百度学术
百度学术
11. 范思远,张海瑜,周永雨,尹秀雯,刘紫嫣,魏峰. 香菇菌丝体多糖对肉鸡生长性能、免疫功能及抗氧化性能的影响. 饲料研究. 2021(23): 41-44 .  百度学术
百度学术
其他类型引用(6)




 下载:
下载:



 粤公网安备 44010502001741号
粤公网安备 44010502001741号
