Effect of carotenoids on expression of heat shock protein 22 gene in pearl oyster (Pinctada fucata)
-
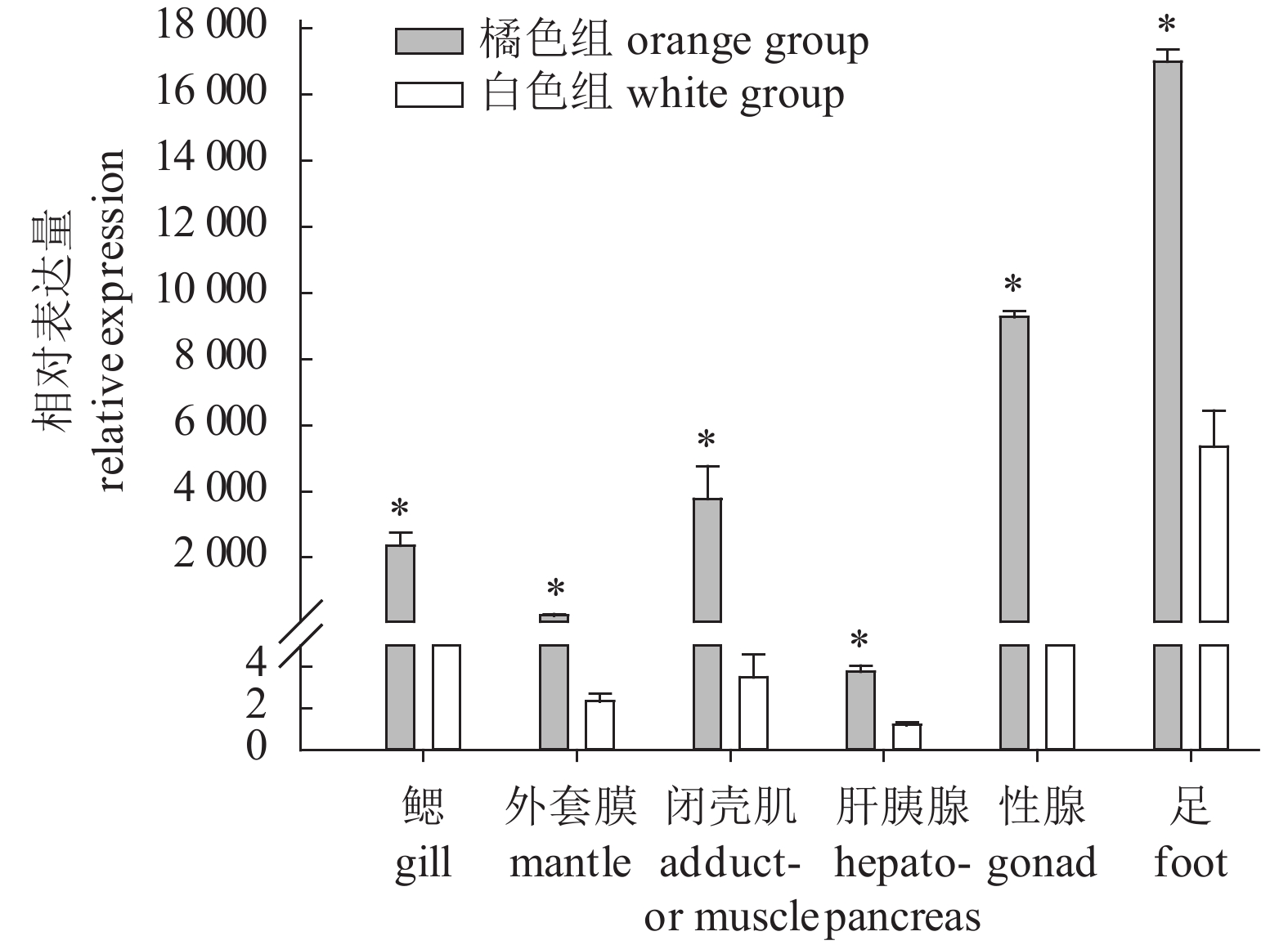
摘要: 该研究获得了合浦珠母贝(Pinctada fucata)热休克蛋白22 (heat shock protein 22,PfHSP22)基因cDNA序列,全长2 187 bp,其中开放阅读框699 bp,预测编码232个氨基酸。结构预测显示PfHSP22具有小热休克蛋白家族典型结构域“α-晶体结构域”(ACD)。氨基酸序列比对结果显示,PfHSP22与缢蛏(Sinonovacula constricta)的HSP22相似性最高(54%)。进化分析显示,PfHSP22与软体动物的亲缘关系较近。实时荧光定量PCR结果分析表明,常温条件下,PfHSP22在类胡萝卜素含量高的橘色组和含量低的白色组的各组织中均有表达,足中表达量最高,且橘色组均显著高于白色组(P<0.05),表明类胡萝卜素含量高低可能影响PfHSP22的基础表达量。高温胁迫时,橘色组和白色组各组织的PfHSP22表达量在前3 h基本呈现下降趋势,之后呈现出或升高或下降的复杂变化;其中橘色组一些组织的PfHSP22表达量显著升高时间晚于白色组,这可能是由类胡萝卜素含量差异引起。Abstract: We obtained the full-length cDNA sequence of heat shock protein 22 gene (GenBank accession No.: MG013985, named PfHSP22) from pearl oyster (Pinctada fucata). The full length of PfHSP22 cDNA was 2 187 bp, including a 699 bp ORF (open reading frame) which encoded 232 amino acid residues. PfHSP22 was predicted to contain the "α-crystal domain" (ACD), a typical domain of the small heat shock protein family. The amino acid sequence alignment results show that PfHSP22 had the highest similarity (54%) with HSP22 of Sinonovacula constricta. The phylogenetic analysis shows that PfHSP22 was closely related with molluscs. The qRT-PCR (quantitative real-time PCR) analysis reveals that PfHSP22 gene was expressed in various tissues of orange adductor muscle individuals with high carotenoids content and white adductor muscle individuals with low carotenoids content. The highest expression of PfHSP22 was observed in foot, and the expression of PfHSP22 in orange group was significantly higher than that in white group at normal temperature (P<0.05). It is indicated that the level of carotenoids might affect the basic expression of PfHSP22 gene. During the high temperature stress process, the expression of PfHSP22 in each tissue generally showed a downward trend in the first 3 h, and then showed a complex change of increase or decrease. There were several tissues whose time for PfHSP22 gene expression to rise significantly was later in orange group than in white group, which might be caused by the difference in the carotenoid content.
-
Keywords:
- Pinctada fucata /
- HSP22 /
- carotenoids /
- expression analysis /
- small heat shock protein
-
金线鱼(Nemipterus virgatus)属金线鱼科、金线鱼属,是南海区重要的经济鱼类[1-2]。2013年南海区金线鱼捕捞产量为317 094 t,占海洋捕捞总产量的9.72%[3]。南海金线鱼的主要作业方式包括底拖网、手钓、延绳钓和流刺网[1, 4-5]。金线鱼刺网属于漂流单片刺网,是南海区重要作业方式,其捕捞种类除金线鱼外,还包括多齿蛇鲻(Saurida tumbil)、长尾大眼鲷(Priacanthus tayenus)、带鱼(Trichiurus haumela)等[5]。目前,南海区金线鱼刺网网目尺寸有不断减小的趋势[5],且该刺网尚未见有最小网目尺寸的标准或研究报道,仅农业部于2014年以通告的形式规定南海区流刺网最小网目尺寸为50 mm。关于南海金线鱼刺网最小网目尺寸定为50 mm是否合理这一问题,目前尚未见有相关的研究报道。
刺网选择性研究是制定最小网目尺寸的理论基础和前提[6]。目前,刺网选择性研究最常用的方法是间接估算法,即采用几种网目尺寸不同的刺网进行共同捕鱼试验,然后通过比较渔获物的体长变化确定刺网的选择性[6-7]。SELECT(Share Each LEngthclass′s Catch Total)模型于1992年由MILLAR发明并应用于拖网选择性研究中,之后该模型被广泛应用于张网、刺网、笼壶和延绳钓的选择性估算中[8-14]。国外很多刺网选择性研究都以SELECT模型作为参数估算的手段[11, 15-16]。迄今,中国也进行过一些刺网选择性研究[4, 17-18],但以SELECT模型为基础的不多。尤其基于SELECT模型的金线鱼刺网选择性研究还未见有报道。文章根据南海区金线鱼刺网选择性试验的相关数据,以SELECT模型为基础,分析刺网网目尺寸对金线鱼的选择性,为制定最小网目尺寸提供科学依据,也为SELECT模型在中国刺网选择性研究的应用提供参考。
1. 材料与方法
1.1 试验渔船和渔场
试验于2008年5月在南海北部近海渔场进行。试验渔船为传统金线鱼刺网生产船,船名“粤阳东18023”,船长23.2 m,主机功率183 kW。作业海域经纬度为112° 00′~113° 00′E、20°00′~21°30′N,水深75~87 m,底质为沙泥。
1.2 试验网具
用网目尺寸分别为40 mm、45 mm、50 mm、55 mm和60 mm的金线鱼刺网共47片进行试验,网具的详细参数见表 1。网线材料为锦纶单丝,机械编织。上纲长度为36.97 m,缩结系数为0.51;下纲长度45.45 m,缩结系数为0.63。
表 1 实验网的主要技术参数Table 1. Technical characteristics of gillnets used in this experiment参数parameter 网目尺寸/mm mesh size 40 45 50 55 60 横向目数/目number of mesh in length 1 798 1 598 1 438 1 308 1 198 纵向目数/目number of mesh in height 120 106 96 88 80 上纲长度/m length of floatline 36.97 36.97 36.97 36.97 36.97 下纲长度/m length of leadline 45.45 45.45 45.45 45.45 45.45 网线直径/mm diameter of net twine 0.25 0.25 0.30 0.30 0.35 网片数量/片number of gillnets 10 10 10 7 10 1.3 数据收集
将网片按网目尺寸大小依次连接后,接连渔船实际生产网片进行作业。一般放网时间为04: 00~04: 30,起网时间为12: 30~13: 10,网片的平均浸泡时间约为8~9 h。一共完成了6网次捕捞试验。起网后按照网目尺寸摘取渔获,进行种类鉴定,然后测量生物学参数。
1.4 数据分析
1.4.1 SELECT模型的基本原理
假定cij为li体长的金线鱼被网目尺寸为mj的刺网捕获的数量,则:
$$ c_{i j}=q_i x_i \lambda_i S_{i j} $$ (1) 这里λi为li体长的金线鱼接触网具的数量;Sij为网目尺寸为mj的刺网对li体长的金线鱼的选择性;qi为渔具系数;xi为捕捞努力量。将pi定义为相对作业强度,而pi=qixi,式(1)表示为:
$$ c_{i j}=p_i x_i \lambda_i S_{i j} $$ (2) 其中$\sum\limits_{i=1}^k p_i=1$,k为所用网目总数。
根据几何相似假设,网目尺寸为mj的刺网对体长为li的金线鱼的选择性可表示如下:
$$ S_{i j}=s\left(l_{i j}\right) $$ (3) 将式(3)代入式(2)得:
$$ c_{i j}=p_i \lambda s\left(l_{i j}\right) $$ (4) 该研究用分别用Normal、Gama和Bi-normal模型计算刺网对金线鱼的选择率s(lij),计算公式分别为:
$$ \text { Normal: } s\left(l_{i j}\right)=\exp \left[-\frac{\left(l_{i j}-k \cdot m_j\right)^2}{2 \sigma^2}\right] $$ (5) 式中待估参数为k和σ。
$$ \begin{aligned} & \;\;\;\text { Gama: } s\left(l_{i j}\right)=\left(\frac{l_{i j}}{(\alpha-1) \cdot k \cdot m_j}\right)^{\alpha-1} \exp (\alpha-1- \\ & \left.\frac{l_{i j}}{k \cdot m_j}\right) \end{aligned} $$ (6) 式中待估参数为α和k。
$$ \begin{aligned} & \;\;\;\text { Bi-normal: } s\left(l_{i j}\right)=\exp \left[-\frac{\left(l_{i j}-k_1 \cdot m_j\right)^2}{2 k_2^2 \cdot m_j^2}\right]+ \\ & \operatorname{cexp}\left[-\frac{\left(l_{i j}-k_3 \cdot m_j\right)^2}{2 k_4^2 \cdot m_i^2}\right] \end{aligned} $$ (7) 式中待估参数为k1, k2, k3, k4和c。
假设Cj为li体长的金线鱼被刺网捕获的总数,则:
$$ C_j=\sum\limits_{i=1}^k c_{i j} $$ (8) li体长的金线鱼被各网目尺寸c1j, ..., ckj捕获的概率可以用多项分布描述如下:
$$ P_j=\frac{C_{j}!}{\prod\limits_{i=1}^k c_{i j}!} \prod\limits_{i=1}^k \varphi_{i j}^{c_{i j}} $$ (9) 这里φij为li体长的金线鱼被网目尺寸为mj的刺网捕获的概率,其计算方程如下:
$$ \varphi_{i j}=c_{i j} / C_j=c_{i j} / \sum\limits_{i=1}^k c_{i j} $$ (10) 将式(9)应用于式(8)得到总的渔获概率为:
$$ P=\prod\limits_{j=1}^n P_j=\prod\limits_{j=1}^n\left(\frac{C_{j}!}{\prod\limits_{i=1}^n c_{i j}!} \prod\limits_{i=1}^k \varphi_{i j}^{c_{i j}}\right) $$ (11) 这里n为体长组的数量。将式(4)代入式(9),可得模型估计的渔获概率为:
$$ \begin{aligned} & \;\;\;\varphi\left(l_{i j}\right)=p_i \lambda_i s\left(l_{i j}\right) / \sum\limits_{i=1}^k p_i \lambda_j s\left(l_{i j}\right)=p_i s\left(l_{i j}\right) / \sum\limits_{i=1}^k p_i \\ & s\left(l_{i j}\right) \end{aligned} $$ (12) 选择性参数和相对作业强度pi可以通过极大似然法进行估算,其似然方程如下:
$$ L=\prod\limits_{j=1}^n\left\{\frac{C_{j}!}{\prod\limits_{i=1}^k c_{i j}!} \prod\limits_{i=1}^k\left[p_i s\left(l_{i j}\right) / \sum\limits_{i=1}^k p_i s\left(l_{i j}\right)\right]^{c_{i j}}\right\} $$ (13) 在实际计算中,需要最大化对数似然函数,将常数项去除简化如下:
$$ \log _{\mathrm{e}} L=\sum\limits_{j=1}^n \sum\limits_{i=1}^k\left[c_{i j}\left(p_i s\left(l_{i j}\right) / \sum\limits_{i=1}^k p_i s\left(l_{i j}\right)\right)\right] $$ (14) 根据pi建立2个模型:1)等分隔模型(the equal split model)。假设所有刺网对康氏马鲛的捕捞概率相同,pi用各网目尺寸的实际捕捞努力量(实验中的网片数量)代替;2)估计分隔模型(the estimated split model)。pi由模型估计而得。
式(14)的求解用Excel 2010中的“规划求解”功能来实现[11, 19-20]。
1.4.2 模型优劣的判定
用赤池信息指数(Akaike′s Information Criterion,AIC)判断各模型的拟合度优劣,AIC的计算公式为:
$$ \mathrm{AIC}=-2 \mathrm{MLL}+2(K-1) $$ (15) 式中MLL为模型的最大对数尤度,K为待估参数的数量[21]。
2. 结果
2.1 渔获概况
试验共捕获目标种类金线鱼185尾,31.253 kg。40 mm刺网捕获金线鱼36尾(占19.46%),45 mm刺网捕获金线鱼14尾(占7.57%),50 mm刺网捕获金线鱼12尾(占6.49%),55 mm刺网捕获金线鱼57尾(占36.22%),60 mm刺网捕获金线鱼56尾(占30.27%)。金线鱼的体长分布见图 1。总体上,金线鱼体长分布呈先增大后减小的单峰分布趋势, 40 mm刺网捕捞的金线鱼众数体长组为171~180 mm,45 mm、50 mm刺网捕获的金线鱼众数体长组为191~200 mm,55 mm、60 mm刺网捕获的金线鱼众数体长组为201~210 mm(图 1)。
2.2 选择性参数
Normal、Gama和Bi-normal模型估算的最大对数尤度值(MLL)、参数个数和AIC值见表 2。用等分隔模型估算的MLL绝对值比估计分隔模型的大;估计分隔模型的待参数个数比等分隔模型的多。同一种模型中,估计分隔模型的AIC值均小于等分隔模型。在所有模型中,Gama的估计分隔模型AIC值最小(466.55),将其作为最佳拟合模型(以下简称最佳模型)。
表 2 根据估算AIC值判断各模型的拟合度优劣Table 2. Model selection based on AIC value for each model模型model 等分隔equal split model 估计分隔estimated split model MLL 参数个数number of parameters AIC MLL 参数个数number of parameters AIC normal -270.61 2 543.21 -227.39 7 466.79 Gama -276.14 2 554.29 -227.28 7 466.55a Bi-normal -272.37 5 552.74 -226.86 10 471.71 注:MLL. 模型的最大对数尤度值;a. AIC最小值
Note:MLL. maximum logarithmic value; a. minimum AIC value最佳模型估算的各项参数值及其标准差见表 3。模型残差值小于其自由度(P>0.05),表明模型不存在拟合度缺失。刺网对金线鱼的相对作业强度(Pi)大小顺序依次为40 mm>60 mm>55 mm>45 mm>50 mm。最佳模型估算的相对作业强度与实际捕捞努力量(网片数量)的比较见图 2。40 mm、45 mm和50 mm刺网的相对作业强度与捕捞努力量差异较大。50 mm刺网的相对作业强度最小。各网目尺寸刺网拟合的残差值分布见图 3。40 mm、45 mm、50 mm、55 mm和60 mm刺网对金线鱼的众数体长理论值分别为146.27 mm、164.55 mm、182.84 mm、201.12 mm和219.40 mm。最佳模型拟合的选择性曲线见图 4。
表 3 最佳模型的参数估算值Table 3. Estimated parameters for the best fit model参数
parameter估计值
estimated value标准差
standard errora 53.57 2.562 2 k 0.07 0.001 5 p1 0.48 0.134 4 p2 0.07 0.009 0 p3 0.04 0.002 3 p4 0.20 0.046 0 p5 0.21 0.095 4 模型残差Model deviance 32.62 自由度df 38 P 0.72 注:p1、p2、p3、p4和p5分别代表网目尺寸为40 mm、45 mm、50 mm、55 mm和60mm的刺网对金线鱼的相对作业强度
Note:p1,p2,p3,p4 and p5 indicate relative operating intensities with gillnets of 40 mm,45 mm,50 mm and 60 mm.2.3 最小网目尺寸的探讨
根据相关报道[22],该研究将南海金线鱼的开捕规格(minimum landing size,MLS)定为150 mm。结合最佳模型选择性曲线,40 mm、45 mm、50 mm、55 mm和60 mm刺网对150 mm金线鱼的选择率分别为98.39%、80.94%、39.30%、13.70%和3.87%(图 4)。与50 mm刺网相比,55 mm刺网对150 mm金线鱼的选择率减少了25.6%。因此,该研究认为将金线鱼刺网最小网目尺寸定为55 mm,更加有利于保护渔业资源。
3. 讨论
南海金线鱼流刺网属漂流单片刺网,渔具主尺度为36.97 m×4.80 m,主要渔获种类有金线鱼、带鱼(Trichiurus haumela)、长尾大眼鲷(Priacanthus tayenus)等。笔者参考该金线鱼流刺网的主尺度,制作了5组网目尺寸刺网共47片,进行了选择性试验。虽然各网目尺寸刺网的网片数量并不完全一致,但用SELECT模型进行拟合,估算出了刺网对金线鱼的选择性参数。由此可见,SELECT模型在刺网选择性参数估算中有重要作用。目前,在最佳选择性模型的判定中存在2种方法:1)比较模型残差值,最小者为最佳[11, 15];2)比较AIC的大小,最小者为最佳[21]。由于模型间的估算参数数量不相同,即模型间的自由度存在差异,所以用AIC值作为评价和选择最佳拟合模型的标准更为合理。因为AIC值的计算公式包括了模型待估参数的个数。
南海金线鱼作业方式除流刺网外,还包括底拖网[1]。杨吝等[23]分析了拖网方目网囊对南海金线鱼的选择性,根据其研究结果,金线鱼50%选择叉长(L0.5)与方目网囊网目尺寸(m)存在如下关系:L0.5=21.85+1.68m (R=0.999 7)。将当时金线鱼的开捕规格120 mm(叉长)作为L0.5,可计算得方目网囊网目尺寸为58.42 mm。该网目尺寸比此研究建议的刺网最小网目尺寸55 mm略大。首先,拖网与刺网的捕捞原理有本质的区别。拖网是主动型渔具,遭遇网具的鱼类会本能产生逃逸行为,直至疲惫而被网囊捕获[24]。当金线鱼需要从拖网网囊的网目中逃逸时,逃逸能力已大为减弱。刺网是被动型渔具,以网目刺挂或网衣缠络进行作业[25]。当鱼体一旦发现刺网的存在,则会竭尽全力进行逃逸。拖网在作业过程中,由于渔船拖曳和水体的作用,即使是方目网囊也会产生一定的变形。另外,在金线鱼的可捕规格上,他们用的是120 mm叉长(广东省旧标准);该研究则参考陈丕茂[22]的金线鱼开捕规格,为150 mm体长。两者存在一定的差异。
张鹏等[5]通过分析渔获物的多样性指数、相似性指数和ABC曲线(abundance biomass comparison curve),认为当金线鱼刺网网目尺寸小于50 mm时对渔获生物群落的干扰较大。另外,农业部2014年发布的渔具管理通告中规定南海区流刺网最小网目尺寸也是50 mm。该研究在SELECT模型的架构下,重点分析刺网网目尺寸对金线鱼的选择率。根据各刺网对150 mm(MLS)金线鱼的选择率,该研究认为将50 mm作为南海金线鱼刺网的最小网目尺寸是不够的。因为网目尺寸为50 mm的刺网对体长为150 mm的金线鱼选择率高达39.30%,这意味着很大比例体长<150 mm的金线鱼会被捕获,对金线鱼补充群体的损伤较大。当网目尺寸为55 mm时,刺网对体长为150 mm的金线鱼选择率为13.70%。虽然60 mm的刺网对体长为150 mm的金线鱼选择率更低,但考虑到网目尺寸过大可能会造成其他种类渔获量的下降,损害渔民的经济利益。因此,该研究建议将南海金线鱼流刺网最小网目尺寸暂定为55 mm。该研究仅从刺网对目标种类金线鱼的选择性进行分析和探讨,建议今后进行选择性的后续研究时,将南海金线鱼刺网对其副渔获种类的选择性作深入分析,为更科学、更合理地制定最小网目尺寸提供参考。
-
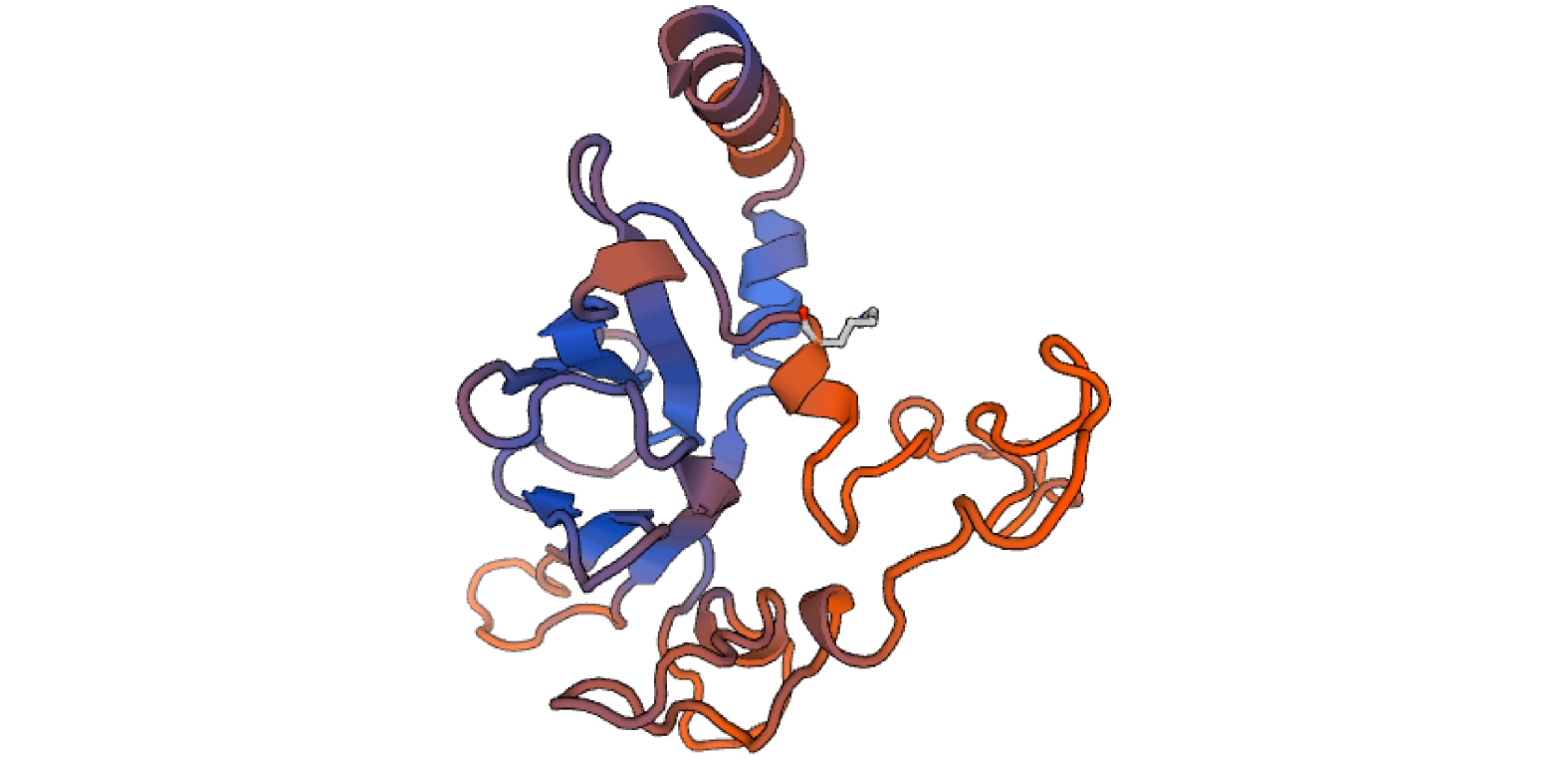
图 1 PfHSP22 cDNA及编码氨基酸序列
起始密码子(ATG)和终止密码子(TAA)序列字体加粗显示;灰色背景序列表示sHSP结构域;图形框表示磷酸化位点;圆形框表示糖基化位点
Figure 1. Predicted amino acid and nucleotide sequence of PfHSP22 cDNA
The sequences of start codon (ATG) and stop codon (TAA) are in bold; the sequences in grey represent the sHSP domain; the hosphorylation sites are framed by box; the glycosylation site is surrounded by a circle.
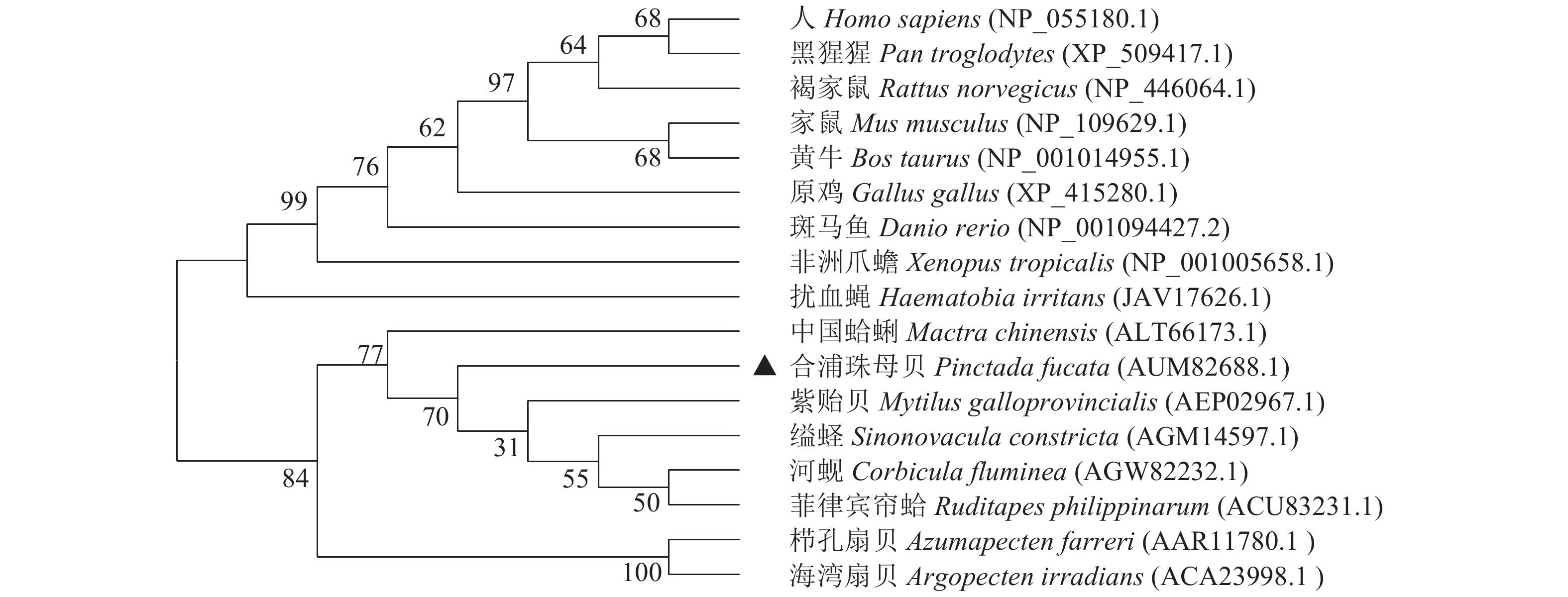
图 4 基于NJ法构建的HSP22家族成员进化树
分支旁边的数值表示在bootstrap测验中相关分类群聚成一支的复制树的百分比(1 000次重复)
Figure 4. A phylogenetic tree of HSP22 family members constructed with neighbor-joining method in MEGA software
The percentage of replicate trees in which the associated taxa clustered together in the bootstrap test (1 000 replicates) are shown next to the branches.
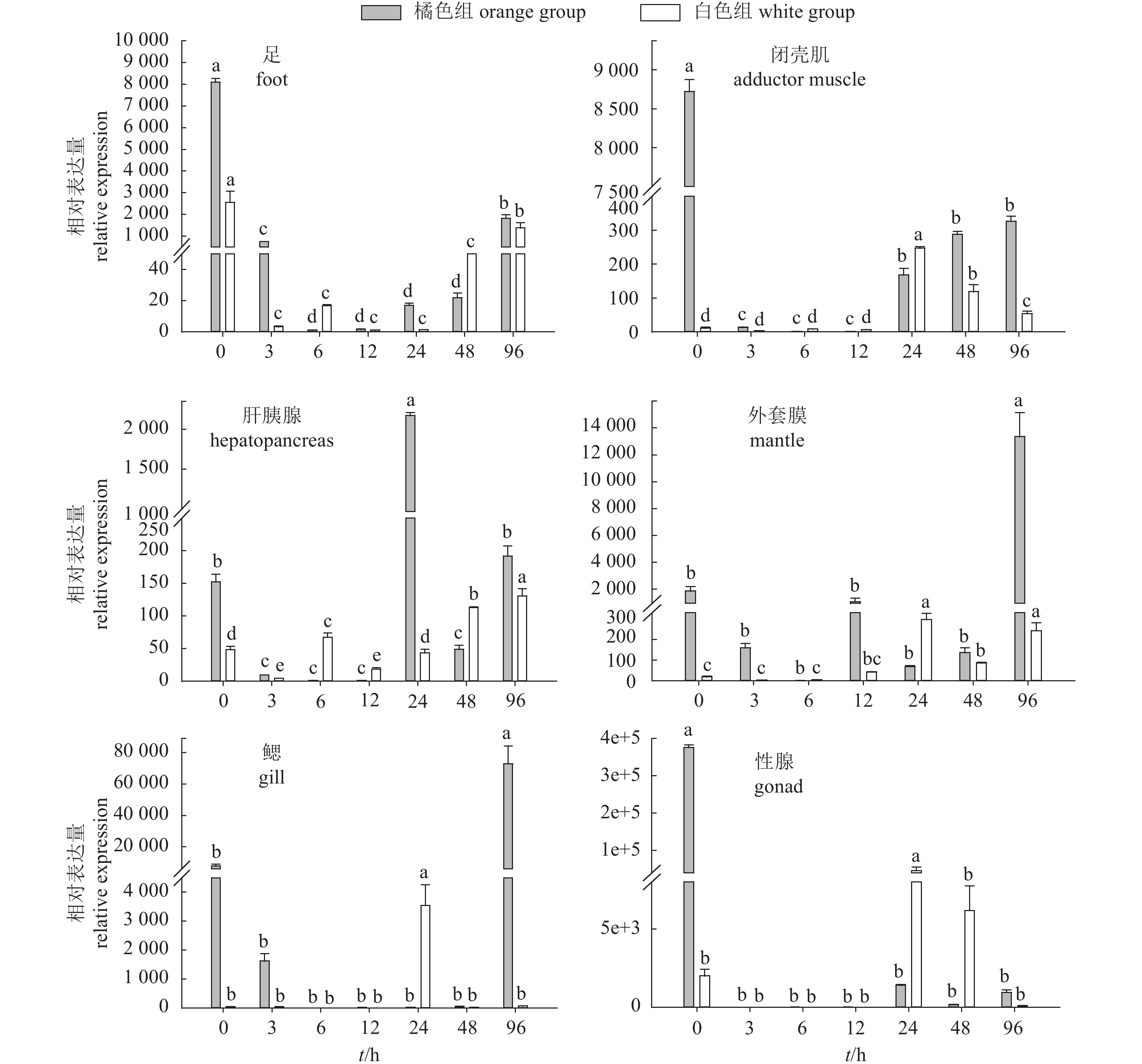
图 6 高温胁迫下橘色组和白色组各组织PfHSP22 mRNA在不同时间的表达比较
相同颜色组内不同小写字母表示不同时间的PfHSP22 mRNA表达量差异显著(P<0.05)
Figure 6. Comparison of PfHSP22 mRNA expression in different tissues of orange group and white group at different time under high temperature stress
Different lowercase letters in the same color group indicate significant difference in the expression of PfHSP22 mRNA at different time (P<0.05).
表 1 合浦珠母贝HSP22基因氨基酸序列与其他物种HSP22的比较
Table 1 Comparison of amino acid sequence of HSP22 gene of P.fucata with other species
物种 species 一致性/% identity 相似性/% similarity 序列登录号 accession No. 缢蛏 Sinonovacula constricta 43 54 AGM14597.1 菲律宾帘蛤 Ruditapes philippinarum 44 53 ACU83231.1 紫贻贝 Mytilus galloprovincialis 39 51 AEP02967.1 人 Homo sapiens 22 38 NP_055180.1 黑猩猩 Pan troglodytes 22 38 XP_509417.1 家鼠 Mus musculus 23 37 NP_109629.1 原鸡 Gallus gallus 22 37 XP_415280.1 褐家鼠 Rattus norvegicus 23 37 NP_446064.1 黄牛 Bos taurus 23 37 NP_001014955.1 致倦库蚊 Culex quinquefasciatus 25 35 EDS45823.1 栉孔扇贝 Azumapecten farreri 18 35 AAR11780.1 海湾扇贝 Argopecten irradians 20 35 ACA23998.1 斑马鱼 Danio rerio 25 34 NP_001094427.2 中国蛤蜊 Mactra chinensis 22 31 ALT66173.1 非洲爪蟾 Xenopus tropicalis 21 31 NP_001005658.1 扰血蝇 Haematobia irritans 16 31 JAV17626.1 果蝇 Drosophila melanogaster 19 30 NP_001027115.1 河蚬 Corbicula fluminea 22 28 AGW82232.1 -
[1] 邓陈茂, 童银洪, 符韶. 马氏珠母贝的研究进展[J]. 现代农业科技, 2009, 2(2): 204-206, 210. [2] 姜娓娓. 扇贝和皱纹盘鲍对温度变化的生理响应研究[D]. 北京: 中国科学院大学, 2017: 25-41. [3] MENG Z, ZHANG B, LIU B, et al. High carotenoids content can enhance resistance of selected Pinctada fucata families to high temperature stress[J]. Fish Shellfish Immunol, 2017, 61(1): 211-218.
[4] WANG Y J, LI L S, LI Q Z, et al. Research progress on eco-physiological response of shellfish under ocean acidification and global warming[J]. Acta Ecologica Sinica, 2014, 34(13): 3499-3508.
[5] 陈明帅, 徐超, 宋兴超, 等. 热休克蛋白的研究进展[J]. 经济动物学报, 2016, 20(1): 44-53. [6] 李艳, 张国强, 邵东燕, 等. 小分子热休克蛋白的结构与功能[J]. 生命科学, 2017, 29(1): 55-61. [7] MARTÍN-FOLGAR R, de la FUENTE M, MORCILLO G, et al. Characterization of six small HSP genes from Chironomus riparius (Diptera, Chironomidae): differential expression under conditions of normal growth and heat-induced stress[J]. Comp Biochem Physiol A, 2015, 188(1): 76-86.
[8] 陈琦, 程晓曙. 热休克蛋白22研究进展[J]. 国际病理科学与临床杂志, 2006, 26(3): 235-237, 242. [9] ACUNZO J, KATSOGIANNOU M, ROCCHI P. Small heat shock proteins HSP27 (HspB1), αB-crystallin (HspB5) and HSP22 (HspB8) as regulators of cell death[J]. Int J Biochem Cell Biol, 2012, 44(10): 1622-1631.
[10] KIM H J, MORROW G, WESTWOOD J T, et al. Gene expression profiling implicates OXPHOS complexes in lifespan extension of flies over-expressing a small mitochondrial chaperone, Hsp22[J]. Exp Gerontol, 2010, 45(7/8): 611-620.
[11] MORROW G, KIM H J, PELLERITO O, et al. Changes in Drosophila mitochondrial proteins following chaperone-mediated lifespan extension confirm a role of Hsp22 in mitochondrial UPR and reveal a mitochondrial localization for cathepsin D[J]. Mech Ageing Dev, 2016, 155(1): 36-47.
[12] 杨官品, 张蕾, 董超华. 热休克蛋白22结构和功能研究进展[J]. 中国海洋大学学报(自然科学版), 2009, 39(5): 965-970. [13] ZHANG L, WANG L, SONG L, et al. The involvement of HSP22 from bay scallop Argopecten irradians in response to heavy metal stress[J]. Mol Biol Rep, 2010, 37(4): 1763-1771.
[14] 张蕾. 栉孔扇贝、海湾扇贝热休克蛋白22基因的克隆和表达及其与栉孔扇贝抗热性状相关SNP位点的筛查[D]. 青岛: 中国海洋大学, 2009: 39-47. [15] LEI Q N, WU Y Y, LIANG H Y, et al. Molecular cloning and expression analysis of heat shock protein 20 (HSP20) from the pearl oyster Pinctada martensii[J]. Genet Mol Res, 2016, 15(2): 15028799.
[16] LI J, ZHANG Y, LIU Y, et al. Co-expression of heat shock protein (HSP) 40 and HSP70 in Pinctada martensii response to thermal, low salinity and bacterial challenges[J]. Fish Shellfish Immunol, 2016, 48(1): 239-243.
[17] 王志新, 梁海鹰, 杜晓东, 等. 马氏珠母贝热休克蛋白HSP60基因的克隆与表达分析[J]. 广东海洋大学学报, 2013, 33(6): 14-23. [18] 黄桂菊, 曲妮妮, 喻达辉, 等. 合浦珠母贝热休克蛋白hsp70基因的克隆与表达分析[J]. 中国水产科学, 2007, 14(5): 726-732. [19] WANG Z, WU Z, JIAN J, et al. Cloning and expression of heat shock protein 70 gene in the haemocytes of pearl oyster (Pinctada fucata, Gould 1850) responding to bacterial challenge[J]. Fish Shellfish Immunol, 2009, 26(4): 639-645.
[20] 杜俊俏, 廖承红, 周海龙, 等. 马氏珠母贝hsp90基因的克隆及芘胁迫对其表达水平的影响[J]. 生态毒理学报, 2014, 9(3): 503-511. [21] LIANG H Y, WANG Z X, LEI Q N, et al. Molecular cloning and expression analysis of a pearl oyster (Pinctada martensii) heat shock protein 90 (HSP90)[J]. Genet Mol Res, 2015, 14(4): 18778-18791.
[22] 靳青, 毕宇霖, 刘晓牧, 等. 类胡萝卜素代谢及功能研究进展[J]. 动物营养学报, 2014, 26(12): 3561-3571. [23] LEI C, HAO R J, ZHENG Z, et al. Molecular cloning and characterisation of scavenger receptor class B in pearl oyster Pinctada fuctada martensii[J]. Electron J Biotechnol, 2017, 30(1): 12-17.
[24] HAN J, LU Y, ZHENG H, et al. Differential expression of CuZnSOD gene under low temperature stress in noble scallop Chlamys nobilis with different carotenoid content[J]. Fish Shellfish Immunol, 2016, 54(1): 30-39.
[25] ZHANG H, CHENG D, LIU H, et al. Differential responses of a thioredoxin-like protein gene to Vibrio parahaemolyticus challenge in the noble scallop Chlamys nobilis with different total carotenoids content[J]. Fish Shellfish Immunol, 2018, 72: 377-382.
[26] LU Y, ZHENG H, ZHANG H, et al. Cloning and differential expression of a novel toll-like receptor gene in noble scallop Chlamys nobilis with different total carotenoid content[J]. Fish Shellfish Immunol, 2016, 56(1): 229-238.
[27] 孟子豪. 类胡萝卜素含量和SCD基因表达水平对合浦珠母贝高温适应性的影响[D]. 上海: 上海海洋大学, 2017: 8-61. [28] LI H, WANG D, DENG Z, et al. Molecular characterization and expression analysis of chitinase from the pearl oyster Pinctada fucata[J]. Comp Biochem Physiol B, 2017, 203(1): 141-148.
[29] 王德清, 李海梅, 黄桂菊, 等. 合浦珠母贝章鱼胺受体(OAR)基因的克隆与表达分析[J]. 南方水产科学, 2017, 13(1): 58-65. [30] KUMAR S, STECHER G, TAMURA K. MEGA7: Molecular Evolutionary Genetics Analysis version 7.0 for bigger datasets[J]. Mol Biol Evol, 2016, 33(7): 1870-1874.
[31] ZHU W, FAN S, HUANG G, et al. Highly expressed EGFR in pearl sac may facilitate the pearl formation in the pearl oyster, Pinctada fucata[J]. Gene, 2015, 566(2): 201-211.
[32] 周代志, 黄桂菊, 刘宝锁, 等. 合浦珠母贝骨形态发生蛋白10(BMP10)基因的克隆与表达分析[J]. 南方水产科学, 2016, 12(6): 83-90. [33] BAKTHISARAN R, TANGIRALA R, RAO C M. Small heat shock proteins: role in cellular functions and pathology[J]. Biochim Biophys Acta, 2015, 1854(4): 291-319.
[34] MATSUSHIMA-NISHIWAKI R, TOYODA H, TAKAMATSU R A, et al. Heat shock protein 22 (HSPB8) reduces the migration of hepatocellular carcinoma cells through the suppression of the phosphoinositide 3-kinase (PI3K)/AKT pathway[J]. Biochimica et Biophysica Acta, 2017, 1863(6): 1629-1639.
[35] CHOWDARY T K, RAMAN B, RAMAKRISHNA T, et al. Mammalian Hsp22 is a heat-inducible small heat-shock protein with chaperone-like activity[J]. Biochem J, 2004, 381(Pt 2): 379-387.
[36] MARTÍN-FOLGAR R, MARTÍNEZ-GUITARTE J L. Cadmium alters the expression of small heat shock protein genes in the aquatic midge Chironomus riparius[J]. Chemosphere, 2017, 169(1): 485-492.
[37] RAUCH J N, TSE E, FREILICH R, et al. BAG3 is a modular, scaffolding protein that physically links heat shock protein 70 (Hsp70) to the small heat shock proteins[J]. J Mol Biol, 2017, 429(1): 128-141.
[38] 李宁. 虾夷扇贝橘红色闭壳肌产生的原因及其在育种中的应用[D]. 青岛: 中国海洋大学, 2009: 2-8. [39] 任晓亮, 侯睿, 王珊, 等. 控制虾夷扇贝闭壳肌积累类胡萝卜素相关基因的筛查[J]. 中国海洋大学学报(自然科学版), 2012, 42(9): 41-47. [40] 雷超, 郑哲, 李俊辉, 等. 马氏珠母贝细胞内视黄酸结合蛋白表达及其与类胡萝卜素的相关性分析[J]. 南方农业学报, 2017, 48(6): 1086-1092. -
期刊类型引用(9)
1. 杨炳忠,晏磊,李杰,王腾,张鹏. 南海区单船有袖单囊拖网网囊网目对金线鱼的选择性研究. 南方水产科学. 2024(03): 1-7 .  本站查看
本站查看
2. 张力友,刘淑德,董秀强,于梦杰,唐衍力. 人工鱼礁区不同网目尺寸单片刺网对许氏平鲉和大泷六线鱼的选择性. 中国水产科学. 2022(10): 1519-1528 .  百度学术
百度学术
3. 杨炳忠,杨吝,谭永光,晏磊,张鹏,李杰. 基于裤式拖网法的虾拖网网囊网目选择性试验与分析. 中国海洋大学学报(自然科学版). 2020(04): 36-44 .  百度学术
百度学术
4. 潘梦珍,王海山,叶乐,陈治,杨超杰. 崖州湾附近海域金线鱼形态学指标的相关性. 海南热带海洋学院学报. 2020(02): 11-17 .  百度学术
百度学术
5. 彭露,徐姗楠,蔡研聪,许友伟,孙铭帅,陈作志,张魁,粟丽. 北部湾金线鱼的数量分布及变化趋势. 海洋湖沼通报. 2020(04): 120-126 .  百度学术
百度学术
6. 杨炳忠,杨吝,谭永光,晏磊,张鹏,李杰. 南海区虾拖网网囊对刀额新对虾的选择性研究. 南方水产科学. 2019(02): 1-11 .  本站查看
本站查看
7. 杨超杰,唐婷婷,吴东霞,杜良玉,方馨正. 崖州湾附近海域金线鱼繁殖生物学研究. 海南热带海洋学院学报. 2019(05): 6-11 .  百度学术
百度学术
8. 庄海旗,刘江琴,崔燎,罗辉. 南海海域8种金线鱼肌肉的脂肪酸分析. 现代食品科技. 2018(03): 218-225 .  百度学术
百度学术
9. 彭露,江艳娥,徐姗楠,陈作志. 南海北部陆架区金线鱼矢耳石形态及其与体长、体质量关系. 南方水产科学. 2018(06): 27-33 .  本站查看
本站查看
其他类型引用(0)



 下载:
下载:






 粤公网安备 44010502001741号
粤公网安备 44010502001741号
