Cloning and expression profiling of gsdf and amh genes in large yellow croaker (Larimichthys crocea)
-
摘要:
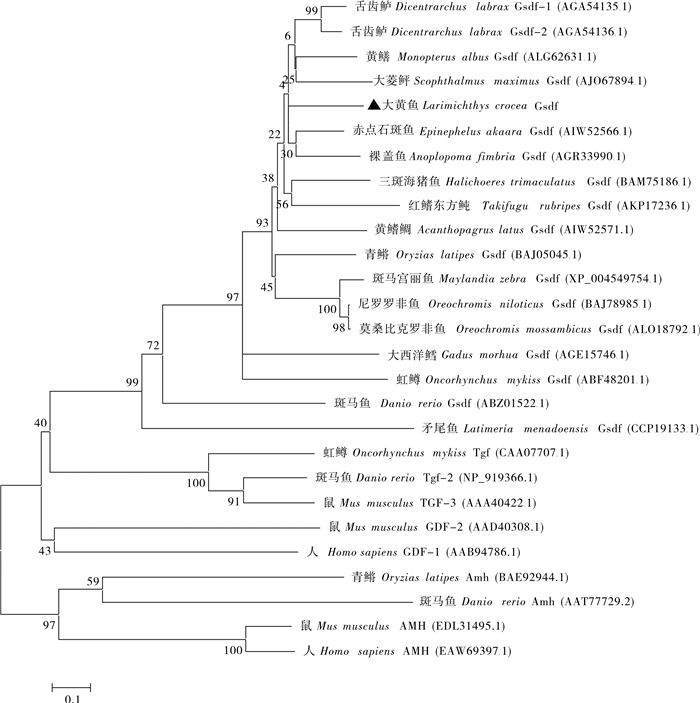
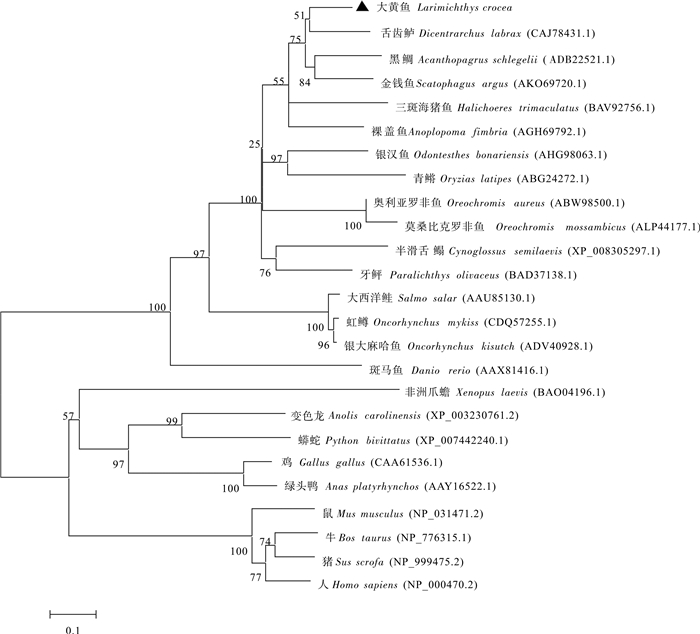
该研究克隆了大黄鱼(Larimichthys crocea)gsdf (gonadal soma derived factor)和amh (anti-Müllerian hormone)基因的开放阅读框序列并对它们的表达进行分析。大黄鱼gsdf基因cDNA序列开放阅读框长为618 bp,可编码205个氨基酸,含有信号肽和TGF-β结构域。系统进化分析显示,大黄鱼Gsdf与其他鱼类Gsdf聚为一枝,而与TGF-β超家族其他成员分开。Amh基因cDNA序列开放阅读框为1 563 bp,可编码520个氨基酸,含有信号肽、AMH-N区域和TGF-β保守结构域。系统进化分析显示,大黄鱼Amh与舌齿鲈(Dicentrarchus labrax)Amh进化关系最近。荧光定量PCR表达分析显示,gsdf和amh基因主要在大黄鱼性腺表达,在精巢中的表达量显著高于卵巢(P < 0.05),2个基因都在性腺分化前开始表达,在雄鱼精巢中表达量呈现先升高后下降的趋势,在卵巢的表达量很低。此外,相比于正常雌鱼,gsdf和amh基因在伪雄鱼(遗传性雌鱼)性腺中的表达量显著上调。这些结果表明,gsdf和amh基因在大黄鱼性腺分化过程中起到重要的作用。
Abstract:In this study, the gonadal soma derived factor (gsdf) and anti-Müllerian hormone (amh) were cloned from Larimichthys crocea, and their expression patterns were analysed by qRT-PCR. The results shows that the open reading frame (ORF) of gsdf gene spaned a region of 618 bp and coded 205 amino acids with a signal peptide and a conserved domain of the TGF-β superfamily. Sequence alignment analysis reveals that the gsdf of L.crocea and Dicentrarchus labrax shared the highest homology. Phylogenetic analysis shows that the fish Gsdf proteins had a clade separated from the rest members of the TGF-β superfamily. The ORF of amh gene spaned a region of 1 563 bp and coded 520 amino acids that contained a signal peptide, an AMH-N domain and a TGF-β conserved domain. Phylogenetic analysis shows that Amh proteins of L.crocea and D.labrax had the nearest relationship. The qPCR analysis reveals that gsdf and amh genes were expressed mainly in gonad, and the expression levels in testis were significantly higher than that in ovary (P < 0.05). Before the gonad differentiation, gsdf and amh genes had already expressed, and the expression levels of two genes showed an increase-decrease trend in testis whereas the expression levels were very low in ovaries. Besides, compared with normal females, the expressions of two genes had more significant expression in gonad of pseudo-males (genetic females). It is indicated that gsdf and amh genes play a very important role in the process of L.crocea gonad differentiation.
-
鳞片是由鱼类皮肤原始干细胞定向分化产生[1],是鱼体与外界接触的边缘组织。其基本功能除减少游泳产生的摩擦力、维持体型骨架之外,还起到保护鱼体免遭病原损害的作用。同时,鳞片的形态结构也是研究鱼类分类学特征、资源分布、栖息环境以及生长规律的重要依据[2]。根据鳞片的外形、构造和发生特点,可将鳞片划分为3种基本类型:盾鳞、硬鳞和骨鳞。骨鳞是最常见的一种鳞片,为真骨鱼类所有,呈覆瓦状排列。根据鳞片露出部的表面边缘的构造不同可将骨鳞分为两类:圆鳞和栉鳞。
条石鲷(Oplegnathus fasciatus)隶属于辐鳍鱼纲、鲈形目、鲈亚目、石鲷科、石鲷属,自然分布范围在东海、黄海、台湾海峡和太平洋[3]。俗称日本鹦鹉鱼,栖息于温热带近海碎石、岩礁或珊瑚礁底质的底层水域。条石鲷形态优美,色泽艳丽,肉质细嫩,营养价值高,是一种极具养殖前景和观赏价值的海产名贵鱼类[4]。近年来对条石鲷的早期发育已有许多研究[5-9],但关于鳞片的形成在中国未见有报道,同时由于南北方水域环境的差异,鳞片的发育在时间和速度上也可能会存在一些差异。该文采用茜素红染色法初步分析了条石鲷鳞片最初出现的时间和位置,以及鳞片形成的时间及各个发育阶段的特点,旨在丰富条石鲷早期发育的生物学文库,同时通过对鳞片发育过程的观察,判断鱼类种苗的培育效果,及时调整种苗生产管理措施。
1. 材料与方法
1.1 材料
观察样本为采自广东省饶平县中国水产科学研究院南海水产研究所海水鱼类试验基地人工孵化和培育的0~40日龄的条石鲷仔稚鱼。
1.2 方法
将人工催产的受精卵置于容积为0.5 m3的玻璃纤维孵化桶内进行孵化,连续充气,仔鱼孵出后在面积为1/15~2/15 hm2,水深为1.5~2 m的池塘内进行人工育苗,育苗期间水温为24~27 ℃(其中前期培育水温为22~23 ℃,后期为24~27 ℃),盐度29~30,pH 7.4~8.2。
实验方法采用茜素红染色法[10]。从2008年5月2日到6月11日育苗期间每天用手抄网随机采集10~20尾样本,用5%甲醛溶液保存,将要观察鳞片的鱼苗样本放入清水中浸泡3 h,然后放入2%茜素红溶液中染色,染色后的样本用滤纸吸干体表水分,在体视显微镜下观察鳞片出现的部位及其分布情况、鳞片上的鳞嵴数、鳞焦的中心以及水平鳞列数。用解剖针小心将鱼体的鳞片掀起,用解剖刀轻轻刮下,在显微镜下观察、拍照。
1.3 实验数据处理
采用SPSS 18.0软件,对鳞嵴数与发育阶段的相关关系分别用直线方程、幂函数方程以及二次方程进行拟合,对相关系数做显著性检验,依最小剩余平方和来确定最适回归方程。
2. 结果
2.1 早期鳞被的形成
2.1.1 条石鲷鳞片起始中心及鳞被形成
条石鲷鳞片最初出现的部位在鳃盖后缘至胸鳍基部、胸鳍后缘的侧线上方和尾柄处,共有3个鳞被起始中心。鳃盖后缘至胸鳍基部的鳞被向上下前后扩展,胸鳍后缘的侧线上方鳞被向下和向前后扩展,尾柄处的鳞被前后扩展,头顶部的鳞被向四周扩展,最后连成一片,鳞被覆盖全身。根据条石鲷鳞被在鱼体体表的形成过程将其划分为5个阶段(图 1)。
阶段A:鳞片未出现,全身无鳞。
阶段B:鳃盖后缘至胸鳍基部、胸鳍后缘的侧线上方和尾柄处开始出现鳞片,水平鳞列数1~2。
阶段C:鳞被向各方扩展,在侧线的上下方均出现鳞被,尾柄处的鳞被发育较快,水平鳞列数5~11。头部开始出现鳞片。
阶段D:鳞被向全身扩展,鳃盖后缘至胸鳍基部、胸鳍后缘的侧线上方和尾柄处的鳞被连成一片,并覆盖大部分鱼体。鱼体腹部出现鳞被,鳞被发育较均匀,尾柄全部覆盖鳞被,鳃盖上也出现鳞片,鳞被发育较晚。
阶段E:体表鳞被与头部鳞被连合,鳞被发育完全,鱼体全身具鳞。
2.1.2 鳞被形成特点
条石鲷鳞被向下方扩展的速度快于上方,上下扩展速度快于前后扩展,向前扩展到鳃盖后暂停,向后发育到达尾柄末端,最后出现鳞片的部位是鳃盖。同一个部位鳞被的发育速度并不完全相同。
2.1.3 条石鲷鳞被形成的体长和日龄
条石鲷仔鱼最初出现鳞片的最小个体为全长19 mm、体长15 mm,最大个体为全长26 mm、体长20 mm,为孵化后18~20日龄(表 1);鳞被发育完全时的最小个体为全长36 mm、体长29.9 mm,最大个体为全长66 mm、体长51 mm,为孵化后35~40日龄。最初出现鳞片和鳞被发育完全时个体的大小差异最大为全长47 mm、体长36 mm,22日龄。
表 1 条石鲷鳞被发育阶段与个体生长的关系(n=220)Table 1. Relationship between early developmental stage of squamation and body length and total length of O. fasciatus鳞被发育阶段
developmental stage全长/mm total length 体长/mm body length 日龄
day after hatching最大maximum 最小minimum 最大maximum 最小minimum 阶段A Stage A 22 15 18 11 15~20 阶段B Stage B 26 19 20 15 18~20 阶段C Stage C 39 26 31 20 25~32 阶段D Stage D 35 32 27 25 32~35 阶段E Stage E 66 36 51 29.9 35~40 2.2 鳞片形态结构和初生鳞的发育
2.2.1 鳞片的形态结构
条石鲷鳞片为细栉鳞,长方形,前区较平截,后区边缘和鳞嵴具细栉齿(图 2);具放射状辐射沟2~6条,向基区(前区)辐射,起始处不一致,有的始于鳞焦,有的始于中途,成鱼辐射沟界限不太清晰;鳞焦偏于后区。
2.2.2 初生鳞的发育
条石鲷初生鳞为圆形或椭圆形,表面光滑、透明,鳞嵴(环片)、栉齿、鳞焦和辐射沟等均无。鳞片在发育过程中,其外形、鳞嵴、栉齿、鳞焦和辐射沟均随个体大小和日龄而发生变化。条石鲷初生鳞的发育特征与鳞被形成阶段的关系为:
阶段A:鳞片未出现。
阶段B:鳃盖后缘初生鳞的形态为较原始的圆鳞,鳞嵴为1~3,胸鳍基部鳞嵴为4~6;侧线上方鳞片的鳞嵴为3~6,鳞片极薄易碎;尾部鳞片鳞嵴为3~6(图 3-B-a,b,c)。
![]() 图 3 条石鲷各个鳞片形成阶段的鳞片B-a. 侧线上鳞片;B-b. 尾柄鳞片;B-c. 鳃盖后缘鳞片;C-a. 侧线上鳞片;C-b. 胸鳍基鳞片;C-c. 头部鳞片;C-d. 鳃盖鳞片;C-e. 尾柄鳞片;C-f. 腹部鳞片;D-a. 侧线上鳞片;D-b. 侧线下鳞片;D-c. 胸鳍基鳞片;D-d. 头部鳞片;D-e. 鳃盖鳞片;D-f. 尾柄鳞片;E-a. 侧线上鳞片;E-b. 鳃盖鳞片;E-c. 尾柄鳞片;E-d. 胸鳍基鳞片;标尺=0.25 mmFigure 3. Scales at different developmental stages in O. fasciatusB-a. scale up lateral line; B-b. scale of caudal peduncle; B-c. scale of posterior margin of gill cover; C-a. scale up lateral line; C-b. scale of pectoral fin base; C-c. scale of head; C-d. scale of gill cover; C-e. scale of caudal peduncle; C-f. scale of ventral; D-a. scale up lateral line; D-b. scale down ateral line; D-c. scale of pectoral fin base; D-d. scale of head; D-e. scale of gill cover; D-f. scale of caudal peduncle; E-a. scale up the lateral line; E-b. scale of gill cover; E-c. scale of caudal peduncle; E-d. scale of pectoral fin base; scale=0.25 mm
图 3 条石鲷各个鳞片形成阶段的鳞片B-a. 侧线上鳞片;B-b. 尾柄鳞片;B-c. 鳃盖后缘鳞片;C-a. 侧线上鳞片;C-b. 胸鳍基鳞片;C-c. 头部鳞片;C-d. 鳃盖鳞片;C-e. 尾柄鳞片;C-f. 腹部鳞片;D-a. 侧线上鳞片;D-b. 侧线下鳞片;D-c. 胸鳍基鳞片;D-d. 头部鳞片;D-e. 鳃盖鳞片;D-f. 尾柄鳞片;E-a. 侧线上鳞片;E-b. 鳃盖鳞片;E-c. 尾柄鳞片;E-d. 胸鳍基鳞片;标尺=0.25 mmFigure 3. Scales at different developmental stages in O. fasciatusB-a. scale up lateral line; B-b. scale of caudal peduncle; B-c. scale of posterior margin of gill cover; C-a. scale up lateral line; C-b. scale of pectoral fin base; C-c. scale of head; C-d. scale of gill cover; C-e. scale of caudal peduncle; C-f. scale of ventral; D-a. scale up lateral line; D-b. scale down ateral line; D-c. scale of pectoral fin base; D-d. scale of head; D-e. scale of gill cover; D-f. scale of caudal peduncle; E-a. scale up the lateral line; E-b. scale of gill cover; E-c. scale of caudal peduncle; E-d. scale of pectoral fin base; scale=0.25 mm阶段C:圆鳞逐渐发育成栉鳞,胸鳍基鳞嵴为4~6,侧线上方鳞片的鳞嵴为2~6,侧线下方鳞片的鳞嵴为3~8,尾柄处鳞片的鳞嵴为4~7,头部鳞片鳞嵴为2~5(图 3-C-a,b,c,d,e,f)。
阶段D:侧线上方鳞片鳞嵴为2~9,侧线下方鳞片的鳞嵴为12~16,腹部鳞片鳞嵴为5~9,胸鳍基鳞片鳞嵴为3~11,尾柄部鳞嵴为4~8,头部的鳞片鳞嵴为3~6,鳃盖上的鳞片鳞嵴为3~8(图 3-D-a,b,c,d,e,f)。
阶段E:侧线上方鳞片鳞嵴为8~13,下方为11~16,尾柄处鳞嵴为13~15,胸鳍基鳞片鳞嵴为8~12,鳃盖后缘鳞片鳞嵴为15~18(图 3-E-a,b,c,d)。
条石鲷初生鳞鳞嵴(环片)数目与发育阶段的关系为条石鲷初生鳞在发育过程中,鱼体不同部位鳞嵴(环片)数目随个体大小和日龄而发生变化(图 4)。从总体趋势看,随着发育进程,鱼体不同部位鳞片的鳞嵴数逐渐增加。经统计学拟合,鳞嵴数与发育阶段的相关关系可分别用直线方程y=2.88x-2.96(n=220,R2=0.918 1)、幂函数方程y=6.802 4ln(x)-0.833 3(n=220,R2=0.827 4)以及二次方程y=0.414 3x2 +0.394 3x-0.06(n=220,R2=0.944 6)表示。式中y为鳞嵴数,x为发育阶段。统计结果显示3种方程的适合度均较高,表现出较好的拟合性,因而三者都可以较好地描述条石鲷初生鳞鳞嵴(环片)数目与发育阶段的关系,依最小剩余平方和来选择回归方程,在3种相关方程中,以二次方程的描述更为吻合。
3. 讨论
3.1 鱼类鳞片最先出现部位和起始位置数量
此研究观察显示,条石鲷具有3个鳞片起始中心。徐恭昭等[11]把鱼类的鳞片起始中心分成两大类型:1)鳞片发育只具有1个起始中心,2)具有2个或2个以上起始中心。鲷科的黑鲷(Sparus macroeephlus)[12]、真鲷(Pagrus major)[13],科的黑边石斑鱼(Epinephelus fasciatus)[14],鳗鲡科的奥克兰鳗鲡(Anguilla australis)和大鳗鲡(A.dieffenbachii)[15]等,只具有1个起始中心。具有2个或2个以上起始中心的种类,如鲻科的梭鱼(Mugil soiuy)[11]、溪鳉科的花斑溪鳉(Rivulus marmoratus)[16]、鲱科的大鳞油鲱(Brevooritia patronus)[17]有2个;齿鳉科杂色鳉(Cyprinodon variegatus variegatus)[18]、太阳鱼科的暗斑棘盖太阳鱼(Pomoxis nigromaeulatus)[19]有3个;鳢科的乌鳢(Channa agrus)[20]、底鳉科的沼泽底鳉(Fundulus confluentus)、底鳉(F.heteroclitus)等种类[18]有4个。而鲤科的齐口裂腹鱼(Schizothorax prenanti)[21]和重口裂腹鱼(S.davidi)[22]稚鱼鳞片发生起始位置有6个,以此为中心向四周扩展延伸直到覆盖全鱼体。据SIRE和ARNULF[23]报道,4种硬骨鱼类的鳞片发生起始位置有7个。从现有这些文献来看,不同鱼类物种之间鳞片发生起始点的数目及其覆盖方式存在着差异,是否与物种进化以及栖息环境具有一定的相关性尚待深入探讨。
3.2 鱼类鳞被覆盖过程
此研究显示,条石鲷稚鱼体表开始长出形态较为原始的圆鳞,而后圆鳞逐渐发育成栉鳞,其发生过程与圆鳞鱼类大致类似[24]。在鳞片开始形成的时间以及鳞片发育完全的时间,条石鲷和黑鲷等种类相似,而且鳞片发育的过程也很相近。关于鱼类鳞片最初出现的时间和位置的问题,KUBO和YASHIWARA[25]把鱼体最早出现鳞片的区域分为两大类型:1)在躯体的前部,如鲤(Cyprinus carpio)和鳟(Salmo trutta)等。草鱼(Ctenopharyngodon idella)、鲢(Hypophthalmichthys molitrix)、鳙(Aristrichthys nobilis)以及重口裂腹鱼等种类,其鳞片最早均出现在躯干前部的侧线处,鲤和草鱼的鳞片以1个起始点为中心,等速纵向和横向伸展,最后覆盖腹部中线;鳙和鲢鳞片向腹部和尾柄部扩展的速度快于向背部方向,当腹部与尾柄部基本覆盖时鳞片才从侧线上方向背部和由尾柄上部向前伸展,头后背部最后覆盖[26]。2)在鱼体后部尾柄末端的侧线上,如白刺盖太阳鱼(P. annuaris)及淡水鼓鱼(Aptodiotus grunnieus)等种类。根据PENAZ[27]、ABLE和LAMOMACA[28]的报道,许多淡水鱼类和鲆鲽鱼类的鳞片发育起始于尾柄。软骨鱼类澳大利亚虎鲨(Heterodontus portusjacksoni)和眶嵴虎鲨(H. galeatus) 的鳞片发育起始于尾鳍[29];斯氏罗非鱼(Tilapia sparrmani)的鳞片最先出现在尾柄中部,沿侧线处向前覆盖的速度快于向后,并以等速向腹部和背部方向扩展,最后覆盖头后背部[25]。从鳞片形成的整个过程来看,条石鲷早期鳞片的形成在整个鱼群中呈不同步性,鳞片出现的最初时间,鳞片发育的速度,鳞片发育完全的时间,在鱼体大小以及日龄方面均有很大变化。同样是20日龄的仔鱼有的没有一片鳞,有的已开始形成鳞片。所以笔者认为,决定鱼类鳞片发育的因素是多方面的,它并不仅受到水温或是饵料的影响,还可能受到其他一些因素的影响。这有待于以后进一步的研究。
-
图 2 大黄鱼Gsdf氨基酸序列和其他鱼类Gsdf氨基酸序列的比较
箭头代表信号肽切割位点,黑色上画线为TGF-β结构域,9个保守的半胱氨酸残基用星号表示
Figure 2. Alignment of amino acid of L.crocea gsdf with other vertebrate fishes
The arrow indicates the putative cleavage sites of the signal peptide. The TGF-β domain is labeled with black overline. The nine positions with conserved cysteines are marked by asterisks.
图 4 大黄鱼Amh氨基酸序列和其他鱼类Amh氨基酸序列的比较
箭头代表信号肽切割位点,灰色上画线为AMH-N区域,黑色上画线为TGF-β结构域,10个保守的半胱氨酸残基用星号表示
Figure 4. Alignment of amino acid of L.crocea Amh with other vertebrate fishes
The arrow indicates the putative cleavage sites of the signal peptide. The AMH-N domain and the TGF-β domain that characterized this family are labelled with gray and black overline, respectively. The ten positions with conserved cysteines are marked by asterisks.
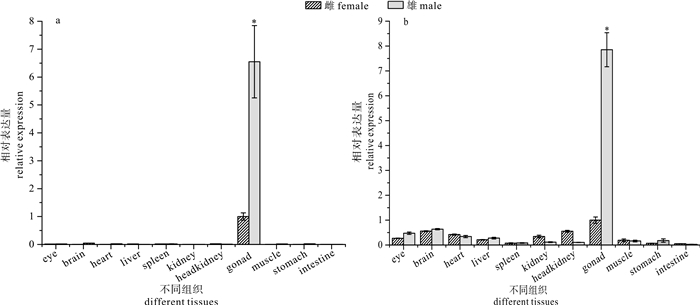
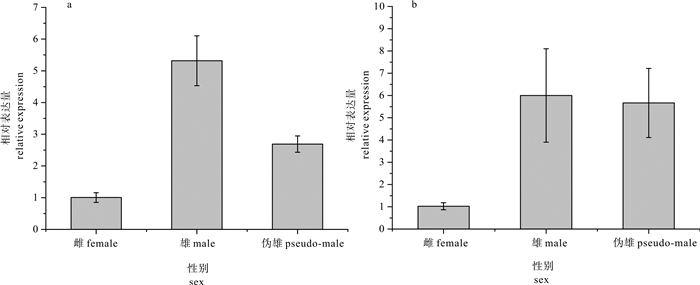
图 6 gsdf(a)和amh(b)基因在大黄鱼不同组织中的表达
eye.眼;brain.脑;heart.心脏;liver.肝;spleen.脾;kidney.肾;headkidney.头肾;gonad.性腺;muscle.肌肉;stomach.胃;intestine.肠; *表示性腺表达量差异显著(P<0.05),且标在表达量较高的一侧
Figure 6. Expressions of gsdf (a) and amh (b) genes in different L.crocea tissues
"*"indicates significant difference between gonads and appears above the higher expression (P<0.05) and was marked on the higher expression value.
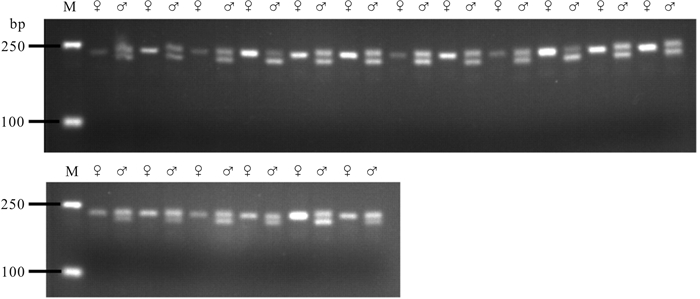
表 1 相关引物及其碱基序列
Table 1 Primers and sequences used in the study
引物名
primer name引物序列(5′-3′)
primer sequence作用
functionmark-F TGGCTCTGTGAGGCGTCT 性别鉴定 mark-R ATACAATGATGACATCAATCCTGAT gsdf-O-F ATGTCCTTTACGTTCATTGTCATG 开放阅读框扩增 gsdf-O-R TTACTCTTCGCTGGGCTGCT amh-O-F ATGTTGTCGGTGGATGTCTTCTG amh-O-R TTAGCGGCATCCGCACTC gsdf-Q-F CTGATGGTGGAAACAGTACGAGCC 荧光定量PCR gsdf-Q-R AGAGTGCACACTGAACGACAGTC amh-Q-F AGCCAACATCAACAACTGCC amh-Q-R TTCATCCAAGTCCACCACCT β-actin-F TTATGAAGGCTATGCCCTGCC β-actin内参引物 β-actin-R TGAAGGAGTAGCCACGCTCTGT 表 2 大黄鱼Gsdf氨基酸序列的同源性分析
Table 2 Homology of L.crocea Gsdf amino acid sequence with other species
物种
species基因
gene相似性/%
similarity舌齿鲈Dicentrarchus labrax gsdf1 69 赤点石斑鱼Epinephelus akaara gsdf 67 舌齿鲈Dicentrarchus labrax gsdf2 66 黄鳝Monopterus albus gsdf 63 裸盖鱼Anoplopoma fimbria gsdf 62 黄鳍棘鲷Acanthopagrus latus gsdf 61 斑马宫丽鱼Maylandia zebra gsdf 60 尼罗罗非鱼Oreochromis niloticus gsdf 60 莫桑比克罗非鱼Oreochromis mossambicus gsdf 59 大菱鲆Scophthalmus maximus gsdf 59 三斑海猪鱼Halichoeres trimaculatus gsdf 58 红鳍东方鲀Takifugu rubripes gsdf 53 青鳉Oryzias latipes gsdf 52 虹鳟Oncorhynchus mykiss gsdf 43 斑马鱼Danio rerio gsdf 33 表 3 大黄鱼Amh氨基酸序列的同源性分析
Table 3 Comparative identity of L.crocea Amh amino acid sequence with other species
物种
species相似性/%
similarity舌齿鲈Dicentrarchus labrax 76 裸盖鱼Anoplopoma fimbria 71 金钱鱼Scatophagus argus 70 奥利亚罗非鱼Oreochromis aureus 67 银汉鱼Odontesthes bonariensis 61 三斑海猪鱼Halichoeres trimaculatus 60 青鳉Oryzias latipes 53 虹鳟Oncorhynchus mykiss 49 斑马鱼Danio rerio 42 -
[1] OSPINA-ÁLVAREZ N, PIFERRER F.Temperature-dependent sex determination in fish revisited:prevalence, a single sex ratio response pattern, and possible effects of climate change[J].PLoS One, 2008, 3(7):e2837. doi: 10.1371/journal.pone.0002837
[2] SINCLAIR A H, BERTA P, PALMER M S, et al.A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif[J].Nature, 1990, 346(6281):240-244. doi: 10.1038/346240a0
[3] KOOPMAN P, GUBBAY J, VIVIAN N, et al.Male development of chromosomally female mice transgenic for Sry[J].Nature, 1991, 351(6322):117-121. doi: 10.1038/351117a0
[4] BOULANGER L, PANNETIER M, GALL L, et al.FOXL2 is a female sex-determining gene in the goat[J].Curr Biol, 2014, 24(4):404-408. doi: 10.1016/j.cub.2013.12.039
[5] SMITH C A, ROESZLER K N, OHNESORG T, et al.The avian Z-linked gene DMRT1 is required for male sex determination in the chicken[J].Nature, 2009, 461(7261):267-271. doi: 10.1038/nature08298
[6] CHEN S L, ZHANG G J, SHAO C W, et al.Whole-genome sequence of a flatfish provides insights into ZW sex chromosome evolution and adaptation to a benthic lifestyle[J].Nat Genet, 2014, 46(3):253-260. doi: 10.1038/ng.2890
[7] YOSHIMOTO S, OKADA E, UMEMOTO H, et al.A W-linked DM-domain gene, DM-W, participates in primary ovary development in Xenopus laevis[J].P Natl Acad Sci USA, 2008, 105(7):2469-2474. doi: 10.1073/pnas.0712244105
[8] MATSUDA M, NAGAHAMA Y, SHINOMIYA A, et al.DMY is a Y-specific DM-domain gene required for male development in the medaka fish[J].Nature, 2002, 417(6888):559-563. doi: 10.1038/nature751
[9] RONDEAU E B, MESSMER A M, SANDERSON D S, et al.Genomics of sablefish (Anoplopoma fimbria):expressed genes, mitochondrial phylogeny, linkage map and identification of a putative sex gene[J].BMC Genomics, 2013, 14(1):452-470. doi: 10.1186/1471-2164-14-452
[10] MYOSHO T, OTAKE H, MASUYAMA H, et al.Tracing the emergence of a novel sex-determining gene in medaka, Oryzias luzonensis[J].Genetics, 2012, 191(1):163-170. doi: 10.1534/genetics.111.137497
[11] HATTORI R S, MURAI Y, OURA M, et al.A Y-linked anti-Müllerian hormone duplication takes over a critical role in sex determination[J].P Natl Acad Sci USA, 2012, 109(8):2955-2959. doi: 10.1073/pnas.1018392109
[12] KAMIYA T, KAI W, TASUMI S, et al.A trans-species missense SNP in Amhr2 is associated with sex determination in the tiger pufferfish, Takifugu rubripes (fugu)[J].PLoS Genet, 2012, 8(7):e1002798. doi: 10.1371/journal.pgen.1002798
[13] WHITMAN M.Smads and early developmental signaling by the TGFβ superfamily[J].Genes Dev, 1998, 12(16):2445-2462. doi: 10.1101/gad.12.16.2445
[14] SAWATARI E, SHIKINA S, TAKEUCHI T, et al.A novel transforming growth factor-beta superfamily member expressed in gonadal somatic cells enhances primordial germ cell and spermatogonial proliferation in rainbow trout (Oncorhynchus mykiss)[J].Dev Biol, 2007, 301(1):266-275. doi: 10.1016/j.ydbio.2006.10.001
[15] SHIBATA Y, PAUL-PRASANTH B, SUZUKI A, et al.Expression of gonadal soma derived factor (GSDF) is spatially and temporally correlated with early testicular differentiation in medaka[J].Gene Expr Patterns, 2010, 10(6):283-289. doi: 10.1016/j.gep.2010.06.005
[16] CRESPO B, GÓMEZ A, MAZÓN M J, et al.Isolation and characterization of Ff1 and Gsdf family genes in European sea bass and identification of early gonadal markers of precocious puberty in males[J].Gen Comp Endocrinol, 2013, 191(9):155-167.
[17] HORIGUCHI R, NOZU R, HIRAI T, et al.Characterization of gonadal soma-derived factor expression during sex change in the protogynous wrasse, Halichoeres trimaculatus[J].Dev Dyn, 2013, 242(4):388-399. doi: 10.1002/dvdy.23929
[18] GAUTIER A, SOHM F, JOLY J S, et al.The proximal promoter region of the zebrafish gsdf gene is sufficient to mimic the spatio-temporal expression pattern of the endogenous gene in Sertoli and granulosa cells[J].Biol Reprod, 2011, 85(6):1240-1251. doi: 10.1095/biolreprod.111.091892
[19] 杨惠惠. 罗非鱼gsdf在性腺的表达及其在性别决定中的功能[D]. 重庆: 西南大学, 2014: 13-55. http://cdmd.cnki.com.cn/Article/CDMD-10635-1014264601.htm [20] JAMIN S P, ARANGO N A, MISHINA Y, et al.Genetic studies of the AMH/MIS signaling pathway for Müllerian duct regression[J].Mol Cell Endocrinol, 2003, 211(1/2):15-19. https://www.sciencedirect.com/science/article/pii/S0303720703003174
[21] HONG W S, ZHANG Q Y.Review of captive bred species and fry production of marine fish in China[J].Aquaculture, 2003, 227(1/2/3/4):305-318.
[22] FORCONI M, CANAPA A, BARUCCA M, et al.Characterization of sex determination and sex differentiation genes in Latimeria[J].PLoS One, 2013, 8(4):e56006. doi: 10.1371/journal.pone.0056006
[23] 闫红伟, 田雨顺, 姜丽楠, 等.红鳍东方鲀gsdf基因的克隆及表达模式分析[J].大连海洋大学学报, 2016, 31(2):140-146. [24] ESCRIVA H, MANZON L, YOUSON J, et al.Analysis of lamprey and hagfish genes reveals a complex history of gene duplications during early vertebrate evolution[J].Mol Biol Evol, 2002, 19(9):1440-1450. doi: 10.1093/oxfordjournals.molbev.a004207
[25] KANEKO H, IJIRI S, KOBAYASHI T, et al.Gonadal soma-derived factor (gsdf), a TGF-beta superfamily gene, induces testis differentiation in the teleost fish Oreochromis niloticus[J].Mol Cell Endocrinol, 2015, 415(1):87-99.
[26] 游秀容, 蔡明夷, 姜永华, 等.大黄鱼性腺性别分化的组织学观察[J].水产学报, 2012, 36(7):1057-1064. https://www.researchgate.net/profile/Zhiyong_Wang26/... [27] JOSSO N, BELVILLE C, DI CLEMENTE N, et al.AMH and AMH receptor defects in persistent Müllerian duct syndrome[J].Hum Reprod Update, 2005, 11(4):351-356. doi: 10.1093/humupd/dmi014
[28] HALM S, ROCHA A, MIURA T, et al.Anti-Müllerian hormone (AMH/AMH) in the European sea bass:its gene structure, regulatory elements, and the expression of alternatively-spliced isoforms[J].Gene, 2007, 388(1/2):148-158.
[29] 刘姗姗, 孙冰, 梁卓, 等.半滑舌鳎抗缪勒氏管激素(AMH)基因的克隆及组织表达分析[J].中国水产科学, 2013, 20(1):35-43. http://www.cnki.com.cn/Article/CJFDTOTAL-ZSCK201301004.htm [30] RODRÍGUEZ-MARÍ A, YAN Y L, BREMILLER R A, et al.Characterization and expression pattern of zebrafish anti-Müllerian hormone amh relative to sox9a, sox9b, and cyp19a1a, during gonad development[J].Gene Expr Patterns, 2005, 5(5):655-667. doi: 10.1016/j.modgep.2005.02.008
[31] AL-ATTAR L, NOËL K, DUTERTRE M, et al.Hormonal and cellular regulation of Sertoli cell anti-Müllerian hormone production in the postnatal mouse[J].J Clin Invest, 1997, 100(6):1335-1343. doi: 10.1172/JCI119653
[32] CHEN Y P, WU W H, WU H M, et al.Effects of anti-Müllerian hormone and follicle stimulating hormone levels on in vitro fertilization pregnancy rate[J].Taiwan J Obstet Gynecol, 2014, 53(3):313-316. doi: 10.1016/j.tjog.2013.06.012
[33] MAUGARS G, SCHMITZ M.Changes in expression profiles of genes related to sexual maturation during spermatogenesis in testes of early-maturing male Atlantic salmon parr, Salmo salar[J].Cybium, 2008, 32(2):167-168. doi: 10.1186/1756-0500-3-215
[34] 曾文刚, 刘振浩, 李红, 等.金钱鱼抗缪勒氏管激素基因克隆及其在性腺发育不同时期mRNA表达水平的分析[J].水产学报, 2015, 39(11):1604-1612. http://www.oalib.com/paper/5218289 [35] ZHU Y, WANG C, CHEN X, et al.Identification of gonadal soma-derived factor involvement in Monopterus albus (protogynous rice field eel) sex change[J].Mol Biol Rep, 2016, 43(7):629-637. doi: 10.1007/s11033-016-3997-8
-
期刊类型引用(20)
1. 田海军,任胜杰,杨治国,顾夕章. 复方中草药制剂对克氏原螯虾抗白斑综合征感染研究. 水产科学. 2024(01): 129-135 .  百度学术
百度学术
2. 林威港,孙琦,海航瑜,刘亚婷,赵鹏,常亚青,马得友. 干露及恢复对中间球海胆抗氧化能力、细胞凋亡和免疫相关基因表达的影响. 大连海洋大学学报. 2024(01): 66-73 .  百度学术
百度学术
3. 黄月,陈荔,钟传艳,陈果,龙晓文. 干露胁迫对中华绒螯蟹成体呼吸和能量代谢及抗氧化能力的影响. 水产学杂志. 2024(02): 61-69 .  百度学术
百度学术
4. 苏禹,王力玄,孟泳岐,马源潮,鲁耀鹏,张泽龙,郑佩华,李军涛,冼健安,刘存歧,王冬梅. 环境因素对克氏原螯虾生长与繁育的影响. 中国饲料. 2024(21): 74-82 .  百度学术
百度学术
5. 邓高威,段健诚,王玉,王林华,欧阳乐飞,高焕,赖晓芳,张庆起,阎斌伦. 干露胁迫对脊尾白虾存活率及氧化应激反应的影响. 水产科学. 2021(02): 244-249 .  百度学术
百度学术
6. 王源源,成永旭,李晨露,刘明明,奚业文,朱传忠,李嘉尧. 干露对克氏原螯虾成虾存活、相关代谢酶及组织结构的影响. 南方水产科学. 2021(05): 34-44 .  本站查看
本站查看
7. 郝晨光,李军涛,张泽龙,张秀霞,冼健安,王冬梅. 模拟空运过程中克氏原螯虾生理生化指标的变化规律. 南方农业学报. 2021(10): 2896-2903 .  百度学术
百度学术
8. 邓平,张立强,艾桃山,喻运珍,余少梅,罗杨志,郑青. 3种中草药对克氏原螯虾肝胰腺抗氧化系统及组织结构的影响. 江苏农业科学. 2020(02): 183-187 .  百度学术
百度学术
9. 熊大林,段亚飞,王芸,张家松,陈成勋,董宏标,李华,刘青松. 氨氮胁迫对凡纳滨对虾肠道免疫相关指标的影响. 海洋渔业. 2020(01): 53-60 .  百度学术
百度学术
10. 王文豪,董宏标,孙彩云,段亚飞,李华,刘青松,张家松,曾祥兵. 石菖蒲挥发油和水溶性氮酮对鱼用麻醉剂的促皮渗透效果研究. 南方水产科学. 2020(04): 62-68 .  本站查看
本站查看
11. 张程凯,黄勃,逯峰,郭云鹏,程遂. Cr~(6+)对红树蚬摄食率及其抗氧化酶活性的影响. 海南大学学报(自然科学版). 2020(03): 240-246 .  百度学术
百度学术
12. 夏玉秀,申旭红,任爽宁,于士翔,刘峰,纪元. 不同干露条件单环刺螠的耐受性及对体表黏液特性的影响. 大连海洋大学学报. 2019(04): 538-544 .  百度学术
百度学术
13. 王海锋,成永旭,李京昊,奚业文,李嘉尧. 干露和再入水对克氏原螯虾抗氧化应激能力的影响. 南方水产科学. 2019(05): 69-76 .  本站查看
本站查看
14. 方晓磊,柯常亮,刘奇,李乐,古小莉,李刘冬. 水产品中丁香酚残留的人体健康风险分析. 水产科学. 2018(01): 140-144 .  百度学术
百度学术
15. 王文豪,董宏标,孙永旭,曹明,段亚飞,李华,刘青松,张家松. MS-222和丁香酚在大口黑鲈幼鱼模拟运输中的麻醉效果. 南方水产科学. 2018(06): 52-58 .  本站查看
本站查看
16. 张月,段亚飞,董宏标,张真真,张家松. 人工基质对凡纳滨对虾免疫和消化相关指标的影响. 水产科学. 2017(04): 462-466 .  百度学术
百度学术
17. 段亚飞,李健,李吉涛,张喆,刘萍. 致病性粪肠球菌对脊尾白虾(Exopalaemon carinicauda)免疫相关基因表达的影响. 渔业科学进展. 2017(05): 148-155 .  百度学术
百度学术
18. 张月,段亚飞,董宏标,张家松. 聚β-羟基丁酸酯对凡纳滨对虾肝胰腺免疫和消化指标的影响. 南方水产科学. 2017(05): 78-84 .  本站查看
本站查看
19. 杨育凯,林黑着,杨其彬,黄小林,黄忠. 3种虾片在凡纳滨对虾育苗中的效果评价. 四川农业大学学报. 2017(02): 266-272 .  百度学术
百度学术
20. 王志铮,祝本强,任夙艺,朱海军,沈伟良. 日本囊对虾(Marsupenaeus japonicus)秋繁同生群仔虾不同耐干露性能群体间的形态表型差异. 海洋与湖沼. 2016(03): 673-680 .  百度学术
百度学术
其他类型引用(23)




 下载:
下载:






 粤公网安备 44010502001741号
粤公网安备 44010502001741号
