Effects of poly-β-hydroxybutyrate (PHB) on immune and digestive indicators in hepatopancreas of Litopenaeus vannamei
-
摘要:
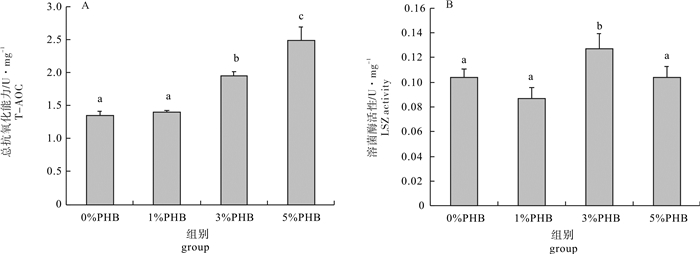
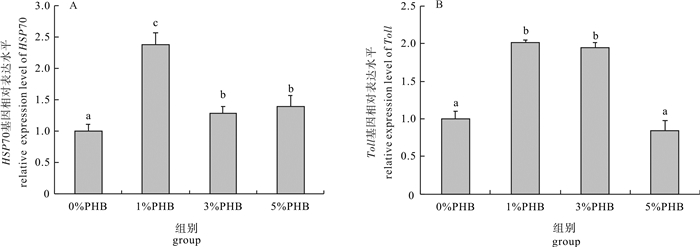
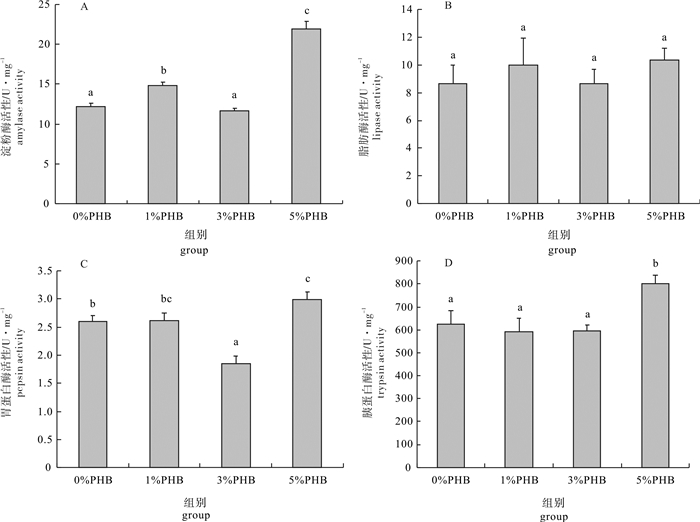
以平均体质量为(5.66±0.14)g的凡纳滨对虾(Litopenaeus vannamei)为研究对象, 分别投喂含聚β-羟基丁酸酯(PHB)质量分数为0%(对照组)、1%、3%和5%的对虾配合饲料, 饲养35 d后检测并比较不同水平PHB对凡纳滨对虾肝胰腺免疫和消化指标的影响。结果显示, 3%PHB添加组凡纳滨对虾的总抗氧化能力和溶菌酶活性显著高于对照组(P < 0.05)。Toll基因表达量随PHB含量的升高呈先上升后下降趋势, 其中1%和3%PHB添加组的表达量显著高于对照组(P < 0.05);对照组HSP70基因表达量显著低于其他处理组(P < 0.05)。5%PHB添加组的淀粉酶、胃蛋白酶和胰蛋白酶活性显著升高(P < 0.05), 而脂肪酶活性无显著变化(P>0.05)。由此可见, 饲料中添加适量的PHB有利于增强凡纳滨对虾肝胰腺的消化和非特异性免疫能力。
-
关键词:
- 凡纳滨对虾 /
- 聚β-羟基丁酸酯(PHB) /
- 肝胰腺 /
- 免疫 /
- 消化
Abstract:Litopenaeus vannamei of average weight of (5.66±0.14) g had been fed for 35 d with four different diets:0%, 1%, 3% and 5% poly-β-hydroxybutyrate (PHB) supplemented feed, and the immune and digestive indicators in hepatopancreas of shrimp were evaluated in this study.The results show that compared with the control group, the shrimps in 3% PHB group had higher total antioxidant capacity (T-AOC) and lysozyme (LSZ) activity (P < 0.05).The relative expression level of Toll gene increased but then decreased with increasing PHB content, and the expression levels in 1% and 3% PHB groups were higher than that in the control group significantly (P < 0.05).The relative expression levels of heat shock protein 70 (HSP70) gene in all three PHB treatment groups were higher than that in the control group significantly (P < 0.05).The amylase, pepsin and trypsin activities of 5% PHB group were significantly higher than those of the control group (P < 0.05), but the lipase activity showed no significant difference (P > 0.05).It is indicated that appropriate PHB content in diet can improve the immune and digestive abilities in hepatopancreas of shrimps significantly.
-
Keywords:
- Litopenaeus vannamei /
- poly-β-hydroxybutyrate (PHB) /
- hepatopancreas /
- immune /
- digestion
-
在软骨中,细胞基质(extracellular matrix,ECM)分子介导细胞-基质、基质-基质相互作用,维持组织完整性[1]。母系蛋白(matrilins)家族是一种新的细胞外基质蛋白家族,其包括至少4个成员(1、2、3和4)。Matrilins的分子结构相似,均含有1~2个血管假性血友病因子A(von Willebrand factor A,VWA)样结构域、连接2个VWA结构域的EGF-like结构域和C端的α-螺旋结构域[1-2]。VWA结构域具有调节蛋白结合、分泌以及通过矩阵蛋白酶水解蛋白质等多重功能[1, 3]。此外VWA还具有调控matrilin齐聚、保护matrilin-1不被蛋白水解的功能,如果VWA缺失会导致三聚体matrilin-1转变为二聚体和三聚体的混合物[2, 4]。Matrilin-1又称软骨基质蛋白(cartilage matrix protein,CMP),Matrilin-1是该家族第一个被发现的[5]。其作为细胞外基质蛋白,主要与细胞外基质(ECM)的形成与稳定有关。Matrilin-1通过绑定Ⅱ型胶原蛋白[6]、aggrecan[6]等发挥作用。
Matrilin-1主要在骨和软骨组织中表达[7-8]。Matrilin-1基因在脊椎动物中研究广泛,在人(Homo sapiens)[9]、斑马鱼(Danio rerio)[10]和大西洋鲑(Salmo salar)[11]中已经克隆出matrilin-1基因。李鑫[12]以matrilin-1敲除鼠和野生鼠为研究对象,研究matrilin-1在小鼠骨折愈合过程中的作用,结果显示matrilin-1对小鼠骨折愈合过程起负调控作用。目前国内外研究最广的是关于matrilin-1基因多态性与青少年特发性脊柱侧凸(AIS)易感性的相关性[13-15],刘晓敏等[16]采用Meta分析对相关文献进行分析后,明确G和A等位基因与AIS的易感性相关联。在体内外实验中,Matrilin-1能抑制血管再生[7]。近年来,对无脊椎动物matrilin-1的研究也陆续见到报道,如matrin-1基因已经在长牡蛎(Crassostrea gigas)中克隆出来[17]。BOUCHUT等[18]从淡水光滑双绮螺(Biomphalaria glabrata)中克隆出matrilin同源基因matrilin-like,并推测其与光滑双绮螺抗棘口吸虫感染相关。XU和FAISAL[19]从斑马贻贝(Dreissena polymorpha)的cDNA文库中筛选出了matrilin的同源基因matrilin-like,并且发现用脂多糖-肽聚糖-酵母聚糖的混合物刺激斑马贻贝的血细胞,会诱导matrilin-like基因表达量升高。虽然matrilin-1基因在无脊椎动物中已经开始研究,但其作用尚不清楚。
合浦珠母贝(Pinctada fucata)隶属于软体动物门,瓣鳃纲,珍珠目,为暖水性贝类,在中国主要分布在广东、广西、海南等地[20-23]。合浦珠母贝是目前中国海水珍珠养殖的主要珍珠贝,具有极高的经济价值。贝壳是生物矿化的主要产物,是在外套膜分泌的基质蛋白的调控下,由碳酸钙晶体有序沉积而成[24]。而matrilin-1是否参与贝壳的矿化过程,尚未见有研究报道。此研究首次从合浦珠母贝中克隆得到matrilin-1基因,观察了该基因在不同组织和幼体发育各阶段的表达情况,并利用生物信息学软件对其基因结构、功能进行了初步探究,旨在探讨该基因在合浦珠母贝生长发育中的作用,为进一步研究生长调控和优化育珠提供参考。
1. 材料与方法
1.1 实验材料
实验用合浦珠母贝为12月龄,壳高为(50±1.45)mm,湿质量为(45±2.1)g,取自海南省陵水县新村热带水产研究开发中心基地,取10个合浦珠母贝的肝胰腺、性腺、闭壳肌、鳃、珍珠囊和外套膜组织,于液氮速冻。根据幼虫形态[25]收集人工培育获得的合浦珠母贝担轮期(受精后8 h)、D型期(受精后24 h)、壳顶期(受精后14 d)、眼点期(受精后20 d)和变态期(受精后24 d)的样品,每个时期收集3个试管,每试管至少包含500个幼虫。收集后分别加入样品保护液,液氮速冻。
1.2 实验方法
1.2.1 总RNA提取与cDNA合成
根据Trizol(Invitrogen,美国)说明书提取合浦珠母贝外套膜总RNA,取1 μL在紫外分光光度计上检测RNA的光密度(OD),并使用琼脂糖凝胶电泳检测其完整性。以总RNA(2 μL)为模板,按照M-MLV(RNase H-)逆转录酶(TaKaRa,大连)说明书合成cDNA第一条链;按照SMARTer® RACE 5′/3′Kit User Manual(Clontech)说明书进行逆转录,分别合成3′RACE-cDNA和5′RACE-cDNA,保存于-20 ℃备用。
1.2.2 matrilin-1基因的克隆
根据合浦珠母贝外套膜转录组数据,筛选得到与matrilin-1相似性较高的unigene片段,拼接后获得合浦珠母贝matrilin-1基因的中间片段。根据基因片段序列设计特异性引物matrilin-1-F和matrilin-1-R克隆cDNA片段(表 1)。PCR反应体系为ddH2O 13.8 μL,10×PCR Ex Buffer(Mg2+ Plus)2.0 μL,dNTP Mixture(各2.5 mmol· L-1)1.6 μL,正/反向引物(F/R)各0.8 μL,cDNA模板0.8 μL,TaKaRa ExTaq(5 U·μL-1)0.2 μL。PCR反应条件为94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。按照纯化回收试剂盒(Meagn,广州)说明书回收PCR产物。琼脂糖凝胶电泳检测片段长度及完整程度,紫外分光光度计检测其OD。PCR产物纯化按照pEASY-T1 Cloning Kit(全士金,北京)说明书进行操作,筛选阳性克隆送上海英潍捷基生物公司测序。根据获得的matrilin-1序列,用Primer Premier 5.0分别设计3′及5′RACE特异性引物(表 1),进行RACE-PCR以获得基因cDNA全长。
表 1 实验中所用引物Table 1. Primers used in this study引物名称
primer name引物序列(5′→3′)
primer sequence用途
applicationmatrilin-1-F GCTTCGTGTCCTCTTTGGTC cDNA克隆 matrilin-1-R AGTGGTTTCTGCATCGGTTG cDNA克隆 matrilin-1-3′-GSP1 GGTATTTGCGAACAACAGTGTGGGTG 3′RACE matrilin-1-3′-GSP2 CAACAGTGTGGGTGTCAGAAGCGG 3′RACE matrilin-1-5′-GSP1 ATAGGCTGATCCGCTTCTGACACCC 5′RACE matrilin-1-5′-GSP2 ATCCGCTTCTGACACCCACACTG 5′RACE UPM CATGGCTACATGCTGACAGCCTA RACE UPM-short CGCGGATCCACAGCCTACTGATGATCAGTCGATG RACE matrilin-1-qF1 GGCTCTCGCTGCTGATTAT qRT-PCR matrilin-1-qR1 CCGTCGTGTGAAGAATAGT qRT-PCR 18S-f GAGAAACGGCTACCACATCC qRT-PCR 18S-r CACCAGACTTGCCCTCCAA qRT-PCR 1.2.3 matrilin-1基因序列分析
使用NCBI网站上的BLASTX(http://blast.ncbi.nlm.nih.gov/ Blast/)程序分析开放阅读框(ORF)、进行序列同源性比对和相似性检索,ORF Finder寻找ORF;用ProtParam(http://web.expasy.org/protparam/)预测编码蛋白的理化特性;采用NetPhos 2.0(http://www.cbs.dtu.dk/services/NetPhos/)预测蛋白磷酸化位点;信号肽预测采用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/);跨膜结构域预测采用TMHMM server 2.0(http://www.cbs.dtu.dk/services/TMHMM/);用SMART 4.0(http://smart.embl-heidelberg.de/)在线程序进行蛋白结构域分析;用NetNGIys 1.0(http://www.cbs.dtu.dk/services/NetNGlyc/)预测糖基化位点;用Bioedit软件和在线软件Clustal Omega(http://www.ebi.ac.uk/Tools/msa/clustalo/)进行多重序列比对;采用MEGA 6.0软件以邻位相连法(neighbor-joining,NJ)构建进化树。
1.2.4 Pfmatrilin-1基因的表达图谱
提取健康的成年合浦珠母贝不同组织(肝胰腺、肠、珍珠囊、闭壳肌、鳃和外套膜)和不同发育时期(担轮期、D型期、壳顶期、眼点期和变态期)幼体的总RNA,用PrimerScript TM 1st strand cDNA synthesis Kit(TaKaRa,大连)逆转录成cDNA备用。根据合浦珠母贝matrilin-1的cDNA序列设计特异性引物matrilin-1-qF1和matrilin-1-qR1(表 1),采用18S rRNA基因作为内参[26]。按照SYBR Real-time PCR Master Mix试剂盒(TaKaRa,大连)说明书进行qRT-PCR,以去离子水为模板作为阴性对照,样品和内参均设3个重复。采用相对ΔCT法(2-ΔΔCT法)分析Pfmatrilin-1基因在合浦珠母贝不同组织和不同发育时期中的相对表达量[27]。目的基因表达水平由“平均值±标准差”(X+SD)表示,运用统计学分析软件SPSS 19.0进行单因素方差分析(One-Way ANOVA),P < 0.05为差异显著。
2. 结果与分析
2.1 matrilin-1的cDNA序列特征
根据合浦珠母贝外套膜转录组测序的matrilin-1序列片段,使用基因特异性引物进行5′-和3′-RACE扩增,经拼接获得2 036 bp全长cDNA,命名为Pfmatrilin-1(GenBank:KU553226),开放阅读框1 194 bp,5′非编码区(UTR)为670 bp,3′UTR为172 bp(图 1)。预测Pfmatrilin-1基因编码397个氨基酸,理论分子量约为43.71 kD,理论等电点(pI)为4.7。SingalP 4.1软件预测Pfmatrilin-1有1个N-端信号肽(1~19)。分别采用NetPhos 2.0和NetNGIys 1.0预测Pfmatrilin-1的翻译后修饰情况,发现Pfmatrilin-1可能有5个N-糖基化位点(N84、N93、N116、N288和N350)和38个磷酸化位点(包括22个丝氨酸,8个苏氨酸和8个酪氨酸位点)。Pfmatrilin-1氨基酸序列有2个典型的VWA结构域(23~199 aa和211~374 aa)(图 1),缺失EGF-like结构域,这与matrilin家族及其相关蛋白存在差异。利用在线软件Clustal Omega将Pfmatrilin-1基因与其他物种的matrilin-1氨基酸序列进行多重序列比对,结果显示Pfmatrilin-1与其他物种matrilin-1的2个VWA区域相对保守,而连接2个VWA结构域的EGF-like结构域及C-端的α-螺旋结构域缺失(图 2)。Blast结果显示Pfmatrilin-1与人、小家鼠(Mus musculus)、斑马鱼、非洲爪蟾(Xenopus laevis)的相似性均为42%,而与长牡蛎的同源性达到了60%,远高于脊椎动物。
![]() 图 1 合浦珠母贝Pfmatrilin-1基因cDNA序列及其编码的氨基酸序列图中加粗字体为起始密码子和终止密码子,阴影部分表示信号肽,下划线和方框分别表示2个VWA结构域,双下划线表示N糖基化位点,斜体部分表示poly(A)尾巴。Figure 1. Full-length cDNA and protein sequence of Pfmatrilin-1 gene of the P.fucataThe initiation codon and stop codon are in bold.The shadow is the deduced signal peptide.Underlines and boxes indicate two Von Willebrand factor type A (VWA) domains.The glycosylation sites are double-underlined. The poly A signal sequence are italicized.
图 1 合浦珠母贝Pfmatrilin-1基因cDNA序列及其编码的氨基酸序列图中加粗字体为起始密码子和终止密码子,阴影部分表示信号肽,下划线和方框分别表示2个VWA结构域,双下划线表示N糖基化位点,斜体部分表示poly(A)尾巴。Figure 1. Full-length cDNA and protein sequence of Pfmatrilin-1 gene of the P.fucataThe initiation codon and stop codon are in bold.The shadow is the deduced signal peptide.Underlines and boxes indicate two Von Willebrand factor type A (VWA) domains.The glycosylation sites are double-underlined. The poly A signal sequence are italicized.![]() 图 2 Pfmatrilin-1与其他物种matrilin-1氨基酸序列比对多重序列比较采用GenBank上的序列登录号,长牡蛎EKC38360.1;小家鼠AAH47140.1;人NP_002370.1;非洲爪蟾NP_001079801.1;斑马鱼NP_001093210.1;“*”表示同源性;“:”或者“.”表示相似性。Figure 2. Multiple sequence alignment of amino acid sequence of Pfmatrilin-1 with matrilin-1 from other organismsCrassostrea gigas EKC38360.1;Mus musculus AAH47140.1;Homo sapiens NP_002370.1;Xenopus laevis NP_001079801.1; Danio rerio NP_001093210.1;identical and similar sites are shown with sparks (*) and dots (:or.), respectively.
图 2 Pfmatrilin-1与其他物种matrilin-1氨基酸序列比对多重序列比较采用GenBank上的序列登录号,长牡蛎EKC38360.1;小家鼠AAH47140.1;人NP_002370.1;非洲爪蟾NP_001079801.1;斑马鱼NP_001093210.1;“*”表示同源性;“:”或者“.”表示相似性。Figure 2. Multiple sequence alignment of amino acid sequence of Pfmatrilin-1 with matrilin-1 from other organismsCrassostrea gigas EKC38360.1;Mus musculus AAH47140.1;Homo sapiens NP_002370.1;Xenopus laevis NP_001079801.1; Danio rerio NP_001093210.1;identical and similar sites are shown with sparks (*) and dots (:or.), respectively.采用表 2中所列物种matrilin-1序列构建进化树。以犬弓蛔虫(Toxocara canis)的matrilin-like为外群,系统进化分析显示matrilin-1在脊椎动物和无脊椎动物中分别聚为群组。Pfmatrilin-1与长牡蛎matrilin-1聚为一支,然后与其他无脊椎动物光滑双绮螺matrilin、斑马贻贝matrilin-like、犬弓蛔虫matrilin-1聚为一支,最后与脊椎动物matrilin-1聚为群组(图 3)。这表明软体动物与脊椎动物的matrilin-1遗传距离较远。
表 2 进化树构建所用物种Table 2. Species used in phylogenetic tree物种名
species氨基酸序列名称
amino acid name登录号
Accession No.(NCBI)合浦珠母贝Pinctada fucata matrilin-1 KU553226 长牡蛎Crassostrea gigas matrilin-1 EKC38360.1 犬弓蛔虫Toxocara canis matrilin-1 KHN84166.1 斑马贻贝Dreissena polymorpha matrilin-like AM503947 光滑双绮螺Biomphalaria glabrata matrilin AAN61407.1 非洲爪蟾Xenopus laevis matrilin-1 NP_001079801.1 斑马鱼Danio rerio matrilin-1 NP_001093210.1 绿头鸭Anas platyrhynchos matrilin-1 EOB04374.1 眼睛王蛇Ophiophagus hannah matrilin-1 ETE70549.1 原鸡Gallus gallus matrilin-1 NP_001025546.2 小家鼠Mus musculus matrilin-1 AAH47140.1 非洲爪蟾Xenopus laevis matrilin-1 NP_001079801.1 褐家鼠Rattus norvegicus matrilin-1 EDL80602.1 牛Bos taurus matrilin-1 NP_001137338.1 大黄鱼Larimichthys crocea matrilin-1 KKF25140.1 绿海龟Chelonia mydas matrilin-1 EMP29967.1 人Homo sapiens matrilin-1 NP_002370.1 2.2 matrilin-1的表达
Pfmatrilin-1 mRNA在肝胰腺、肠、珍珠囊、闭壳肌、鳃和外套膜中均有表达,其中血液表达量最高,其次是外套膜、鳃和闭壳肌,在肝胰腺和肠中表达量最低(图 4)。Pfmatrilin-1 mRNA在所检测的合浦珠母贝不同发育时期均有表达,其中在幼虫眼点期表达量最高,担轮期表达量最低(图 5)(P < 0.05)。
![]() 图 4 合浦珠母贝Pfmatrilin-1 mRNA在不同组织中的表达垂直线表示平均值±标准差(n=3),不同字母表示差异显著(P < 0.05),后图同此。Figure 4. Relative expression level of Pfmatrilin-1 mRNA in different tissues of P.fucataVertical bars are represented as X ±SD (n=3). Significant different letters above vertical bars indicate significant difference (P<0.05). The same case in the following figure.
图 4 合浦珠母贝Pfmatrilin-1 mRNA在不同组织中的表达垂直线表示平均值±标准差(n=3),不同字母表示差异显著(P < 0.05),后图同此。Figure 4. Relative expression level of Pfmatrilin-1 mRNA in different tissues of P.fucataVertical bars are represented as X ±SD (n=3). Significant different letters above vertical bars indicate significant difference (P<0.05). The same case in the following figure.3. 讨论
Matrilin-1的VWA结构域具有调节蛋白结合、分泌以及通过矩阵蛋白酶水解蛋白质等多重功能[1, 3]。此外,VWA还具有调控matrilin齐聚、保护matrilin-1不被蛋白水解的功能,如果VWA缺失会导致三聚体matrilin-1转变为二聚体和三聚体的混合物[2, 4]。ZHANG等[1]发现matrilin-1的VWA基序介导通过域中的金属离子依赖性粘附位点形成丝状矩阵网络。Matrilin-1的vWF A结构域或金属离子依赖性粘附位点缺失或突变都会影响其蜂窝状丝状网络的形成,这表明vWF A具有粘合位点的作用,该位点可以粘合它的基质配体包括胶原和蛋白聚糖,由于vWF A具有多种功能,因此该结构域的缺失或突变都可能导致不同的病理机制[1]。EGF-like的个数并不影响matrilins的组装[28]。Pfmatrilin-1基因的cDNA全长序列结构域分析发现,Pfmatrilin-1包含2个VWA结构域,但是缺少连接2个VWA结构域的EGF-like结构域和C端的α-螺旋结构域。其他无脊椎动物如光滑双绮螺[18]和斑马贻贝[19]的matrilin只包含了1个VWA结构域,并且也缺少EGF-like结构域和C端的α-螺旋结构域。氨基酸序列分析表明,Pfmatrilin-1的2个VWA结构域与其他物种matrilin-1的VWA结构域相对保守。无脊椎动物和脊椎动物matrilin-1氨基酸结构上的差异是否影响其功能还有待深入探究。
利用qRT-PCR技术发现Pfmatrilin-1在合浦珠母贝各组织(肝胰腺、肠、血淋巴、闭壳肌、鳃和外套膜)中均有表达,在血淋巴、外套膜、鳃和闭壳肌中相对表达量显著高于其他组织。在哺乳动物中,matrilin-1主要分布在长骨的脊柱和生长板软骨组织[29]。研究表明matrilin-1多态性与青少年特发性脊柱侧凸(AIS)易感性相关[13-16]。在斑马鱼的脊索中也发现了matrilin-1[10]。PEDERSEN等[11]利用双向电泳和统计学分析首次发现matrilin-1在融合的椎骨中表达量上调,并且发现在大西洋鲑中,matrilin-1在脊椎融合的个体中表达量显著高于脊椎未变形的个体,因此matriin-1也可能是脊椎变形的标志物。但是matrilin-1基因敲除小鼠显示,该基因并不是骨结构和功能所必须的[30]。敲除matrilin-1虽然对骨骼发育没有明显的影响,但是敲除matrilin-1基因的小鼠Ⅱ型胶原原纤维和纤维组织形成出现异常[30],所以matrilin-1在骨、软骨发育和生物矿化中的作用有待进一步研究。Pfmatrilin-1在合浦珠母贝的外套膜和鳃中的表达量相对较高,外套膜是发生生物矿化的主要组织。许多与贝壳形成相关的基因,如KRMP[31]、BMP7[32]、msi31和nacrein[33]都在外套膜高表达,因此推测Pfmatrilin-1基因也可能参与贝壳形成的调控。此外,BOUCHUT等[18]发现matrilin在抗棘口吸虫感染的光滑双绮螺与易感染棘口吸虫的光滑双绮螺中表达量不同,但是其具体功能还未确定。而XU和FAISAL[19]也发现使用脂多糖-肽聚糖-酵母聚糖的混合物刺激斑马贻贝的血细胞,会诱导matrilin-like基因表达量升高,因此推测matrilin-like与宿主防御机制有关。Pfmatrilin-1在合浦珠母贝血淋巴中高表达,是否与合浦珠母贝的防御机制有关,以及该基因在合浦珠母贝中的具体功能还需进一步研究。
Matrilin-1在生物体胚胎发育及其成熟的过程中发挥着不同的作用。在斑马鱼受精15 h之后,matrilin-1开始表达,此时该基因在整个胚胎中(除了脊索)都有表达,随着斑马鱼骨骼的发育,matrilin-1主要在软骨表达。采用Morpholino knockdown技术检测斑马鱼胚胎的matrilin-1基因表达,结果造成整体生长缺陷,尤其是干扰颅面软骨形成,并且Ⅱ型胶原蛋白分泌显著降低[8]。因此matrilin-1是斑马鱼软骨发育中不可或缺的,并且在早期Ⅱ型胶原蛋白沉积过程中也发挥了作用[8]。此研究中,Pfmatrilin-1在合浦珠母贝幼虫的各个时期均有表达,并且在眼点期表达量最高,且差异显著(P<0.05)。海产贝类在生活史的早期要经历一个浮游幼体阶段,当贝类幼虫发育到眼点期就从浮游生活转变为匍匐生活,眼点期幼虫原壳生长停滞,次生壳形成,面盘逐渐消失并在后方出现足部[25]。合浦珠母贝幼虫附着后开始形成棱柱层。因此笔者推测Pfmatrilin-1在眼点期高表达可能与合浦珠母贝幼虫次生壳的形成有关。
此研究克隆得到了Pfmatrilin-1基因cDNA全长,并进行了生物信息学分析。qRT-PCR表明Pfmatrilin-1在合浦珠母贝不同组织和幼虫发育各时期均有表达,在血淋巴和眼点期表达量最高,推测其功能可能与生物矿化相关,为进一步研究Pfmatrilin-1在合浦珠母贝中的功能奠定了基础。
-
图 1 聚β-羟基丁酸酯对凡纳滨对虾肝胰腺总抗氧化能力和溶菌酶活性的影响
不同小写字母表示组间差异显著(P < 0.05), 相同小写字母表示组间差异不显著(P>0.05);后图同此
Figure 1. T-AOC and LSZ activity in hepatopancreas of L.vannamei after PHB treatment
Different letters indicate significant difference (P < 0.05), while the same letters indicate no significant difference (P>0.05).The same case in the following figures.
表 1 该研究所用引物序列
Table 1 Sequence of primers in this study
引物名称
primer name引物序列(5′→3′)
primer sequence登录号
accession No.HSP70-F AGGAGACCGCTGAGGCTTAC AY645906 HSP70-R AGCACATTCAGACCCGAGAT Toll-F CCAGCTTAGAAGACCGGCAA DQ923424 Toll-R GTTGTCCGAGCAGAAGTCCA β-actin-F GCCCTGTTCCAGCCCTCATT AF300705 β-actin-R ACGGATGTCCACGTCGCACT -
[1] 李玉虎, 宋芹芹, 张志怀, 等.凡纳滨对虾生长发育规律及生长曲线拟合研究[J].南方水产科学, 2015, 11(1):89-95. http://www.schinafish.cn/CN/abstract/abstract9184.shtml [2] 向赟, 吴宇学, 王刚, 等.不同温度下哈维氏弧菌和白斑综合症病毒对凡纳滨对虾的致病性[J].大连海洋大学学报, 2015, 30(1):56-61. http://edu.wanfangdata.com.cn/Periodical/Detail/hnrdnydxxb201601001 [3] 李晶晶, 李云, 刘红, 等.感染溶藻弧菌及白斑综合症病毒后凡纳滨对虾不同组织的Toll样受体基因表达变化研究[J].海洋与湖沼, 2016, 47(2):476-483. http://www.cqvip.com/QK/90072X/201602 [4] 罗词兴, 黄旭雄, 李桑, 等.溶藻弧菌感染后凡纳滨对虾鳃组织免疫相关基因的表达[J].中国水产科学, 2014, 21(1):189-196. http://www.cqvip.com/QK/90072X/201602/669133827.html [5] 李健, 梁俊平, 李小彦, 等.黄芩苷在中国对虾体内对诺氟沙星消除及细胞色素P450酶的影响[J].海洋科学, 2012, 36(3):81-88. http://www.oalib.com/references/17806877 [6] 文国樑, 林黑着, 李卓佳, 等.饲料中添加复方中草药对凡纳滨对虾生长、消化酶和免疫相关酶活性的影响[J].南方水产科学, 2012, 8(2):58-63. http://www.schinafish.cn/CN/abstract/abstract8940.shtml [7] 杨铿, 林黑着, 夏冬梅, 等.饲料中海洋红酵母对尼罗罗非鱼幼鱼生长性能、消化酶及免疫酶活性的影响[J].南方水产科学, 2016, 12(6):51-58. http://www.schinafish.cn/CN/abstract/abstract9401.shtml [8] BARUAH S K, NOROUZITALLAB P, DEBNATH D, et al.Organic acids as non-antibiotic nutraceuticals in fish and prawn feed[J].Aquacult Health Int, 2008(12):4-6. https://www.researchgate.net/publication/293336603_Organic_acids...
[9] 孙慧贤, 隋丽英.聚β-羟基丁酸酯对卤虫幼体的强化作用[J].上海海洋大学学报, 2011, 20(3):392-398. http://www.cnki.com.cn/Article/CJFDTOTAL-SCKX201408013.htm [10] 魏茂繁, 邵云海, 钟卫鸿.生物合成聚-β-羟基丁酸(PHB)的研究现状与应用前景[J].黑龙江科学, 2014, 5(6):24-25. http://www.cnki.com.cn/Article/CJFDTOTAL-GSKJ200603049.htm [11] 刘春, 张小凡.PHB在生产可降解塑料方面的应用及其微生物累积的研究进展[J].塑料工业, 2005, 33(8):1-3, 18. http://www.cnki.com.cn/Article/CJFDTotal-XJJB201432022.htm [12] 邓元告, 黄琼叶, 马灌楠, 等.PHB剂量和饲喂时间对中华绒螯蟹肝胰腺酶活力和肠道菌群多样性的影响[J].中国水产科学, 2016, 23(1):138-145. http://d.wanfangdata.com.cn/Periodical_zgsckx201601013.aspx [13] De SCHRYVER P, SINHA A, KUNWAR P, et al.Poly-β-hydroxybutyrate (PHB) increases growth performance and intestinal bacterial range-weighted richness in juvenile European sea bass, Dicentrarchus labrax[J].Appl Microbiol Biotechnol, 2010, 86(5):1535-1541. doi: 10.1007/s00253-009-2414-9
[14] 曹俊明, 严晶, 王国霞, 等.家蝇蛆粉替代鱼粉对凡纳滨对虾消化酶、转氨酶活性和肝胰腺组织结构的影响[J].南方水产科学, 2012, 8(5):72-79. http://www.schinafish.cn/CN/abstract/abstract8983.shtml [15] 邓康裕, 孔杰, 孟宪红, 等.聚β-羟基丁酸酯对中国明对虾抗WSSV能力的影响[J].水产学报, 2014, 38(8):1167-1174. http://industry.wanfangdata.com.cn/dl/Detail/Periodical?id=... [16] SUGUNA P, BINURAMESH C, ABIRAMI P, et al.Immunostimulation by poly-β hydroxybutyrate-hydroxyvalerate (PHB-HV) from Bacillus thuringiensis in Oreochromis mossambicus[J].Fish Shellfish Immunol, 2014, 36(1):90-97. doi: 10.1016/j.fsi.2013.10.012
[17] NHAN D T, WILLE M, de SCHRYVER P, et al.The effect of poly-β-hydroxybuty rate on larviculture of the giant fresh water prawn Macrobrachium rosenbergii[J].Aquaculture, 2010, 302(1/2):76-81. https://www.sciencedirect.com/science/article/pii/S105046481630715X
[18] 刘玉, 隋丽英, 邓元告, 等.聚β-羟基丁酸酯(PHB)对中华绒螯蟹(Eriocheir sinensis)幼蟹生长和肝胰腺酶活力的影响[J].海洋与湖沼, 2013, 44(5):1333-1338. http://www.cnki.com.cn/Article/CJFDTOTAL-HYFZ201305031.htm [19] WU F, XUE Y, LIU X, et al.The protective effect of eicosapentaenoic acid-enriched phospholipids from sea cucumber Cucumaria frondosa on oxidative stress in PC12 cells and SAMP8 mice[J].Neurochem Int, 2014, 64:9-17. doi: 10.1016/j.neuint.2013.10.015
[20] 张克烽, 张子平, 陈芸, 等.动物抗氧化系统中主要抗氧化酶基因的研究进展[J].动物学杂志, 2007, 42(2):153-160. http://www.wenkuxiazai.com/doc/eec3817c1711cc7931b716df-4.html [21] 段亚飞, 董宏标, 王芸, 等.干露胁迫对日本囊对虾抗氧化酶活性的影响[J].南方水产科学, 2015, 11(4):102-108. http://www.schinafish.cn/CN/abstract/abstract9241.shtml [22] 段亚飞, 董宏标, 王芸, 等.鳗弧菌感染对斑节对虾免疫相关指标的影响[J].海洋科学, 2015, 39(9):44-50. doi: 10.11759//hykx20150409001 [23] 邓康裕, 孔杰, 孟宪红, 等.聚β-羟基丁酸酯对凡纳滨对虾抗WSSV能力及免疫基因表达量的影响[J].中国水产科学, 2015, 22(5):877-886. http://www.cqvip.com/QK/98270X/201505/666134560.html [24] SUI L Y, MA G N, LU W L, et al.Effect of poly-β-hydroxybutyrate on growth, enzyme activity and intestinal microbial community of Chinese mitten crab, Eriocheir sinensis (Milne-Edwards) juveniles[J].Aquacult Res, 2016, 47(11):3644-3652. doi: 10.1111/are.2016.47.issue-11
[25] 雷爱莹, 曾地刚.复方中草药对凡纳滨对虾热应激蛋白70基因表达的影响[J].广西农业科学, 2008, 39(6):830-833. http://www.cqvip.com/QK/83434X/200804/29012150.html [26] 曹煜成, 文国樑, 张华军, 等.地衣芽孢杆菌对凡纳滨对虾Toll和HSP70基因表达的影响[J].中国微生态学杂志, 2013, 25(8):882-886. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGWS201308003.htm [27] THAI T, WILLE M, GARCIA-GONZALEZ L, et al.Poly-β-hydroxybutyrate content and dose of the bacterial carrier for Artemia enrichment determine the performance of giant freshwater prawn larvae[J].Appl Microbiol Biotechnol, 2014, 98(11):5205-5215. doi: 10.1007/s00253-014-5536-7
[28] 邓康裕, 孟宪红, 孔杰, 等.聚β-羟基丁酸酯对凡纳滨对虾(Litopenaeus vannamei)非特异性免疫力及氨氮胁迫后免疫基因表达量的影响[J].渔业科学进展, 2015, 36(6):71-78. doi: 10.11758/yykxjz.20150611 [29] MORTENSEN F, NIELSEN H, MULVANY M, et al.Short chain fatty acids dilate isolated human colonic resistance arteries[J].Gut, 1990, 31(12):1391-1394. doi: 10.1136/gut.31.12.1391
[30] PARTANEN K, MROZ Z.Organic acids for performance enhancement in pig diets[J].Nutr Res Rev, 1999, 12(1):117-145. doi: 10.1079/095442299108728884
[31] NAJDEGERAMI E, TRAN T, DEFOIRDT T, et al.Effects of poly-β-hydroxybutyrate (PHB) on Siberian sturgeon (Acipenser baerii) fingerlings performance and its gastrointestinal tract microbial community[J].FEMS Microbiol Ecol, 2012, 79(1):25-33. doi: 10.1111/j.1574-6941.2011.01194.x
[32] NAJDEGERAMI E H, BARUAH K, SHIRI A A, et al.Siberian sturgeon (Acipenser baerii) larvae fed Artemia nauplii enriched with poly-β-hydroxybutyrate (PHB):effect on growth performance, body composition, digestive enzymes, gut microbial community, gut histology and stress tests[J].Aquacult Res, 2015, 46(4):801-812. doi: 10.1111/are.12231
[33] WELTZIEN F A, HEMRE G I, EVJEMO J O, et al.β-hydroxybutyrate in developing nauplii of brine shrimp (Artemia franciscana K.) under feeding and non-feeding conditions[J].Comp Biochem Physiol B, 2000, 125(1):63-69. doi: 10.1016/S0305-0491(99)00159-5
-
期刊类型引用(3)
1. 罗贝,林海生,王庆恒,秦小明,曹文红,高加龙,郑惠娜. 马氏珠母贝L-氨基酸氧化酶基因克隆及表达分析. 上海海洋大学学报. 2024(05): 1074-1083 .  百度学术
百度学术
2. 闫娇,高坤鹏,余可欣,孙建安,毛相朝. 脂肪酶Sv-lip5的异源表达及其在虾青素酯水解中的应用. 南方水产科学. 2022(02): 31-38 .  本站查看
本站查看
3. 陈金辉,冼昶华,罗月红. 华贵栉孔扇贝HSP22基因的克隆及表达分析. 基因组学与应用生物学. 2020(10): 4547-4554 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载:





 粤公网安备 44010502001741号
粤公网安备 44010502001741号
