Research progress of Polydora Complex
-
摘要:
才女虫属复合体(Polydora Complex)是典型的底质摄食者,多数种类栖居于潮间带、海湾、河口等近岸水域。其中一些种类是贝类上常见的多毛类寄生虫,能够钻入贝类的壳内营寄生生活,阻碍宿主的生长发育,感染严重时会导致贝类的大量死亡,是严重危害贝类养殖业发展的主要寄生虫类之一。文章从才女虫属复合体的形态分类、分子系统发育、栖居习性、生殖方式、幼体发育等5个方面综述才女虫属复合体的研究现状以及未来趋势。
Abstract:Polydora Complex, typically marine bottom deposit feeders, mostly inhabit in the coastal waters including intertidal zones, bays and estuaries. Some of Polydora Complex are main shellfish parasites which can bore into shells, and retard growth and development of the hosts. The shellfish heavily affected with Polydora Complex have high mortality. This paper reviews the researches on Polydora Complex from five aspects, including morphological taxonomy, molecular phylogeny, habitat type, reproduction and larval development. Research trends for Polydora Complex are also forecasted.
-
Keywords:
- Polydora Complex /
- morphological taxonomy /
- habitat type /
- reproduction
-
细菌性疾病会对水产养殖业造成重大经济损失,目前水产动物细菌性疾病的治疗仍以抗生素为主,但由于不科学的药物使用,目前水产病原菌的耐药问题十分严重[1-2]。乳酸菌作为一类普遍认同的益生菌,其生长过程中能产生细菌素、过氧化氢和有机酸等代谢产物,这些代谢产物能抑制病原菌的繁殖和生长[3]。因此,作为一种抗生素替代物的乳酸菌受到越来越多的关注。
乳酸菌应用于水产行业以来,研究多集中于促进水产动物生长、提高动物免疫力等方面,而其益生特性的研究则多集中于水产动物肠道定植、体外抑菌[4]以及对消化道低pH[5]和胆盐[6]环境的适应性方面。但乳酸菌是一类能利用可发酵糖产生大量乳酸的细菌统称,现有研究显示这类细菌中包含能分解明胶、导致溶血的致病菌[7];此外,细菌耐药基因转移的情况普遍存在[8],且已有研究指出大肠杆菌(Escherichia coli)和乳链球菌(Streptococcus lactis)之间能转移卡那霉素抗性[9]。因此,以具有溶血、分解明胶能力或耐药特性未知的乳酸菌菌株作为口服益生菌对机体有严重的安全隐患。目前对于水产领域应用乳酸菌的安全性评估相对薄弱,尤其是相关菌株耐药性的研究鲜有报道。故本研究对实验室保存的2株乳酸菌[乳酸菌S60 (干酪乳杆菌Lactobacillus casei) 和S72 (植物乳杆菌L. plantarum)]开展益生特性和安全性研究,评价其作为鱼类口服益生菌的可行性,为其后续的实际应用提供理论依据。
1. 材料与方法
1.1 主要材料和仪器
实验中所用乳酸菌S60、S72和指示菌嗜水气单胞菌 (Aeromonas hydrophila)、维氏气单胞菌 (A. veronii)、无乳链球菌 (S. agalactiae)、迟缓爱德华氏菌 (Edwardsiella tarda)、创伤弧菌 (Vibrio vulnificus)、副溶血弧菌 (V. parahemolyticus)均由本实验室分离保存,且经16S rDNA和常规细菌学鉴定。
1.1.1 试剂
LB培养基、MRS培养基、BHI培养基均购于青岛高科技工业园海博生物科技有限公司,明胶培养基 (杭州滨和微生物试剂有限公司),血平板 (广东环凯微生物科技有限公司),牛胆盐 (胆酸质量分数≥60%,叶源生物),5%脱纤维绵羊血(南京森贝伽生物科技有限公司),氨苄青霉素 (USP级)、硫酸卡那霉素 (USP级)、链霉素 (720 IU·mg−1)、恩诺沙星 (质量分数98%)、氟苯尼考 (质量分数98%) 和盐酸多西环素 (质量分数≥98%) 均购于上海阿拉丁生化科技股份有限公司,磺胺甲唑 (质量分数98%,上海麦克林生化科技有限公司)。血液生化试剂盒[(谷丙转氨酶(ALT)、谷草转氨酶 (AST)、乳酸脱氢酶 (LDH)]均购于上海执诚生物科技有限公司。
1.1.2 仪器
全波长酶标仪 (Multiskan G,Thermo Scientific),高速冷冻离心机 (赛默飞世尔科技有限公司),细菌浊度仪SGZ-6AXJ (上海悦丰仪器仪表有限公司),全自动生化分析仪BS-400 (深圳迈瑞生物医疗电子股份有限公司),智能生化培养箱 (无锡华泽科技有限公司),震荡培养箱ZQL-180S (上海知楚仪器有限公司)。
实验鱼为异育银鲫 (Carassius auratus),由中国水产科学研究院淡水渔业研究中心南泉基地提供,鱼体健康无伤,体质量为 (150±12) g,体长为 (17±3) cm (n=100)。实验前,异育银鲫于循环养殖系统中暂养2周,水温为 (26±1) ℃,持续充氧,光周期同自然光,使用商品化颗粒饲料饲喂,日投饵量按体质量的3%计算,一天3次。
1.2 生长曲线与产酸能力
取乳酸菌菌种于MRS培养基中过夜培养活化 (30 ℃、180 r·min−1),次日将活化好的培养物100 μL接入5 mL新鲜MRS培养基 (30 ℃、180 r·min−1) 培养18 h,然后按1∶100稀释作为菌种,再以20 μL·mL−1接种,设置3个平行。分别在接种后的第0、第3、第6、第9、第12、第15、第24、第27、第30、第33和第36小时取菌液,使用酶标仪测定光密度 (OD600)。以时间为横坐标,OD600为纵坐标,绘制生长曲线。同时在接种后的第0、第12、第24、第36、第48、第60和第72小时检测发酵液pH,评价其产酸能力。
1.3 压力耐受能力
参照杨媛媛等[10]方法检测耐酸能力;参照任世英等[11]方法制备含乳酸菌的MRS平板以检测菌株胆盐耐受能力。
1.4 抑菌活性
1.4.1 抑菌能力评价
选择常见的水产病原菌——嗜水气单胞菌、维氏气单胞菌、无乳链球菌、迟缓爱德华氏菌、创伤弧菌、副溶血弧菌作为指示菌,参照杨媛媛等[10]方法,检测实验菌株的抑菌能力。最终将数据统一调整至菌斑直径为5 mm时的抑菌直径。计算公式为抑菌直径=(抑菌圈直径1/菌斑直径1+抑菌圈直径2/菌斑直径2+抑菌圈直径3/菌斑直径3)/3×5。
1.4.2 抑菌物质检测
参照任世英等[11]方法制备含指示菌的LB琼脂平板,对发酵液进行预处理以分析其所含抑菌物质特性。
1.5 安全性评价
1.5.1 明胶实验
将含实验菌的菌液接种于明胶培养基,30 ℃培养48 h,取出置于4 ℃ 30 min。取出检查明胶培养基的状态;同时设置阴性对照组 (以无菌生理盐水代替实验菌) 和阳性对照组 (以嗜水气单胞菌代替实验菌)。接种实验菌的明胶培养基与阴性对照一样为完全凝固的状态,表示实验菌不分解明胶,若同阳性对照一样完全呈液态则表明实验菌能分解明胶,介于两者之间呈半固体则表明实验菌有较弱的分解明胶的能力。
1.5.2 溶血实验
将活化的菌株划线接种于含有体积分数为5%脱纤维绵羊血的血琼脂平板上,30 ℃倒置培养24~48 h,观察记录菌落周围是否有溶血的透明圈。为避免实验菌产酸引起的溶血对血平板结果造成干扰,参照Mao等[12]的方法同时开展体外溶血实验。
1.5.3 药敏实验
同1.4.2制备含实验菌的MRS平板,打孔备用 (每个平板打孔5个)。以生理盐水配置抗生素质量浓度为256 μg·mL−1、128 μg·mL−1、64 μg·mL−1、32 μg·mL−1和16 μg·mL−1的药液,按150 μL每孔加入到之前准备好的含实验菌的MRS平板,每个浓度重复3次。4 ℃扩散4 h后,转入培养箱30 ℃ 培养48 h后,测量记录抑菌圈直径,判读其抗生素耐受能力。
1.5.4 动物实验
将过夜培养的乳酸菌和嗜水气单胞菌,以5 000 r·min−1离心10 min收集菌体,PBS缓冲液洗涤3次。以PBS缓冲液调节乳酸菌浓度为1.0×109 CFU·mL−1,嗜水气单胞菌浓度为5.0×106 CFU·mL−1。设置4个处理组,每组3个平行,每个平行10尾鱼[空白对照组、S60组、S72组和嗜水气单胞菌(A.h)组]。对实验组每尾银鲫腹腔注射0.5 mL菌液,阴性对照组腹腔注射0.5 mL PBS缓冲液。每天定时检查实验鱼的死亡情况,持续观察96 h。96 h后将实验鱼捞出,麻醉 (MS-222 100 mg·mL−1) 检查鱼体,尾椎静脉取血,4 ℃、5 000 r·min−1离心10 min收集血浆供血液生化检测 (ALT、AST和LDH),剖检成活的实验鱼,观察内脏器官有无病变。
1.6 数据统计
实验数据差异性分析使用SPSS 24.0统计软件中的单因素方差分析 (One-Way ANOVA) 和独立样本t-检验分析,显著性水平设置为P<0.05。
2. 结果
2.1 生长曲线
乳酸菌S60和S72的生长曲线呈典型的“S”形,可以观察到明显的迟缓期、对数生长期和稳定期 (图1)。从S72生长曲线上可以发现其迟缓期约为6 h,S60的迟缓期约为9 h,明显长于S72。表明在相同培养条件下,S72具有更快的生长速度,这与菌落形态方面的结果一致。
2.2 产酸能力
发酵液pH检测结果显示,乳酸菌S60和S72这2株的产酸最大值均出现在培养第24小时附近,2株乳酸菌的产酸能力基本一致,最低pH均约4.0 (图2)。
2.3 压力耐受能力
耐酸实验结果显示乳酸菌S60和S72经pH为4.5的PBS处理2 h后均能成活,由此显示2株乳酸菌能耐受pH为4.5的酸性环境。胆盐耐受实验结果显示,乳酸菌S60和S72能完全耐受0.1%的胆盐浓度,而在胆盐浓度>0.2%时,其生长受到了一定程度的抑制,可以观察到明显的抑菌圈 (表1)。
表 1 乳酸菌对酸、胆盐的耐受能力Table 1 Acid and bile tolerance of two strains of lactic acid bacterian=3 pH 乳酸菌 lactic acid bacteria 胆盐/%
bile salt抑菌圈直径/mm inhibition zone diameter S60 S72 S60 S72 3.5 − − 0 8 8 4.5 + + 0.1 8 8 5.5 + + 0.2 12 12 7.4 + + 0.3 15 16 0.5 19 19 注:−. 无菌生长;+. 有菌生长
Note: −. bacteria can not grow; +. bacteria can grow2.4 抑菌物质检测
用嗜水气单胞菌作为指示菌,以1 mol·L−1 氢氧化钠 (NaOH)加热、胰蛋白酶和蛋白酶K分别处理发酵液上清作为实验组,未处理的发酵上清液为对照组,测定抑菌圈大小。结果显示,对照组有明显的抑菌圈,而实验组无。说明2株乳酸菌主要通过发酵过程中产生的有机酸 (低pH)实现了对嗜水气单胞菌的抑制作用。
2.5 抑菌活性
抑菌实验结果显示,2株乳酸菌均能不同程度地抑制6株指示菌的生长 (表2),其中对嗜水气单胞菌、维氏气单胞菌和创伤弧菌的抑菌能力最强,对副溶血弧菌的抑菌效果次之,对无乳链球菌和迟缓爱德华氏菌的抑菌能力最弱。2株乳酸菌在同一种病原菌中的抑菌效果差异不显著 (P>0.05),而同一乳酸菌菌株对不同病原菌的抑菌效果差异显著 (P<0.05)。
表 2 乳酸菌对鱼源致病菌的抑菌活性Table 2 Antimicrobial activity of two strains of lactic acid bacteria against six fish pathogens$\overline{{\mathit{\boldsymbol{ X }}}} {\bf \pm} {\bf{SD,}}\;{\mathit{\boldsymbol{n}}}{\bf = 5} $ 致病菌
pathogens抑菌圈直径/mm inhibition zone diameter S60 S72 嗜水气单胞菌 A. hydrophila 26.88±2.43b 24.9±1.48C 维氏气单胞菌 A. veronii 28.85±2.45b 28.25±2.46B 创伤弧菌 V. vulnificus 33.87±1.96a 35.6±1.07A 无乳链球菌 S. agalactiae 8.33±2.38d 9.7±0.96E 副溶血弧菌 V. parahemolyticus 15.23±0.78c 13.1±1.82D* 迟缓爱德华氏菌 E. tarda 9.23±2.42d 13.05±1.92D* 注:不同大小写字母表示2株乳酸菌分别针对不同病原菌的抑菌能力的差异显著(P<0.05);*. 2株乳酸菌对同一病原菌的抑菌能力差异显著(P<0.05)Note: Different letters indicate statistical difference in bacteriostatic ability of the same lactobacillus strain among different pathogenic bacteria (P<0.05); *. statistical difference in bacteriostatic ability of different lactobacillus strains on the same pathogenic bacteria (P<0.05) 2.6 安全性评价
划线接种血平板24 h后,2株乳酸菌形成的菌落周围无明显变化,阳性对照组 (嗜水气单胞菌) 菌落周围出现了明显的透明圈。第48小时菌落周围颜色变淡,无明显透明圈出现,阳性对照组的透明圈进一步增大 (图3)。体外溶血实验显示,2株乳酸菌发酵液的溶血率与对照组无显著差异,溶血率约5.0%,而嗜水气单胞菌发酵液引起的溶血率显著高于对照组 (P<0.05),溶血率约72.0% (图4)。由此可见2株乳酸菌不存在溶血相关的毒力因子,也不存在溶血方面的隐患。
2株乳酸菌接入明胶培养基培养48 h后,经4 ℃处理,与阴性对照组一样仍然保持凝固状态,而接种指示菌 (嗜水气单胞菌) 的阳性对照组呈液态 (图5)。由此显示2株乳酸菌均无降解明胶的能力,不存在相关风险。
药敏实验结果显示,2株乳酸菌总体上对硫酸卡那霉素、链霉素和磺胺甲唑耐药,对氨苄青霉素、恩诺沙星、氟苯尼考和多西环素敏感。然而通过进一步的比较分析则发现2株乳酸菌对2种氨基糖胺类抗生素耐药;但S72对2种氨基糖胺类抗生素的高浓度剂量仍有一定的敏感性,对恩诺沙星低浓度剂量则表现出完全耐受 (表3)。
表 3 2株乳酸菌的耐药特性Table 3 Results of antibiotic susceptibility test of two strains of lactic acid bacteria菌株
bacterial strain药物质量浓度/μg·mL−1 drug concentration S60 S72 抑菌圈直径/mm
inhibition zone diameter256 128 64 32 16 256 128 64 32 16 氨苄青霉素 ampicillin 30 26 24 20 17 40 35 32 30 28 硫酸卡那霉素 kanamycin 8 8 8 8 8 11 8 8 8 8 链霉素 streptomycin 8 8 8 8 8 12 9 8 8 8 恩诺沙星 enoxacin 26 21 19 17 10 19 16 13 8 8 氟苯尼考 flufenicol 32 29 26 20 15 34 29 25 24 18 盐酸多西环素 doxycycline 37 34 28 24 21 34 28 24 21 16 磺胺甲唑 sulfamethoxazole 8 8 8 8 8 8 8 8 8 8 生理盐水 physiological saline 8 8 8 8 8 8 8 8 8 8 鱼体攻毒后,S72组仅在第72小时出现了1尾死鱼,死亡鱼类注射部位有炎症和出血症状,体表其他部分也有广泛的出血现象。其他时间点并未出现死鱼现象。对照组和S60组在整个实验期间均无死鱼出现。阳性对照组在攻毒24 h后陆续出现死鱼的情况,在实验结束时的累计死亡率达46.67% (图6),且死亡鱼类在注射部位有炎症和出血现象,鱼体其他部位也有严重的出血现象。96 h后对存活的实验鱼进行检查,结果显示S60和S72组剩余的实验鱼体表在注射部位均有轻微的炎症迹象,而进一步解剖检查显示,鱼体腹腔无腹水存在,体内脏器无明显病变情况。
攻毒实验96 h后,鱼类血液生化检测结果显示S60和S72组鱼类血液ALT、AST和LDH 的水平和对照组无显著差异 (P>0.05,表4)。说明S60和S72攻毒并未造成鱼类组织损伤。而高达1.0×109 CFU·mL−1的细菌腹腔注射仅出现了1尾实验鱼的死亡,且第96小时血液生化检查结果显示剩余鱼类并未出现明显的组织损伤;与此同时嗜水气单胞菌以5.0×106 CFU·mL−1的浓度攻毒,却导致近50%的实验鱼死亡。由此可见,2株乳酸菌仍具有较高的安全性。
表 4 2株乳酸菌对银鲫血液生化指标的影响Table 4 Effects of two strains of lactic acid bacteria on blood biochemical index of C. auratus challenged with two lactic acid bacteriaU·L−1;n=5 项目
index对照组
control乳酸菌 lactic acid bacteria 嗜水气单胞菌组
A.hS60 S72 谷丙转氨酶 ALT 6.39±1.94 6.19±3.24 4.96±1.84 4.21±1.19 谷草转氨酶 AST 323.52±65.91 321.44±105.27 391±133.81 330.55±118.34 乳酸脱氢酶 LDH 116.53±38.97 88.54±43.39 65.14±37.26 73.35±31.90 3. 讨论
3.1 乳酸菌对鱼类肠道环境的适应性
消化道中的pH和胆盐对细菌繁殖生长具有抑制作用,因此益生菌在消化道中的益生作用与其对消化道环境的耐受能力密切相关。人类医学研究表明消化道pH受饮食组成影响,食物的存在能提高益生菌在胃内的成活率[13]。此外,将壳聚糖等生物高分子与菌剂混合应用也能显著提高益生菌在低pH条件下的成活率[14]。而现有资料显示有胃鱼类的胃内pH最低能达2[15],因此本研究中的2株乳酸菌需要辅以饵料、生物高分子或经过一段时间的耐酸驯化[13]才能更好地应用于有胃鱼类。而无胃鱼类,如鲤科鱼类,其消化道内pH近中性[10],因此本研究中的2株乳酸菌能适应其消化道pH。
胆汁能阻止细菌黏附到肠道黏膜的顶端,避免细胞损伤[6],但也对乳酸菌的生存产生了胁迫。本研究中的2株乳酸菌能耐受0.1%的胆盐,而参考海水鱼类数据,胆囊内胆盐含量在0.2%~1.0%,进入肠道会被进一步稀释[15]。并且胆盐质量浓度在0.03%~0.3%范围内波动的肠道环境,尚能分离到不耐受0.1%胆盐浓度的乳酸菌[13]。因此认为2株乳酸菌能耐受鱼类肠道中的胆盐环境。
3.2 乳酸菌的生长特性、产酸能力和抑菌活性物质
乳酸菌是目前公认的肠道有益微生物,大量研究显示乳酸菌对于肠道微生物群落稳定[14]、与人类[16]和水产养殖动物[4]的健康密切相关。虹鳟 (Oncorhynchus mykiss)[17]、凡纳滨对虾(Litopenaeus vannamei)[18]和海参 (Apostichopus japonicus)[19]等养殖实验均显示在日粮中添加乳酸菌能促进养殖动物的生长,提高抗病力和肠道内有害菌产生竞争,发挥保护肠道的作用[20]。本研究结果显示乳酸菌S72比S60的繁殖速度快,更易取得竞争优势,和其他细菌竞争肠道上皮细胞的黏附位点[4,21]、营养物质[8]以及减少病原菌的定植[22];此外,乳酸菌能通过产生乳酸[23-24]、细菌素、过氧化氢及小分子肽类等[20,25]代谢产物对肠道致病菌产生抑菌或杀菌作用,而快速繁殖的能力也意味着更多活性物质的产生,从而发挥更强的抑菌或杀菌效果。本研究结果显示2株乳酸菌产生的抑菌物质均为代谢过程中产生的有机酸类,与其他关于乳酸菌抑菌物质的研究结果[3,23]类似,并非每一株乳酸菌都能产生所有类型的抑菌物质,可见乳酸菌产生的抑菌物质种类和菌株、菌种有关。而Kiymaci等[23]发现乳酸菌所产生的有机酸对病原菌不仅有抑制效果,而且能削弱病原菌的毒力。此外,胞外的一些成分如多糖、蛋白等也具有改善机体免疫[26]和吸附肠道内有害物质[27]的能力,但这些潜在功能有待研究论证。
3.3 乳酸菌在水产动物中应用的安全性问题
溶血素是病原菌致病的重要毒力因子,研究表明溶血素不仅表现为溶解红细胞,其具备的穿孔能力、酯酶活性或表面活性作用能损伤多种细胞,诱发细胞凋亡甚至造成细胞裂解死亡[28]。而乳酸菌是一类能利用糖产生乳酸的细菌统称,其中某些种属具有溶血能力,如闫肃等[7]研究发现,所检视的48株乳酸菌中有9株具有溶血活性。因此,需要对候选益生菌的溶血能力进行检测,从而避免相关毒力的风险。本研究中2株乳酸菌溶血活性的检测结果显示,在血平板实验培养后期 (48 h) 乳酸菌菌落周围有颜色变淡的情况出现,与闫肃等[7]研究中将近68.75%的乳酸菌菌株 (检视菌株总数48株) 的溶血表型一致,因此认为这一现象与低pH相关,且在进一步的体外溶血实验中得到证实。由此可见,2株乳酸菌不产生溶血活性物质。
抗菌药物在保证人类和动物健康的同时[8],也带来了严重的耐药问题,现有资料显示,水产养殖动物主要细菌性病原的耐药现象普遍存在[1,29]。恩诺沙星、氟苯尼考、多西环素和磺胺甲唑是目前用于水产养殖动物细菌性疾病防治的主要药物[30]。鉴于乳酸菌可能涉及的青霉素类[31]、氨基糖苷类[32]和四环素类[33]的耐药基因及其耐药基因可转移的风险。本文结合药敏实验结果,首先排除了本研究中2株乳酸菌在恩诺沙星、氟苯尼考和多西环素耐药性转移方面的风险。而磺胺类药物的耐药现象是否和获得外源性耐药基因 (sul1、sul2和sul3)[33-34]相关需进一步研究。尤其是确认是否携带sul1耐药基因,因为该耐药基因的扩散传播与整合子相关,不仅水平转移概率高,而且拥有更广泛的宿主范围[35]。本研究明确了候选益生菌的耐药特性不仅能有效的规避耐药转移风险,且为科学用药提供指导意见。
在肠道菌群稳态失衡时,常常会出现细菌位移,出现非致病菌感染致病的结果[36]。虽然鲜有哺乳动物食源性乳酸菌引起疾病的报道[8],但应用到水产养殖动物中的一些菌株却暴露出一些安全隐患,如一株植物乳杆菌[37]在应用过程中对达氏鳇(Huso huso)[37]引起了组织损伤。因此,为评估2株乳酸菌潜在的条件致病风险,本研究采取腹腔注射的形式,以高达1.0×109 CFU·mL−1的浓度进行了动物攻毒实验。结果表明乳酸菌S60在整个养殖实验过程中未引起实验鱼的死亡;而乳酸菌S72仅导致了1尾实验鱼死亡 (死亡率3.33%),相较于浓度仅为5.0×106 CFU·mL−1的嗜水气单胞菌 (典型条件致病菌) 所造成将近50%的实验鱼死亡,2株乳酸菌的安全性仍然很高。并且在攻毒处理后96 h的血液生化分析结果表明,实验组鱼类和对照组鱼类在组织损伤方面并未表现出显著差异,由此可见,在第96小时实验鱼基本已恢复到正常状态。综上,2株乳酸菌具备抑制常见鱼类病原菌的能力,对银鲫无明显致病性,可作为银鲫口服益生菌开发的资源储备。
-
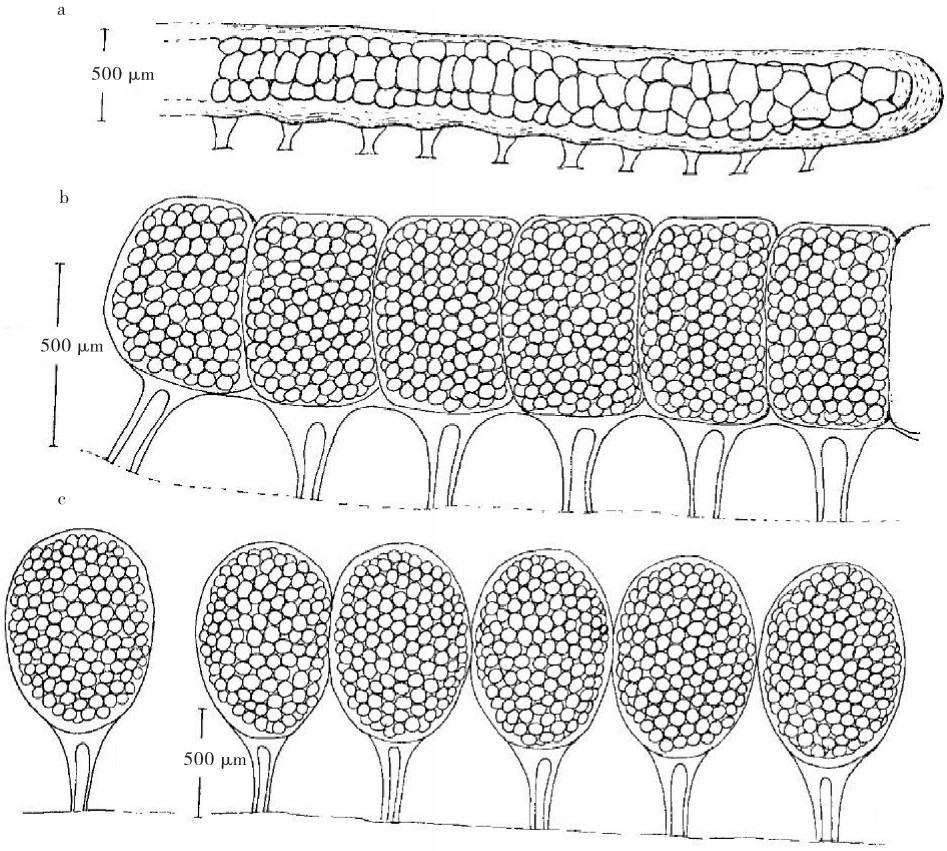
图 1 才女虫属复合体的3种卵袋类型[57]
a.第一种类型; b.第二种类型;c.第三种类型
Figure 1. Three types of egg capsules of Polydora Complex
a. Type 1;b. Type 2;c. Type 3
表 1 才女虫属复合体相关属名汇总
Table 1 List of related genera of Polydora Complex
时间year 命名者namer 属名genus 模式种type species 是否沿用still in use or not 1802 BOSE Polydora P.cornuta 是 1813 MONTAGU Diplotis D.hyalina 否 1838 JOHNSTON Leucodore L.ciliatus 否 1866 KINBER Perialla P.claparedei 否 1874 MOBIUS Leipoceras L.uviferum 否 1879 VERRILL Dipolydora D.concharum 是 1881 CZERNIAVSKY Pseudopolydora P.antennata 是 1881 CZERNIAVSKY Protopolydora P.hamata 否 1881 CZERNIAVSKY Pseudoleucodore P.caecum 否 1893 CARAZZI Boccardia B.polybranchia 是 1896 MESNIL Carazzia C.antennata 否 1914 AUGENER Polydorella P.prolifera 否 1954 BERKELEY Neopygospio N.laminifera 否 1964 WOODWICK Tripolydora T.spinosa 是 1973 RAINER Paraboccardia P.syrtis 否 1978 BLAKE Boccardiella B.hamata 是 1978 BLAKE Carazziella C.citrona 是 1983 BLAKE Amphipolydora A.abranchiata 是 1985 BUZHINSKAJA Neoboccardia N.perata 否 -
[1] WALKER L M. A review of the current status of the Polydora-complex (Polychaeta Spionidae) in Australia and a checklist of recorded species[J]. Zootaxa, 2011, 2751: 40-62. https://www.semanticscholar.org/paper/A-review-of-the-current-status-of-the-Polydora-in-a-Walker/c52ae7f4848f93a80e5327c0080afd1dcb879fa1
[2] EVANS J W. Borers in the shell of the sea scallop, Placopecten magellnnicus [J]. Amer Zool, 1969, 9 (3): 775-782. doi: 10.1093/icb/9.3.775
[3] HANDLEY S J, BERGQUIST P R. Spionid polychaete infestations of intertidal pacific oysters Crassostrea gigas (Thunberg), Mahurangi Harbour, northern New Zealand[J]. Aquaculture, 1997, 153 (3): 191-205. https://www.semanticscholar.org/paper/Spionid-polychaete-infestations-of-intertidal-gigas-Handley-Bergquist/0a508d3301f41753d18188efd3bef18940f3f137
[4] SATO-OKOSHI W, OKOSHI K, SHAW J. Polydorid species (Polychaeta: Spionidae) in south-western Australian waters with special reference to Polydora uncinata and Boccardia knoxi[J]. J Mar Biol Assoc UK, 2008, 88(3): 491-501. doi: 10.1017/S0025315408000842
[5] RIASCOS J M, HEILMAYER O, OLIVA M E, et al. Infestation of the surf clam Mesodesma donacium by the spionid polychaete Polydora bioccipitalis [J]. J Sea Res, 2008, 59 (4): 217-227. doi: 10.1016/j.seares.2008.01.003
[6] SEED R. The infestation of Mytilus edulis Linnaeus by Polydora ciliata (Johnston) in the Conwy Estuary, North Wales[J]. J Moll Stud, 1991, 57(4): 413-424. doi: 10.1093/mollus/57.4.413
[7] READ G B. Comparison and history of Polydora websteri and P. haswelli (Polychaeta: Spionidae) as mud-blister-worms in New Zealand shellfish[J]. New Zeal J Mar Fresh, 2010, 44(2): 83-100. doi: 10.1080/00288330.2010.482969
[8] 杨慧英, 吴开畅, 李有宁, 等. 海南新村港养殖合浦珠母贝主要多毛类寄生虫的流行病学调查[J]. 广东农业科学, 2012, 39(13): 170-173. doi: 10.3969/j.issn.1004-874X.2012.13.058 [9] ZHOU J, JI W, LI X. Records of Polydora complex spionids (Polychaeta: Spionidae) from China's coastal waters, with emphasis on parasitic species and the description of a new species[J]. Mar Fish, 2010, 32(1): 1-15. https://www.semanticscholar.org/paper/Records-of-Polydora-complex-spionids-(Polychaeta%3A-a-%E5%91%A8%E8%BF%9B-%E7%BA%AA%E8%96%87%E8%96%87/41cd012d2bc7cbb6978facf991210ab3bb74deed
[10] BOSC L A G. Histoire naturelle des vers, contenant leur description et leurs moeurs, avec figures dessinees d'apres nature[M]. Paris, France: Deterville, 1802, 1/2/3: 1-324. https://www.biodiversitylibrary.org/bibliography/9373
[11] MONTAGU G. An account of some new and rare marine British shells and animals[J]. Trans Linn Soc Lond, 1813, 11(2): 179-204. https://academic.oup.com/transactionslinnean/article-abstract/os-11/2/179/2374499
[12] JOHNSTON G. Miscellanea Zoologica Aricadae[J]. Mag Zool Botany Edinburgh, 1838, 2: 62-73. https://www.biodiversitylibrary.org/part/245175
[13] GRUBE A E. Die familien der Anneliden[J]. Archiv fur Naturgeschicht, 1850, 16: 249-364. https://www.biodiversitylibrary.org/bibliography/46818
[14] VERRILL A. Notice of recent additions to the marine invertebrata of the north-eastern coast of America, with descriptions of new genera and species and crucial remarks on others[J]. Proc US Nat Mus, 1879, 2: 165-205. doi: 10.5479/si.00963801.76.165
[15] CZERNIAVSKY V. Materialia ad zoographiam Ponticam comparatam. 3 Vermes[J]. Bulletin de la Societe Imperiale des Naturalistes, 1881, 56: 338-420. https://www.marinespecies.org/aphia.php?p=taxdetails&id=129621
[16] CARAZZI D. Revisione del genere Polydora Bosc e cenni su due specie che vivono sulle ostriche[J]. Mittheilungen aus der Zoologischen Station zu Neapel, 1893, 11: 4-45. https://www.semanticscholar.org/paper/Revisione-del-genere-Polydora-Bosc-e-cenni-su-due-Carazzi/a49a80b07ac0a64a452117d0878e766405676e04
[17] MESNIL F. Études de morphologie externe chez les annélides. I. Les spionidens des cotes de la manche[J]. Bulletin Scientifique de la France et de la Belgique, 1896, 29: 110-287. doi: 10.5962/bhl.part.19052
[18] MOORE J P. Descriptions of new species of spioniform annelids[J]. Proc Acad Nat Sci Philadelphia, 1907, 59(2): 195-207. https://research.si.edu/publication-details/?id=125559
[19] WILSON D P. The larvae of Polydora ciliata Johnston and Polydora hoplura Claparede[J]. J Mar Biol Assoc UK, 1928, 15(2): 567-603. doi: 10.1017/S0025315400009553
[20] OKUDA S. Spioniform polychaetes from Japan[J]. J Fac Sci Hokkaido Univ Ser (Series 6: Zoology), 1937, 5(3): 217-254. https://cir.nii.ac.jp/crid/1050282813967081856?lang=en
[21] LOOSANOFF V L, ENGLE J B. Polydora in oysters suspended in the water[J]. Biol Bull, 1943, 85(1): 69-78. doi: 10.2307/1538270
[22] WOODWICK K H. Comparison of Boccardia columbiana Berkeley and Boccardia proboscidea Hartman (Annelida, Polychaeta)[J]. Bull South Calif Acad Sci, 1963, 62: 132-139. https://www.semanticscholar.org/paper/Comparison-of-Boccardia-columbiana-Berkeley-and-Woodwick/7c542a23063093ae5b5c8660fed848c6874aeb43
[23] BLAKE J A. Family Spionidae Grube, 1850[J]. Taxonomic atlas of the benthic fauna of the Santa Maria Basin and Western Santa Barbara Channel, 1996, 6: 81-223. https://www.si.edu/object/siris_sil_471283
[24] BLAKE J A, MACIOLEK N J. A redescription of Polydora cornuta Bosc (Polychaeta: Spionidae) and designation of a neotype[J]. Bull Biol Soc Washington, 1987, 7: 11-15. https://www.semanticscholar.org/paper/A-redescription-of-Polydora-cornuta-Bosc-Spionidae)-Blake-Maciolek/2066971365d88cf3c77926f3dc2f5ffc36868999
[25] ANNENKOVA N V. Kurze Ubersicht der Polychaeten der Litoralzone der Bering-Insel (Kommandor-Inseln) nebst Beschreibung neuer Arten[J]. Zool Anz, 1934, 106(12): 322-331. https://bionames.org/references/34288789e5c41233b9dcf76615876e45
[26] BLAKE J A. Reproduction and larval development of Polydora from Northern New England (Polychaeta: spionidae)[J]. Ophelia, 1969, 7(1): 1-63. doi: 10.1080/00785326.1969.10419288
[27] RADASHEVSKY V I, PANKOVA V V. The morphology of two sibling sympatric Polydora species (Polychaeta: Spionidae) from the Sea of Japan[J]. J Mar Biol Assoc UK, 2006, 86(2): 245-252. doi: 10.1017/S0025315406013099
[28] ROUSSET V, PLEIJEL F, ROUSE G W, et al. A molecular phylogeny of annelids[J]. Cladistics, 2007, 23(1): 41-63. doi: 10.1111/j.1096-0031.2006.00128.x
[29] RICE S A, KARL S, RICE K A. The Polydora cornuta complex (Annelida: Polychaeta) contains populations that are reproductively isolated and genetically distinct[J]. Invertebr Biol, 2008, 127(1): 45-64. doi: 10.1111/j.1744-7410.2007.00104.x
[30] SIMON C A, THORNHILL D J, OYARZUN F, et al. Genetic similarity between Boccardia proboscidea from Western North America and cultured abalone, Haliotis midae, in South Africa[J]. Aquaculture, 2009, 294(1/2): 18-24. https://www.semanticscholar.org/paper/Genetic-similarity-between-Boccardia-proboscidea-in-Simon-Thornhill/78d54df94a689a9590350ccd2e683ac854cb3890
[31] SATO-OKOSHI W, ABE H. Morphological and molecular sequence analysis of the harmful shell boring species of Polydora (Polychaeta: Spionidae) from Japan and Australia[J]. Aquaculture, 2012, 368/369: 40-47. doi: 10.1016/j.aquaculture.2012.08.046
[32] SATO-OKOSHI W, ABE H. Morphology and molecular analysis of the 18S rRNA gene of oyster shell borers, Polydora species (Polychaeta: Spionidae), from Japan and Australia[J]. J Mar Biol Assoc UK, 2013, 93(5): 1279-1286. doi: 10.1017/S002531541200152X
[33] RADASHEVSKY V I, PANKOVA V V. Shell-boring versus tube-dwelling: is the mode of life fixed or flexible? Two cases in spionid polychaetes (Annelida, Spionidae)[J]. Mar Biol, 2013, 160(7): 1619-1624. doi: 10.1007/s00227-013-2214-8
[34] BLAKE J A. Revision of the genus Polydora from the east coast of North America (Polychaeta Spionidae)[J]. Smithson Contr Zool, 1971, 75: 1-32. https://repository.si.edu/handle/10088/5285
[35] BLAKE J A. Polychaetes of the family Spionidae from South America, Antarctica, and adjacent seas and islands[M]. American Geophysical Union: Antarctic Research Series (Biology of the Antarctic Seas XIV), 1983, 39: 205-287. doi: 10.1029/AR039p0205
[36] MACIOLEK N J. A new species of Polydora (Polychaeta: Spionidae) from deep water in the north-west Atlantic Ocean and new records of other polydorid species[J]. Sarsia, 1984, 69(2): 123-131. doi: 10.1080/00364827.1984.10420598
[37] SATO-OKOSHI W. Polydorid species (Polychaeta : Spionidae) in Japan, with descriptions of morphology, ecology and burrow structure. 2. Non-boring species[J]. J Mar Biol Assoc UK, 2000, 80(3): 443-456. doi: 10.1017/S0025315499002143
[38] SATO-OKOSHI W. Polydorid species (Polychaeta: Spionidae) in Japan, with descriptions of morphology, ecology and burrow structure. 1. Boring species[J]. J Mar Biol Assoc UK, 1999, 79(5): 831-848. doi: 10.1017/S0025315498001003
[39] READ G B. Systematics and biology of polydorid species (Polychaeta: Spionidae) from Wellington Harbour[J]. J Roy Soc New Zeal, 1975, 5(4): 395-419. doi: 10.1080/03036758.1975.10419361
[40] SATO-OKOSHI W, SUGAWARA Y, NOMURA T. Reproduction of the boring polychaete Polydora variegata inhabiting scallops in Abashiri Bay, North Japan[J]. Mar Biol, 1990, 104(1): 61-66. doi: 10.1007/BF01313158
[41] WILLIAMS J D, RADASHEVSKY V I. Morphology, ecology, and reproduction of a new Polydora species from the east coast of North America (Polychaeta: Spionidae)[J]. Ophelia, 1999, 51(2): 115-127. doi: 10.1080/00785326.1999.10409403
[42] RADASHEVSKY V I, HSIEH H L. Polydora (Polychaeta: Spionidae) species from Taiwan[J]. Zool Stud, 2000, 39(3): 203-217. https://www.semanticscholar.org/paper/Polydora-%28Polychaeta%3A-Spionidae%29-species-from-Radashevsky-Hsieh/6a17fda56b31ab53ae84ae26da868f7f26c590e7
[43] 姜卫国, 彭云辉, 谢玉坎. 合浦珠母贝多毛虫寄生病继发性脓疡(俗称"黑心肝病") 的研究Ⅲ. 凿贝才女虫的繁殖期, 附着高峰和附着过程的研究[M]//中国科学院南海海洋研究所珠贝文集. 北京: 科学出版社, 1984: 81-86. https://zh.z-lib.gs/book/30482383/ab650a/%E7%8F%8D%E7%8F%A0%E8%B4%9D%E6%96%87%E9%9B%86.html [44] 崔秀林. 扇贝养殖中黑壳病的发生和预防[J]. 河北渔业, 1995 (2): 16. https://www.doc88.com/p-0979787401292.html [45] 张树林, 李晓东, 刘青. 利氏才女虫幼虫对轮虫和河蟹蚤状幼体的影响[J]. 水产科学, 2002, 21(1): 14-16. https://doc.taixueshu.com/journal/20020072sckx.html [46] LLEONART M, HANDLINGER J, POWELL M. Spionid mudworm infestation of farmed abalone (Haliotis spp. )[J]. Aquaculture, 2003, 221(1/2/3/4): 85-96. https://www.semanticscholar.org/paper/Spionid-mudworm-infestation-of-farmed-abalone-spp.)-Lleonart-Handlinger/0261977fc128cd72bddaeac6241c68a8c7041125
[47] LANKESTER E R. On lithodomous Annelids[J]. Ann Mag Nat Hist, 1868, 1(4), 233-238. doi: 10.1080/00222936808695684
[48] MÍNTOSH W C. On the boring of certain Annelids[J]. Ann Mag Nat Hist, 1868, 2(10): 276-295. doi: 10.1080/00222936808695802
[49] WHITELEGGE T. Report on the worm disease affecting the oysters on the coast of New South Wales. Commissioners of Fisheries of New South Wales[J]. Rec Aust Mus, 1890, 1(2): 41-54. doi: 10.3853/j.0067-1975.1.1890.1224
[50] HANNERZ L. Larval development of the polychaete families Spionidae Sars, Disomidae Mesnil, and Poecilochaetidae n. fam. in the Gullmar Fjord (Sweden)[J]. Zoologiska bidrag från Uppsala, 1956, 31: 1-204. doi: 10.1023/A:1003784324125
[51] DORSETT D A. The behaviour of Polydora ciliata (Johnst. ). Tube-building and burrowing[J]. J Mar Biol Assoc UK, 1961, 41(3): 577-590. doi: 10.1017/S0025315400016167
[52] HAIGLER S A. Boring mechanism of Polydora websteri inhabiting Crassostrea virginica [J]. Amer Zool, 1969, 9(3): 821-828. doi: 10.1093/icb/9.3.821
[53] BLAKE J A, EVANS J W. Polydora and related Genera as borers in mollusk shells and other calcareous substrates: (Polychaeta: Spionidae)[J]. Veliger, 1973, 15(3): 235-249. https://www.researchgate.net/publication/279962050_Polydora_and_related_genera_Polychaeta_Spionidae_as_borers_in_mollusk_shells_and_other_calcareous_substrates
[54] DORSETT D A. The reproduction and maintenance of Polydora ciliata (Johnst. ) at Whitstable[J]. J Mar Biol Assoc UK, 1961, 41(2), 383-396. doi: 10.1017/S0025315400023985
[55] DAY R L, BLAKE J A. Reproduction and larval development of Polydora giardi Mesnil (Polychaeta: Spionidae)[J]. Biol Bull, 1979, 156(1): 20-30. doi: 10.2307/1541000
[56] GUÉRIN J P. Élevage de Spionides (Annélides, Polychètes) en cycle complet: 3. Description du développement larvaire de Boccardia semibranchiata[J]. Ann Inst Oceanogr, 1991, 67(2): 145-154.
[57] BLAKE J A, ARNOFSKY P L. Reproduction and larval development of the spioniform Polychaeta with application to systematics and phylogeny[J]. Hydrobiologia, 1999, 402: 57-106. doi: 10.1023/A:1003784324125
[58] STOCK M W. Anterior regeneration in Spionidae[D]. Connecticut, US: University of Connecticut, 1964: 91.
[59] GIBSON G D, PATERSON I G. Morphogenesis during sexual and asexual reproduction in Amphipolydora vestalis (Polychaeta: Spionidae)[J]. New Zeal J Mar Fresh, 2003, 37(4): 741-752. doi: 10.1080/00288330.2003.9517204
[60] BLAKE J A, KUDENOV J D. The Spionidae (Polychaeta) from southeastern Australia and adjacent areas with a revision of the genera[J]. Mem Natn Mus Vict, 1978, 39: 171-280. doi: 10.24199/j.mmv.1978.39.11
[61] TZETLIN A B, BRITAYEV T A. A new species of the Spionidae (Polychaeta) with asexual reproduction associated with sponges[J]. Zool Scripta, 1985, 14(3): 177-181. doi: 10.1111/j.1463-6409.1985.tb00188.x
[62] RADASHEVSKY V I. Morphology, ecology and asexual reproduction of a new Polydorella species (Polychaeta: Spionidae) from the South China Sea[J]. Bull Mar Sci, 1996, 58(3): 684-693. https://www.infona.pl/resource/bwmeta1.element.elsevier-f4916dab-bc5c-34cf-a117-6e9a8aed374b?locale=en
[63] BLAKE J A, WOODWICK K H. Reproduction and larval development of Pseudopolydora paucibranchiata (Okuda) and Pseudopolydora kempi (Southern) (Polychaeta: Spionidae)[J]. Biol Bull, 1975, 149: 109-127. doi: 10.2307/1540483
[64] BLAKE J A, KUDENOV J D. Larval development, larval nutrition and growth for two Boccardia species (Polychaeta Spionidae) from Victoria Australia[J]. Mar Ecol Prog Ser, 1981, 6: 175-182. doi: 10.3354/meps006175
[65] RADASHEVSKY V I. Life history of a new Polydora species from the Kurile Islands and evolution of lecithotrophy in polydorid genera (Polychaeta: Spionidae)[J]. Ophelia, 1994, 39(2): 121-136. doi: 10.1080/00785326.1994.10429539
[66] LEVIN L A, CREED E L. Effect of temperature and food availability on reproductive responses of Streblospio benedicti (Polychaeta: Spionidae) with planktotrophic or lecithotrophic development[J]. Mar Biol, 1986, 92(1): 103-113. doi: 10.1007/BF00392752
[67] RADASHEVSKY V I, FAUCHALD K. Chaetal arrangement and homology in spionids[J]. Bull Mar Sci, 2000, 67(1): 13-23. https://www.ingentaconnect.com/content/umrsmas/bullmar/2000/00000067/00000001/art00003
[68] NEL R, COETZEE P S, NIEKERK G V. The evaluation of two treatments to reduce mud worm (Polydora hoplura Claparede) infestation in commercially reared oysters (Crassostrea gigas Thunberg)[J]. Aquaculture, 1996, 141(1): 31-39. https://www.semanticscholar.org/paper/The-evaluation-of-two-treatments-to-reduce-mud-worm-Nel-Coetzee/66572eeab0d45dd5c1d462cdce34a5eda9a763c3
[69] MORTENSEN S, MEEREN T, FOSSHAGEN A, et al. Mortality of scallop spat in cultivation, infested with tube dwelling bristle worms, Polydora sp. [J]. Aquac Int, 2000, 8(2/3): 267-271. doi: 10.1023/A:1009287706756
[70] 高燕. 才女虫生物学特征及其寄生行为的基础研究[D]. 青岛: 中国科学院海洋研究所, 2013. [71] BILBAO A, NUNEZ J, VIERA M D, et al. Control of shell-boring polychaetes in Haliotis tuberculata Coccinea (Reeve 1846) aquaculture: species identification and effectiveness of Mebendazole[J]. J Shellfish Res, 2011, 30(2): 331-336. doi: 10.2983/035.030.0219
[72] LLEONART M, HANDLINGER J, POWELL M. Treatment of spionid mud worm (Boccardia knoxi Rainer) infestation of cultured abalone[J]. Aquaculture, 2003, 217(1/2/3/4): 1-10. https://europepmc.org/article/AGR/IND23330249
-
期刊类型引用(19)
1. 姜芳燕,谢浪萍,杨宁,黄海. 金鲳鱼肠炎病的病原菌分离鉴定及其中草药防治. 信阳师范学院学报(自然科学版). 2024(02): 228-233 .  百度学术
百度学术
2. 张婷,王瑞旋,孙敬锋,黄嘉健,林小植,周飞,马细兰. 哈维弧菌对皱纹盘鲍不同组织内细菌群落结构的影响. 热带海洋学报. 2023(01): 56-65 .  百度学术
百度学术
3. 范嗣刚,孙珍珠,郭靖,吴昊,邓维德,李翔,黎源,陈燕飞,文菁. 日本对虾IKKβ基因克隆及其表达分析. 南方农业学报. 2023(06): 1837-1846 .  百度学术
百度学术
4. 滕爽爽,张炯明,张利兵,谢尚庶,王瑶华,肖国强,杨千元,方军. 泥蚶致病性哈维氏弧菌的分离与鉴定. 水产科学. 2022(04): 547-555 .  百度学术
百度学术
5. 陈秀程,王江勇,孙敬锋. 盐度对哈维弧菌耐药性的影响及耐药基因gyrB的表达实验研究. 生态科学. 2022(06): 123-129 .  百度学术
百度学术
6. 王楠,尹纪元,王英英,李莹莹,吴斯宇,石存斌,李家豪,曹际振,王庆. 草鱼源乳酸菌的分离鉴定及其生物学特性研究. 南方水产科学. 2021(06): 74-84 .  本站查看
本站查看
7. 何嘉乐,叶仕根,赵小然. 哈维氏弧菌生物膜生成的影响因素研究进展. 水产养殖. 2021(12): 12-17 .  百度学术
百度学术
8. 魏文娟,赵姝,王元,周俊芳,李新苍,房文红. 副溶血弧菌养殖对虾分离株耐药性及耐药基因分析. 南方水产科学. 2020(01): 9-16 .  本站查看
本站查看
9. 刘晓靖,王瑞旋,凌慧,姚托,王江勇. 方斑东风螺“急性死亡症”病原及其毒力基因研究. 海洋环境科学. 2019(01): 7-15 .  百度学术
百度学术
10. 林彦伶,梁枫,胡高垚,韦孟咪,许士兰,龙文芳. 亚抑菌浓度抗生素对海水浴场来源肺炎克雷伯菌的接合及intI突变影响. 中国卫生检验杂志. 2019(04): 389-392+399 .  百度学术
百度学术
11. 赵小慧,苏洁,樊景凤,马悦欣. 海洋环境中细菌耐药性研究进展. 中国抗生素杂志. 2019(04): 406-412 .  百度学术
百度学术
12. 陈凯,朱璐丹,谭宏亮,黄东宇,习丙文,潘良坤,谢骏. 2株乳酸菌抑菌作用研究及安全性评价. 南方水产科学. 2019(05): 118-125 .  本站查看
本站查看
13. 纪佳丽,刘广锋,冯娟,杨文斌,管淑玉. 广藿香对耐药哈维氏弧菌生物膜形成及相关基因的影响研究. 广东药科大学学报. 2018(02): 239-243 .  百度学术
百度学术
14. 黄艳华,马沙,韩书煜,黄伟德,韦慕兰,蒙兰丽,吕小丽,覃惠明,李德壮,梁静真,黄钧. 2011~2016年广西罗非鱼源无乳链球菌的耐药谱型分析. 南方农业学报. 2018(05): 1023-1031 .  百度学术
百度学术
15. 贝蕾,苏友禄,赵超,徐力文,刘广锋,王雨,郭志勋,冯娟. 哈维弧菌rbsB基因的克隆与表达. 南方水产科学. 2018(02): 75-82 .  本站查看
本站查看
16. 李富祥,王鹏飞,闫路路,邱丽华. 花鲈irak4基因cDNA的克隆与表达分析. 南方水产科学. 2018(05): 70-79 .  本站查看
本站查看
17. 钟志鸿,王菲,陈永贵,邓恒为,王世锋,孙云,陈雪芬,郭伟良,周永灿. 基于响应面法分析乌梅和抗生素对哈维氏弧菌的协同抑制作用. 南方水产科学. 2018(06): 81-88 .  本站查看
本站查看
18. 刘开放,步君,章翔,谢珍玉. 华南地区海水养殖水域中哈维氏弧菌的抗药性分析. 海南大学学报(自然科学版). 2017(02): 131-139 .  百度学术
百度学术
19. 蒋魁,徐力文,苏友禄,马红玲,刘广锋,郭志勋,高芳,冯娟. 两株珍珠龙趸病原性哈维弧菌(Vibrio harveyi)的分离与鉴定. 生态科学. 2017(06): 16-24 .  百度学术
百度学术
其他类型引用(7)




 下载:
下载:






 粤公网安备 44010502001741号
粤公网安备 44010502001741号
