Loop-mediated isothermal amplification for detection of Aeromonas hydrophila and A.sobria
-
摘要:
利用环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)分别建立嗜水气单胞菌(Aeromonas hydrophila,AH)与温和气单胞菌(A.sobria,AS)的快速检测方法。针对嗜水气单胞菌pilin基因、温和气单胞菌zipA基因设计特异性LAMP引物。在恒温条件下利用实时浊度仪对2组引物进行特异性和灵敏度试验,并以琼脂糖凝胶电泳和核酸染料颜色变化对扩增结果进行判定。结果显示,LAMP实时浊度法能够特异地检测嗜水气单胞菌和温和气单胞菌,最低检出限分别为46 fg·mL-1和320 fg·mL-1,是普通PCR方法的104倍和102倍;并能应用于已知临床样品检测。该研究建立的嗜水气单胞菌与温和气单胞菌LAMP快速检测方法具有高效、特异、灵敏的特点。
Abstract:The study established a loop-mediated isothermal amplification (LAMP) technology for Aeromonas hydrophila and A.sobria. We designed the primers based on the sequences of the pilin gene of A.hydrophila and the zipA gene of A.sobria, respectively, and conducted specificity and sensitivity tests by real-time turbidimeter under isothermal conditions, which were detected by agarose gel electrophoresis test and change of SYBR Green I colour. The results show that the LAMP method was effective for rapid detection of A.hydrophila and A.sobria with limit of detections of 46 fg·mL-1 and 320 fg·mL-1, 104 and 102 times more sensitive than the conventional PCR, respectively. In conclusion, the LAMP detective method for A.hydrophila and A.sobria which we established was specific, sensitive, effective and rapid.
-
近岸水域由于其独特的地理位置及水环境特征,是海洋与陆地相互作用和海洋生物多样性保护研究的重要水域[1]。近年来,由于人类活动和海洋环境变化等,直接导致了近岸水域渔业资源的衰退,优质鱼比例下降,低质鱼成了主要捕捞对象,以及个体减小、性成熟提前等[2]。因此,人类干扰对渔业资源群落的影响越来越受到海洋渔业专家及生态专家的关注。
张网是南海近岸渔业的重要定置渔具,研究张网渔业资源群落有助于制定中国海洋渔具管理决策,特别是对于促进《全国海洋捕捞渔具目录》的实施具有重要意义。目前,已有部分学者对张网的作业概况、网目选择性、渔获组成多样性及渔业资源群落结构等进行了研究[2-9],并探讨了一系列分析群落变化的方法和指标[10]。粒径谱理论就是其中的一种重要方法,是由SHELDON和PARSONS首次提出的[11]。该理论已广泛应用于浮游生物、底栖生物、微型生物的群落特征分析及鱼类的潜在产量估算等方面[12-18]。因此,该研究利用黄茅海河口近岸休渔前后(春季和夏季)的张网调查资料,采用数量生物量比较曲线(abundance-biomass comparison curves,ABC曲线)和生物量谱方法对张网渔业资源群落状况进行了分析,以期有助于南海近岸渔业资源的合理开发和可持续利用。
1. 材料与方法
1.1 数据来源
数据来源于2015年休渔前后(春季和夏季)在珠江口沿岸新会崖门的黄茅海河口开展的张网调查,经纬度为113°06′ E,22°08′ N。休渔前(春季)调查时间为2015年4月16日~27日,有效网次为15网次;休渔后(夏季)航次时间为2015年8月19日~31日,有效网次为12网次。
调查渔船为“粤新会41008”船,木质,船长12.00 m,型宽2.85 m,型深0.83 m,总吨位8.0 GT,净吨位3.0 t,主机功率19.4 kW,2台,每台9.7 kW,携带张网4顶,船上还配备避碰仪、GPS导航仪等设备。
该张网属于双桩竖杆张网,是一种由双桩固定,由竖杆使网口垂直张开的单囊张网,主要张设于沿岸鱼虾类繁育的场所或近海鱼类的洄游通道,是依靠海流将捕捞对象裹挟进入网具达到捕捞目的的被动性网具。其网具主尺度为:40.00 m×67.89 m,即结附网衣的网口纲周长为40.00 m,网衣的纵向拉直总长为67.89 m。网衣展开图如图 1所示。每个网次作业时长约2.5 h。起网后对渔获物进行抽样,取1/8进行种类鉴定、分类计数、称重,并对渔获进行生物学测定,体长、甲宽等以mm为单位,体质量以g为单位。所有样品个体鉴定到种,体质量精确到0.1 g。
1.2 数据处理
1.2.1 物种优势度
采用相对重要性指数(index of relative importance,IRI)来评价渔获种类的优势种,IRI≥1 000为优势种,100≤IRI<1 000为重要种,10≤IRI<100为常见种,IRI<10为少见种[19-20],其计算公式为[19-20]:
$$ \mathrm{IRI}=(N \%+W \%) \times F \% $$ 其中N%表示某种渔获种类的尾数百分比;W%表示生物量百分比;F%表示出现频率百分比。
为进一步分析春夏两季渔获种类组成及每个种类的相对生物量差异,根据平均网次生物量经过平方根转换计算得到Bray-Curtis相似系数矩阵,采用相似性分析(ANOSIM)进行休渔前后(春季和夏季)的渔业资源群落结构差异的显著性检验[21]。
1.2.2 ABC曲线
采用ABC曲线方法来分析渔业资源群落受人类干扰情况,该方法是1986年由WARWICK[22]提出的,是通过在同一坐标系中比较数量优势度曲线和生物量优势度曲线来分析群落在不同干扰状况下的特征[10, 23]。ABC曲线方法反映了r选择和k选择的传统进化的理论背景。在未受干扰(稳定)的状态下,群落主要是以k选择种类(生长慢、性成熟晚的大个体种类)为主,生物量优势度曲线位于数据优势度曲线之上。随着干扰的增加,k选择物种的生物量(或数量)逐渐减少,r选择物种的生物量(或数量)则逐渐增加,当处于中等干扰(或不稳定)的状态时,两条曲线将相交;当群落逐渐变为由r选择的物种(生长快、个体小的种类)为主,此时生物量的优势度曲线在数量优势度曲线之下,则表明群落处于严重干扰的(不稳定)状态[9-10, 23]。
用W值表示ABC曲线中生物量和丰度的相对关系统计量[9-10]:
$$ W=\sum\limits_{i=1}^s \frac{\left(B_i-A_i\right)}{50(S-1)} $$ 式中Bi和Ai为ABC曲线中种类序号对应的生物量和数量的累积百分比,S为出现物种数。
1.2.3 生物量谱
生物量谱是粒径谱理论的变形[14]。随着粒径谱理论的发展,新的粒径谱理论模型相继提出,各种新的粒径谱表示方法也不断革新。P-D模型就是其中的典型模型之一,由PLATTER和DENMAN提出[24],该方法是以对数化生物量为纵坐标,对数化粒径为横坐标所得到的谱线,称为非标准化生物量谱。并提出标准化生物量的概念,某一粒径级的生物量与该粒径级宽度的比值,就称为标准化的生物量。
采用生物量谱方法分析生物量与平均个体质量之间的关系,先计算每个渔获种类的平均体质量(wi),并对其取对数,然后将对数化的平均体质量进行分组,以1 g为单位区间间隔,计算各个区间的总生物量,以对数化的平均个体体质量为x轴,以对数化的各个区间总生物量为y轴,线性回归后可以得到一条直线谱线[12]。谱线的斜率和截距分别表示群落的粒径结构和生物丰度。稳定状态下的生物群落标准化粒径谱是一条斜率为-1的直线,即生物量随着体质量的增加均匀分布;如果斜率大于-1,则生物量随着体质量的增加而增加;如果斜率小于-1,生物量随着体质量的增加而减少[13-14]。
2. 结果
2.1 渔获组成
共捕获渔获种类56种,其中鱼类47种,隶属于1纲12目27科38属;虾类5种,隶属于1纲1目2科3属;虾姑类1种,隶属于1纲1目1科1属;蟹类3种,隶属于1纲1目2科3属。春季捕获渔获种类44种,夏季40种,其中共同种28种。春季张网渔获优势种为凤鲚(Coilia mystus)、红狼牙



 表 1 黄茅海河口张网优势种组成Table 1. Dominant species of stow-net in Huangmaohai Estuary
表 1 黄茅海河口张网优势种组成Table 1. Dominant species of stow-net in Huangmaohai Estuary渔获种类species 春季spring 夏季summer F/% N/% W/% IRI F/% N/% W/% IRI 斑点鸡笼鲳Drepane punctata 6.67 0.02 0.06 0.51 - - - - 斑 
46.67 0.35 1.67 94.26 75.00 1.09 1.90 224.39 斑头舌鳎Cynoglossus puncticeps 20.00 0.31 0.13 8.80 8.33 0.02 0.02 0.32 赤鼻棱鳀Thrissa kammalensis - - - - 58.33 1.47 2.65 240.84 大甲 
- - - - 8.33 0.01 0.05 0.57 弹涂鱼Periophthalmidae cantonensis - - - - 8.33 0.03 0.04 0.54 刺鲳Psenopsis anomala 6.67 0.02 0.02 0.28 - - - - 聪明关公蟹Dorippe astuta 26.67 0.35 0.10 11.82 - - - - 粗吻海龙Trachyrhamphus serratus 6.67 0.02 0.01 0.16 - - - - 大鳞舌鳎Cynoglossus macrolepidotus 6.67 0.02 0.63 4.31 - - - - 带鱼Trichiurus lepturus 13.33 0.04 0.14 2.31 - - - - 刀额新对虾Metapenaeus ensis 86.67 2.12 1.27 293.83 91.67 1.66 0.78 223.82 杜氏叫姑鱼Johnius dussumieri 66.67 0.53 0.85 91.94 - - - - 杜氏棱鳀Thryssa dussumieri 46.67 0.18 0.24 19.97 - - - - 短吻蛇鳗Ophichthus brevirostris 6.67 0.02 0.01 0.20 - - - - 短吻新银鱼Neosalanx brevirostris 13.33 0.05 0.02 0.97 - - - - 多鳞 
6.67 0.02 0.03 0.36 25.00 0.08 0.25 8.31 凤鲚Coilia mystus 100.00 36.51 54.83 9 133.79 100.00 31.70 45.08 7 678.42 弓斑东方鲀Takifugu ocellatus 80.00 4.89 1.94 546.83 41.67 0.07 0.74 33.67 海南 
- - - - 8.33 0.01 0.01 0.15 海鳗Muraenesox cinereus 13.33 0.04 0.62 8.80 - - - - 海鲶Ariussinensis Lacepede 40.00 0.16 0.26 16.96 58.33 0.55 1.13 97.79 褐斑三线舌鳎Cynoglossus trigrammus 80.00 1.48 0.74 177.79 58.33 0.16 0.19 20.63 黑尾吻鳗Rhynchoconger ectenurus 20.00 0.05 0.06 2.37 - - - - 红狼牙虎鱼 
100.00 25.44 19.23 4 467.24 91.67 7.09 11.22 1 678.19 花 
33.33 0.13 0.56 22.93 - - - - 黄斑鲾Leiognathus bindus 66.67 0.37 0.29 43.78 91.67 5.22 2.78 733.51 黄斑蓝子鱼Siganus oramin 6.67 0.02 0.07 0.57 16.67 0.04 0.08 1.89 黄鳍鲷Sparus latus 6.67 0.02 0.03 0.33 - - - - 棘头梅童鱼Collichthys lucidus 60.00 0.46 2.16 156.80 91.67 2.33 6.09 771.42 脊突猛虾蛄Harpiosquilla raphidea 53.33 0.42 0.54 51.23 8.33 0.01 0.02 0.24 脊尾白虾Exopalaemon carinicauda 100.00 10.15 2.81 1 296.13 91.67 3.70 1.00 431.06 尖吻蛇鳗Ophichthus apicalis 13.33 0.05 0.08 1.76 8.33 0.01 0.01 0.13 近缘新对虾Metapenaeus affinis - - - - 8.33 0.01 0.02 0.25 居氏银鱼Salanx cuvieri 60.00 1.01 0.29 77.82 33.33 0.09 0.06 4.98 锯缘青蟹Scylla serrata - - - - 8.33 0.01 0.28 2.41 康氏小公鱼Anchoviella commersonii 46.67 0.82 0.57 65.15 100.00 32.08 13.75 4 583.75 孔 
80.00 3.19 1.28 357.28 41.67 0.25 0.38 25.91 鳓Ilisha elongata 6.67 0.02 0.22 1.61 41.67 0.16 0.48 26.48 丽叶鲹Caranx kalla - - - - 75.00 5.53 5.21 805.43 粒突鳞鲬Onigocia tuberculatus 46.67 0.31 0.10 19.13 50.00 0.14 0.14 14.33 龙头鱼Harpodon nehereus - - - - 41.67 0.29 0.27 23.18 矛尾 
86.67 2.40 0.72 270.09 91.67 0.80 1.04 169.13 皮氏叫姑鱼Johnius belengeri - - - - 75.00 0.38 0.48 64.78 乳香鱼Lactarius lactarius - - - - 41.67 0.74 0.23 40.65 少鳞 
- - - - 8.33 0.01 0.01 0.16 四指马鲅Eleutheronema tetradactylum - - - - 8.33 0.01 0.26 2.25 纹缟 
93.33 0.88 0.46 124.92 25.00 0.04 0.03 1.69 享氏仿对虾Parapenaeopsis hungerfordi 20.00 0.07 0.03 2.06 - - - - 硬头骨鲻Osteomugil strongylocephalus 53.33 0.70 0.61 69.80 50.00 0.21 0.74 47.33 圆颌针鱼Tylosurus melanotus 6.67 0.04 0.08 0.77 8.33 0.06 0.15 1.70 直额鲟Charybdis truncate 86.67 2.99 2.57 481.85 - - - - 中华青鳞鱼Harengula nymphaca 80.00 1.59 3.00 367.34 91.67 0.76 1.14 174.22 中华小公鱼Stolephorus chinensis 6.67 0.15 0.11 1.68 25.00 0.21 0.08 7.16 中线天竺鲷Apogon kallopterus 60.00 1.28 0.38 99.97 83.33 0.72 0.46 98.85 周氏新对虾Metapenaeus joyneri 46.67 0.31 0.19 23.29 75.00 2.25 0.74 224.73 2.2 ABC曲线
春夏两季渔业资源群落的ABC曲线见图 2。春季渔业资源群落的数量优势度曲线与生物量的优势度曲线相交,处于中等干扰状态,其根据ABC曲线计算的W统计值为-0.015;夏季渔业资源群落的数量优势度曲线在生物量优势度曲线之上,处于严重干扰状态[10],其根据ABC曲线计算的W统计值为-0.046。表明该海域的渔业资源群落中,小型个体或大型鱼类的幼体占绝对优势,且春季该海域的渔业资源群落结构优于夏季。
春季数量百分比排在前5位的渔获分别为凤鲚、红狼牙



夏季数量百分比排在前5位的渔获分别为康氏小公鱼、凤鲚、红狼牙



2.3 生物量谱
春夏两季标准化生物量谱线性回归分析见图 3,回归方程分别为y=-0.698 3x+10.056(R2= 0.454 1)和y=-1.157 6x+11.483(R2=0.771 5)。春季标准化生物量谱线性回归的斜率大于-1,说明春季张网渔业资源群落的生物量随着体质量的增加不呈均匀分布,而是随着体质量的增加生物量也增加;夏季标准化生物量谱线性回归的结果与春季差异较大,其斜率小于-1,说明夏季张网渔业资源群落的生物量随着体质量的增加而减少,其相关系数R2值也明显高于春季。
从生物量随个体平均体质量的变化来看(图 4),春夏两季生物量随着个体平均体质量的增加不呈规律分布,不同个体体质量区间的生物量比例差异较大,小个体鱼种的生物量比例相对较高,其中凤鲚所占生物量百分比跨度最高。春季体质量小于10 g的生物量比例达到33.91%,小于20 g的生物量比例达到93.88%,以个体体质量在10~20 g的生物量比例最高;夏季个体体质量小于10 g的生物量比例达到90.93%,以个体体质量小于10 g的生物量占绝对优势。对比春夏两季渔获的个体体质量,可以看出春季渔获的平均个体体质量明显高于夏季。
3. 讨论
张网由于其良好的作业性能和较高的经济效益,目前仍然是中国近海一种重要的作业方式。该研究以张网为研究对象,其原因为:1)张网是在无外界干扰情况下,使渔获物被潮流裹挟入网,渔法上选择性较小,更接近自然分布[25],以该网具研究该海域的渔业资源群落结构更加合理;2)张网目前属于过渡渔具,而专家对其今后划分为准用渔具还是禁用渔具意见不一,该研究提供的基础数据有助于更加准确地把握该种渔具的捕捞现状。
研究显示,ABC曲线特征反映了群落中大型种类和小型种类相对数量的变化以及个体大小组成的变化[23, 26]。珠江口近岸张网渔业资源群落不同季节ABC曲线特征有所差异,春季渔业资源群落的数量优势度曲线与生物量的优势度曲线相交,处于中等干扰状态,而夏季渔业资源群落的数量优势度曲线在生物量优势度曲线之上,处于严重干扰状态。表明该海域的渔业资源群落中,小型个体或大型鱼类的幼体占绝对优势。研究显示休渔对保护经济种类及其幼鱼、幼体的繁衍生长能起到一定的作用[10, 25, 27]。从调查时间来看,春夏两次调查正好是伏季休渔的前后,但是从夏季渔业资源群落的状况来看,休渔在过度捕捞下并没有达到预期效果,主捕对象的比例以及个体体质量反而不如春季。另外该张网作业主要集中于春夏秋3个季节作业,在冬季作业次数少,渔业资源能得到一定程度上的恢复,且该夏季渔获调查并未在休渔结束后立马进行,故存在一定的差异。
生物量谱是生物个体大小的分布模式,是能量在生物群落中的分布[28]。研究显示,捕捞能够影响鱼类粒径谱,捕捞死亡可以导致粒径谱斜率下降,反映了大型鱼类的减少[29-30];反之,鱼类粒径谱也可以反映捕捞的影响,探测该资源群落是否处于过度开发状态[31]。标准化生物量谱线性回归分析结果显示夏季渔业资源群落生物量谱斜率下降,说明该海域张网渔业已处于过度捕捞状态。且从生物量随个体体质量的分布来看,春夏两季种类组成中小个体的比例都非常高,春季以个体体质量在10~20 g的生物量比例最高(59.97%);夏季个体体质量小于10 g的生物量比例达到90.93%。这些小个体的种类包括凤鲚、红狼牙


近岸水域由于其水环境条件的变化,导致群体优势种和一些种类的交替变化[32]。该张网主要在阴历初一和十五前后作业,受月相影响较大。且由于资料的缺失和调查条件的限制,未能从年间变动以及全年序列来分析该海域的渔业资源群落特征,具有一定的局限性。在今后的研究工作中,应加强连续性,并加强对环境因子的影响研究。
-
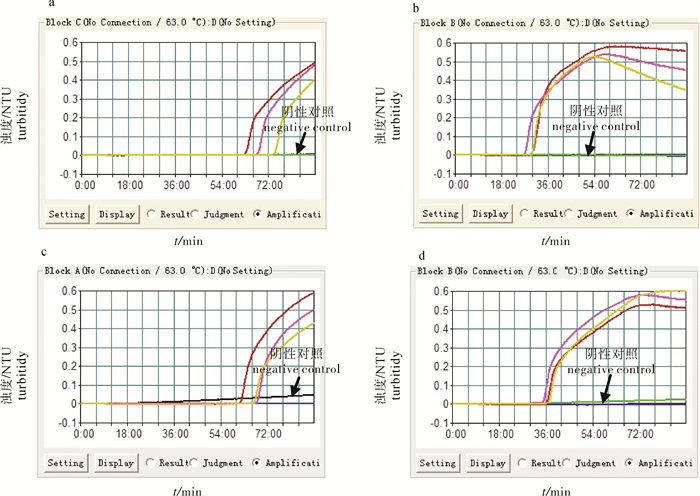
图 1 LAMP环引物的加速试验
a. 未加环引物的嗜水气单胞菌LAMP反应;b. 加入环引物的嗜水气单胞菌LAMP反应;c. 未加环引物的温和气单胞菌LAMP反应;d. 加入环引物的温和气单胞菌LAMP反应
Figure 1. Influence of loop-primers for LAMP reaction process
a. AH LAMP reaction without loop primers; b. AH LAMP reaction with loop primers; c. AS LAMP reaction without loop primers; d. AS LAMP reaction with loop primers
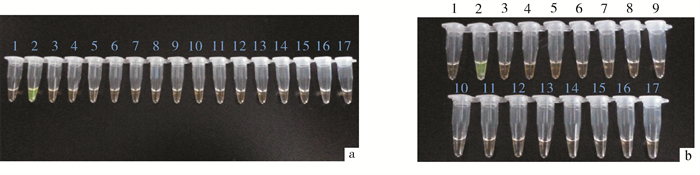
图 2 LAMP特异性试验
a. 嗜水气单胞菌引物LAMP特异性试验;b. 温和气单胞菌引物LAMP特异性试验
1. 阴性对照;2a. 嗜水气单胞菌;2b. 温和气单胞菌;3a. 温和气单胞菌;3b.嗜水气单胞菌;4. 维氏气单胞菌;5. 豚鼠气单胞菌;6. 大肠埃希氏菌;7. 迟缓爱德华氏菌;8. 无乳链球菌;9. 海豚链球菌;10. 金黄色葡萄球菌;11. 霍乱弧菌;12. 蜡样芽胞杆菌;13. 痢疾志贺氏菌;14. 肺炎克雷伯杆菌;15. 铜绿假单胞菌;16. 弗氏柠檬酸杆菌;17. 摩氏摩根菌Figure 2. Specificity test of LAMP
a. specificity test of A.hydrophila; b. specificity test of A.sobria
1. negative control; 2a.A.hydrophila; 2b. A.sobria; 3a.A.sobria; 3b.A.hydrophila; 4. A.veronii; 5. A.caviae; 6. E.coli; 7. E.tarda; 8. S.agalactiae; 9. S.iniae; 10. S.aureus; 11. V.cholerae; 12. B.cereus; 13. S.dysenteriae; 14. K.pneumoniae; 15. P.aeruginosa; 16. C.frenudii; 17. M.morganii图 4 LAMP和PCR灵敏度灵敏度试验
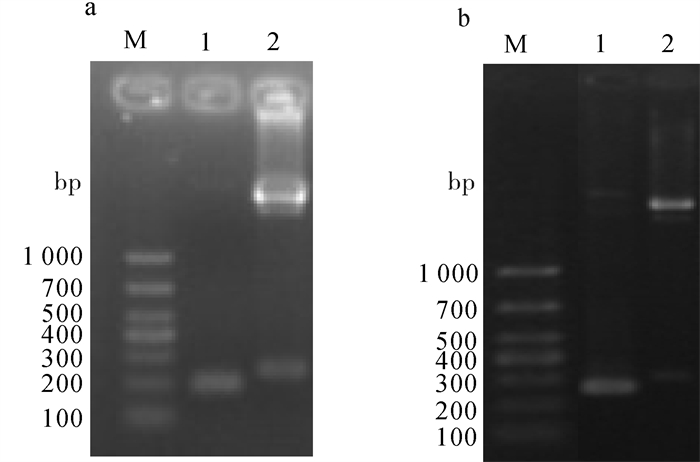
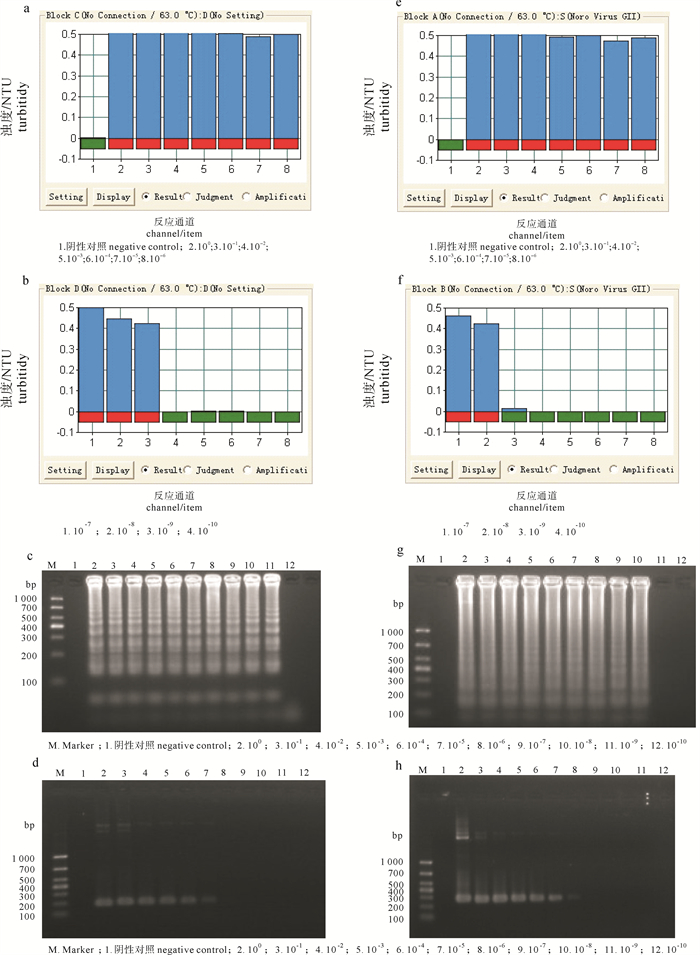
a~b. 嗜水气单胞菌LAMP灵敏度试验;c. 嗜水气单胞菌LAMP灵敏度凝胶电泳图;d. 嗜水气单胞菌PCR灵敏度凝胶电泳图;e~f. 温和气单胞菌LAMP灵敏度试验;g. 温和气单胞菌LAMP灵敏度凝胶电泳图;h. 温和气单胞菌PCR灵敏度凝胶电泳图
Figure 4. Sensitivity test of LAMP and PCR
a~b. sensitivity test of A.hydrophila; c. sensitivity test of agarose gel electrophoresis of LAMP of A.hydrophila; d. sensitivity test of agarose gel electrophoresis of PCR of A.hydrophila; e~f. sensitivity test of A.sobria; g. sensitivity test of agarose gel electrophoresis of LAMP of A.sobria; h. sensitivity test of agarose gel electrophoresis of PCR of A.sobria
图 5 嗜水气单胞菌的pilin引物、温和气单胞菌的zipA引物检测已知的临床样品
a. 实时浊度图(AH);b. 核酸染料图(AH);c. 实时浊度图(AS);d. 核酸染料图(AS);1.阴性对照;2.嗜水气单胞菌(KQ2010522);3.嗜水气单胞菌(BF20120816);4.嗜水气单胞菌(DSN20121018);6.嗜水气单胞菌(NH130605)
Figure 5. Results of AH samples by the detection of real-time turbidmeter and SYBR GreenⅠ
a. detection of real-time turbidmeter (A.hydrophila); b. detection of SYBR GreenⅠ(A.hydrophila); c. detection of real-time turbidmeter (A.sobria); d. detection of SYBR GreenⅠ(A.sobria); 1.negative control; 2.A.hydrophila(KQ2010522);3.A.hydrophila (BF20120816);4.A.hydrophila(SK20120912);5.A.hydrophila(DSN20121018);6.A.hydrophila(NH130605)
表 1 嗜水气单胞、温和气单胞LAMP引物序列
Table 1 LAMP primers sequences of A.hydrophila and A.sobria
引物名称
primer引物序列(5′→ 3′)
sequenceAH-B3 TGTCGGCTCATGTCAGTA AH-F3 CAATGGCAGTCTGATCTCC AH-BIP CGCTGCAATTGATGGTGAGCAGTTTGATATCCCGCTGC AH-FIP CTGACCTGACTGCTTGGCAGCGACGATACCGTAGAGA AH-LB GGCACTGACGCTGAATCT AH-LF GGAGCCTGAACGTCATGG AS-B3 AAGCTCTGGCAGAGGCTC AS-F3 CGGACGAATGGACTCGAA AS-BIP GAAGACGAGGAAGAGGATCTGCAATTCGTCTTCCTGATAGACAG AS-FIP AACGCAGGAGTGGCACGATTTGACAGCGATGGCATC AS-LB CACTTCGCAAGCCTGCTG AS-LF AGCGAGTTCCGGCTCTTC -
[1] ZHOU X, GUO Q, DAI H, et al. Identification of differentially expressed immune-relevant genes in Chinese soft-shelled turtle (Trionyx sinensis) infected with Aeromonas hydrophila[J]. Vet Immunol Immunopathol, 2008, 125(1): 82-91. doi: 10.1016/j.vetimm.2008.05.008
[2] YUCEL N, ERDOGAN S. Virulence properties and characterization of aeromonads isolated from foods of animal origin and environmental sources[J]. J Food Prot, 2010, 73(5): 855-860. doi: 10.4315/0362-028X-73.5.855
[3] SARKAR A, SAHA M, ROY P, et al. Detection of 232 bp virulent gene of pathogenic Aeromonas hydrophila through PCR based technique: (a rapid molecular diagnostic approach)[J]. Adv Microbiol, 2013, 3(14): 83-87. doi: 10.4236/AIM.2013.31013
[4] SZCZUKA E, KAZNOWSKI A. Typing of clinical and environmental Aeromonas sp. strains by random amplified polymorphic DNA PCR, repetitive extragenic palindromic PCR, and enterobacterial repetitive intergenic consensus sequence PCR[J]. J Clin Microbiol, 2004, 42(1): 220-228. doi: 10.1128/JCM.42.1.220-228.2004
[5] 王远微, 汤承, 于学辉, 等. 三重PCR检测鱼类致病性嗜水气单胞菌[J]. 微生物学报, 2008, 48(7): 947-951. doi: 10.3321/j.issn:0001-6209.2008.07.018 [6] POLLARD D R, JOHNSON W M, LIOR H, et al. Detection of the aerolysin gene in Aeromonas hydrophila by the polymerase chain reaction[J]. J Clin Microbiol, 1990, 28(11): 2477-2481. doi: 10.1128/jcm.28.11.2477-2481.1990
[7] WANG G, CLARK C G, LIU C, et al. Detection and characterization of the hemolysin genes in Aeromonas hydrophila and Aeromonas sobria by multiplex PCR[J]. J Clin Microbiol, 2003, 41(3): 1048-1054. doi: 10.1128/JCM.41.3.1048-1054.2003
[8] 胡秀彩, 吕爱军, 陈宏. 产色素温和气单胞菌的特性及其外膜蛋白型研究[J]. 安徽农业科学, 2008, 36(8): 3240-3241. doi: 10.3969/j.issn.0517-6611.2008.08.090 [9] ONUK E E, FINDIK A, TURK N, et al. Molecular identification and determination of some virulence genes of Aeromonas spp. in fish and water from Turkish coastal regions[J]. Revue Med Vet, 2013, 164(4): 200-206. https://www.researchgate.net/publication/233401475_Molecular_identification_and_determination_of_some_virulence_genes_of_Aeromonas_spp_in_fish_and_water_from_Turkish_coastal_regions
[10] 程方俊, 徐兴然, 宋振辉, 等. 温和气单胞菌RC-07-KA株溶血素基因克隆、表达及活性检测[J]. 中国预防兽医学报, 2012, 34(3): 201-205. doi: 10.3969/j.issn.1008-0589.2012.03.09 [11] MATHUR A K, KUMAR P, MEHROTRA S C, et al. Abdominal dropsy disease in major carps of Meghalaya: isolation and characterization of Aeromonas hydrophila[J]. Curr Sci, 2005, 88(12): 1897-1900. https://www.researchgate.net/publication/286750020_Abdominal_dropsy_disease_in_major_carps_of_Meghalaya_Isolation_and_characterization_of_Aeromonas_hydrophila
[12] KAO H T, HUANG Y C, LIN T Y. Fatal bacteremic pneumonia caused by Aeromonas hydrophila in a previously healthy child[J]. Microbiol Infect, 2003, 36(3): 209-211. https://pubmed.ncbi.nlm.nih.gov/14582567/
[13] OTTAVIANI D, LEONI F, ROCCHEGIANI E, et al. A severe case of Aeromonas veronii biovar sobria travellers′ diarrhea characterized by Vibrio parahaemolyticus co-isolation[J]. J Med Microbiol, 2012, 62(Pt 1): 161-164. doi: 10.1099/jmm.0.044743-0
[14] FILLER G, EHRICH J H H, STRAUCH E, et al. Acute renal failure in an infant associated with cytotoxic Aeromonas sobria isolated from patient′s stool and from aquarium water as suspected source of infection[J]. J Clin Microbiol, 2000, 38(1): 469-470. doi: 10.1128/JCM.38.1.469-470.2000
[15] ROBERTS M T M, ENOCH D A, HARRIS K A, et al. Aeromonas veronii biovar sobria bacteraemia with septic arthritis confirmed by 16S rDNA PCR in an immunocompetent adult[J]. J Med Microbiol, 2006, 55(2): 241-243. doi: 10.1099/jmm.0.46295-0
[16] DAS A, VINAYASREE V, SANTHOSH C R, et al. Surveillance of Aeromonas sobria and Aeromonas hydrophila from commercial food stuffs and environmental sources[J]. Exp Sci, 2012, 3(9): 36-42. https://www.semanticscholar.org/paper/Surveillance-of-Aeromonas-sobria-and-Aeromonas-from-Das-Vinayasree/f397c85d6c2567e3c6ff4732b866f82a7af63826
[17] KUHN I, ALBERT M J, ANSARUZZAMAN M, et al. Characterization of Aeromonas spp. isolated from humans with diarrhea, from healthy controls, and from surface water in Bangladesh[J]. J Clin Microbiol, 1997, 35(2): 369-373. doi: 10.1128/jcm.35.2.369-373.1997
[18] 付乔芳, 邱军强, 胡鲲, 等. 嗜水气单胞菌毒力基因在传代过程中的稳定性研究[J]. 生物技术通报, 2011(9): 130-135. https://biotech.aiijournal.com/CN/abstract/abstract6154.shtml [19] NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucl Acids Res, 2000, 28(12): 63. doi: 10.1093/nar/28.12.e63
[20] PARIDA M M, SANTHOSH S R, DASH P K, et al. Development and evaluation of reveres transcription- loop-mediated isothermal amplification assay for rapid and real-time detection of Japanese encephalitis virus[J]. J Clin Microbiol, 2006, 44(11): 4172-4178. doi: 10.1128/JCM.01487-06
[21] NAGAMINE K, HASE T, NOTOMI T. Accelerated reaction by loop-mediated isothermal amplification using loop primers[J]. Mol Cell Probe, 2002, 16(3): 223-229. doi: 10.1006/mcpr.2002.0415
[22] SONG T, TOMA C, NAKASONE N, et al. Sensitive and rapid detection of Shigella and enteroinvasive Escherichia coli by loop-mediated isothermal amplification method[J]. FEMS Microbiol Lett, 2005, 243(1): 259-263. doi: 10.1016/j.femsle.2004.12.014
[23] YAMAZAKI W, KUMEDA Y, MISAWA N, et al. Development of a loop-mediated isothermal amplification assay for sensitive and rapid detection of the tdh and trh genes of Vibrio parahaemolyticus and related Vibrio species[J]. Appl Environ Microbiol, 2010, 76(3): 820-828. doi: 10.1128/AEM.02284-09
[24] CAI Z, LOU G, CAI T, et al. Development of a novel genotype-specific loop-mediated isothermal amplification technique for Hepatitis B virus genotypes B and C genotyping and quantification[J]. J Clin Virol, 2011, 52(4): 288-294. doi: 10.1016/j.jcv.2011.08.013
[25] MEKATA T, SUDHAKARAN R, KONO T, et al. Real-time reverse transcription Loop-mediated isothermal amplification for rapid detection of yellow head virus in shrimp[J]. J Virol Methods, 2009, 162(1/2): 81-87. doi: 10.1016/j.jviromet.2009.07.018
[26] NKOUAWA A, SAKO Y, NAKAO M, et al. Loop-mediated amplification method for differentiation and rapid detection of Taenia species[J]. J Clin Microbiol, 2009, 47(1): 168-174. doi: 10.1128/JCM.01573-08
[27] BAKHEIT M A, TORRA D, PALOMINO L A, et al. Sensitive and specific detection of Cryptosporidium species in PCR-negative samples by loop-mediated isothermal DNA amplification and confirmation of generated LAMP products by sequencing[J]. Vet Parasitol, 2008, 158(1/2): 11-22. doi: 10.1016/j.vetpar.2008.09.012
[28] 袁瑛娜, 单潇潇, 王宗德, 等. 应用LAMP实时浊度法检测转基因大豆[J]. 现代食品科技, 2011, 27(10): 1264-1267. doi: 10.3969/j.issn.1673-9078.2011.10.023 [29] 张隽, 李志勇, 叶宇鑫, 等. 环介导等温扩增法检测转基因玉米MON89034[J]. 现代食品科技, 2012, 28(4): 469-472. doi: 10.3969/j.issn.1673-9078.2012.04.028 [30] 匡燕云. 环介导等温扩增技术检测嗜水气单胞菌方法的建立[D]. 南昌: 南昌大学, 2007. https://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_Y1152389&dbid=WF_XW [31] 程天印, 刘洵, 常小斌. 嗜水气单胞菌LAMP检测方法的建立及应用[J]. 中国兽医科学, 2007, 37(12): 1013-1016. doi: 10.3969/j.issn.1673-4696.2007.12.003 [32] MORI Y, NAGAMINE K, TOMITA N, et al. Detection of loop-mediated isothermal amplification reaction by turbidyty derived from magnesium pyrophosphate formation[J]. Biochem Biophys Res Commubr, 2001, 289(1): 150-154. doi: 10.1006/bbrc.2001.5921
[33] 杨守明, 王民生. 嗜水气单胞菌及其对人的致病性[J]. 疾病控制杂志, 2006, 10(5): 511-514. doi: 10.3969/j.issn.1674-3679.2006.05.021 [34] 沈锦玉. 嗜水气单胞菌的研究进展[J]. 浙江海洋学院学报: 自然科学版, 2008, 27(1): 78-86. doi: 10.3969/j.issn.1008-830X.2008.01.017 [35] 李文艳, 张伟伟, 马秀娟, 等. 嗜水气单胞菌相关毒力基因的研究进展[J]. 安徽农业科学, 2011, 39(9): 5060-5064. doi: 10.3969/j.issn.0517-6611.2011.09.009 [36] 朱兴国, 范红结, 陆承平, 等. 嗜水气单胞菌J-1株粘附素及其受体分析[J]. 南京农业大学学报, 2002, 25(2): 82-84. doi: 10.3321/j.issn:1000-2030.2002.02.019 [37] 于学辉, 王远微, 汤承, 等. 嗜水气单胞菌的研究进展[J]. 西南民族大学学报: 自然科学版, 2007, 33(3): 507-514. doi: 10.3969/j.issn.1003-2843.2007.03.016 [38] ROGER F, MARCHANDIN H, JUMAS-BILAK E, et al. Multilocus genetics to reconstruct aeromonad evolution[J]. BMC Microbiol, 2012, 12: 62-85. doi: 10.1186/1471-2180-12-62
-
期刊类型引用(15)
1. 黄央央,杨毕铖,戴桂香. 互花米草入侵对漳江口红树林保护区的影响研究. 海洋开发与管理. 2023(02): 115-124 .  百度学术
百度学术
2. Guangjie FANG,Haolin YU,Xinmeng WANG,Huaxiang SHENG,Yanli TANG,Changdong LIU,Chuanxi CHEN,Zhenlin LIANG. Impact of summer moratorium on set-net fishery in Haizhou Bay, China. Journal of Oceanology and Limnology. 2022(04): 1678-1691 .  必应学术
必应学术
3. 陈静,黄德练,王雪辉,徐磊,张健,李亚芳,宁加佳,王亮根,刘双双,林昭进,杜飞雁. 基于DNA条形码的江门近岸海域春季鱼卵的种类鉴定及其形态. 南方水产科学. 2022(06): 10-18 .  本站查看
本站查看
4. 徐姗楠,郭建忠,陈作志,张魁,许友伟,李纯厚. 胶州湾鱼类生物量粒径谱特征. 水产学报. 2020(04): 596-605 .  百度学术
百度学术
5. 陈梓林,李纯厚,肖雅元,刘永,林琳,王九江,全秋梅. 江门近岸海域大型底栖动物群落结构的分布特征. 南方水产科学. 2020(04): 18-27 .  本站查看
本站查看
6. 徐姗楠,郭建忠,范江涛,许友伟,粟丽,李纯厚. 大亚湾夏季鱼类生物量粒径谱年际变化特征. 南方水产科学. 2020(04): 28-38 .  本站查看
本站查看
7. 徐姗楠,郭建忠,陈作志,许友伟,周林滨,柯志新,李纯厚. 大亚湾鱼类生物量粒径谱特征. 中国水产科学. 2019(01): 34-43 .  百度学术
百度学术
8. 苏莹佳,陈国宝,周艳波,马胜伟,吴洽儿. 2015—2017年南海海域伏季休渔制度实施效果评价. 南方水产科学. 2019(02): 20-28 .  本站查看
本站查看
9. 韦朋,王雪辉,马胜伟,周艳波,黄应邦,苏莹佳,吴洽儿. 我国南海区海洋捕捞现状分析. 上海海洋大学学报. 2019(06): 976-982 .  百度学术
百度学术
10. 余景,胡启伟,袁华荣,陈丕茂. 基于遥感数据的大亚湾伏季休渔效果评价. 南方水产科学. 2018(03): 1-9 .  本站查看
本站查看
11. 晏磊,杨吝,谭永光,杨炳忠,张鹏,李杰. 黄茅海河口张网网囊网目对凤鲚的选择性研究. 上海海洋大学学报. 2018(02): 274-283 .  百度学术
百度学术
12. 张楠,吴娜,郭华阳,朱克诚,刘永,李纯厚,杨静文,江世贵,张殿昌. 基于DNA条形码技术对江门沿岸海域夏季鱼卵的鉴定. 中国水产科学. 2018(04): 721-727 .  百度学术
百度学术
13. 谢志超,孙典荣,刘永,林琳,王腾,肖雅元,李纯厚. 江门海域游泳动物群落组成及其多样性初步分析. 南方水产科学. 2018(05): 21-28 .  本站查看
本站查看
14. Yu Jing,Hu Qiwei,Chen Pimao,Mang Qi. Effect Evaluation of Summer Fishing Moratorium (SFM) in Daya Bay Based on Remote Sensing and Survey Data. Animal Husbandry and Feed Science. 2018(04): 219-225 .  必应学术
必应学术
15. 郭建忠,陈作志,徐姗楠. 鱼类粒径谱研究进展. 海洋渔业. 2017(05): 582-591 .  百度学术
百度学术
其他类型引用(7)




 下载:
下载:



 粤公网安备 44010502001741号
粤公网安备 44010502001741号
