Annual variation in fish biomass size spectrum in Daya Bay, South China Sea in summer
-
摘要:
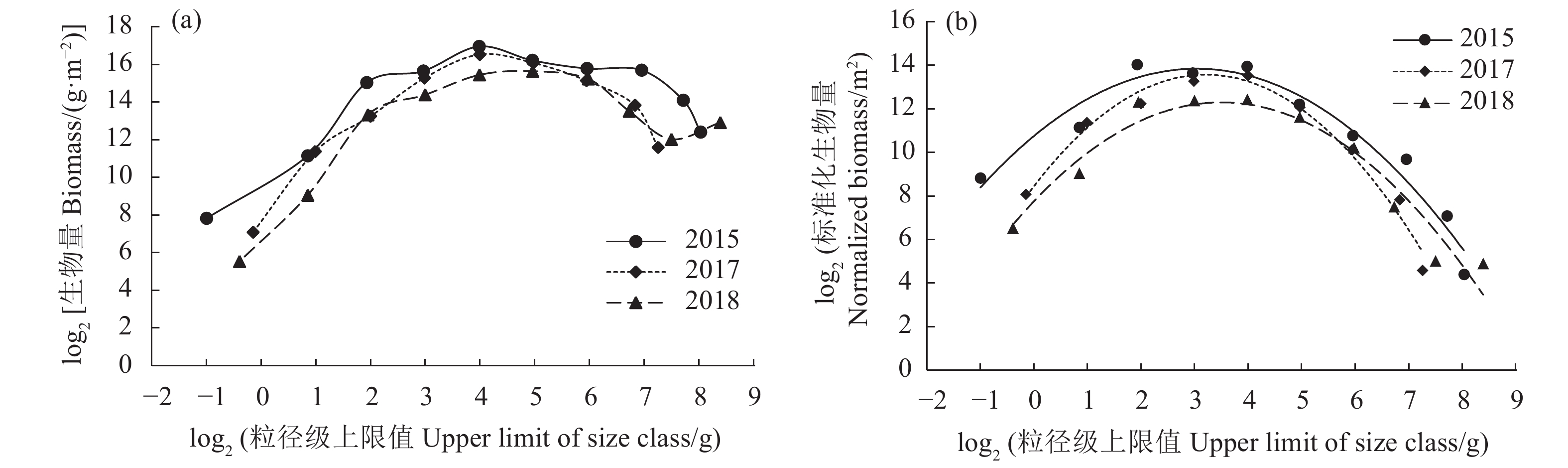
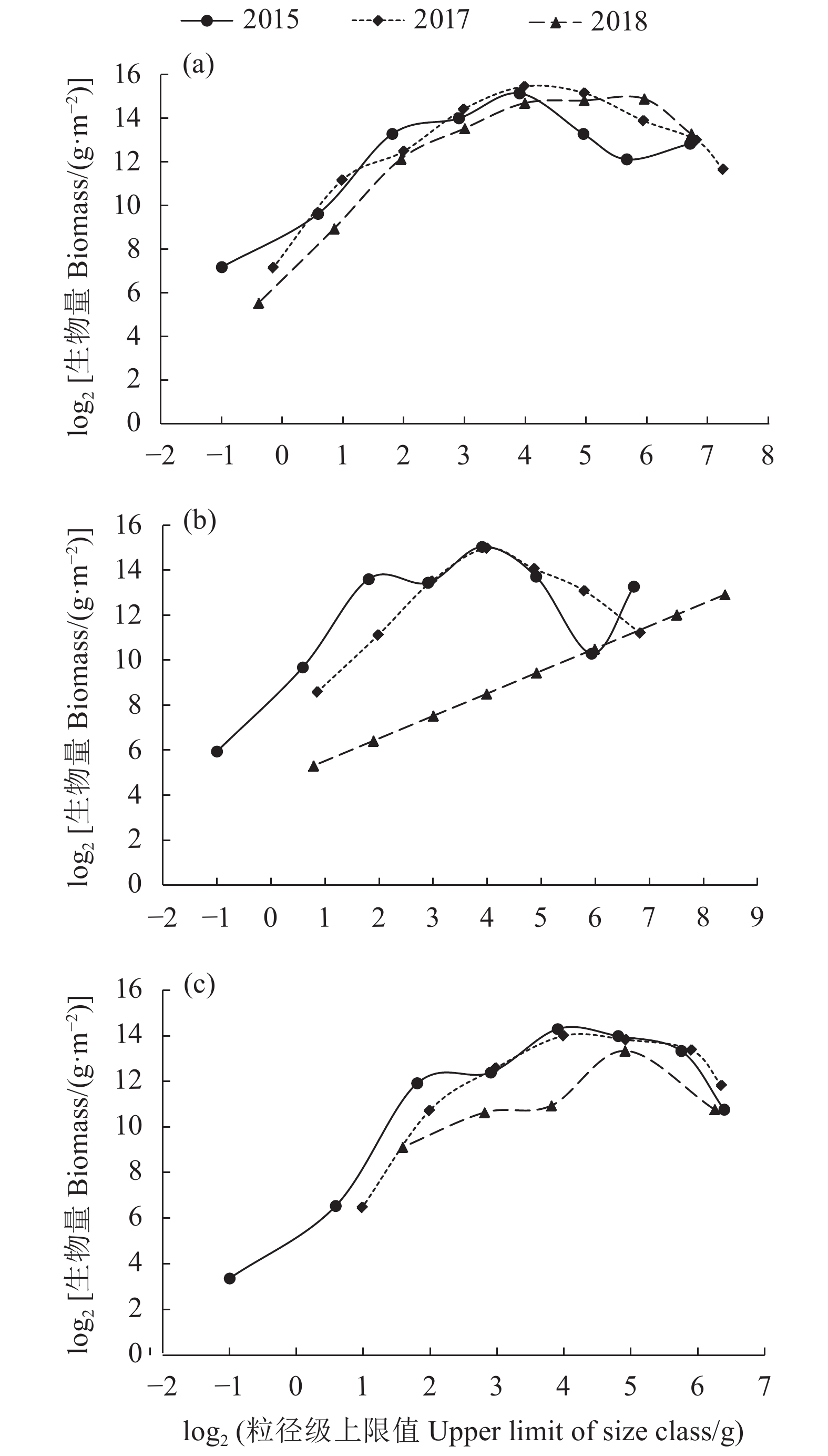
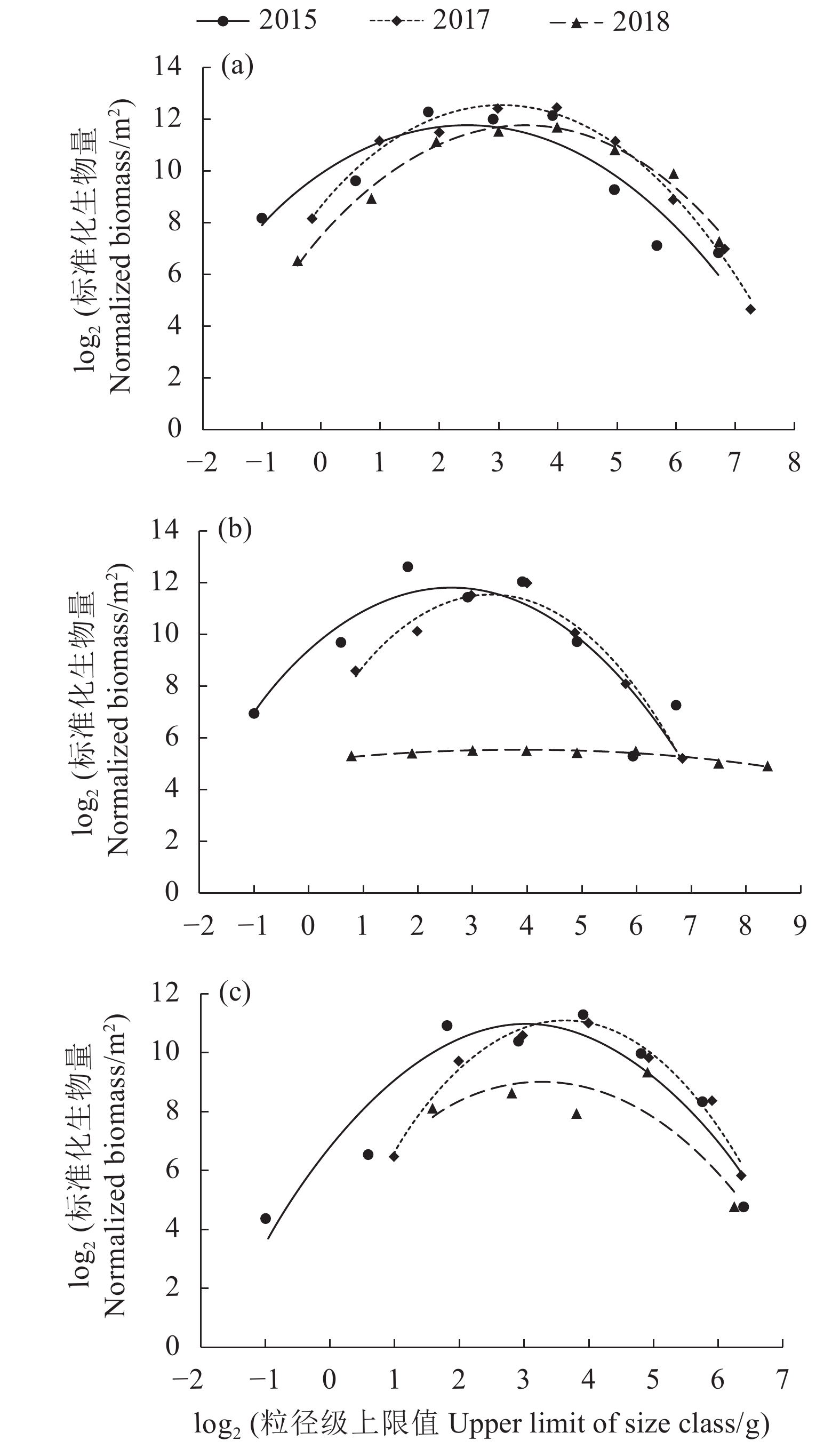
文章根据2015、2017和2018年3次底拖网渔业资源调查数据,构建了大亚湾夏季鱼类生物量粒径谱,并比较分析了这3个时期夏季鱼类生物量粒径谱特征参数差异性。结果表明,大亚湾夏季鱼类生物量粒径谱存在明显的年际和空间变化,3个时期Sheldon型生物量粒径谱呈“单峰”型,粒径范围以2015和2018年最大 (−1~9),2017年次之 (−1~8);优势种组成由2015年以黄鳍马面鲀 (Thamnaconus hypargyreus)、短吻鲾 (Leiognathus brevirostris) 和细条天竺鲷 (Apogon lineatus) 为主演变为2017、2018年以短吻鲾、黄斑蓝子鱼 (Siganus oramin) 等粒径级小的鱼类为主。标准化生物量粒径谱曲率年际变化上以2015年最大,2018年次之,2017年最小;空间分布上,沿岸海域以2015年最大,2017年最小;湾中部海域以2018年最大,2017年最小;湾口海域以2018年最大,2017年最小。数量-生物量比较 (Abundance-biomass comparison, ABC) 曲线表明,大亚湾夏季鱼类群落处于严重干扰状态。大亚湾夏季鱼类生物量粒径谱特征存在明显的年际差异与鱼类自身生活习性、补充比率、栖息环境及人类活动干扰有关,尤其是捕捞因素。
Abstract:Based on the data collected from three bottom trawl surveys of fishery resources in 2015, 2017 and 2018, we constructed the biomass size spectrum of fish in the Daya Bay in summer, and compared and analyzed the differences of the characteristic parameters of fish biomass size spectrum. The results show that the biomass size spectrum in different years displayed obvious annual and spatial variation characteristics. The fish biomass size spectrum of the Sheldon-type were all "single-peak" as a whole, with the largest particle size ranges in 2015 and 2018 (−1–9), followed by 2017 (−1–8); The dominant species composition of the fish community evolved from Thamnaconus hypargyreus, Leiognathus brevirostris and Apogon lineatusin in 2015 to the main small-size species such as L. brevirostris and Siganus oramin in 2017 and 2018. The species composition of the normalized biomass size spectrum curvature in 2015 was the largest, followed by that in 2018, while that in 2017 was the smallest. In terms of spatial distribution, the curvature of the coastal waters was the largest in 2015 but the smallest in 2017; the curvature of the central area was the largest in 2018 but the smallest in 2017; and the curvature of the mouth area was the largest in 2018 but the smallest in 2017. The abundance-biomass comparison (ABC) curve indicates that the fish community in the Daya Bay in summer was at a state of severe disturbance. The biomass size spectrum characteristics displayed obvious annual differences, relating to fish life habits, supplement ratios, habitat environment and human activities, especially fishing factors.
-
Keywords:
- Fish /
- Biomass particle size spectrum /
- Particle size structure /
- ABC curve /
- Daya Bay
-
鸢乌贼 (Symplectoteuthis oualaniensis) 隶属于头足纲、枪形目、柔鱼科,广泛分布在印度洋和太平洋海域[1],是这些海域重要的经济渔业资源之一,也是目前中国远洋渔船在西北印度洋公海即阿拉伯外海的主捕对象。21世纪初期中国开始对阿拉伯外海鸢乌贼开展试验性探捕和资源调查,发现阿拉伯海外海的北部鸢乌贼资源较丰富[2],但随后并未对其进行商业型规模的开发和利用。直至2013年前后中国才有渔船在阿拉伯海外海进行正式的商业性捕捞开发。目前中国在西北印度洋公海海域进行商业捕捞的渔船近200艘,并且有逐年增加的趋势。对阿拉伯海外海鸢乌贼资源进行合理开发及可持续利用,有利于提升中国在印度洋海域渔业科学研究中的地位和影响力,同时对缓解近岸资源捕捞压力具有积极意义。
近年来,印度洋鸢乌贼的研究主要集中在渔业生态学方面,如角质颚和耳石等[3-6],而环境因素对鸢乌贼的影响研究区域集中在中国南海[7-10]。有研究根据印度洋北部捕捞鸢乌贼3种方式 (灯光敷网、灯光罩网和鱿钓) 的作业次数、渔获量和单位捕捞努力量渔获量 (Catch per unit effort, CPUE) 进行统计,对渔场时空分布及其年间差异进行分析[11],但缺少对印度洋公海海域鸢乌贼渔场海洋环境变动的相关研究;且伴随着《北太平洋公海渔业资源养护和管理公约》的实施,更多远洋渔船可能会从北太平洋选择转移至印度洋生产,因此从掌握该海域资源状况及提升生产稳定性等角度出发,对阿拉伯海外海鸢乌贼的时空分布和渔场环境信息的了解尤为必要。本研究利用2019年12月—2020年2月和2020年10—11月2个航次的调查资料,选取经纬度、农历日、海表温度 (Sea surface temperature, SST)、叶绿素a (Chl a)浓度和海表温度距平 (Sea surface temperature anomaly, SSTA),开展上述要素在阿拉伯海外海鸢乌贼渔场的时空分布研究,旨为掌握印度洋鸢乌贼的渔汛规律、渔场的发生机理,为阿拉伯海外海渔场的精细化渔场预报提供科学参考和可靠依据。
1. 材料与方法
1.1 调查要素
第1航次的调查渔船为灯光敷网渔船“欣海1202”,船总长50.95 m,船型宽8.2 m,型深4.2 m,总吨位722 t,主机机1台,功率1260 kW,副机600、400、250 kW各1台;网具的网口周长约420 m,网衣长度250 m,最大网目尺寸60 mm,最小网目尺寸30 mm;船上配有75盏集鱼灯,功率为4 kW,另配有1盏2 kW的水下导鱼灯。第2航次的调查渔船为灯光罩网渔船“兴邦908”,船总长61.64 m,船型宽12.2 m,型深5.2 m,总吨位1 492 t,主机1台,功率1 540 kW,副机809、809、441 kW各1台;网具的网口周长624 m,网衣长度约115 m,最大网目尺寸40 mm, 最小网目尺寸35 mm;船上配有300盏2 kW的水上集鱼灯,8盏4 kW的水下集鱼灯。
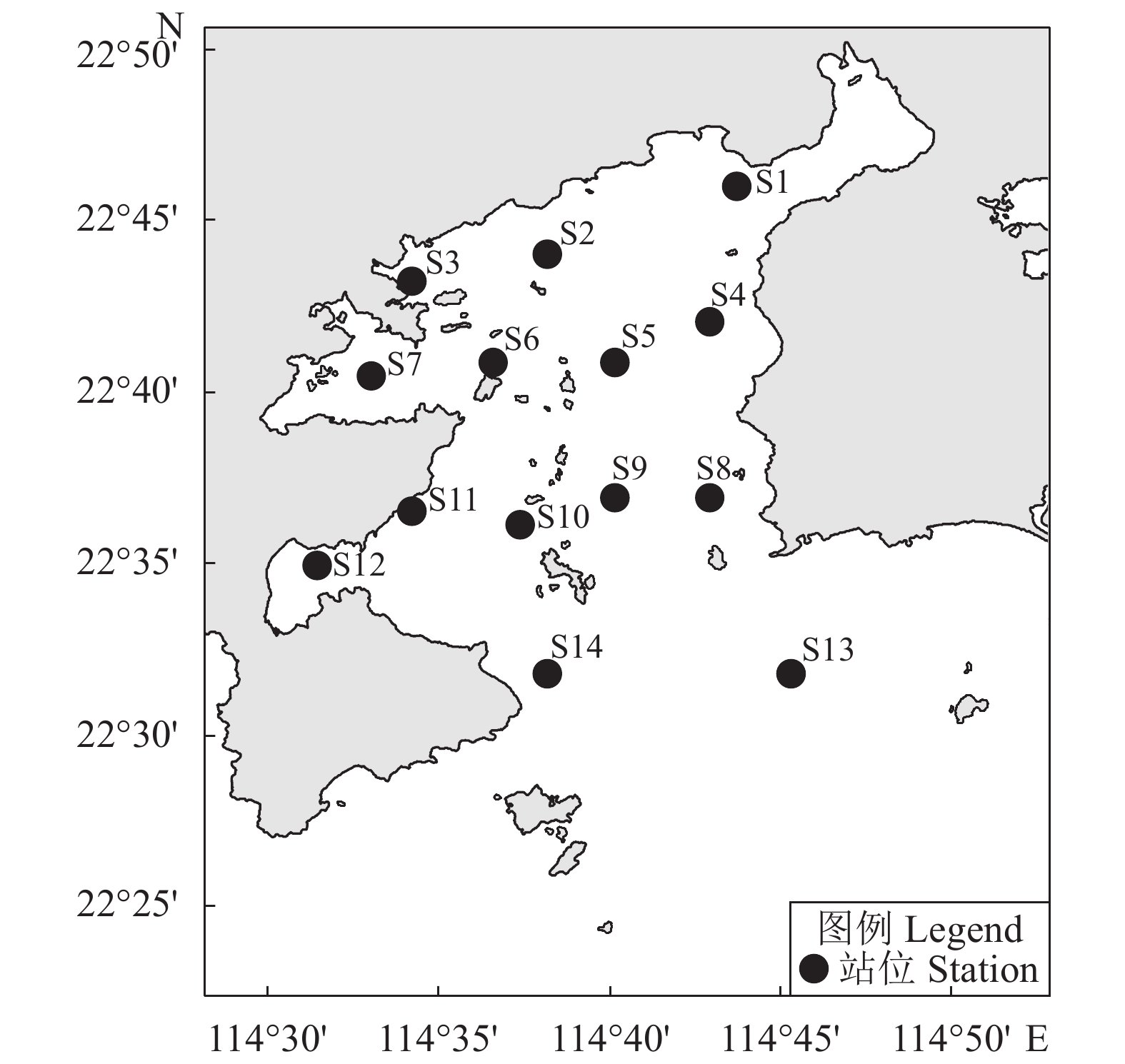
第1航次的调查时间为2019年12月—2020年2月,调查站位49个;第2航次的调查时间为2020年10—11月,调查站位54个。作业时每个站点灯诱3~5 h,记录每站下网信息 (经纬度、农历日) 和渔获数据。调查海域位于阿拉伯海外海 (60.18°E—65.0°E, 15.87°N—19.70°N) (图1)。2个航次的调查站点设计参考鸢乌贼的历史中心渔场,并覆盖了中心渔场的附近海域,以期开拓阿拉伯海外海鸢乌贼渔场范围。
1.2 环境要素与生产调查数据的采集
海洋环境要素的数据采集参照GB 17378.3—1998 《海洋监测规范)》进行,当场采用CTD (Conductivity, Temperature, Depth system, Sea-Bird 911 plus CTD) 记录SST。生产调查数据包括每网次、每次下网的经纬度、农历日、鸢乌贼渔获量等。
1.3 遥感数据的获取
遥感数据包括Chl a浓度和SSTA。Chl a浓度数据来自美国航空航天局 (National Aeronautics and Space Administration, NASA) 网站 (https://www.nasa.gov/) 提供的中分辨率成像光谱仪 (Moderate-resolution Imaging Spectroradiometer, MODIS) 卫星传感器;SSTA来自美国国家海洋和大气局 (National Oceanic and Atmospheric Administration, NOAA) 的Ocean Watch网站 (https://oceanwatch.pifsc.noaa.gov/)。时间分别率均1 d,其中Chl a浓度的空间分辨率为1/24°×1/24° (约4 km),SSTA的空间分别率为5 km。将遥感数据进行0.25°×0.25°的处理后与生产调查数据进行对照匹配。
1.4 数据处理
鸢乌贼的CPUE为每个站点的各网次的渔获量 (t·网−1);根据农历日和实际生产设定:月光夜为农历日的初十至廿二,月黑夜为农历日的廿三至三十、初一至初九;设定以0.5 ℃为1个SST区间,以0.1 mg·m−3为1个Chl a区间,以0.2 ℃为1个SSTA区间。
$$ {\rm{CPUE}}=\frac{ y_{\rm{catch}}}{n_{\rm{net}}} $$ (1) 式中:ycatch为每日站位的总产量 (t);nnet为每日站位的放网次数。
广义可加模型 (Generalized Additive Model, GAM) 是1986年Hastie 和Tibshirani[12]提出的一种广义线性模型的非参数化扩展,能直观地对多个解释变量和相应变量之间进行非线性关系的处理。本研究将可能影响响应变量 (阿拉伯海外海鸢乌贼CPUE) 的解释变量分为时空因素和海洋环境因素,其中时空因素包括经纬度和农历日;海洋环境要素包括SST、Chl a和SSTA。综上,构建的GAM模型如下:
$$ \begin{array}{c} \lg \left( { {\rm{CPUE}} + 1} \right) = {\text{s}}\left( {{\rm{lon}},{\rm{lat}}} \right) + s\left( {{\rm{lc}}} \right) + s\left( {\rm{SST}} \right) +\\ s\left( {\rm{Chla}} \right) + s\left( {\rm{SSTA} }\right) \end{array} $$ (2) 式中:为防止零值出现,采用CPUE加上1后进行对数化处理的方法;s()为样条平滑 (Smoothing spline),可用于单变量平滑及多变量的各项同性平滑;lon为经度;lat为纬度;lc为农历日;SST (℃);Chla (mg·m−3);SSTA (℃)。
利用赤池信息准则 (Akaike's Information Criterion, AIC) 检验加入解释变量后模型的拟合度,选择最优的解释变量,AIC的值越小,表示模型的拟合效果越好[13]。利用F检验评估各因子的显著性。构建GAM模型和计算采用R 4.0.5软件包的mgcv函数库。绘图采用ArcGIS 10.2、Excel 2019和R 4.0.5软件进行。
1.5 最佳模型的筛选
模型中逐步加入各解释变量后的详细变化情况见表1。方差解释率与决定系数不断增大,且最终各因素均对模型存在显著性影响。lg(CPUE+1)~ s(lon, lat)+s(lc)+s(SST)+s(Chla)+s(SSTA)为最佳模型,解释率为83.7 %。残差分布图 (图2) 表明最终选择的最优模型能较好地解释阿拉伯海外海鸢乌贼CPUE的变化。
表 1 最优广义可加模型分析结果Table 1. Analysis results of optimal Generalized Additive Model模型
Model决定系数 R2
Determination
coefficient方差解释
Explained
variance/%赤池信
息准则
AICP Model 1 0.291 34.5 41.034 24 0.004 242 ** Model 2 0.502 54.5 5.290 793 2.29×10−5 *** Model 3 0.577 64.9 −4.358 79 0.005 970 ** Model 4 0.594 67.8 −5.837 11 0.015 904 * Model 5 0.746 83.7 −44.95 0.000 537 *** 注:*. P≤0.05 (存在差异);**. P≤0.01 (显著差异);***. P≤0.001 (极其显著差异)。 Note: *. P≤0.05 (Different); **. P≤0.01 (Significant different); ***. P≤0.001 (Extremely different); 1. lg(CPUE+1)~s(lon,lat); 2. lg(CPUE+1)~s(lon,lat)+s(lc); 3. lg(CPUE+1)~s(lon,lat)+s(lc)+s(SST); 4. lg(CPUE+1)~s(lon,lat)+s(lc)+s(SST)+s(Chla); 5. lg(CPUE+1)~s(lon,lat)+s(lc)+s(SST)+s(Chla)+s(SSTA). 2. 结果
2.1 调查概况
2个航次的阿拉伯海外海鸢乌贼资源调查情况见表2。调查期间,共捕获鸢乌贼277.44 t,平均CPUE为2.69 t·网−1;第2航次的总产量和CPUE平均值均大于第1航次;2个航次的SST介于24.56~28.60 ℃,Chl a质量浓度介于0.16~1.49 mg·m−3,SSTA介于−0.45~1.16 ℃。
表 2 2个航次的阿拉伯海外海鸢乌贼资源调查概况Table 2. Survey of S. oualaniensis resources by two voyages in outer sea of Arabian Sea航 次
Voyage调查时间
Sampling
time站位数
Number of
sites渔获量
Total
catch/t单位捕捞努力量
渔获量范围
Range of CPUE/
(t·网−1)单位捕捞努力量
渔获量平均值
average CPUE/
(t·网−1)海表温度
范围
Range of
SST/°C叶绿素 a质量
浓度范围
Range of ρ(Chl a)/
(mg·m−3)海表温度
距平范围
Range of
SSTA/°C第一航次
1st voyage2019.12—2020.02 49 113.20 0.3~7.13 2.31 24.56~26.10 0.26~1.49 −0.45~0.84 第二航次
2nd voyage2020.10—2020.11 54 164.24 0.1~12.0 3.04 27.30~28.60 0.16~0.80 0.01~1.16 2.2 CPUE分布情况
图3为2个航次鸢乌贼CPUE的分布情况。第1航次的调查范围为60°E—63.50°E,15.50°N—18.50°N,总渔获量113.20 t,平均CPUE为2.31 t·网−1,高CPUE区域主要集中在60°E—61°E,16°N和62°E,16°N—18°N附近 (图3-a);第1航次的调查范围为61.50°E—65°E,16°N—20°N,总渔获量164.24 t,平均CPUE为3.04 t·网−1,高CPUE区域主要集中在61.50°E—63°E,17°N—17.75°N附近 (图3-b)。
2.3 主要海洋环境因子与CPUE的叠加分布
渔场的SST为24.5~25.5 ℃时,鸢乌贼的总渔获量为60.01 t,占总渔获量的53.0%,CPUE为3.14 t·网−1,是平均CPUE的1.16倍 (图4-a);在26.5~27.5 ℃组内,鸢乌贼的渔获量占总渔获量的85.6%,共140.7 t,CPUE呈现下降趋势,最高值出现在26.5~27.0 ℃组内,为8.31 t·网−1 (图4-b)。
Chl a质量浓度为0.3~0.4 mg·m−3时,渔获量为85.73 t,占总渔获量的75.73 %,其对应的CPUE为2.38 t·网−1,CPUE最高值是3.73 t·网−1,对应的Chl a为0.2~0.3 mg·m−3 (图5-a),CPUE与Chl a的叠加图 (图6-a) 显示,CPUE高值区颜色较深,说明其对应Chl a范围小于0.5 mg·m−3;渔获量和CPUE最高值均落在Chl a质量浓度0.4~0.5 mg·m−3范围内,分别为140.7 t和4.69 t·网−1 (图5-b)。因为未在Chl a质量浓度为0.5~0.7 mg·m−3的区域进行调查,因此该范围内的CPUE与渔获量均为0。CPUE高值区域集中在0.4~0.8 mg·m−3范围内 (图6-b)。
SSTA介于0.2~0.6 ℃时,两组的渔获量约占总渔获量一半,CPUE分别为3.82和4.22 t·网−1 (图7-a);渔获量和CPUE的最高值分别为84.2 t和9.78 t·网−1,是平均CPUE的3.21倍 (图7-b)。2个航次的高CPUE主要集中在图中黄色区域附近,即SSTA为0.2~1.0 ℃的区域 (图8)。
2.4 最佳模型显示要素对CPUE的影响作用
通过选择最佳GAM模型分析得到经纬度在所有变量中的方差解释率最高 (34.5%)。图9-a中黑色实线的范围表明阿拉伯海外海鸢乌贼CPUE较高的区域有3处,分别是60°E—61.50°E,15.90°N—16.50°N;60.80°E—64°E,17°N—17.80°N;62°E—64.8°E,18.8°N—19.10°N;图9-b显示,在经纬度较小范围的区域,随着经纬度变大,对鸢乌贼CPUE的影响逐渐下降,并且在62°E—63°E,17°E—18°N附近有一穹顶状突起,对应了图3-a中的1个CPUE高值密集区 (62°E、16°N—18°N) 和图3-b的CPUE高值密集区。
农历日的方差解释率为20.0%。图9-c显示农历日对鸢乌贼CPUE的影响呈现先升后小幅下降的趋势,并在农历日为15—23日呈上升趋势,之后下降。GAM模型最适农历日介于17—25日。2个航次中,月黑夜的渔获量、作业次数和CPUE均大于月亮夜,第1和第2航次月黑夜的产量分别为月亮夜的3.01和2.00倍,但作业次数差别不大 (表3)。
表 3 农历日鸢乌贼渔获量和单位捕捞努力量渔获量情况Table 3. Catch and CPUE of S. oualaniensis on lunar calendar day项目
Item第一航次
1st voyage第二航次
2nd voyage月黑夜
No-
moonlight月亮夜
Bright
moonlight月黑夜
No-
moonlight月亮夜
Bright
moonlight渔获量
Catch/t78.24 34.96 125.00 62.54 作业次数
Frequency26 23 35 21 单位捕捞努力量渔获量
CPUE/(t·网−1)3.01 1.52 3.79 2.98 SST的方差解释率为20.0%。影响曲线呈先降低、回升后再降低的趋势,波峰位于27.0~28.0 ℃ (图9-d),置信区间表明最适SST介于26.5~27.5 ℃。Chl a的方差贡献率最低(2.9%),影响曲线呈倒“V”形。当Chl a为0.30~0.50 mg·m−3时,置信度较高,CPUE与Chl a呈现正相关关系 (图9-e);当Chl a大于0.50 mg·m−3时,则为负相关关系。SSTA的方差解释率为15.9%,系环境因子中解释率最高的因子。当SSTA为0~0.4 ℃时,影响曲线呈递增趋势;当SSTA>0.4 ℃时,则CPUE与SSTA呈负相关 (图9-f)。置信区间表明最适SSTA范围在0~0.43 ℃。
3. 讨论
3.1 阿拉伯海外海鸢乌贼CPUE时空变化
第2航次的渔获总量和CPUE平均值高于第1航次 (表2),相较于第1航次的灯光覆网渔船,灯光罩网渔船在作业水深与作业方式上有所不同,导致了2次探捕的结果不同,灯光罩网的作业水深较灯光覆网的深,因此灯光罩网渔获物的种类、年龄结构等较灯光覆网更丰富[14],且季节性渔获物也存在差异。
鸢乌贼CPUE高值的集中区域主要有3个,分别是60°E—61°E,16°N;62°E,16°N—18°N;61.50°E—63°E,17°N—17.75°N (图2)。陈新军和叶旭昌[15]通过对2003年印度洋西北海域 (58°E—65°E,2°N—18°N) 探捕生产情况研究发现,10月下旬鸢乌贼中心渔场分布在61°E,15°N—16°N附近海域,这与本研究的结果相似。钱卫国等[16]发现在2004年冬季调查期间60°E,14°30'N附近海域鸢乌贼的CPUE最高,该研究采用的数据为鱿钓渔船数据,因此造成与本研究结果有差异,本研究采用的是灯光围网渔船数据,在灯光集鱼效果、作业深度、渔获选择性等方面与鱿钓作业方式的调查有较大区别,并且该研究的调查时间在2003年左右,与本研究相距时间较长,而印度洋西北海域的季风气候的情况复杂,在秋冬季节为东北季风而夏季为西南季风[17],导致每年鸢乌贼和澳洲鲐 (Scomber australasicus)[18]等中上层鱼类的渔场分布和产量会产生年际间和季节性波动。本研究调查持续时间较短且不连续,存在样本量不足的缺点,故暂不适宜进行季节性的具体研究,有待后续补充调查。
根据GAM模型结果,农历日 (月亮夜与月光夜) 对阿拉伯海外海鸢乌贼的CPUE具有极其显著的影响 (P≤0.001)。影响曲线在15 d后呈现升高趋势 (图9-c),说明在满月附近的时段,渔船为了减少作业成本会减少每天的作业次数,而在满月之后,月光照度开始下降,渔船会进入正常生产状况;月黑夜总作业次数是月亮夜的1.38倍,月黑夜的总渔获量较月亮夜增加了108.21% (表3),基本与晏磊等[19]、招春旭等[20]、李杰等[21]研究结果一致,进一步表明农历日对鸢乌贼分布的影响显著。另外,有研究表明,除了月光会导致水上集鱼灯的效果降低,还会对水温、海流等外部环境条件造成影响[22];同时,不同物种的趋光特性也会有所不同,钱卫国等[23]研究证明印度洋鸢乌贼适宜光照强度低于智利外海茎柔鱼 (Dosidicus gigas)。因此依据主捕渔获物的生物学习性,选择不同类型不同功率的集鱼灯,适当配置水上集鱼灯和水下集鱼灯的数量,有利于渔船降低生产成本,提高经济效益,减少渔获物中的兼捕物种,保护该海域的生物资源。
3.2 主要环境要素对鸢乌贼CPUE的影响
上升流是一种海水垂直向上运动的现象,上升的水体通常来自数百米深处,虽然上升流海域的面积仅占海洋总面积的1‰,但渔获量却占世界海洋总渔获量的50%[7,24-25]。上升流是印度洋鸢乌贼渔场形成与变动的内在驱动[26],表层海水与低温的深层海水交汇,SST发生变化,且因为上升流带动深海底层的营养盐来到表层,表层藻类生长旺盛,导致Chl a浓度上升,由此形成了阿拉伯海外海渔场。SSTA能反映渔场的水温变化状况,与上升流的强弱具有一定的相关性[27]。因此,本文利用SST、Chl a和SSTA作为海洋环境因子,研究其与鸢乌贼CPUE的关系是可行的。本研究中SST、Chl a浓度、SSTA对阿拉伯海外海鸢乌贼CPUE均存在影响 (P≤0.05)。
GAM模型表明,阿拉伯海外海鸢乌贼的最适SST介于26.5~27.5 ℃。林东明和陈新军[28]根据在印度洋西北部海域2004年9月—2005年4月的生产调查资料,发现印度洋鸢乌贼的渔场主要分布在60°E—61.50°E,15°N—16.50°N,作业渔场的适宜SST为25~29 ℃,该结果与本研究范围基本一致;另外周艳波等[29]认为SST、Chl a浓度和海面高度 (Sea surface height, SSH) 与南海外海鸢乌贼分布有关,其中最适宜SST为25~31 ℃;徐红云[30]研究发现1—12月南海外海鸢乌贼渔场的SST介于25.6~29.3 ℃并呈现由南到北递减的趋势;李杰等[21]研究表明29.00~29.49 ℃适合南海中南部海域鸢乌贼的捕获,以上相关南海海域的研究结果有所差异,是因为调查海域的具体位置及调查时间不同,并且研究阿拉伯海外海鸢乌贼渔汛期为10月—翌年4月,调查期间SST介于27~29 ℃,而南海外海鸢乌贼全年均有作业,渔汛期间的SST介于25~31 ℃[29],这导致南海外海鸢乌贼的SST范围较阿拉伯海外海的范围宽。
Chl a浓度决定了浮游动物如桡足类、糠虾类等的分布,阿拉伯海外海海域丰富的浮游动物资源是鸢乌贼的重要饵料[16],因此Chl a浓度能在一定程度上影响鸢乌贼的分布。本研究中,阿拉伯海外海鸢乌贼的适宜Chl a质量浓度介于0.30~0.50 mg·m−3。这与杨晓明等[2]以及余为和陈新军[31]的结论有一定差异,笔者推测是上述研究中所用渔具渔法为钓钩,因此渔获组成和个体差异等与灯光围网的渔获会存在一定差异。此外,由于阿拉伯海外海的海洋环境复杂,同时受到索马里海流和赤道海流的影响[32],Chl a浓度范围变化较大,2个航次的调查研究时间较短,而没有覆盖完整的鸢乌贼渔汛期。同时,通过对比南海外海鸢乌贼的相关研究,发现阿拉伯海外海鸢乌贼的最适Chl a浓度范围高于南海外海[7,10,29-30],也表明不同海域的相同物种会因为生境不同而产生一定差异。
SSTA,又称为SST异常,常用于捕捉SST在的异常变化特征,相关研究发现,当阿拉伯海外海渔场附近有上升流发生,会出现较大的SST梯度和Chl a梯度变化,导致鱼群汇集从而形成渔场,而当上升流消失时,渔场消失[2]。环境因子中,SSTA对鸢乌贼CPUE的影响极其显著 (P≤0.001),且关联度大于SST和Chl a。当SSTA小于0 ℃或大于0.4 ℃时,整体趋势与鸢乌贼CPUE呈现负相关关系,这与鸢乌贼作为头足类动物对SST的异常变动较为敏感这一生物学特性相一致,异常的温度变动不仅会影响头足类自身的生长[33],还可能对饵料生物的丰度产生影响[16]。后期研究计划利用SSH分布和海洋环流等物理要素推测渔场的上升流情况,结合渔业生产调查资料以探究阿拉伯海外海鸢乌贼渔场的内在驱动因子,有利于今后合理地开发和利用阿拉伯海外海渔业资源。
4. 结论
本文采用GAM模型分析了时空及海洋环境因子对阿拉伯海外海鸢乌贼CPUE的影响,初步探究了鸢乌贼CPUE变化与时空因子和SST等海洋环境因子的关系,并得出了相关结论,但仍有所不足:1) 本研究中虽然SST和Chl a对CPUE有显著影响,但模型解释率并不高,这可能与经纬度在模型中偏差解释率较大有关[27];2) 影响阿拉伯海外海鸢乌贼CPUE的环境因子可能不仅有SST、Chla和SSTA,也有其他表征海流或物理海洋过程的因子未被考虑;3) 本研究采用的是2个不同航次的探捕数据,虽然可以保证数据的真实性和准确性,但调查的经纬度范围未能覆盖整个西北印度洋渔场区域,调查时间也未能包含整个渔汛期,存在数据覆盖面窄的缺点。综上,在今后的研究中,建议将多年份及大面积的调查数据进行整合,包含整个西北印度洋的渔汛期和渔场,结合海洋环境数据开展深入的调查与重点分析,为今后该区域渔场系统的分析提供科学依据。
-
表 1 大亚湾夏季不同年份鱼类组成
Table 1 Composition of fish in Daya Bay in summer in different years
项目 Item 年份 Year 2015 2017 2018 目 Order 12 8 9 科 Family 41 27 34 属 Genus 54 42 47 种 Species 69 50 56 尾数渔获率 Catch rates in number/(尾·h−1) 11 414 3 983 8 666 质量渔获率 Catch rates in mass/(kg·h−1) 67.75 34.06 95.72 平均体质量 Average body mass/g 5.94 8.55 11.05 优势种 Dominant species 黄鳍马面鲀 Thamnaconus hypargyreus 短吻鲾 Leiognathus brevirostris 短吻鲾 Leiognathus brevirostris 短吻鲾 Leiognathus brevirostris 黄斑蓝子鱼 Siganus oramin 黄斑蓝子鱼 Siganus oramin 细条天竺鲷 Apogon lineatus 表 2 大亚湾夏季鱼类生物量粒径谱主要参数比较
Table 2 Comparison of main parameters of fish biomass size spectrum of Daya Bay in summer
年份
Year总生物量
Total biomass/(kg·km−2)粒径级范围
Size range/g峰值对应粒径级
Size class of the peak/g拟合方程
Fitted equationR2 2015 632.6 [0.5,512] [8,16] y=−0.33x2+2.03x+10.76 0.95 2017 359.4 [0.5,256] [8,16] y=−0.50x2+3.19x+8.45 0.97 2018 830.6 [0.5,512] [16,32] y=−0.37x2+2.59x+7.76 0.92 表 3 大亚湾海域夏季各区域鱼类Sheldon 型生物量粒径谱年际比较
Table 3 Interannual comparison of Sheldon-type biomass particle size spectra of fish in different regions of Daya Bay in summer
年份
Year海域
Area峰型
Peak shape粒径级
范围
Size range/g峰值区
Peak zone/g主要物种组成
Major species composition2015 沿岸海域 单峰 [0.5,128] [8,16] 短吻鲾
Leiognathus brevirostris南方䲗
Callionymus meridionalis及达副叶鲹
Alepes djedaba中部海域 单峰 [0.5,128] [8,16] 短吻鲾
Leiognathus brevirostris南方䲗
Callionymus meridionalis六指马鲅
Polynemus sextarius湾口海域 单峰 [0.5,128] [8,16] 南方䲗
Callionymus meridionalis短吻鲾
Leiognathus brevirostris黄鳍马面鲀
Thamnaconus hypargyreus2017 沿岸海域 单峰 [0.5,256] [8,16] 短吻鲾
Leiognathus brevirostris黄斑蓝子鱼
Siganus oramin䱨
Therapon theraps中部海域 单峰 [1,128] [8,16] 短吻鲾
Leiognathus brevirostris黄斑蓝子鱼
Siganus oramin李氏䲗
Callionymus richardsoni湾口海域 单峰 [1,128] [8,16] 黄斑蓝子鱼
Siganus oramin短吻鲾
Leiognathus brevirostris李氏䲗
Callionymus richardsoni2018 沿岸海域 单峰 [0.5,128] [32,64] 金钱鱼
Scatophagus argus白姑鱼
Argyrosomus argentatus黄鳍鲷
Acanthopagrus latus中部海域 直线 [1,512] − − 湾口海域 单峰 [1,128] [16,32] 二长棘犁齿鲷
Evynnis cardinalis截尾白姑鱼
Pennahia anea丽叶鲹
Caranx kalla注:−. 无数据 Note: −. no data 表 4 大亚湾海域夏季各区域鱼类标准化生物量粒径谱年际比较
Table 4 Interannual comparison of normalized biomass particle size spectra of fish in different regions of Daya Bay in summer
年份
Year海域
Area生物量
Biomass/(g·km−2)拟合曲线方程
Fit curve equation曲率
CurvatureR2 2015 沿岸海域 84 883.1 y=−0.33x2+1.61x+9.83 −0.33 0.84 中部海域 82 837.2 y=−0.37x2+1.94x+9.29 −0.37 0.77 湾口海域 57 665.3 y=−0.46x2+2.78x+6.77 −0.46 0.88 2017 沿岸海域 137 681.5 y=−0.43x2+2.60x+8.58 −0.43 0.98 中部海域 74 723.9 y=−0.52x2+3.48x+5.78 −0.52 0.97 湾口海域 52 992.3 y=−0.65x2+4.73x+2.55 −0.65 0.97 2018 沿岸海域 112 390.1 y=−0.37x2+2.55x+7.40 −0.37 0.97 中部海域 14 693.2 y=−0.03x2+0.21x+5.14 −0.03 0.93 湾口海域 16 183.2 y=−0.42x2+2.78x+4.47 −0.42 0.72 表 5 亚湾海域夏季主要环境因子的年际变化
Table 5 Interannual variations of major environmental factors in Daya Bay in summer
年份
Year海表温度
Sea surface temperature/℃海表盐度
Sea surface salinity水深
Water depth/mpH 溶解氧
Dissolved oxygen/(mg·L−1)2015 26.20~30.10 32.73~35.73 3.30~19.00 7.89~8.32 4.80~8.88 2017 27.50~30.90 26.06~35.03 2.50~19.50 8.05~8.49 5.63~11.93 2018 29.20~33.60 20.94~30.52 3.00~16.00 8.30~8.52 4.36~9.68 表 6 大亚湾海域夏季主要鱼类物种生物量的年际比较
Table 6 Interannual comparison of biomass of major fish species in Daya Bay in summer
物种
Species2015 2017 2018 密度
Density/
(尾·km−2)生物量
Biomass/
(kg·km−2)密度
Density/
(尾·km−2)生物量
Biomass/
(kg·km−2)密度
Density/
(尾·km−2)生物量
Biomass/
(kg·km−2)青石斑鱼 Epinephelus awoara 63 0.4 40 2.0 138 17.0 带鱼 Trichiurus lepturus 0 0 40 0.6 69 4.8 真鲷 Pagrosomus major 0 0 0 0 207 8.7 黄姑鱼 Nibea albiflora 0 0 40 4.6 69 22.1 金钱鱼 Scatophagus argus 0 0 0 0 322 15.9 -
[1] SHELDON R W, PARSONS T R. A continuous size spectrum for particulate matter in the sea[J]. J Fish Res Board Can, 1967, 24(5): 909-915. doi: 10.1139/f67-081
[2] 郭建忠, 陈作志, 徐姗楠. 鱼类粒径谱研究进展[J]. 海洋渔业, 2017, 39(5): 582-591. doi: 10.3969/j.issn.1004-2490.2017.05.012 [3] 周林滨, 谭烨辉, 黄良民, 等. 水生生物粒径谱/生物量谱研究进展[J]. 生态学报, 2010, 30(12): 3319-3333. [4] LEFORT S, AUMONT O, BOPP L, et al. Spatial and body-size dependent response of marine pelagic communities to projected global climate change[J]. Global Change Biol, 2015, 21(1): 154-164. doi: 10.1111/gcb.12679
[5] GUIET J, POGGIALE J C, MAURY O. Modelling the community size-spectrum: recent developments and new directions[J]. Ecol Model, 2016, 337: 4-14. doi: 10.1016/j.ecolmodel.2016.05.015
[6] DUPLISEA D E, KERR S R. Application of a biomass size spectrum model to demersal fish data from the scotian shelf[J]. J Theor Biol, 1995, 177(3): 263-269. doi: 10.1006/jtbi.1995.0243
[7] GRAHAM N, DULVY N K, JENNINGS S, et al. Size-spectra as indicators of the effects of fishing on coral reef fish assemblages[J]. Coral Reefs, 2005, 24(1): 118-124. doi: 10.1007/s00338-004-0466-y
[8] JUNG S, HOUDE E D. Fish biomass size spectra in Chesapeake Bay[J]. Estuar Coast, 2005, 28(2): 226-240. doi: 10.1007/BF02732857
[9] BLANCHARD J L, ANDERSEN K H, SCOTT F, et al. Evaluating targets and trade-offs among fisheries and conservation objectives using a multispecies size spectrum model[J]. J Appl Ecol, 2014, 51(3): 612-622. doi: 10.1111/1365-2664.12238
[10] 林秋奇, 赵帅营, 韩博平, 等. 广东流溪河水库后生浮游动物生物量谱时空异质性[J]. 湖泊科学, 2006, 18(6): 661-669. doi: 10.3321/j.issn:1003-5427.2006.06.016 [11] 宋伦, 王年斌, 宋永刚, 等. 辽宁近岸浑浊海域网采浮游生物的粒径结构特征[J]. 应用生态学报, 2013, 24(4): 900-908. [12] 林岿璇, 张志南, 王睿照. 东、黄海典型站位底栖动物粒径谱研究[J]. 生态学报, 2004, 24(2): 241-245. doi: 10.3321/j.issn:1000-0933.2004.02.011 [13] 饶义勇, 蔡立哲, 黄聪丽, 等. 湛江高桥红树林湿地底栖动物粒径谱[J]. 生态学报, 2015, 35(21): 7182-7189. [14] 徐姗楠, 郭建忠, 陈作志, 等. 大亚湾鱼类生物量粒径谱特征[J]. 中国水产科学, 2019, 26(1): 34-43. [15] CHEN Z Z, XU S N, QIU Y S. Using a food-web model to assess the trophic structure and energy flows in Daya Bay, China[J]. Cont Shelf Res, 2015, 111: 316-326. doi: 10.1016/j.csr.2015.08.013
[16] FETZER W W, ROTH B M, INFANTE D M, et al. Spatial and temporal dynamics of nearshore fish communities in Lake Michigan and Lake Huron[J]. J Great Lakes Res, 2017, 43(2): 319-334. doi: 10.1016/j.jglr.2016.12.003
[17] LOTZE H K, LENIHAN H S, BOURQUE B J, et al. Depletion, degradation, and recovery potential of estuaries and coastal seas[J]. Science, 2005, 312(5781): 1806-1809.
[18] 徐恭昭. 大亚湾环境与资源[M]. 合肥: 安徽科学技术出版社, 1989: 245-272. [19] SUN C C, WANG Y S, WU M L, et al. Seasonal variation of water quality and phytoplankton response patterns in Daya Bay, China[J]. Int J Env Res Pub, 2011, 8(7): 2951-2966. doi: 10.3390/ijerph8072951
[20] 谢福武, 刘华雪, 黄洪辉, 等. 大亚湾浮游植物粒级结构对温排水和营养盐输入的响应[J]. 热带海洋学报, 2018, 37(3): 55-64. [21] 杜飞雁, 李纯厚, 廖秀丽, 等. 大亚湾海域浮游动物生物量变化特征[J]. 海洋环境科学, 2006, 25(S1): 37-39. [22] 王肇鼎, 练健生, 胡建兴, 等. 大亚湾生态环境的退化现状与特征[J]. 生态科学, 2003, 22(4): 313-320. doi: 10.3969/j.issn.1008-8873.2003.04.006 [23] 王雪辉, 杜飞雁, 邱永松, 等. 1980-2007年大亚湾鱼类物种多样性、区系特征和数量变化[J]. 应用生态学报, 2010, 21(9): 2403-2410. [24] 陈丕茂, 袁华荣, 贾晓平, 等. 大亚湾杨梅坑人工鱼礁区渔业资源变动初步研究[J]. 南方水产科学, 2013, 9(5): 100-108. doi: 10.3969/j.issn.2095-0780.2013.05.016 [25] 郭建忠, 陈作志, 许友伟, 等. 人类活动对大亚湾海域鱼类群落多样性及其演替的影响[J]. 中国水产科学, 2018, 25(3): 595-607. [26] 林昭进, 王雪辉, 江艳娥. 大亚湾鱼卵数量分布及种类组成特征[J]. 中国水产科学, 2010, 17(3): 543-550. [27] 成庆泰, 郑葆珊. 中国鱼类系统检索.下册[M]. 北京: 科学出版社, 1987: 287-293. [28] NELSON J S. Fishes of the World, 4th Edition[J]. Fish Fish, 2006, 7(4): 334. doi: 10.1111/j.1467-2979.2006.00227.x
[29] WARWICK R M. A new method for detecting pollution effects on marine macrobenthic communities[J]. Mar Biol, 1986, 92(4): 557-562. doi: 10.1007/BF00392515
[30] YEMANE D, FIELD J G, LESLIE R W. Exploring the effects of fishing on fish assemblages using Abundance Biomass Comparison (ABC) curves[J]. ICES J Mar Sci, 2005, 62(3): 374-379. doi: 10.1016/j.icesjms.2005.01.009
[31] 晏磊, 谭永光, 杨炳忠, 等. 基于张网渔业休渔前后的黄茅海河口渔业资源群落比较[J]. 南方水产科学, 2016, 12(6): 1-8. doi: 10.3969/j.issn.2095-0780.2016.06.001 [32] SPRULES W, MUNAWAR M. Plankton size spectra in relation to ecosystem productivity, size, and perturbation[J]. Can J Fish Aquat Sci, 1986, 43(9): 1789-1794. doi: 10.1139/f86-222
[33] SPRULES W G, STOCKWELL J D. Size-based biomass and production models in the St Lawrence Great Lakes[J]. ICES J Mar Sci, 1995, 52(3/4): 705-710.
[34] KERR S R, DICKIE L M. The biomass spectrum[M]. New York: Columbia University Press, 2001: 110-128.
[35] MACPHERSON E, GORDOA A. Biomass spectra in benthic fish assemblages in the Benguela System[J]. Mar Ecol Prog, 1996, 138(1/2/3): 27-32.
[36] TREBILCO R, BAUM J K, SALOMON A K, et al. Ecosystem ecology: size-based constraints on the pyramids of life[J]. Trends Ecol Evol, 2013, 28(7): 423-431. doi: 10.1016/j.tree.2013.03.008
[37] ROCHET M J, BENOIT E. Fishing destabilizes the biomass flow in the marine size spectrum[J]. Proc Biol Sci, 2012, 279(1727): 284-292. doi: 10.1098/rspb.2011.0893
[38] 詹秉义. 渔业资源评估[M]. 北京: 中国农业出版社, 1995: 257-260. [39] SHINDO S. General review of the trawl fishery and the demersal fish stocks of the South China Sea[R]. Rome: FAO Fish Tech Pap, 1973, 120: 1-49.
[40] SHELDON R W, PRAKASH A, SUTCLIFFE W H. The size distribution of particles in the ocean[J]. Limnol Oceanogr, 1972, 17(3): 327-340. doi: 10.4319/lo.1972.17.3.0327
[41] PINKAS L, OLIPHANT M S, IVERSON I L K. Food habits of albacore, bluefin tuna, and bonito in California waters[J]. Calif Dep Fish Game, Fish Bull, 1971, 152: 1-105.
[42] CLARKE K R, AINSWORTH M. A method of linking multivariate community structure to environmental variables[J]. Mar Ecol Prog Ser, 1993, 92(3): 205-219.
[43] 李圣法. 以数量生物量比较曲线评价东海鱼类群落的状况[J]. 中国水产科学, 2008, 15(1): 136-144. doi: 10.3321/j.issn:1005-8737.2008.01.018 [44] FENBERG P B, ROY K. Ecological and evolutionary consequences of size-selective harvesting: how much do we know?[J]. Mol Ecol, 2008, 17(1): 209-220. doi: 10.1111/j.1365-294X.2007.03522.x
[45] 王跃中, 孙典荣, 贾晓平, 等. 捕捞压力和气候变化对东海马面鲀渔获量的影响[J]. 南方水产科学, 2013, 9(1): 8-15. doi: 10.3969/j.issn.2095-0780.2013.01.002 [46] 施震, 黄小平. 大亚湾海域氮磷硅结构及其时空分布特征[J]. 海洋环境科学, 2013, 32(6): 118-123. [47] HAEDRICH R L, BARNES S M. Changes over time of the size structure in an exploited shelf fish community[J]. Fish Res, 1997, 31(3): 229-239. doi: 10.1016/S0165-7836(97)00023-4
[48] SVEDANG H. The inshore demersal fish community on the Swedish Skagerrak coast: regulation by recruitment from offshore sources[J]. ICES J Mar Sci, 2003, 60(1): 23-31. doi: 10.1006/jmsc.2002.1329
[49] JENNINGS S, GREENSTREET S P R, HILL L, et al. Long-term trends in trophic structure of the North Sea fish community: evidence from stable-isotope analysis, size spectra and community metrics[J]. Mar Biol, 2002, 141(6): 1085-1097. doi: 10.1007/s00227-002-0905-7
[50] SILVERT W, PLATT T. Energy flux in the pelagic ecosystem: a time-dependent equation[J]. Limnol Oceanogr, 1978, 23(4): 813-816. doi: 10.4319/lo.1978.23.4.0813
[51] MACPHERSON E, GORDOA A, GARCIA-RUBIES A. Biomass size spectra in littoral fishes in protected and unprotected areas in the NW Mediterranean[J]. Estuar Coast Shelf Sci, 2002, 55(5): 777-788. doi: 10.1006/ecss.2001.0939
[52] 郭建忠, 陈作志, 许友伟, 等. 大亚湾鱼类资源数量的时空分布特征[J]. 中国海洋大学学报, 2018, 48(12): 47-55. [53] WANG Y S, LOU Z P, SUN C C, et al. Ecological environment changes in Daya Bay, China, from 1982 to 2004[J]. Mar Pollut Bull, 2008, 56(11): 1871-1879. doi: 10.1016/j.marpolbul.2008.07.017
[54] 李纯厚, 徐姗楠, 杜飞雁, 等. 大亚湾生态系统对人类活动的响应及健康评价[J]. 中国渔业质量与标准, 2015, 5(1): 1-10. -
期刊类型引用(3)
1. 廖祖军,王学锋,周艳波,张磊,吕少梁,吴洽儿,董建宇,马胜伟. 基于结构方程模型分析海洋环境因子对南海鸢乌贼的影响. 南方水产科学. 2024(02): 11-18 .  本站查看
本站查看
2. 李文,蒲艳,田辉伍,邓华堂,成必新,孙干,刘绍平,陈大庆,段辛斌. 黑水河红尾副鳅时空分布特征及其最适生境条件. 中国水产科学. 2023(04): 515-524 .  百度学术
百度学术
3. 张漫瑶,石雯静,桂峰,曾宪敏,徐开达,赵晟. 利用MaxEnt模型的舟山海域曼氏无针乌贼生境适宜性研究. 南方水产科学. 2023(05): 22-31 .  本站查看
本站查看
其他类型引用(4)




 下载:
下载:










 粤公网安备 44010502001741号
粤公网安备 44010502001741号
