Full-length cDNA cloning and tissue expression of major histocompatibility complex(MHC)-Ⅰα from cobia (Rachycentron canadum)
-
摘要:
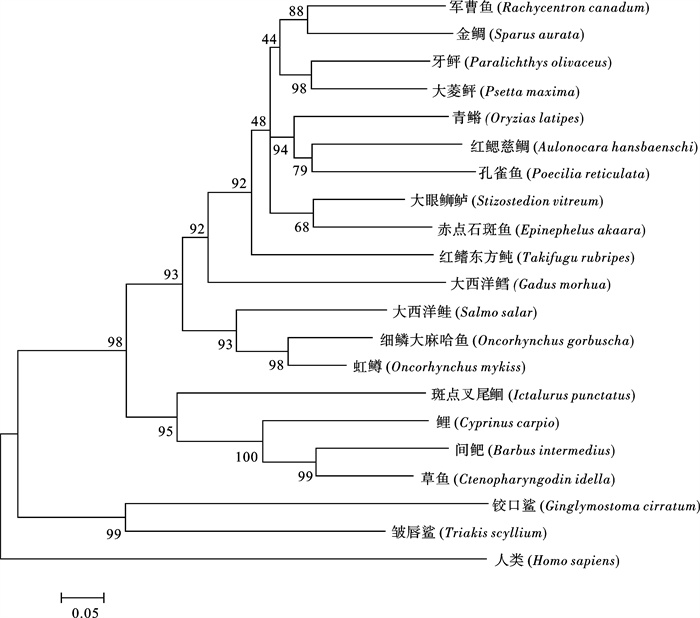
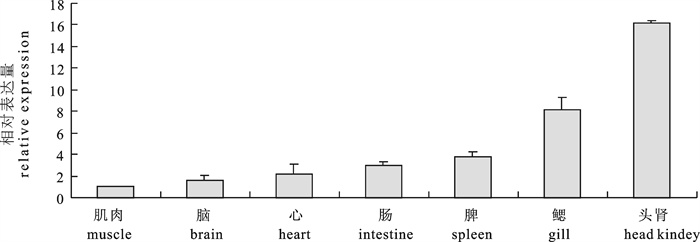
采用同源克隆和末端快速扩增(RACE)方法,得到1 330 bp的军曹鱼(Rachycentron canadum)MHC-Ⅰα全长cDNA片段。该序列包括76 bp的5′末端非编码区(UTR),189 bp的3′UTR及1 065 bp的开放阅读框(ORF),编码354个氨基酸,预测其蛋白质分子量约40.10 kDa,等电点5.70。构建MHC-Ⅰα氨基酸序列的系统进化树并进行氨基酸相似性比对,结果表明,军曹鱼和已知鱼类及人类(Homo sapiens)MHC-Ⅰα氨基酸的同源性在27.9%~67.1%之间。所推测的蛋白序列具有一些重要特征,包括前导肽、α1、α2、α3区、CP/TM/CYT区和保守的半胱氨酸等。Real-time PCR检测结果显示,MHC-Ⅰα基因在各个正常军曹鱼组织中均表达,但表达量各有不同,其中较强的表达于头肾;中等程度表达于鳃、脾和肠;在心、脑和肌肉中表达较弱。
Abstract:We cloned the MHC-Ⅰα gene from cobia (Rachycentron canadium) by homology cloning and RACE PCR. The full-length cDNA of MHC-Ⅰα comprises 1 330 bp with a 76 bp 5′ untranslated region (UTR), a 189 bp 3′ UTR and a 1 065 bp open reading frame (ORF), encoding a polypeptide of 354 amino acid residues with a predicted molecular weight of 40.10 kDa and a theoretical isoelectric point of 5.70. According to the phylogenetic tree and amino acid similarity comparison, the homology of MHC-Ⅰα amino acids between cobia and some known fishes and human (Homo sapiens) varies from 27.9% to 67.1%. The putative protein sequence shows some important features including leader peptide, α1, α2, α3, CP/TM/CYT regions and conserved cysteines, etc.. Real-time PCR result indicates that MHC-Ⅰα expresses in all detected tissues at different expression levels. High expression is detected in head kidney; moderate expression is detected in gill, spleen and intestine; while low expression is detected in heart, brain and muscle.
-
Keywords:
- cobia (Rachycentron canadum) /
- MHC-Ⅰα /
- full-length cDNA /
- tissue-specific expression
-
脂肪是生物个体重要的储能和代谢物质,在相同当量下脂肪所能提供的能量是碳水化合物和蛋白质的两倍[1]。脂肪储备不仅影响海洋生物个体的生活史过程,还可反映生物个体对栖息海域生产力及环境波动变化的适应性[2]。现生头足类 (除鹦鹉螺外) 终生仅一次繁殖产卵,产卵结束后不久便死亡[3],补充群体资源量大小决定于亲本的繁殖潜能和孵化个体的成活率,后两者则与组织能量积累及生殖能量投入分配紧密相关[4]。脂肪作为头足类的重要营养和能量物质之一,其含量占比仅次于蛋白质[5-7]。为此,分析脂肪能量积累及其在生殖能量中的投入分配,对掌握这些种类的生活史过程及资源量的波动变化具有重要的理论价值和实践意义。
阿根廷滑柔鱼 (Illex argentinus),隶属于头足纲、枪形目、柔鱼科,广泛分布在西南大西洋22°S—55°S的大陆架和大陆坡海域,并以35°S—52°S巴塔哥尼亚大陆架海域的资源量最为丰富[8]。该种类是我国远洋鱿钓渔业的三大捕捞对象之一[9],近年来的年均渔获量达10万吨[10]。类似于其他头足类,阿根廷滑柔鱼资源量的年际波动大,补充群体资源量大小与亲体的潜在繁殖力密切相关[8],后者则取决于亲体的生殖能量投入大小[11-12]。肌肉和消化腺组织是阿根廷滑柔鱼最大的能量存储组织[13],前者以蛋白质营养物质组成为主,后者则含有丰富的脂肪[14-16]。已有研究表明,阿根廷滑柔鱼的繁殖产卵策略为间歇性终端产卵型,卵母细胞批次同步发育 (Group-synchronous development)[17];生殖投入策略为收入-资本混合型,在生殖发育过程中,生殖能量来源以现场食物摄食的吸收转化为主,体内存储能量转化利用为辅[18-19]。同时随着性腺发育,卵巢组织的脂肪含量增加显著,而消化腺组织的脂肪含量则在生理性发育成熟期之后呈显著下降趋势[19]。然而,脂肪及其积累对组织能量的贡献度,以及对生殖能量积累的作用,尚鲜有报道。为此,本研究利用组织能量密度测定技术和脂肪萃取技术,测定分析了阿根廷滑柔鱼胴体肌肉、消化腺和性腺等组织的脂肪含量,探索这些组织的脂肪能量积累及其对生殖能量投入的贡献度,为深入了解阿根廷滑柔鱼生殖投入策略提供资料参考,并为其资源的持续开发利用提供科学基础。
1. 材料与方法
1.1 样本来源
阿根廷滑柔鱼雌性样本来自我国远洋鱿钓渔业渔获物,采样时间为2019年1—3月,采样海域为西南大西洋公海海域 (61°09'W—62°53'W, 46°08'S—47°51'S)。每个采集站点平均随机采样50尾,样品于−30 ℃冷冻保存后运回岸上实验室进行分析。
1.2 生物学测定
样本在实验室室温解冻后,进行生物学解剖及生物学参数测量。生物学测定参数包括胴长、体质量、性腺发育成熟度等。胴长测定精确至1 mm,体质量和肌肉组织质量精确至1 g。根据林东明等[20]对阿根廷滑柔鱼性腺发育成熟度等级的划分标准,对实验样本的性腺发育成熟度划分为I、II、III、IV、V、VI、VII和VIII 8个时期;其中,I—II期为性腺未发育期,III期为性腺开始发育期,IV—VI期为性腺发育成熟期,VII期为繁殖期,VIII期为衰败期。本实验样本未见衰败期个体。
阿根廷滑柔鱼的性腺发育滞后于个体生长,自III期起性腺组织迅速生长[8]。因此,本研究选取性腺发育成熟度III期及以上的样本共71尾进行后续研究分析,其中III—VI期每期各15尾,VII期11尾 (表1)。每尾样本剪取胴体腹部肌肉组织约10 g,摘取完整的卵巢、输卵管复合体、消化腺等组织,称量组织湿质量 (Wet weight, WeW),精确至0.001 g,随后于−40 ℃冷冻保存。
表 1 阿根廷滑柔鱼雌性样本的胴长和体质量Table 1 Mantle length and body mass of female I. argentinus samples性腺成熟度Maturity stage 样本个数Sample size 胴长Mantle length/mm 体质量Body mass/g III 15 201.00±12.93 196.77±53.43 IV 15 214.13±15.52 227.07±57.49 V 15 222.67±18.22 230.87±54.30 VI 15 224.60±10.75 244.00±39.92 VII 11 215.64±18.38 197.00±61.86 1.3 能量密度测定及脂肪能量积累估算
1.3.1 组织预处理
肌肉、消化腺、卵巢、输卵管卵子等组织置于冷冻干燥机 (Scientz-48) 中−50 ℃冷冻干燥24~36 h,待干燥至恒质量后取出并称量组织干质量 (Dry weight, DW),测定精确至0.001 g。随后,将干燥组织置于研磨机 (Scientz-10N) 中研磨粉碎。消化腺组织由于含脂量高,无法利用研磨机研磨成粉,因此将其置于研钵中捣碎均匀。各组织研磨捣碎后均分成两份:第一份直接置于氧弹热量仪 (Calorimeter Parr6400, Parr Instrument Company, Moline, IL, USA) 中测定能量密度 (Energy density including lipid content, EDlipid, kJ·g−1);第二份称量质量后,采用Bligh等[21]脂肪萃取方法,利用二氯甲烷-甲醇-蒸馏水混合液 (5∶10∶4,体积比) 萃取组织脂肪,提取脂肪溶液后过滤组织残渣置于恒温干燥箱中干燥12~24 h,然后利用氧弹热量仪测定组织残渣的能量密度值,即为组织脱脂后的能量密度 (Energy density after lipid extraction, EDlipidfree, kJ·g−1)。
1.3.2 脂肪质量分数测定
对1.3.1中提取的脂肪溶液,利用旋转蒸发仪 (Rotavapor R300, BÜCHI, Switzerland) 蒸发去除提取溶剂,随后利用氮吹仪 (JXDC-400) 吹至恒质量,再利用电子天平称取脂肪质量。组织脂肪质量分数为每克干燥组织中的脂肪毫克质量 (mg·g−1)。
1.3.3 组织脂肪能量计算
根据1.3.1测得的每个组织去脂肪前、去脂肪后的能量密度值,计算肌肉、消化腺、卵巢和输卵管卵子等组织的脂肪能量 (Lipid energy, Elipid, kJ),公式为:
$$ E_{\rm {lipid }}=\left[\mathrm{ED}_{\rm {lipid }}-\mathrm{ED}_{\rm {lipidfree }} \times\left(1-L_{\mathrm{r}}\right)\right] \times \mathrm{TW} \times \mathrm{DW} / \mathrm{WeW} $$ (1) 式中:Elipid为计算组织的脂肪能量 (kJ);EDlipid和EDlipidfree分别为计算组织脱脂前和脱脂后的能量密度 (kJ·g−1);TW为计算组织的总湿质量 (g);DW为脂肪萃取组织样品的干质量 (g);WeW为脂肪萃取组织样品的湿质量 (g);Lr 为计算组织的脂肪质量分数百分比 (%)。
1.3.4 组织脂肪能量占比计算
根据公式 (1) 得到的组织脂肪能量计算肌肉、消化腺、卵巢和输卵管卵子等组织的脂肪能量占比 (Percentage of lipid energy, PElipid,%),公式为:
$$ \mathrm{PE}_{\text {lipid }}=E_{\text {lipid }} /\left(\mathrm{ED}_{\text {lipid }} \times \mathrm{TW} \times \mathrm{DW} / \mathrm{WeW}\right) $$ (2) 式中:PElipid为计算组织的脂肪能量占比;Elipid为计算组织的脂肪能量 (kJ);EDlipid为计算组织去脂肪前的能量密度 (kJ·g−1);TW为计算组织的总湿质量 (g);DW为脂肪萃取组织样品的干质量 (g);WeW为脂肪萃取组织样品的湿质量 (g)。
1.4 数据处理
应用R统计平台处理分析实验数据,所有数据以“均值±标准差 (
$\overline { X}\pm { \rm {SD}} $ )”表示。利用单样本Kolmogorov-Smirnoff分析检验各组织能量密度、脂肪质量分数、脂肪能量及脂肪能量占比等数据的正态性。若符合正态分布,则利用单因素方差分析 (One-way ANOVA) 检验分析各数据分布的性腺发育成熟度差异性,并进行Tukey HSD随后检验;若不符合正态分布,则利用Kruskall-Wallis非参数检验分析各数据分布的性腺发育成熟度差异性,利用Games-Howell HSD进行随后的显著性检验。同时,利用Pearson相关性分析探究性腺组织 (卵巢、输卵管卵子合并)与 肌肉、消化腺等组织的脂肪质量分数、脂肪能量及脂肪能量占比等之间的关系。统计分析的显著性水平为P<0.05。2. 结果
2.1 肌肉组织能量密度和脂肪积累及其能量贡献
脱脂前,肌肉组织能量密度介于19.02~20.54 kJ·g−1,平均值为(19.80±0.31) kJ·g−1;在不同性腺发育时期,肌肉组织能量密度值无显著性差异 (F=2.55,P=0.05,图1-a)。脱脂后,组织能量密度介于17.16~19.65 kJ·g−1,平均值为 (18.10±0.48) kJ·g−1;与脱脂前相比,能量密度值下降显著 (χ2=102.22, P<0.05),平均下降 (8.54±2.58)%;然而,脱脂后的组织能量密度值在不同性腺发育时期也无显著性差异 (χ2=2.87,P=0.58,图1-a)。
![]() 图 1 阿根廷滑柔鱼肌肉组织能量密度、脂肪质量分数、脂肪能量及其占比随性腺发育的分布注:不同字母表示随后检验差异显著 (P<0.05),后图同此。Fig. 1 Distribution of tissue energy density, lipid mass fraction, lipid energy and percentage of lipid energy for mantle soma in I. argentinus during maturation progressNote: Different letters indicate significant difference (P<0.05). The same case in the following figures.
图 1 阿根廷滑柔鱼肌肉组织能量密度、脂肪质量分数、脂肪能量及其占比随性腺发育的分布注:不同字母表示随后检验差异显著 (P<0.05),后图同此。Fig. 1 Distribution of tissue energy density, lipid mass fraction, lipid energy and percentage of lipid energy for mantle soma in I. argentinus during maturation progressNote: Different letters indicate significant difference (P<0.05). The same case in the following figures.肌肉组织的脂肪质量分数介于65.04~234.97 mg·g−1,平均值为 (148.72±38.85) mg·g−1,脂肪能量介于80.22~477.94 kJ,平均值为 (217.43±76.40) kJ,脂肪能量占比为12.00%~29.92%,平均值为 (22.18±3.91)%。在不同性腺发育时期,肌肉组织脂肪能量存在显著性差异 (F=4.43, P<0.05),在III期最大 [(287.71±110.89) kJ],随后呈下降趋势 (图1-b);然而,脂肪质量分数、脂肪能量占比均无显著性差异 (脂肪质量分数:F=0.25,P=0.91;脂肪能量占比:F=0.39,P=0.81;图1-b)。
2.2 消化腺组织能量密度和脂肪积累及其能量贡献
消化腺脱脂前的组织能量密度介于24.69~31.15 kJ·g−1,平均值为 (30.44±1.97) kJ·g−1;随着性腺发育,组织能量密度值下降显著 (χ2=22.13, P<0.05),在VII期最小 [(28.50±2.19) kJ·g−1 ,图2-a)]。脱脂后,消化腺组织能量密度值下降显著(χ2=104.26, P<0.05),平均下降(36.80±5.32)%;组织能量密度介于17.66~21.53 kJ·g−1,平均值为 (19.19±1.33) kJ·g−1。与脱脂前的不同,脱脂后的组织能量密度值随着性腺发育显著增大 (χ2=17.25, P=0.002),在VI期达到最大值 [(20.05±1.34) kJ·g−1,图2-a]。
消化腺的脂肪质量分数介于319.92~833.88 mg·g−1,平均值为 (591.76±115.24) mg·g−1;脂肪能量介于21.71~756.97 kJ,平均值为 (195.65±161.72) kJ;脂肪能量占比介于52.03%~90.77%,平均值为 (73.81±8.89)%。随着性腺发育,消化腺的脂肪质量分数、脂肪能量及其占比均显著下降 (脂肪质量分数:F=12.02,P<0.05;脂肪能量:F=6.75,P<0.05;脂肪能量占比:F=12.91,P<0.05),且均在VII期时达到最小值,分别为 (491.03±95.12) mg·g−1、(75.42±54.19) kJ和 (65.30±9.02)% (图2-b)。
2.3 卵巢组织能量密度和脂肪积累及其能量贡献
脱脂前,卵巢的组织能量密度介于22.29~23.97 kJ·g−1,平均值为 (23.29±0.94) kJ·g−1;随着性腺发育,卵巢的组织能量密度显著增加 (χ2=35.56, P<0.05),在VI期达到最大值 [(23.85±0.49) kJ·g−1,图3-a]。脱脂后,卵巢的组织能量密度值均下降显著 (χ2=103.75, P<0.05),平均下降 (15.83±3.63)%,平均组织能量密度为 (19.57±0.50) kJ·g−1,不同性腺发育时期的组织能量密度值无显著性差异 (F=0.82,P=0.52,图3-a)。
卵巢的脂肪质量分数介于219.00~634.24 mg·g−1,平均值为 (436.33±115.04) mg·g−1;脂肪能量介于3.07~130.36 kJ,平均值为 (42.49±27.88) kJ;脂肪能量占比介于29.98%~71.08%,平均值为 (52.36±11.06)%。随着性腺发育,卵巢的脂肪质量分数、脂肪能量及其占比均在IV期达到最大值 (脂肪质量分数:F=10.85, P<0.05;脂肪能量:F=10.84, P<0.05;脂肪能量占比:F=12.72, P<0.05),分别为 (528.24±96.38) mg·g−1、(58.24±27.41) kJ和 (60.91±9.21)%;随后呈下降趋势,在VII期达到最小值,分别为 (373.29±59.30) mg·g−1、(20.70±12.54) kJ和 (46.53±6.43)% (图3-b)。
2.4 输卵管卵子组织能量密度和脂肪积累及其能量贡献
脱脂前,输卵管卵子的组织能量密度介于24.69~25.78 kJ·g−1,平均值为 (25.38±0.40) kJ·g−1;脱脂后的组织能量密度显著下降 (χ2=76.50, P<0.05),平均下降了 (17.65±1.81)%,平均组织能量密度为 (20.91±0.39) kJ·g−1。在不同性腺发育时期,输卵管卵子脱脂前后的组织能量密度值均无显著差异 (脱脂前:χ2=4.80,P=0.19;脱脂后:F=2.35,P=0.08;图4-a)。
输卵管卵子的脂肪质量分数介于361.60~778.64 mg·g−1,平均值为 (620.69±90.38) mg·g−1;脂肪能量介于8.12~197.87 kJ,平均值为 (63.71±45.19) kJ;脂肪能量占比介于48.35%~81.91%,平均值为 (68.82±7.69)%。在不同性腺发育时期,输卵管卵子的脂肪质量分数没有显著性差异 (F=1.40,P=0.26;图4-b);脂肪能量在不同性腺发育时期也存在显著性差异 (F=18.12, P<0.05),随着性腺发育不断增大,在VI期达到最大值 (Tukey HSD, P<0.05),为 (98.11±39.86) kJ (图4-b);然而,脂肪能量占比保持相对稳定水平,在不同性腺发育成熟度之间无显著性差异 (F=1.65,P=0.19;图4-b)。
2.5 性腺与肌肉、消化腺之间脂肪积累的关系
Pearson相关性分析显示,性腺 (合并卵巢和输卵管卵子) 与消化腺之间的脂肪质量分数、脂肪能量和脂肪能量占比均呈显著负相关性 (脂肪质量分数:R=−0.37, t=−3.28, P<0.05;脂肪能量:R=−0.39, t=−3.42, P<0.05;脂肪能量占比:R=−0.39, t=−3.44, P<0.05),即随着性腺组织脂肪质量分数及其能量积累的增加,消化腺组织中相应的脂肪质量分数及其能量积累降低 (图5)。
相反,性腺与肌肉组织之间的脂肪质量分数、脂肪能量均无显著相关性 (脂肪质量分数:R=0.09, t=0.71, P=0.48;脂肪能量:R=−0.05, t=−0.44, P=0.66;图6-a、6-b);在脂肪能量占比上,两者呈弱的正相关关系但不显著 (R=0.21, t=1.76, P=0.08;图6-c)。
3. 讨论
3.1 组织的脂肪积累及能量贡献
蛋白质、脂肪和碳水化合物既是头足类体内3种重要的营养物质,也是组织能量存储的物质基础[5-7]。本研究发现,阿根廷滑柔鱼消化腺、肌肉、卵巢和输卵管卵子等的组织能量密度在脱脂后均显著下降。其中,消化腺的组织能量密度下降最大 (平均下降37%);肌肉的组织能量密度下降最小 (平均下降9%);卵巢、输卵管卵子的组织能量密度则分别下降了16%和18%。同时,脂肪能量在卵巢、输卵管卵子、消化腺和肌肉等组织能量积累中的占比分别为52%、69%、74%和22%。可见脂肪是阿根廷滑柔鱼组织能量积累存储的重要营养物质。
然而,阿根廷滑柔鱼在能量积累过程中对脂肪物质的积累存在组织特殊性。在脱脂前后,雌性个体的肌肉和输卵管卵子的能量密度值均不随性腺发育而显著变化;而且,两组织的脂肪含量及脂肪能量占比在性腺发育时期均无显著差异性。这些结果说明阿根廷滑柔鱼肌肉、输卵管卵子的脂肪积累水平稳定,同时也表明在性腺发育过程中两者的蛋白质、脂肪和碳水化合物等营养物质的组成比例相对恒定。通常,头足类的肌肉组织以蛋白质为基础、脂肪含量较低,成熟卵子则具有相对稳定的营养物质组成以达成配子质量最优化[6,22]。阿根廷滑柔鱼潜在繁殖力高,繁殖期间批次成熟卵子、多批次排卵[17]。因此,在性腺发育及繁殖期间,个体保持稳定的肌肉组织质量特征及发生营养物质组成稳定的配子将有利于生殖价值的最大化。
相反,卵巢组织脱脂前的能量密度在性腺发育成熟期显著增加,脱脂后的能量密度无显著的性腺发育时期差异性。这表明卵巢组织在能量积累过程中以脂肪物质积累为主,而蛋白质、碳水化合物等营养物质则保持稳定水平,可能与性腺开始发育后卵黄卵母细胞大量发育并积累卵黄物质密切相关[5]。在生理性发育期开始之后,阿根廷滑柔鱼卵巢中的卵黄卵母细胞大量发生,细胞内的卵黄物质较快速地增加,脂肪含量亦增加显著[17,23],与好望角枪乌贼 (Loligo reynaudii) 的卵巢卵母细胞发生及卵黄物质积累过程[24-25]一致。林东明等[26]也发现阿根廷滑柔鱼卵巢组织在性腺发育过程中持续积累脂肪酸供给卵子发生,一定程度上佐证了该种类卵巢组织能量积累过程中对脂肪的积累。同时,本研究发现,卵巢组织在性腺发育成熟前期 (IV期) 的脂肪质量分数、脂肪能量及脂肪能量占比等均显著增加,随后维持相对稳定直至繁殖期 (VII期) 出现较显著的下降。该结果进一步说明了卵巢组织随着性腺的发育不断地积累脂肪;然而,卵巢组织脂肪质量分数在繁殖期呈下降趋势则可能是已有卵黄卵母细胞发生成熟并排入输卵管中[17]所致,且摄食强度下降[27]可能是原因之一。
此外,消化腺组织脱脂前的组织能量密度也存在显著的性腺发育时期差异性。但是,该组织能量密度随着性腺发育呈显著的下降趋势。与此相反,脱脂后的组织能量密度则随着性腺发育显著增加。结合脂肪质量分数、脂肪能量及其占比随性腺发育显著下降的结果,可见消化腺组织中脂肪物质积累随着性腺发育呈下降趋势。但是,在性腺发育过程中,消化腺的脂肪质量分数仅次于输卵管卵子,并且脂肪能量占比在4个组织中最高 (74%)。该结果进一步佐证了阿根廷滑柔鱼消化腺的脂肪含量丰富[5,19],这可能是头足类共有的特性,以实现其较大的能量积累与存储[14-15,28]。
3.2 脂肪积累对生殖能量的贡献
与其他无脊椎动物相类似,现生头足类的繁殖是生活史中能量需求最为紧张的时期,能量积累及其生殖投入的最优化是维持该种类种群资源量的关键[29]。已有研究表明,有些头足类在性腺发育开始之后较快速地转化肌肉组织存储的能量,以供给生殖发育所需的能量[30]。阿根廷滑柔鱼的生殖能量主要依赖于现场摄食食物的吸收和转化,在能量需求较大的生理性发育期和繁殖期会转化部分肌肉组织中存储的能量[18-19]。本研究发现,在生理性发育期,阿根廷滑柔鱼卵巢的组织能量密度显著增加;与此同时,组织中的脂肪质量分数、脂肪能量及其占比均显著增加。在性腺发育成熟期和繁殖期,卵巢、输卵管卵子的脂肪质量分数、脂肪能量均保持较高水平,并且两者的脂肪能量占比均在50%以上。上述结果表明脂肪积累对阿根廷滑柔鱼的生殖能量积累有重要贡献,可能与脂肪具有较大的热量密切相关[1]。一般来说,脂肪所提供的能量是相同当量的碳水化合物或者蛋白质的2倍[1]。Morillo-Velarde等[22]报道了头足类个体在食物资源不足时可有效地转化利用存储的脂肪以供给日均代谢总能量的26%以上。值得注意的是,卵子发生需要较大量的磷脂以形成发育良好的卵膜[31-32]。因此,阿根廷滑柔鱼卵巢和输卵管卵子中的脂肪对生殖能量积累的具体贡献仍需后续深入的研究分析。
通常,头足类消化腺中的脂肪水平与其饵料食物密切相关,可作为食物丰度和系统能量学的重要指标之一[33-35]。Stowasser等[36]和Fluckiger等[37]在实验室喂养实验中也发现圆鳍枪乌贼 (Lolliguncula brevis) 和乌贼 (Sepia officinalis) 消化腺可以快速地转化食性脂肪,其中的脂肪酸可反映最近1~2周的摄食情况。本研究发现,随着性腺发育,卵巢的脂肪质量分数、脂肪能量及其占比均显著增加,而消化腺的脂肪质量分数、脂肪能量及其占比等则显著下降。同时,Pearson相关性分析显示性腺 (卵巢+输卵管卵子) 与消化腺的脂肪质量分数、脂肪能量及其占比均呈显著负相关关系,而与肌肉组织的无显著相关性。可见阿根廷滑柔鱼性腺组织中的脂肪来自于现场食物摄食,也进一步佐证了该种类的生殖能量主要依赖于外源性投入[5,19,27]。
4. 结论
本研究利用组织能量密度测定技术和脂肪萃取技术,测定分析了阿根廷滑柔鱼雌性个体肌肉、消化腺和性腺等组织脱脂前后的组织能量密度及脂肪积累,发现脂肪是该种类组织能量积累存储的重要营养物质。其中,消化腺是最大的脂肪积累组织,脂肪能量占比达74%,其次为输卵管卵子和卵巢,肌肉组织的脂肪能量占比最低 (22%)。在组织能量积累过程中,阿根廷滑柔鱼的脂肪积累存在组织特殊性,肌肉和输卵管卵子的脂肪积累水平稳定,而卵巢和消化腺的脂肪积累存在显著的性腺发育时期差异性,前者在性腺发育成熟时显著增加,后者随着性腺发育显著下降。同时,性腺组织与消化腺组织的脂肪质量分数、脂肪能量及其占比等均呈显著的负相关关系,而与肌肉组织的脂肪质量分数、脂肪能量及其占比等无显著相关性。上述结果表明,阿根廷滑柔鱼的脂肪积累对其生殖能量积累有重要贡献,性腺组织的脂肪积累与表征食物来源的消化腺脂肪积累密切相关,可进一步佐证其生殖能量来源主要依赖于外源性投入,为深入了解其生殖投入策略提供了重要的参考资料。然而,脂肪在配子发生过程中不仅仅作为能量存储物质,也是细胞膜形成的重要成分,尤其是脂肪中的磷脂成分。因此,后续仍需深入开展组织脂肪中不同脂质成分的研究,以深入认识脂肪积累对其生殖能量积累的贡献,为掌握阿根廷滑柔鱼的生殖投入策略提供参考资料。
-
图 1 军曹鱼MHC-Ⅰα cDNA序列及推导的氨基酸序列
起始密码子(ATG)和终止密码子(TGA)用阴影标出,不同区域起始氨基酸用下划线标出; 小写字母表示核酸序列,大写字母表示氨基酸序列;“<”表示区域的起始位置,“>”表示区域的终止位置,这些区域包括前导肽、3个胞外区(α1、α2和α3)、跨膜区、连接肽和胞浆区
Figure 1. cDNA sequence of MHC-Ⅰα from cobia and deduced amino acid sequence
The start and stop codons are shown in shadow; the start amino acid of different region is underlined.Lowercase letters indicate nucleotide sequence; capital letters indicate amino acid sequence; " < " indicates the initial position of the region; ">" indicates the final position of the region; these regions include the leader peptide, α1, α2 and α3 regions as well as CP/TM/CYT region (connecting peptide, transmembrane and cytoplasm)
图 2 推导的军曹鱼MHC-Ⅰα氨基酸与其他已知物种MHC-Ⅰα氨基酸比对图
上述序列比对对应不同的区域:前导肽、α1区、α2区和CP/TM/CYT区。“*”表示所有序列中都一致的氨基酸;“:”表示保守的氨基酸;“.”表示半保守的氨基酸;深色阴影部分为军曹鱼和其他鱼类差异不显著的位点;浅色阴影部分为军曹鱼和其他鱼类差异显著的位点。
Figure 2. Sequence alignment of predicted MHC-Ⅰα amino acid from cobia and MHC-Ⅰα amino acid from other known species
Regions corresponding to the putative leader peptide, α1, α2 and CP/TM/CYT regions are shown above the sequences. "*"means that the residues or nucleotides in that column are identical in all sequences in the alignment. ": " means that conserved substitutions have been observed. "." means that semi-conserved substitutions are observed. The dark shadow areas indicate no significant difference between cobia and other fish species; the light shadow parts indicate significant difference between cobia and other fish species.
表 1 试验中所用到的引物序列
Table 1 Primer sequences used in tests
引物名称 primer 核酸序列 (5′~3′) nucleotide sequence 应用范围 scope of application RCMC1AF GGATGAAGGGACAAATGA 同源克隆 RCMC1AR GATAGAAACCTGTAGCGTG 同源克隆 oligo-dT接头引物 AAGCAGTGGTATCAACGCAGAGTACT(30)VN 反转录 SMART 3a CAGAGTACTTTTTTTTTTTTTTTT 3′RACE RCMC32AOUT TRACAGAGGTTKGAACACACAG 3′RACE RCMC32AIN AAGTCTCCCTCCTCTTCAGTCAGC 3′RACE RCMC52AOUT GCTGACTGAAGAGGAGGGAGAC 5′RACE RCMC52AIN GRWKTGTSYTGASTGGGTGAAG 5′RACE olido-dG GGGGGGGGGGGGGGG(A/T/C) 5′RACE β-ActinF TGCTGTCCCTGTATGCC RT-PCR内参 β-ActinR TGATGCTGTTGTAGGTGGTC RT-PCR内参 J1AF GCTGACTGAAGAGGAGGG RT-PCR J1AR TGAATGGGATGAAGGGAC RT-PCR 表 2 军曹鱼MHC-Ⅰα氨基酸与其他已报道动物氨基酸同源性分析
Table 2 Homology analysis of amino acids of MHC-Ⅰα from cobia and other reported animals
物种 species 同源性/% homology 注册号 accession No. 参考文献 references 大菱鲆(Psetta maxima) 67.1 ABM92962 WANG等(2008)[14] 大眼 
65.0 AAL11412 牙鲆(Paralichthys olivaceus) 64.6 BAD13368 SRISAPOOME等(2004)[15] 金鲷(Sparus aurata) 63.5 DQ211540 孔雀鱼(Poecilia reticulata) 61.3 CAA90791 青鳉(Oryzias latipes) 61.2 BAB83849 MATSUO等(2002)[16] 赤点石斑鱼(Epinephelus akaara) 60.9 ABX80521 红鳃慈鲷(Aulonocara hansbaenschi) 56.8 AAD37812 SATO等(1997)[17] 红鳍东方鲀(Takifugu rubripes) 55.6 AAC41238 TIMON等(1998)[18] 虹鳟(Oncorhynchus mykiss) 53.4 AAG25199 AOYAGI等(2002)[19] 细鳞大麻哈鱼(O.gorbuscha) 51.9 BAA09553 大西洋鳕(Gadus morhua) 51.8 AAL14532 MILLER等(2002)[20] 大西洋鲑(Salmo salar) 48.5 AAN75116 GRIMHOLT等(2002)[21] 鲤(Cyprinus carpio) 43.1 CAA62497 草鱼(Ctenopharyngodon idellus) 43.0 AAS76087 间鲃(Barbus intermedius) 43.0 CAD44955 KRUISWIJK等(2004)[22] 斑点叉尾 
40.6 AAG29241 ANTAO等(2001)[23] 人类(Homo sapiens) 27.9 CAC15502 铰口鲨(Ginglymostoma cirratum) 32.2 AAC60347 BARTL等(1997)[24] 皱唇鲨(Triakis scyllium) 36.0 AAB97322 OKAMURA等(1997)[25] -
[1] 周光炎. 免疫学原理[M]. 上海: 上海科学技术出版社, 2000: 63-121. ZHOU Guangyan. Principles of immunology[M]. Shanghai: Shanghai Science and Technology Publishing Press, 2000: 63-121. (in Chinese)
[2] 王重庆. 分子免疫学基础[M]. 北京: 北京大学出版社, 1997: 139-140. https://xueshu.baidu.com/usercenter/paper/show?paperid=7011b8fc62ce53426e3df3d303ccafc9&site=xueshu_se WANG Chongqing. Molecular immunology[M]. Beijing: Peking University Press, 1997: 139-140. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=7011b8fc62ce53426e3df3d303ccafc9&site=xueshu_se
[3] HASHIMOTO K, NAKANISHI T, KOROSAWA K. Isolation of carp genes encoding major histocompatibility complex antigens[J]. Proc Natl Acad Sci USA, 1990, 87(17): 6863-6867. doi: 10.1073/pnas.87.17.6863
[4] GRIMHOLT U B, HORDVIK I, FOSSE V M, et al. Molecular cloning of major histocompatibility complex classⅠcDNAs from Atlantic salmon (Salmo salar)[J]. Immunogenet, 1993, 37(6): 469-473. doi: 10.1007/BF00222473
[5] HANSEN J D, STRASSBURGER P, DU PASQUIER L. Conservation of an alpha 2 domain within the teleostean world, MHC class Ⅰ from the rainbow trout Oncorhynchus mykiss[J]. Dev Comp Immunol, 1996, 20(6): 417-425. doi: 10.1016/S0145-305X(96)00030-4
[6] van ERP S H M, DIXON B, FIGUEROA F, et al. Identification and characterization of a new major histocompatibility complex classⅠgene in carp (Cyprinus carpio L. )[J]. Immunogenet, 1996, 44(1): 49-61. doi: 10.1007/BF02602656
[7] FUJIKI K, BOOMAN M, DIXON E C, et al. Cloning and characterization of cDNA clones encoding membrane-bound and potentially secreted major histocompatibility classⅠreceptors from walleye (Stizostedion vitreum)[J]. Immunogenet, 2001, 53(9): 760-769. doi: 10.1007/s00251-001-0400-1
[8] YANG Tianyao, HAO Huifang, JIA Zhenhu, et al. Characterization of grass carp (Ctenopharyngodon idellus)MHC classⅠdomain lineages[J]. Fish Shellfish Immunol, 2006, 21(5): 583-591. doi: 10.1016/j.fsi.2006.03.005
[9] 孟庆闻. 鱼类学[M]. 上海: 上海科学技术出版社, 1987: 261-263. MENG Qingwen. Ichthyology[M]. Shanghai: Shanghai Science and Technology Publishing Press, 1987: 261-263. (in Chinese)
[10] 勾效伟, 区又君, 廖锐. 我国军曹鱼研究现状[J]. 海洋渔业, 2007, 29(1): 84-89. https://www.docin.com/p-1128663622.html GOU Xiaowei, OU Youjun, LIAO Rui. Present status on studies of cobia Rachycentron canadum in China[J]. Mar Fish, 2007, 29(1): 84-89. (in Chinese) https://www.docin.com/p-1128663622.html
[11] 简纪常, 吴灶和, 陈刚, 等. 海水网箱养殖军曹鱼弧菌病病原的分离及其特性[J]. 中国兽医学报, 2003, 23(4): 329-330. doi: 10.3969/j.issn.1005-4545.2003.04.007 JIAN Jichang, WU Zaohe, CHEN Gang, et al. Isolation and characteristics of pathogen of vibriosis in cobia (Rachycentron canadum) maricultured in cage[J]. Chinese J Vet Sci, 2003, 23(4): 329-330. (in Chinese) doi: 10.3969/j.issn.1005-4545.2003.04.007
[12] 郭明元, 刘广锋, 冯娟. 1株军曹鱼病原弧菌的鉴定及其系统发育树分析[J]. 中国水产科学, 2006, 13(5): 823-828. doi: 10.3321/j.issn:1005-8737.2006.05.020 GUO Mingyuan, LIU Guangfeng, FENG Juan. Identification and phylogenetic analysis of a pathogenic Vibrio sp. isolated from Rachycentron canadum[J]. J Fish Sci China, 2006, 13(5): 823-828. (in Chinese) doi: 10.3321/j.issn:1005-8737.2006.05.020
[13] 常藕琴, 石存斌, 马红, 等. 军曹鱼淋巴囊肿的病理学研究[J]. 中国水产科学, 2006, 13(6): 973-977. doi: 10.3321/j.issn:1005-8737.2006.06.016 CHANG Ouqing, SHI Cunbin, MA Hong, et al. Histopathological study on lymphocystis disease of Rachycentron canadum[J]. J Fish Sci China, 2006, 13(6): 973-977. (in Chinese) doi: 10.3321/j.issn:1005-8737.2006.06.016
[14] WANG Chuanjuan, ZHANG Xiaohua, JIA Airong, et al. Identification of immune-related genes from kidney and spleen of turbot, Psetta maxima(L. ), by suppression subtractive hybridization following challenge with Vibrio harveyi[J]. J Fish Dis, 2008, 31 (7): 505-514. doi: 10.1111/j.1365-2761.2008.00914.x
[15] SRISAPOOME P, OHIRA T, HIRONO I. Cloning, characterization and expression of cDNA containing major histocompatibility complex class Ⅰ, Ⅱ alpha and Ⅱ beta genes of Japanese flounder Pariehthys olivaceus[J]. Fish Sci, 2004, 70(2): 264-276. doi: 10.1111/j.1444-2906.2003.00800.x
[16] MATSUO M Y, ASAKAWA S, SHIMIZU N, et al. Nucleotide sequence of the MHC class Ⅰ genomic region of a teleost, the medaka(Oryziazs latipes)[J]. Immunogenet, 2002, 53 (10/11): 930-940. doi: 10.1007/s00251-001-0427-3
[17] SATO A, KLEIN D, SULTMANN H, FIGUEROA F, et al. Class Ⅰ MHC genes of cichlid fishes: identification, expression, and polymorphism[J]. Immunogenet, 1997, 46 (1): 63-72. doi: 10.1007/s002510050243
[18] TIMON M, ELGAR G, HABU S, et al. Molecular cloning of major histocompatibility complex Class Ⅰ cDNAs from the pufferfish Fugu rubripes[J]. Immunogenet, 1998, 47 (2): 170-173. doi: 10.1007/s002510050343
[19] AOYAGI K, DIJKSTRA J M, XIA C, et al. Classical MHC class Ⅰ genes composed of highly divergent sequence lineages share a single locus in rainbow trout (Oncorhynchus mykiss)[J]. J Immunol, 2002, 168 (1): 260-273. doi: 10.4049/jimmunol.168.1.260
[20] MILLER K M, KAUKINEN K H, SCHULZE A D. Expansion and contraction of major histocompatibility complex genes: a teleostean example[J]. Immunogenet, 2002, 53 (10/11): 941-963. doi: 10.1007/s00251-001-0398-4
[21] GRIMHOLT U, DRABLOS F, JORGENSEN S M, et al. The major histocompatibility Class Ⅰ locus in Atlantic salmon (Salmo salar L. ): polymorphism, linkage analysis and protein modelling[J]. Immunogenet, 2002, 54 (8): 570-581. doi: 10.1007/s00251-002-0499-8
[22] KRUISWIJK C P, HERMSEN T, FUJIKI K, et al. Analysis of genomic and expressed major histocompatibility Class Ⅰ α and class Ⅱ genes in a hexaploid Lake Tana African large barb individual (Barbus intermedius)[J]. Immunogenet, 2004, 55(11): 770-781. doi: 10.1007/s00251-003-0635-0
[23] ANTAO A B, WILSON M, WANG J, et al. Genomic organization and differential expression of channel catfish MHC class Ⅰ genes[J]. Dev Comp Immunol, 2001, 25 (7): 579-595. doi: 10.1016/S0145-305X(01)00017-9
[24] BARTL S, BAISH M A, FLAJNIK M F, et al. Identification of Class Ⅰ genes in cartilaginous fish, the most ancient group of vertebrates displaying an adaptive immune response[J]. Immunol, 1997, 159 (12): 6097-6104. doi: 10.1007/s13258-010-0166-7
[25] OKAMURA K, OTOTAKE M, NAKANISHI T, et al. The most primitive vertebrates with jaws possess highly polymorphic MHC class Ⅰ genes comparable to those of humans[J]. Immunity, 1997, 7 (6): 777-790. doi: 10.1016/S1074-7613(00)80396-9
[26] 金伯泉. 细胞和分子免疫学[M]. 2版. 北京: 科学出版社, 2001: 290-295. https://xueshu.baidu.com/usercenter/paper/show?paperid=bfb812b641f3dbabe87d4d6300bbc9dd&site=xueshu_se JING Boquan. Cellular and molecular immunology[M]. 2nd ed. Beijing: Science Press, 2001: 290-295. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=bfb812b641f3dbabe87d4d6300bbc9dd&site=xueshu_se
-
期刊类型引用(9)
1. 丁鹏,邹晓荣,丁淑仪,白思琦. 基于CNN-BiLSTM模型的黄鳍金枪鱼渔获量与气候因子关系研究. 南方水产科学. 2024(02): 19-26 .  本站查看
本站查看
2. 王月,杨晓明,朱江峰. 中西太平洋自由群鲣资源丰度序列的振荡模态分析. 海洋渔业. 2024(03): 266-274 .  百度学术
百度学术
3. 蒋明峰,陈新军,吕泽华,汪金涛,雷林,许子安,林泓羽,贺海平,贾海滨. 中西太平洋鲣围网渔业入渔指标体系构建与应用. 水产学报. 2024(10): 62-71 .  百度学术
百度学术
4. 王啸,刘文俊,张健. 基于ARIMA的海洋尼诺指数对中西太平洋黄鳍金枪鱼年际CPUE的影响. 南方水产科学. 2023(04): 10-20 .  本站查看
本站查看
5. 蒋明峰,陈新军. 中东太平洋赤道公海海域鱿钓渔业自主休渔效果初步评价. 上海海洋大学学报. 2022(03): 670-676 .  百度学术
百度学术
6. 周晓磊,万辛如,李建云,闫东,邵奎东,张忠兵,张知彬,杜国义,鞠成,徐成. 内蒙古高原长爪沙鼠疫源地鼠疫流行规律及影响因素分析. 中华地方病学杂志. 2022(09): 695-702 .  百度学术
百度学术
7. 刘洋帆,李绪鹏,冯阳,王迪,陈胜军,杨贤庆,吴燕燕,邓建朝. 超高效液相色谱-串联质谱法测定鲣鱼中的生物胺. 食品与发酵工业. 2022(20): 225-230 .  百度学术
百度学术
8. 白思琦,邹晓荣,张鹏,丁鹏. 环境因子对东南太平洋智利竹?鱼渔场时空分布异质性影响. 南方水产科学. 2021(01): 17-24 .  本站查看
本站查看
9. 方伟,周胜杰,赵旺,杨蕊,胡静,于刚,马振华. 黄鳍金枪鱼5月龄幼鱼形态性状对体质量的相关性及通径分析. 南方水产科学. 2021(01): 52-58 .  本站查看
本站查看
其他类型引用(2)



 下载:
下载:











 粤公网安备 44010502001741号
粤公网安备 44010502001741号
