Developmental features of ovary and ultramicroscopic observation of thelycum contents of Harpiosquilla harpax
-
摘要:
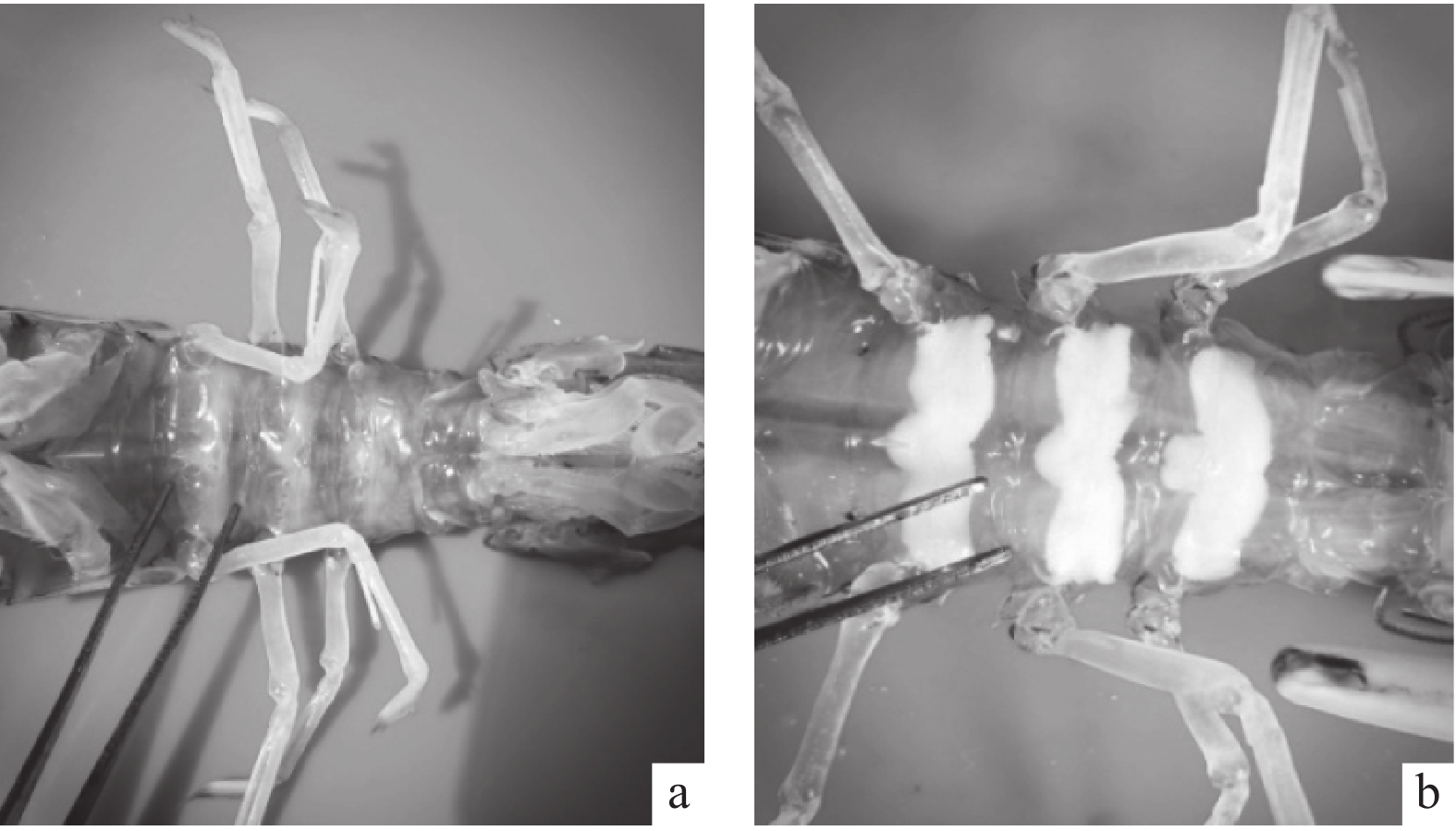
该研究收集了168尾雌性猛虾蛄(Harpiosquilla harpax)并逐一解剖,比较了不同个体猛虾蛄卵巢和纳精结构的发育特征,对乳白色纳精结构内容物进行了超显微观察。结果显示,猛虾蛄具成对的卵巢,位于围心窦和消化道之间,从头胸甲后部延伸至尾节。卵巢发育颜色变化为无色-灰黄色−土黄色−浅黄色−橘黄色,成熟的卵巢呈橘黄色或粉红色。性腺指数分别为1.62±0.53、2.73±0.44、3.82±0.48、6.84±1.04和11.63±2.11;雌性虾蛄第6、第7、第8胸节腹部有3条平行带,为储存精子的器官,其表观颜色也有变化(无色透明−浅白色浑浊−乳白色),性腺成熟度越高,纳精结构乳白色越明显。其内容物具集群状态的精子,群外被包膜,精子间充满丝状间质,精子近球形,无鞭毛,无顶体,大小为1~3 μm。研究结果可为猛虾蛄的繁殖生物学和人工育苗研究提供参考依据。
Abstract:We collected 168 female Harpiosquilla harpax and dissected them individually for a comparison of their developmental features of thelycum and ovary, and for ultramicroscopic observation of contents in the milky-white thelycum. The results show that the females had paired ovaries that lied between pericardial sinus and digestive tract, which extended from the back of the breastplate to the tail. The apparent color of ovary changed as follows: colorless−rayish yellow−earthy yellow−light yellow−orange, and the mature ovaries were orange or pink. The gonadosomatic index (GSI) were 1.62±0.53, 2.73±0.44, 3.82±0.48, 6.84±1.04 and 11.63±2.11, respectively. The females had three parallel strips that were visible through the exoskeleton at the sixth, seventh, and eighth thoracic sternites, which were organs for sperm-storage, and the apparent colours of thelycum were changeable (colorless−transparent−light white−turbidity−milk white−dense). The more mature the ovary was, the heavier milk white of the thelycum became. Group of sperms with membranes had been observed in the thelycum contents which were filled with filamentous stroma. The shape of sperm was spherical but without flagellum and acrosome, size of 1~3 μm. The results provide references for further research on the reproductive biology and artificial breeding of H. harpax.
-
Keywords:
- Harpiosquilla harpax /
- ovary /
- thelycum /
- sperm /
- ultramicroscopic observation
-
海洋红酵母(Rhodotorula mucilaginosa)是从海泥中分离出的单细胞真核生物,含有丰富的蛋白质、碳水化合物、不饱和脂肪酸、维生素、消化酶、生长因子及以虾青素为主的类胡萝卜素等多种营养物质[1-3]。海洋红酵母作为生态养殖中广泛应用的饲料添加剂,具有促进水生动物生长、显著提高抗氧化能力、提高成活率和增强机体的非特异性免疫能力的作用[4-5]。目前,海洋红酵母主要作为饵料应用于水产动物(鱼、虾、贝、蟹等)工厂化育苗以及轮虫养殖和营养强化,也可作为饲料添加剂应用于水产动物养殖,能促进生长发育,提高生长率,同时还对改善水质、预防疾病起到积极作用[5-6]。目前在大菱鲆(Scophthalmus maximus L.)、凡纳滨对虾(Litopenaeus vannamei)等水产动物上已开展相关研究[4-5, 7]。
尼罗罗非鱼(Oreochromis niloticus),是联合国粮农组织向世界各国推荐的养殖鱼类之一,2012年中国罗非鱼产量145×104 t,居世界首位[8-9],而有关罗非鱼饲料中海洋红酵母的适宜添加量以及作用效果的研究尚未见报道。该实验通过在饲料中添加不同水平的海洋红酵母,研究其对罗非鱼幼鱼生长性能、消化酶活性以及相关免疫酶活性的影响,探讨罗非鱼幼鱼饲料中海洋红酵母的最适添加量,为海洋红酵母在罗非鱼幼鱼饲料中的应用提供依据。
1. 材料与方法
1.1 实验饲料
海洋红酵母由广州市欣海利生生物科技有限公司提供。海洋红酵母营养成分组成为:水分81.17%、粗蛋白9.27%、总糖4.2%、β-葡聚糖1.3%、β-胡萝卜素1.4 mg · kg-1、虾青素1.0 mg ·kg-1和维生素E 172 mg · kg-1。
采用鱼粉、豆粕和花生粕为主要蛋白源,配制粗蛋白水平为31.2%的6组饲料(表 1)。分别为对照组(不添加)、添加1 g · kg-1、2 g · kg-1、3 g ·kg-1、4 g · kg-1和5 g · kg-1的海洋红酵母组。所有原料粉碎过40目筛后混合均匀,制成直径为1.5mm和2.0 mm的沉性颗粒饲料(F-26(Ⅲ)型双螺旋杆挤条机),将饲料放置在空调房内抽干,置于-20 ℃冰箱中保存备用。
表 1 罗非鱼基础饲料配方和营养成分(干物质)Table 1. Formulation and proximate composition of experimental diets of Nile tilapia (dry matter)% 原料
ingredient饲料成分组成
dietary composition鱼粉fishmeal 8 大豆粕soybean meal 30 花生粕peanut meal 15 次粉wheat flour 30 玉米淀粉corn starch 8 鱼油fish oil 5 维生素预混料1 vitamin mixture 1 矿物质预混料2 mineral mixture 1.5 氯化胆碱(50%) choline choride(50%) 1 卵磷脂lecithin 0.5 营养成分nutrient levels 干物质dry matter 88.9 粗蛋白crude protein 31.6 粗脂肪crude lipid 6.9 灰分ash 7.6 注:1. 多维(g · kg-1):VD3 0.1;VE 80;VK3 15;烟酸121;核黄素22;VB6 10;VB1 10;VB12 10;泛酸钙10;生物素0.06;叶酸0.82;肌醇450;微晶纤维素9 271.02;2. 多矿(g · kg-1):FeSO4 · 6H2O 85;MgSO4 · 7H2O 500;NaH2PO4 4 000;NaCl 1 740;CuSO4 · 5H2O 3.4;ZnSO4 · H2O 30;CoCl2 ·6H2O 40;MnSO4 · H2O 7;沸石粉3 337.1
Note:1. Vitamin premix (g · kg-1):VD3 0.1;VE 80;VK3 15;VB3 121;VB2 22;VB6 10;VB1 10;VB12 10;Calcium pantothenate 10;Biotin 0.06;Folic acid 0.82;Inositol 450;Cellulose 9 271.02;2. Mineral premix (g · kg-1): FeSO4 ·6H2O 85;MgSO4 · 7H2O 500;NaH2PO4 4 000;NaCl 1 740;CuSO4 · 5H2O 3.4;ZnSO4 · H2O 30;CoCl2 · 6H2O 40;MnSO4 · H2O 7;Zeolite 3 337.11.2 实验对象及实验管理
实验在中国水产科学研究院南海水产研究所深圳试验基地室内养殖系统进行。选择当年鱼种进行实验,经2周暂养,商品料驯化后,随机选择体质健康、平均体质量为(5.22±0.01) g的尼罗罗非鱼作为实验对象,在500 L自动充气玻璃纤维桶淡水养殖系统中进行养殖实验。实验分为6个处理,每个处理3个重复,每个重复20尾鱼。每天投喂2次,投喂时间分别为08: 30和17: 30,投饲量以体质量的2%~5%为准,以实时摄食量适当调节。温度25.7~30.2 ℃,溶氧5 g · L-1以上,流水速度4 mL · s-1。正式养殖56 d后结束,称质量、测量体长和采样等。
1.3 采样与处理
饲养实验结束后禁食24 h,每桶随机取5尾鱼放置在-20 ℃冰箱中保存用于体成分测定。每桶随机选取3尾鱼,每组9尾罗非鱼,用丁香酚(1 : 10 000)(上海医疗器械股份有限公司)麻醉[10],依次给每尾鱼称质量和量体长。然后立即剖开腹部,剥离出肝脏并称质量。同时采取胃、肠道和肝脏,-80 ℃冻存备用。
1.4 测定指标与方法
1.4.1 生长和形体指标
分别按下式计算增重率(weight gain,WG)、特定生长率(specific growth rate,SGR)、饲料系数(feed conversion ratio,FCR)、肝体比(hepatosomatic index,HSI):
增重率(WG,%)=100×(Wt-W0)/W0
特定生长率(SGR)=100×(lnWt-lnW0)/t
饲料系数(FCR)=FI/(Wt-W0)
肝体比(HSI)=Wh/W
其中Wt为实验结束时罗非鱼平均体质量(g),W0为实验开始时罗非鱼平均体质量(g),t为养殖时间(d),FI为实验期间罗非鱼摄食饲料的干物质质量(g),Wh为所取肝脏的质量(g),W为所取肝脏的罗非鱼体质量(g)。
1.4.2 鱼体营养成分分析
粗蛋白采用凯氏定氮法测定(Foss,2300),粗脂肪采用索氏抽提法测定(Foss,2050),水分采用105 ℃烘干法测定,粗灰分采用550 ℃马弗炉灼烧法测定(YATNATO,FO610C)。
1.4.3 酶活性测定
胃蛋白酶采用比色法测定;胰蛋白酶采用紫外比色法测定;淀粉酶采用淀粉-碘比色法测定;脂肪酶采用比色法测定。试剂盒均购自南京建成生物工程研究所。肝脏溶菌酶(lysozyme,LYZ)活力利用溶壁微球菌使用自身对照法测定;一氧化氮合成酶(Nitric Oxide Synthase,NOS)采用比色法测定。
1.5 数据处理
采用Excel 2010和SPSS 19.0软件对数据进行统计分析,先对数据进行单因素方差分析(ANOVA),处理若有显著差异,再进行Duncan′s多重比较,P<0.05表示差异显著,所有数值用平均数±标准差(X±SD)表示。
2. 结果与分析
2.1 对罗非鱼生长的影响
由表 2可知,实验组的末均质量、增重率和特定生长率随饲料中海洋红酵母添加量的增加呈先增加后降低的趋势,饲料系数则与之相反,呈先降低后增加的趋势(P>0.05)。实验组的末均质量、增重率和特定生长率均优于照组,但差异不显著(P>0.05)。2 g · kg-1和4 g · kg-1组的饲料系数显著低于对照组(P<0.05),但1 g · kg-1、3 g · kg-1和5 g · kg-1组则与对照组没有显著性差异(P>0.05)。与对照组相比,1 g · kg-1组的肝体比有增加的趋势,其余各组有降低的趋势,但是差异都不显著(P>0.05);4 g · kg-1组的肝体比显著低于1 g ·kg-1组(P<0.05)。
表 2 饲料中添加不同水平的海洋红酵母对罗非鱼生长的影响Table 2. Effect of dietary R.mucilaginosa on growth performance of Nile tilapia指标
indicator海洋红酵母添加量level of R.mucilaginosa 对照组control 1 g·kg-1 2 g·kg-1 3 g·kg-1 4 g·kg-1 5 g·kg-1 初始平均质量/g initial mean weight 5.23±0.03 5.18±0.02 5.26±0.04 5.23±0.04 5.23±0.07 5.21±0.05 终末平均质量/g final mean weight 62.02±0.25 63.58±0.59 63.85±0.93 62.87±0.03 63.20±0.97 63.20±0.55 特定生长率/%·d-1 specific growth rate 4.76±0.02 4.79±0.02 4.80±0.04 4.80±0.02 4.78±0.01 4.77±0.02 增重率/% weight gain 1 086±11 1 128±16 1 114±28 1 112±13 1 101±9 1 108±32 饲料系数feed conversion ratio 0.98±0.00c 0.99±0.01c 0.94±0.02ab 0.96±0.00bc 0.93±0.01a 0.97±0.01bc 肝体比/% hepatosomatic index 1.74±0.08ab 1.82±0.11b 1.64±0.07ab 1.70±0.09ab 1.51±0.07a 1.67±0.0.08ab 注:同一行数值不同上标字母表示差异显著(P<0.05)。
Note:Values in the same column with different letter are significantly different from each other (P<0.05).2.2 对罗非鱼体成分的影响
由表 3可知,各处理组鱼体的水分和粗脂肪含量没有显著性差异(P>0.05)。鱼体粗蛋白含量呈先增加后降低的趋势(表 3)。5 g · kg-1组鱼体粗蛋白含量显著低于1 g · kg-1和2 g · kg-1组(P<0.05)。其他各组之间鱼体粗蛋白含量差异不显著(P>0.05)。1 g · kg-1、3 g · kg-1和5 g · kg-1组鱼体粗灰分含量显著低于对照组(P<0.05),2 g · kg-1组和4 g · kg-1组间的粗灰分含量有降低的趋势,但是差异不显著(P>0.05)。
表 3 饲料中添加不同水平的海洋红酵母对罗非鱼体成分的影响Table 3. Effect of dietary R.mucilaginosa on body composition of Nile tilapia% 海洋红酵母添加量
level of R.mucilaginosa水分
moisture粗蛋白
crude protein粗脂肪
crude fat灰分
ash对照组control 56.86±4.32 52.69±0.77ab 34.23±3.11 13.45±0.16c 1 g·kg-1 55.82±2.35 54.27±0.96b 34.22±2.06 12.30±0.14a 2 g·kg-1 55.07±2.82 54.41±0.72b 32.30±2.51 13.05±0.13bc 3 g·kg-1 59.47±2.31 53.09±0.23ab 30.16±3.45 12.32±0.23a 4 g·kg-1 55.74±1.95 53.37±0.31ab 31.30±5.70 12.94±0.23bc 5 g·kg-1 58.16±2.31 52.05±0.26a 30.94±4.15 12.50±0.16ab 注:同一列数值不同上标字母表示差异显著(P<0.05),后表同此。
Note:Values in the same column with different letter are significantly different from each other (P<0.05).The same case in the following table.2.3 对尼罗罗非鱼消化酶活性的影响
2.3.1 对尼罗罗非鱼蛋白酶活性的影响
随着饲料中海洋红酵母添加量的增加,罗非鱼胃、肝脏和肠道(前、中、后肠)的蛋白酶活性呈先升高后降低的趋势(图 1和图 2)。1 g · kg-1组胃蛋白酶活性显著高于对照组(P<0.05),3 g · kg-1、4 g · kg-1和5 g · kg-1组胃蛋白酶活性都显著低于对照组(P<0.05),2 g · kg-1组有增加的趋势,但是差异不显著(P>0.05)。1 g · kg-1组肝脏蛋白酶活性显著高于对照组(P<0.05),2 g · kg-1、3 g · kg-1、4 g · kg-1和5 g · kg-1组肝脏蛋白酶活性显著低于对照组(P<0.05)。1 g ·kg-1组前肠蛋白酶活性显著高于对照组(P<0.05),3 g · kg-1~5 g · kg-1组前肠蛋白酶活性显著低于对照组(P<0.05),2 g · kg-1组有增加的趋势,但是差异不显著(P>0.05)。1 g · kg-1、2 g · kg-1、3 g · kg-1和4 g · kg-1组中肠蛋白酶活性均显著高于对照组(P<0.05),5 g · kg-1组中肠蛋白酶活性则与之相反,显著低于对照组(P<0.05)。与对照组相比,3 g · kg-1组后肠蛋白酶活性显著升高(P<0.05),5 g · kg-1组后肠蛋白酶活性显著降低(P<0.05),其他各组后肠蛋白酶活性与对照组之间没有显著差异(P>0.05)。
2.3.2 对尼罗罗非鱼淀粉酶活性的影响
随饲料中海洋红酵母添加量的增加,罗非鱼胃、肝脏和肠道(前、中、后肠)的淀粉酶活性呈升高的趋势(图 3)。2 g · kg-1、3 g · kg-1和4 g · kg-1组胃淀粉酶活性显著高于对照组(P<0.05),1 g ·kg-1和5 g · kg-1组胃淀粉酶活性有增加的趋势,但是差异不显著(P>0.05)。2 g ·kg-1组肝脏淀粉酶活性显著高于对照组(P<0.05),1 g · kg-1、3 g · kg-1、4 g · kg-1和5 g · kg-1组肝脏淀粉酶活性有增加的趋势,但是差异不显著(P>0.05)。1 g · kg-1、2 g · kg-1、3 g · kg-1、4 g · kg-1和5 g · kg-1组前肠淀粉酶活性均显著高于对照组(P<0.05)。与对照组相比,1 g · kg-1、2 g · kg-1和3 g · kg-1组中肠淀粉酶活性显著升高(P<0.05),4 g · kg-1组中肠淀粉酶活性有增加的趋势,5 g · kg-1组中肠淀粉酶活性有降低的趋势,但是差异不显著(P>0.05)。5 g · kg-1组后肠淀粉酶活性显著高于对照组(P<0.05),1 g · kg-1、2 g · kg-1、3 g · kg-1和4 g · kg-1组后肠淀粉酶活性有增加的趋势,但是差异不显著(P>0.05)。
2.3.3 对尼罗罗非鱼脂肪酶活性的影响
由图 4可知,各组之间的罗非鱼胃脂肪酶活性没有显著差异(P>0.05)。5 g · kg-1组肝脏脂肪酶活性显著高于对照组(P<0.05),1 g · kg-1、3 g ·kg-1和4 g · kg-1组肝脏脂肪酶活性有降低的趋势,2 g · kg-1组肝脏脂肪酶活性有增加的趋势,但是差异都不显著(P>0.05)。2 g · kg-1、3 g · kg-1、4 g · kg-1和5 g · kg-1组前肠脂肪酶活性均显著高于对照组(P<0.05),1 g · kg-1组前肠脂肪酶活性有增加的趋势,但是差异不显著(P>0.05)。1 g · kg-1、2 g · kg-1、3 g · kg-1和5 g · kg-1组中肠脂肪酶活性均显著高于对照组(P<0.05),4 g ·kg-1组中肠脂肪酶活性有降低的趋势,但是差异不显著(P>0.05)。1 g ·kg-1、2 g · kg-1、3 g ·kg-1组后肠脂肪酶活性显著高于对照组(P<0.05),4 g · kg-1和5 g ·kg-1组后肠脂肪酶活性有降低的趋势,但是差异不显著(P>0.05)。
2.4 对尼罗罗非鱼肝脏免疫酶活性的影响
随饲料中海洋红酵母添加量的增加,罗非鱼肝脏溶菌酶和一氧化氮合酶活性都呈先升高后降低的趋势(表 4)。2 g · kg-1和3 g · kg-1组肝脏溶菌酶活性均显著高于对照组(P<0.05),1 g ·kg-1、4 g ·kg-1和5 g · kg-1组肝脏溶菌酶活性有增加的趋势,但是差异不显著(P>0.05)。类似地,与对照组相比,2 g · kg-1和3 g · kg-1组肝脏一氧化氮合酶活性均显著升高(P<0.05),1 g ·kg-1、4 g · kg-1和5 g · kg-1组肝脏一氧化氮合酶活性有增加的趋势,但是差异不显著(P>0.05)。
表 4 饲料中添加不同水平的海洋红酵母对罗非鱼肝脏免疫酶活性的影响Table 4. Effect of dietary R.mucilaginosa on hepatic lysozyme and nitric oxide synthase activities of Nile tilapiaU · mL-1 海洋红酵母添加量
level of R.mucilaginosa溶菌酶
LYZ一氧化氮合酶
NOS对照组control 0.62±0.08a 0.62±0.08a 1 g·kg-1 1.22±0.15a 1.16±0.21a 2 g·kg-1 99.03±2.96c 105.20±3.21c 3 g·kg-1 82.28±4.50b 88.24±6.50b 4 g·kg-1 6.84±0.16a 6.58±0.09a 5 g·kg-1 2.71±0.23a 2.71±0.23a 3. 讨论
海洋红酵母及其产生的生长因子和消化酶类能有效促进水产动物对营养素的消化吸收,提高其生长速度和对饲料的利用率[10]。海洋红酵母含有的营养因子能够帮助有益菌的生长,饲料中添加海洋红酵母(Rhodotorula benthica),能够促进哺乳母猪采食性能的提高[11]。饲料中添加1 g · kg-1海洋红酵母(R.benthica)对大菱鲆的体成分和形体指标的影响不显著,但能显著提高大菱鲆对红鱼粉替代白鱼粉饲料的摄食率、蛋白效率和生长性能,使得红鱼粉替代组的饲料性能达到白鱼粉组的生长水平[4]。在海洋红酵母(R.benthica)和微生态饲料添加剂的对照实验中,发现海洋红酵母显著增加了对虾的末均质量[1]。在饲料中添加一定量的海洋红酵母(R.benthica)后,能提高日本对虾(Penaeus japonicus)幼虾的成活率,促进其生长[12]。海洋红酵母也显著提高了凡纳滨对虾的增重率和特定生长率[13]。添加海洋红酵母(R.mucilaginosa)的实验鱼的末均质量、增重率和特定生长率随饲料中海洋红酵母添加量的增加均优于照组,但差异不显著。在对大菱鲆4周养殖实验中,也发现其摄食率、相对增重率、特定生长率和饵料系数均没有显著差异,在白鱼粉为主的大菱鲆饲料中添加海洋红酵母(R.benthica)0.5~1.5 g · kg-1不能提高大菱鲆的摄食和生长性能[5]。笔者认为,导致以上研究结果不一致的原因可能与红酵母的种类、实验鱼的种类和规格以及养殖周期、饲料配方等有关。
鱼类消化酶对食物的催化作用易受饲料和外界环境因素的影响,饲料不仅影响消化酶活性和分布,而且还可影响酶的分泌,饲料中营养物质影响消化酶的活性,蛋白质含量影响各种消化酶的活性,脂肪含量影响消化道脂肪酶和淀粉酶活性[14-15]。养殖水体温度的变化对消化酶活性具有显著的影响[16-17]。饲料中添加沼泽生海洋红酵母(R.paludigenum)显著提高凡纳滨对虾肝胰腺中蛋白酶和脂肪酶活性,但是对肝胰腺中淀粉酶没有显著影响[18]。饲料中添加一定量的海洋红酵母能够显著提高罗非鱼消化道蛋白酶、淀粉酶和脂肪酶的活性,表明海洋红酵母能够提高罗非鱼消化酶的活性,增强其对营养物质的消化吸收能力,进而促进鱼体生长。
海洋红酵母含有丰富的类胡萝卜素、维生素E和β-葡聚糖。类胡萝卜素通过消除自由基维护细胞膜的稳定性[19],具有增强免疫功能的作用[20]。类胡萝卜素(从红假单胞菌中提取)可以显著提高罗非鱼的生长性能,增强其非特异性免疫因子血清溶菌酶的活性,通过调节免疫功能提高罗非鱼的生长性能[21]。饲料中添加适量的维生素E(300 mg ·kg-1)可以促进尼罗罗非鱼的生长,提高其溶菌酶活力和巨噬细胞的吞噬活性,但过量的维生素E(>1 000 mg · kg-1)会抑制其生长[22]。该实验中由海洋红酵母提供的类胡萝卜素和维生素E含量都较低,对尼罗罗非鱼的生长和非特异性免疫可能起到辅助作用。
在饲料中添加β-葡聚糖和肽聚糖未能促进罗非鱼生长,而且复合肽聚糖还会抑制其生长[23]。多糖会抑制尼奥罗非鱼的生长,降低脂肪沉积率[24]。酿酒酵母(Saccharomyces cerevisiae)提取物甘露寡糖可以显著促进尼罗罗非鱼的生长,提高其抵抗病原菌的能力[25]。益生菌产物β-葡聚糖具有免疫调节作用[26-27]。异育银鲫(Carassius auratus gibelio)短时间(28 d)投喂酵母β-葡聚糖(200 mg ·kg-1)饲料可以增强抵抗嗜水气单胞菌(Aeromonas hydrophila)的能力,具有促生长作用[28];鲤(Cyprinus carpio)长时间(60 d)投喂β-葡聚糖饲料,虽然对生长性能没有显著影响并且降低其对嗜水气单胞菌的抵抗力,但可以提高其肝脏溶菌酶和酸性磷酸酶的活性[29]。该实验中,随着海洋红酵母添加量的增加,肝脏溶菌酶和一氧化氮合酶活性呈现先升高后降低的趋势,投喂1~2 g · kg-1的海洋红酵母依然可以提高尼罗罗非鱼的免疫酶活性;但是,高浓度海洋红酵母(3~5 g · kg-1组)会抑制罗非鱼的免疫能力,可能是因为长期投喂高浓度的β-葡聚糖导致的免疫疲劳。
4. 结论
饲料中添加海洋红酵母可以促进罗非鱼的生长,提高其消化酶活性和增强其非特异性免疫能力。根据尼罗罗非鱼幼鱼的生长性能、消化酶及免疫酶活性等指标综合分析得出,海洋红酵母在罗非鱼饲料中的建议添加量为2~3 g · kg-1。
-
表 1 SEM生物样品准备流程表
Table 1 Flow chart of SEM biological sample preparation
序号
No.操作
operation试剂
reagent次数
times时间
time1 浸泡固定
(30倍体积)2.5%戊二醛 1 3 h以上 2 浸泡清洗 0.1mol·L−1
磷酸缓冲液4~6 20 min 3 浸泡 30%乙醇 1 15 min 4 脱水 50%乙醇 1 15 min 5 脱水 70%乙醇 1 15 min 6 70%乙醇 浸泡过夜 7 脱水 90%乙醇 1 15 min 8 脱水 无水乙醇 1 15 min 9 脱水 无水乙醇 1 15 min 10 脱水 无水乙醇 1 15 min 11 浸泡置换 叔丁醇 (4 ℃固化) 3 15 min 12 加入六甲基硅烷 13 干燥 冷冻干燥 1 3 h以上 表 2 雌性猛虾蛄形态参数及纳精囊、卵巢表观特征
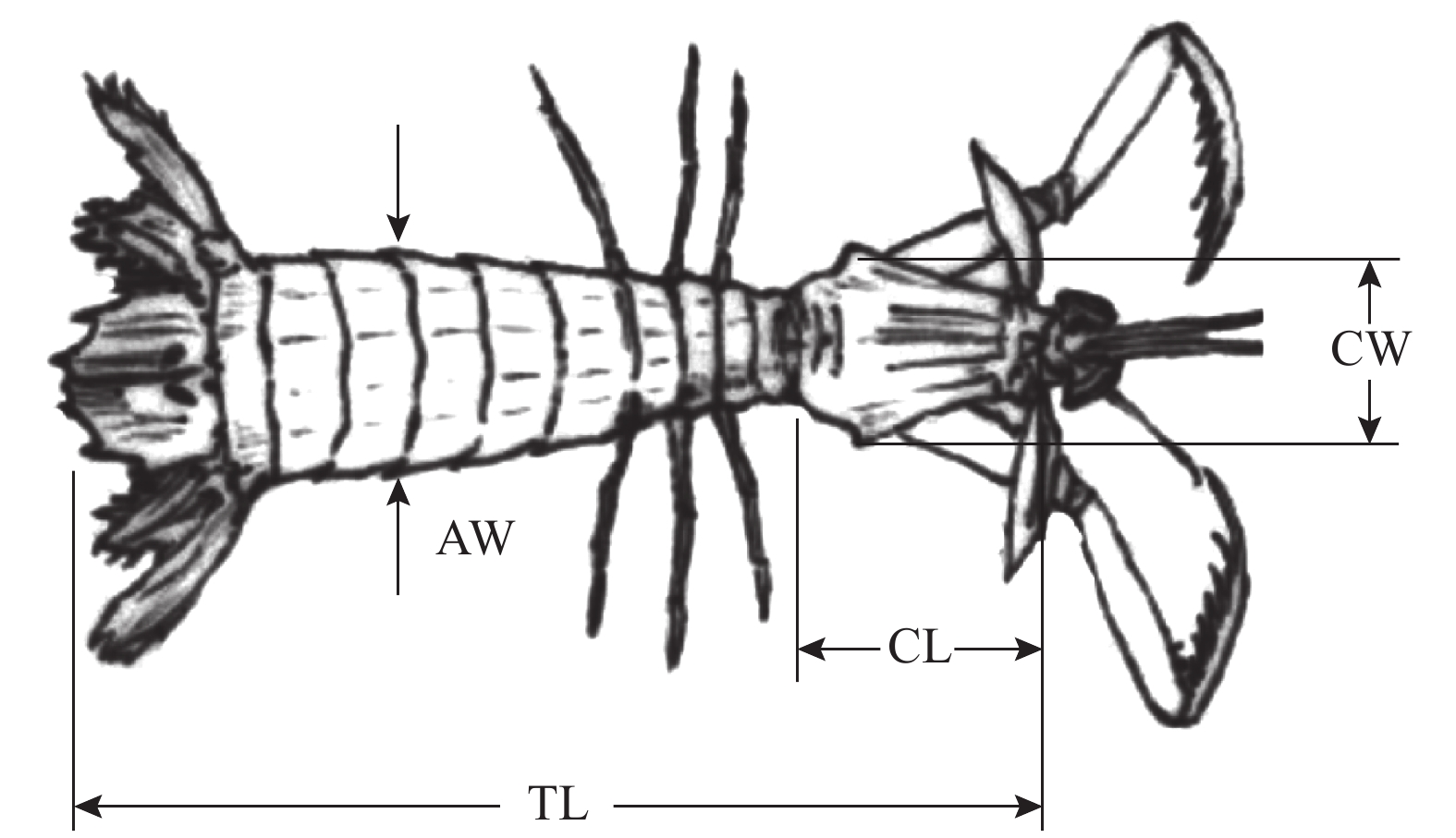
Table 2 Morphologic parameter, apparent features of thelycum and ovary of female H. harpax
项目
item形态参数、纳精囊和卵巢表观特征
morphologic parameter, apparent features of thelycum and ovary甲壳长/cm carapace length 3.0~3.5 3.4~3.8 3.2~4.2 3.2~4.0 3.3~4.4 甲壳宽/cm carapace width 2.1~3.0 2.6~3.3 2.8~3.5 2.6~2.8 2.8~3.6 体长/cm total length 14.5~15.6 14.8~16.4 15.9~18.7 15.5~17.3 17.2~20.0 体宽/cm abdomen width 3.1~3.6 3.2~3.8 3.4~4.0 3.4~3.6 3.4~4.1 体质量/g body mass 37.08~50.88 47.26~56.47 54.37~79.04 49.60~69.38 61.84~96.69 卵巢表观特征 apparent features of ovary 无色 灰黄色 土黄色 浅黄色 橘黄色 性腺指数 GSI 1.62±0.53 2.73±0.44 3.82±0.48 6.84±1.04 11.63±2.11 纳精囊表观特征 apparent features of thelycum 无色,透明 浅白色,浑浊 乳白色,浓密 -
[1] LUI K K Y, NG S J S, LEUNG K M Y, et al. Spatiotemporal variations in the diversity and abundance of commercially important decapoda and stomatopoda in subtropical Hong Kong waters[J]. Estuar Coast Shelf Sci, 2007, 72: 635-647. doi: 10.1016/j.ecss.2006.11.023
[2] YAN Y R, ZHANG Y Y, WU G R, et al. Seasonal feeding habits, reproduction, and distribution of Harpiosquilla harpax (Stomatopoda: Harpiosquillidae) in the Beibu Gulf, South China Sea[J]. J Crust Biol, 2015, 35(6): 776-784. doi: 10.1163/1937240X-00002386
[3] KODAMA K, SHIMIZU T, YAMAKAWA T, et al. Changes in reproductive patterns in relation to decline in stock abundance of the Japanese mantis shrimp Oratosquilla oratoria in Tokyo Bay[J]. Fish Sci, 2006, 72: 568-577. doi: 10.1111/fis.2006.72.issue-3
[4] PRASAD D R, RAO P Y. Seasonal changes in the muscle biochemical composition of Harpiosquilla harpax (de Haan, 1844) (Stomatopoda: Crustacea) represented in trawl net by-catches off Visakhapatnam, East Coast of India[J]. J Chem Biol Phys Sci, 2017, 7(1): 292-303.
[5] MULYONO M, MUFTI P, ABINAWANTO M P, et al. The development of gonad mantis shrimp Harpiosquilla raphidea Fabricius, 1798 in Banten Bay, Indonesia[J]. Int J Aquat Sci, 2017, 8(1): 26-33.
[6] WARDIATNO Y, MASHAR A. Biological information on the mantis shrimp, Harpiosquilla raphidea (Fabricius 1798) (Stomatopoda, Crustacea) in Indonesia with a highlight of its reproductive aspects[J]. J Trop Biol Conserv, 2010, 7: 65-73.
[7] CALDWELL R L. Variation in reproductive behavior in stomatopod[C]. New York: Columbia University Press, 1991: 67-90.
[8] EL-SHERIF S S, EL-KHODARY G M, GHONIM A Z. Ovarian cycle and scanning electron micrographs of the spawned egg of female mantis shrimp Oratosquilla massavensis (Alexandria, Egypt)[J]. J Bas Appl Zool, 2012, 65: 116-124. doi: 10.1016/j.jobaz.2012.07.006
[9] 冯玉爱, 张珍兰. 广东湛江沿海口足类的初步报告[J]. 湛江水产学院学报, 1995, 15(1): 21-32. [10] 刘瑞玉, 王永良. 南海虾蛄科及猛虾蛄科(甲壳动物口足目)二新种[J]. 海洋与湖沼, 1998, 29(6): 588-596. doi: 10.3321/j.issn:0029-814X.1998.06.005 [11] YEDUKONDALA R P, RAJENDRA P D, RUKMINI S I, et al. Meat yield studies in Harpiosquilla harpax (de Haan, 1844) and Oratosquilla anomala (Tweedie, 1935) (Crustacea: Stomatopoda) represented in the shrimp trawl net by-catches off Visakhapatnam, East Coast of India[J]. Eur J Exp Biol, 2015, 5(5): 6-11.
[12] RAJENDRA P D, YEDUKONDALA R P. Studies on food and feeding habits of Harpiosquilla harpax (de Haan, 1844) (Crustacea: Stomatopoda) represented in the shrimp trawl net by-catches off Visakhapatnam, East Coast of India[J]. Int J Adv Res, 2015, 3(7): 1578-1584.
[13] WARDIATNO Y, MASHAR A. Population dynamics of the Indonesian mantis shrimp, Harpiosquilla raphidea (Fabricius 1798) (Crustacea: Stomatopoda) collected from a mud flat in Kuala Tungkal, Jambi Province, Sumatera Island[J]. Indonesian J Mar Sci, 2011, 16(2): 111-118.
[14] MULYONO M, PATRIA1 M P, ABINAWANTO A, et al. Length-weight relationship and condition factor in giant harpiosquillid mantis shrimp, Harpiosquilla raphidea (Crustacea: Stomatopoda) in Banten Bay waters, Indonesia[J]. Int J Aquat Biol, 2013, 1(4): 185-187.
[15] ANTONY P J, RAHMAN M M, RAJKUMAR M, et al. Relative growth of Harpiosquilla raphidea (Fabricius, 1798) (Crustacea: Stomatopoda) male and female populations[J]. Sains Malaysiana, 2014, 43(9): 1305-1310.
[16] ARSHAD A, SOFEA T, ZAMRI Z, et al. Population dynamics of mantis shrimp, Harpiosquilla harpax in the coastal waters of Pantai Remis, Perak, Peninsular Malaysia[J]. Iran J Fish Sci, 2015, 14(1): 15-26.
[17] MULYONO M, PATRIA M P, ABINAWANTO A, et al. Growth aspects of giant mantis shrimp Harpiosquilla raphidea Fabricius, 1798 Banten Bay Waters, Banten Province[J]. Int J Mar Sci, 2016, 6(32): 1-14.
[18] 薛梅, 闫红伟, 刘海映, 等. 大连市皮口海域口虾蛄群体繁殖生物学特征初步研究[J]. 大连海洋大学学报, 2016, 31(3): 237-245. [19] KODAMA K, SHIRAISHI H, MORITA M A. Reproductive biology of the Japanese mantis shrimp Oratosquilla oratoria (Crustacea Stomatopoda): annual cycle of gonadal development and copulation[J]. Mar Biol Res, 2009, 5(5): 415-426. doi: 10.1080/17451000802644714
[20] 山崎诚, 富士昭. シ ヤ コOratosquilla oratoria (de Huan)の生殖周期の研究[J]. 西海区水产研究报告, 1988(57): 86-98. [21] 邓景耀, 程济生. 渤海虾蛄渔业生物学研究[C]//甲壳动物学论文集. 青岛: 青岛海洋大学出版社, 1992: 36-44. [22] 堵南山. 甲壳动物学(下册) [M]. 北京: 科学出版社, 1993: 384-386. [23] 吴桂荣, 颜云榕, 卢伙胜, 等. 北部湾猛虾蛄生物学特性与渔业资源时空分布[C]//2012年中国水产学会学术年会论文集. 北京: 海洋出版社, 2012: 215-215. [24] 吴长功, 周令华, 相建海, 等. 鹰爪虾与中国对虾雌虾纳精囊的形态结构[J]. 水产学报, 1999, 23(3): 223-228. [25] 蒋霞敏, 王春琳, 赵青松, 等. 黑斑口虾蛄繁殖生物学的研究[J]. 华东师范大学学报 (自然科学版), 2000, 12: 19-24. [26] JENNIFER L, WORTHAM-NEAL W. Reproductive morphology and biology of male and female mantis shrimp (Stomatopoda: Squillidae)[J]. J Crust Biol, 2002, 4(22): 728-741.
[27] 宣富君, 管卫兵, 戴小杰, 等. 东海三疣梭子蟹纳精囊形态结构与内含物的变化[J]. 动物学杂志, 2009, 44(2): 1-11. doi: 10.3969/j.issn.1671-7856.2009.02.001 [28] 成永旭, 李少菁, 王桂忠. 锯缘青蟹排卵后纳精囊及其内部精子的超微结构[J]. 上海水产大学学报, 2000, 9(1): 69-71. [29] 王春琳, 朱冬发, 蒋霞敏, 等. 黑斑口虾蛄雄性生殖系统的组织学与超微结构[J]. 水产学报, 2002, 26(5): 403-410. [30] 王文琪, 杨敬昆, 徐世宏, 等. 3种对虾精子超低温冷冻保存技术研究[J]. 海洋科学, 2017, 41(9): 81-86. [31] ALFARO J, MUNOZ N, VARGAS M, et al. Induction of sperm activation in open and closed thelycum penaeoid shrimps[J]. Aquaculture, 2003, 216(1/2/3/4): 371-381.
[32] AUNGSUCHAWAN S, BROWDY C L, WITHYACHUMNARNKUL B. Sperm capacitation of the shrimp Litopenaeus vannamei[J]. Aquacult Res, 2011, 42(2): 188-195. doi: 10.1111/are.2010.42.issue-2
[33] 管卫兵, 王桂忠, 李少菁, 等. 锯缘青蟹纳精囊精子顶体酶活力研究[J]. 海洋通报, 2005, 24(6): 87-91. doi: 10.3969/j.issn.1001-6392.2005.06.012 [34] PONGTIPPATEE P, VANICHVIRIYAKIT R, CHAVADEJ J, et al. Acrosome reaction in the sperm of the black tiger shrimp Penaeus monodon (Decapoda, Penaeidae)[J]. Aquacult Res, 2007, 38: 1635-1644. doi: 10.1111/are.2007.38.issue-15
[35] 王春琳, 蒋霞敏, 赵青松, 等. 黑斑口虾蛄的卵巢组织学研究[J]. 动物学杂志, 2001, 36(4): 6-9. doi: 10.3969/j.issn.0250-3263.2001.04.002 [36] 蒋霞敏, 王春琳, 赵青松, 等. 黑斑口虾蛄育苗技术研究[J]. 海洋科学, 2000, 24(5): 17-20. doi: 10.3969/j.issn.1000-3096.2000.05.007 [37] WEN W G, YANG Q B, MA Z H, et al. Comparison of ovarian maturation and spawning after unilateral eyestalk ablation of wild-caught and pond-reared Penaeus monodon[J]. Span J Agric Res, 2015, 13(3): 1-6.
-
期刊类型引用(13)
1. 李腾,郭慧,卢怡凝,冼健安,张泽龙,李军涛,郑佩华,鲁耀鹏. 免疫增强剂在水产动物中的应用研究进展. 河北渔业. 2023(05): 34-40 .  百度学术
百度学术
2. 董兰芳,张彩群,刘家辉,郑晓利,童潼,张琴,王秀华,杨慧赞. 酵母水解物对吉富罗非鱼生长、免疫力、抗氧化性及抗无乳链球菌感染的影响. 渔业科学进展. 2022(01): 115-122 .  百度学术
百度学术
3. 汤伟,李佳欣,王悦,张军,何增国. 胶红酵母CYJ03的体外体内抗氧化活性研究. 工业微生物. 2022(01): 1-8 .  百度学术
百度学术
4. 何玉,朱彦博,田相利,贾钊阳,李海东,李丽,董双林,范瑞用. 海洋红酵母不同添加剂量对凡纳滨对虾生长、免疫酶活性及抗病力的影响. 海洋湖沼通报. 2022(04): 33-41 .  百度学术
百度学术
5. 刘宝同,梁晶晶,李培根,王永庆,秦朋,梁奕. 生物饲料伴侣在凡纳滨对虾中的应用研究. 中国畜牧杂志. 2021(08): 256-260 .  百度学术
百度学术
6. 赵硕,梁晶晶,刘宝同,王永庆,李永生. 四种复合生物制剂对鲫鱼生长和免疫功能的影响. 中国饲料. 2020(03): 65-69 .  百度学术
百度学术
7. 郭静文,陈山多,冯雨薇,郭子华,吴丹,邢程顺,侯丽萍,舒琥. 饲料中添加海洋红酵母对宝石鲈生长性能的影响. 饲料工业. 2020(10): 44-49 .  百度学术
百度学术
8. 王悦,欧阳丹,汤伟,刘仕博,顾燕,何增国. 六株红酵母抗氧化活性的研究. 生物技术通报. 2020(10): 156-164 .  百度学术
百度学术
9. 魏涯,郝志明,江蓝蓝,曾劲,岑剑伟,邓建朝. 荸荠加工废弃物混合发酵法制备水产益生菌的工艺优化. 食品工业科技. 2019(04): 166-171 .  百度学术
百度学术
10. 郝志明,江蓝蓝,曾劲. 荸荠加工废弃物资源综合利用研究. 广东农工商职业技术学院学报. 2018(02): 77-82 .  百度学术
百度学术
11. 廖永山,杨创业,王庆恒,孙瑞椒,邓岳文,杜晓东. 不同饲料对马氏珠母贝(Pinctada fucata martensii)消化酶、免疫和生长相关基因表达的影响. 基因组学与应用生物学. 2018(12): 5251-5257 .  百度学术
百度学术
12. 周胜杰,胡静,于刚,杨其彬,杨蕊,刘亚娟,马振华. 光周期对尖吻鲈仔稚鱼消化酶活性的影响. 海洋科学. 2018(06): 63-69 .  百度学术
百度学术
13. 张月,段亚飞,董宏标,张家松. 聚β-羟基丁酸酯对凡纳滨对虾肝胰腺免疫和消化指标的影响. 南方水产科学. 2017(05): 78-84 .  本站查看
本站查看
其他类型引用(9)



 下载:
下载:






 粤公网安备 44010502001741号
粤公网安备 44010502001741号
