Spatial distribution and assessment of nutrients in marine ranching in Zhelin Bay-Nanao Island in summer
-
摘要:
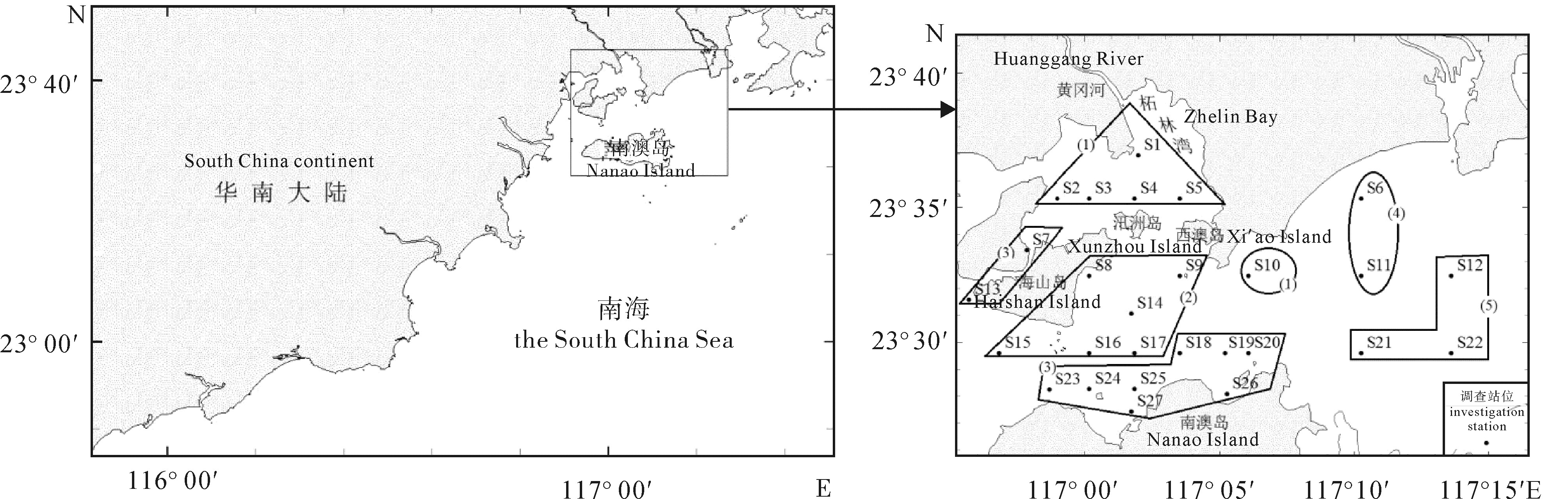
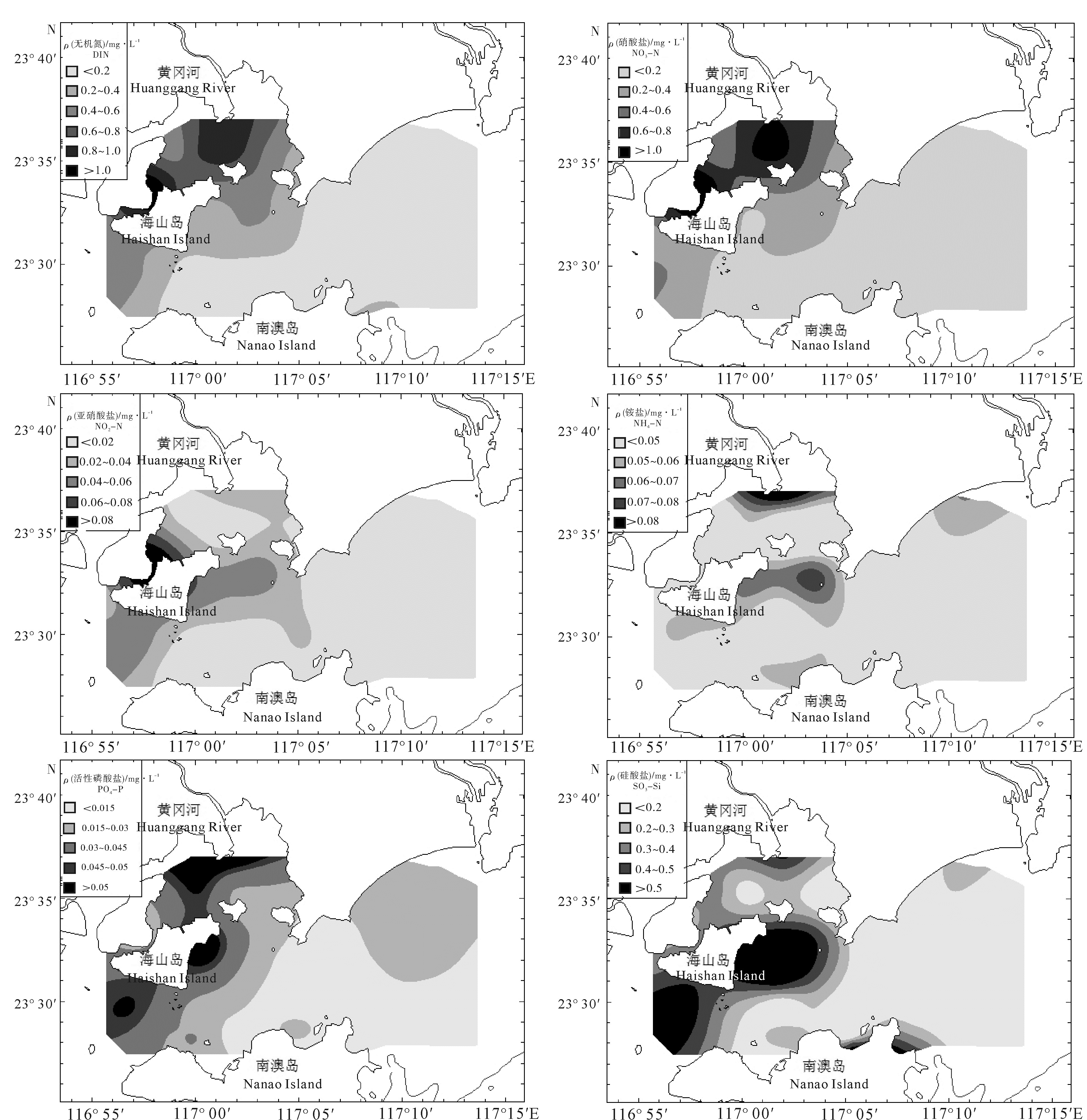
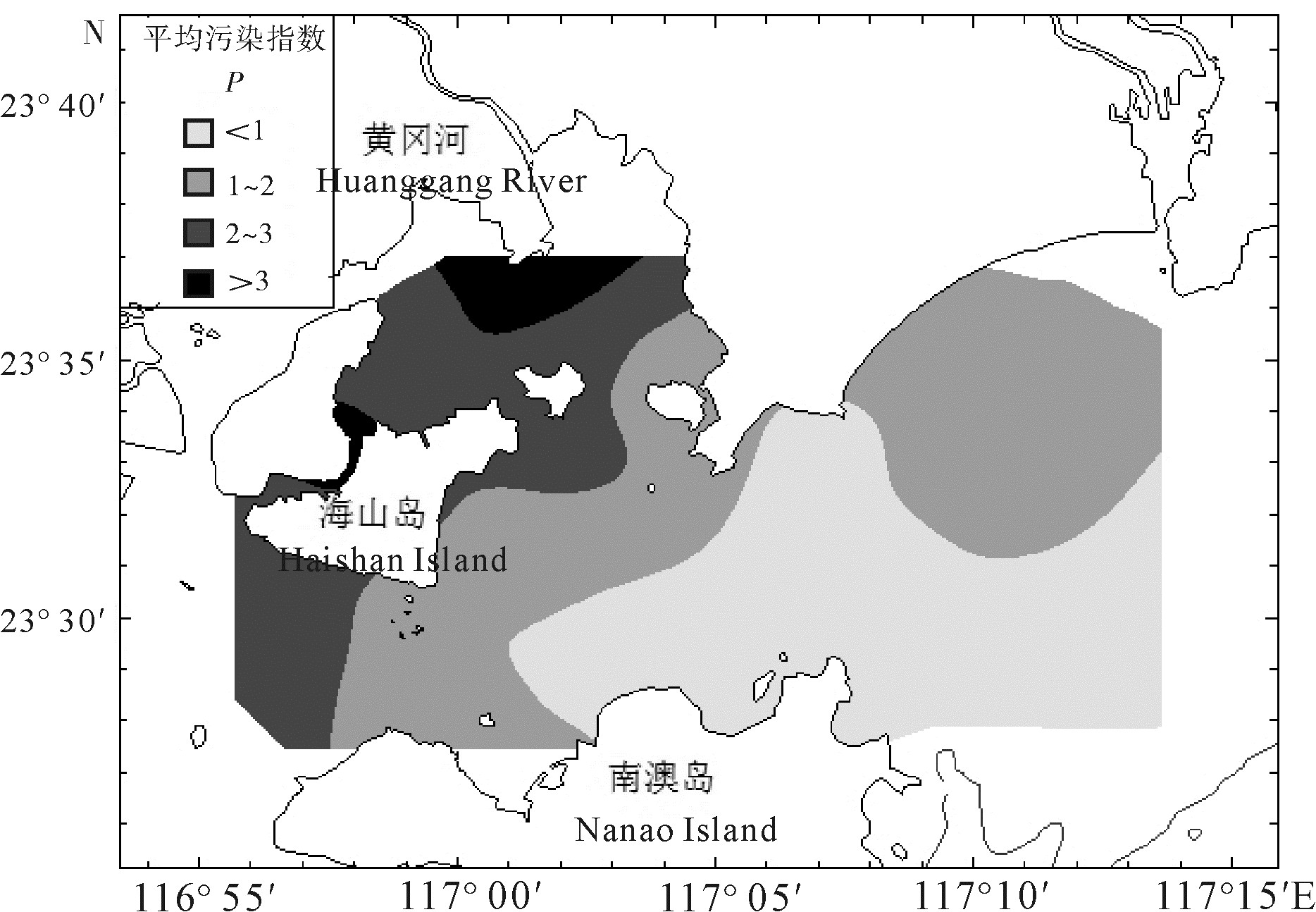
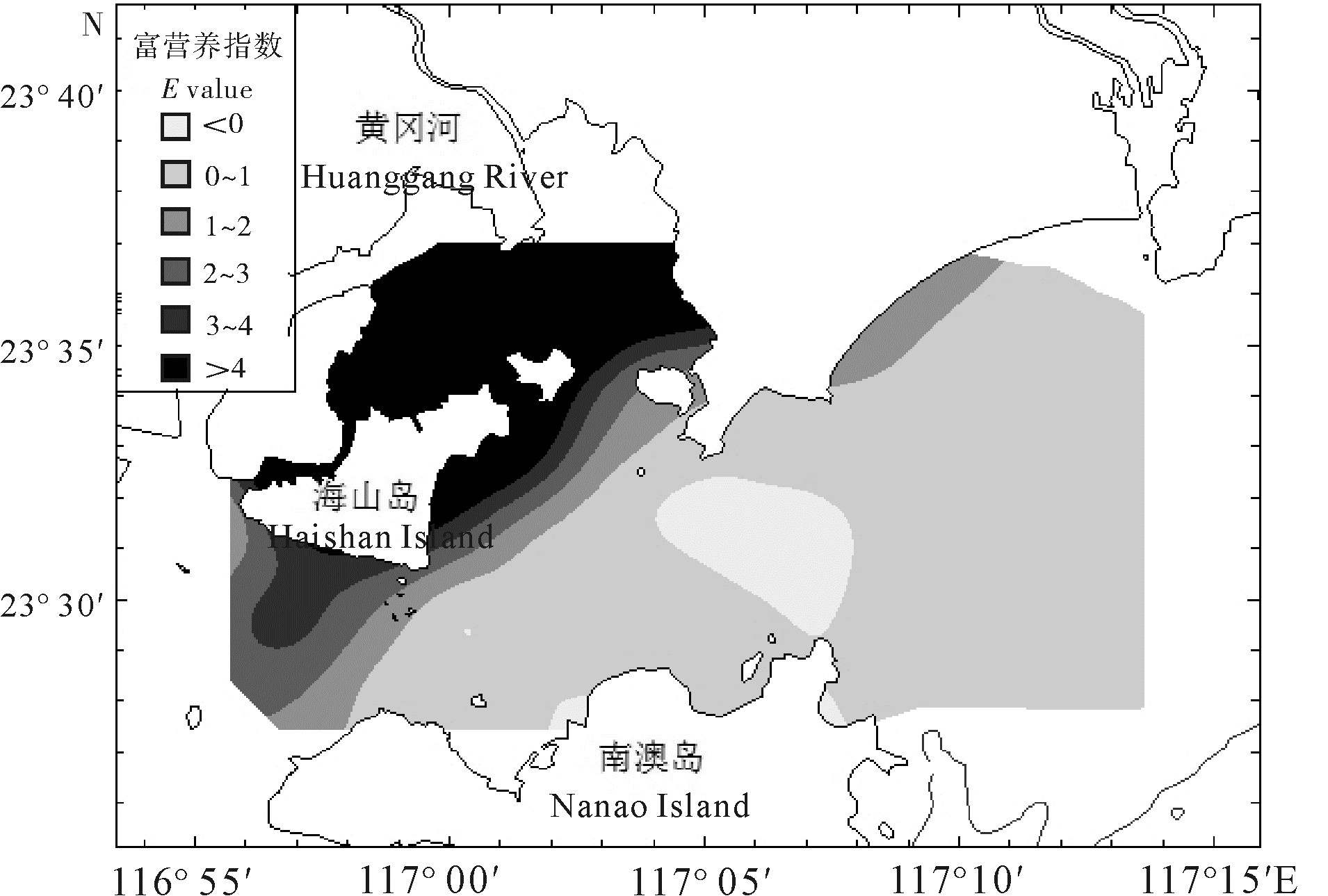
柘林湾-南澳岛海洋牧场由网箱养殖区、贝类底播区、海藻养殖区和人工鱼礁区4个不同的功能区构成。根据2011年夏季(8月)海水营养盐的调查数据,分析其表层海水营养盐含量的空间分布特征,并对其污染现状进行综合评价。结果表明,氮、磷营养盐的空间分布均呈现由西北部柘林湾近岸海域向东南部海域递减的变化趋势。不同功能区中,无机氮(DIN)和活性磷酸盐(PO4-P)的高值出现在网箱养殖区,硅酸盐(SiO3-Si)的高值出现在贝类底播区,人工鱼礁区的营养盐水平均较低。单因子污染指数、污染物分担率和综合污染指数评价结果也表明,海洋牧场受到DIN和PO4-P污染的程度以及富营养化程度均呈现由西北海域向东南海域递减、近岸向离岸递减的变化趋势。网箱养殖区受DIN和PO4-P污染最重,呈现严重富营养化,其次为贝类底播区,而人工鱼礁区和对比区受到的污染程度均较轻。
Abstract:The marine ranching in Zhelin Bay-Nanao Island is divided into four different function areas: cage culture area, shellfish farming area, seaweed culture area and artificial reef area. Based on the survey data in that marine ranching in August of 2011, we analyzed the spatial distribution characteristics of nutrients in the surface seawater and evaluated the nutritional status. The results show that the contents of dissolved inorganic nitrogen (DIN) and active phosphate (PO4-P) decreased from the northwest of Zhelin Bay to the southeast of the investigated area. Among the four different function areas, the high-value of DIN and PO4-P occurred in the cage culture area, while the maximum content of silicate (SiO3-Si) was occurred in the shellfish framing area. Nutrient salts levels in the artificial reef area were relatively low. We assessed the sea water quality in the marine ranching by using single factor index, share rate of pollutants and comprehensive pollution index. The results suggest that the nutrient pollution trend caused by DIN and PO4-P in the marine ranching declined from the northwest to the southeast and from inshore to offshore waters. Moreover, the pollution and eutrophication state in the cage culture area was most serious, followed by the shellfish farming area, while the artificial reef area and control area were found for less pollution.
-
Keywords:
- marine ranching /
- nutrients /
- spatial distribution /
- eutrophication
-
20世纪90年代朱军[1-3]结合我国的育种实践提出了一些新的遗传模型和新的统计方法,极大地推动了数量遗传学的进一步发展。对于杂种优势分析方法,朱军[4]提出了利用亲本和杂种F1预测杂种后代基因型值和杂种优势的统计分析方法,既能估计模型的固定效应,得到其最佳线性无偏估计值,又能预测随机的遗传效应,得到其最佳线性无偏预测值,从而使遗传参数估计的准确性大大提高。国外对于罗非鱼也有一些数量遗传学研究文献报道[5-9]。但各研究结果之间有不少差异。这是由于有些研究是采用传统的ANOVA进行分析的,其分析结果的精确度受到一定的局限; 有些研究是在单一的、严格控制的环境条件下进行的,不能反映在多种多样环境里的情况; 有些研究的试验材料本身性状差异小,不具有广泛代表性; 有些试验环境间差异小,因而没有检测到、或者极少检测到基因型×环境互作的存在。由于这些缘故,使得其结果的运用受到一定程度的限制。通过种间杂交来生产高雄性率的杂交鱼,是罗非鱼苗种业的一大特点。但是到目前为止采用数量遗传学方法对鱼类杂种优势的研究国内仅见到李思发等[10]关于鲤鱼生长性状杂种优势的报道,在其它鱼类中,包括罗非鱼,还未见到重要数量性状杂种优势遗传效应的研究报道。本研究利用罗非鱼种间双列杂交的资料,对其主要生长性状的遗传力与杂种优势效应进行初步的探讨。
1. 材料与方法
1.1 研究材料与试验方法
2005年5月中旬,取尼罗罗非鱼(Oreochromis niloticus)、奥利亚罗非鱼(O.aureus)母本各30尾,父本各10尾,在4个水泥池(长×宽×深为500 cm×150 cm×80 cm,水深60 cm)中,每个池子按雌雄比例3 : 1放入母本15尾,父本5尾,按表 1所示的方式配成2×2的双列杂交。
表 1 试验的交配设计Table 1. Mating design of current study配组代码
mating code杂交组合
hybridizationA 尼罗罗非鱼♀×奥利亚罗非鱼♂ C 尼罗罗非鱼♀×尼罗罗非鱼♂ B 奥利亚罗非鱼♀×尼罗罗非鱼♂ D 奥利亚罗非鱼♀×奥利亚罗非鱼♂ 6月中旬开始陆续见苗,至繁殖盛期将各个池子中的小苗全部捞出,分别放入4个水泥池中进行培育。鱼苗经过1个月的强化培育,体全长达4 cm左右时,予以剪鳍标记,A组左腹鳍,B组右腹鳍,C组左胸鳍,D组右胸鳍。隔10 d后检查所剪标记,选择规格整齐、健壮的仔鱼开始进行试验。
1.2 实验环境
试验在水泥池和网箱中进行。水泥池(长×宽×深为500 cm×150 cm×80 cm,水深60 cm),水体积4.5 m3。网箱(长×宽×深为100 cm×100 cm×80 cm,水深60 cm),挂于相邻、一样大小的水泥池内,每池挂1只网箱,在池中分隔出水体积0.6 m3的载鱼水体。试验期间各水泥池均保持来自同一蓄水池的流水进行水交换,日换水量18.0 m3,进水口位于池的上面,出水口位于池底中央,水流带走大部份鱼类排泄废物,各池每天16: 00左右吸污1次,并采用每池6个气石进行不间断充分增氧,以保证载鱼水体水质良好,因此,水泥池与网箱之间温度等水质条件基本一致。但网箱放养密度约为233尾· m-3,水泥池放养密度约为31尾· m-3,两者密度殊异,乃是2种不同养殖环境的主要影响因子。
2005年7月27日,每池(网箱)放养剪鳍标记的A、B、C及D 4种鱼各35尾,共140尾。每天投饲2次,投饲量以0.5 h后水面上不再有剩余饵料为准。试验结束时(饲养120 d),测量每池中140尾鱼的体重、全长、体长、体高、体宽等5个参数,计算肥满系数,共6项。肥满系数=100× (体重/体长3)[11]。
1.3 遗传分析方法
数据统计与分析参照加性-显性与环境互作的遗传模型[3]。该模型表示亲本(i=j)和杂交种在第h个环境下的平均表型值的线性公式如下:
$$ \begin{aligned} & \quad Y_{k i j l}=u+E_h+A_i+A_j+D_{i j}+E A_{h i}+E A_{h j}+E D_{k i j}+ \\ & B_l+e_{i j k l} \end{aligned} $$ 式中,Yijkl是各个生长性状的表型值; u为群体均值; Ek为环境效应; Ai和Aj分别是母本和父本的加性效应; Dij为显性效应; EAki为h环境下的母本×环境互作效应; EAkj为h环境下的父本×环境互作效应; EDkij为h环境下的显性×环境互作效应; Bl为区组效应; eijkl为随机效应。
遗传效应的计算公式[4]:
(1) F1代遗传效应$\operatorname{Pre}\left(\mathrm{F}_1\right)=A_i+A_j+D_{i j} $
(2) F2代遗传效应$ \operatorname{Pre}\left(\mathrm{F}_2\right)=A_i+A_j+\frac{1}{4} D_{i j}+\frac{1}{4} D_{j j}+\frac{1}{2} D_{i j}$
杂种优势的计算公式[4]:
(1) F1的群体平均优势$ \operatorname{Hpm}\left(\mathrm{F}_1\right)=D_{i j}+\frac{1}{2}\left(D_{i j}+D_{j j}\right)$
(2) F1的群体超亲优势$ \operatorname{Hpb}\left(\mathrm{F}_1\right)=\operatorname{Hpm}\left(\mathrm{F}_1\right)+\frac{1}{2} \omega_G$
(3) F2的群体平均优势$\operatorname{Hpm}\left(\mathrm{F}_2\right)=\frac{1}{2} \operatorname{Hpm}\left(\mathrm{~F}_1\right) $
(4) F2的群体超亲优势$ \operatorname{Hpb}\left(\mathrm{F}_2\right)=\frac{1}{2} \operatorname{Hpm}\left(\mathrm{~F}_1\right)-\frac{1}{2} \omega_G$
遗传效应与杂种优势的计算公式中,Ai和Aj为亲本i和亲本j的加性效应,Dii、Djj、Dij是亲本i和亲本j累加的显性效应,ωG为优亲与劣亲的遗传差异的绝对值。
采用MINQUE(1)法计算方差分量估计值、基因型值,用AUP法预测F1和F2代的群体平均优势和群体超亲优势,用Jackknife数值抽样技术对各基因型的世代平均数进行抽样,并计算其标准误[12],用t测验方法对各遗传参数做统计显著性检验。
2. 结果
2.1 罗非鱼F1、F2代生长性状杂种优势分析
杂种优势(heterosis)是指杂交子代在生长、繁殖、适应性及抗逆性等经济性状方面超越双亲相关均值的现象。国内生产实践中奥尼鱼(Oreochrois niloticus×O.aureus)是重要的罗非鱼养殖对象之一,主要利用其杂种优势,但对于其遗传基础的研究却未见报道。本文对其杂交F1、F2代生长性状的平均遗传表现进行分析,结果见表 2。对基因型×环境互作预测值分析表明,除体重性状基因型×环境互作达到显著水平以外,其它生长性状基因型×环境互作都达极显著水平,说明尼罗罗非鱼与奥利亚罗非鱼亲本杂交杂种后代生长性状基因型易受环境条件的影响。从表中可以看出,杂交F1代相对于F2代具有在各生长性状上均表现出更强的杂种优势,原因可能是F2代自交后出现性状分离导致杂种优势的降低。各性状的优势程度也有所不同,F1代群体平均优势在15.1%~30.6%之间,F2代则有所降低,为7.6%~15.3%。同时,除肥满系数超亲优势较大外,F1、F2代的群体超亲优势则都比较小,F1其它性状超亲优势仅在2.7%~9.0%之间,F2代则基本都表现为负向超亲。结果说明,罗非鱼各生长性状在F1代均表现出超中亲优势,但在F2代则表现出负向群体超亲优势。
表 2 罗非鱼F1、F2代生长有关性状基因型和杂种优势预测值Table 2. Predicted performances of growth-related traits in F1and F2cross of tilapia参数
parametersGE预测值
predictedGE群体平均优势
mean heterosis群体超亲优势
better-parent heterosisPre(F1) Pre(F2) Hpm(F1) Hpm(F2) Hpb(F1) Hpb(F2) 体重 body weight 192.032±12.516* 167.654±3.140* 0.306±0.113* 0.153±0.057* 0.027±0.135 -0.126±0.077* 全长 total length 20.660±0.379** 19.213±0.100** 0.154±0.030** 0.077±0.015** 0.038±0.034 -0.039±0.027* 体长 standard length 16.594±0.322** 15.367±0.084** 0.164±0.032** 0.082±0.016** 0.045±0.040 -0.038±0.026* 体高 body height 7.096±0.131** 6.477±0.033** 0.197±0.031** 0.099±0.016** 0.090±0.044 -0.009±0.040 体厚 body width 3.456±0.088** 3.175±0.023* 0.182±0.042** 0.091±0.021** 0.042±0.051 -0.049±0.041 肥满系数 condition factor 23.721±0.692** 22.093±0.185* 0.151±0.045** 0.076±0.022** 0.136±0.049* 0.061±0.028** 注: * *,*分别表示1%和5%显著性水平
Note: The significance levels at 1% and 5% were denoted by " *"and " * *",respectively.2.2 罗非鱼F1、F2代生长性状基因型和杂种优势与环境互作预测值
罗非鱼生长性状基因型×环境互作分析表明其基因型×环境互作效应显著,因而对杂交F1、F2代生长性状基因型和杂种优势与环境互作进行进一步分析(表 3)。从表 3中可以看出,体重、全长、体长、体宽等4个性状的基因型效应与杂种优势都存在明显的环境差异,表现为在网箱内高密度的养殖环境(E1)中存在较强的杂种优势,而在水泥池内低密度养殖环境(E2)中杂种优势效应则相对较弱,表明在对罗非鱼的杂种优势利用中应当充分考虑环境因素的影响。对于体重性状,在网箱内高密度环境中杂交子代F1群体平均优势与环境互作效应为8.4%,而在水泥池低密度环境中仅有1.5%;而F1代群体超亲优势在网箱高密度环境中为7.9%,在水泥池则出现下降趋势,为-22.1%。其它性状如全长、体长、体宽的变化情况也表现出这种趋势。但是在本研究中,体高与肥满系数2个性状的基因型和杂种优势与环境的互作效应计算值很小,因而其计算结果在表 3中未列出,表明这2个性状需要通过较为复杂的遗传交配试验来进行分析。
表 3 罗非鱼F1、F2代生长有关性状基因型和杂种优势与环境互作预测值Table 3. Predicted performances of growth-related traits in F1and F2cross of tilapia体重
body weight全长
total length体长
standard length体宽
body widthGE 预测值 predicted Pre(F1) E1 8.969 0.781 0.430 0.222 E2 1.612 0.205 0.149 0.034 GE Pre(F2) E1 2.242 0.195 0.107 0.055 E2 0.403 0.051 0.037 0.009 群体平均优势
mean heterosisHpm(F1) E1 0.084 0.063 0.043 0.108 E2 0.015 0.016 0.015 0.017 Hpm(F2) E1 0.042 0.031 0.022 0.054 E2 0.008 0.008 0.007 0.008 群体超亲优势
better-parent heterosisHpb(F1) E1 0.079 0.057 0.039 0.098 E2 -0.221 0.007 0.008 -0.016 Hpb(F2) E1 0.037 0.026 0.017 0.045 E2 -0.229 -0.002 0.001 -0.025 3. 讨论
人们自认识到杂种优势现象以来,一直都在探索杂种优势的有效预测方法。早期评价杂交效果主要是通过杂交试验进行配合力测定,既费力又费时,至少需要2~3个世代才能得到可靠的结果,因而其应用受到一定程度的限制。因此,必须借助于其它新的评估方法。近年来,人们注意到自然界存在大量的表型、生化或分子水平的遗传多态现象,遗传多态现象的存在似乎与群体的生活力和适应性优势有关。分子标记技术的发展与广泛应用使人们认识到杂种优势在一定程度上取决于2个杂交亲本间遗传差异的大小,即遗传距离的大小。可以说差别越大的群体间杂交,所产生的杂种优势越大[13]。但是,许多研究表明,杂种优势与遗传距离之间的关系极为复杂,呈现出曲线关系,同时,反映遗传距离大小的基因频率往往会集中在多态性高的座位,当测定样本数与标记座位数少时理论值与实际值之间产生偏差,因此造成预测结果有时准确、有时不准确,缺乏稳定性[14]。从理论上讲,标记杂合度与杂种优势之间的相关性受特定性状杂种优势遗传基础的制约,故仅从杂交亲本的遗传纯度和遗传距离角度来预测杂种优势是不够的,还必须对相应杂优的数量遗传学基础进行研究才能做出较为准确的杂种优势预测[15]。对于鱼类杂种优势的预测,目前主要也是通过分子标记的手段[16-18],通过一些间接指标,如亲本的亲缘关系,来进行杂交优势程度的预测。
根据杂种优势的显性学说,一般有利的性状多由显性基因控制,不利的性状多由隐性基因控制,杂交改变了杂交后代的基因组合,增加了基因的杂合性,由于显性对隐性的掩盖作用,改变了不同位点上的基因互作,既是显性基因互补,又是异质等位基因互作和非等位基因互补等的综合作用,在绝大多数基因型和环境之间获得一种相互协调的平衡,因而提高了杂种的生活力、繁殖力和生长速度等重要经济性状[19]。虽然杂交可以增加变异性、增加异质性、产生某些双亲没有的新性状、出现可利用的杂种优势等,但是杂交的这些积极作用并非任何杂交组合都有,更不能苛求某一特定的杂交组合同时具有所有的优良特性。HENA等[20]采用尼罗罗非鱼与莫桑比克罗非鱼(O.mossambicus)杂交,发现F1代在体重性状的杂种优势为1.24,在所有盐度下生长优于莫桑比克罗非鱼,在盐度10以上的环境中F1对尼罗罗非鱼有生长速度优势。URMAZA和AGUILAR[21]采用尼罗罗非鱼、红罗非鱼与莫桑比克罗非鱼杂交,发现杂交子代在高盐环境中具有生长优势。BRYDEN等[22]采用野生和养殖的大鳞大麻哈鱼(Oncorhynchus tshawyacha)交配,发现12种数量性状中有9个表现出杂种优势但与中亲值相去不远,其中4个是对生产有益的性状,但杂种F1代没有一种性状的表现能够超过野生品系。QUINTON等[23]对三品系虹鳟(Oncorhynchus mykiss)的杂交实验表明F1代的表现普遍处于纯系品种之间,没有表现出杂种优势。DOUPE等[24]对布氏棘鲷(Acanthopagrus butcheri)2个品系采用双列杂交分析发现体长、全长、体重等性状的遗传力分别为0.27,0.33,0.28,性状间表型相关系数为0.95~0.98,没有一个性状表现出杂种优势。ARGUE等[25]对(Ictalurus punctatus)和(I.furcatus)的杂交实验发现其正交子代鱼片产量和出肉率性状存在杂种优势,亲本的显性遗传效应对鱼片产量和出肉率性状为负向效应。ARAS-HISAR等[26]采用红点鲑(Salvelinus alpinus) 和河鳟(Salmo trutta fario)杂交,发现发育到眼点时的存活率杂交种显著低于双亲,在养殖性状方面杂交种也没有表现出杂种优势。GJERDE等[27]对南亚野鲮(Labeo rohita)采用3×3的双列杂交研究,发现所有杂交组合的产量性状和存活率都表现出负向或极弱的杂种优势。SHIKANO等[28]对4个杂交种虹鳉(Poecilia reticulata)耐盐性能的分析表明,杂种优势的强弱与双亲的亲缘远近呈相关关系,双亲亲缘关系越远,其杂交F1代耐盐性状优势度越大。NGUENGA等[29]对长丝异鳃鲶(Heterobranchus longifilis)2个品系的2×2完全双列杂交研究表明,杂交种受精率处于双亲之间但远高于低亲值,平均存活率与双亲没有显著差异,生长速度相对于高亲具有15.1%的杂种优势。CHIYOKUBO等[30]发现虹鳉杂交F1代具有显著的耐盐性杂种优势,但在F2代耐盐性显著下降。王楚松等[31]以奥尼鱼、尼罗罗非鱼、奥利亚罗非鱼、福寿鱼进行生长对比,发现奥尼鱼个体增重比母本尼罗罗非鱼高11.32%~24.45%,比父本奥利亚高17.76%~72.7%,而且在生长、产量、抗寒、起捕率等主要经济性状方面均具有明显的杂种优势。杂交组合繁殖力比亲本低,不具有优势。刘志国等[32]对瓯江彩鲤(Cyprinus carpio color var.)与日本锦鲤(Koi carp)及其正反杂交F1生长研究发现,正反交F1子代生长速度最高只达到中亲值水平。本研究发现尼罗罗非鱼与奥利亚罗非鱼杂交子代主要生长性状在网箱环境中表现出超高亲优势,但在水泥池环境中表现为超中亲优势,与其它杂交育种研究结果相类似。需要指出是,本研究所计算的杂种优势是在网箱内高密度饲养与水泥池内低密度饲养2种环境中得到,因而,不能更进一步地指明杂种优势的差异表现具体是来源于不同的养殖方式(水泥池或网箱),还是来源于养殖密度的差异,这是下一步研究需要注意的一个问题。
尼罗罗非鱼和奥利亚罗非鱼是我国当前淡水养殖业的重要养殖品种[33],在亲缘关系上存在一定的距离,但生殖隔离不很明显,能自然杂交产生正常可育的后代[34]。根据WU和LI[35]提出的杂种遗传力的概念,认为它的大小随着杂交次数的增加而增加,最后所有后代都表现这一性状,此时一个新的物种开始形成。本研究只是在罗非鱼主要生长性状杂种优势方面作一些初步的分析,还没有涉及到对于繁殖、抗病、抗逆、饲料转化效率、肉质等其它重要经济性状的遗传分析,也未能尝试通过杂种选育产生优良新品种,因而本研究之后还有广阔的领域。与其它鱼类杂交相比,罗非鱼杂交子代出现性别比例偏离的情况,尼奥杂交子代通常出现较高雄性率,对于这一现象本研究将另作专门的探讨。
-
表 1 海水水质标准GB 3097-1997
Table 1 Seawater quality standard GB 3097-1997
mg·L-1 项目item 第一类Grade Ⅰ 第二类Grade Ⅱ 第三类Grade Ⅲ 第四类Grade Ⅳ 无机氮DIN≤ 0.20 0.30 0.40 0.50 活性磷酸盐PO4-P≤ 0.015 0.030 0.045 表 2 水质污染程度分类标准
Table 2 Standard for classification of pollution degree of water quality
平均污染指数
average pollution index等级
grade质量状况
quality status< 0.2 1 清洁 0.2~0.4 2 尚属清洁 0.4~0.7 3 轻度污染 0.7~1.0 4 中度污染 1.0~2.0 5 重度污染 >2.0 6 严重污染 表 3 不同功能区氮盐的质量浓度
Table 3 Concentrations of DIN, NO3-N, NO2-N and NH4-N in different function areas
mg·L-1 功能区
function area无机氮DIN 硝酸盐NO3-N 亚硝酸盐NO2-N 铵盐NH4-N 范围
range均值
mean范围
range均值
mean范围
range均值
mean范围
range均值
mean网箱养殖区cage culture area 0.107~0.913 0.625±0.306 0.085~0.832 0.568±0.283 0.001~0.033 0.017±0.011 0.021~0.100 0.040±0.031 贝类底播区shellfish farming area 0.114~0.478 0.297±0.145 0.084~0.372 0.215±0.117 0.005~0.059 0.034±0.024 0.020~0.074 0.048±0.020 海藻养殖区seaweed culture area 0.126~1.191 0.275±0.333 0.071~1.070 0.214±0.312 0.002~0.106 0.021±0.031 0.008~0.059 0.040±0.016 人工鱼礁区artificial reef area 0.117~0.131 0.124±0.010 0.064~0.084 0.074±0.014 0.006~0.012 0.009±0.004 0.028~0.055 0.041±0.019 对比区control area 0.133~0.195 0.168±0.032 0.082~0.163 0.133±0.044 0.007~0.009 0.008±0.001 0.019~0.042 0.028±0.013 表 4 不同功能区活性磷酸盐和硅酸盐的质量浓度
Table 4 Concentrations of PO4-P and SiO3-Si in different function areas
mg·L-1 功能区
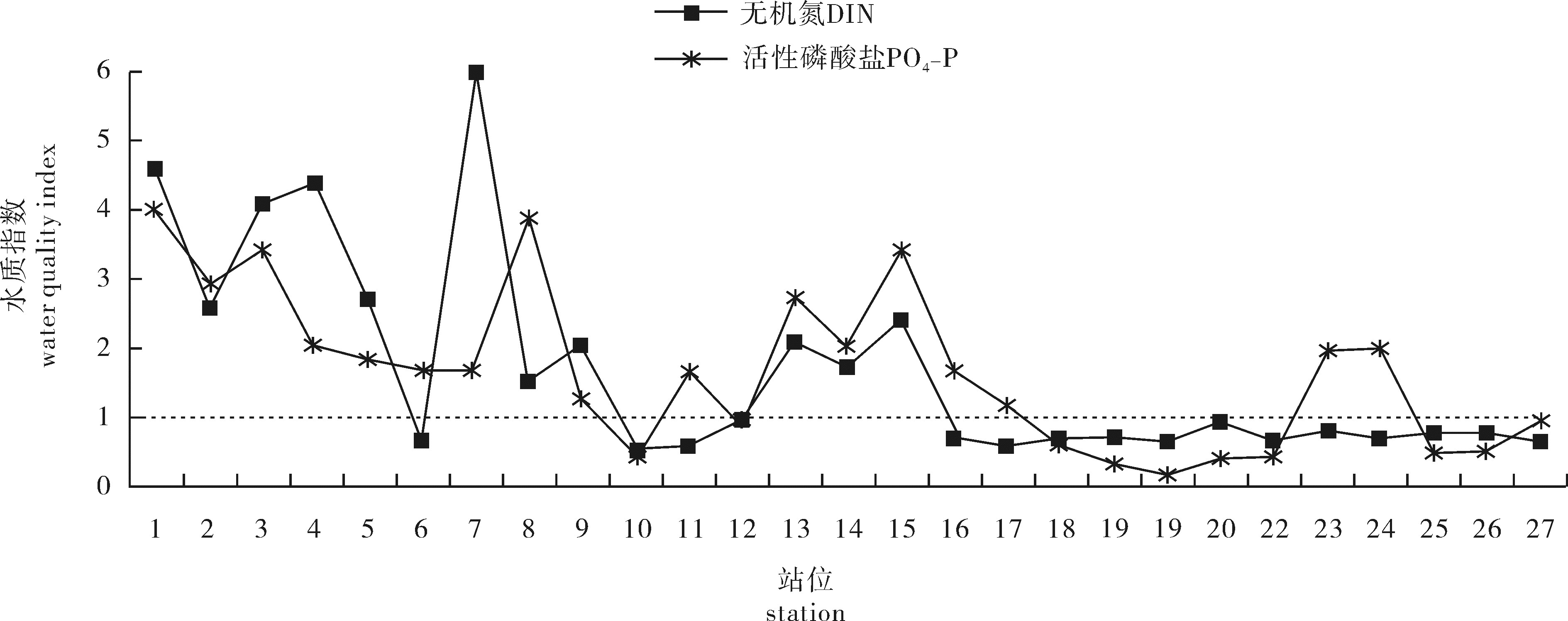
function area活性磷酸盐PO4-P 硅酸盐SiO3-Si 范围range 均值mean 范围range 均值mean 网箱养殖区cage culture area 0.006~0.060 0.036±0.019 0.018~0.510 0.226±0.173 贝类底播区shellfish farming area 0.017~0.058 0.033±0.017 0.003~0.679 0.441±0.260 海藻养殖区seaweed culture area 0.002~0.041 0.017±0.013 0.057~0.367 0.219±0.117 人工鱼礁区artificial reef area 0.025 0.025±0.000 0.076~0.201 0.139±0.088 对比区control area 0.006~0.014 0.009±0.004 0.028~0.125 0.064±0.053 表 5 海洋牧场不同功能区单因子水质指数、分担率和平均污染指数
Table 5 Single factor index of water quality, share rate and average pollution index in different areas of marine ranching
功能区
function area无机氮DIN 活性磷酸盐PO4-P 平均污染指数
PjP K/% P K/% 网箱养殖区cage culture area 3.1±1.5 56.4±7.4 2.4±1.3 43.6±7.4 2.8±1.3 贝类底播区shellfish farming area 1.5±0.7 39.9±12.8 2.2±1.2 60.1±12.8 1.9±0.8 海藻养殖区seaweed culture area 1.4±1.7 53.9±18.8 1.1±0.9 46.1±18.8 1.3±1.1 人工鱼礁区artificial reef area 0.6±0.0 27.2±1.5 1.7±0.0 72.8±1.5 1.1±0.0 对比区control area 0.8±0.2 60.5±8.4 0.6±0.3 39.5±8.4 0.7±0.2 表 6 海洋牧场不同功能区的富营养指数
Table 6 Eutrophication value in different areas of marine ranching
功能区function area 范围range 均值mean 网箱养殖区cage culture area 0.07~21.47 10.06±7.53 贝类底播区shellfish farming area 0.09~6.39 1.98±2.45 海藻养殖区seaweed culture area 0.03~11.10 1.29±3.28 人工鱼礁区artificial reef area 0.17~0.83 0.50±0.47 对比区control area 0.22~0.35 0.29±0.06 -
-
期刊类型引用(16)
1. 周志希,唐汇娟,柯志新,刘甲星,周伟华. 基于形态学和高通量测序的春季南澳海域浮游植物群落特征及其与环境因子关系. 热带海洋学报. 2025(01): 53-65 .  百度学术
百度学术
2. 黄皓晨,柯志新,周志希,周伟华. 南澳岛周边海域表层海水营养盐分布及富营养化特征. 热带海洋学报. 2025(02): 196-207 .  百度学术
百度学术
3. 柳原,柯志新,李开枝,谭烨辉,梁竣策,周伟华. 人类活动和沿岸流影响下的粤东近海浮游动物群落特征. 热带海洋学报. 2024(04): 98-111 .  百度学术
百度学术
4. 薛宇,于浩林,周广军,赵伟,唐衍力. 渤海小竹山岛海洋牧场区营养盐分布特征及增养殖适宜性探究. 渔业科学进展. 2023(01): 1-12 .  百度学术
百度学术
5. 黎素菊,洪捷娴,陈树鹏. 柘林湾养殖区氮、磷季节分布特征及富营养化评价. 江西水产科技. 2022(04): 45-47+51 .  百度学术
百度学术
6. 匡翠萍,王丹,赵钒,刘会欣,朱磊. 金梦海湾及其邻近海域水环境因子时空分布特征. 同济大学学报(自然科学版). 2021(06): 880-890 .  百度学术
百度学术
7. 任玉正,柯志新,谭烨辉,李开枝. 广东省南澳岛东部海域浮游动物群落结构及其影响因素. 热带海洋学报. 2020(02): 65-76 .  百度学术
百度学术
8. 杨文超,黄道建,陈继鑫,陈晓燕,王宇珊. 大亚湾海域2009—2015年氮、磷营养盐时空分布及富营养化评价. 南方水产科学. 2020(02): 54-61 .  本站查看
本站查看
9. 陈丹婷,柯志新,谭烨辉,刘甲星. 汕头南澳—东山海域营养盐季节分布特征及其对浮游植物生长的潜在性限制. 生态科学. 2020(04): 41-50 .  百度学术
百度学术
10. 马欢,秦传新,陈丕茂,林会洁,段丁毓. 柘林湾海洋牧场生态系统服务价值评估. 南方水产科学. 2019(01): 10-19 .  本站查看
本站查看
11. 王言丰,胡启伟,余景,陈丕茂,舒黎明. 粤东柘林湾海洋牧场渔业资源增殖效果评估. 南方水产科学. 2019(02): 12-19 .  本站查看
本站查看
12. 徐淑敏,齐占会,史荣君,刘永,韩婷婷,黄洪辉. 水产养殖对亚热带海湾氮磷营养盐时空分布的影响——以深澳湾为例. 南方水产科学. 2019(04): 29-38 .  本站查看
本站查看
13. 王文杰,陈丕茂,袁华荣,冯雪,张露,龙鑫玲,陈文静,李丹丹. 粤东柘林湾甲壳类群落结构季节变化分析. 南方水产科学. 2018(03): 29-39 .  本站查看
本站查看
14. 佟飞,秦传新,余景,陈丕茂. 粤东柘林湾溜牛人工鱼礁建设选址生态基础评价. 南方水产科学. 2016(06): 25-32 .  本站查看
本站查看
15. 舒黎明,陈丕茂,秦传新,黎小国,周艳波,冯雪,于杰,袁华荣,李国迎. 柘林湾-南澳岛潮间带冬夏两季大型底栖动物种类组成及优势种. 生态学杂志. 2016(02): 423-430 .  百度学术
百度学术
16. 舒黎明,陈丕茂,黎小国,秦传新,于杰,周艳波,袁华荣. 柘林湾附近海域大型底栖动物物种多样性. 中国水产科学. 2015(03): 501-516 .  百度学术
百度学术
其他类型引用(5)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
