Preliminary investigation of fish diversity in middle and lower reaches of Pearl River based on environmental DNA technology
-
摘要:
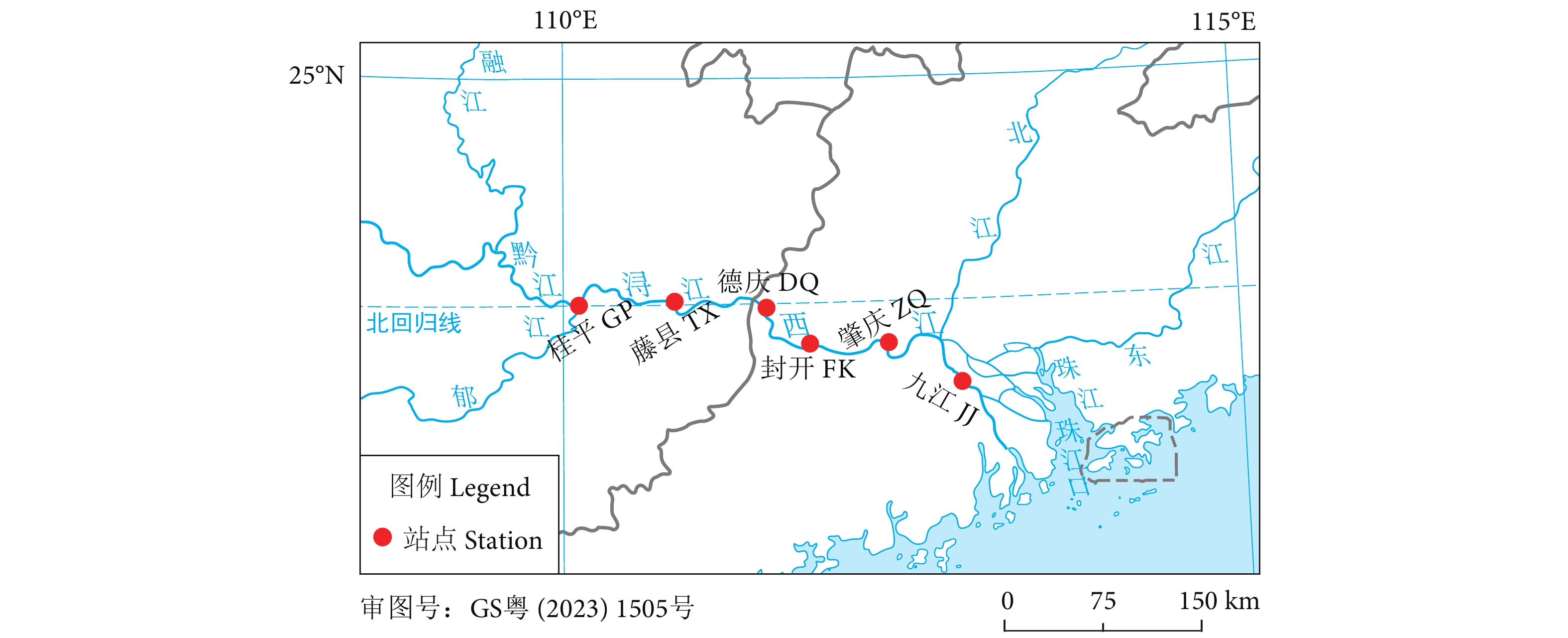
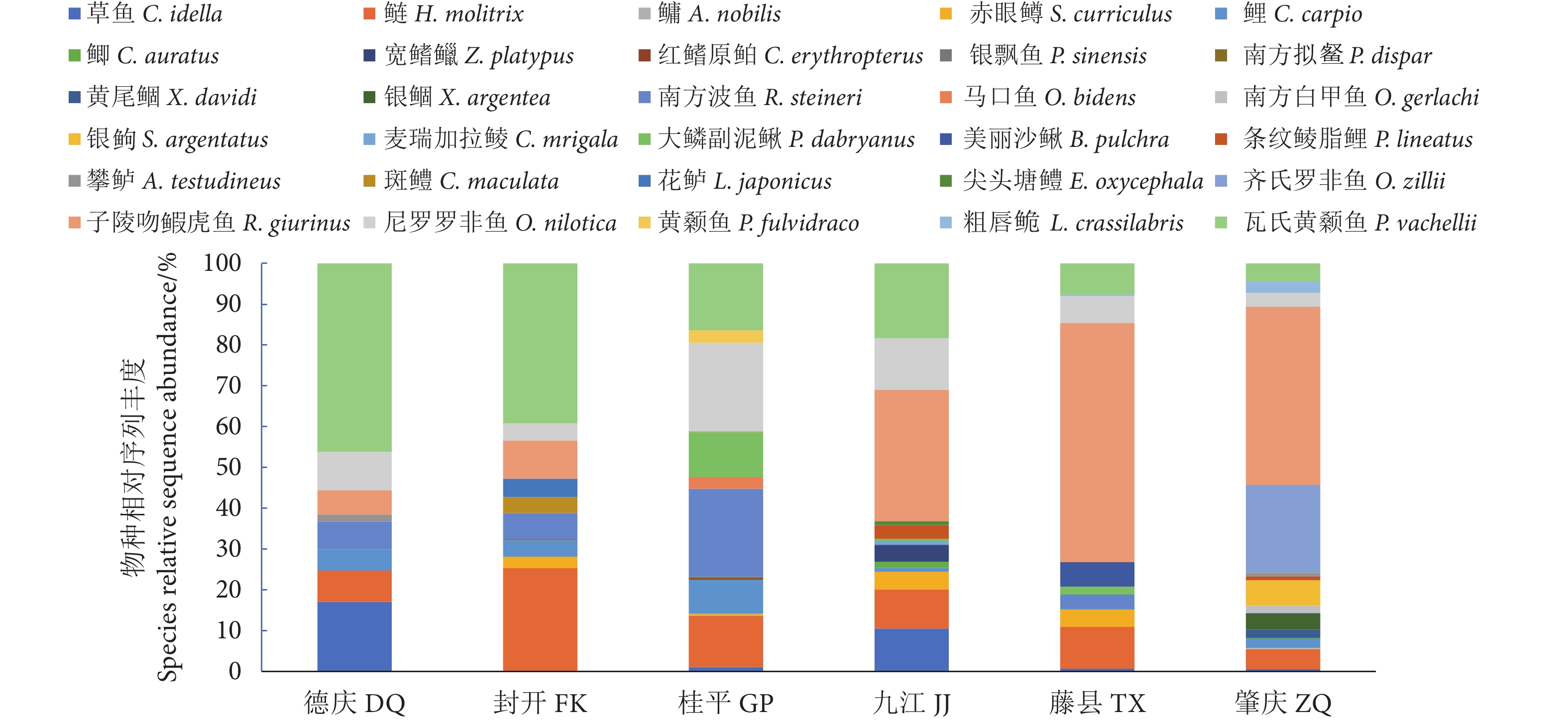
通过环境DNA技术 (Environmental DNA, eDNA) 检测珠江中下游鱼类生物多样性,探索珠江中下鱼类多样性监测和保护的新途径。2023年2月在珠江中下游设置了桂平、藤县、封开、德庆、肇庆和九江共6个采样点,通过水样采集及过滤、eDNA提取、遗传标记扩增及测序和数据库比对分析等流程检测鱼类多样性。结果表明,6个采样点共检测出30种鱼类,隶属于4目10科27属,其中土著鱼类26种,外来种4种。较已有传统调查数据新检出2种鱼类:美丽沙鳅 (Botia pulchra) 和齐氏罗非鱼 (Oceochromis zillii)。鱼类优势种为子陵吻鰕虎鱼 (Rhinogobius giurinus)、瓦氏黄颡鱼 (Pelteobagrus vachellii)、鲢 (Hypophthalmichthys molitrix)、尼罗罗非鱼 (O. nilotica)、齐氏罗非鱼、南方波鱼 (Rasbora steineri) 和鲤 (Cyprinus carpio)。根据Shannon指数和Simpson指数显示,eDNA检测九江和桂平站点的鱼类多样性最高,藤县的最低。作为一种新的检测方法,eDNA技术可用于快速检测珠江中下游鱼类的多样性及分布,在实际应用中可将eDNA技术与传统的监测方法相结合,以提供更全面的鱼类生物多样性数据信息。
-
关键词:
- 环境DNA (eDNA) /
- 鱼类多样性 /
- 珠江中下游
Abstract:To explore new ways for observing and protecting fish species diversity in the middle and lower reaches of the Pearl River, we used eDNA technology to detect fish species diversity in that river section. Six sampling localities, namely Guiping, Tengxian, Fengkai, Deqing, Zhaoqing and Jiujiang, were set up in February 2023. The fish diversity was detected by eDNA metabarcoding analysis that includes water collection, water filtration, eDNA extraction, genetic marker amplification, sequencing and bioinformatic analyses. The results show that 30 fish species had been detected in 6 sampling sites, belonging to 4 orders, 10 families and 27 genera, in which 26 were native species and 4 were non-native species. Compared with traditional survey reports, two new species (Botia pulchra and Oceochromis zillii) were detected. Rhinogobius giurinus, Pelteobagrus vachellii, Hypophthalmichthys molitrix, O. nilotica, O. zillii, Rasbora steineri and Cyprinus carpio were found at each sampling site, indicating that these species are the dominant species in the survey area. According to Shannon index and Simpson index, the fish diversity was highest in Jiujiang and Guiping, while lowest in Tengxian. As a new detection method, eDNA technology can efficiently investigate the fish biodiversity and distribution in the middle and lower reaches of the Pearl River. To sum up, eDNA technology can be combined with traditional fish resources monitoring methods to provide more comprehensive data information on fish species diversity.
-
硬骨鱼类的生长主要受生长轴,即生长激素(GH)/胰岛素样生长因子(IGF)的调控,GH为脑垂体分泌的单链肽类激素,通过生长激素受体(GHR)刺激肝脏等组织分泌IGF,进而发生生物学效应。GH居于生长轴的中心位置,在鱼类的个体生长中起关键性作用[1]。研究表明鱼类垂体GH基因的转录和转译水平受性别[2-5]、季节和生理状态[4-7]及外界理化因子[8-10]等因素的影响,且研究结果显示在一定条件下垂体GH基因转录或转译水平高的鱼类其生长速度也快。因此,GH成为研究鱼类生长性能的重要指标。
高密度养殖是提高单位面积产量、实现更大经济效益的有效手段,但不可避免地影响养殖对象的生长速度和健康。而革胡子鲶(Clarias gariepinus)比其他养殖鱼类对高密度养殖的适应性强[11-16]。天津市德仁农业发展有限公司设施化养殖的革胡子鲶,在高密度下仍然能够快速生长(最高产量可达400 kg · m-3水体),推测与其内在的生长调控因子有关。文章通过分析不同养殖密度下革胡子鲶幼鱼的日增质量和垂体GH基因mRNA的表达水平,初步探讨革胡子鲶幼鱼在不同养殖密度下生长差异和生长差异的内在原因,以期为深入探究革胡子鲶的生长调节以及高密度养殖快速生长的机理奠定基础。
1. 材料与方法
1.1 试验材料
试验用鱼为天津市德仁农业发展有限公司从福建漳州购进约1.5 g的革胡子鲶饲养而成,选取大小规格相近的幼鱼为试验对象,平均体质量为10~12 g。
1.2 养殖试验
试验分组及饲养管理同DAI等[17]。即试验用革胡子鲶幼鱼取回后在天津农学院天津市水产生态及养殖重点实验室于水族箱(70 cm×50 cm×50 cm)中暂养2周后,选取发育良好、体质健康的个体[平均体质量为(30.71±0.89)g]用于该试验。试验鱼随机分为35 kg · m-3、65 kg · m-3、95 kg ·m-3和125 kg · m-3 4个密度组,每组3个重复,饲养于水族箱(70 cm×50 cm×50 cm)中,实际水体积为120 L。模拟天津市德仁农业发展有限公司水泥池饲养革胡子鲶幼鱼的实际养殖条件,每日10: 00和18: 00各换水一次,每次换水量为水体积的3/4;养殖水温保持在(27±1)℃。按体质量的2%每天8: 00和16: 00各投喂一次,所用饲料为天津市天祥水产有限公司生产的鲶鱼膨化配合饲料(粗蛋白35%、粗脂肪5%、粗纤维10%、灰分10%)。养殖试验为期60 d,试验期间水体积保持不变,每30 d取样一次。每天观察并记录鱼的摄食及死亡情况。
1.3 相关指标分析方法
1.3.1 革胡子鲶生长的测定
分别于第30和第60天各分析一次。分析时停饲24 h,并以200 mg · L-1的MS-222麻醉,以水族箱为单位称量鱼体的总质量,同时计数鱼体数量,根据下列公式计算鱼的均质量和日增质量:
鱼的均质量=试验结束时每箱鱼总质量(g)/鱼的数量(尾)
日增质量=[试验结束时鱼的均质量(g · 尾-1)-试验开始时鱼的均质量(g · 尾-1)]/养殖天数
1.3.2 GH基因mRNA表达的半定量分析
养殖第30和第60天时,每个养殖密度各取经MS-222麻醉的鱼18尾(每个水族箱取鱼6尾),解剖取出垂体后立即放入液氮中,之后于-80 ℃保存备用。以β-肌动蛋白基因作为内参基因分析垂体GH基因mRNA的相对表达量。试验中以个体为单位,根据王晓梅等[18]报道的方法进行垂体总RNA的提取、cDNA第一条链的合成、GH基因ORF区段和β-肌动蛋白基因片段的扩增以及GH基因mRNA相对表达量分析。
1.3.3 数据统计分析
试验数据以“平均值±标准差”(X+SD)表示,数据采用SPSS 11.5统计软件进行单因素方差分析(One-Way ANOVA),LSD法多重比较各组间数值的差异显著性(P<0.05)。
2. 结果
2.1 生长分析
根据革胡子鲶在不同密度养殖30 d和60 d后体质量(表 1)计算鱼体在0~30 d以及30~60 d 2个养殖期的日增质量。结果表明,试验期间随着养殖密度的增大出现日增质量降低的趋势(图 1),统计分析结果显示,在0~30 d的养殖期间,35 kg ·m-3和65 kg · m-3密度组的日增质量差异不显著(P>0.05),95 kg · m-3和125 kg · m-3密度组的日增质量差异也不显著(P>0.05);但35 kg · m-3和65 kg · m-3密度组的日增质量显著高于95 kg · m-3和125 kg · m-3密度组(P<0.05);养殖30~60 d期间,35 kg · m-3和65 kg · m-3密度组的日增质量显著高于125 kg · m-3密度组(P<0.05),而其余各密度组间的日增质量差异均不显著(P>0.05)。
表 1 养殖密度对革胡子鲶体质量的影响Table 1. Effect of stocking density on body weight of juvenile C.gariepinus指标index 养殖密度/ kg·m-3 stocking density 35 65 95 125 初始体质量/g initial body weight 31.01±0.47 29.77±0.32 30.82±1.17 31.22±0.90 第30天体质量/g body weight on 30th day 64.75±1.21a 60.79±0.43ab 57.40±3.38bc 55.38±2.83c 第60天体质重/g body weight on 60th day 100.94±3.42a 96.64±3.84a 90.70±1.19b 82.87±2.71c 死亡率/% mortality 3.69±0.76a 3.68±1.13a 5.13±0.36b 5.40±0.43b 注:部分数据引自文献[17]。同一行肩标字母相同或无肩标字母者表示差异不显著(P>0.05),肩标字母不同者表示差异显著(P<0.05)
Note:Some data in this table are taken from Reference [17].Values with the same letters or no letter within the same row are not significantly different (P>0.05);whereas those with different letters are significantly different (P<0.05).![]() 图 1 不同养殖密度革胡子鲶日增质量同一线上肩标字母不同者为差异显著(P<0.05),肩标字母相同者为差异不显著(P>0.05)Figure 1. Daily weight gain of C.gariepinus reared at different stocking densitiesValues with different superscripts on the same lines are significantly different (P < 0.05), while those with the same superscripts are not significantly different (P > 0.05).
图 1 不同养殖密度革胡子鲶日增质量同一线上肩标字母不同者为差异显著(P<0.05),肩标字母相同者为差异不显著(P>0.05)Figure 1. Daily weight gain of C.gariepinus reared at different stocking densitiesValues with different superscripts on the same lines are significantly different (P < 0.05), while those with the same superscripts are not significantly different (P > 0.05).2.2 GH基因mRNA表达的半定量RT-PCR分析
2.2.1 总RNA分离结果
经1%琼脂糖凝胶电泳检测表明提取的革胡子鲶脑垂体总RNA完整性较好(图 2显示了4个RNA样本的电泳结果)。用核酸蛋白测定仪(德国Eppendorf公司出品,BioPhotometer型)测定出每个RNA样本光密度比(OD260/OD280)为1.80~2.00,表明总RNA纯度较好,RNA样本可以用于后续的试验。
2.2.2 PCR扩增产物电泳检测结果
图 3-a和图 3-b分别为养殖第30和第60天时革胡子鲶部分个体GH和β-actin基因片段扩增后的电泳检测结果。
![]() 图 3 养殖第30天(a)和第60天时(b)革胡子鲶个体GH和β-actin基因片段PCR产物电泳图泳道1~3、4~6、7~8和9~12分别为养殖密度35 kg · m-3、65 kg · m-3、95 kg · m-3和125 kg · m-3的各3个体GH和β-actin基因片段RCR产物电泳图,泳道M为DNA标准分子量(BBI公司)Figure 3. Electrophoretic patterns of PCR products of GH and β-actin gene fragments of individuals on 30th (a) and 60th day nursing(b)Lanes 1~3, 4~6, 7~8 and 9~12 are electrophoretic patterns of PCR products of GH and β-actin gene fragments separately on three individuals at stocking densities of 35 kg · m-3, 65 kg · m-3, 95 kg · m-3 and 125 kg · m-3, respectively; Lane M is DNA Marker (BBI Company)
图 3 养殖第30天(a)和第60天时(b)革胡子鲶个体GH和β-actin基因片段PCR产物电泳图泳道1~3、4~6、7~8和9~12分别为养殖密度35 kg · m-3、65 kg · m-3、95 kg · m-3和125 kg · m-3的各3个体GH和β-actin基因片段RCR产物电泳图,泳道M为DNA标准分子量(BBI公司)Figure 3. Electrophoretic patterns of PCR products of GH and β-actin gene fragments of individuals on 30th (a) and 60th day nursing(b)Lanes 1~3, 4~6, 7~8 and 9~12 are electrophoretic patterns of PCR products of GH and β-actin gene fragments separately on three individuals at stocking densities of 35 kg · m-3, 65 kg · m-3, 95 kg · m-3 and 125 kg · m-3, respectively; Lane M is DNA Marker (BBI Company)2.2.3 GH mRNA表达半定量PCR分析的数据统计
利用GeneTools软件分析革胡子鲶个体GH(目标基因)和β-actin(内参基因)基因片段扩增后的电泳图谱,GH与β-actin基因片段扩增产物的信号强度比即为GH基因的相对表达量。
图 4为养殖第30和第60天时不同养殖密度下革胡子鲶GH基因mRNA平均相对表达量的统计分析结果。养殖第30天时,各养殖密度间革胡子鲶GH基因mRNA相对表达量差异均不显著(P>0.05);养殖第60天时,革胡子鲶GH基因mRNA相对表达量在35 kg · m-3和65 kg · m-3密度组间差异不显著(P>0.05),95 kg · m-3和125 kg · m-3密度组间差异也不显著(P>0.05),但35 kg · m-3和65 kg · m-3密度组GH基因mRNA的相对表达量显著高于95 kg · m-3和125 kg · m-3密度组(P<0.05)。
![]() 图 4 不同养殖密度革胡子鲶GH基因mRNA的相对表达量标有不同字母者为差异显著(P<0.05),无字母或字母相同者为差异不显著(P>0.05)Figure 4. Relative expression of GH mRNA in pituitary of C.gariepinus reared at different densitiesDifferent letters above the bar indicate significant difference (P < 0.05);while the same letters or no letter above the bar indicate no significant difference (P > 0.05)
图 4 不同养殖密度革胡子鲶GH基因mRNA的相对表达量标有不同字母者为差异显著(P<0.05),无字母或字母相同者为差异不显著(P>0.05)Figure 4. Relative expression of GH mRNA in pituitary of C.gariepinus reared at different densitiesDifferent letters above the bar indicate significant difference (P < 0.05);while the same letters or no letter above the bar indicate no significant difference (P > 0.05)3. 讨论
鱼体的生长状况是水产养殖中备受关注的重要经济性状,而GH与鱼类的生长密切相关,在鱼类的个体生长及生长调节中起关键性作用。马细兰等[2]指出垂体GH基因在转录水平上反映GH的合成速度,是反映动物生长速度的有效指标,生长快速的鱼其垂体GH mRNA表达量高;并且应用半定量RT-PCR法分析得出尼罗罗非鱼(Oreochromis niloticus)雄鱼垂体GH mRNA表达水平明显高于雌鱼,认为这可能是尼罗罗非鱼雄鱼生长快于雌鱼的主要内在原因之一。性成熟的金钱鱼(Scatophagus argus)雌鱼生长快于雄鱼,其生长差异与垂体GH mRNA的水平也呈显著的正相关[3]。同样,生长快速的雌性黄鲈(Perca flavescens)垂体GH mRNA水平显著高于雄鱼,并且在生长快速的春季显著高于秋季[4]。性成熟的鲤(Cyprinus carpio)垂体GH mRNA表达也呈现出季节性的周期变化,生长较快的季节(水温18~20 ℃)垂体GH mRNA表达比生长相对较慢的季节(水温8~10 ℃)高3倍[6]。鲇形目鳠科的大鳍鳠(Mystus macropterus)脑垂体GH的含量分别在3月和8月出现峰值,与该鱼春季和秋季的快速生长一致[7]。该目鲇科的野生鲇(Silurus asotus)垂体GH的含量在3月和7月各出现一个高峰值,研究者认为这可能与野生鲇春季和产卵后生长加快有关;并且雌性鲇鱼垂体GH的周年含量显著高于雄鱼,与雌鱼生长速度显著快于雄鱼的现象相符合[5]。SHIN等[8]研究发现光的波长可影响观赏性鱼类——克氏双带锯齿盖鱼(Amphiprion clarkii)的生长速度和垂体GH mRNA水平、生长速率与垂体GH mRNA的水平呈正相关。李云等[9]研究显示饲料中添加一定量的半胱胺盐酸盐(1 mg · g-1饲料)可显著提高斜带石斑鱼(Epinephelus coioides)的体质量增长率和垂体GH的转录水平。马细兰等[10]发现促黄体素释放激素类似物(LHRH-A)可显著上调尼罗罗非鱼生长轴相关基因(GH、GHR和IGF)的表达,从而促进鱼类的生长。上述研究说明鱼体的生长速度与垂体GH基因的转录水平呈正相关。
由于脑垂体合成GH后经过血液运送至靶器官,再通过GHR和IGF的介导进而达到促进鱼体生长的作用,因此鱼类的生长速度并不能完全通过GH水平来体现,还与GHR和IGF的水平有关。如银大麻哈鱼(Oncorhynchus kisutch)在禁食3周后,比正常投喂组肝脏GHR mRNA水平低,提示长时间禁食可引起肝脏GHR基因表达的下降[19]。SAERA-VILA等[20]报道金鲷(Sparus aurata)肝脏和脂肪组织GHRⅠ基因表达最丰富,但禁食后可引起GHRⅠmRNA水平的下降。斑点叉尾(Ictalurus punctatus)在投喂外源皮质醇或者禁食4周后,与对照组相比,肝脏GHR mRNA的丰度以及血清中IGF的浓度均显著下降,且肝脏GHR mRNA的丰度和血清中IGF的浓度呈正相关;投喂外源皮质醇后鱼的生长显著下降,禁食组鱼的体质量减少[21]。华益民和林浩然[22]报道鲤饥饿32 d导致生长受阻,肝组织IGF-ⅠmRNA表达水平下降;再投喂后,其生长和肝组织IGF-ⅠmRNA丰度都逐渐恢复,表现出鲤的生长状况与肝组织IGF-ⅠmRNA水平的同步变化。尼罗罗非鱼饥饿28 d内血清GH含量反倒显著升高,而血清IGF含量和肝胰脏IGF mRNA表达丰度显著下降,饥饿后再投喂,第14天时血清GH含量显著升高,继续投喂7 d血清GH含量又表现出显著下降,但仍与饥饿第7天时的GH水平相当,而血清IGF含量和肝胰脏IGF mRNA表达丰度在第21天恢复投喂过程中显著升高,并恢复到饥饿前水平[23]。鲮(Cirrhinus molitorella)在投喂不同蛋白水平的饲料时,在8周的养殖期内其特定生长率与肝组织IGF mRNA的表达量呈极显著的正相关[24]。但强俊等[25]在分析温度和饲料蛋白水平对吉富品系尼罗罗非鱼幼鱼生长的影响时则发现血清GH水平与鱼的特定生长率相关性较低。黄国强等[26]研究也发现褐牙鲆(Paralichthys olivaceus)幼鱼在低温胁迫10 d导致的生长减缓能在恢复至最适生长温度的30 d内获得完全补偿生长,但血浆GH和IGF水平与生长率不存在明显的相关性。
该研究通过分析不同养殖密度下革胡子鲶幼鱼的生长以及垂体GH基因的表达,探讨养殖密度对二者的影响以及二者的相关性。该研究的数据统计分析结果显示,0~30 d养殖期内,35 kg · m-3和65 kg · m-3密度组间的日增质量以及95 kg · m-3和125 kg · m-3密度组间的日增质量差异均不显著,但前2个密度组的日增质量显著高于后2个密度组(图 1)。但养殖第30天时各密度组间GH基因mRNA的相对表达量并未受养殖密度的影响,即各密度组间的GH基因的相对表达量差异不显著(图 4)。30~60 d养殖期内,35 kg · m-3和65 kg · m-3密度组间的日增质量与95 kg · m-3密度组差异不显著,但显著高于125 kg · m-3密度组(图 1)。而养殖第60天时,GH mRNA表达量的分析结果显示35 kg · m-3和65 kg · m-3密度组显著高于95 kg · m-3和125 kg · m-3密度组(图 4)。上述结果表明在该研究中革胡子鲶幼鱼的日增质量与垂体GH基因mRNA相对表达量不存在紧密的相关性。结合前人的研究结果,在该研究中笔者推测,仅就生长轴GH-GHR-IGF而言,革胡子鲶在较短的养殖时间内(30 d),养殖密度增大时,由于空间不足、摄食不均等原因可能影响鱼体生存状态和营养水平,而导致GH下游的生长调控因子,如GHR和IGF的合成与分泌减少,最终使鱼体的日增质量降低。但是随着养殖时间的延长(60 d),养殖密度增大到一定程度时则会影响处于生长轴中心位置的因子——GH mRNA表达的下降,进而GH的合成与分泌减少,这可能成为影响鱼体生长速度的主要内在因素。对于GH-GHR-IGF这一生长轴在革胡子鲶生长中的调节作用以及三者的相互补偿关系仍需进一步深入探究。
-
表 1 各采样点检测物种序列数
Table 1 Number of reads detected for each species at each sampling station
种类 Species 调查站位 Sampling station 德庆 DQ 封开 FK 桂平 GP 九江 JJ 藤县 TX 肇庆 ZQ 1 鲤形目 Cypriniformes 43 207 266 105 81 198 1.1鲤科 Cyprinidae 43 207 216 103 57 198 1.1.1草鱼 Ctenopharyngodon idella 20 0 5 34 2 5 1.1.2鲢 Hypophthalmichthys molitrix 9 135 57 31 31 43 1.1.3鳙 Aristichthys nobilis 0 0 0 0 0 2 1.1.4赤眼鳟 Squaliobarbus curriculus 0 15 2 14 13 1 1.1.5鲤 Cyprinus carpio 6 21 38 3 1 20 1.1.6鲫 Carassius auratus 0 0 0 5 0 2 1.1.7宽鳍鱲 Zacco platypus 0 0 0 13 0 0 1.1.8红鳍原鲌 Cultrichthys erythropterus 0 0 1 0 0 0 1.1.9银飘鱼 Pseudolaubuca sinensis 0 2 0 0 0 0 1.1.10南方拟䱗 Pseudohemiculter dispar 0 0 2 0 0 0 1.1.11黄尾鲴 Xenocypris davidi 0 0 0 0 0 18 1.1.12银鲴 Xenocypris argentea 0 0 0 0 0 35 1.1.13南方波鱼 Rasbora steineri 8 34 98 1 10 1 1.1.14马口鱼 Opsariichthys bidens 0 0 13 0 0 0 1.1.15南方白甲鱼 Onychostoma gerlachi 0 0 0 0 0 16 1.1.16银鮈 Squalidus argentatus 0 0 0 0 0 55 1.1.17麦瑞加拉鲮▲ Cirrhinus mrigala 0 0 0 2 0 0 1.2花鳅科 Cobitidae 0 0 50 2 24 0 1.2.1大鳞副泥鳅 Paramisgurnus dabryanus 0 0 50 2 6 0 1.2.2美丽沙鳅 Botia pulchra 0 0 0 0 18 0 2脂鲤目 Characiformes 0 0 0 11 0 8 2.1鲮脂鲤科 Prochilodontidae 0 0 0 11 0 8 2.1.1条纹鲮脂鲤▲ Prochilodus lineatus 0 0 0 11 0 8 3鲈形目 Perciformes 20 117 99 148 197 615 3.1攀鲈科 Anabantidae 2 0 0 0 0 9 3.1.1攀鲈 Anabas testudineus 2 0 0 0 0 9 3.2鳢科 Channidae 0 21 0 0 0 0 3.2.1斑鳢 Channa maculata 0 21 0 0 0 0 3.3狼鲈科 Moronidae 0 24 0 0 0 0 3.3.1花鲈 Lateolabrax japonicus 0 24 0 0 0 0 3.4塘鳢科 Eleotridae 0 0 0 3 0 0 3.4.1尖头塘鳢 Eleotris oxycephala 0 0 0 3 0 0 3.5鰕虎科 Gobiidae 7 50 1 104 177 386 3.5.1子陵吻鰕虎鱼 Rhinogobius giurinus 7 50 1 104 177 386 3.6丽鱼科 Cichlidae 11 22 98 41 20 220 3.6.1齐氏罗非鱼▲ Oceochromis zillii 0 0 0 0 0 190 3.6.2尼罗罗非鱼▲ Oceochromis nilotica 11 22 98 41 20 30 4鲇形目 Siluriformes 54 209 88 59 24 64 4.1鲿科 Bagridae 54 209 88 59 24 64 4.1.1黄颡鱼 Pelteobagrus fulvidraco 0 0 14 0 0 0 4.1.2粗唇鮠 Leiocassis crassilabris 0 0 0 0 1 25 4.1.3瓦氏黄颡鱼 Pelteobagrus vachellii 54 209 74 59 23 39 注:▲. 外来物种。 Note: ▲. Alien species. 表 2 各样本Alpha多样性指数
Table 2 Alpha diversity index of each sample
样本
SampleChao1指数
Chao1香农指数
Shannon辛普森指数
Simpson覆盖度
Coverage德庆 DQ 8.00 2.38 0.73 1.000 0 封开 FK 10.00 2.54 0.76 1.000 0 桂平 GP 13.33 2.89 0.84 0.995 6 九江 JJ 14.00 2.90 0.82 0.996 9 藤县 TX 11.50 2.15 0.63 0.993 4 肇庆 ZQ 18.33 2.73 0.75 0.997 7 -
[1] CHEN Y S, QU X, XIONG F Y, et al. Challenges to saving China's freshwater biodiversity: fishery exploitation and landscape pressures[J]. Ambio, 2020, 49(4): 926-938. doi: 10.1007/s13280-019-01246-2
[2] HE Y F, WANG J W, LEK S, et al. Structure of endemic fish assemblages in the upper Yangtze River Basin[J]. River Res Appl, 2011, 27(1): 59-75. doi: 10.1002/rra.1339
[3] REID A J, CARLSON A K, CREED I F, et al. Emerging threats and persistent conservation challenges for freshwater biodiversity[J]. Biol Rev, 2019, 94(3): 849-873. doi: 10.1111/brv.12480
[4] COULTHARD S, JOHNSON D, MCGREGOR J A. Poverty, sustainability and human wellbeing: a social wellbeing approach to the global fisheries crisis[J]. Global Environ Chang, 2011, 21(2): 453-463. doi: 10.1016/j.gloenvcha.2011.01.003
[5] DUDGEON D. Multiple threats imperil freshwater biodiversity in the Anthropocene[J]. Curr Biol, 2019, 29(19): 960-967. doi: 10.1016/j.cub.2019.08.002
[6] BONAR S A, MERCADO-SILVA N, HUBERT W A, et al. Standard methods for sampling freshwater fishes: opportunities for international collaboration[J]. Fisheries, 2017, 42(3): 150-156. doi: 10.1080/03632415.2017.1276352
[7] YAO M, ZHANG S, LU Q, et al. Fishing for fish environmental DNA: ecological applications, methodological considerations, surveying designs, and ways forward[J]. Mol Ecol, 2022, 31(20): 5132-5164. doi: 10.1111/mec.16659
[8] 秦传新, 左涛, 于刚, 等. 环境DNA在水生生态系统生物量评估中的研究进展[J]. 南方水产科学, 2020, 16(5): 123-128. doi: 10.12131/20190256 [9] 舒璐, 林佳艳, 徐源, 等. 基于环境DNA宏条形码的洱海鱼类多样性研究[J]. 水生生物学报, 2020, 44(5): 1080-1086. [10] DEINER K, BIK H M, MACHLER E, et al. Environmental DNA metabarcoding: transforming how we survey animal and plant communities[J]. Mol Ecol, 2017, 26(21): 5872-5895. doi: 10.1111/mec.14350
[11] ALICE V, PIERRE T, CLAUDE M, et al. Next-generation monitoring of aquatic biodiversity using environmental DNA metabarcoding[J]. Mol Ecol, 2015, 25(4): 929-942.
[12] QUENTIN M, LYNSEY R H, MICHAEL S, et al. The multiple states of environmental DNA and what is known about their persistence in aquatic environments[J]. Environ Sci Technol, 2022, 56(9): 5322-5333. doi: 10.1021/acs.est.1c07638
[13] PAWLOWSKI J, KELLY-QUINN M, ALTERMATT F, et al. The future of biotic indices in the ecogenomic era: integrating (e)DNA metabarcoding in biological assessment of aquatic ecosystems[J]. Sci Total Environ, 2018, 637/638(1): 1295-1310.
[14] TABERLET P, COISSAC E, HAJIBABAEI M, et al. Environmental DNA[J]. Mol Ecol, 2012, 21(8): 1789-1793. doi: 10.1111/j.1365-294X.2012.05542.x
[15] SHU L, LUDWIG A, PENG Z G. Standards for methods utilizing environmental DNA for detection of fish species[J]. Genes-Basel, 2020, 11(3): 296. doi: 10.3390/genes11030296
[16] BOHMANN K, EVANS A, GILBERT M T P, et al. Environmental DNA for wildlife biology and biodiversity monitoring[J]. Trends Ecol Evol, 2014, 29(6): 358-367. doi: 10.1016/j.tree.2014.04.003
[17] TAKAHARA T, MINAMOTO T, YAMANAKA H, et al. Estimation of fish biomass using environmental DNA[J]. PLoS One, 2012, 7(4): e35868. doi: 10.1371/journal.pone.0035868
[18] THOMSEN P F, KIELGAST J, IVERSEN L L, et al. Detection of a diverse marine fish fauna using environmental DNA from seawater samples[J]. PLoS One, 2012, 7(8): e41732. doi: 10.1371/journal.pone.0041732
[19] BELLE C C, STOECKLE B C, GEIST J. Taxonomic and geographical representation of freshwater environmental DNA research in aquatic conservation[J]. Aquat Conserv, 2019, 29(11): 1996-2009. doi: 10.1002/aqc.3208
[20] 赵明, 赵梦迪, 马春艳, 等. 环境DNA在水域生态中的研究进展[J]. 中国水产科学, 2018, 25(4): 714-720. [21] TSUJI S, TAKAHARA T, DOI H, et al. The detection of aquatic macroorganisms using environmental DNA analysis: a review of methods for collection, extraction, and detection[J]. Environ DNA, 2019, 1(2): 99-108. doi: 10.1002/edn3.21
[22] 《中国河湖大典》编纂委员会. 中国河湖大典 珠江卷[M]. 北京: 中国水利水电出版社, 2013: 1-10. [23] 张迎秋, 黄稻田, 李新辉, 等. 西江鱼类群落结构和环境影响分析[J]. 南方水产科学, 2020, 16(1): 42-52. [24] XING Y C, ZHANG C G, FAN E Y, et al. Freshwater fishes of China: species richness, endemism, threatened species and conservation[J]. Divers Distrib, 2016, 22(3): 358-370. doi: 10.1111/ddi.12399
[25] 李捷, 李新辉, 贾晓平, 等. 西江鱼类群落多样性及其演变[J]. 中国水产科学, 2010, 17(2): 298-311. [26] 李跃飞, 李新辉, 杨计平, 等. 珠江干流长洲水利枢纽蓄水后珠江鳡鱼 (Elopichthys bambusa) 早期资源现状[J]. 湖泊科学, 2015, 27(5): 917-924. [27] 帅方敏, 李新辉, 刘乾甫, 等. 珠江水系鱼类群落多样性空间分布格局[J]. 生态学报, 2017, 37(9): 3182-3192. [28] 盛强, 茹辉军, 李云峰, 等. 中国国家级水产种质资源保护区分布格局现状与分析[J]. 水产学报, 2019, 43(1): 62-80. [29] 杨君兴, 潘晓赋, 陈小勇, 等. 中国淡水鱼类人工增殖放流现状[J]. 动物学研究, 2013, 34(4): 267-280. [30] OWEN S W, CREU P, MAGDALENA G, et al. DNA metabarcoding of littoral hard-bottom communities: high diversity and database gaps revealed by two molecular markers[J]. PeerJ, 2018, 6: e4705. doi: 10.7717/peerj.4705
[31] CHEN W T, LI C, YANG J P, et al. Temporal species-level composition of larvae resources in the lower Pearl River drainage and implications for species' reproductive cycles[J]. Gene, 2021, 776: 145351. doi: 10.1016/j.gene.2020.145351
[32] 王梦, 杨鑫, 王维, 等. 基于eDNA技术的长江上游珍稀特有鱼类国家级自然保护区重庆段鱼类多样性研究[J]. 水生生物学报, 2022, 46(1): 2-16. [33] 郑慈英. 珠江鱼类志[M]. 北京: 科学出版社, 1989: 77-367. [34] 张春光, 赵亚辉. 中国内陆鱼类物种与分布[M]. 北京: 科学出版社, 2016: 210-213. [35] DIXON P. VEGAN, a package of R functions for community ecology[J]. J Veg Sci, 2003, 14(6): 927-930. doi: 10.1111/j.1654-1103.2003.tb02228.x
[36] 李捷, 李新辉, 谭细畅, 等. 广东肇庆西江珍稀鱼类省级自然保护区鱼类多样性[J]. 湖泊科学, 2009, 21(4): 556-562. doi: 10.3321/j.issn:1003-5427.2009.04.015 [37] 李跃飞, 李新辉, 谭细畅, 等. 西江肇庆江段渔业资源现状及其变化[J]. 水利渔业, 2008, 28(2): 80-83. [38] HEBERT P D, CYWINSKA A, BALL S L, et al. Biological identifications through DNA barcodes[J]. Proc R Soc B, 2003, 270(1512): 313-321. doi: 10.1098/rspb.2002.2218
[39] 蒋佩文, 李敏, 张帅, 等. 基于线粒体COI和12S rDNA基因构建珠江河口鱼类DNA宏条形码数据库[J]. 南方水产科学, 2022, 18(3): 13-21. [40] 郜星晨, 姜伟. 三峡库区常见鱼类DNA条形码本地BLAST数据库的构建和应用[J]. 基因组学与应用生物学, 2021, 40(5/6): 1952-1960. [41] 乐佩琦. 中国动物志. 硬骨鱼纲 鲤形目 中卷[M]. 北京: 科学出版社, 2000: 1-16. [42] 刘亚秋, 李新辉, 李跃飞, 等. 西江广东鲂 (Megalobrama terminalis) 繁殖生物学及繁殖策略[J]. 湖泊科学, 2021, 33(1): 232-241. [43] GOUTTE A, MOLBERT N, GUÉRIN S, et al. Monitoring freshwater fish communities in large rivers using environmental DNA metabarcoding and a long-term electrofishing survey[J]. J Fish Biol, 2020, 97(2): 444-452. doi: 10.1111/jfb.14383
[44] LAMY T, PITZ K J, CHAVEZ F P, et al. Environmental DNA reveals the fine-grained and hierarchical spatial structure of kelp forest fish communities[J]. Sci Rep-UK, 2021, 11(1): 14439. doi: 10.1038/s41598-021-93859-5
[45] CIVADE R, DEJEAN T, VALENTINI A, et al. Spatial representativeness of environmental DNA metabarcoding signal for fish biodiversity assessment in a natural freshwater system[J]. PLoS One, 2016, 11(6): e0157366.
[46] RUPERT A C, JUDITH B, OWEN S W, et al. Non-specific amplification compromises environmental DNA metabarcoding with COI[J]. Methods Ecol Evol, 2019, 10(11): 1985-2001. doi: 10.1111/2041-210X.13276
[47] 刘军, 赵良杰, 凡迎春, 等. 鱼类环境DNA研究中通用引物的筛选验证[J]. 淡水渔业, 2016, 46(1): 9-17. [48] MACKENZIE D I, NICHOLS J D, LACHMAN G B, et al. Estimating site occupancy rates when detection probabilities are less than one[J]. Ecology, 2002, 83(8): 2248-2255. doi: 10.1890/0012-9658(2002)083[2248:ESORWD]2.0.CO;2
[49] GU W D, SWIHART R K. Absent or undetected? Effects of non-detection of species occurrence on wildlife–habitat models[J]. Biol Conserv, 2004, 116(2): 195-203. doi: 10.1016/S0006-3207(03)00190-3
[50] GOTELLI N J, COLWELL R K. Estimating species richness[M]//MAGURRAN A E, McGILL B J. Frontiers in measuring biodiversity. New York: Oxford University Press, 2011: 39-54.
[51] CRISTESCU M E, HEBERT P D N. Uses and misuses of environmental DNA in biodiversity science and conservation[J]. Annu Rev Ecol Evol S, 2018, 49(1): 209-230. doi: 10.1146/annurev-ecolsys-110617-062306
[52] ZOU K S, CHEN J W, RUAN H T, et al. eDNA metabarcoding as a promising conservation tool for monitoring fish diversity in a coastal wetland of the Pearl River Estuary compared to bottom trawling[J]. Sci Total Environ, 2020, 702: 134704. doi: 10.1016/j.scitotenv.2019.134704
[53] ZHANG S N, ZHAO J D, YAO M. A comprehensive and comparative evaluation of primers for metabarcoding eDNA from fish[J]. Methods Ecol Evol, 2020, 11(12): 1609-1625. doi: 10.1111/2041-210X.13485
[54] SHIN-ICHIRO O, HIDEYUKI D, KEI M, et al. Environmental DNA metabarcoding for biodiversity monitoring of a highly diverse tropical fish community in a coral reef lagoon: estimation of species richness and detection of habitat segregation[J]. Environ DNA, 2021, 3(1): 55-69. doi: 10.1002/edn3.132
[55] 熊美华, 杨志, 胡兴坤, 等. 长江中游监利江段鱼类群落结构研究[J]. 长江流域资源与环境, 2019, 28(9): 2109-2118. [56] 武智, 李跃飞, 朱书礼, 等. 基于渔业声学调查的珠江东塔产卵场鱼类栖息地适宜性研究[J]. 南方水产科学, 2023, 19(3): 11-18. [57] 蒋佩文, 李敏, 张帅, 等. 基于环境DNA宏条码和底拖网的珠江河口鱼类多样性[J]. 水生生物学报, 2022, 46(11): 1701-1711. [58] 谭细畅, 李新辉, 李跃飞, 等. 尼罗罗非鱼早期发育形态及其在珠江水系的空间分布[J]. 生物安全学报, 2012, 21(4): 295-299. [59] 顾党恩, 牟希东, 罗渡, 等. 广东省主要水系罗非鱼的建群状况[J]. 生物安全学报, 2012, 21(4): 277-282. [60] TONY D, ALICE V, ANTOINE D, et al. Persistence of environmental DNA in freshwater ecosystems[J]. PLoS One, 2012, 6(8): e23398.
[61] FICETOLA G F, MIAUD C, POMPANON F, et al. Species detection using environmental DNA from water samples[J]. Biol Lett, 2008, 4(4): 423-425. doi: 10.1098/rsbl.2008.0118
[62] HOWALD G, DONLAN C J, GALVAN J P, et al. Invasive rodent eradication on islands[J]. Conserv Biol, 2007, 21(5): 1258-1268. doi: 10.1111/j.1523-1739.2007.00755.x
[63] BOOTHROYD M, MANDRAK N E, FOX M, et al. Environmental DNA (eDNA) detection and habitat occupancy of threatened spotted gar (Lepisosteus oculatus)[J]. Aquat Conserv, 2016, 26(6): 1107-1119. doi: 10.1002/aqc.2617
[64] JANOSIK A M, JOHNSTON C E. Environmental DNA as an effective tool for detection of imperiled fishes[J]. Environ Biol Fish, 2015, 98(8): 1889-1893. doi: 10.1007/s10641-015-0405-5
[65] 甘西, 蓝家湖, 吴铁军, 等. 中国南方淡水鱼类原色图鉴[M]. 郑州: 河南科学技术出版社, 2017: 75. [66] VALDIVIA-CARRILLO T, ROCHA-OLIVARES A, REYES-BONILLA H, et al. Integrating eDNA metabarcoding and simultaneous underwater visual surveys to describe complex fish communities in a marine biodiversity hotspot[J]. Mol Ecol Resour, 2021, 21(5): 1558-1574. doi: 10.1111/1755-0998.13375
[67] CILLEROS K, VALENTINI A, ALLARD L, et al. Unlocking biodiversity and conservation studies in high-diversity environments using environmental DNA (eDNA): a test with Guianese freshwater fishes[J]. Mol Ecol Resour, 2019, 19(1): 27-46. doi: 10.1111/1755-0998.12900
-
期刊类型引用(15)
1. 周志希,唐汇娟,柯志新,刘甲星,周伟华. 基于形态学和高通量测序的春季南澳海域浮游植物群落特征及其与环境因子关系. 热带海洋学报. 2025(01): 53-65 .  百度学术
百度学术
2. 柳原,柯志新,李开枝,谭烨辉,梁竣策,周伟华. 人类活动和沿岸流影响下的粤东近海浮游动物群落特征. 热带海洋学报. 2024(04): 98-111 .  百度学术
百度学术
3. 薛宇,于浩林,周广军,赵伟,唐衍力. 渤海小竹山岛海洋牧场区营养盐分布特征及增养殖适宜性探究. 渔业科学进展. 2023(01): 1-12 .  百度学术
百度学术
4. 黎素菊,洪捷娴,陈树鹏. 柘林湾养殖区氮、磷季节分布特征及富营养化评价. 江西水产科技. 2022(04): 45-47+51 .  百度学术
百度学术
5. 匡翠萍,王丹,赵钒,刘会欣,朱磊. 金梦海湾及其邻近海域水环境因子时空分布特征. 同济大学学报(自然科学版). 2021(06): 880-890 .  百度学术
百度学术
6. 任玉正,柯志新,谭烨辉,李开枝. 广东省南澳岛东部海域浮游动物群落结构及其影响因素. 热带海洋学报. 2020(02): 65-76 .  百度学术
百度学术
7. 杨文超,黄道建,陈继鑫,陈晓燕,王宇珊. 大亚湾海域2009—2015年氮、磷营养盐时空分布及富营养化评价. 南方水产科学. 2020(02): 54-61 .  本站查看
本站查看
8. 陈丹婷,柯志新,谭烨辉,刘甲星. 汕头南澳—东山海域营养盐季节分布特征及其对浮游植物生长的潜在性限制. 生态科学. 2020(04): 41-50 .  百度学术
百度学术
9. 马欢,秦传新,陈丕茂,林会洁,段丁毓. 柘林湾海洋牧场生态系统服务价值评估. 南方水产科学. 2019(01): 10-19 .  本站查看
本站查看
10. 王言丰,胡启伟,余景,陈丕茂,舒黎明. 粤东柘林湾海洋牧场渔业资源增殖效果评估. 南方水产科学. 2019(02): 12-19 .  本站查看
本站查看
11. 徐淑敏,齐占会,史荣君,刘永,韩婷婷,黄洪辉. 水产养殖对亚热带海湾氮磷营养盐时空分布的影响——以深澳湾为例. 南方水产科学. 2019(04): 29-38 .  本站查看
本站查看
12. 王文杰,陈丕茂,袁华荣,冯雪,张露,龙鑫玲,陈文静,李丹丹. 粤东柘林湾甲壳类群落结构季节变化分析. 南方水产科学. 2018(03): 29-39 .  本站查看
本站查看
13. 佟飞,秦传新,余景,陈丕茂. 粤东柘林湾溜牛人工鱼礁建设选址生态基础评价. 南方水产科学. 2016(06): 25-32 .  本站查看
本站查看
14. 舒黎明,陈丕茂,秦传新,黎小国,周艳波,冯雪,于杰,袁华荣,李国迎. 柘林湾-南澳岛潮间带冬夏两季大型底栖动物种类组成及优势种. 生态学杂志. 2016(02): 423-430 .  百度学术
百度学术
15. 舒黎明,陈丕茂,黎小国,秦传新,于杰,周艳波,袁华荣. 柘林湾附近海域大型底栖动物物种多样性. 中国水产科学. 2015(03): 501-516 .  百度学术
百度学术
其他类型引用(5)
-
其他相关附件
-
PDF格式
20230111附录A 点击下载(649KB)
-



 下载:
下载:





 粤公网安备 44010502001741号
粤公网安备 44010502001741号
