Study on artificial propagation and early development of Acrossocheilus longipinnis
-
摘要:
长鳍光唇鱼 (Acrossocheilus longipinnis) 是红水河珍稀特有鱼类,也是当地的重要经济物种。为实现长鳍光唇鱼苗种规模化生产,并为其增殖放流提供技术指导,对人工驯养的长鳍光唇鱼亲鱼进行强化培育和催产,采用干法授精获得受精卵,并观察其胚胎及仔鱼的发育过程。连续进行了4次人工催产,催产率为 (68.95±13.26)%、受精率为 (68.50±19.82)%、孵化率为 (80.00±10.23)%。长鳍光唇鱼受精卵为沉性卵,具弱黏性,呈金黄色,卵径为 (2.42±0.06) mm,吸水膨胀后为 (3.03±0.08) mm。胚胎发育过程历经胚盘形成期、卵裂期、囊胚期、原肠期、神经胚期、器官形成期和孵化期7个阶段、28个发育时期。水温22~24 ℃时,经66~74 h孵化出膜,积温为1 501.13 ℃·h。初孵仔鱼平均全长为 (8.33±0.23) mm,肌节34对,4日龄仔鱼形成5条横斑雏形。卵黄囊期历时8 d,全长特定生长率为4.13%·d−1;仔鱼期共历时21 d,全长特定生长率为2.70%·d−1。研究结果对保护红水河鱼类资源及其多样性具有重要意义。
Abstract:Acrossocheilus longipinnis is a rare fish and an economically important species in the Hongshui River. To achieve large-scale production of A. longipinis fry and provide technical guidance for its proliferation and release, artificially domesticated A. longipinnis were intensively cultivated and induced to produce fertilized eggs by dry fertilization. The embryonic and larval development was observed. Four times of artificial inductions were performed. The oxytocin rate was (68.95±13.26)%, the fertilization rate was (68.50±19.82)%, and the hatching rate was (80.00±10.23)%. The fertilized eggs of the A. longipinnis were sedimentary, weakly viscous and golden in color. The egg diameter of the yolk was (2.42±0.06) mm, and the expansion of water absorption was (3.03±0.08) mm. The embryonic development process went through a total of 7 stages and 28 periods including blastogenesis stage, cleavage stage, blastocyst stage, gastrum stage, neuroembryo stage, organogenesis stage and hatching stage. The membrane was hatched after 66−74 h at the water temperature of 22−24 ℃, with an accumulated temperature of 1 501.13 ℃·h. The total length of the newly hatched larvae was (8.33±0.23) mm, with 34 pairs of sarcotomes. At 4 days after hatching, the larvae formed 5 transversely spotted embryonic prototypes. The yolk sac stage lasted for 8 d, with a total length special growth rate of 4.13%·d−1. The larvae stage lasted for 21 d, with a special growth rate of total length of 2.70%·d−1. The results are important for protecting A. longipinnis resources and diversity of the Hongshui River.
-
黄颡鱼 (Pelteobagrus fulvidraco) 是黄颡鱼属最常见的物种,俗称戈丫、黄骨鱼、黄辣丁等,广泛分布于长江、黄河、珠江及黑龙江等水系[1]。黄颡鱼无肌间刺、营养丰富、肉质鲜美,深受消费者青睐,是我国主要的经济鱼类之一。近年来,黄颡鱼养殖热潮兴起,安徽省的黄颡鱼养殖业也发展强劲。根据2019年中国渔业统计年鉴的数据,2018年我国黄颡鱼养殖产量为50.96万t,其中安徽省为3.41万t,居全国第五[2]。安徽省内的长江和淮河流域既是黄颡鱼养殖的主产区之一,又具有丰富的黄颡鱼野生资源。然而,由于野生黄颡鱼栖息生境遭到破坏、各地黄颡鱼的无序引进、养殖黄颡鱼的逃逸及杂交黄颡鱼 (黄颡鱼♀×瓦氏黄颡鱼P. vachelli♂) 品种的推广等原因,野生黄颡鱼种质纯度面临威胁。目前对野生黄颡鱼种质资源的遗传现状不清,在缺乏科学规划和盲目利用的情况下,难以获得优异的养殖性状。因此,开展野生群体的遗传多样性和遗传结构研究,是保护黄颡鱼种质资源和进一步开发利用的必要基础工作。
微卫星标记由于具有高多态性、稳定性、共显性及方便检测等特点,被广泛应用于水产领域。作为一种高效率的中性分子标记,微卫星分子标记技术是鱼类群体遗传学研究的常见选择,如黄唇鱼 (Bahaba flavolabiata)[3]、军曹鱼 (Rachycentron canadum)[4]等海水鱼类,和四大家鱼[5-8]、鲤 (Cyprinus carpio)[9]、大口黑鲈 (Micropterus salmoides)[10]等淡水鱼类。有关野生黄颡鱼的群体遗传多样性和遗传结构已有诸多研究,如库喜英[11]、张鹤千等[12]、钟立强等[13]、Zhong等[14]基于线粒体DNA序列变异研究了中国不同水系黄颡鱼群体的遗传多样性和遗传结构,发现各地黄颡鱼的群体遗传多样性水平和遗传分化程度差别较大。基于微卫星标记的相关研究也有类似结果,如Zhong等[15]认为来自长江中下游5个湖泊的黄颡鱼群体遗传多样性中等而遗传分化程度较低;李大宇等[16]发现来自长江上游、东北、天津的6个黄颡鱼群体的多样性水平总体呈适中偏高水平,各自然群体聚类结果与地理分布有一定相关性;刘红艳等[17]对长江中下游湖泊和云南抚仙湖黄颡鱼群体进行了遗传分析,结果显示其遗传多样性水平较高,群体间存在明显遗传分化,6个黄颡鱼群体可分为两组,鄱阳湖、巢湖和洪泽湖为一组,滆湖、太湖和抚仙湖群体为另一组;Guo等[18]指出长江7个群体和白洋淀黄颡鱼的群体遗传多样性高,但群体间无显著遗传分化。然而,目前有关安徽两水系黄颡鱼群体遗传的研究不多,对当前黄颡鱼种质资源状况的研究不充分,且近年来黄颡鱼繁育及养殖产业的蓬勃发展是否对其自然种质有所影响也不得而知。因此,本研究以安徽省内长江、淮河水系9个黄颡鱼群体为研究对象,采用微卫星标记分析其遗传多样性,有助于深入了解其种质资源现状和变化,并为黄颡鱼的资源保护和开发利用提供基础资料。
1. 材料与方法
1.1 样品采集
黄颡鱼样品采集于2018—2019年,采集信息见表1和图1。取样品鱼背部肌肉于95%乙醇中保存备用。
表 1 黄颡鱼样本采集信息Table 1 P. fulvidraco samples information采样点编号
Sampling site No.群体
Population样本数
Sample size采集地
Samplinig site所属水系
River system1 望江 WJ 29 望江县 长江干流 2 无为 WW 20 无为县 长江干流 3 龙窝湖 LW 28 龙窝湖 长江干流湖泊 4 石台 ST 30 石台县 长江支流秋浦河 5 泾县 JX 30 泾县 长江支流青弋江 6 麻川河 MC 30 黄山区三口镇 长江支流青弋江河源麻川河 7 凤台 FT 30 凤台县 淮河干流 8 瓦埠湖 WB 30 瓦埠湖 淮河干流湖泊 9 阜南 FN 27 阜南县 淮河干流 1.2 DNA提取和PCR扩增
根据文献[15, 19],通过聚丙烯酰胺凝胶电泳筛选扩增片段条带清晰、大小适度且多样性较高的10对微卫星引物 (表2)。委托生工生物工程 (上海) 股份有限公司合成引物并利用荧光修饰标记 (HEX和6-FAM) 修饰。使用动物基因组提取试剂盒 (Universal Genomic DNA Extraction Kit,天根生化科技有限公司生产) 提取黄颡鱼基因组DNA,用1%的琼脂糖凝胶电泳检测DNA质量,−20 ℃保存备用。
表 2 黄颡鱼10对微卫星引物信息Table 2 Information of ten pairs of microsatellite primers of P. fulvidraco位点
Locus引物序列
Primer sequence核心序列
Core sequence退火温度
Annealing temperature/℃产物长度
Size range/bpCT30 F: ACACCAAAACATTGTGCTAC
R: ATTCAGGAGATCCCGACACT(CT)9T(TC)2 55 235~293 CT42 F: GCAGAGGGTTGCTTTTGCCTTTTA
R: CAACAATCACATTCTATGAGGAGT(TC)6 65 129~151 CT81 F: GTCTCCATCACTGCCACAT
R: TCAGCAATTATGTGAAAAGTGTCT(CT)6G(TC)4 58 128~170 CT209 F: ACACTCACTCACCGCACGTCGC
R: GTGTGAAGACTGAACGATGAT(TC)13 62 369~419 HLJ13 F: GACCCAGTTCCCACATTG
R: GGCTACCACATCCCTCAT(CA)23 58 163~223 HLJ17 F: ATGGTATAAACATGGTGCTA
R: ATGATGCTGATAGGGTGA(TG)25 58 174~234 HLJ45 F: TGGGTCTCTCTGGGTTCA
R: GCGGCTTCACTCACTTCC(TG)29 56 169~271 HLJ60 F: GATCAACGTCCAACAGAG
R: GGAAAGAAAGATGGCTAG(CA)28(TTTG)7 56 228~286 HLJ66 F: ACACTGACATACACTGGCATAA
R: CTGGCAACGTGTTTCTGGCATAA(TG)27 56 250~316 AG48 F: GCTGATACATTCTTTATTAGGGCACC
R: GTCGCACTTCCCCTCTGTCA(AG)13 65 185~263 PCR扩增体系 (20 μL) 包括模板DNA 20~50 ng,Mg2+浓度3 mmol·L−1,1×buffer 2 μL、dNTP 400 mmol·L−1,Taq酶1 U,上下游引物各0.2 mmol·L−1。PCR反应程序和参数为:94 ℃预变性5 min;94 ℃变性30 s,55~65 ℃ (表2) 退火30 s,72 ℃延伸40 s,35个循环;72 ℃延伸10 min。PCR产物4 ℃避光保存后,委托生工生物工程 (上海) 股份有限公司使用ABI 3730XL测序仪进行毛细管电泳检测。采用Genemarker 2.0软件[20]结合人工分析检测数据进行STR基因分型。
1.3 数据分析
基于STR分型结果,使用CONVERT 1.31软件[21]转换为各软件所需格式。采用PopGene 32软件[22]计算各微卫星位点和各群体的等位基因数 (Na)、有效等位基因数 (Ne)、观测杂合度 (Ho)、期望杂合度 (He)、群体间Nei's遗传距离 (Da) 和等位基因频率。利用GENEPOP软件[23]检验微卫星位点是否符合Hardy-Weinberg平衡。群体的多态信息含量 (PIC) 由PIC_Calc 0.6软件 (中国水产科学研究院黄海水产研究所开发) 计算。基于群体间遗传距离使用MEGA 4.0软件[24]构建UPGMA 聚类树。利用Arlequin 3.5软件[25]开展群体间遗传分化指数 (FST) 的检测和分子方差分析 (AMOVA)。由公式Nm= (1/FST−1)/4计算群体间基因流 (Nm)[26]。利用Structure 2.3.4软件[27]分析黄颡鱼群体间遗传结构并进行聚类分析。使用Bottlenecks 1.2软件[28]进行瓶颈效应分析,基于TPM突变模型 (Two phase mutation model) 的Wilcoxon test分析群体突变-漂移平衡来估计群体是否有杂合子过剩或缺失。
2. 结果
2.1 微卫星位点多态性
采用的10个微卫星位点在9个黄颡鱼群体中的信息和遗传多样性结果见表3。共检测到等位基因245个,所有位点的Na、Ne、Ho和He的平均值分别为24.5、9.75、0.601和0.795。所有位点的PIC介于0.287~0.936,平均0.785。位点均符合Hardy-Weinberg平衡。
表 3 黄颡鱼10个微卫星位点的信息和遗传多样性Table 3 Information and genetic diversity information of ten microsatellites in P. fulvidraco位点
Locus等位基因数
Na有效等位基因数
Ne观测杂合度
Ho期望杂合度
He多态信息含量
PICCT30 27 13.17 0.591 0.926 0.919 CT42 7 1.46 0.299 0.317 0.287 CT81 13 1.52 0.319 0.344 0.335 CT209 23 10.38 0.756 0.906 0.896 HLJ13 29 13.70 0.799 0.929 0.923 HLJ17 27 14.79 0.677 0.934 0.928 HLJ45 42 16.41 0.835 0.941 0.936 HLJ60 22 10.78 0.429 0.909 0.900 HLJ66 30 7.95 0.598 0.876 0.865 AG48 25 7.37 0.705 0.866 0.854 均值 Mean 24.5 9.75 0.601 0.795 0.785 2.2 群体遗传多样性
麻川河群体的平均Na (5.20)、Ne (2.64)、Ho (0.496) 和He (0.557) 均最低,而龙窝湖与凤台群体Na相同且最高 (14.80),龙窝湖群体的Ho最高 (0.671),泾县群体的Ne和He均最高 (8.93和0.818)。各群体的平均PIC (0.500~0.790) 相近且均大于0.5 (表4)。表明黄颡鱼群体总体遗传多样性较高,各采样群体中麻川河群体遗传多样性最低。
表 4 黄颡鱼9个群体的遗传多样性Table 4 Genetic diversity of nine populations of P. fulvidraco群体
Population等位基因数
Na有效等位基因数
Ne观测杂合度
Ho期望杂合度
He多态信息含量
PIC望江 WJ 13.00 7.56 0.635 0.779 0.752 无为 WW 12.70 6.76 0.640 0.781 0.749 龙窝湖 LW 14.80 8.42 0.671 0.792 0.765 石台 ST 9.60 4.09 0.497 0.643 0.608 泾县 JX 14.70 8.93 0.603 0.818 0.790 麻川河 MC 5.20 2.64 0.496 0.557 0.500 凤台 FT 14.80 8.71 0.663 0.782 0.760 瓦埠湖 WB 13.60 8.33 0.613 0.777 0.754 阜南 FN 11.30 4.95 0.607 0.719 0.688 2.3 群体遗传结构
各群体间的Nei's Da为0.079~0.640 (表5),其中凤台和瓦埠湖群体间遗传距离最小,麻川河和石台群体间最大。群体FST和Nm见表6。FST (0.006~0.236) 范围较大,各群体间具有不同程度的遗传分化,其中凤台和瓦埠湖群体间的FST最小 (无分化),石台和麻川河群体间FST最大 (高度分化)。群体间Nm为0.811~40.073,其中凤台和瓦埠湖群体间最大,麻川河群体和石台群体间最小 (0.811)、麻川河和阜南群体间Nm也小于1 (0.937),表明这些群体间几乎无基因交流。另外,麻川河群体和其他所有群体间、石台群体和其他所有群体间、阜南群体和其他所有群体间的Nm均小于4,表明这些群体间基因交流受限。
表 5 黄颡鱼群体间遗传距离 (对角线下)Table 5 Nei's genetic distance (below diagonal) of P. fulvidraco populations群体
Population望江
WJ无为
WW龙窝湖
LW石台
ST泾县
JX麻川河
MC凤台
FT瓦埠
WB阜南
FN望江 WJ 无为 WW 0.114 龙窝湖 LW 0.086 0.111 石台 ST 0.290 0.224 0.239 泾县 JX 0.138 0.158 0.110 0.308 麻川河 MC 0.505 0.508 0.516 0.640 0.375 凤台 FT 0.167 0.223 0.165 0.416 0.142 0.426 瓦埠湖 WB 0.175 0.214 0.159 0.362 0.142 0.381 0.079 阜南 FN 0.343 0.360 0.366 0.569 0.364 0.637 0.319 0.333 表 6 黄颡鱼群体分化指数FST (对角线下) 和群体间基因流Nm (对角线上)Table 6 Pairwise F-statistics (below diagonal) and gene flow (above diagonal) of P. fulvidraco populations群体
Population望江
WJ无为
WW龙窝湖
LW石台
ST泾县
JX麻川河
MC凤台
FT瓦埠
WB阜南
FN望江 WJ 21.489 38.212 2.562 13.411 1.228 8.647 7.947 2.911 无为 WW 0.012 26.346 3.373 12.637 1.202 6.364 6.618 2.852 龙窝湖 LW 0.007* 0.009* 3.101 24.260 1.228 9.403 9.710 2.821 石台 ST 0.089 0.069 0.075 2.522 0.811 1.869 2.093 1.279 泾县 JX 0.018 0.019 0.010* 0.090 1.588 12.771 12.313 2.984 麻川河 MC 0.169 0.172 0.169 0.236 0.136 1.401 1.517 0.937 凤台 FT 0.028 0.038 0.026 0.118 0.019 0.151 40.073 3.147 瓦埠湖 WB 0.031 0.036 0.025 0.107 0.020 0.142 0.006* 2.976 阜南 FN 0.079 0.081 0.081 0.164 0.077 0.211 0.074 0.078 注:*. P>0.05;无*则表示P<0.001 Note: *. P>0.05, while the values without * means P<0.001. AMOVA结果 (表7) 显示,把所有群体划分为一个组时,8.15%的遗传变异来自群体间;当把所有群体按照水系分别划分为长江和淮河2个组时,有0.73%的遗传变异来自不同组间,而有7.74%的遗传变异来自组内群体间,占群体间变异总数的91.52%,说明群体间的变异主要是水系内群体间变异,因水系不同而导致遗传变异较小。综上,黄颡鱼9个自然群体间存在遗传分化。
表 7 黄颡鱼群体遗传结构的分子变异分析Table 7 AMOVA analysis of genetic structure of P. fulvidraco populations分组
Group变异来源
Source of variation自由度
df变异分量
Variance components变异百分比
Percentage of variation/%P 1个组群 One group 群体间 8 0.327 8.15 <0.01 群体内 499 3.683 91.85 <0.01 总计 507 4.010 2个组群 Two groups 组群间 1 0.030 0.73 >0.05 组群内群体间 7 0.312 7.74 <0.01 群体内 499 3.683 91.52 <0.01 总计 507 4.024 基于群体Da构建的UPGMA聚类树 (图2) 结果显示,长江水系的望江、龙窝湖、无为和泾县4个群体,淮河水系的凤台和瓦埠湖2个群体分别先聚在一起,然后两者再聚在一起,最后依次与石台、阜南和麻川河群体聚类。石台、阜南、麻川河群体与其他群体间距离较远。表明石台、阜南、麻川河3个群体遗传组成比较独立,与其他群体间亲缘关系较远。
Structure软件分析结果显示,L(K) 随K快速递增后达到稳定,ΔK随K先递增后下降。K=5时,ΔK最大,但与K为4时的ΔK十分相近 (图3),表明最可能的谱系数为5或者4 (图4)。
各采样群体在每个谱系中的样本分布见表8。K=4时,各采样群体在每个谱系中均有样本分布,所有群体均有一个主要分布谱系,样品占比介于59.42%~95.50%;K=5时,各采样群体在每个谱系中均有样品分布,其中8个群体均有一个主要分布谱系,样本比例高达62.11%~95.00%;而泾县群体中样品比例最高的2个谱系占比分别为41.52%和45.71%,均未达一半,且差异不大。
表 8 黄颡鱼各群体的样本在不同谱系中的分布Table 8 Proportion of different P. fulvidraco populsations population individuals in each genetic lineage群体
Population谱系占比 Genetic lineage proportion/% (K=4) 谱系占比 Genetic lineage proportion/% (K=5) Ⅰ Ⅱ Ⅲ Ⅳ Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ 望江 WJ 4.01 82.04 11.28 2.67 17.86 71.55 2.79 3.69 4.11 无为 WW 4.96 59.42 31.76 3.86 14.35 67.13 4.00 3.41 11.10 龙窝湖 LW 5.62 70.73 22.44 1.20 25.98 62.11 1.31 4.38 6.22 石台 ST 1.00 8.95 88.56 1.49 3.80 11.0 1.80 1.30 83.00 泾县 JX 1.34 77.47 15.40 5.79 41.52 45.71 5.61 1.30 5.87 麻川河 MC 0.80 2.90 0.80 95.50 0.90 2.50 95.00 0.80 0.80 凤台 FT 6.32 87.48 4.50 1.70 79.27 12.01 1.70 4.82 2.20 瓦埠湖 WB 1.90 82.47 10.92 4.72 78.37 11.95 3.78 1.30 4.59 阜南 FN 72.34 23.52 3.24 0.90 8.08 18.63 0.90 69.99 2.40 注:粗体数字表示每个群体中分布最多谱系中的个体占比 Note: The bold numbers represent the proportion of individuals in the most widely distributed lineage in each population. 2.4 瓶颈效应分析
所有群体中,仅石台和阜南群体显著偏离突变-飘移不平衡 (P<0.05),均表现为杂合子缺失 (P分别为0.009和0.005)。这表明石台和阜南2个群体可能经历了瓶颈效应。
3. 讨论
3.1 群体遗传多样性
群体的遗传多样性通常反映了物种应对环境变化的能力和进化潜力,其遗传多样性参数如Ne、Ho及PIC等越大,表明物种的适应能力越好、进化潜力越大。根据相关研究,当杂合度为0.5~0.8时群体遗传多样性较高[29],当PIC>0.5时为高度多态性[30],而一般淡水鱼类的群体遗传多样性平均水平约为He=0.46、Na=7.50[31]。本研究中黄颡鱼遗传多样性参数的平均Ho为0.601、He为0.795、Na为24.5、Ne为9.75、PIC为0.785;各群体的Na为5.20~14.80,Ne为2.64~8.93,Ho为0.497~0.671,He为0.557~0.818,PIC为0.500~0.790。表明本研究中黄颡鱼的遗传多样性在淡水鱼中较高。与其他黄颡鱼群体比较,本研究中黄颡鱼的遗传多样性也较高,高于李大宇等[16]对6个黄颡鱼群体 (吉林月亮湖、四川、黑龙江松花江段、湖北省长湖、天津养殖群体) 的报道 (Ne=1.96, Ho=0.49, He=0.40, PIC=0.34);也略高于长江中下游5个湖泊和云南抚仙湖黄颡鱼群体遗传多样度 (Na为3.5~4.6,Ne为2.240~3.041,Ho为0.343~0.499,He为0.432~0.600,PIC为0.389~0.571)[17];还高于长江中上游赤水、乐山和洞庭3个黄颡鱼自然群体的研究结果 (Na=4.8, PIC=0.466, Ne=2.568, He=0.544)[19]。但是同种标记在不同研究中其多态性研究结果存在较大差异,这与采用的研究样本及检测技术不同有关;即使相同微卫星位点在利用不同检测技术的研究中也会表现出较大差异[32]。已有研究[16-17, 19]中少数群体 (黑龙江松花江段、乐山和洞庭) 的样品量偏少 (<20尾);尤其选用的多数微卫星标记及其检测手段 (聚丙烯酰胺凝胶电泳) 与本研究 (毛细管电泳法) 不同,由于聚丙烯酰胺凝胶电泳的分辨率相比最新的毛细管电泳技术偏低,常造成Na缺失。有鉴于此,早期研究中多数黄颡鱼群体的遗传多样性需要采用最新的毛细管电泳技术重新检测,以确定其真实的遗传多样性水平。
本研究中9个黄颡鱼自然群体间相比较,麻川河、石台和阜南3个群体的遗传多样性明显低于其他6个群体,这可能与这3个采样群体位于河流的上游有关。由于栖息地河窄水浅、季节性缺水且受人为捕捞压力较大,导致水环境稳定性差,群体数量不稳定,受遗传漂变影响较大。其他6个采样群体位于河流的中下游,河宽水深、种群数量多且稳定,受遗传漂变影响较小。瓶颈效应分析结果也基本证实了这种推测。如石台和阜南群体确实显著偏离了突变-飘移不平衡 (P<0.05),表现为杂合子缺失,其他群体未明显偏离突变-飘移不平衡。另外,地理隔离导致的与周边群体的基因交流受限也可能是原因之一。因为石台群体位于长江支流秋浦河上游,与长江干流及沿岸不仅距离远而且海拔落差大;麻川河群体采自于长江支流青弋江的河源溪流之一且青弋江和麻川河之间经过太平湖大坝阻隔,阜南群体虽然位于淮河干流,但采自于淮河大坝——王家坝上游,与坝下凤台等群体不仅距离远而且由于大坝的阻隔难以进行基因交流。其余6个采样群体的遗传多样性参数 (Na 为12.7~14.8,Ne为6.76~8.93,Ho为0.603~0.671,He为0.777~0.818和PIC为0.749~0.790) 不仅高,而且群体间差异小。这表明安徽境内长江、淮河两水系黄颡鱼总体上具有较高的遗传多样性,具有黄颡鱼遗传改良的潜力,但部分群体由于受到自然及人为因素的影响,可能经历了瓶颈效应,需要重视其保护。
3.2 群体遗传结构
群体间FST、Nm和群体Da是衡量群体遗传分化程度的重要指标。当FST为0~0.5、0.5~0.15和0.15~1时群体间分别为无分化、中度分化和高度分化[33]。本研究中黄颡鱼群体间FST为0.006~0.236,各成对群体间处于无分化至高度分化间;而AMOVA的分层分析结果显示群体间的遗传变异占比仅8.15% (P<0.01),且群体间的变异主要是水系内群体间变异,由于水系分化而导致的遗传变异较小。比较成对群体间FST大小可知,石台、阜南、麻川河3个群体与其他群体间的FST均大于0.05,而这3个群体间的FST均大于0.15,其余6个群体间的成对FST均小于0.05,这表明黄颡鱼各群体间有不同程度的遗传分化,主要由于石台、阜南、麻川河3个群体的遗传变异所引起。Nm的结果可与FST结果相互印证,即所有包含石台、阜南、麻川河3个群体的Nm均小于4,否则均大于4,而相关研究认为Nm>4时,遗传漂变的影响可忽略,各群体间处于随机交配状态,基因流动是影响群体遗传分化的主要因素[34−35]。这说明除上述3个群体外,其余6个群体间基因交流频繁,各群体间无明显遗传分化。群体遗传距离中包含石台、阜南、麻川河3个群体的群体间Da为0.224~0.640,其余6个群体间的Da为0.079~0.223。显示了石台、阜南、麻川河3个群体间及它们与另外6个群体的遗传差异较大,与FST和Nm分析结果一致。
UPGMA系统进化树和种群遗传结构分析结果与遗传分化分析结果相吻合,均显示9个群体可能来自5个或者4个谱系 (亚类群),各群体内绝大部分个体 (K=4时,72.34%~95.50%;K=5时,62.11%~95.00%) 均属于某一个谱系。其中石台、麻川河、阜南3个群体的个体遗传结构均比较独立,与其他群体亲缘关系较远;其他6个群体中个体的遗传结构较为复杂,可能存在2个谱系的混杂。考虑到各采样群体的地理位置,黄颡鱼群体遗传结构可能与各自然群体所处水系及地理位置的特点有关。如石台群体来自于长江支流秋浦河,麻川河群体采自于长江支流青弋江的河源溪流之一且青弋江和麻川河之间经过太平湖大坝阻隔,阜南群体虽然位于淮河干流,但采自于淮河大坝—王家坝上游,与坝下凤台等群体不仅距离远而且由于大坝的阻隔难以进行基因交流。而其余6个群体来自长江或淮河干流和沿岸地区,具有相似的地理环境条件,种群数量大而稳定且同水系间基因交流频繁,群体间难以积累大量遗传变异。综上,安徽境内长江、淮河两水系黄颡鱼野生资源遗传多样性较高,地理群体间存在遗传分化且部分群体间经历了瓶颈效应。
-
图 1 长鳍光唇鱼胚胎发育时序
注:a. 受精卵;b. 胚盘期;c. 2细胞期;d. 4细胞期;e. 8细胞期;f. 16细胞期;g. 32细胞期;h. 64细胞期;i. 多细胞期;j. 囊胚早期;k. 囊胚中期;l. 囊胚晚期;m. 原肠早期;n. 原肠中期;o. 原肠晚期;p. 神经胚期;q. 胚孔封闭期;r. 肌节出现期;s. 眼基期;t. 眼囊期;u. 尾芽期;v. 尾泡期;w. 眼晶体形成期;x. 尾鳍出现;y. 肌肉效应期;z. 耳石出现期;aa. 心脏搏动期;ab. 孵化期;ac. 破膜期;ad. 初孵仔鱼。标尺=1 mm。
Figure 1. Embryonic development sequence of A. longipinnis
Note: a. Fertilized egg; b. Blastodem stage; c. 2-cell stage; d. 4-cell stage; e. 8-cell stage; f. 16-cell stage; g. 32-cell stage; h. 64-cell stage; i. Multicellular stage; j. Early-blastula stage; k. Mid-blastula stage; l. Late-blastula stage; m. Early-gastrula stage; n. Mid-gastrula stage; o. Late-gastrula stage; p. Neural stage; q. Closure of blastopore stage; r. Appearance of myomere; s. Optic rudiment stage; t. Eye vesicle formation period; u. Tail bud stage; v. Tail vesicle period; w. Crystal stage of eyes; x. Rudiment of tail fin; y. Muscular contraction period; z. Appearance of statolith; aa. Heart beating period; ab. Hatching stage; ac. Embryo hatching; ad. Newly hatched larvae. Bar=1 mm.
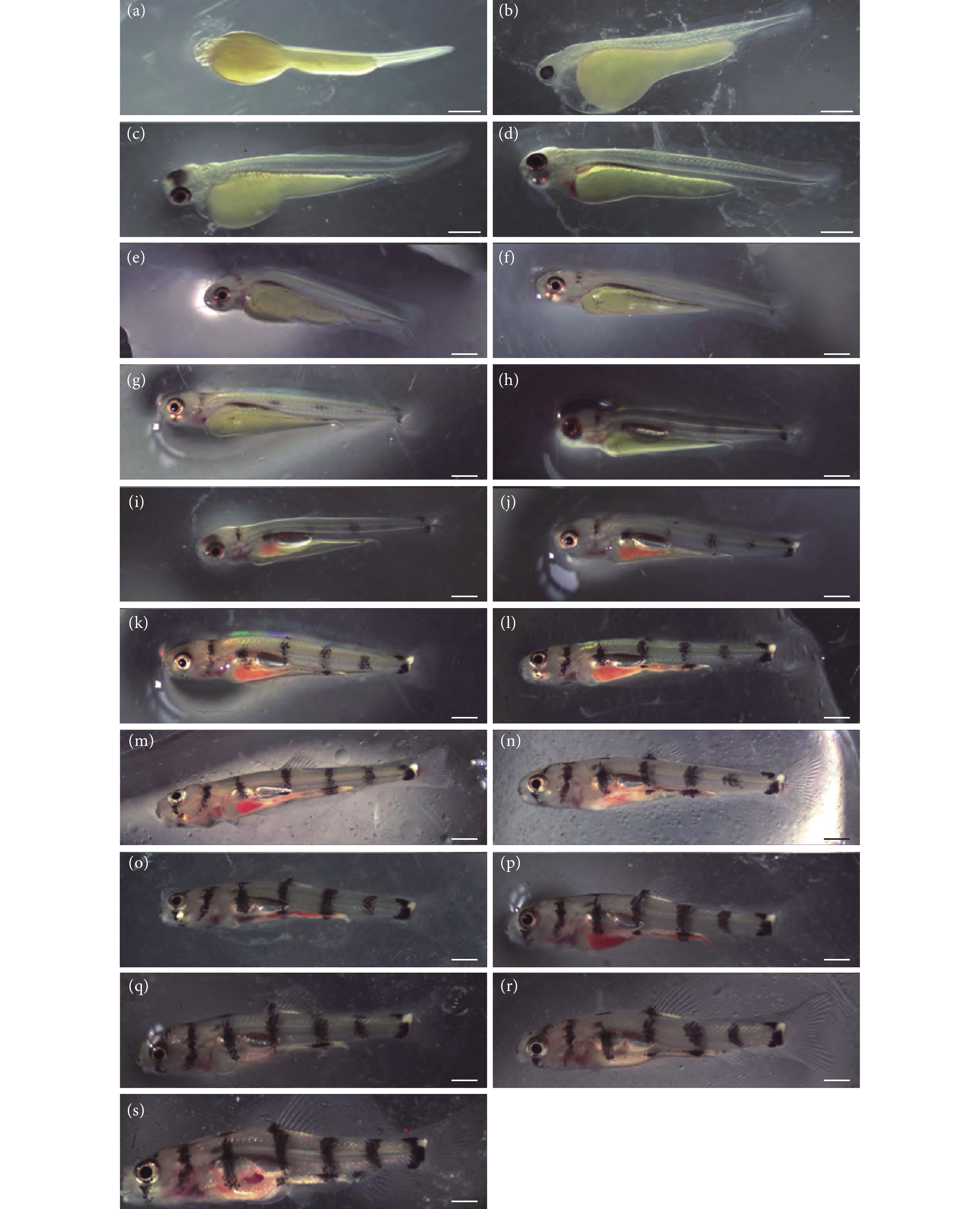
图 2 长鳍光唇鱼仔鱼发育
注:a. 孵后4 h仔鱼;b. 孵后16 h仔鱼;c. 孵后24 h仔鱼;d. 孵后36 h仔鱼;e. 孵后48 h仔鱼;f. 3 DAH仔鱼; g. 4 DAH仔鱼; h. 5 DAH仔鱼;i. 6 DAH仔鱼;j. 7 DAH仔鱼;k. 8 DAH仔鱼;l. 9 DAH仔鱼;m. 10 DAH仔鱼; n. 11 DAH仔鱼;o. 12 DAH仔鱼; p. 13 DAH仔鱼;q. 14 DAH仔鱼;r. 15 DAH仔鱼;s. 21 DAH仔鱼。标尺=1 mm。
Figure 2. Development of A. longipinnis larva
Note: a. Larv of 4 h after hatching; b. Larv of 16 h after hatching; c. Larv of 24 h after hatching; d. Larv of 36 h after hatching; e. Larv of 48 h after hatching; f. 3 DAH larv; g. 4 DAH larv; h. 5 DAH larv; i. 6 DAH larv; j. 7 DAH larv; k. 8 DAH larv; l. 9 DAH larv; m. 10 DAH larv; n. 11 DAH larv; o. 12 DAH larv; p. 13 DAH larv; q. 14 DAH larv; r. 15 DAH larv; s. 21 DAH larv. Bar=1 mm.
表 1 长鳍光唇鱼人工繁殖情况
Table 1 Artificial propagation of A. longipinnis
项目Item 2023-04-14 2023-04-17 2023-04-25 2023-04-28 雌雄亲鱼数量比
Male-to-female parental ratio9∶9 51∶44 30∶14 23∶15 催产率 Oxytocic rate/% 77.78 78.43 50.00 69.57 产卵量 Spawning capacity/104粒 1.30 3.20 0.90 1.10 受精率 Fertilization rate/% 70.00 72.00 42.00 90.00 孵化率 Hatchability/% 66.00 89.00 79.00 86.00 出苗量Seedling output/104尾 0.60 2.05 0.30 0.85 表 2 长鳍光唇鱼胚胎发育时序
Table 2 Timing of embryonic development sequence of A. longipinnis
发育时期
Developmental period受精后时间
Time after fertilization持续时间
Duration积温
Accumulative temperature/(℃·h)图序
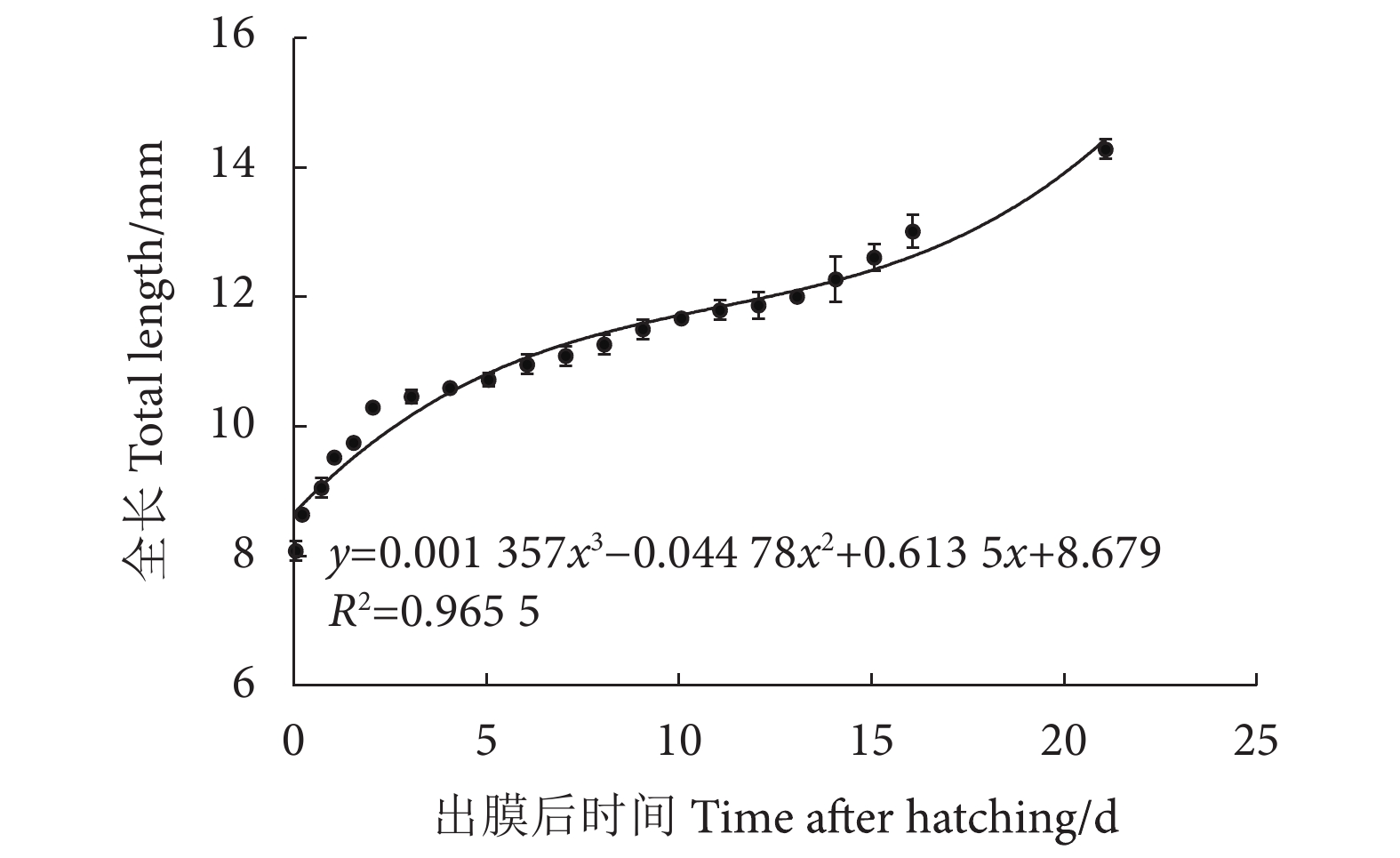
Plate受精卵 Fertilized egg 0 57 min 20.90 1-a 胚盘形成期 Blastodem stage 57 min 29 min 10.63 1-b 2细胞期 2-cell stage 1 h 26 min 36 min 13.20 1-c 4细胞期 4-cell stage 2 h 2 min 14 min 5.13 1-d 8细胞期 8-cell stage 2 h 16 min 12 min 4.40 1-e 16细胞期 16-cell stage 2 h 28 min 15 min 5.50 1-f 32细胞期 32-cell stage 2 h 43 min 28 min 10.27 1-g 64细胞期 64-cell stage 3 h 11 min 30 min 11.50 1-h 多细胞期 Multicellular stage 3 h 41 min 1 h 28 min 33.73 1-i 囊胚早期 Early-blastula stage 5 h 9 min 1 h 5 min 26.00 1-j 囊胚中期 Mid-blastula stage 6 h 14 min 53 min 21.20 1-k 囊胚晚期 Late-blastula stage 7 h 7 min 1 h 27 min 34.80 1-l 原肠早期 Early-gastrula stage 8 h 34 min 2 h 37 min 62.80 1-m 原肠中期 Mid-gastrula stage 11 h 11 min 1 h 59 min 45.62 1-n 原肠晚期 Late-gastrula stage 13 h 10 min 1 h 51 min 42.55 1-o 神经胚期 Neural stage 15 h 1 min 1 h 36 min 36.80 1-p 胚孔封闭期 Closure of blastopore stage 16 h 37 min 5 h 6 min 112.20 1-q 肌节出现期 Appearance of myomere 21 h 43 min 6 h 54 min 151.80 1-r 眼基期 Optic rudiment stage 28 h 35 min 1 h 19 min 28.97 1-s 眼囊期 Eye vesicle formation period 29 h 54 min 5 h 40 min 124.67 1-t 尾芽期 Tail bud stage 35 h 34 min 31 min 11.37 1-u 尾泡期 Tail vesicle period 36 h 5 min 1 h 46 min 38.87 1-v 眼晶体形成期 Crystal stage of eyes 37 h 51 min 51 min 18.70 1-w 尾鳍出现 Rudiment of tail fin 38 h 42 min 1 h 16 min 27.87 1-x 肌肉效应期 Muscular contraction period 39 h 58 min 6 h 4 min 139.53 1-y 耳石形成期 Appearance of statolith 46 h 2 min 7 h 168.00 1-z 心跳期 Heart beating period 53 h 2 min 7 h 23 min 169.82 1-aa 孵化期 Hatching stage 60 h 25 min 5 h 39 min 124.30 1-ab 破膜期 Embryo hatching 66 h 4 min 3~5 min 1-ac 初孵仔鱼 Newly hatched larvae 66 h 8 min 1-ad 表 3 长鳍光唇鱼仔鱼各发育阶段的生长率
Table 3 Growth rates of A. longipinnis larvae at different developmental stages
发育阶段
Developmental stage经历时间
Experience time/d全长绝对生长率
AGR/(mm·d−1)全长特定生长率
SGR/(%·d−1)2 DAH前仔鱼 Prelarvae of 2 DAH 2 1.10 12.05 2 DAH后仔鱼 Larvae after 2 DAH 19 0.21 1.72 2~8 DAH仔鱼 Larvae of 2−8 DAH 6 0.16 1.49 卵黄囊期仔鱼 Yolk sac stage larvae 8 0.40 4.13 晚期仔鱼 Late larvae 13 0.23 1.82 仔鱼期 Larval stage 21 0.29 2.70 -
[1] 袁乐洋. 中国光唇鱼属鱼类的分类整理[D]. 南昌: 南昌大学, 2005: 60-67. [2] 王崇, 方艳红, 梁银铨, 等. 红水河干流鱼类组成和分类多样性研究[J]. 水产学杂志, 2019, 32(6): 48-53. [3] 王崇, 谢山, 谢文星, 等. 红水河干流梯级运行后鱼类资源调查[J]. 淡水渔业, 2015, 45(2): 30-36. [4] 蒋志刚. 中国生物多样性红色名录. 脊椎动物. 第五卷, 淡水鱼类. 下册[M]. 北京: 科学出版社, 2021: 429-430. [5] 张志明, 梁炆汉, 杨洋, 等. 国家重点保护淡水鱼类特点及其保护建议[J]. 人民长江, 2023, 54(4): 68-75. [6] 刘鉴毅, 李琪, 孙艳秋, 等. 多纹钱蝶鱼胚胎发育及胚后发育观察[J]. 中国水产科学, 2021, 28(8): 978-987. [7] 严太明, 何学福, 贺吉胜. 宽口光唇鱼胚胎发育的研究[J]. 水生生物学报, 1999(6): 636-640. [8] 张玉明, 姜建湖. 光唇鱼人工繁殖研究[J]. 浙江海洋学院学报(自然科学版), 2010, 29(3): 211-214. [9] 张玉明, 闫家强. 光唇鱼胚胎发育的研究[J]. 绍兴文理学院报(自然科学), 2010, 30(3): 44-48. [10] 程东海. 光唇鱼 (Acrossoeheilus fasciatus) 育苗阶段的饵料选择及相关营养生理研究[D]. 金华: 浙江师范大学, 2012: 3-7. [11] 姜建湖, 张德明, 竺俊全, 等. 光唇鱼 (Acrossocheilus fasciatus) 胚胎及仔、稚鱼的发育[J]. 海洋与湖沼, 2012, 43(2): 280-287. [12] 华泽祥, 陈俊, 石永伦, 等. 云南光唇鱼的人工繁殖和胚胎发育观察[J]. 水产科技情报, 2017, 44(2): 69-72. [13] 唐安华, 何学福. 云南光唇鱼Acrossocheilus yunanensis (Regan) 的胚胎和胚后发育的初步观察[J]. 西南师范学院学报 (自然科学版), 1982(1): 91-99. [14] 陈礼强, 吴青, 郑曙明. 云南光唇鱼的人工繁殖研究[J]. 淡水渔业, 2006(1): 43-45. [15] 周礼敬, 詹会祥, 王贤文, 等. 云南光唇鱼人工繁殖与苗种培育初步研究[J]. 家畜生态学报, 2014, 35(3): 78-80, 96. [16] 韩军军, 贺疆滔, 陈朋, 等. 扁吻鱼胚胎发育及仔稚鱼形态与生长观察研究[J]. 南方水产科学, 2021, 17(1): 59-66. [17] HACHERO C I, ORTIZ D J B, BORREGA B, et al. Larval organogenesis of flatfish brill Scophthalmus rhombus L: histological and histochemical aspects[J]. Aquaculture, 2009, 286(1/2): 138-149.
[18] 潘晓赋, 刘倩, 王晓爱, 等. 软鳍新光唇鱼 (Neolissochilus benasi) 的人工繁殖与胚胎发育[J]. 动物学研究, 2013, 34(6): 617-625. [19] 陈军平, 沈方方, 武慧慧, 等. 我国鱼类胚胎发育研究进展[J]. 江苏农业科学, 2021, 49(17): 45-52. [20] 甘维熊, 王红梅, 邓龙君, 等. 雅砻江短须裂腹鱼胚胎和卵黄囊仔鱼的形态发育[J]. 动物学杂志, 2016, 51(2): 253-260. [21] 姜建湖. 光唇鱼性腺及胚胎与仔、稚鱼发育的研究[D]. 宁波: 宁波大学, 2012: 8-10, 24-31. [22] 殷名称. 鱼类生态学[M]. 北京: 中国农业出版社, 1995: 105-130. [23] 刘明鉴, 郭华阳, 高杰, 等. 尖翅燕鱼早期胚胎发育及仔稚鱼形态观察[J]. 南方水产科学, 2022, 18(4): 103-111. [24] 殷名称. 鱼类早期生活史研究与其进展[J]. 水产学报, 1991, 15(4): 348-358. [25] 黄洪贵. 水温对黑脊倒刺鲃胚胎发育的影响及胚后发育观察[J]. 水生态学杂志, 2009, 30(4): 84-88. [26] 黄洪贵. 中华倒刺鲃胚胎与仔鱼发育的观察[J]. 江西农业大学学报, 2009, 31(6): 1087-1092. [27] 于振海, 安丽, 朱树人, 等. 大鳞鲃胚胎发育及仔鱼发育观察[J]. 长江大学学报 (自然科学版), 2018, 15(6): 38-42, 94-95. [28] 覃宝利, 蔺玉华, 丁辰龙. 淡水驯化后大鳞鲃胚胎发育观察[J]. 南京师大学报 (自然科学版), 2017, 40(4): 109-115. [29] KNUTSEN G M, TILSETH S. Growth, development, and feeding success of Atlantic cod larvae Gadus morhua related to egg size[J]. Trans Am Fish Soc, 1985, 114(4): 507-511. doi: 10.1577/1548-8659(1985)114<507:GDAFSO>2.0.CO;2
[30] 熊美华. 长江五种鲤科鱼类早期形态发育与生长[D]. 武汉: 中国科学院研究生院 (水生生物研究所), 2006: 15-42. [31] 顾志敏, 朱俊杰, 贾永义, 等. 太湖翘嘴红鲌胚胎发育及胚后发育观察[J]. 中国水产科学, 2008, 15(2): 204-214. [32] CHOJNACKI K A, DODSON M J, GEORGE A E, et al. Ontogenetic development of pallid sturgeon (Scaphirhynchusalbus) and shovelnose sturgeon (Scaphirhynchus platorynchus) from hatch through yolk absorption[J]. Ecol Freshw Fish, 2023, 32: 209-231. doi: 10.1111/eff.12680
[33] 黄俊, 朱挺兵, 杨德国, 等. 短须裂腹鱼仔稚鱼发育及生长特性的初步研究[J]. 水生态学杂志, 2019, 40(6): 99-105. -
期刊类型引用(12)
1. 颉江,刘乙,龚全,周闯,覃川杰. 黄颡鱼生长相关SSR_S多态性与性状关联分析. 水产学杂志. 2025(03): 24-30 .  百度学术
百度学术
2. 李兵部,傅建军,陶易凡,强俊,徐跑. 基于D-loop序列和微卫星标记的4个黄颡鱼群体的遗传变异分析. 黑龙江畜牧兽医. 2024(04): 115-127 .  百度学术
百度学术
3. 胡玉婷,凌俊,江河,汪焕,潘庭双,段国庆,周华兴,杨敏,李彤. 苏皖地区中华绒螯蟹养殖群体微卫星遗传多样性的评估. 渔业科学进展. 2024(06): 178-187 .  百度学术
百度学术
4. 李大命,杨子萍,刘燕山,谷先坤,殷稼雯,蔡永久,唐晟凯,张彤晴. 基于线粒体COI序列的江淮下游湖泊鲢群体遗传多样性和遗传结构分析. 淡水渔业. 2023(04): 3-11 .  百度学术
百度学术
5. 宋立民,王娜,郑英珍,丁子元,刘肖莲,姜巨峰,张韦,耿绪云. 基于微卫星标记技术的5个黄颡鱼群体遗传多样性分析. 经济动物学报. 2023(02): 101-108 .  百度学术
百度学术
6. 葛锐,强壮,聂竹兰,李丽,魏杰. 基于高通量转录组测序的斑重唇鱼SSR分布及序列特征分析. 南方农业学报. 2023(03): 806-814 .  百度学术
百度学术
7. 邹利,王金龙,李传武,王冬武,曾春芳,刘明求,刘丽,谢敏,曾鸣. 稻田适养品种呆鲤的遗传多样性分析. 水产科学. 2023(05): 795-804 .  百度学术
百度学术
8. 黄皓,范嗣刚,王鹏飞,陈佳,赵超,闫路路,邱丽华,潘滢. 基于微卫星标记对6个花鲈群体的遗传多样性分析. 南方水产科学. 2022(01): 99-106 .  本站查看
本站查看
9. 胡玉婷,凌俊,江河,汪焕,潘庭双,周华兴. 中华绒螯蟹4个养殖群体遗传多样性与遗传结构分析. 江苏农业科学. 2022(16): 54-59 .  百度学术
百度学术
10. 胡玉婷,侯冠军. 安徽省翘嘴鲌野生群体的遗传多样性分析. 生物学杂志. 2022(04): 79-83 .  百度学术
百度学术
11. 罗宇婷,方弟安,周彦锋,徐东坡,彭云鑫,彭飞,张桂宁,刘凯,尤洋. 基于微卫星标记对长江下游鲢遗传多样性现状的分析. 南方水产科学. 2021(06): 48-57 .  本站查看
本站查看
12. 张显波,傅建军,胡锦丽,朱文彬,闵倩雯,赵飞,吴俣学,董在杰. 基于D-loop序列和SSR的从江田鱼与6个鲤群体的遗传分析. 贵州农业科学. 2021(12): 76-85 .  百度学术
百度学术
其他类型引用(5)



 下载:
下载:





 粤公网安备 44010502001741号
粤公网安备 44010502001741号
