Relationship between center of gravity and environmental factors of main catches of purse seine fisheries in North Pacific high seas based on GAM
-
摘要:
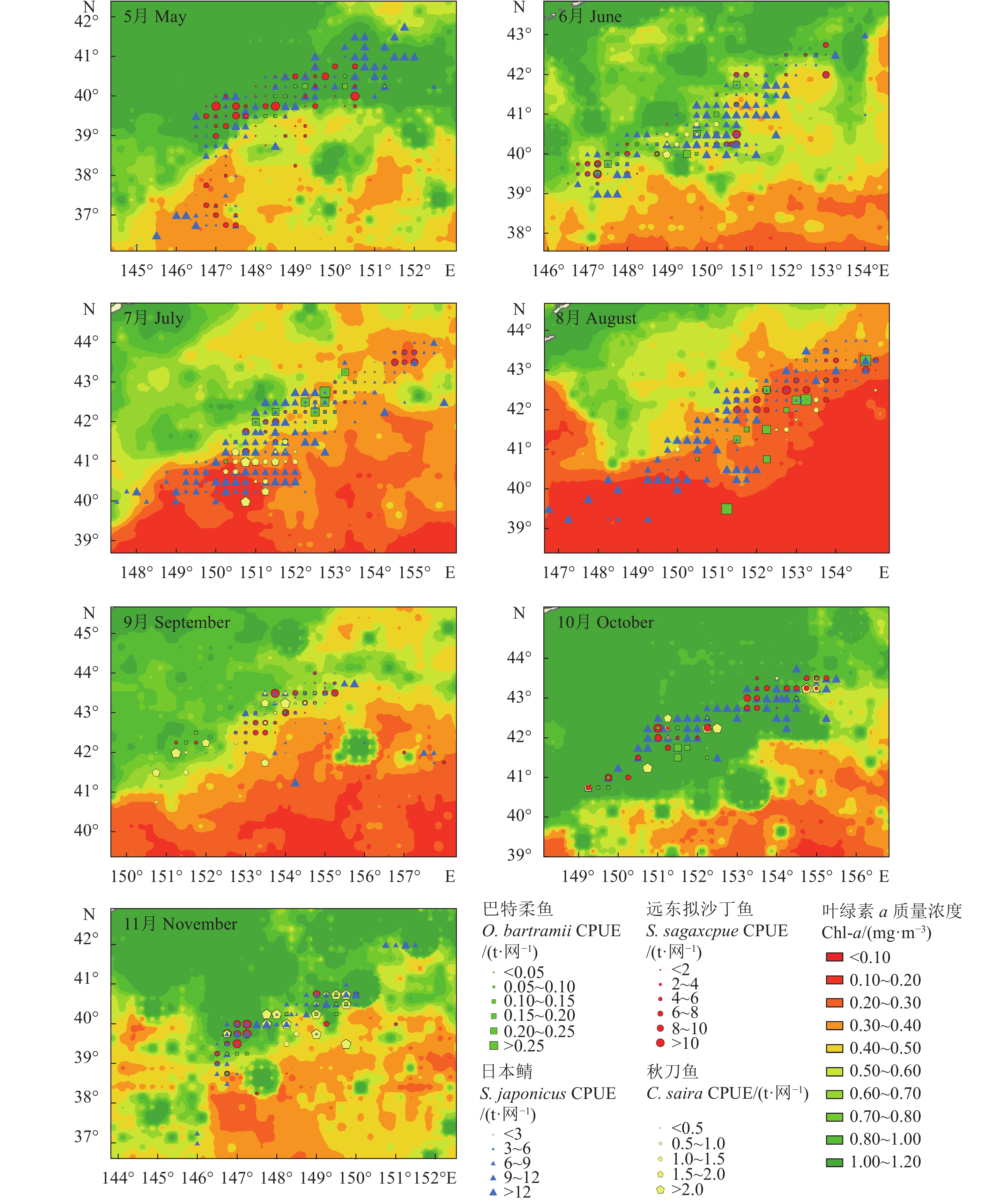
北太平洋公海灯光围网渔业是近年来我国新兴的远洋渔业项目,其中日本鲭 (Scomber japonicus)、远东拟沙丁鱼 (Sardinops sagax)、巴特柔鱼 (Ommastrephes bartrami) 和秋刀鱼 (Cololabis saira) 是主要渔获组成,厘清关键鱼种的渔场重心与环境因子的关系对研究渔场的形成机制及指导渔业生产具有重要意义。该研究利用2016—2017年北太平洋灯光围网渔业渔获数据及海表温 (Sea surface temperature, SST)、叶绿素 (Chl-a) 等环境因子,通过广义可加模型等分析渔获量的季节性变化及其与环境的关系。结果表明,北太平洋渔场重心整体上在渔汛初期向东北方向偏移,8—9月后期往西南折返。研究发现日本鲭渔场集中在148°E—154°E、40°N—42°N,远东拟沙丁鱼渔场集中在149°E—153°E、40°N—42°N,巴特柔鱼渔场集中在150°E—154°E、40°N—42°N,秋刀鱼渔场集中在150°E—153°E、41°N—42°N;2016—2017年北太平洋公海日本鲭的单位捕捞努力量渔获量 (Catch per unit effort, CPUE) 最适SST介于13~20.18 ℃,最适Chl-a介于0.1~0.8 mg·m−3;远东拟沙丁鱼CPUE最适SST介于12~19.1 ℃,最适Chl-a介于0.3~0.88 mg·m−3;巴特柔鱼 CPUE 最适 SST 介于 14~22 ℃,最适Chl-a介于0.2~1.1 mg·m−3;秋刀鱼CPUE 最适 SST 介于 14~21 ℃,最适Chl-a介于0.24~0.98 mg·m−3。
Abstract:Light seine fishery in North Pacific high seas is a new offshore fishery project in China in recent years. Scomber japonicus, Sardinops sagax, Ommastrephes bartramii and Cololabis saira are the main economic species in that area. It is important to clarify the relationship between the center of gravity and environmental factors for the study on the formation mechanism of fishery and the guidance of fishery production. Based on the 2016−2017 North Pacific Light Seine Fishery catch data and environmental factors such as sea surface temperature (SST) and chlorophyll a (Chl-a), we analyzed the seasonal variation of catch and its relationship with environment were analyzed by generalized additive model (GAM). On the whole, the center of gravity of North Pacific fisheries shifted northeast at the beginning of the fishing flood, and turned southwest during August to late September. The results show that S. japonicas fishing grounds were mainly at 148°E−154°E, 40°N−42°N; S. melanostictus fishing grounds were mainly at 149°E−153°E, 40°N−42°N; O. bartramii fishing grounds were mainly at 150°E−154°E, 40°N−42°N; C. saira fishing grounds were mainly at 150°E−153 °E, 41°N−42°N. Moreover, the optimal SST of S. japonicus CPUE was 13−20.18 ℃, and the optimal Chl-a was 0.1−0.8 mg·m−3. The optimal SST of S. sagax CPUE was 12−19.1 ℃, and the optimal Chl-a was 0.3−0.88 mg·m−3. The optimal SST of O. bartramii CPUE was 14−22 ℃, and the optimal Chl-a was 0.2−1.1 mg·m−3. The optimal SST of C. saira CPUE was 14−21 ℃, and the optimal Chl-a was 0.24−0.98 mg·m−3.
-
Keywords:
- Light seine /
- Commercial species /
- Environmental factors /
- GAM /
- North Pacific high seas
-
大口黑鲈 (Micropterus salmoides),俗称加州鲈,隶属鲈形目、鲈亚目、太阳鱼科、黑鲈属。原自然分布于北美洲,于1983年从中国台湾引入广东省[1]。大口黑鲈适温范围较广,生长快且易起捕,同时其肉质鲜美、无肌间刺,因而深受养殖者和消费者欢迎,在我国多个省市与地区得以迅速推广养殖。近几年大口黑鲈人工配合饲料的突破与应用,使大口黑鲈养殖区域与规模迅速扩大。2017年,我国养殖大口黑鲈年产量已达45.7万吨[2]。但近两三年来养殖大口黑鲈抗病性能下降,病害问题频发。大口黑鲈引进中国已三十多年,虽然这期间也从原产地进行过为数不多的小规模引进,但相对于养殖规模而言,亲本的种质更新极为有限。因此抗病性能下降是否与种质质量与遗传多样性下降有关,进一步开展选择育种的种质遗传基础如何,都亟需对中国现有大口黑鲈养殖群体的遗传多样性进行评估。
微卫星 (microsatellite) 标记,又称简单重复序列 (simple sequence repeats, SSR) 或短串联重复序列 (simple tandem repeats, STR),是均匀分布于真核生物基因组中的简单重复序列,由2~6个核苷酸的串联重复片段构成,具有分布广泛、共显性遗传、多态性高等特点,广泛应用于多个生命学科领域[3-4]。20世纪90年代初,微卫星标记开始应用于鱼类遗传及育种研究中[5]。利用微卫星研究大口黑鲈的遗传多样性在近年有所报道。梁素娴等[6]用21对微卫星引物对广东的3个大口黑鲈养殖群体进行遗传多样性分析发现,3个不同群体平均杂合度处于中等偏低水平 (期望杂合度He分别为0.375、0.403和0.368),遗传多样性不高。李镕等[7]利用11对微卫星引物对大口黑鲈第2~第4代选育群体的遗传结构进行分析发现,与F2相比,F4的遗传多样性减少8.76%,表明选育群体的遗传多样性在逐步下降。樊佳佳等[8]用43个微卫星标记对目前国内养殖的大口黑鲈群体、2009年引进的佛罗里达亚种、2010年引进的佛罗里达亚种和北方亚种这4个群体进行遗传多样性检测,发现国内养殖的大口黑鲈群体遗传多样性水平明显低于国外新引进的大口黑鲈群体。以上研究表明,我国大口黑鲈养殖群体出现遗传多样性显著下降、种质退化及种群结构单一等问题。
广东省是中国大口黑鲈成鱼的主养区和主要苗种培育基地。2016年广东省大口黑鲈养殖面积约5 333.4 hm2,产量为23.5万吨,占全国总产量的62.8%。广东省大口黑鲈成鱼养殖主要集中在珠江三角洲的佛山市,其养殖产量近20万吨。佛山市的顺德区和南海区有大口黑鲈鱼苗培育专业村,仅南海区九江镇的大口黑鲈鱼苗生产量就接近40亿尾,约占广东全省生产量的75%,占全国生产量的60%[9]。因此佛山地区的大口黑鲈养殖群体极具代表性,研究其养殖群体的遗传多样性和遗传结构,可以反映出中国大口黑鲈养殖群体的遗传多样性现状。本研究选取广东省佛山市3个不同地方的大口黑鲈养殖群体作为研究对象,利用微卫星标记技术对其进行遗传多样性分析,旨在为当前大口黑鲈养殖群体的种质资源调查和进一步的选育种工作提供支撑。
1. 材料与方法
1.1 实验材料
实验所需大口黑鲈样品分别为佛山市南海区西樵镇的西樵群体 (编号为XJ)、九江镇沙头片区的沙头群体 (编号为ST)、九江镇九江片区烟南村的烟南群体 (编号为YN),这3个养殖群体的苗种来自不同苗种场。从3个养殖群体中各随机选取32尾个体,分别剪取尾鳍,–20 ℃保存于95%的乙醇中,用于DNA的提取。
1.2 基因组DNA的提取与检测
利用天根生化科技 (北京)有限公司的海洋动物组织基因组DNA提取试剂盒,提取大口黑鲈尾鳍的基因组DNA。用1%的琼脂糖凝胶进行电泳,并用酶标仪检测其质量和浓度,−20 ℃冰箱保存。
1.3 微卫星引物的筛选与合成
根据GenBank及文献上登录的大口黑鲈微卫星引物序列[10-14],选择并设计合成51对引物,进行预扩增,并用Qsep100全自动核酸蛋白分析系统 (中国,台湾) 检测引物的特异性和多态性,最终确定其中的12对重复性好、特异性强和多态性高的微卫星引物 (表1) 用于研究。引物委托生工生物工程 (上海) 股份有限公司进行合成。各对引物分别带有TAMRA、HEX和FAM的特异性荧光标记,用于扩增和测算目的条带的大小。
表 1 大口黑鲈微卫星引物序列及退火温度Table 1. Primer sequences and annealing temperatures of microsatellite marker位点
loci引物序列 (5'−3')
primer sequence片段长度/bp
size重复序列
repeat sequence退火温度/℃
annealingtemperature参考文献
Referencemdo3 AGGTGCTTTGCGCTACAAGT
CTGCATGGCTGTTATGTTGG119~143 (CA)20 46.2 [11] mdo4 TCTGAACAACTGCATTTAGACTG
CTAATCCCAGGGCAAGACTG151~155 (CA)11 48.6 [11] mdo7 TCAAACGCACCTTCACTGAC
GTCACTCCCATCATGCTCCT179~205 (CA)12 53 [11] lma120 TGTCCACCCAAACTTAAGCC
TAAGCCCATTCCCAATTCTCC204~224 (GT)28 60 [10, 13] MiSaTPW011 CAACATGGACGCTACTAT
CAACCATCACATGCTTCT170~194 (AGAT)13 60 [14] MiSaTPW038 AGTCAACATTCAAACCACTTTCCCAC
TTGTATGTTAGGATCGGCTGATTGTG227~312 (AGAT)6+5+9+5 60 [14] MiSaTPW025 CCAAGGTCAGGTTTAAC
ACCTTTGTGCTGTTCTGTC277~298 (AGAT)11 55 [14] MiSaTPW060 TATAGTTTGGTCCAGCAGGTGGCGT
TGTGGAATGACATTTAGCCGAGGCC294~561 (AGAT)14+10+3+2+4+9+10 60 [14] MiSaTPW116 CCAAACAGCCTACAGAATGTGCCT
AGTCCCTCGACTGAATGTGTGCAA191~219 (AC)21 55 [14] MiSaTPW001 AGTAAAGGACCACCCTTGTCCA
GCCTGGTCATTAGGTTTCGGAG293~299 (AC)16 60 [14] MiSaTPW058 CATTCCTGAGAGACGTGGTTGCTG
TGTGACTTGCTCTGTGAAAGGTGC143~169 (AAGT)6 60 [14] MiSaTPW154 TGCGGGCTAATAGGCCTGTCTG
GCACCACACAATCACACCTGGTAT182~228 (AC)18 55 [14] 1.4 PCR的反应体系与程序
PCR反应总体积20 μL,含有模板DNA 1 μL、上下游引物 (10 μmol·L–1) 各1 μL、ddH2O 7 μL、Premix rTaq (TaKaRa,中国大连) 10 μL,在96孔板中进行PCR反应。扩增程序为94 ℃预变性3 min;94 ℃变性30 s,退火 (各引物退火温度参照表1中的退火温度) 30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min,4 ℃保存。
1.5 扩增产物的检测
引物筛选的预扩增产物通过Qsep100全自动核酸蛋白分析系统进行毛细管电泳检测。将PCR扩增产物室温放置2~3 min,开盖后按要求放在样品托上进行毛细管电泳。电泳参数为6 kV下进样2 s再电泳300 s。电泳完毕后,用Q-ANALYZER软件对结果进行矫正与分析,对扩增产物分子量的差异大小进行个体各微卫星基因座的分型。
荧光引物的扩增产物通过STR基因分型检测,由生工生物工程 (上海) 股份有限公司完成。使用毛细管电泳分离STR片段,激光诱导的荧光检测,由设备检测并数据化存储,自动数据采集并分型。荧光颜色分离,计算片段大小,确定各个等位座的基因分型。整个过程通过ABI 310遗传分析仪 (美国) 完成。
1.6 数据统计与分析
通过STR分型确定标记在个体中的基因型,运用POPGENE 32软件进行统计分析,计算各个群体微卫星位点的等位基因数 (Na)、有效等位基因数 (Ne)、观测杂合度 (Ho)、He、Shannon指数 (I)、遗传相似度 (S) 及群体间遗传距离 (Da)。运用FSTAT软件算出遗传分化指数 (FST)。根据Nei氏遗传距离的大小,运用MEGA 5软件构建系统树[15]。运用CERVUS 3.0软件统计出多态信息含量 (polymorphism information content, PIC)[16]。运用ARLEQUIN 3.1软件进行群体间FST计算、群体分子方差分析 (AMOVA)[17]。利用STRUCTURE 2.3软件分析群体的遗传结构[18]。
2. 结果
2.1 微卫星位点筛选
从不同地区采集到的大口黑鲈养殖群体中,随机选取12个大口黑鲈样本,利用51对微卫星引物进行PCR扩增,通过Qsep100全自动核酸蛋白分析系统进行毛细管电泳检测产物(图1),筛选出12对多态性好、特异性强的微卫星引物用于大群体的扩增分析 (表1)。
![]() 图 1 毛细管电泳检测引物MiSaTPW011部分扩增产物绿色箭头指示20 bp align Marker和1 000 bp align Marker;M. size Marker;1~8. 大口黑鲈8个个体的毛细管电泳结果Figure 1. Detection for partial PCR products of MiSaTPW011 with capillary electrophoresisGreen arrows indicate 20 bp align Marker and 1 000 bp align Marker, respectively; M. size Marker; 1−8. output of eight M. salmoides capillary electrophoresis
图 1 毛细管电泳检测引物MiSaTPW011部分扩增产物绿色箭头指示20 bp align Marker和1 000 bp align Marker;M. size Marker;1~8. 大口黑鲈8个个体的毛细管电泳结果Figure 1. Detection for partial PCR products of MiSaTPW011 with capillary electrophoresisGreen arrows indicate 20 bp align Marker and 1 000 bp align Marker, respectively; M. size Marker; 1−8. output of eight M. salmoides capillary electrophoresis2.2 微卫星位点多态性与群体遗传参数
用筛选出的12对微卫星引物扩增3个大口黑鲈群体共96个个体的DNA,将产物进行STR分型 (图2)。结果表明,各对引物在3个群体中均能扩增到目的条带,并体现了程度不一的多态性(表2)。其中,Na为1~6,Ne为1~3.52,I为0~1.427,Ho为0~0.854,He为0~0.720,PIC为0.02~0.693。
表 2 大口黑鲈12个微卫星位点的等位基因数、杂合度及多态信息含量Table 2. Number of alleles, heterozygosity and polymorphic information content of 12 microsatellite loci of M. salmoides位点
locus等位基因数
Na有效等位基因数
NeShannon指数
I观测杂合度
Ho期望杂合度
He多态信息含量
PICmdo3 1 1.00 0.000 0.000 0.000 0.040 mdo4 4 1.89 0.797 0.086 0.473 0.439 mdo7 2 1.13 0.225 0.118 0.112 0.158 lma120 4 2.89 1.211 0.552 0.658 0.604 MISATPW011 4 2.14 0.838 0.854 0.536 0.425 MISATPW038 4 1.72 0.658 0.523 0.420 0.442 MISATPW025 3 2.49 0.980 0.484 0.601 0.526 MISATPW060 6 3.52 1.427 0.667 0.720 0.693 MISATPW116 1 1.00 0.000 0.000 0.000 0.020 MISATPW001 2 1.12 0.219 0.115 0.109 0.102 MISATPW058 2 1.04 0.101 0.000 0.041 0.040 MISATPW154 4 1.65 0.749 0.208 0.397 0.363 平均 mean 3.08 1.80 0.600 0.301 0.339 0.321 3个大口黑鲈群体的遗传多样性见表3。其中3个群体的Na为2.583 3~2.666 7,Ne为1.659 2~1.911 0,I为0.533 7~0.620 6,Ho为0.294 7~0.304 9,He为0.312 5~0.360 6,PIC为0.294 2~0.335 6。沙头群体的6个遗传多样性参数略高于西樵和烟南群体,西樵和烟南群体的比较接近,且西樵群体的遗传多样性参数最低。
表 3 3个大口黑鲈养殖群体遗传多样性Table 3. Genetic diversity of three populations of M. salmoides群体
population等位基因数
Na有效等位基因数
NeShannon指数
I观测杂合度
Ho期望杂合度
He多态信息含量
PIC西樵 XJ 2.583 3 1.659 2 0.533 7 0.294 7 0.312 5 0.294 2 沙头 ST 2.666 7 1.911 0 0.620 6 0.304 9 0.360 6 0.335 6 烟南 YN 2.583 3 1.736 1 0.554 1 0.301 5 0.328 4 0.296 4 2.3 群体间的遗传分化及遗传距离分析
3个大口黑鲈养殖群体间的遗传分化指数 (FST)为0.012 1~0.028 9 (表4),属低水平遗传分化 (FST<0.05)。其中西樵和烟南群体间的遗传分化水平最低 (FST=0.012 1),沙头群体和烟南群体间的遗传分化水平最高 (FST=0.028 9,表4)。
表 4 3个大口黑鲈养殖群体的遗传分化指数Table 4. Fixation index (FST) of three populations of M. salmoides西樵 XJ 沙头 ST 烟南 YN 西樵 XJ − 沙头 ST 0.017 9 − 烟南 YN 0.012 1 0.028 9 − AMOVA分析显示,14.17%的遗传变异来自群体间,85.83%的遗传变异来自群体内 (P<0.01)。结果表明,遗传变异主要存在个体间,个体间的遗传变异程度远大于群体间 (表5)。
表 5 3个大口黑鲈养殖群体AMOVA分析Table 5. AMOVA analysis among three populations of M. salmoides变异来源
source of variation自由度
df平方和
sum of squares方差组分
variance component% 群体间 among populations 95 192.859 0.296 76 14.17 群体内 within populations 96 146.500 1.526 04 85.83** 总变异 total variation 191 339.359 1.778 07 注:**. 1 023次模拟检验后为极显著 (P<0.01) Note: **. very significant difference after 1 023 permutation tests (P<0.01) 3个群体间Nei's遗传距离 (Da)介于0.013 7~0.024 9,遗传相似度 (S)介于0.975 4~0.986 4 (表6),其中西樵群体和沙头群体的遗传距离最近 (Da=0.013 7)、遗传相似度最高 (S=0.986 4),而烟南群体和沙头群体的遗传距离最远 (Da=0.024 9)、遗传相似度最低 (S=0.975 4)。由遗传距离大小构建了UPGMA聚类树,聚类分析结果显示,3个大口黑鲈群体归为两大类,西樵与烟南群体为一类,沙头群体单独为一类 (图3)。
表 6 3个大口黑鲈养殖群体的遗传相似度S (对角线上) 和遗传距离Da (对角线下)Table 6. Genetic similarity (above diagonal) and genetic distance (below diagonal) of three populations of M. salmoides西樵 XJ 沙头 ST 烟南 YN 西樵 XJ − 0.982 5 0.986 4 沙头 ST 0.017 7 − 0.975 4 烟南 YN 0.013 7 0.024 9 − 2.4 群体遗传结构的分析
运用STRUCTURE软件对3个大口黑鲈群体的遗传结构进行分析,执行K=2~7的假设,设定10次重复,结果显示对数似然函数值lnP(D)随亚群数K的增加而降低,K=1时,lnP(D)最大,从而确定出最适宜的亚群数为1 (图4)。K=2时,3个群体的遗传结构图几乎没有分别 (图5),也说明3个养殖群体都来自一个亚群。
3. 讨论
本研究采用Qsep100全自动核酸蛋白分析系统,通过毛细管电泳筛选微卫星引物,在51对微卫星引物中挑选出12对多态性相对较好的引物进行大群体遗传多样性的检测。在检测阶段则是采用ABI310遗传分析仪通过荧光标记的引物进行PCR扩增,扩增产物经毛细管电泳后进行STR分析。Qsep100全自动核酸蛋白分析系统和ABI310遗传分析仪均采用毛细管电泳系统,2个系统都具有操作简单、速度快、准确性高的优点。不同之处在于,Qsep100系统在电泳介质中加入能结合核酸的荧光物质,利用激光诱导其发光来检测核酸[19],ABI310系统则是先对引物进行荧光标记,使得PCR产物带有荧光,毛细管电泳时直接检测产物荧光来确定产物大小[20]。Qsep100系统成本较高的部分是带有荧光的电泳介质 (即卡夹),ABI310系统成本较高的部分是荧光引物的合成,Qsep100系统的总成本略低。但ABI310系统毛细管的峰图则更清晰,更容易排除杂带的干扰,检测准确性更高。因此综合2套系统的优势,本研究在引物筛选阶段采用Qsep100系统,在检测分型阶段则采用ABI310系统,可以在保证准确性的前提下提高检测效率,节省成本。
对本研究筛选的12对微卫星引物的遗传参数分析发现,12对引物中有5对引物属于低度多态 (PIC<0.25),4对引物属于中度多态 (0.25<PIC<0.5),只有3对引物属于高度多态 (PIC>0.5)。其中有2对引物 (mdo3和MISATPW116)只有1个等位基因 (Na=1),其He均为0,说明这2对引物没有多态性。Malloy等[11]和Lutz-Carrillo等[13-14]通过磁珠富集法筛选到大量的大口黑鲈微卫星引物,本研究选择其中的51对引物用于扩增,并从中筛选出12对多态性高且特异性好的微卫星引物。在Malloy等[11]和Lutz-Carrillo等[13-14]的研究中,这12对引物大都属于高度多态性,其中有10对引物He为0.55~0.94,其遗传多样性参数均显著高于本研究所获得的参数值。另外,在他们的研究中报道有高度多态性的引物,大部分在本研究的3个群体中已不再具有多态性[10-14]。因此,从本研究12对引物在大口黑鲈3个养殖群体扩增所获得的多样性参数来看,本研究中的3个养殖群体的遗传多样性较Malloy等报道过的群体已显著下降。推测当前养殖的大口黑鲈群体大都是由最初引进的大口黑鲈群体繁育的后代,经过多年的近交繁育,遗传多样性已显著下降。
对本研究选取的广东佛山3个大口黑鲈养殖群体的遗传多样性分析发现,3个群体的He为0.312 5~0.360 6。而樊佳佳等[8]用微卫星标记对国内养殖群体和3个引进群体进行遗传多样性检测,其He为0.454 9~0.613 8,高于本研究的分析结果。本研究所选用的MISATPW001和mdo72位点,PIC值已下降为0.102和0.158,而在樊佳佳等[8]的结果中,国内养殖群体中这2个位点的PIC分别为0.141 1和0.239 2,这均说明近几年我国大口黑鲈养殖群体遗传多样性下降明显。另外,3个群体之间,沙头群体 (ST)的遗传多样性最高 (He=0.360 6),各遗传参数均高于另外2个群体,可能与苗种来源有关。
本研究的3个大口黑鲈养殖群体遗传分化指数 (FST)为0.012 1~0.028 9,遗传分化水平较低,说明3个群体遗传差异不明显。3个群体Da介于0.013 7~0.024 9,非常接近,另外,运用STRUCTURE软件进行遗传结构分析也表明3个养殖群体应来自于一个亚群。这佐证了上述观点,即当前大口黑鲈养殖群体极可能均由最初引进的大口黑鲈群体繁育而来。当前大口黑鲈养殖群体结构单一,遗传多样性低,抗病性能下降的问题除了与养殖模式及管理有关外,也极可能与种质退化、遗传多样性下降有关。由于遗传多样性下降,导致其对环境的适应能力变差,进而更容易被病原等侵袭。因此应高度重视提高与维持大口黑鲈种群遗传多样性的问题,并通过分子选育种技术进行优良品种的培育,以促进大口黑鲈养殖产业的健康可持续发展。
-
表 1 2016—2017年北太平洋渔场环境因子与渔获量GAM模拟的检验系数值和显著性
Table 1 Inspection coefficient value and significance for GAM simulation of environmental factors and catches in North Pacific fishing grounds during 2016−2017
鱼种
Fish species环境因子
Environment factor有效自由度
Effective degrees of freedomF P 日本鲭 S. japonicas 经度 Lon 7.12 8.76 1.48×10−11 *** 纬度 Lat 5.47 8.16 5.54×10−9 *** 海表温 SST 3.43 7.23 5.20×10−6 *** 叶绿素a Chl-a 1.00 11.65 6.79×10−4 *** 沙丁鱼 S. sagax 经度 Lon 1.00 0.99 0.32 纬度 Lat 1.00 8.34 4.11×10−3 ** 海表温 SST 3.65 2.53 3.46×10−2 * 叶绿素a Chl-a 1.00 1.22 0.27 柔鱼 O. bartrami 经度 Lon 4.59 3.88 1.52×10−3 ** 纬度 Lat 1.00 12.80 4.38×10−4 *** 海表温 SST 2.74 4.42 2.93×10−3 ** 叶绿素a Chl-a 3.13 5.18 5.88×10−4 *** 秋刀鱼 C. saira 经度 Lon 1.00 11.45 9.54×10−4 *** 纬度 Lat 1.00 16.73 7.60×10−5 *** 海表温 SST 1.00 9.93 2.12×10−3 ** 叶绿素a Chl-a 1.00 1.24 0.27 注:*. P<0.05; **. P<0.01; ***. P<0.001 -
[1] FAO. State of world fisheries and aquaculture (SOFIA) 2018. [EB/OL]. (2018-06-01) [2019-10-1]. http://www.fao.org/fisheries/en/
[2] YU W, GUO A, ZHANG Y, et al. Climate-induced habitat suitability variations of chub mackerel Scomber japonicus in the East China Sea[J]. Fish Res, 2018, 207: 63-73. doi: 10.1016/j.fishres.2018.06.007
[3] 李纲, 陈新军. 东海鲭鱼资源和渔场时空分布特征的研究[J]. 中国海洋大学学报 (自然科学版), 2007, 37(6): 921-926. [4] 程家骅, 林龙山. 东海区鲭鱼生物学特征及其渔业现状的分析研究[J]. 海洋渔业, 2004, 26(2): 73-78. doi: 10.3969/j.issn.1004-2490.2004.02.001 [5] YATSU A, WATANABE T, ISHIDA M, et al. Environmental effects on recruitment and productivity of Japanese sardine Sardinops melanostictus and chub mackerel Scomber japonicus with recommendations for management[J]. Fish Oceanogr, 2005, 14(4): 263-278. doi: 10.1111/j.1365-2419.2005.00335.x
[6] KAMIMURA Y, TAKAHASHI M, YAMASHITA N, et al. Larval and juvenile growth of chub mackerel Scomber japonicus in relation to recruitment in the western North Pacific[J]. Fish Sci, 2015, 81(3): 505-513. doi: 10.1007/s12562-015-0869-4
[7] 由上龍嗣, 西嶋翔太, 井須小羊子ら. 平成30 (2018) 年度マサバ太平洋系群の資源評価[R]. 中央水産研究所, 2018: 4-8. [8] 渡邊千夏子. マサバ太平洋系群の繁殖特性の変化とその個体群動態への影響[J]. 水産海洋研究, 2010, 74: 46-50. [9] 西田宏, 川端淳, 目黒清美, ら. マサバとゴマサバの分布と回遊1−幼魚[J]. 水産海洋研究, 2001, 65(4): 201. [10] 目黒清美, 梨田一也, 三谷卓美. マサバとゴマサバの分布と回遊 (成魚)(総特集 マサバとゴマサバ太平洋系群−−漁業·資源·管理の現状と将来展望)[J]. 海洋, 2002, 34(4): 256-260. [11] 川崎健. マサバ太平洋系群未成魚の生態について[J]. 東海区水産研究所研究報告, 1968(55): 59-114. [12] 飯塚景記. 東北海区におけるマサバ未成魚の生態−3−八戸沖で越冬すると推定される魚群について[J]. 東北区水産研究所研究報告, 1974(33): 37-49. [13] WATANABE C, YATSU A. Long-term changes in maturity at age of chub mackerel (Scomber japonicus) in relation to population declines in the waters off northeastern Japan[J]. Fish Res, 2006, 78(2-3): 323-332. doi: 10.1016/j.fishres.2006.01.001
[14] 黒田一紀. 日本の太平洋沿岸域におけるさば属魚類の産卵期, 産卵場及び産卵量水準の動向[J]. 水産海洋研究, 1992, 56: 65-72. [15] 加藤充宏, 渡邊千夏子. マサバとゴマサバの成熟·産卵および食性 (総特集 マサバとゴマサバ太平洋系群——漁業·資源·管理の現状と将来展望)[J]. 海洋, 2002, 34(4): 266-272. [16] 庄之栋, 马超, 刘勇, 等. 北太平洋公海秋季鲐鱼生物学特性的初步研究[J]. 海洋湖沼通报, 2018(06): 125-131. [17] 薛嘉伦, 樊伟, 唐峰华, 等. 基于最大熵模型预测西北太平洋平洋公海鲐潜在栖息地分布[J]. 南方水产科学, 2018, 14(1): 92-98. doi: 10.3969/j.issn.20950780.2018.01.012 [18] 田思泉, 陈新军. 不同名义CPUE计算法对 CPUE 标准化的影响[J]. 上海海洋大学学报, 2010, 19(2): 240-245. [19] 唐峰华, 崔雪森, 杨胜龙, 等. 海洋环境对中西太平洋金枪鱼围网渔场影响的 GIS 时空分析[J]. 南方水产科学, 2014, 10(2): 18-26. doi: 10.3969/j.issn.2095-0780.2014.02.003 [20] 化成君, 张衡, 伍玉梅, 等. 中东太平洋金枪鱼延绳钓中心渔场的时空变化[J]. 生态学杂志, 2014, 33(5): 1243-1247. [21] 郑波, 陈新军, 李纲. GLM 和 GAM 模型研究东黄海鲐资源渔场与环境因子的关系[J]. 水产学报, 2008, 32(3): 379-386. [22] AUSTIN M P, MEYERS J A. Current approaches to modelling the environmental niche of eucalypts: implication for management of forest biodiversity[J]. Forest Ecol Manag, 1996, 85(1/2/3): 95-106. doi: 10.1016/S0378-1127(96)03753-X
[23] 周甦芳, 樊伟, 崔雪森, 等. 环境因子对东海区帆式张网主要渔获物渔获量影响[J]. 应用生态学报, 2004(9): 1637-1640. doi: 10.3321/j.issn:1001-9332.2004.09.030 [24] BELLIDO J M, PIERCE G J, WANG J. Modelling intra-annual variation in abundance of squid Loligo forbesi in Scottish waters using generalised additive models[J]. Fish Res, 2001, 52(1/2): 23-39. doi: 10.1016/S0165-7836(01)00228-4
[25] SWARTZMAN G, HUANG C, KALUZNY S. Spatial analysis of Bering Sea groundfish survey data using generalized additive models[J]. Can J Fish Aquat Sci, 1992, 49(7): 1366-1378. doi: 10.1139/f92-152
[26] Burnham K,Anderson D. Model Selection and Multimodel Inference: a practical information theoretic approach [M]. 2nd ed. New York: Springer, 2002: 267-347.
[27] 戴澍蔚, 唐峰华, 樊伟. 北太平洋平洋公海日本鲭资源分布及其渔场环境特征[J]. 海洋渔业, 2017, 39(4): 372-382. doi: 10.3969/j.issn.1004-2490.2017.04.002 [28] 朱国平, 李纲, 郑晓琼, 等. 东海鲐鱼资源时空分布特征[J]. 生态科学, 2011, 30(l): 1-7. [29] 唐峰华, 樊伟, 伍玉梅, 等. 北太平洋柔鱼渔场资源与海洋环境关系的季节性变化[J]. 农业资源与环境学报, 2015(3): 242-249. [30] 苏杭, 陈新军, 汪金涛. 海表水温变动对东、黄海鲐鱼栖息地分布的影响[J]. 海洋学报, 2015, 37(6): 88-96. [31] 袁小楠, 陈新军, 李纲. 黄海日本鲐灯光围网渔场重心年际变化及其与环境因子关系[J]. 广东海洋大学学报, 2016, 36(3): 110-114. doi: 10.3969/j.issn.1673-9159.2016.03.018 [32] 王良明, 李渊, 张然, 等. 西北太平洋日本鲭资源丰度分布与表温和水温垂直结构的关系[J]. 中国海洋大学学报, 2019, 49(11): 29-38. -
期刊类型引用(11)
1. 李兵部,傅建军,陶易凡,强俊,徐跑. 基于D-loop序列和微卫星标记的4个黄颡鱼群体的遗传变异分析. 黑龙江畜牧兽医. 2024(04): 115-127 .  百度学术
百度学术
2. 胡玉婷,凌俊,江河,汪焕,潘庭双,段国庆,周华兴,杨敏,李彤. 苏皖地区中华绒螯蟹养殖群体微卫星遗传多样性的评估. 渔业科学进展. 2024(06): 178-187 .  百度学术
百度学术
3. 李大命,杨子萍,刘燕山,谷先坤,殷稼雯,蔡永久,唐晟凯,张彤晴. 基于线粒体COI序列的江淮下游湖泊鲢群体遗传多样性和遗传结构分析. 淡水渔业. 2023(04): 3-11 .  百度学术
百度学术
4. 宋立民,王娜,郑英珍,丁子元,刘肖莲,姜巨峰,张韦,耿绪云. 基于微卫星标记技术的5个黄颡鱼群体遗传多样性分析. 经济动物学报. 2023(02): 101-108 .  百度学术
百度学术
5. 葛锐,强壮,聂竹兰,李丽,魏杰. 基于高通量转录组测序的斑重唇鱼SSR分布及序列特征分析. 南方农业学报. 2023(03): 806-814 .  百度学术
百度学术
6. 邹利,王金龙,李传武,王冬武,曾春芳,刘明求,刘丽,谢敏,曾鸣. 稻田适养品种呆鲤的遗传多样性分析. 水产科学. 2023(05): 795-804 .  百度学术
百度学术
7. 黄皓,范嗣刚,王鹏飞,陈佳,赵超,闫路路,邱丽华,潘滢. 基于微卫星标记对6个花鲈群体的遗传多样性分析. 南方水产科学. 2022(01): 99-106 .  本站查看
本站查看
8. 胡玉婷,凌俊,江河,汪焕,潘庭双,周华兴. 中华绒螯蟹4个养殖群体遗传多样性与遗传结构分析. 江苏农业科学. 2022(16): 54-59 .  百度学术
百度学术
9. 胡玉婷,侯冠军. 安徽省翘嘴鲌野生群体的遗传多样性分析. 生物学杂志. 2022(04): 79-83 .  百度学术
百度学术
10. 罗宇婷,方弟安,周彦锋,徐东坡,彭云鑫,彭飞,张桂宁,刘凯,尤洋. 基于微卫星标记对长江下游鲢遗传多样性现状的分析. 南方水产科学. 2021(06): 48-57 .  本站查看
本站查看
11. 张显波,傅建军,胡锦丽,朱文彬,闵倩雯,赵飞,吴俣学,董在杰. 基于D-loop序列和SSR的从江田鱼与6个鲤群体的遗传分析. 贵州农业科学. 2021(12): 76-85 .  百度学术
百度学术
其他类型引用(5)



 下载:
下载:










 粤公网安备 44010502001741号
粤公网安备 44010502001741号
