Molecular cloning and expression pattern analysis of GLUT1 in black tiger shrimp (Penaeus monodon)
-
摘要:
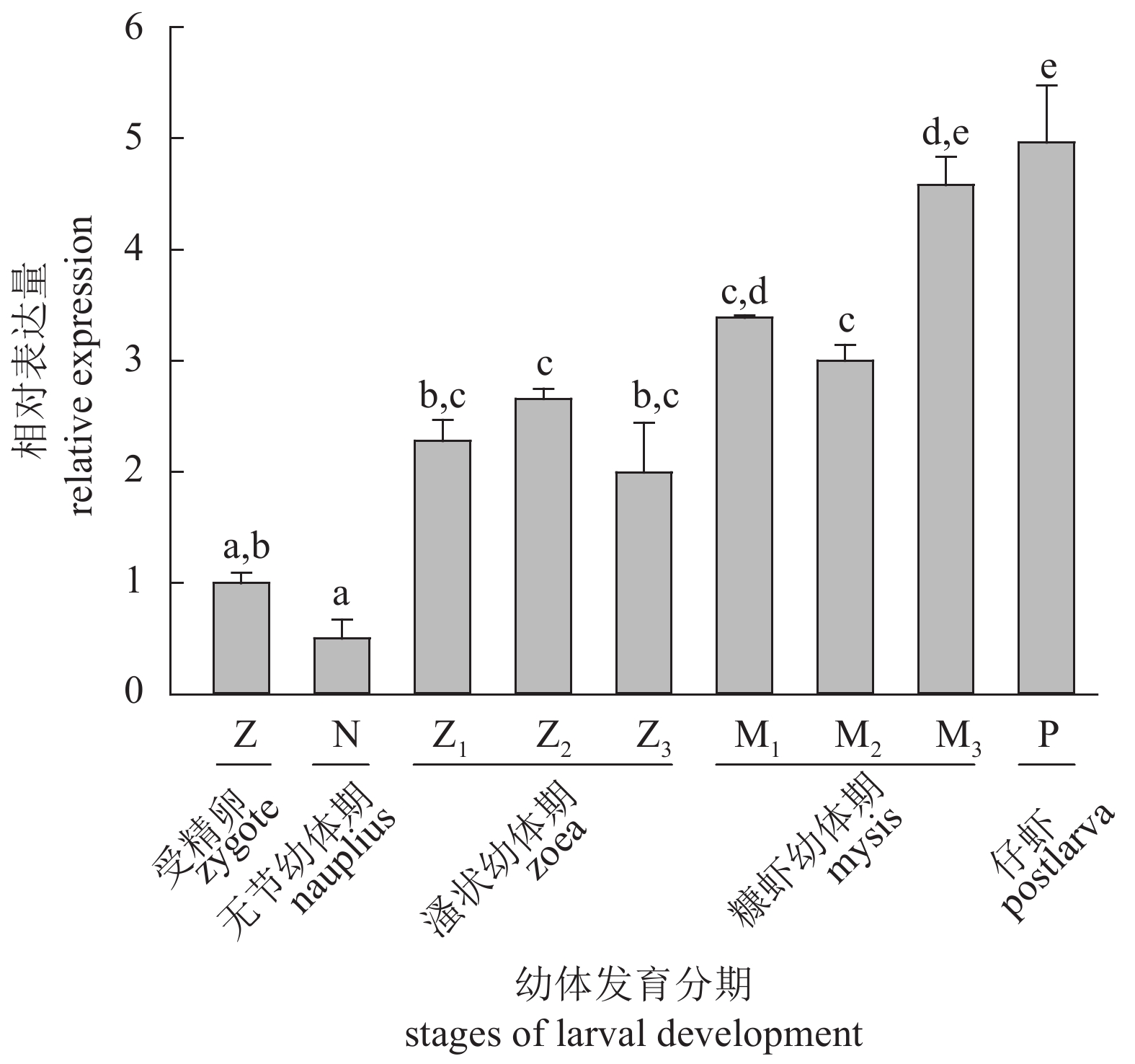
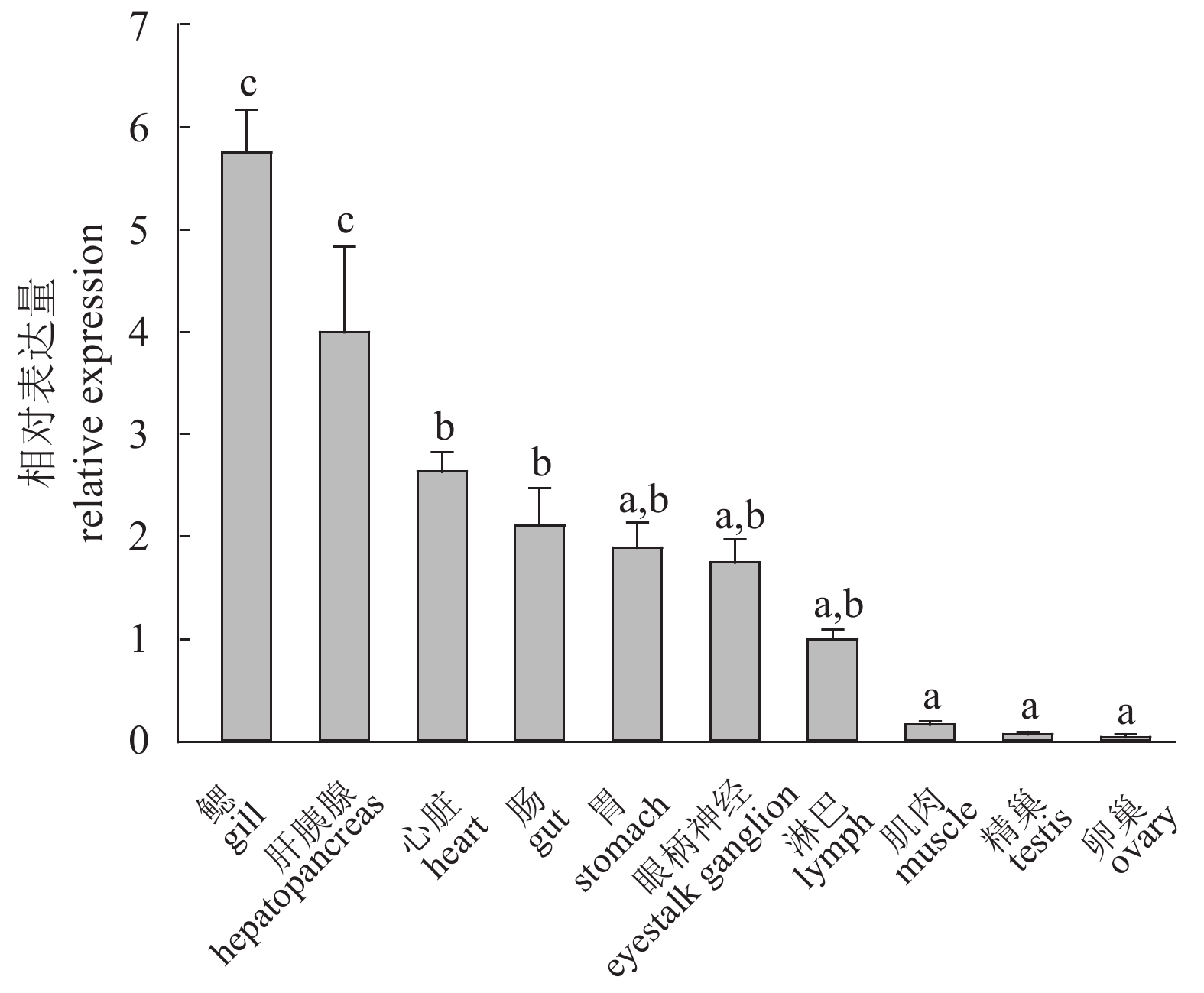
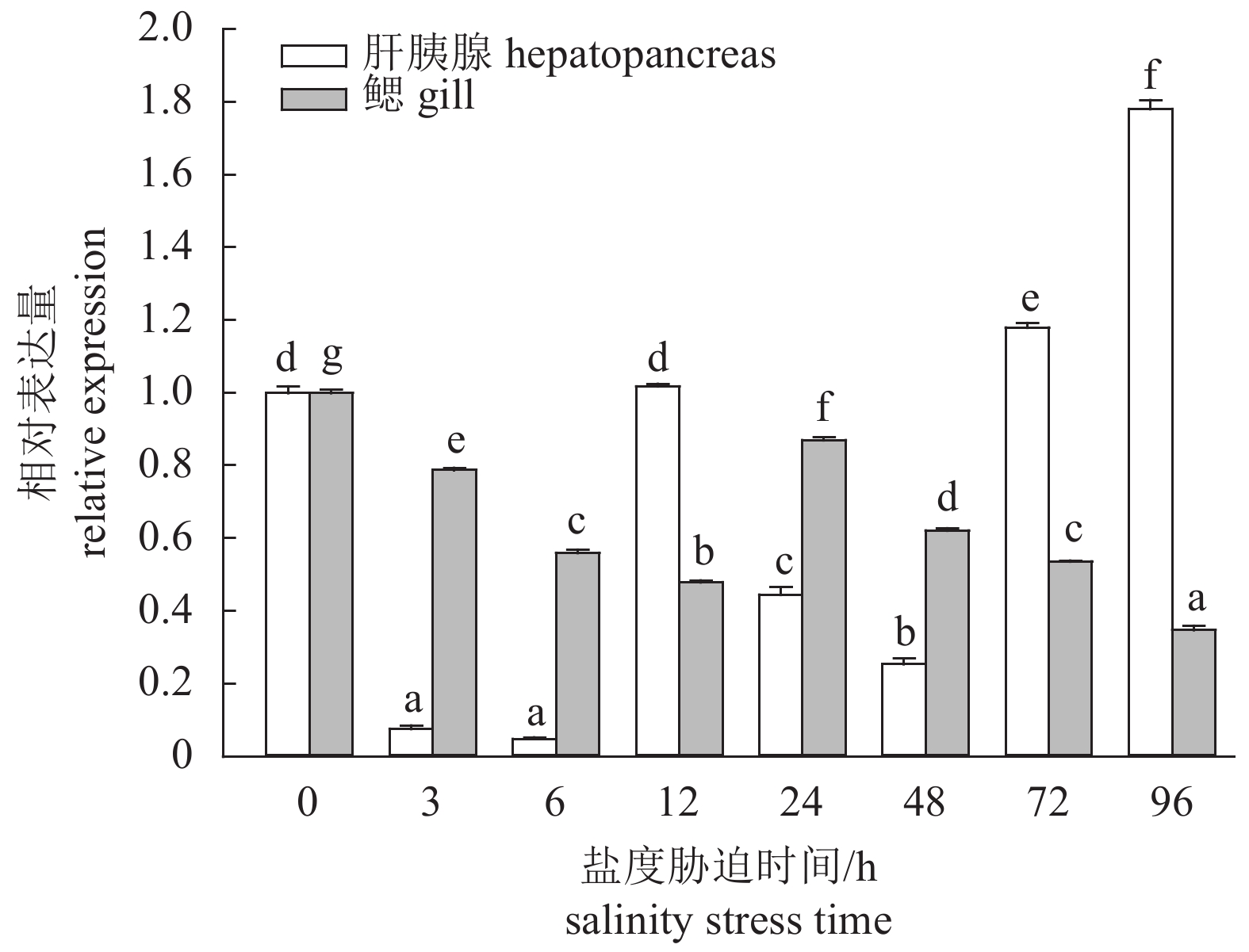
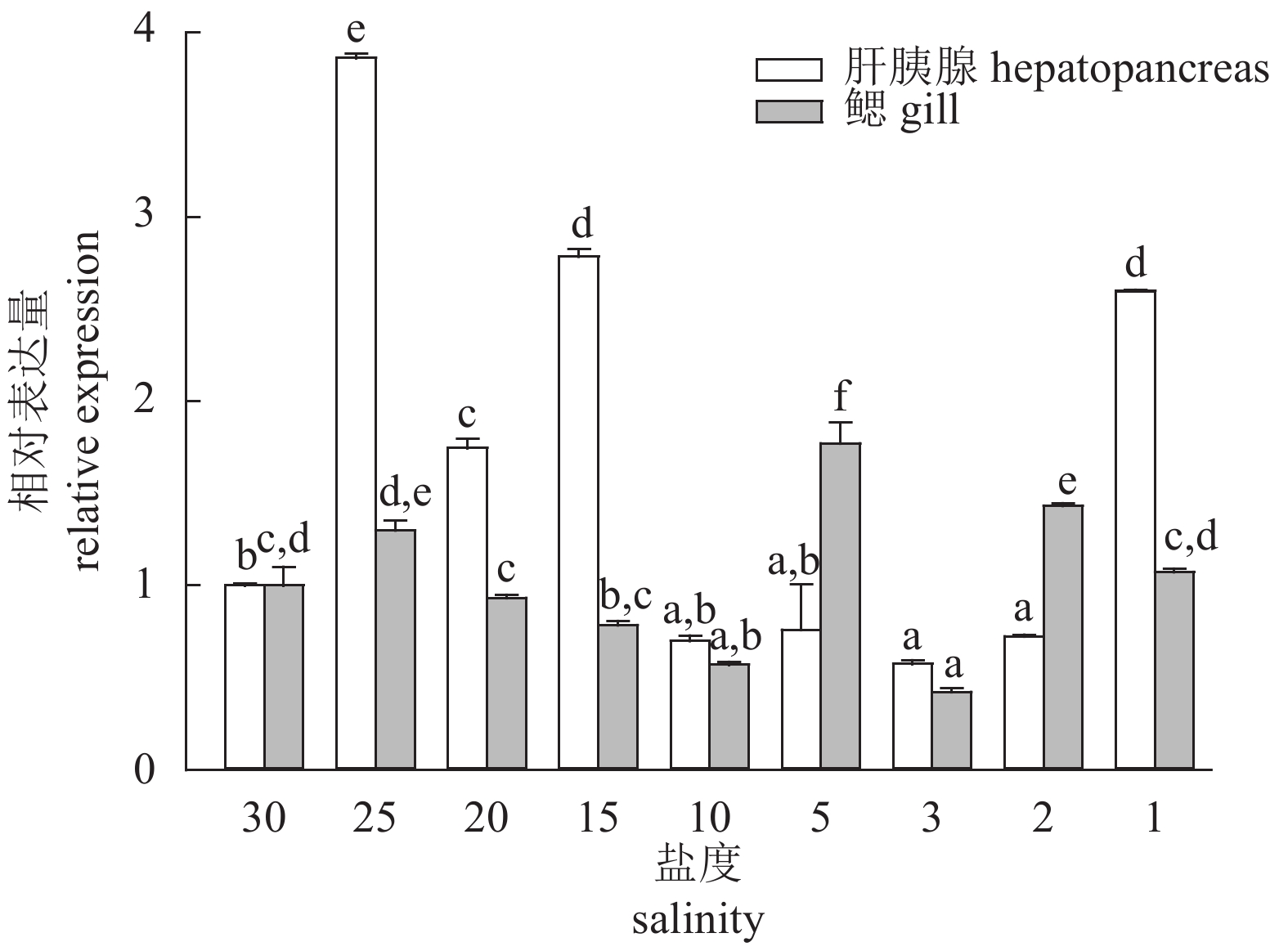
该研究利用RACE技术克隆获得了斑节对虾(Penaeus monodon) GLUT1 (glucose transporter type 1)的cDNA全长序列;采用实时荧光定量的方法研究了PmGLUT1在斑节对虾幼体发育过程中、各个组织中及低盐胁迫下的差异表达情况。该基因cDNA开放阅读框(ORF)全长1 476 bp,可编码491个氨基酸。检测PmGLUT1基因从受精卵至仔虾期发育过程的表达情况,结果显示,PmGLUT1在幼体发育各期的表达量有所波动,但总体呈现上升趋势。组织表达分析发现,PmGLUT1在鳃组织中的表达量最高,肝胰腺次之,在卵巢中的表达量最低。急性低盐胁迫后,PmGLUT1在肝胰腺中的表达水平显著高于对照组(P<0.05),但在鳃中的表达水平显著低于对照组(P<0.05)。研究结果表明,PmGLUT1可能在斑节对虾幼体发育及机体应对低盐胁迫过程中具有重要作用,这为进一步研究葡萄糖转运蛋白基因在斑节对虾幼体发育调控和耐低盐胁迫应答中的分子机制提供了理论依据。
Abstract:We obtained the full-length cDNA sequence of GLUT1 from Penaeus monodon by rapid amplification of cDNA ends (RACE), and investigated the expression of GLUT1 at different larval developmental stages, in different tissues, and under low salinity stress by quantitative real-time PCR. The total cDNA sequence of PmGLUT1 open reading frame (ORF) was 1 476 bp, encoding 491 amino acids. From zygote to postlarva stages, the expression of PmGLUT1 fluctuated but showed an increasing trend. The PmGLUT1 was expressed in all tested tissues with the highest expression in gill tissue, followed by hepatopancreas, and the lowest expression was in ovary. After acute low salinity stress, the expression level of PmGLUT1 mRNA in hepatopancreas was significantly higher than that in the control group, while the expression level in gill was significantly lower than that in the control group (P<0.05). The results show that PmGLUT1 might play an important role at different larval developmental stages and under low salinity stress, which provides a theoretical basis for studying the molecular mechanism of PmGLUT1 in larval development and salinity adaptation of P. monodon.
-
Keywords:
- Penaeus monodon /
- GLUT1 /
- gene cloning /
- larval development /
- low salinity stress
-
企鹅珍珠贝(Pteria penguin Röding)隶属于软体动物门、瓣鳃纲、翼形亚纲、珍珠贝目、珍珠贝科、珍珠贝属,是热带和亚热带的海产大型珍珠贝类[1]。在中国主要分布于广东、广西以及海南省[2]。其生长速度快,个体大(最大个体壳长可达25 cm),常作为培育海水半圆附壳珠的首选贝类。目前,关于企鹅珍珠贝的研究相对较多,大多数集中在苗种繁育[3-7]、养殖技术[8-11]、插核育珠[12-18]、遗传多样性[19-22]等方面。在生长性状研究方面,梁飞龙等[23]观察了在海区养殖企鹅珍珠贝人工苗种的周年生长情况;MILIONE等[10]对澳大利亚东北部不同海区养殖的企鹅珍珠贝的生长进行了比较;LINOY等[11]研究了不同规格企鹅珍珠贝形态与体质量间的相互关系。
生长模型常用于生物的个体生长发育规律研究。近年来,关于水产动物的生长模型的报道主要集中在鱼类[24-27]、虾[28-30]方面。在贝类生长模型研究中,金启增等[31]对华贵栉孔扇贝(Chlamys nobilis)综合生长模型进行了研究;LEE等[32]利用von Bertalanffy模型对淡水珍珠蚌[Margaritifera margaritifera(L.)]的生长规律进行研究,并详细描述了其生长特征;符世伟等[33]利用von Bertalanffy、Brody、Logistic、Gompertz和Richards 5种生长模型对马氏珠母贝(Pinctada martensii)壳长生长进行了比较分析, 发现Brody生长模型能够较好地模拟马氏珠母贝壳长生长规律;刘志刚等[34]和王辉等[35]利用Logistic模型分别拟合了湛江北部湾养殖的墨西哥湾扇贝(Argopecten irradians concentricus)形态性状和体质量性状的生长发育规律;邬思荣等[36]利用von Bertalanffy、Gompertz、Logistic和Brody 4种非线性生长模型对马氏珠母贝红壳色选育系的形态性状及体质量性状的生长发育规律进行了拟合分析,研究表明,Brody模型和von Bertalanffy模型分别为马氏珠母贝形态性状和体质量的最优生长模型。CHEN等[37]开展了背角无齿蚌(Pinctada margaritifera)生长模型研究,结果表明,在0~60 d养殖期中壳长遵循Logistic模型,而60~750 d养殖过程中壳长生长遵循von Bertalanffy模型。目前,对于企鹅珍珠贝生长模型方面的研究,仅见于顾志峰等[38]利用单一生长模型建立了海南黎安养殖条件下企鹅珍珠贝的生长模型。为进一步验证不同生长模型对企鹅珍珠贝海区养殖中生长性状的模拟效果,该研究采用von Bertalanffy、Gompertz、Logistic 3个生长模型对海南陵水新村港海区养殖企鹅珍珠贝生长曲线进行拟合分析,以期揭示企鹅珍珠贝海区养殖过程中形态性状和体质量性状生长发育规律,为企鹅珍珠贝的养殖管理、健康养殖及插核育珠提供基础资料。
1. 材料与方法
1.1 实验材料
企鹅珍珠贝亲本来源于广东徐闻野生企鹅珍珠贝,收集后利用低温运输方法运至中国水产科学研究院南海水产研究所热带水产研究开发中心海南陵水新村试验站贝架进行吊养催熟。2011年1月选用40个性腺发育成熟的野生企鹅珍珠贝为亲本,阴干刺激2 h后,采用群体自排法获得企鹅珍珠贝苗种幼体。经水泥池培育3个月后,移至海南省陵水新村港贝架(109°59'40.11″N,18°25'01.48″E)进行养殖。该养殖海区盐度为27.58~32.74,水温变化为22.19~30.30 ℃,平均水温为27.25 ℃,养殖海区平均水深为7 m,养殖期间海区透明度为1.5~3.0 m。根据水质调查结果,养殖区域表层叶绿素a质量浓度的变化为2.100~17.562 mg·m-3,平均为6.41 mg·m-3;浮游植物丰度变化为34.56×104~122.73×104个·m-3,平均为72.47×104个·m-3。
1.2 养殖管理
2011年4月10日将培育的壳长为(10±0.5) mm的企鹅珍珠贝苗种移至海区养殖。在养殖初期,利用网孔径为0.8 cm网袋套在规格为30 cm×30 cm×20 cm的拱形铁框进行养殖,贝苗放养密度为150粒·笼-1;当壳长达到30 mm左右时,改用网孔径为2.0 cm、笼底径30 cm的单圈养成笼进行养殖,养殖密度调整至30个·笼-1;当贝体壳长至60 mm左右,调整养殖密度至15个·笼-1;贝体壳长达80 mm左右,调整养殖密度至5~6个·笼-1。全程采用吊养方式,养殖方法和养殖管理参照珍珠贝常规养殖方法[39]。
1.3 数据测量
2011年4月10日企鹅珍珠贝贝苗出池后移至海区养殖。每个月定期对企鹅珍珠贝生长数据进行测量,第一次数据测量在5月10日,此时贝体壳长平均为(18.66±1.28) mm,体质量平均为(0.29±0.05) g。整个养殖周期为17个月,2012年9月10日数据测量结束。为了减少吊养贝笼间养殖效应对数据测量造成的误差,根据不同养殖阶段的养殖密度,随机从同一养殖群体中取若干笼企鹅珍珠贝,确保每次取样群体的贝数至少在1 000只以上,将其倒出再混合均匀从中随机抽取50只,对贝体附着物进行清除、洗净后对其生长性状进行测量。
企鹅珍珠贝壳长(shell length,SL)、壳高(shell height,SH)、壳宽(shell width,SW)形态性状以电子游标卡尺测量(图 1),精度为±0.01 mm;利用电子天平对体质量性状(total weight,TW)进行测量,精度为±0.01 g。
1.4 生长模型
利用von Bertalanffy、Gompertz、Logistic 3个生长模型分别对企鹅珍珠贝形态性状和体质量进行拟合。各模型形式为:
模型 表达式 拐点t 拐点Y
von Bertalanffy y=B[1-aexp(-kt)]3 k-1ln(3a) 8B/27
Gompertz y=Bexp[-aexp(-kt)] k-1lna B/e
Logistic y=B[1+aexp(-kt)]-1 k-1lna B/e
其中y为待拟合的各生长性状在t时的值,参数B为各生长性状的生长极限,a为增长初始值参数,e为欧拉常数,参数k为各性状的瞬间生长速率,t为养殖时间(月)[33, 36]。
1.5 数据处理分析
采用SPSS 18.0统计软件对企鹅珍珠贝各生长性状的数据进行分析处理。使用Levenberg-Marquardt迭代法[40-41]逐次迭代估计模型中3个生长参数,收敛标准为10-8。根据收敛的结果拟合算出参数B、a、k的最优估计值,建立企鹅珍珠贝各生长性状的最佳生长模型,并根据其参数估计值,计算出企鹅珍珠贝的拐点月龄、拐点值以及最大月增量。模型的参数初始值设置需根据贝体各性状的实际生长情况和养殖经验而定。一般而言,生长参数初值的设置并不影响参数收敛的全局最优化,仅影响迭代的次数[42]。
2. 结果
2.1 企鹅珍珠贝生长性状的测量
海区养殖17个月的企鹅珍珠贝生长数据见表 1。随着养殖时间的增加,企鹅珍珠贝的形态性状(壳长、壳高以及壳宽)和体质量均呈现不断增长的趋势,其中壳长、壳高以及壳宽在养殖前期生长速度较快,随后生长速度逐渐下降。而体质量的生长速度在整个养殖周期中呈现“慢-快-慢”的生长趋势,其中在养殖前6个月生长速度较慢,6~10个月时生长速度逐渐加快,在养殖10个月以后,体质量的生长速度又呈现下降趋势。
表 1 企鹅珍珠贝不同生长时期性状的统计量(n=50)Table 1. Statistics of traits of P. penguin at different developmental stages日期
date平均数±标准差 X±SD 壳长/mm shell length 壳高/mm shell height 壳宽/mm shell width 体质量/g total weight 2011.05 18.66±1.28 10.04±0.35 3.56±0.49 0.29±0.05 2011.06 25.88±3.36 15.64±1.81 5.14±0.65 0.86±0.27 2011.07 32.78±4.72 21.68±3.03 7.00±0.76 2.04±0.60 2011.08 47.24±6.39 36.28±4.58 11.26±1.28 7.16±2.40 2011.09 53.98±7.70 42.88±5.28 13.18±1.58 11.79±3.73 2011.10 61.88±8.79 49.68±7.05 15.62±1.82 18.36±6.32 2011.11 69.22±8.15 57.44±5.78 17.84±1.61 27.03±7.36 2011.12 72.68±9.34 61.88±6.44 19.90±1.86 36.36±9.29 2012.01 78.48±8.66 69.98±6.74 23.50±1.74 56.07±13.04 2012.02 82.24±8.13 73.88±6.44 24.60±1.58 66.02±11.99 2012.03 82.84±8.41 75.16±6.34 26.60±2.22 71.59±14.48 2012.04 84.76±9.04 79.16±7.11 28.12±2.10 83.60±18.30 2012.05 85.68±9.01 81.24±6.97 29.68±2.40 91.62±17.57 2012.06 90.72±8.54 85.20±9.00 31.80±2.97 107.86±24.70 2012.07 91.18±9.10 86.14±7.74 32.88±3.08 116.96±26.52 2012.08 91.84±9.66 87.46±7.86 33.68±3.37 122.88±26.22 2012.09 92.15±13.23 87.91±7.44 34.64±2.59 124.74±20.69 2.2 企鹅珍珠贝各生长性状的模型拟合
根据企鹅珍珠贝形态性状的实际生长情况,预设4种生长模型对壳长、壳高、壳宽以及体质量模拟的生长参数初值。其中壳长、壳高的参数设置为B=100,a=5,k=0.6;壳宽的初始值设置为B=40,a=5,k=0.3;体质量的参数值为B=100,a=5,k=0.6。利用von Bertalanffy、Gompertz和Logistic 3种生长模型对企鹅珍珠贝各生长性状生长曲线进行拟合,各模型参数估计和拟合精度结果见表 2。3种生长模型对企鹅珍珠贝壳长、壳高、壳宽以及体质量的拟合程度均较高,各模型的预测标准误为0.269~15.090,相关系数R2均大于0.99,方差分析(ANOVA)结果表明各模型F值均存在统计学意义(P < 0.01)。由图 2可见,这3种生长模型对企鹅珍珠贝壳长、壳高、壳宽和体质量的拟合效果均较佳。
表 2 企鹅珍珠贝4个生长性状的参数估计及拟合精度Table 2. Parameter estimates and fitting of growth models of four growth traits of P. penguin生长性状
growth trait生长模型
growth model参数
parameter估计
estimate预测标准误
residualR2 F 显著性
sig.壳长shell length von Bertalanffy B 95.019 a 0.559 2.441 0.996 29 629.045 < 0.001 k 0.238 Gompertz B 93.519 a 2.206 2.240 0.997 29 629.986 < 0.001 k 0.277 Logistic B 90.949 a 5.218 3.890 0.994 29 622.285 < 0.001 k 0.394 壳高shell height von Bertalanffy B 93.020 a 0.682 2.070 0.997 24 155.088 < 0.001 k 0.217 Gompertz B 90.641 a 2.869 2.290 0.997 24 154.062 < 0.001 k 0.261 Logistic B 87.047 a 8.296 5.837 0.993 24 137.507 < 0.001 k 0.391 壳宽shell width von Bertalanffy B 41.674 a 0.656 0.211 0.998 3 101.624 < 0.001 k 0.142 Gompertz B 39.075 a 2.802 0.269 0.998 3 101.355 < 0.001 k 0.183 Logistic B 35.623 a 8.644 0.722 0.994 3 099.239 < 0.001 k 0.303 体质量total weight von Bertalanffy B 181.874 a 1.243 8.422 0.997 28 816.964 < 0.001 k 0.143 Gompertz B 157.755 a 7.384 7.848 0.997 28 819.641 < 0.001 k 0.208 Logistic B 133.361 a 65.152 15.090 0.994 28 785.846 < 0.001 k 0.401 在对企鹅珍珠贝壳长生长性状的拟合中,Gompertz模型的拟合度最高,为0.997,估计的生长极限为93.519 mm,与其壳长的实际生长接近。在壳高和壳宽的拟合过程中,von Bertalanffy和Gompertz 2种模型的拟合度均相等,但Gompertz模型的拟合生长极限相对von Bertalanffy模型更接近企鹅珍珠贝壳高的实际生长情况。而在体质量的拟合过程中,Logistic模型的增长初始值参数a的估计值为65.152,明显与企鹅珍珠贝体质量生长的实际情况不符,不适合作为企鹅珍珠贝体质量生长曲线的拟合模型。虽然von Bertalanffy和Gompertz模型的拟合度相等,但von Bertalanffy模型的生长极限的估计值为181.874 g,偏离了企鹅珍珠贝体质量的实际生长。综合3种生长模型对企鹅珍珠贝形态性状和体质量的拟合结果分析,Gompertz模型可作为企鹅珍珠贝壳长、壳高、壳宽以及体质量的最适拟合模型。
2.3 企鹅珍珠贝生长性状的生长拐点及最大月增量
Gompertz模型作为企鹅珍珠贝生长性状的最适模型,根据表 2中参数估计得出其对各生长性状y随时间t(月)的生长方程如下:
$$ \begin{aligned} & \quad y_{\mathrm{SL}}=93.519 \times \mathrm{e}^{\left(-2.206 \times \mathrm{e}^{-0.277 t)}\right)} ; y_{\mathrm{SH}}=90.641 \times \\ & \mathrm{e}^{\left(-2.869 \times \mathrm{e}^{-0.261 t)}\right.} \\ & \quad y_{\mathrm{SW}}=39.075 \times \mathrm{e}^{\left(-2.802 \times \mathrm{e}^{-0.183 t)}\right.} ; y_{\mathrm{TW}}=157.755 \\ & \times \mathrm{e}^{\left(-7.384 \times \mathrm{e}^{-0.208 t)}\right.}。 \end{aligned} $$ 整个生长过程中生长速率最大值点即是生长曲线的拐点。企鹅珍珠贝各生长性状的拐点时间存在明显差异,其中壳长的拐点时间出现的最早,出现在第2.86个月,其拐点性状值为34.40 mm,经拟合后的最大月增量为9.53 mm·月-1;壳高的生长拐点出现的时间比壳长晚1.16个月,其拐点性状值为33.34 mm;壳宽的拐点时间出现在第5.63个月,拐点性状值为14.37 mm;体质量的拐点时间出现最晚,出现在第9.61个月,但其最大月增量在4个生长性状中最大,为12.07 g·月-1(表 3)。
表 3 企鹅珍珠贝各生长性状的生长拐点及最大月增量Table 3. Growth inflection points and maximum monthly increment of growth traits of P. penguin生长性状
growth trait拐点时间/月
time of inflection point/month拐点性状值
character value of inflection point最大月增量
maximum monthly increment壳长/mm shell length 2.86 34.40 9.53 壳高/mm shell height 4.04 33.34 8.70 壳宽/mm shell width 5.63 14.37 2.63 体质量/g total weight 9.61 58.03 12.07 2.4 企鹅珍珠贝生长性状的绝对和相对生长速度
生长过程中不同阶段所测量的性状值仅反映了生物体该性状在某一时间点前期的生长积累,无法有效地反映出生物体在生长过程中某一时刻的生长速度。因此,需对模型的一阶导数的运算得到该生物性状在其生长过程中某一时刻点的瞬时生长速度[33-36, 42]。Gompertz模型拟合下企鹅珍珠贝各生长性状的绝对生长速度见图 3-a。企鹅珍珠贝各生长性状间的绝对生长速度在不同生长期内差异较大,但随着月龄的增大均呈现先增加后降低的趋势。其中在初期的0~5个月,壳长、壳高及壳宽的绝对生长速度大小依次为SL>SH>SB,而在5个月后,壳高的绝对生长速度相对于壳长有所加快,壳宽的绝对生长速度仍相对较低,3个形态性状的绝对生长速度在实际结束时均较小,趋向于0。而体质量的绝对生长速度在0~6个月时均小于壳长和壳高,但6个月后明显增大,在养殖结束期仍保持在5.69 g·月-1,并表现出持续下降的趋势。不同生长性状的绝对生长速度出现峰值的时间也存在差异,其中壳长约为3个月,壳高约为4个月,壳宽约5.5个月,而体质量约9.5个月,这与表 3中各生长性状的拐点时间基本上一致。
相对增长速度是性状的绝对增长速度与相对应时间点的性状值的比值[34, 43]。Gompertz模型的相对生长速度经简化后公式为k(ln B-ln yt),根据相关参数计算出企鹅珍珠贝各生长性状的相对生长速度,结果见图 3-b。企鹅珍珠贝各生长性状的相对生长速度在养殖初期相对较大,之后均随着月龄的增加而逐渐降低,养殖末期相对生长速度接近于0, 由此可见其增长已进入停滞期。体质量的相对生长速度较其他3个性状而言最大,而壳长(SL)的相对生长速度在前6个月内下降速度最快,其他性状相对生长速度下降趋势基本保持一致。
3. 讨论
3.1 不同养殖海域企鹅珍珠贝生长比较
企鹅珍珠贝的适宜生长温度为20~30 ℃,适宜盐度为26~33[39]。该实验中,养殖海区盐度为27.58~32.74,水温变化幅度为22.19~30.30 ℃,适合企鹅珍珠贝的生长。经过海区养殖17个月后,企鹅珍珠贝壳长、壳高、壳宽和体质量4个生长性状平均值分别为(92.15±13.23)mm、(87.91±7.44)mm、(34.64±2.59) mm和(124.74±20.69) g。在养殖前期,企鹅珍珠贝形态性状生长速度较快,随后逐渐下降。而体质量的生长速度在整个养殖周期中呈现“慢-快-慢”的趋势,这一结果符合贝类一般生长规律。梁飞龙等[23]报道了湛江市流沙港海区养殖企鹅珍珠贝的生长情况,平均壳高为3.13 mm的企鹅珍珠贝幼苗经过12个月的海区养殖平均壳长、壳高、壳宽分别可达58.12 mm、69.18 mm、22.17 mm。顾志峰等[38]观察了室内培育56 d的企鹅珍珠贝幼贝在海南黎安港养殖生长情况,经过716 d的养殖,企鹅珍珠贝的壳高(SH)、最大对角线长(MDL)、绞合线长(HL)和总质量(TW)分别达到83.29 mm、110.84 mm、83.61 mm和90.70 g。由此可见,贝体的大小对贝体的生长存在一定的影响,同时养殖季节、海域环境条件等不同,贝体的生长速度也有差异。
3.2 企鹅珍珠贝最适生长模型选择
生物生长是生物体种群动力学的重要研究内容。生物体的生长发育与年龄的增加密切相关,呈现出规律性和连续性变化,常用生长曲线加以描述[44]。一般而言,生物的生长曲线常呈现S型,根据其生长曲线曲率的变化,可将其划分为初始生长阶段、指数生长阶段和稳定生长阶段3个生长阶段[35, 45]。在动物生长最适模型的研究上,不同物种或同一物种的研究结果也不尽相同,可能与研究对象的生长环境有关[46]。此外,不同的发育阶段也会呈现不同的生长模式[37, 47]。因此,生长模型的拟合效果需根据其与实际生长值的偏离程度而定,偏离程度越小,模型拟合效果越佳。
企鹅珍珠贝的自然寿命约为10年[48]。影响企鹅珍珠贝生长的因素是多方面的,如海区水质、饵料、温度、盐度、管理水平之间的差异等。成体企鹅珍珠贝壳长约21 cm,壳高约18 cm,厚约4 cm,个体大的壳高可达25 cm。企鹅珍珠贝在第1年的生长速度最快,第2至第3年次之,3年以后生长速度明显下降[39, 49]。该研究测量了企鹅珍珠贝海区养殖17个月的生长数据,此时贝体正处在生长速度最快的初始生长阶段。因此,该研究所模拟的只是其生长的最初阶段。目前在中国南海海域,珍珠贝的遗传选育都是在其生长至1龄左右,利用早期生长记录建立其最优生长模型并根据该模型做出可靠的预测,对企鹅珍珠贝选种具有较大实际意义。
为了揭示企鹅珍珠贝早期生长阶段生长性状的增长规律,该研究利用Logistic、von Bertalanffy和Gompertz 3种非线性模型对企鹅珍珠贝的形态性状和体质量性状生长曲线进行模拟。结果表明3种模型均能较好地拟合企鹅珍珠贝生长性状的生长过程,R2均大于0.990(表 2)。然而,不同曲线对企鹅珍珠贝各生长性状的生长过程拟合所得的极限生长值B、增长初始值参数a以及瞬间生长速率k均存在较大的差异。尽管3个生长模型曲线与企鹅珍珠贝各性状的实际生长拟合度较高(图 2),但综合其实际生长情况,Gompertz模型可作为企鹅珍珠贝壳长、壳高、壳宽以及体质量的最适拟合模型,符合企鹅珍珠贝各性状的实际生长规律。
3.3 企鹅珍珠贝各形态性状生长特征及研究意义
研究表明,贝类的形态性状在早期的生长中生长速度较快,随后生长速度下降;而体质量性状在养殖前期生长速度较慢,随后增大,但达到一定阶段后又减缓[50-51]。利用Gompertz模型对企鹅珍珠贝各性状的生长拐点进行分析,结果表明,不同性状的生长拐点间存在明显差异,生长拐点出现的时间按先后顺序依次为: 壳长(2.86个月) < 壳高(4.04个月) < 壳宽(5.63个月) < 体质量(9.61个月),其中体质量的拐点时间相对于形态性状而言明显滞后。与邬思荣等[36]报道的用Gompertz模型拟合的马氏珠母贝红壳色选育品系的生长性状拐点时间相比,企鹅珍珠贝各性状的生长拐点均比马氏珠母贝红壳色选育系各性状的生长拐点出现的晚,其中两者壳长的生长拐点时间相差不大,而壳宽的生长拐点出现时间相差最大,为2.047个月。由此可见,拐点月龄的不同可能与品种、养殖条件以及养殖管理有关。
企鹅珍珠贝形态性状的绝对生长速度在养殖初期的2~6个月内较快,随后逐渐下降,而体质量的绝对生长速度在0~9个月内随着月龄的增加逐渐增大,在9个月左右达到峰值,之后也随着月龄的增大逐渐下降。这一结果显示在养殖过程中企鹅珍珠贝SL和SH的生长提前和SW、TW的生长延缓。SW和TW的生长延缓具有一定的生物学意义和生产意义。研究表明,当贝类处于养殖环境条件恶劣或进入生长衰退期时,壳长及壳高首先出现生长下降或停滞,而此时生长轮纹的增加导致壳缘增厚,使得壳宽加大、壳内容积相应拓宽、软体部快速生长,从而使得其体质量得到明显增加[34]。企鹅珍珠贝作为培育海水珍珠的优良品种之一,其壳宽的大小对其插核具有重要意义,同时体质量的大小在一定程度上反映了贝体的健康状态。因此,在对企鹅珍珠贝的选育或插核育珠过程中,除了考虑壳高的影响外,还应考虑壳宽和体质量这2个指标。在实际生产中,可根据建立的企鹅珍珠贝生长模型对其生长进行预测,根据不同阶段的生长特点确定企鹅珍珠贝的养殖生长潜力,优化养殖管理模式,实现企鹅珍珠贝更好地生长。此外,在企鹅珍珠贝优良性状新品系的选育过程中,可根据生长模型的参数对相同养殖环境和养殖管理下的企鹅珍珠贝家系或群体进行选育,筛选具有最大生长极限的家系或群体作为下一代家系或群体亲本,最终获得具有优良性状的新品种或新品系。
-
表 1 实验中所用引物序列
Table 1 Oligonucleotide primers used in this experiment
引物
primer引物序列 (5'–3')
primer sequence用途
functionGLUT1-F ATGGCTTATTCGGGTTTAACGT cDNA序列验证 GLUT1-R TTATAGTTTGGCCTCCTCTTTGG GLUT1-3'GSP1 ATGATTGGTGGTTTCTGCGGTGGC 3'RACE GLUT1-3'GSP2 CTCTCAACCTGCGTGGTGGGCTG GLUT1-5'GSP1 CCAGACCCGCAGCCGTGAATAGG 5'RACE GLUT1-5'GSP2 CTACTATGCCACCGCAGAAACCACC GLUT1-qPCR-F CTTCTTGTGTTACGCCATCTTC real-time RT-PCR GLUT1-qPCR-R TGCTGCCTTCAATGTTCCT EF-1α-qPCR-F AAGCCAGGTATGGTTGTCAACTTT real-time RT-PCR EF-1α-qPCR-R CGTGGTGCATCTCCACAGACT -
[1] 江诚, 谢俊, 陈海峰. 葡萄糖转运蛋白的转运机制研究[J]. 基因组学与应用生物学, 2015, 34(7): 1372-1377. [2] ULDRY M, THORENS B. The SLC2 family of facilitated hexose and polyol transporters[J]. Pflugers Arch, 2004, 447(5): 480-489. doi: 10.1007/s00424-003-1085-0
[3] AUGUSTIN R. The protein family of glucose transport facilitators: it's not only about glucose after all[J]. IUBMB Life, 2010, 62(5): 315-333.
[4] 王尔孚, 李昕, 贾春松, 等. 低氧预适应上调大鼠海马神经元和星形胶质细胞在急性缺氧时的葡萄糖转运蛋白的活性和基因表达[J]. 基础医学与临床, 2009, 29(12): 1273-1276. [5] 邱萤, 黄桂菊, 刘宝锁, 等. 企鹅珍珠贝GLUT1基因全长cDNA克隆及其对葡萄糖的表达响应[J]. 南方水产科学, 2016, 12(5): 81-89. doi: 10.3969/j.issn.2095-0780.2016.05.010 [6] 任鸣春. 军曹鱼和虹鳟糖类营养生理研究[D]. 青岛: 中国海洋大学, 2012: 115-135. [7] BALMACEDA-AGUILERA C, MARTOS-SITCHA J A, MANCERA J. Cloning and expression pattern of facilitative glucose transporter 1 (GLUT1) in gilthead sea bream Sparus aurata in response to salinity acclimation[J]. Comp Biochem Physiol A, 2012, 163(1): 38-46. doi: 10.1016/j.cbpa.2012.04.026
[8] MARTINEZ-QUINTANA J A, PEREGRINO-URIARTE A B, GOLLAS-GALVÁN S, et al. The glucose transporter 1-GLUT1-from the white shrimp Litopenaeus vannamei is up-regulated during hypoxia[J]. Mol Biol Rep, 2014, 41(12): 7885-7898. doi: 10.1007/s11033-014-3682-8
[9] WANG X D, LI E C, CHEN K, et al. Response of facilitative glucose transporter 1 to salinity stress and dietary carbohydrate nutrition in white shrimp Litopenaeus vannamei[J]. Aquacult Nutr, 2017, 23(1): 90-100. doi: 10.1111/anu.2017.23.issue-1
[10] LI R X, LIU H Y, DONG X H, et al. Molecular characterization and expression analysis of glucose transporter 1 and hepatic glycolytic enzymes activities from herbivorous fish Ctenopharyngodon idellus in respond to a glucose load after the adaptation to dietary carbohydrate levels[J]. Aquaculture, 2018, 492: 290-299. doi: 10.1016/j.aquaculture.2018.04.028
[11] LIU H Y, DONG X H, CHI S Y, et al. Molecular cloning of glucose transporter 1 in grouper Epinephelus coioides and effects of an acute hyperglycemia stress on its expression and glucose tolerance[J]. Fish Physiol Biochem, 2017, 43(1): 103-114. doi: 10.1007/s10695-016-0271-x
[12] 杨其彬, 叶乐, 温为庚, 等. 盐度对斑节对虾蜕壳、存活、生长和饲料转化率的影响[J]. 南方水产, 2008, 4(1): 16-21. doi: 10.3969/j.issn.2095-0780.2008.01.003 [13] 滕继林, 肖军. 葡萄糖转运蛋白1的研究进展[J]. 生物学教学, 2015, 40(6): 2-3. [14] 江世贵, 杨丛海, 周发林, 等. 斑节对虾种虾繁育技术[M]. 北京: 海洋出版社, 2013: 80-81. [15] YANG L, LI X, JIANG S, et al. Characterization of Argonaute2 gene from black tiger shrimp (Penaeus monodon) and its responses to immune challenges[J]. Fish Shellfish Immunol, 2014, 36(1): 261-269. doi: 10.1016/j.fsi.2013.11.010
[16] 吴勉之, 杨丽诗, 周发林, 等. 斑节对虾2种高血糖激素家族基因的基因组序列分析和表达研究[J]. 南方水产科学, 2018, 14(4): 27-36. doi: 10.3969/j.issn.2095-0780.2018.04.004 [17] 邱萤. 企鹅珍珠贝葡萄糖转运蛋白1同源异构型基因的克隆及对葡萄糖应激的表达响应分析[D]. 上海: 上海海洋大学, 2016: 41-46. [18] HALL J R, MACCORMACK T J, BARRY C A, et al. Sequence and expression of a constitutive, facilitated glucose transporter (GLUT1) in Atlantic cod Gadus morhua[J]. J Exp Biol, 2004, 207(26): 4697-4706. doi: 10.1242/jeb.01346
[19] MORRIS S. Neuroendocrine regulation of osmoregulation and the evolution of air-breathing in decapod crustaceans[J]. J Exp Biol, 2001, 204(5): 979-989.
[20] VINAGRE A S, da SILVA R S M. Effects of fasting and refeeding on metabolic processes in the crab Chasmagnathus granulata (Dana, 1851)[J]. Can J Zool, 2002, 80(8): 1413-1421. doi: 10.1139/z02-122
[21] WANG X D, LI E C, XU Z X, et al. Molecular response of carbohydrate metabolism to dietary carbohydrate and acute low salinity stress in Pacific white shrimp Litopenaeus vannamei[J]. Turkish J Fish Aquat Sci, 2017, 17(1): 153-169.
[22] SÁNCHEZ-PAZ A, GARCÍA-CARREÑO F, HERNÁNDEZ-LÓPEZ J, et al. Effect of short-term starvation on hepatopancreas and plasma energy reserves of the Pacific white shrimp (Litopenaeus vannamei)[J]. J Exp Mar Bio Ecol, 2007, 340(2): 184-193. doi: 10.1016/j.jembe.2006.09.006
[23] OLIVEIRA G T, da SILVA R S M. Hepatopancreas gluconeogenesis during hyposmotic stress in crabs Chasmagnathus granulata maintained on high-protein or carbohydrate-rich diets[J]. Comp Biochem Physiol B, 2000, 127(3): 375-381. doi: 10.1016/S0305-0491(00)00274-1
[24] ROSAS C, CUZON G, GAXIOLA G, et al. Metabolism and growth of juveniles of Litopenaeus vannamei: effect of salinity and dietary carbohydrate levels[J]. J Exp Mar Bio Ecol, 2001, 259(1): 1-22. doi: 10.1016/S0022-0981(01)00222-2
[25] CARMONA R, GARCÍA-GALLEGO M, SANZ A, et al. Chloride cells and pavement cells in gill epithelia of Acipenser naccarii: ultrastructural modifications in seawater-acclimated specimens[J]. J Fish Biol, 2004, 64(2): 553-566. doi: 10.1111/jfb.2004.64.issue-2
[26] 王晓杰, 张秀梅, 姜明. 盐度胁迫对许氏平鲉鳃、头肾、脾脏超微结构的影响[J]. 中国海洋大学学报(自然科学版), 2006(S1): 85-90. [27] 王艳, 胡先成. 不同盐度下鲈鱼稚鱼鳃的显微结构观察[J]. 海洋科学, 2009, 33(12): 138-142. [28] 张硕, 董双林. 饵料和盐度对中国对虾幼虾能量收支的影响[J]. 大连水产学院学报, 2002, 17(3): 227-233. doi: 10.3969/j.issn.1000-9957.2002.03.009 [29] YE L, JIANG S G, ZHU X M, et al. Effects of salinity on growth and energy budget of juvenile Penaeus monodon[J]. Aquaculture, 2009, 290(1/2): 140-144.
[30] YIN S J, ZHANG L M, ZHANG L L, et al. Metabolic responses and arginine kinase expression of juvenile cuttlefish (Sepia pharaonis) under salinity stress[J]. Int J Biol Macromol, 2018, 113: 881-888. doi: 10.1016/j.ijbiomac.2018.03.036
-
期刊类型引用(11)
1. 方增冰,梅泊承,赵淳朴,徐继林,王丹丽,徐善良. 春季和秋季播苗的缢蛏(Sinonovacula constricta)生长模型及肥满度比较研究. 海洋与湖沼. 2024(03): 736-745 .  百度学术
百度学术
2. 潘渊博,孙秀俊,郭贺,林忠洲,徐建峰,周成旭. 围隔生境下养殖密度对菲律宾蛤仔生长的影响. 中国海洋大学学报(自然科学版). 2023(01): 53-65 .  百度学术
百度学术
3. 张凯强,李刚,王庆龙,张龙,陈志方,温海深,李吉方,徐扬涛. 淡水养殖花鲈形态性状与体质量的相关性及通径分析. 中国海洋大学学报(自然科学版). 2023(09): 58-68 .  百度学术
百度学术
4. 黄俊杭,陈舜,房景辉,倪孝品,陈万东,谢尚微,于瑞海,郑小东. 南麂海域“海大系列”长牡蛎新品种筏式笼养效果评估. 中国海洋大学学报(自然科学版). 2023(11): 24-32 .  百度学术
百度学术
5. 汪福保,程光兆,董浚键,孙成飞,王淼,卢迈新,叶星. 人工配合饲料池塘养殖翘嘴鳜广清1号生长模型构建. 广东农业科学. 2022(05): 125-132 .  百度学术
百度学术
6. 方伟,周胜杰,赵旺,杨蕊,胡静,于刚,马振华. 黄鳍金枪鱼5月龄幼鱼形态性状对体质量的相关性及通径分析. 南方水产科学. 2021(01): 52-58 .  本站查看
本站查看
7. 陈明强,魏海军,李有宁,邓正华,王雨,马振华,于刚,孙静. 企鹅珍珠贝F_3选育系的珍珠层颜色及生长性状的比较分析. 南方农业学报. 2020(03): 659-668 .  百度学术
百度学术
8. 魏海军,陈明强,邓正华,李有宁,王雨,马振华,于刚. 4个企鹅珍珠贝F_3选育系的生长存活差异及其生长规律. 中国水产科学. 2020(06): 624-636 .  百度学术
百度学术
9. 陈明强,李有宁,邓正华,于刚,马振华,郑兴,洪嘉炜,魏海军,王雨. 恩诺沙星曝露下企鹅珍珠贝肠道微生物多样性及优势菌变化规律. 南方农业学报. 2019(04): 851-859 .  百度学术
百度学术
10. 陈明强,魏海军,李有宁,邓正华,王雨,陈旭,孙静,马振华. 野生企鹅珍珠贝形态性状对质量性状的影响. 中国渔业质量与标准. 2019(06): 48-56 .  百度学术
百度学术
11. 陈倩,苏胜彦,刘思辰,叶伟,朱伟凡,袁新华. 不同放养规格和放养密度下吉富罗非鱼体长生长模型研究. 江苏农业科学. 2017(22): 170-175 .  百度学术
百度学术
其他类型引用(4)




 下载:
下载:




 粤公网安备 44010502001741号
粤公网安备 44010502001741号
