Genome sequence analysis and expression of two CHH genes in tiger shrimp (Penaeus monodon)
-
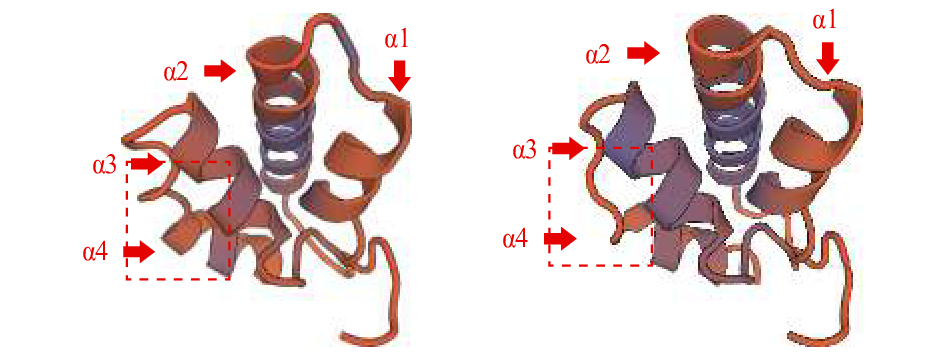
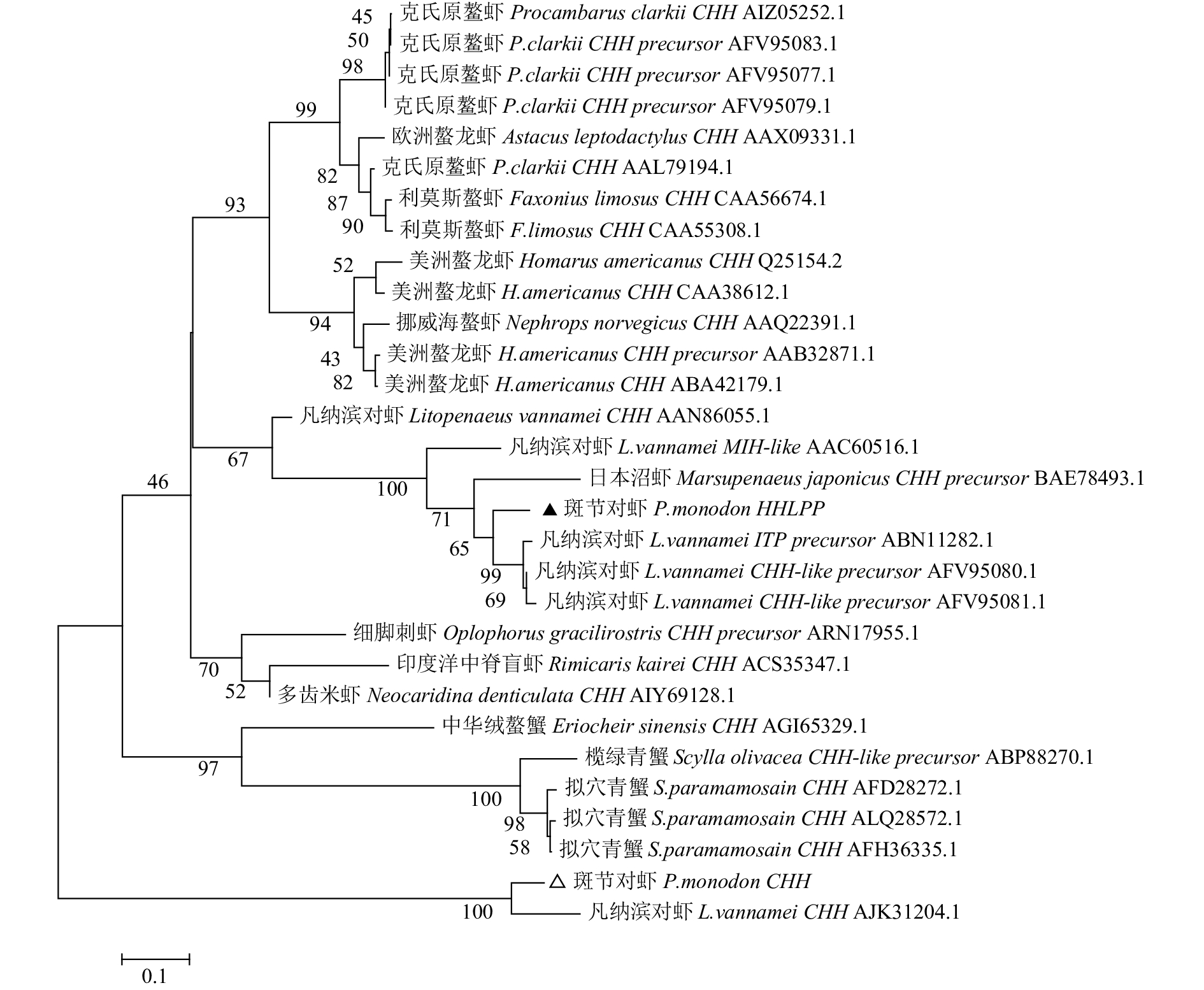
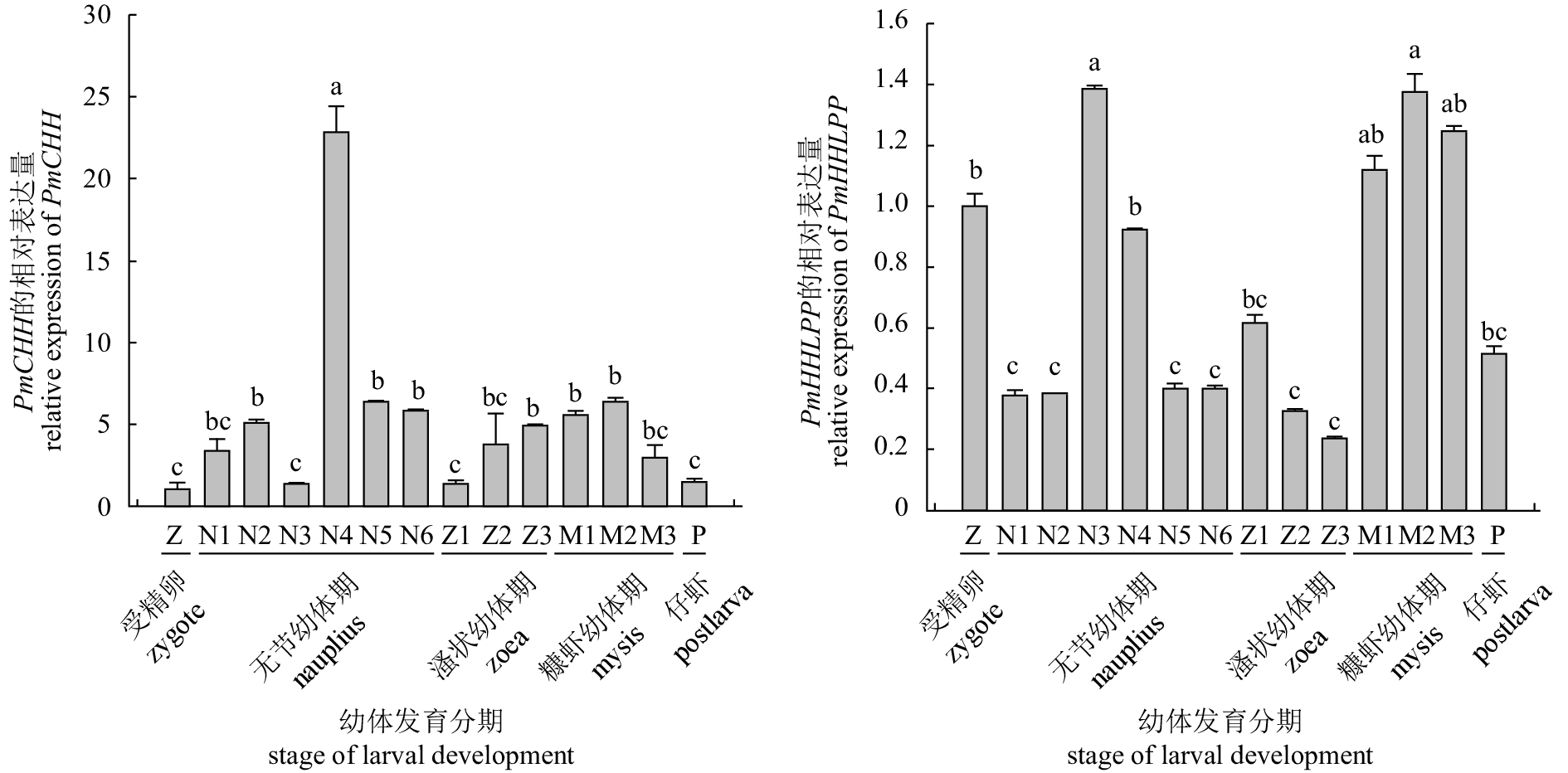
摘要: 在斑节对虾(Penaeus monodon)体内新发现了2种高血糖激素(crustacean hyperglycemic hormone, CHH)家族基因PmCHH和PmHHLPP。基因组分析结果显示,其均具有CHH-Ⅰ型基因基本的“信号肽-CPRP-KR/ER/RR-成熟肽”结构,且与已报道的CHHs基因的基因组结构相似;聚类分析结果显示,尽管PmCHH 和PmHHLPP与多个CHHs基因序列相似性超过50% (最高达99%),但与其聚为一支的基因均不是CHH-Ⅰ型基因;生物信息学分析结果显示,PmCHH和PmHHLPP的转录起始位点“A”及其核心启动子区域分别位于开放阅读框(ORF)上游的99 bp和190 bp,同时在预测其空间结构后发现,两者的三维结构中均含有4个α螺旋构型;组织表达结果显示,2个基因均在肠中有较高的表达量,而PmCHH在鳃、PmHHLPP在眼柄中表达量也较高,但在肝胰腺和肌肉中表达量较低;幼体发育阶段表达结果显示,2个基因在无节幼体Ⅲ~Ⅳ期、溞状幼体Ⅰ期和糠虾幼体期表达量均有较大波动,与代谢强度呈弱相关关系。根据其一级结构的特征和相关表达情况,可推测PmCHH和PmHHLPP均为CHHs家族基因。Abstract: Two genes encoding crustacean hyperglycemic hormones, named as PmCHH and PmHHLPP, were found in tiger shrimp (Penaeus monodon). In the analysis of genomic sequence, a typical domain of CHH-I gene called CPRP (CHH precursor-related peptide) was found between the signal and the mature peptides in these two genes, and all aligned sequences shared a homogeneous structure of genome. They were alike other CHHs when being blasted in the NCBI. The similarity was over 50% and the maximum was 99%. Besides, PmCHH and PmHHLPP were clustered with the non-CHH-I genes in the phylogenetic analysis. The bioinformatics analysis of their sequences predicts that the transcription initiation site "A" as well as its core promoter region in both genes located at 99 bp and 190 bp upstream of the ORF (open reading frame), and both had four α-helices in the predictive proteins. The expression analysis of different tissues and larval development of P.monodon provides evidence that PmCHH and PmHHLPP could not be easily identified as hyperglycemic genes: the highest expression level was detected in gut, while they expressed low in tissues regulating blood glucose, hepatopancreas and muscle. For the larval development, the stages of Nauplius Ⅲ-Ⅳ, Zoea Ⅰ and Mysis witnessed the peaks and declines of the expression of both genes, which seemed irrelevant to glycemic regulation. In conclusion, PmCHH and PmHHLPP could be identified as members of the CHH family according to their CHH-I like structure.
-
凡纳滨对虾(Litopenaeus vannamei)又称南美白对虾, 具有生长速度快、环境适应性强等特点, 是中国重要的海水养殖品种[1]。近年来随着养殖规模的扩大和养殖密度的增加, 疾病成为阻碍凡纳滨对虾产业发展的瓶颈之一[2-4]。由于对其疾病发生的原因及机理了解不够, 对虾一旦发病, 养殖户往往会大量使用或滥用抗生素等药物, 这不仅会造成致病菌多重抗药性, 而且会引发对虾肠道菌群失调和药物残留等问题, 危害环境和食品安全, 负面效应日益严重[5]。因此, 寻找新型免疫增强剂等提高对虾免疫力、促进其生长显得尤为重要。研究表明, 在饲料中适量添加中草药和海洋红酵母(Rhodotorula mucilaginosa)等成分能有效提高凡纳滨对虾和尼罗罗非鱼(Oreochromis niloticus)的生长和免疫能力[6-7]。
短链脂肪酸—丁酸是厚壁菌门细菌的主要代谢产物, 可以为动物肠道黏膜提供能量, 降低肠道pH, 减少有害菌生长, 且不产生抗药性[8-9]。聚β-羟基丁酸酯(poly-β-hydroxybutyrate, PHB)作为短链脂肪酸β-羟基丁酸的聚合体, 是由细菌合成的一种酯类天然产物, 具有生物可降解性和生物相容性等特点[10]。在碳、氮营养失衡的情况下, 细菌胞内可以积累PHB作为碳源和能量储备物质[11]。PHB可在动物肠道内降解为β-羟基丁酸单体, 通过营造肠道微酸性环境促进有益微生物(尤其是革兰氏阳性细菌)在肠道中形成优势菌群[8, 12]。此外, PHB为脂溶性颗粒, 其疏水特性可避免短链脂肪酸易挥发的缺点, 更适于在水产养殖中应用[11]。该研究拟通过投喂不同PHB含量的饲料养殖凡纳滨对虾, 测定对虾肝胰腺免疫和消化酶活性及HSP70和Toll免疫基因表达量的变化, 初步探讨饲料添加不同含量PHB对对虾免疫和消化机能的影响, 以期为PHB在对虾养殖中的应用提供基础数据。
1. 材料与方法
1.1 材料
实验用凡纳滨对虾取自中国水产科学研究院南海水产研究所深圳试验基地, 平均体质量为(5.66±0.14)g。实验前在玻璃纤维桶(300 L)中暂养7 d, 每桶30尾, 投喂不含PHB的对虾基础配合饲料。养殖水温为(25±0.5)℃, 盐度30, pH 8.5, 连续充气, 日换水量为总水量1/3。实验与暂养期间的养殖条件基本一致。
凡纳滨对虾配合饲料为揭阳“海大牌”2号料, 其中粗蛋白质量分数为40%。实验用PHB购自宁波天安生物材料有限公司, 其添加方法参照de SCHRYVER等[13], 即将PHB溶解于80%三氯甲烷溶液中, 均匀喷洒在饲料颗粒表面, 室温通风条件下晾干去除三氯甲烷, 4 ℃冰箱密闭保存备用。
1.2 实验设计
将暂养7 d的凡纳滨对虾随机分为4组, 即对照组和PHB饲喂组, 每组3个平行, 每个平行30尾虾。对照组对虾投喂不添加PHB的对虾基础配合饲料, PHB饲喂组分别投喂含有PHB质量分数为1%、3%和5%的对虾配合饲料。对虾日投喂量为虾体质量的5%, 依摄食情况具体调整, 日投喂3次(08:00、12:00和18:00), 自然光周期, 养殖周期为35 d。每天记录对虾成活率。
1.3 样品制备
分别于养殖第35天从每个平行组随机取5尾虾的肝胰腺, 用0.9%的预冷生理盐水漂洗, 去除多余的组织液, 用滤纸擦拭后称量, 放置于灭菌的离心管中。按照m(组织):V(生理盐水)=1:9的比例与对虾肝胰腺组织混合, 超声粉碎, 用冷冻离心机于4 ℃、3 000 r · min-1离心10 min, 吸取上清进行分装, 保存在-80 ℃, 用于测定相关酶活性。
1.4 免疫和消化酶活性的测定
分别测定各组凡纳滨对虾肝胰腺的总抗氧化能力(T-AOC)、溶菌酶(LSZ)、淀粉酶、脂肪酶、胃蛋白酶和胰蛋白酶活性以及肝胰腺总蛋白含量, 实验使用南京建成生物工程研究所的试剂盒, 且所用试剂盒均为该研究所同一批次生产。
总抗氧化能力单位定义为, 每毫克动物组织蛋白1 min在37 ℃下使反应系统的吸光度(OD)每升高0.01为1个单位; 溶菌酶能水解细菌细胞壁上的肽聚糖使细菌裂解, 通过测定菌液透光度变化测定溶菌酶活性; 淀粉-碘比色法测定淀粉酶活性, 单位定义为37 ℃下, 10 mg淀粉被每毫克组织蛋白与底物溶液作用30 min后水解为1个活性单位; 1个脂肪酶活性单位定义为每克组织蛋白37 ℃条件下与底物作用1 min水解1 μmol底物; 1个胃蛋白酶活性单位定义为37 ℃下每毫克组织蛋白每分钟分解蛋白生成1 μg氨基酸; 采用考马斯亮蓝法进行组织蛋白定量。在37 ℃下, 每毫克组织中含有的胰蛋白酶1 min使吸光值变化0.003为1个胰蛋白酶活性单位。
1.5 免疫基因表达分析
利用Trizol试剂分别提取不同处理组凡纳滨对虾肝胰腺组织的总RNA, 核酸定量仪确定其纯度和浓度符合标准, 1.0%琼脂糖凝胶电泳检验所得RNA的完整度和质量, DNaseⅠ消化总RNA中多余的DNA, 再用M-MLV反转录酶将RNA反转录得到相应的cDNA, 所得产物于-20 ℃保存备用。具体操作按照说明书进行。
根据GenBank中的凡纳滨对虾HSP70、Toll和内参基因β-actin的cDNA序列, 使用Primer Premier 5.0软件分别设计正反特异性引物(表 1), Real-time PCR分别检测各处理组对虾肝胰腺中HSP70和Toll基因的表达量, 每个样品做3个重复, 按照SYBR Premix Ex TaqTMⅡ(TaKaRa)试剂盒说明书进行具体操作。反应体系总量为20 μL, 包括10 μL SYBR Premix Ex TaqTMⅡ(2×), 0.8 μL正向引物(浓度10 μmol · L-1), 0.8 μL反向引物(浓度10 μmol · L-1), 0.4 μL ROX Reference DyeⅡ(50×), 2.0 μL cDNA, 6.0 μL DEPC水。反应程序为95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 34 s, 40个循环; 95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s。采用2-ΔΔCt法计算凡纳滨对虾HSP70和Toll基因的相对表达量。
表 1 该研究所用引物序列Table 1. Sequence of primers in this study引物名称
primer name引物序列(5′→3′)
primer sequence登录号
accession No.HSP70-F AGGAGACCGCTGAGGCTTAC AY645906 HSP70-R AGCACATTCAGACCCGAGAT Toll-F CCAGCTTAGAAGACCGGCAA DQ923424 Toll-R GTTGTCCGAGCAGAAGTCCA β-actin-F GCCCTGTTCCAGCCCTCATT AF300705 β-actin-R ACGGATGTCCACGTCGCACT 1.6 数据分析
用SPSS 17.0软件处理实验所得数据, 以“平均值±标准误(X ±SE)”表示, 进行单因素方差分析, 显著性水平为α=0.05。
2. 结果
2.1 PHB对肝胰腺免疫指标的影响
PHB对凡纳滨对虾肝胰腺总抗氧化能力和溶菌酶活性的影响见图 1。与对照组相比, 养殖第35天, 3%和5%PHB添加组对虾肝胰腺的总抗氧化能力显著高于对照组(P<0.05), 其中5%PHB添加组最高, 约为对照组的1.8倍(图 1-A)。3%PHB添加组的溶菌酶活性与对照组相比显著升高(P<0.05), 而1%与5%PHB添加组的溶菌酶活性与对照组之间差别不显著(P>0.05, 图 1-B)。
![]() 图 1 聚β-羟基丁酸酯对凡纳滨对虾肝胰腺总抗氧化能力和溶菌酶活性的影响不同小写字母表示组间差异显著(P < 0.05), 相同小写字母表示组间差异不显著(P>0.05);后图同此Figure 1. T-AOC and LSZ activity in hepatopancreas of L.vannamei after PHB treatmentDifferent letters indicate significant difference (P < 0.05), while the same letters indicate no significant difference (P>0.05).The same case in the following figures.
图 1 聚β-羟基丁酸酯对凡纳滨对虾肝胰腺总抗氧化能力和溶菌酶活性的影响不同小写字母表示组间差异显著(P < 0.05), 相同小写字母表示组间差异不显著(P>0.05);后图同此Figure 1. T-AOC and LSZ activity in hepatopancreas of L.vannamei after PHB treatmentDifferent letters indicate significant difference (P < 0.05), while the same letters indicate no significant difference (P>0.05).The same case in the following figures.PHB对凡纳滨对虾肝胰腺HSP70基因和Toll基因表达量的影响见图 2。与对照组相比, 养殖第35天, 3个PHB添加组的HSP70基因表达量均显著升高, 其中1%PHB添加组的表达量最高(P<0.05), 约为对照组的2.4倍(图 2-A); Toll基因表达量随PHB添加浓度的升高呈先增高后降低的趋势, 1%和3%PHB添加组的Toll基因表达量显著升高(P<0.05), 约为对照组的2倍, 但5%PHB添加组的表达量与对照组差异不显著(P>0.05, 图 2-B)。
2.2 PHB对肝胰腺消化指标的影响
PHB对凡纳滨对虾肝胰腺淀粉酶、脂肪酶、胃蛋白酶和胰蛋白酶活性的影响见图 3。与对照组相比, 养殖第35天, 1%和5%PHB添加组对虾肝胰腺的淀粉酶活性显著升高(P<0.05), 分别为对照组的1.2和1.8倍。而3%PHB添加组淀粉酶活性与对照组差异不显著(P>0.05, 图 3-A)。脂肪酶各PHB添加组与对照组均无显著性差异(P>0.05, 图 3-B)。5% PHB添加组的胃蛋白酶活性显著升高(P<0.05), 而1%PHB添加组胃蛋白酶活性与对照组差异不显著(P>0.05), 3%PHB添加组胃蛋白酶活性有显著降低现象(P<0.05, 图 3-C)。与胃蛋白酶活性一致, 5%PHB添加组的胰蛋白酶活性显著高于其他各组(P<0.05), 1%、3%PHB添加组和对照组间均无显著差异(P>0.05, 图 3-D)。
3. 讨论
肝胰腺是甲壳动物体内分泌酶、吸收及储存营养物质的重要器官, 其酶活性通常被用作衡量动物消化和免疫功能的指标之一[12, 14]。PHB在甲壳动物消化道内能降解为短链脂肪酸β-羟基丁酸, 具有促进动物生长、提高动物免疫能力的功能。研究表明, PHB能提高感染白斑综合征病毒(WSSV)的中国对虾(Fenneropenaeus chinensis)的成活率, 延长其存活时间, 并降低感染前期虾体的病毒拷贝数[15]; PHB同样能提高卤虫(Artemia franciscana)[9]和莫桑比克罗非鱼(Oreochromis mossambicus)[16]的成活率, 在动物抵抗病原感染的过程中发挥作用。
此外, PHB还能降低对虾肠道的pH, 营造不利于有害菌生长的弱酸性环境, 调节肠道菌群, 增强对虾抵御病原菌的能力。PHB在动物肠道内降解产生的β-羟基丁酸能在革兰氏阴性菌胞内释放H+, 抑制病原细菌的酶活性从而抑制其生长, 维护肠道健康, 增强养殖对虾的消化和免疫功能[9]。用PHB培养的卤虫无节幼体投喂罗氏沼虾(Macrobrachium rosenbergii), 结果显示, 含有PHB的实验组罗氏沼虾成活率显著升高, 肠道总细菌数和弧菌数降低, 说明PHB对一些肠道潜在致病菌有抑制作用[17]。
3.1 PHB对凡纳滨对虾肝胰腺免疫指标的影响
凡纳滨对虾无特异性免疫系统, 主要通过吞噬细胞及各种免疫因子来抵御外界环境胁迫和疾病[18]。对虾在代谢过程中会产生大量的活性氧, 而过量的活性氧会引发机体的氧化损伤, 清除活性氧的能力与对虾的免疫力密切相关, 所以总抗氧化能力能综合反映对虾的抗氧化防御系统功能[19-21]。溶菌酶是一种抗菌蛋白, 能破坏细菌的细胞壁, 在甲壳动物免疫中起着重要作用, 其活性可以用来衡量对虾非特异性免疫功能强弱[22]。研究表明, 添加质量分数为1%的PHB能延长感染WSSV的凡纳滨对虾的存活时间[23]。在一定范围内, 中华绒螯蟹(Eriocheir sinensis)幼蟹血清中的总超氧化物歧化酶活性随PHB添加量的增加而升高, 说明在饲料中适量添加PHB能增强幼蟹的抗氧化能力, 提高其非特异性免疫能力[24]。该研究结果显示, 3%和5%PHB添加组对虾肝胰腺的总抗氧化能力显著升高, 表明饲料中该水平的PHB添加有助于提高凡纳滨对虾的抗氧化能力; 同时3%PHB添加组的溶菌酶活性最高。以上结果说明饲料中适量添加PHB对凡纳滨对虾肝胰腺的免疫能力具有一定的促进作用。但对于不同的免疫酶PHB的最适浓度不一致, 如何平衡不同指标的差异, 以确定提高凡纳滨对虾综合免疫能力的最适添加浓度, 还有待进一步研究。
HSP70和Toll基因在生物体内广泛存在, 与动物的免疫能力密切相关。HSP70是一种应激蛋白, 在动物受到环境刺激时表达量增加, 提高动物的应激能力[25]。Toll途径能在细菌、真菌和病毒等病原体入侵动物机体时被激活, 诱导动物的非特异性免疫[26]。因此, HSP70和Toll基因的表达量在一定程度上反映对虾机体的免疫力。该实验在饲料中添加PHB显著促进了HSP70和Toll基因的表达, 其中添加1%PHB的实验组表达量最高, 但5%PHB添加组的表达量有所下降。研究表明, 用富含PHB的真养产碱杆菌(Alcaligenes eutrophus H16)培养的卤虫喂养罗氏沼虾幼虾, 显著提高了其成活率[27]。邓康裕等[23, 28]研究表明, PHB能在凡纳滨对虾受到WSSV病毒感染后延长其存活时间, 刺激其免疫基因的表达, 且最有效的添加水平为1%, 与该实验研究结果一致。
3.2 PHB对凡纳滨对虾肝胰腺消化指标的影响
在机体代谢中, 丁酸作为能量物质可以促进肠道黏膜细胞增殖、增强对营养物质的吸收作用[29]。β-羟基丁酸能够增加肠黏膜绒毛的大小和蛋白酶的活力, 促进动物对营养物质的消化吸收, 提高饲料蛋白质和矿物质的利用率, 从而促进动物生长[9, 30]。NAJDEGERAMI等[31-32]研究表明, PHB可以显著提高西伯利亚鲟(Acipenser baerii)的特定生长率、增重率和成活率, 增加其肠道胃蛋白酶活性, 却抑制了淀粉酶活性。SUI等[24]的研究也显示, PHB的添加提高了中华绒螯蟹幼蟹的胃蛋白酶、胰蛋白酶和脂肪酶活性, 但淀粉酶活性下降。该研究中5%PHB添加组的对虾肝胰腺中淀粉酶、胃蛋白酶和胰蛋白酶活性与对照组相比均显著升高, 而脂肪酶活性均无显著性变化, 表明饲料中添加PHB对养殖对虾肝胰腺消化酶具有促进作用, 有利于其对淀粉、蛋白质等营养物质的消化。以上研究中PHB均不同程度地提高了养殖动物的消化能力, 但对不同种类消化酶的促进效果不同, 推测可能与养殖动物的种类和投喂的饲料组成有关。WELTZIEN等[33]发现丁酸在甲壳动物体内过量积累可能造成酮酸中毒现象, 而该研究中PHB的添加是否存在过量还需进一步深入研究。邓元告等[12]发现高剂量PHB和较长时间饲喂均显著降低中华绒螯蟹肝胰腺淀粉酶和胰蛋白酶活性, 推测可能是PHB在幼蟹胃肠道中降解产生β-羟基酸单体, 较低的肠道pH对幼蟹的生理机能产生胁迫而造成的, 因此建议饲料中低剂量PHB可饲喂较长时间, 而较高剂量PHB应适当缩短饲喂时间。
综上, 在饲料中添加适量PHB对凡纳滨对虾的免疫和消化机能具有促进作用, 在对虾免疫增强剂开发中具有较高的应用潜力。在不同的研究中PHB的最适添加水平存在不一致现象, 推测可能与养殖动物种类、生长期、养殖环境和养殖时间有关。未来将针对PHB对凡纳滨对虾肠道菌群的影响和宿主代谢之间的相关性进行研究, 以期解析PHB在对虾中的免疫促生长机理。
-
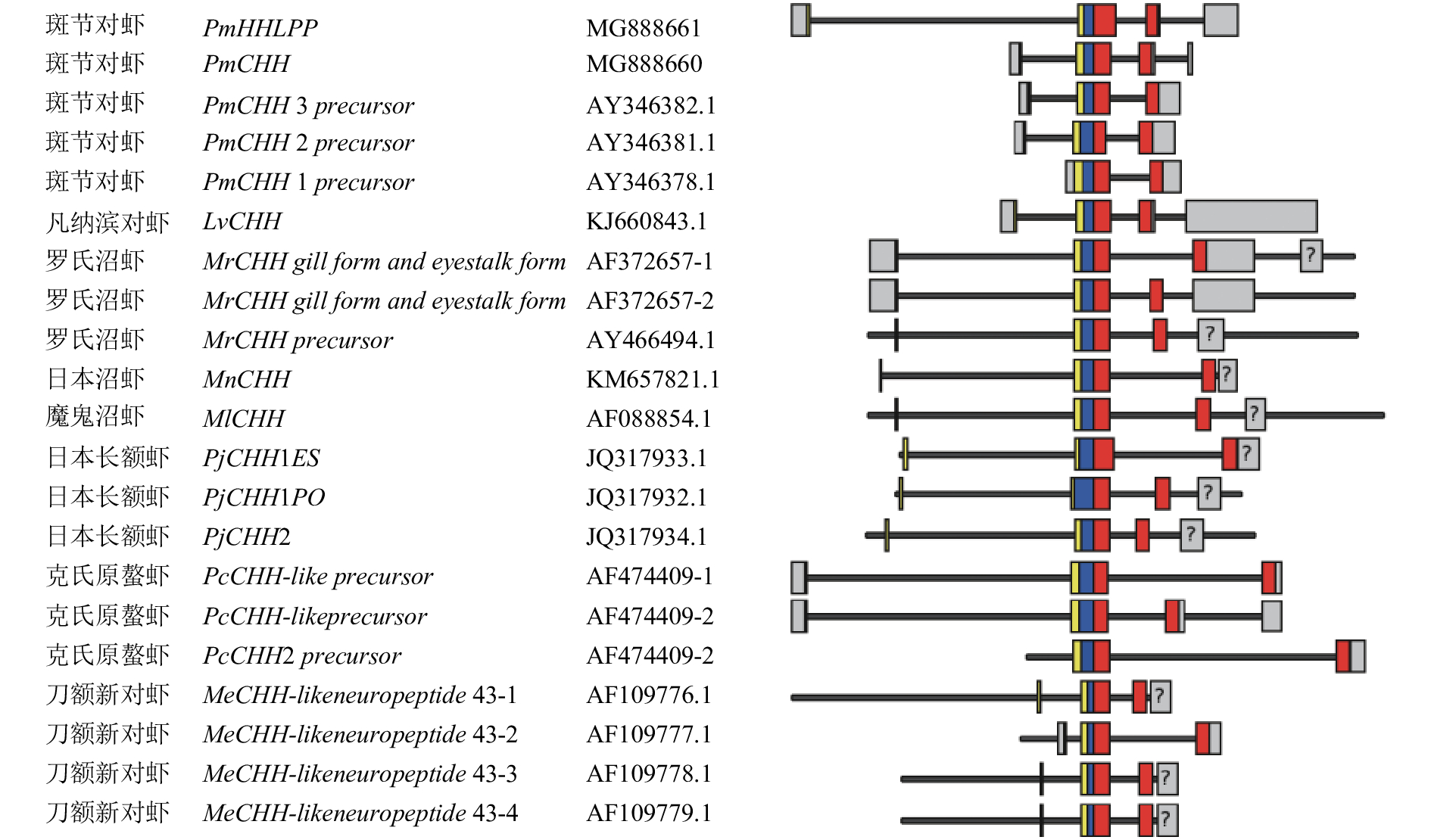
图 1 PmCHH和PmHHLPP的基因组结构比较分析
黑色实线代表基因组序列全长,其中非编码区、信号肽、CPRP结构、成熟肽的位置分别用灰色、黄色、蓝色、红色方框表示,灰色问号区域表示预测的非编码区域,但尚未证实
Figure 1. Genomic structural analysis of PmCHH and PmHHLPP
The solid black lines represent the full length of the genomic sequence. The non-coding regions, signal peptides, CPRP regions and mature peptides are indicated by gray, yellow, blue and red boxes, respectively. The predicted non-coding regions that have not been confirmed are marked with gray boxes with question marks.
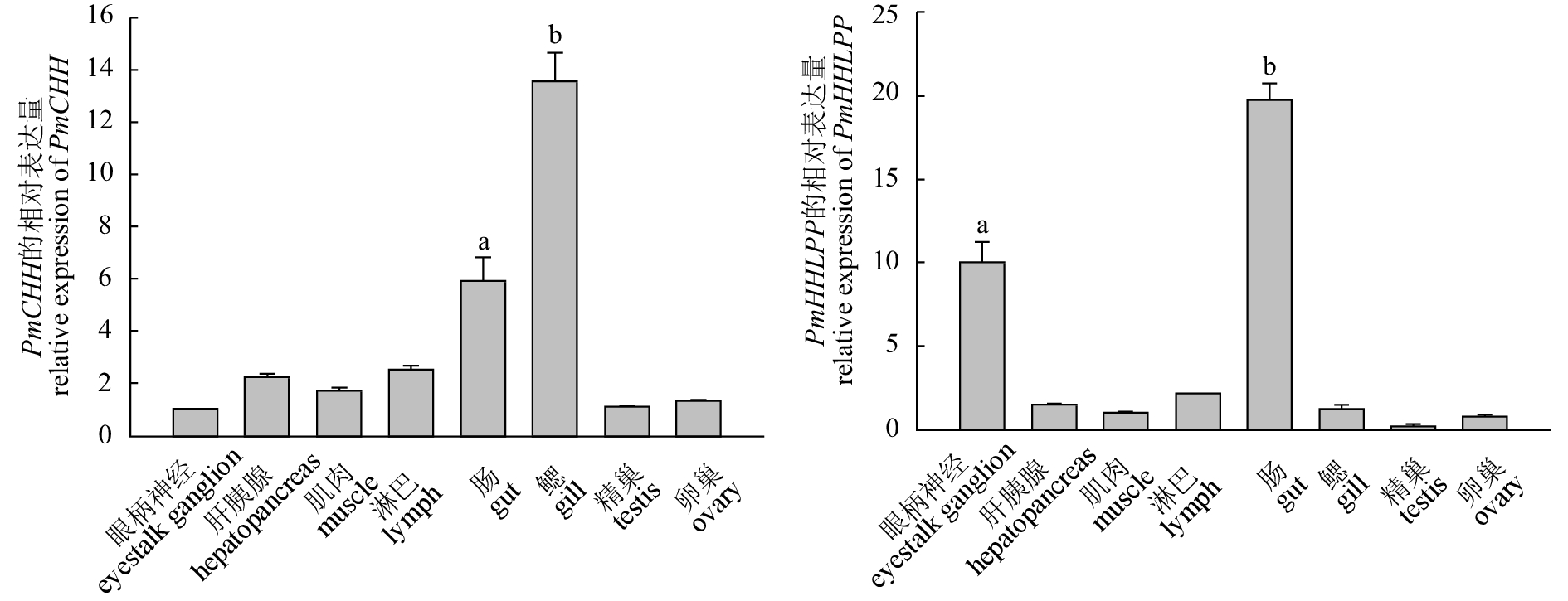
图 4 PmCHH和PmHHLPP组织差异性表达
使用Duncan法进行单因素方差分析,按照a>b>c的顺序数据的显著性依次降低一个水平,复合字母(如ab)表示数值的显著性介于两者之间;下图同此
Figure 4. Expression levels of PmCHH and PmHHLPP in different tissues
Ducan's method was used in One-Way ANOVA test, and the descending order of the significance is indicated as a>b>c. Compound letters (such as ab) indicate that the significance is between those two levels. The same case in the following figure.
表 1 实验所用的引物及其序列
Table 1 Primers and their sequences used in this experiment
引物
primer引物序列
primer sequence作用
function产物长度/bp
product sizePmHHLPP-GF1 GAGTGAGAACGCAGTTACAGGT 基因组序列验证 3 785 PmHHLPP-GR1 GACGAAGACGAGGACGACA PmHHLPP-GF2 CGACCACAGCGTGAACAA 基因组序列验证 246 PmHHLPP-GR2 GAATAGCGGAGAAACATAGCC PmHHLPP-GF3 GGCTATGTTTCTCCGCTATTC 基因组序列验证 469 PmHHLPP-GR3 GACTCCTGTCCTTTACTTCCCTA HHLPP-qPCR-F CTACAACCTGTACCGCAAGCCCTA Real-time RT-PCR 75 HHLPP-qPCR-R TTACTGAACCTCTGATTCACGAAGC PmCHH-GF1 GGGAACTCTAGTATAACTGTAGCCA 基因组序列验证 457 PmCHH-GR1 TTCGGGAACAACGGACC PmCHH-GF2 GCTTGGACTGCCAGAACAT 基因组序列验证 313 PmCHH-GR2 GCATCCGTAGAAGACCTGTG PmCHH-GF3 CACAGGTCTTCTACGGATGC 基因组序列验证 269 PmCHH-GR3 TCAGCTGTAACGATTTCTGTTC CHH-qPCR-F GTTCGCCGTCAGAAGAA Real-time RT-PCR 100 CHH-qPCR-R GCAGTCCAAGCACACATTG EF-1α-qPCR-F AAGCCAGGTATGGTTGTCAACTTT Real-time RT-PCR 73 EF-1α-qPCR-R CGTGGTGCATCTCCACAGACT -
[1] MONTAGNÉ N, DESDEVISES Y, SOYEZ D, et al. Molecular evolution of the crustacean hyperglycemic hormone family in ecdysozoans[J]. BMC Evol Biol, 2010, 10(1): 62.
[2] 蔡生力. 甲壳动物内分泌学研究与展望[J]. 水产学报, 1998, 22(2): 59-66. [3] KELLER R. Crustacean neuropeptides: structures, functions and comparative aspects[J]. Experientia, 1992, 48(5): 439-448.
[4] BÖCKING D, DIRCKSEN H, KELLER R. The crustacean neuropeptides of the CHH/MIH/GIH family: structures and biological activities[J]. Springer Berlin Heidelberg, 2002, 13(1): 71-71.
[5] NAGAI C, MABASHI-ASAZUMA H, NAGASAWA H, et al. Identification and characterization of receptors for ion transport peptide (ITP) and ITP-like (ITPL) in the silkworm Bombyx mori[J]. J Biol Chem, 2014, 289(46): 32166-32177.
[6] DIRCKSEN H. Insect ion transport peptides are derived from alternatively spliced genes and differentially expressed in the central and peripheral nervous system[J]. J Exp Biol, 2009, 212(Pt 3): 401-412.
[7] 杨济芬, 朱冬发, 沈建明, 等. 甲壳动物高血糖激素家族生理功能研究进展[J]. 动物学杂志, 2009, 44(1): 151-158. [8] 王雪惠, 孙金生, 杨卫军. 中华绒螯蟹眼柄神经多肽激素的分离纯化及活性鉴定[J]. 水产学报, 2006, 30(2): 151-155. [9] OHIRA T. Crustacean hyperglycemic hormone, e53[M]. San Diego: Academic Press, 2016: 403-404.
[10] DUANGPROM S, KORNTHONG N, SUWANSA-ARD S, et al. Distribution of crustacean hyperglycemic hormones (CHH) in the mud crab (Scylla olivacea) and their differential expression following serotonin stimulation[J]. Aquaculture, 2017, 468(1): 481-488.
[11] 舒妙安, 张龙韬, 周宇芳, 等. 拟穴青蟹(Scylla paramamosain)两种Ⅰ型高血糖激素基因全长cDNA的克隆及组织表达分析[J]. 海洋与湖沼, 2012, 43(4): 695-701. [12] FANJUL-MOLES M L. Biochemical and functional aspects of crustacean hyperglycemic hormone in decapod crustaceans: review and update[J]. Comp Biochem Physiol C, 2006, 142(3/4): 390-400.
[13] FU C, HUANG X, GONG J, et al. Crustacean hyperglycaemic hormone gene from the mud crab, Scylla paramamosain: cloning, distribution and expression profiles during the moulting cycle and ovarian development[J]. Aquacult Res, 2016, 47(7): 2183-2194.
[14] LIU M Q, PAN L Q, LI L, et al. Molecular cloning, characterization and recombinant expression of crustacean hyperglycemic hormone in white shrimp Litopenaeus vannamei[J]. Peptides, 2014, 53: 115-124.
[15] 金舒博, 王宁, 乔慧, 等. 青虾高血糖激素基因全长cDNA序列的克隆及表达分析[J]. 中国水产科学, 2013, 37(1): 82-92. [16] QIAN Y Q, DAI L, YANG J S, et al. CHH family peptides from an 'eyeless' deep-sea hydrothermal vent shrimp, Rimicaris kairei: characterization and sequence analysis[J]. Comp Biochem Physiol B, 2009, 154(1): 37-47.
[17] LI S H, LI F H, WANG B, et al. Cloning and expression profiles of two isoforms of a CHH-like gene specifically expressed in male Chinese shrimp, Fenneropenaeus chinensis[J]. Gen Comp Endocr, 2010, 167(2): 308-316.
[18] CAMACHO-JIMÉNEZ L, SÁNCHEZ-CASTREJÓN E, DÍAZ F, et al. Cloning and expression of the recombinant crustacean hyperglycemic hormone isoform B2 (rCHH-B2) and its effects on the metabolism and osmoregulation of the Pacific white shrimp Litopenaeus vannamei[J]. Gen Comp Endocr, 2017, 253: 33-43.
[19] 王在照, 相建海. 甲壳动物CHH家族神经激素结构和功能研究进展[J]. 水产学报, 2001, 25(2): 175-180. [20] De KLEIJN D P, van HERP F. Molecular biology of neurohormone precursors in the eyestalk of Crustacea[J]. Comp Biochem Physiol B, 1995, 112(4): 573-579.
[21] 王艳华, 张亦陈, 孙妍, 等. 中华绒螯蟹高血糖激素基因的克隆和分子结构解析[J]. 水产学报, 2013, 37(7): 987-993. [22] DAVEY M L, HALL M R, WILLIS R H, et al. Five crustacean hyperglycemic family hormones of Penaeus monodon: complementary DNA sequence and identification in single sinus glands by electrospray ionization-fourier transform mass spectrometry[J]. Mar Biotechnol, 2000, 2(1): 80-91.
[23] UDOMKIT A, CHOOLUCK S, SONTHAYANON B, et al. Molecular cloning of a cDNA encoding a member of CHH/MIH/GIH family from Penaeus monodon and analysis of its gene structure[J]. J Exp Mar Biol Ecol, 2000, 244(1): 145-156.
[24] TREERATTRAKOOL S, UDOMKIT A, EURWILAICHITR L, et al. Expression of biologically active crustacean hyperglycemic hormone (CHH) of Penaeus monodon in Pichia pastoris[J]. Mar Biotechnol, 2003, 5(4): 373-379.
[25] UDOMKIT A, TREERATTRAKOOL S, PANYIM S. Crustacean hyperglycemic hormones of Penaeus monodon: cloning, production of active recombinant hormones and their expression in various shrimp tissues[J]. J Exp Mar Biol Ecol, 2004, 298(1): 79-91.
[26] TREERATTRAKOOL S, PANYIM S, CHAN S M, et al. Molecular characterization of gonad-inhibiting hormone of Penaeus monodon and elucidation of its inhibitory role in vitellogenin expression by RNA interference[J]. FEBS J, 2008, 275(5): 970-980.
[27] WEBSTER S G, KELLER R, DIRCKSEN H. The CHH-superfamily of multifunctional peptide hormones controlling crustacean metabolism, osmoregulation, moulting, and reproduction[J]. Gen Comp Endocrinol, 2012, 175(2): 217-233.
[28] 江世贵. 斑节对虾种虾繁育技术[M]. 北京: 海洋出版社, 2013: 80-82 [29] YANG L S, LI X L, JIANG S, et al. Characterization of Argonaute2 gene from black tiger shrimp (Penaeus monodon) and its responses to immune challenges[J]. Fish Shellfish Immunol, 2014, 36(1): 261-269.
[30] VENTURA-LÓPEZ C, GÓMEZ-ANDURO G, ARCOS F G, et al. A novel CHH gene from the Pacific white shrimp Litopenaeus vannamei was characterized and found highly expressed in gut and less in eyestalk and other extra-eyestalk tissues[J]. Gene, 2016, 582(2): 148-160.
[31] YAMANO K, UNUMA T. Expressed sequence tags from eyestalk of kuruma prawn, Marsupenaeus japonicus[J]. Comp Biochem Physiol A, 2006, 143(2): 155-161.
[32] GU P L, CHAN S M. The shrimp hyperglycemic hormone-like neuropeptide is encoded by multiple copies of genes arranged in a cluster[J]. FEBS Lett, 1998, 441(3): 397-403.
[33] DIRCKSEN H, BÖCKING D, HEYN U, et al. Crustacean hyperglycaemic hormone (CHH)-like peptides and CHH-precursor-related peptides from pericardial organ neurosecretory cells in the shore crab, Carcinus maenas, are putatively spliced and modified products of multiple genes[J]. Biochem J, 2001, 356(Pt 1): 159-170.
[34] DAI L, ZITNAN D, ADAMS M E. Strategic expression of ion transport peptide gene products in central and peripheral neurons of insects[J]. J Comp Neurol, 2007, 500(2): 353-367.
[35] DIRCKSEN H, TESFAI L K, ALBUS C, et al. Ion transport peptide splice forms in central and peripheral neurons throughout postembryogenesis of Drosophila melanogaster[J]. J Comp Neurol, 2008, 509(1): 23-41.
[36] 周凯敏, 江世贵, 黄建华, 等. 斑节对虾 Chitinase-2基因的克隆及其在蜕皮和幼体发育过程中的表达分析[J]. 南方水产科学, 2017, 13(4): 59-68. [37] 李运东, 周发林, 黄建华, 等. 斑节对虾组织蛋白酶L基因的克隆及其表达分析[J]. 南方水产科学, 2016, 12(3): 58-66. [38] LI X G, XU Z Q, ZHOU G, et al. Molecular characterization and expression analysis of five chitinases associated with molting in the Chinese mitten crab, Eriocheir sinensis[J]. Comp Biochem Physiol B, 2015, 187: 110-120.
[39] LI W F, CHIU K H, TIEN Y C, et al. Differential effects of silencing crustacean hyperglycemic hormone gene expression on the metabolic profiles of the muscle and hepatopancreas in the crayfish Procambarus clarkii[J]. PLoS One, 2017, 12(2): e0172557.
[40] CAMACHO-JIMENEZ L, DIAZ F, MUNOZ-MARQUEZ M E, et al. Hyperglycemic and osmotic effects of dopamine and recombinant hormone CHH-B1 in the Pacific white shrimp Litopenaeus vannamei[J]. Mar Freshw Behav Physiol, 2017, 50(1): 67-79.
[41] VRINDA S, RESHMI C, JOSE S, et al. Crustacean hyperglycemic hormone family gene silencing in Penaeus monodon mediated through dsRNA synthesized in vitro from genomic and cDNA[J]. Ind J Biotechnol, 2017, 16(1): 37-43.
-
期刊类型引用(3)
1. 陈乐然,郑建波,贾永义,迟美丽,李飞,程顺,刘士力,刘一诺,蒋文枰,顾志敏. 红螯螯虾CHH2基因的表达特征及其在卵巢发育中的功能. 浙江农业学报. 2023(01): 33-40 .  百度学术
百度学术
2. 黄智康,江世贵,周发林,黄建华,杨其彬,姜松,李运东,杨丽诗. 基于InDel标记的斑节对虾早期性别鉴定方法的建立. 南方水产科学. 2020(03): 113-118 .  本站查看
本站查看
3. 何鹏,江世贵,李运东,杨其彬,姜松,杨丽诗,黄建华,周发林. 斑节对虾GLUT1基因cDNA的克隆与表达分析. 南方水产科学. 2019(02): 72-82 .  本站查看
本站查看
其他类型引用(4)



 下载:
下载:



 粤公网安备 44010502001741号
粤公网安备 44010502001741号
