Effect of dietary Rhodiola rosea extract on antioxidant system and anti-low salinity stress of Litopenaeus vannamei
-
摘要: 为研究红景天(Rhodiola rosea)提取物对凡纳滨对虾(Litopenaeus vannamei)抗氧化系统及抵抗低盐度胁迫的影响,该实验设计0 mg·kg–1、300 mg·kg–1、1 000 mg·kg–1和3 000 mg·kg–1 4个红景天提取物水平饵料添加量,饲喂凡纳滨对虾28 d。然后进行72 h低盐度(10)胁迫实验,测试凡纳滨对虾肝胰腺总抗氧化能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)活性及GSH-Px、CAT基因表达水平。结果显示,在天然海水养殖条件下,GSH-Px、CAT活性和GSH-Px基因表达水平在某些时段被显著诱导(P<0.05)。低盐度胁迫24 h,对照组抗氧化指标相比于其他各组的变化幅度最大。低盐度胁迫72 h,红景天组T-AOC、CAT活性和GSH-Px、CAT基因表达水平均显著高于对照组(P<0.05)。双因素方差分析结果显示红景天提取物添加量与时间的交互效应对抗氧化指标的影响显著。结果表明,红景天提取物能够有效缓解胁迫初期凡纳滨对虾抗氧化指标的剧烈改变,明显提高胁迫后期机体的抗氧化系统功能,具有成为抗应激饲料添加剂的潜力。Abstract: In order to investigate the effect of Rhodiola rosea extract on the antioxidant system and anti-low salinity stress of Litopenaeus vannamei, four levels of R.rosea extract were designed (0 mg·kg–1, 300 mg·kg–1, 1 000 mg·kg–1 and 3 000 mg·kg–1). We have fed the shrimps for 28 d and carried out a 72-hour low salinity (10) stress test to analyze the antioxidant capacity including total antioxidant status (T-AOC), glutathione peroxidase (GSH-Px), catalase (CAT) as well as gene expression of GSH-Px and CAT in hepatopancreas of shrimps. The results show that enzyme activities of GSH-Px and CAT and gene expression of GSH-Px were significantly induced in hepatopancreas of shrimps fed with R.rosea extract at different time intervals (P<0.05). The antioxidant indices of shrimps of the control group at low salinity stress at 24th hour varied greater than those of shrimps of supplemental R.rosea groups. For the shrimps fed with dietary R.rosea extract at low salinity stress at 72nd hour, the activities of T-AOC, CAT as well as gene expression of GSH-Px and CAT of hepatopancreas were significantly higher than those in the control group (P<0.05). The GLM analysis results show significant interaction between the effects of R.rosea extract level and time on the antioxidant indices. In conclusion, R.rosea extract can alleviate drastic variation of antioxidant indices in the hepatopancreas of shrimps at the early stress stage effectively. Besides, the antioxidant capacity of shrimps fed with supplemental R.rosea extract was significantly improved at the late stress stage. Thus, the R.rosea extract has the potential to become an anti-stress feed additive.
-
Keywords:
- Litopenaeus vannamei /
- environmental stress /
- Rhodiola rosea extract /
- antioxidantion
-
凡纳滨对虾(Litopenaeus vannamei)发源于拉丁美洲的热带太平洋海岸,目前已占世界对虾养殖总产量的70%以上,具有诸多生理优点,最重要的就是广盐耐受性,范围从0.5到40[1-2],所以凡纳滨对虾成为内陆水域的主要养殖对虾品种[3]。自2001年凡纳滨对虾养殖面临着严重的病害问题,给养殖业带来了巨大的经济损失,其中主要原因之一是暴雨和大量换水导致养殖水体尤其是内陆水域养殖的盐度骤降,降低了对虾的适应性[4]。对虾的生长、成活率和新陈代谢等受多种环境因子的影响,盐度就是其中重要的环境因子之一[5-7]。盐度对水生动物的抗氧化系统功能影响明显,如低盐胁迫显著影响凡纳滨对虾和黄姑鱼(Nibea albiflor)幼鱼肝脏抗氧化功能[8-9]。因此抗氧化系统功能在一定程度上能够反映动物不同环境条件下的生理状况,可以作为衡量动物是否受到外界环境胁迫的一个重要生理指标[10]。
植物提取物例如大黄蒽醌提取物、绿原酸和香蕉皮提取物能够有效保护水产动物抵御环境胁迫[11-13],而且能够显著增强水产动物的抗氧化酶活性,例如增强凡纳滨对虾[14]、团头鲂(Megalobrama amblycephala)[15]和草鱼(Ctenopharyngodon idellus)[16]的抗氧化酶活性。红景天(Rhodiola rosea)系景天科多年生草本或亚灌木植物,能够有效增强机体抵御多种胁迫的能力[17]。红景天提取物的抗氧化和抗应激功效十分明显,研究表明红景天提取物比维生素C (VC)具有更强的清除活性氧自由基的能力[18],并且可以增强秀丽线虫(Caenorhabditis elegans)体内的抗氧化功能[19]。在日粮中添加不同比例的红景天对冷应激的断奶仔猪有良好的促生长及抗病能力[20],也可以有效提高低氧应激条件下肉鸡的免疫力[21]。水产养殖领域的研究表明在饲料中添加高山红景天(R.sachalinensis),能提高吉富罗非鱼(Oreochromis niloticus×O.aureu)抗低温能力,增强低温条件下鱼体肝脏的抗氧化酶活性,提高成活率[22]。但是有关红景天提取物对凡纳滨对虾抗氧化功能的影响尚未见报道。本研究以凡纳滨对虾为研究对象,投喂含有不同浓度的红景天提取物的实验饲料,测定凡纳滨对虾肝胰腺组织总抗氧化能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)的活性及GSH-Px、CAT基因表达的变化情况,评估红景天提取物对凡纳滨对虾抗低盐度胁迫的影响,为开发提高凡纳滨对虾耐低盐能力的饲料添加剂提供理论依据。
1. 材料与方法
1.1 实验饲料
根据凡纳滨对虾的营养需求,设计了以鱼粉、豆粕、花生麸为主要蛋白源的配合饲料(表1),在基础饲料(control)中分别添加300 mg·kg–1(HJT-300),1 000 mg·kg–1(HJT-1000)和3 000 mg·kg–1(HJT-3000)的红景天提取物制成实验饲料。饲料原料由珠海世海饲料有限公司提供,红景天提取物购自陕西森弗高科实业有限公司。将所有原料粉碎过60目筛,按照饲料配方准确称质量、初步混匀,然后加入红景天提取物用逐级扩大法混合均匀,饲料中添加35%的水分搅拌均匀后制成1.5 mm直径的颗粒饲料,在阴凉通风的房间晾干后–20 ℃冰箱中保存备用。
表 1 基础饲料配方及营养组成 (风干基础)Table 1. Ingredients and nutritional composition of basal feed formula (air-dry basis)% 项目
item组别 group 对照 control HJT-300 HJT-1000 HJT-3000 原料 ingredient 鱼粉 fish meal 25 25 25 25 大豆粕 soybean meal 18 18 18 18 菜籽粕 peanut meal 16.4 16.4 16.4 16.4 面粉 flour 23 22.97 22.90 22.70 啤酒酵母 beer yeast 5 5 5 5 虾头粉 krill meal 5 5 5 5 大豆磷脂 soybean lecithin 1 1 1 1 鱼油 fish oil 1 1 1 1 豆油 sybean oil 1 1 1 1 氯化胆碱 (50%) choline chloride 0.5 0.5 0.5 0.5 磷酸二氢钙 monocalcium phosphate 1 1 1 1 抗坏血酸酯 ascorbic phosphate ester 0.1 0.1 0.1 0.1 多维预混料a vitamin premix 1 1 1 1 微量矿物元素预混料b mineral premix 1 1 1 1 红景天提取物 Rhodiola rosea extract 0 0.03 0.10 0.30 海藻酸钠 sodium alginate 1 1 1 1 总量 total 100 100 100 100 营养水平c nutrient value 粗蛋白 crude protein 39.74 39.43 39.74 39.80 粗脂肪 lipid 7.31 7.24 7.26 7.30 粗灰分 ash 11.21 11.34 11.33 11.02 水分 moisture 9.65 9.87 9.82 9.67 注:a. 多维预混料(g·kg–1):维生素A 2.5,维生素D3 6.25,维生素E 75,维生素K3 2.5,维生素B1 0.25,维生素B2 1.0,维生素B3 5.0,维生素B6 0.75,维生素B12 2.5,维生素B5 2.5,叶酸 0.25,生物素2.5,肌醇 379,纤维素 500[13];b. 微量矿物元素预混料(g·kg–1): 氯化钾 90,碘化钾 0.04,氯化钠 40,五水硫酸铜 3,七水合硫酸锌 4,七水合硫酸钴 0.02,七水合硫酸亚铁 20,一水合硫酸锰 3,七水合硫酸镁 124,二水合磷酸氢钙 500,碳酸钙 215[23];c. 实测值Note:a. vitamin premix (g·kg–1): VA 2.5, VD3 6.25, VE 75, Vk3 2.5, VB1 0.25, VB2 1.0, VB3 5.0, VB6 0.75, VB12 2.5, VB5 2.5, folic acid 0.25, biotin 2.5, meso-inositol 379, cellulose 500[13];b. mineral premix (g·kg–1): KCl 90, KI 0.04, NaCl 40, CuSO4·5H2O 3, ZnSO4·7H2O 4, CoSO4·7H2O 0.02, FeSO4·7H2O 20, MnSO4·H2O 3, MgSO4·7H2O 124, CaHPO4·2H2O 500, CaCO3 215[23]; c. measured value 1.2 实验用虾及饲养管理
实验用凡纳滨对虾均在中国水产科学研究院南海水产研究所深圳试验基地暂养,挑选健康、均匀、活力好的虾,随机分配至容积800 L的玻璃钢纤维桶中,每个桶30尾对虾,初始体质量(6.74±0.08) g。养殖实验所有的对虾先使用对照组饲料驯化1周,待摄食正常后投喂各组实验饲料,每组3个平行。养殖为期28 d,实验桶内放置饵料台,每天投喂量为对虾体质量的4%~6%,分别在8:00、17:00和22:00进行投喂,并根据天气、摄食情况进行调整。在实验期间养殖水体的温度和盐度分别为(25.4±0.5) ℃和32~34,每隔2 d换水1/3。
1.3 低盐度胁迫实验
凡纳滨对虾投喂添加红景天提取物的饲料养殖28 d后开展低盐度胁迫实验,胁迫时间为72 h。随机从每个玻璃钢桶中挑选15尾对虾,放入调整好的盐度为10的水体中。低盐度胁迫24 h,记录对虾的死亡情况。
1.4 样品的采集与处理
实验包含2个阶段,第一个阶段是对虾的养殖实验,凡纳滨对虾摄食含有红景天提取物的饲料养殖28 d,分别在养殖过程中的第7、第14、第21和第28天获取对虾的肝胰腺组织,保存于液氮中;第二个阶段是对虾养殖28 d后开展72 h低盐度胁迫实验,分别在低盐胁迫后的第24 、第48和第72小时获取对虾的肝胰腺组织,保存于液氮中。每个采样时间点从每个玻璃钢纤维桶中随机选取3尾对虾,每尾对虾的肝胰腺组织平均分为2部分,用于抗氧化酶活性和抗氧化酶基因表达情况的分析。
将上述液氮中保存的1份肝胰腺组织转移至– 80 ℃冰箱待测。肝胰腺组织匀浆液的制备:取肝胰腺并称质量,在冰上解冻后按照其质量加入10倍预冷的0.1 mol·L–1磷酸钾盐缓冲液(pH 6.4),冰浴下匀浆、离心(4 ℃,3 000 r·min–1,10 min),取上清液即酶的粗提液,用于抗氧化系统酶活性的测定。
1.5 抗氧化酶活性的测定
肝胰腺的T-AOC、GSH-Px、CAT和总蛋白质量浓度的测定使用试剂盒(南京建成生物工程研究所)完成,具体方法按照试剂盒说明书。T-AOC单位定义为在37 ℃时每分钟每毫克组织蛋白,使反应体系的光密度(OD)每增加0.01时,为1个总抗氧化能力单位(U·mg–1)。GSH-Px活性规定为每毫克蛋白质,每分钟扣除非酶反应的作用,使反应体系中GSH浓度降低1 μmol·L–1为1个酶活性单位(U·mg–1)。CAT活性定义为每毫克组织蛋白每秒钟分解1 μmol的H2O2的量为1个活性单位。考马斯亮蓝显色法测定总蛋白质量浓度(mg·mL–1)。
1.6 RNA的提取及反转录
凡纳滨对虾肝胰腺组织的总RNA提取方法参照TRIzol (Invitrogen)说明书流程操作。所得RNA用RQ1 RNase-Free DNase (Promega)去除残留的DNA,以ND-1000分光光度计(NanoDrop Technologies,USA)测定260 nm和280 nm处的吸光值,应用M-MLV (Promega)合成cDNA,合成的cDNA存于-20 ℃备用。
1.7 抗氧化酶基因的表达分析
根据凡纳滨对虾抗氧化酶基因GSH-Px(AY973252)、CAT (AY518322)和内参基因β-actin (AF300705)的cDNA全序列设计特异性引物(表2)。引物合成和cDNA序列测定委托上海生工生物工程有限公司完成。
表 2 Real-time PCR扩增的引物及碱基序列Table 2. Primers and sequences used for real-time PCR amplification基因名称
cDNA正向引物 (5′ − 3′)
forward primer反向引物 (5′ − 3′)
reverse primer产物大小/bp
size of productionCAT TCAGCGTTTGGTGGAGAA GCCTGGCTCATCTTTATC 147 GPx AGGGACTTCCACCAGATG CAACAACTCCCCTTCGGTA 117 β-actin GCCCATCTACGAGGGATA GGTGGTCGTGAAGGTGTAA 121 采用实时荧光定量PCR技术,以凡纳滨对虾肝胰腺组织的cDNA为模板,β-actin为内参基因检测目的基因的相对表达水平。依照SYRB Premix Ex TaqTMⅡ(TakaRa)试剂盒进行Real-time PCR分析,10 μL体系,包含5 μL的2×SYBR® Premix Ex TaqTM Ⅱ(TaKaRa),0.6 μL模板,0.4 μL正向引物(10 μmol·L–1),0.4 μL反向引物 (10 μmol·L–1),3.6 μL RNase Free ddH2O (TaKaRa)。以水代替模板为阴性对照,每个样品设置3个重复,反应参数为95 ℃预变性5 min,循环条件为95 ℃ 10 s,60 ℃ 20 s,72 ℃ 10 s,共40个循环;融解曲线条件为95 ℃ 5 s,65 ℃ 1 min,97 ℃ continuous。反应完成后,用LightCycler®480 Software V1.5.0软件分析结果。结果采用2–△△Ct计算方法[24]。
1.8 数据统计学分析
运用SPSS 16.0统计软件进行单因素方差分析,结果值以平均值
$ \pm $ 标准误($\overline X \pm {\rm SE}$ )表示,采用Duncan氏多重比较法检验组间差异(P<0.05)。红景天提取物的添加水平、养殖时间和胁迫时间与抗氧化指标(T-AOC、GSH-Px、CAT活性以及GSH-Px和CAT基因表达水平)的线性关系使用SPSS 16.0的一般线性模型(General Linear Models,GLM)程序分析。2. 结果
2.1 对凡纳滨对虾成活率的影响
养殖28 d,对照组与各红景天提取物添加组之间的成活率无显著性差异(P>0.05),但是HJT-3000组对虾成活率显著高于HJT-300组(P<0.05),以HJT-3000组对虾的成活率最高(表3)。低盐度胁迫24 h,各组对虾成活率之间没有显著性差异(P>0.05),但红景天添加组成活率较对照组提高了7.90%~10.53%。
表 3 红景天提取物对凡纳滨对虾成活率的影响Table 3. Effects of R.rosea on survival of L.vannamein=3; $\overline {\mathit{\boldsymbol{X}}}\pm {\bf SE} $ 时间
time组别 group 对照 control HJT-300 HJT-1000 HJT-3000 28 d 98.89±1.11ab 96.67±0.00a 97.78±1.11ab 100±0.00b 24 h 84.44±2.22 93.33±6.67 91.11±5.88 93.33±6.67 注:同行上标小写字母不同表示差异显著 (P<0.05) Note:Values with different small letter superscripts within the same row differ significantly (P<0.05). 2.2 对凡纳滨对虾肝胰腺抗氧化功能的影响
2.2.1 凡纳滨对虾肝胰腺T-AOC的变化
在养殖第7和第28天,各组对虾肝胰腺T-AOC无显著性差异(P>0.05);养殖第14和第21天,HJT-300组T-AOC显著低于HJT-1000组(P<0.05)(表4)。低盐度胁迫第24小时,对照组T-AOC较养殖第28天提高了32.32%,HJT-300、HJT-1000和HJT-3000组T-AOC分别较养殖第28天提高了37.56%、16.74%和26.73%,HJT-1000和HJT-3000组T-AOC显著低于对照组(P<0.05)。低盐度胁迫第48小时,HJT-3000组T-AOC显著低于HJT-300和HJT-1000组,与对照组无显著差异(P>0.05)。低盐度胁迫第72小时,HJT-300和HJT-1000组T-AOC显著高于对照组(P<0.05)。低盐度胁迫第24小时至第72小时对照组、HJT-300和HJT-3000组T-AOC呈现先降低后升高的变化过程,而HJT-1000组T-AOC逐渐升高。HJT-1000组T-AOC在低盐度胁迫第24小时与养殖第28天无显著性差异(P>0.05),而胁迫第48和第72小时较养殖第28天显著升高(P<0.05)。
表 4 凡纳滨对虾肝胰腺总抗氧化能力在养殖第28天和低盐度胁迫过程中的变化Table 4. Effect of dietary R.rosea on T-AOC activity in hepatopancreas of L.vannamei during 28-day rearing period at low salinity stressn=3; $\overline {\mathit{\boldsymbol{X}}}\pm {\bf SE} $; U·mg–1 组别
group28 d养殖实验 28-day rearing period 0 7 d 14 d 21 d 28 d 对照 control 5.42±0.22 5.41±0.20 4.99±0.36ab 5.19±0.05b 4.92±0.19A HJT-300 5.64±0.35 4.91±0.25 4.22±0.31a 4.02±0.27a 4.26±0.10A HJT-1000 5.63±0.17 5.59±0.11 5.27±0.07b 5.07±0.18b 4.84±0.42A HJT-3000 5.61±0.13 4.93±0.35 5.09±0.21ab 4.68±0.35ab 4.49±0.24A 组别
group低盐度胁迫 low-salinity stress 24 h 48 h 72 h 对照 control 6.51±0.28bC 5.57±0.14abAB 6.32±0.33aBC HJT-300 5.86±0.10abB 5.70±0.16bB 8.01±0.48bC HJT-1000 5.65±0.17aAB 6.01±0.32bB 7.19±0.14abC HJT-3000 5.69±0.23aB 4.87±0.21aA 7.52±0.19bC 注:同列上标小写字母不同表示不同浓度组间差异显著(P<0.05);同行上标大写字母不同表示养殖第28天与胁迫不同时间点之间差异显著(P < 0.05);后表同此 Note:Values with different small letter superscripts within the same column differ significantly (P<0.05); values with different capital letter superscripts within the same row differ significantly between the 28-day rearing and different time of low-salinity stress (P<0.05); the same case in the following tables. 2.2.2 凡纳滨对虾肝胰腺GSH-Px活性的变化
养殖第14天,HJT-3000组对虾肝胰腺GSH-Px活性显著低于其他各组(P<0.05);在养殖第28天,HJT-1000组对虾肝胰腺GSH-Px活性显著高于对照组,HJT-3000组显著高于HJT-300组(P<0.05,表5)。低盐度胁迫第24小时,对照组GSH-Px活性较养殖第28天提高了27.96%,而HJT-300、HJT-1000和HJT-3000组GSH-Px活性分别较养殖第28天降低了5.15%、4.30%和19.13%,HJT-300和HJT-3000组GSH-Px活性显著低于对照组和HJT-1000组(P<0.05)。低盐度胁迫第48小时,HJT-3000组GSH-Px活性显著低于其他各组(P<0.05)。低盐度胁迫第72小时,各组之间无显著性差异(P>0.05)。低盐度胁迫第24小时至第72小时,对照组和HJT-1000组GSH-Px活性呈现先升高后降低的变化过程,而HJT-300组GSH-Px活性逐渐升高,HJT-3000组GSH-Px活性呈现先降低后升高的变化过程。对照组、HJT-300和HJT-1000组GSH-Px活性在低盐度胁迫第24小时与养殖第28天无显著性差异(P>0.05),而胁迫第48和第72小时较养殖第28天显著升高(P<0.05)。HJT-3000组GSH-Px活性分别在低盐度胁迫第24和第48小时显著低于养殖第28天(P<0.05),在低盐度胁迫第72小时显著高于养殖第28天(P<0.05)。
表 5 凡纳滨对虾肝胰腺谷胱甘肽过氧化物酶活性在养殖28 d和低盐度胁迫过程中的变化Table 5. Effect of dietary R.rosea on GSH-Px activity in hepatopancreas of L.vannamei during 28-day rearing period at low salinity stressn=3; $\overline {\mathit{\boldsymbol{X}}}\pm {\bf SE}$; U·mg–1 组别
group28 d养殖实验 28-day rearing period 0 7 d 14 d 21 d 28 d 对照 control 160.96±1.83 180.81±4.96 173.25±19.69a 171.06±15.17 127.54±8.00aA HJT-300 160.96±1.83 169.98±6.74 201.81±0.90a 165.40±2.75 140.05±5.23abA HJT-1000 160.96±1.83 186.09±10.65 175.95±11.17a 173.01±0.88 161.35±6.65bcA HJT-3000 160.96±1.83 162.23±7.72 119.43±9.93b 166.18±1.15 168.70±7.86cB 组别
group低盐度胁迫 low-salinity stress 24 h 48 h 72 h 对照 control 163.20±0.12bAB 187.21±9.67bB 177.77±21.99B HJT-300 132.86±0.17aA 169.11±2.19bB 212.88±7.89C HJT-1000 154.41±6.45bA 191.92±7.28bB 187.04±5.26B HJT-3000 136.42±2.73aA 131.24±9.15aA 198.06±1.63C 2.2.3 凡纳滨对虾肝胰腺CAT活性的变化
凡纳滨对虾肝胰腺CAT活性的变化见表6。在养殖第7天,HJT-300组对虾肝胰腺CAT活性显著低于对照组(P<0.05),而HJT-1000和HJT-3000组CAT活性显著高于对照组(P<0.05)。在养殖第14天,HJT-1000组CAT活性显著高于对照组(P<0.05)。低盐度胁迫第24小时,对照组CAT活性较养殖第28天降低了51.05%,HJT-300、HJT-1000和HJT-3000组CAT活性分别较养殖第28天降低了37.92%、29.22%和28.41%,对照组CAT活性显著低于其他各组(P<0.05)。低盐度胁迫第48小时,HJT-300组CAT活性显著高于对照组(P<0.05),而HJT-1000和HJT-3000组CAT活性均显著低于对照组(P<0.05)。低盐度胁迫第72小时,对照组CAT活性显著低于其他各组(P<0.05)。低盐度胁迫第24至第72小时,对照组和HJT-300组CAT活性呈现先降低后升高再降低的变化过程,而HJT-1000和HJT-3000组CAT活性呈现先降低后升高的变化过程。HJT-1000和HJT-3000组对虾肝胰腺CAT活性在低盐度胁迫过程中均显著低于养殖第28天 CAT活性(P<0.05)。HJT-300组CAT活性在低盐度胁迫第24和第72小时较养殖第28天显著降低(P<0.05),而在低盐度胁迫第48小时较养殖第28天显著升高(P<0.05)。
表 6 凡纳滨对虾肝胰腺过氧化氢酶活性在养殖28 d和低盐度胁迫过程中的变化Table 6. Effect of dietary R.rosea on CAT activity in hepatopancreas of L.vannamei during 28-day rearing period at low salinity stressn=3; $\overline {\mathit{\boldsymbol{X}}}\pm {\bf SE}$; U·mg–1 组别
group28 d养殖实验 28-day rearing period 0 7 d 14 d 21 d 28 d 对照 control 4.48±0.20 4.64±0.07b 5.34±0.12a 4.49±0.21 4.78±0.27C HJT-300 4.35±0.10 4.01±0.12a 4.87±0.09a 4.58±0.12 5.30±0.28C HJT-1000 4.29±0.08 5.97±0.15c 6.21±0.11b 4.74±0.10 5.03±0.09D HJT-3000 4.38±0.13 5.69±0.19c 5.18±0.38a 5.13±0.32 5.28±0.18C 组别
group低盐度胁迫 low-salinity stress 24 h 48 h 72 h 对照 control 2.34±0.16aA 4.90±0.02cC 3.23±0.41aB HJT-300 3.29±0.08bA 5.99±0.15dD 4.73±0.08bB HJT-1000 3.56±0.03bcB 3.16±0.17aA 4.25±0.11bC HJT-3000 3.78±0.04cA 3.64±0.34bA 4.56±0.16bB 2.3 对凡纳滨对虾肝胰腺抗氧化酶基因表达的影响
2.3.1 凡纳滨对虾肝胰腺GSH-Px基因的表达变化
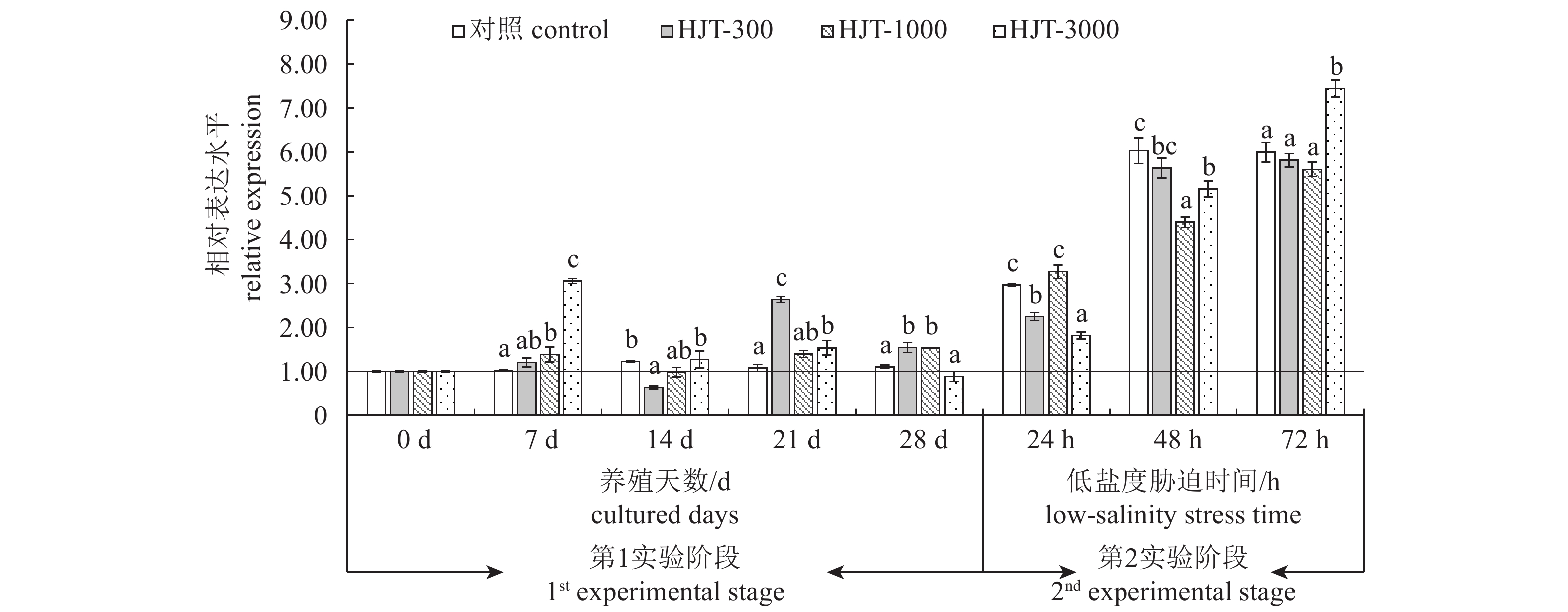
正常养殖条件下对虾摄食含有红景天提取物的饲料后肝胰腺GSH-Px基因表达水平阶段性升高(图1),例如对虾养殖第7天,HJT-1000和HJT-3000组GSH-Px表达水平显著高于对照组(P<0.05);对虾养殖第21天,HJT-300和HJT-3000组GSH-Px表达水平显著高于对照组(P<0.05);对虾养殖第28天,HJT-300和HJT-1000组GSH-Px基因表达水平显著高于对照组(P<0.05)。低盐度胁迫第24~第72小时,各组GSH-Px基因表达水平逐渐升高。低盐度胁迫第24小时,HJT-300、HJT-1000和HJT-3000组GSH-Px基因表达水平较养殖第28天分别提高了45.84%、113.78%和104.51%,而对照组GSH-Px基因表达水平较养殖第28天提高了169.72%。胁迫第48小时,各组GSH-Px基因表达水平较第24小时明显升高,其中HJT-1000和HJT-3000组GSH-Px基因表达水平显著低于对照组(P<0.05)。胁迫第72小时,HJT-3000组GSH-Px基因表达水平显著高于对照组(P<0.05)。
2.3.2 凡纳滨对虾肝胰腺CAT基因的表达变化
正常海水养殖条件下第7~第21天,对虾摄食含有红景天提取物的饲料后肝胰腺CAT基因表达水平均显著低于对照组(P<0.05);养殖养殖第28天,HJT-3000组CAT基因表达水平显著高于对照组(P <0.05),而HJT-1000组显著低于对照组(P<0.05)(图2)。低盐度胁迫第24小时,对照组CAT基因表达水平较养殖第28天降低了64.36%,HJT-300、HJT-1000和HJT-3000组CAT基因表达水平较养殖第28天分别降低了76.74%、36.18%和47.57%,且HJT-1000和HJT-3000组CAT基因表达水平显著高于对照组(P<0.05)。胁迫第48小时,各组CAT基因表达水平较第24小时明显上升,HJT-300组CAT基因表达水平显著高于对照组(P<0.05),HJT-1000和HJT-3000组CAT基因表达水平显著低于对照组。胁迫第72小时,红景天提取物添加各组CAT基因表达水平均显著高于对照组(P<0.05)。
2.4 提取物添加量、养殖和胁迫时间与抗氧化指标的关系
红景天提取物添加量与养殖时间和胁迫时间对凡纳滨对虾T-AOC、GSH-Px和CAT酶活性以及GSH-Px和CAT基因表达水平影响显著(P<0.05),红景天提取物添加量与养殖时间和胁迫时间的交互效应对抗氧化指标影响显著(P<0.05,表7)。这说明红景天不同添加水平在不同的取样时间对凡纳滨对虾肝胰腺的抗氧化指标有显著性的影响。
表 7 双因素方差分析凡纳滨对虾肝胰腺的抗氧化指标Table 7. Two-Way ANOVA analysis of antioxidant indices in hepatopancreas of L.vannamei源
sourceⅢ型平方和
sum of squares自由度
DF均方
MSF P T-AOC/U·mg–1 校正模型 corrected model 75.449 31 2.434 12.906 0.000 R 1.730 3 0.577 3.095 0.034 T 60.919 7 8.703 46.148 0.000 R × T 12.800 21 0.610 3.232 0.000 误差 error 12.069 64 0.189 总计 total 2 961.238 96 GSH-Px/U·mg–1 校正模型 corrected model 44 612.840 31 1 439.124 7.086 0.000 R 4 464.424 3 1 488.141 7.328 0.000 T 18 648.068 7 2 664.010 13.118 0.000 R × T 21 500.347 21 1 023.826 5.041 0.000 误差 error 12 997.126 64 203.080 总计 total 2 720 041.648 96 CAT/U·mg–1 校正模型 corrected model 72.715 31 2.346 24.862 0.000 R 2.771 3 0.924 9.790 0.000 T 38.541 7 5.506 58.358 0.000 R × T 31.402 21 1.495 15.850 0.000 误差 error 6.038 64 0.094 总计 total 2 081.784 96 GSH-Px gene 校正模型 corrected model 376.057 31 12.131 252.425 0.000 R 1.320 3 0.440 9.158 0.000 T 347.506 7 49.644 1 033.011 0.000 R × T 27.231 21 1.297 26.982 0.000 误差 error 3.076 64 0.048 总计 total 1 022.592 96 CAT gene 校正模型 corrected model 11.404 31 0.368 106.217 0.000 R 1.145 3 0.382 110.165 0.000 T 4.901 7 0.700 202.130 0.000 R × T 5.359 21 0.255 73.681 0.000 误差 error 0.222 64 0.003 误差 total 60.832 96 注:R代表红景天提取物的添加水平;T代表养殖和胁迫时间
Note:R. R.rosea supplementation levels; T. rearing period and stress time3. 讨论
红景天的化学成分有酪醇、红景天苷、多酚类和黄酮类物质,以及各种氨基酸和微量元素[25]。研究表明红景天具有抗缺氧、抗疲劳、抗炎症、提高免疫力和抗氧化等多种药理作用[26],甚至其抗氧化能力高于VC[18]。T-AOC作为机体对抗过氧化损伤能力的主要体现,通过机体有效的抗氧化防御系统,使得活性氧(ROS)的产生与清除处于一种动态平衡的状态,以维持正常生理水平的ROS浓度[27]。T-AOC已经被认为是评估甲壳动物体内抗氧化状态的重要指标,包括在益生菌和绿原酸作为饲料添加剂应用效果评估的主要指标[28-29]。在养殖实验过程中,添加红景天各组对虾肝胰腺T-AOC与对照组之间无显著差异,这说明正常养殖条件下红景天提取物对凡纳滨对虾肝胰腺的T-AOC无影响。这与曾经报道的研究结果相反,例如饲料中添加高浓度枯草芽孢杆菌和葡多酚能够显著提高吉富罗非鱼肝胰脏的T-AOC[30-31];但是也有研究表明饲料中添加浒苔饲喂黄斑篮子鱼(Siganus canaliculatus)对其肝脏和肌肉的T-AOC无明显影响[32]。此外,饲料添加红景天提取物饲喂对虾养殖过程中,肝胰腺GSH-Px和CAT活性在不同养殖时间显著升高,其中HJT-1000和HJT-3000组表现最为明显。Mourente等[33]研究表明以金头鲷(Sparus aurata)为例,肝脏抗氧化酶在清除ROS之前需要其活性在体内的骤然积累,所以意味着肝脏抗氧化酶活性短期的显著性提高。相似的结果也出现在红景天提取物作用下小鼠和吉富罗非鱼抗氧化酶活性的显著增强[18,22]。GSH-Px和CAT是催化体内H2O2转化成无害的H2O和O2的主要活性酶[34],事实上GSH-Px和CAT活性的升高伴随着对虾体内过氧化氢含量的升高。双因素方差结果显示双因素(红景天提取物添加水平和养殖时间、胁迫时间)及其交互作用对凡纳滨对虾的抗氧化指标都有显著性影响,都是不可忽视的重要因素。随着红景天提取物添加水平的升高,对虾肝胰腺CAT活性和GSH-Px基因表达水平升高,这说明CAT活性和GSH-Px基因表达水平呈现明显的时间-剂量效应,这与红景天作用于人类角质细胞后CAT活性的变化趋势相一致[35]。本研究发现在养殖第7天HJT-1000和HJT-3000组GSH-Px基因表达水平显著高于对照组,但是CAT基因的表达水平则显著降低,且GSH-Px活性在各组之间没有表现出明显差异,这说明GSH-Px基因表达比GSH-Px蛋白合成更迅速的对红景天提取物的添加做出反应。
虽然凡纳滨对虾是对盐度适应范围很广的水产养殖动物,但是盐度骤变对养殖对虾的刺激相当大,会导致对虾的氧化压力增大和新陈代谢紊乱[36]。凡纳滨对虾在应激条件下的成活率可能是作为最直接的健康状况评价指标之一。低盐度胁迫第24小时,虽然各组对虾成活率没有显著性差异,但添加红景天提取物各组对虾成活率略高于对照组。红景天已被证实在增强机体应对各种环境胁迫过程中的效果显著[37-38],本研究过程中发现低盐度胁迫条件下凡纳滨对虾摄食含有红景天提取物的饲料可以改善肝胰腺抗氧化系统功能,主要表现在低盐度胁迫第72小时饲喂含有红景天提取物的对虾肝胰腺T-AOC、CAT活性和GSH-Px、CAT基因表达水平均显著高于对照组。这说明随着低盐度胁迫时间的延长,可能导致机体活性氧自由基的积累,机体出于自我保护的机制诱导体内抗氧化酶活性升高和抗氧化基因表达水平增强,从而缓解由于低盐度胁迫造成的氧化应激损伤。但是笔者也注意到,低盐度胁迫第24小时,对照组的抗氧化指标相对于养殖第28天的变化幅度剧烈,较红景天添加组的变化幅度大,这说明低盐度胁迫下凡纳滨对虾体内抗氧化系统功能的剧烈改变在对虾摄食含有红景天提取物的饲料后得到有效的缓解,主要表现在降低对虾机体T-AOC、GSH-Px、CAT活性和GSH-Px、CAT基因表达水平的显著提高。抗氧化指标活性的相对降低必然标志着氧化胁迫状态的缓解和活性自由基水平的降低,也就是说氧化胁迫状态的缓解伴随着机体抗氧化指标活性的降低[39]。Lygren等[40]的研究表明,饲料中添加脂溶性抗氧化剂,机体对于内源性的抗氧化酶如GSH-Px和CAT等的需求量会相应减少。红景天提取物含有丰富的植物多糖,具有清除体内活性氧自由基的功能,避免过氧化作用对机体细胞的损伤[41]。所以凡纳滨对虾摄食含有红景天提取物的饲料可以直接清除体内超氧阴离子和自由基等,从而保护机体免受氧化损伤。笔者推测在低盐度胁迫条件下凡纳滨对虾机体的活性氧自由基较正常状态会有所增加,红景天提取物有可能只能直接消除机体过多的活性氧自由基,从而防止胁迫初期自由基对机体的氧化损伤,因此红景天提取物添加组对虾肝胰腺抗氧化指标的变化幅度降低。
综上所述,在养殖第28天和低盐度胁迫第24小时,对照组与各红景天添加组之间凡纳滨对虾的成活率无显著性差异。双因素方差分析结果显示红景天提取物添加量与养殖时间、胁迫时间对凡纳滨对虾肝胰腺抗氧化酶活性与抗氧化酶基因表达水平影响显著,且红景天提取物添加量与时间的交互效应对抗氧化指标的影响显著。凡纳滨对虾摄食含有红景天提取物的饲料能够增强其对低盐度胁迫的抵抗能力,主要表现在低盐度胁迫初期红景天提取物能够有效缓解凡纳滨对虾抗氧化系统功能的剧烈改变,红景天提取物组相对于对照组降低了抗氧化指标的快速改变;另外,低盐度胁迫后期红景天提取物添加组凡纳滨对虾抗氧化指标显著提高,应对环境胁迫造成的机体氧化应激损伤。总之,红景天提取物具有成为养殖对虾饲料添加剂的潜力,在凡纳滨对虾抵抗环境胁迫中发挥作用。
-
表 1 基础饲料配方及营养组成 (风干基础)
Table 1 Ingredients and nutritional composition of basal feed formula (air-dry basis)
% 项目
item组别 group 对照 control HJT-300 HJT-1000 HJT-3000 原料 ingredient 鱼粉 fish meal 25 25 25 25 大豆粕 soybean meal 18 18 18 18 菜籽粕 peanut meal 16.4 16.4 16.4 16.4 面粉 flour 23 22.97 22.90 22.70 啤酒酵母 beer yeast 5 5 5 5 虾头粉 krill meal 5 5 5 5 大豆磷脂 soybean lecithin 1 1 1 1 鱼油 fish oil 1 1 1 1 豆油 sybean oil 1 1 1 1 氯化胆碱 (50%) choline chloride 0.5 0.5 0.5 0.5 磷酸二氢钙 monocalcium phosphate 1 1 1 1 抗坏血酸酯 ascorbic phosphate ester 0.1 0.1 0.1 0.1 多维预混料a vitamin premix 1 1 1 1 微量矿物元素预混料b mineral premix 1 1 1 1 红景天提取物 Rhodiola rosea extract 0 0.03 0.10 0.30 海藻酸钠 sodium alginate 1 1 1 1 总量 total 100 100 100 100 营养水平c nutrient value 粗蛋白 crude protein 39.74 39.43 39.74 39.80 粗脂肪 lipid 7.31 7.24 7.26 7.30 粗灰分 ash 11.21 11.34 11.33 11.02 水分 moisture 9.65 9.87 9.82 9.67 注:a. 多维预混料(g·kg–1):维生素A 2.5,维生素D3 6.25,维生素E 75,维生素K3 2.5,维生素B1 0.25,维生素B2 1.0,维生素B3 5.0,维生素B6 0.75,维生素B12 2.5,维生素B5 2.5,叶酸 0.25,生物素2.5,肌醇 379,纤维素 500[13];b. 微量矿物元素预混料(g·kg–1): 氯化钾 90,碘化钾 0.04,氯化钠 40,五水硫酸铜 3,七水合硫酸锌 4,七水合硫酸钴 0.02,七水合硫酸亚铁 20,一水合硫酸锰 3,七水合硫酸镁 124,二水合磷酸氢钙 500,碳酸钙 215[23];c. 实测值Note:a. vitamin premix (g·kg–1): VA 2.5, VD3 6.25, VE 75, Vk3 2.5, VB1 0.25, VB2 1.0, VB3 5.0, VB6 0.75, VB12 2.5, VB5 2.5, folic acid 0.25, biotin 2.5, meso-inositol 379, cellulose 500[13];b. mineral premix (g·kg–1): KCl 90, KI 0.04, NaCl 40, CuSO4·5H2O 3, ZnSO4·7H2O 4, CoSO4·7H2O 0.02, FeSO4·7H2O 20, MnSO4·H2O 3, MgSO4·7H2O 124, CaHPO4·2H2O 500, CaCO3 215[23]; c. measured value 表 2 Real-time PCR扩增的引物及碱基序列
Table 2 Primers and sequences used for real-time PCR amplification
基因名称
cDNA正向引物 (5′ − 3′)
forward primer反向引物 (5′ − 3′)
reverse primer产物大小/bp
size of productionCAT TCAGCGTTTGGTGGAGAA GCCTGGCTCATCTTTATC 147 GPx AGGGACTTCCACCAGATG CAACAACTCCCCTTCGGTA 117 β-actin GCCCATCTACGAGGGATA GGTGGTCGTGAAGGTGTAA 121 表 3 红景天提取物对凡纳滨对虾成活率的影响
Table 3 Effects of R.rosea on survival of L.vannamei
n=3; $\overline {\mathit{\boldsymbol{X}}}\pm {\bf SE} $ 时间
time组别 group 对照 control HJT-300 HJT-1000 HJT-3000 28 d 98.89±1.11ab 96.67±0.00a 97.78±1.11ab 100±0.00b 24 h 84.44±2.22 93.33±6.67 91.11±5.88 93.33±6.67 注:同行上标小写字母不同表示差异显著 (P<0.05) Note:Values with different small letter superscripts within the same row differ significantly (P<0.05). 表 4 凡纳滨对虾肝胰腺总抗氧化能力在养殖第28天和低盐度胁迫过程中的变化
Table 4 Effect of dietary R.rosea on T-AOC activity in hepatopancreas of L.vannamei during 28-day rearing period at low salinity stress
n=3; $\overline {\mathit{\boldsymbol{X}}}\pm {\bf SE} $; U·mg–1 组别
group28 d养殖实验 28-day rearing period 0 7 d 14 d 21 d 28 d 对照 control 5.42±0.22 5.41±0.20 4.99±0.36ab 5.19±0.05b 4.92±0.19A HJT-300 5.64±0.35 4.91±0.25 4.22±0.31a 4.02±0.27a 4.26±0.10A HJT-1000 5.63±0.17 5.59±0.11 5.27±0.07b 5.07±0.18b 4.84±0.42A HJT-3000 5.61±0.13 4.93±0.35 5.09±0.21ab 4.68±0.35ab 4.49±0.24A 组别
group低盐度胁迫 low-salinity stress 24 h 48 h 72 h 对照 control 6.51±0.28bC 5.57±0.14abAB 6.32±0.33aBC HJT-300 5.86±0.10abB 5.70±0.16bB 8.01±0.48bC HJT-1000 5.65±0.17aAB 6.01±0.32bB 7.19±0.14abC HJT-3000 5.69±0.23aB 4.87±0.21aA 7.52±0.19bC 注:同列上标小写字母不同表示不同浓度组间差异显著(P<0.05);同行上标大写字母不同表示养殖第28天与胁迫不同时间点之间差异显著(P < 0.05);后表同此 Note:Values with different small letter superscripts within the same column differ significantly (P<0.05); values with different capital letter superscripts within the same row differ significantly between the 28-day rearing and different time of low-salinity stress (P<0.05); the same case in the following tables. 表 5 凡纳滨对虾肝胰腺谷胱甘肽过氧化物酶活性在养殖28 d和低盐度胁迫过程中的变化
Table 5 Effect of dietary R.rosea on GSH-Px activity in hepatopancreas of L.vannamei during 28-day rearing period at low salinity stress
n=3; $\overline {\mathit{\boldsymbol{X}}}\pm {\bf SE}$; U·mg–1 组别
group28 d养殖实验 28-day rearing period 0 7 d 14 d 21 d 28 d 对照 control 160.96±1.83 180.81±4.96 173.25±19.69a 171.06±15.17 127.54±8.00aA HJT-300 160.96±1.83 169.98±6.74 201.81±0.90a 165.40±2.75 140.05±5.23abA HJT-1000 160.96±1.83 186.09±10.65 175.95±11.17a 173.01±0.88 161.35±6.65bcA HJT-3000 160.96±1.83 162.23±7.72 119.43±9.93b 166.18±1.15 168.70±7.86cB 组别
group低盐度胁迫 low-salinity stress 24 h 48 h 72 h 对照 control 163.20±0.12bAB 187.21±9.67bB 177.77±21.99B HJT-300 132.86±0.17aA 169.11±2.19bB 212.88±7.89C HJT-1000 154.41±6.45bA 191.92±7.28bB 187.04±5.26B HJT-3000 136.42±2.73aA 131.24±9.15aA 198.06±1.63C 表 6 凡纳滨对虾肝胰腺过氧化氢酶活性在养殖28 d和低盐度胁迫过程中的变化
Table 6 Effect of dietary R.rosea on CAT activity in hepatopancreas of L.vannamei during 28-day rearing period at low salinity stress
n=3; $\overline {\mathit{\boldsymbol{X}}}\pm {\bf SE}$; U·mg–1 组别
group28 d养殖实验 28-day rearing period 0 7 d 14 d 21 d 28 d 对照 control 4.48±0.20 4.64±0.07b 5.34±0.12a 4.49±0.21 4.78±0.27C HJT-300 4.35±0.10 4.01±0.12a 4.87±0.09a 4.58±0.12 5.30±0.28C HJT-1000 4.29±0.08 5.97±0.15c 6.21±0.11b 4.74±0.10 5.03±0.09D HJT-3000 4.38±0.13 5.69±0.19c 5.18±0.38a 5.13±0.32 5.28±0.18C 组别
group低盐度胁迫 low-salinity stress 24 h 48 h 72 h 对照 control 2.34±0.16aA 4.90±0.02cC 3.23±0.41aB HJT-300 3.29±0.08bA 5.99±0.15dD 4.73±0.08bB HJT-1000 3.56±0.03bcB 3.16±0.17aA 4.25±0.11bC HJT-3000 3.78±0.04cA 3.64±0.34bA 4.56±0.16bB 表 7 双因素方差分析凡纳滨对虾肝胰腺的抗氧化指标
Table 7 Two-Way ANOVA analysis of antioxidant indices in hepatopancreas of L.vannamei
源
sourceⅢ型平方和
sum of squares自由度
DF均方
MSF P T-AOC/U·mg–1 校正模型 corrected model 75.449 31 2.434 12.906 0.000 R 1.730 3 0.577 3.095 0.034 T 60.919 7 8.703 46.148 0.000 R × T 12.800 21 0.610 3.232 0.000 误差 error 12.069 64 0.189 总计 total 2 961.238 96 GSH-Px/U·mg–1 校正模型 corrected model 44 612.840 31 1 439.124 7.086 0.000 R 4 464.424 3 1 488.141 7.328 0.000 T 18 648.068 7 2 664.010 13.118 0.000 R × T 21 500.347 21 1 023.826 5.041 0.000 误差 error 12 997.126 64 203.080 总计 total 2 720 041.648 96 CAT/U·mg–1 校正模型 corrected model 72.715 31 2.346 24.862 0.000 R 2.771 3 0.924 9.790 0.000 T 38.541 7 5.506 58.358 0.000 R × T 31.402 21 1.495 15.850 0.000 误差 error 6.038 64 0.094 总计 total 2 081.784 96 GSH-Px gene 校正模型 corrected model 376.057 31 12.131 252.425 0.000 R 1.320 3 0.440 9.158 0.000 T 347.506 7 49.644 1 033.011 0.000 R × T 27.231 21 1.297 26.982 0.000 误差 error 3.076 64 0.048 总计 total 1 022.592 96 CAT gene 校正模型 corrected model 11.404 31 0.368 106.217 0.000 R 1.145 3 0.382 110.165 0.000 T 4.901 7 0.700 202.130 0.000 R × T 5.359 21 0.255 73.681 0.000 误差 error 0.222 64 0.003 误差 total 60.832 96 注:R代表红景天提取物的添加水平;T代表养殖和胁迫时间
Note:R. R.rosea supplementation levels; T. rearing period and stress time -
[1] 段亚飞, 黄忠, 林黑着, 等. 深水网箱和池塘养殖凡纳滨对虾肌肉营养成分的比较分析[J]. 南方水产科学, 2017, 13(2): 93-100. [2] MENZ A, BLAKE B F. Experiments on the growth of Penaeus vannamei boone[J]. J Exp Mar Biol Ecol, 1980, 48(2): 99-111.
[3] LI E C, CHEN L Q, ZENG C, et al. Growth, body composition, respiration and ambient ammonia nitrogen tolerance of the juvenile white shrimp, Litopenaeus vannamei, at different salinities[J]. Aquaculture, 2007, 265(1/2/3/4): 385-390.
[4] CAPY P, GASPERI G, BIEMONT C, et al. Stress and transposable elements: co-evolution or useful parasites?[J]. Heredity (Edinb), 2000, 85(2): 101-106.
[5] 李小勤, 李星星, 冷向军, 等. 盐度对草鱼生长和肌肉品质的影响[J]. 水产学报, 2007, 31(3): 343-348. [6] 申玉春, 陈作洲, 刘丽, 等. 盐度和营养对凡纳滨对虾退壳和生长的影响[J]. 水产学报, 2012, 36(2): 290-299. [7] 钱佳慧, 栗志民, 申玉春, 等. 温度和盐度对华贵栉孔扇贝抗氧化酶活性的联合效应研究[J]. 南方水产科学, 2015, 11(6): 49-57. [8] 王芸, 李健, 李正, 等. 绿原酸诱导凡纳滨对虾抗氧化功能及抵御低盐度胁迫的响应[J]. 中国水产科学, 2014, 21(2): 340-350. [9] 张晨捷, 张艳亮, 高权新, 等. 低盐度胁迫对黄姑鱼幼鱼肝脏抗氧化功能的影响[J]. 南方水产科学, 2015, 11(4): 59-64. [10] 王妤, 庄平, 章龙珍, 等. 盐度对点篮子鱼的存活、生长及抗氧化防御系统的影响[J]. 水产学报, 2011, 35(1): 66-73. [11] 刘波, 明俊超, 谢骏, 等. 大黄蒽醌提取物对罗氏沼虾高温下抗氧化能力与热应激70基因表达的影响[J]. 水产学报, 2010, 34(6): 972-980. [12] RATTANAVICHAI W, CHENG W. Dietary supplement of banana (Musa acuminata) peels hot-water extract to enhance the growth, anti-hypothermal stress, immunity and disease resistance of the giant freshwater prawn, Macrobrachium rosenbergii[J]. Fish Shellfish Immunol, 2015, 43(2): 415-426.
[13] WANG Y, LI Z, LI J, et al. Effects of dietary chlorogenic acid on growth performance, antioxidant capacity of white shrimp Litopenaeus vannamei under normal condition and combined stress of low-salinity and nitrite[J]. Fish Shellfish Immunol, 2015, 43(2): 337-345.
[14] TAYAG C M, LIN Y C, LI C C, et al. Administration of the hot-water extract of Spirulina platensis enhanced the immune response of white shrimp Litopenaeus vannamei and its resistance against Vibrio alginolyticus[J]. Fish Shellfish Immunol, 2010, 28(5/6): 764-773.
[15] LIU B, XU P, XIE J, et al. Effects of emodin and vitamin E on the growth and crowding stress of Wuchang bream (Megalobrama amblycephala)[J]. Fish Shellfish Immunol, 2014, 40(2): 595-602.
[16] CUI Y T, LIU B, XIE J, et al. The effect of emodin on cytotoxicity, apoptosis and antioxidant capacity in the hepatic cells of grass carp (Ctenopharyngodon idellus)[J]. Fish Shellfish Immunol, 2014, 38(1): 74-79.
[17] SCHRINER S E, AVANESIAN A, LIU Y, et al. Protection of human cultured cells against oxidative stress by Rhodiola rosea without activation of antioxidant defenses[J]. Free Radic Biol Med, 2009, 47(5): 577-584.
[18] ZHOU Q, YIN Z P, MA L, et al. Free radical-scavenging activities of oligomeric proanthocyanidin from Rhodiola rosea L. and its antioxidant effects in vivo[J]. Nat Prod Res, 2014, 28(24): 2301-2303.
[19] XIAO L, LI H, ZHANG J, et al. Salidroside protects Caenorhabditis elegans neurons from polyglutamine-mediated toxicity by reducing oxidative stress[J]. Molecules, 2014, 19(6): 7757-7769.
[20] 周芬, 丁月云, 殷宗俊, 等. 中草药红景天对冷应激断奶仔猪生理功能的影响[J]. 安徽农业科学, 2011, 39(12): 7289-7290. [21] 李龙, 王宏辉, 刘锁珠, 等. 红景天对高原缺氧条件下肉鸡免疫功能的影响[J]. 中国家禽, 2013, 35(2): 19-21. [22] 张琛, 杨长庚, 文华, 等. 饲料中添加红景天对吉富罗非鱼耐低温特性的影响[J]. 淡水渔业, 2016, 46(5): 75-80. [23] 夏冬梅, 杨铿, 李卓佳, 等. 海洋红酵母对凡纳滨对虾生长及免疫的影响[J]. 广东农业科学, 2013, 40(14): 133-137. [24] WONG M L, MEDRANO J F. Real-time PCR for mRNA quantitation[J]. Biotechniques, 2005, 39(1): 75-85.
[25] 王爱玲, 曲玮, 梁敬钰. 红景天属植物化学成分及药理作用研究进展[J]. 海峡药学, 2014, 26(1): 1-8. [26] 左占广, 朱彩霞, 鲁东立, 等. 红景天提高黑腹果蝇肠道免疫功能研究[J]. 中草药, 2014, 45(5): 691-694. [27] VASSALLE C, MASINI S, CARPEGGIANI C, et al. In vivo total antioxidant capacity: comparison of two different analytical methods[J]. Clin Chem Laby Med, 2004, 42(1): 84-89.
[28] 王芸, 李正, 李健, 等. 绿原酸对凡纳滨对虾抗氧化系统及抗低盐度胁迫的影响[J]. 生态学报, 2013, 33(18): 5704-5713. [29] CASTEX M, LEMAIRE P, WABETE N, et al. Effect of dietary probiotic Pediococcus acidilactici on antioxidant defences and oxidative stress status of shrimp Litopenaeus stylirostris[J]. Aquaculture, 2009, 294(3/4): 306-313.
[30] 程远, 黄凯, 黄秀芸, 等. 饲料中添加枯草芽孢杆菌对吉富罗非鱼幼鱼整张性能, 免疫力和抗氧化功能的影响[J]. 动物营养学报, 2014, 26(6): 1503-1512. [31] 卢俊姣, 翟少伟. 饲料中添加葡多酚对吉富罗非鱼生长性能、肠道消化酶活性、血脂水平和肝胰脏抗氧化能力的影响[J]. 动物营养学报, 2014, 26(4): 1095-1102. [32] 周胜强, 游翠红, 王树启, 等. 饲料中添加浒苔对黄斑篮子鱼生长性能与生理生化指标的影响[J]. 中国水产科学, 2013, 20(6): 1257-1265. [33] MOURENTE G, DIAZ-SALVAGO E, BELL J G, et al. Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream (Sparus aurata L.) fed dietary oxidised oil: attenuation by dietary vitamin E[J]. Aquaculture, 2002, 214(1/2/3/4): 343-361.
[34] SCHWARZ K B. Oxidative stress during viral infection: a review[J]. Free Radic Biol Med, 1996, 21(5): 641-649.
[35] CALCABRINI C, de BELLIS R, MANCINI U, et al. Rhodiola rosea ability to enrich cellular antioxidant defences of cultured human keratinocytes[J]. Arch Dermatol Res, 2010, 302(3): 191-200.
[36] 季延滨, 于雯雯, 孙金辉, 等. 盐度骤降对南美白对虾仔虾抗氧化机能的影响[J]. 天津农学院学报, 2008, 15(4): 19-23. [37] HERNÁNDEZ-SANTANA A, PÉREZ-LÓPEZ V, ZUBELDIA J M, et al. A Rhodiola rosea root extract protects skeletal muscle cells against chemically induced oxidative stress by modulating heat shock protein 70 (HSP70) expression[J]. Phytother Res, 2014, 28(4): 623-628.
[38] WIEGANT F, SURINOVA S, YTSMA E, et al. Plant adaptogens increase lifespan and stress resistance in C.elegans[J]. Biogerontology, 2009, 10(1): 27-42.
[39] RAHMAT A, ABU BAKAR M F, FAEZAH N, et al. The effects of guava (Psidium guajava) consumption on total antioxidant and lipid profile in normal male youth[J]. Asia Pac J Clin Nutr, 2004, 13(6): 1-12.
[40] LYGREN B, HAMRE K, WAAGBO R. Effects of dietary pro-and antioxidants on some protective mechanisms and health parameters in Atlantic Salmon[J]. J Aquat Anim Health, 1999, 11(3): 211-221.
[41] 郭萌. 红景天多糖的提取与抗氧化活性的研究[D]. 福州: 福建农林大学, 2014: 44-48. -
期刊类型引用(16)
1. 张钰伟,赵旺,邓正华,黄星美,温为庚,孙敬锋,王瑞旋. 芽孢杆菌对方斑东风螺生长、存活、免疫及消化酶活性的影响. 南方水产科学. 2023(01): 106-115 .  本站查看
本站查看
2. 肖博,周胜杰,汪迎港,付正祎,方伟,于刚,马振华. 发酵黄芪对棕点石斑鱼的生长、消化、免疫功能和抗氨氮能力的影响. 南方水产科学. 2023(02): 161-169 .  本站查看
本站查看
3. 周文川,王芸,段亚飞,王珺,周传朋,黄忠. 饲料中添加红景天对凡纳滨对虾抗氧化功能及盐度骤变适应性的影响. 中国农学通报. 2023(14): 144-151 .  百度学术
百度学术
4. 陈旭 ,左涛 ,周胜杰 ,杨蕊 ,于刚 ,秦传新 ,马振华 . 饲喂甘草后低盐胁迫对尖吻鲈相关酶活性的影响. 水产科学. 2023(03): 404-412 .  百度学术
百度学术
5. 郭倩倩,张航,朱琳琳. 植物提取物在水产动物免疫上的应用研究概述. 南方农业. 2022(18): 175-177 .  百度学术
百度学术
6. 李会峰,李二超,徐畅,周利,陈立侨. 饲料中添加水飞蓟素对低盐度下凡纳滨对虾生长、免疫、肝胰腺组织结构及肠道菌群的影响. 水产学报. 2021(01): 98-114 .  百度学术
百度学术
7. 孙彩云,董宏标,王文豪,李勇,古群红,段亚飞,张家松,许晓东. 月桂酸单甘油酯对花鲈脂质代谢的影响. 南方水产科学. 2021(01): 67-75 .  本站查看
本站查看
8. 虞为,杨育凯,林黑着,黄小林,黄忠,李涛,周传朋,马振华,荀鹏伟,杨长平. 牛磺酸对花鲈生长性能、消化酶活性、抗氧化能力及免疫指标的影响. 南方水产科学. 2021(02): 78-86 .  本站查看
本站查看
9. 王迎伟,任昕,陈君,陈永庆,耿硕,郑超,李杨,于佳佳,王立新. 黄河盐碱地区南美白对虾淡化技术研究. 家畜生态学报. 2021(04): 57-62 .  百度学术
百度学术
10. 杨肖杰,黄卉,李来好,杨贤庆,赵永强,岑剑伟,郝淑贤. 南美白对虾酶促剥壳工艺优化及其对虾仁品质的影响. 食品与发酵工业. 2021(11): 119-125 .  百度学术
百度学术
11. 韩梦瑶,王晓梅,王占旗,叶金云,张忠山. 天然活性多糖在水产动物养殖中的应用. 水产学杂志. 2021(04): 85-92 .  百度学术
百度学术
12. 樊英,王晓璐,刘吉丹,刘洪军,王友红,盖春蕾,许拉,叶海斌,吴海一,麻丹萍,张涛. 盐度胁迫对非洲斑节对虾生理特征的影响. 广西科学院学报. 2021(02): 123-132 .  百度学术
百度学术
13. 苏家齐,祝华萍,朱长波,张博,李婷,陈素文. 盐度和钠离子/钾离子对凡纳滨对虾幼虾存活与组织结构的影响. 南方水产科学. 2021(05): 45-53 .  本站查看
本站查看
14. 董甜甜,崔彦婷,王忠凯,龙劲男,陈怡更,王聪,赵楠楠,王仁杰,李玉全. 高盐胁迫对凡纳滨对虾(Litopenaeus vannamei)生长、代谢和抗氧化酶活力的影响. 海洋与湖沼. 2020(05): 1239-1245 .  百度学术
百度学术
15. 虞为,杨育凯,陈智彬,林黑着,黄小林,周传朋,杨铿,曹煜成,黄忠,马振华,李涛,王珺,王芸,荀鹏伟,黄倩倩,于万峰. 饲料中添加螺旋藻对花鲈生长性能、消化酶活性、血液学指标及抗氧化能力的影响. 南方水产科学. 2019(03): 57-67 .  本站查看
本站查看
16. 王伟,胡立新,伏光华,张海丽. 红景天苷单克隆抗体的制备及间接竞争酶联免疫方法的建立. 福建农业学报. 2019(05): 595-599 .  百度学术
百度学术
其他类型引用(6)



 下载:
下载:

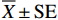
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
