Cloning, structure analysis and expression of interferon gamma (IFN-γ) gene in Oreochromis niloticus
-
摘要:
γ-干扰素(interferon,IFN)是调控天然免疫与细胞免疫的一种重要细胞因子,在抵抗病毒入侵和细菌感染中发挥重要作用。该研究从尼罗罗非鱼(Oreochromis niloticus)脾脏组织中扩增到γ-干扰素基因的cDNA,大小为621 bp,编码206个氨基酸。生物信息学分析表明,尼罗罗非鱼γ-干扰素分子(On IFN γ)具有信号肽、IFN特征序列及核定位信号。预测的三级结构与人类IFN γ晶体结构最相似。qPCR检测显示,IFNγ在正常鱼体内的脾脏中表达量最高,其次是肠、鳃和肾脏。感染无乳链球菌(Streptococcus agalactiae)后,On IFN γ在脾脏、肾和鳃中的表达均显著上调(P < 0.05)。On IFN γ在相关免疫器官中的高表达、受感染后的表达上调,说明其在罗非鱼免疫防御中可能具有重要作用。该研究为进一步开展On IFN γ基因的功能研究、探讨其在抗病转基因及抗病选育中的开发应用奠定了基础。
Abstract:Interferon-γ is a cytokine crucial for the regulation of both natural and cellular immunity, playing an important role in defending against virus invasion and bacterial infection. In this study, the cDNA of interferon-γ genes was amplified from the spleen tissues of Nile tilapia; this cDNA had an open reading frame of 621 bp, encodeing 206 amino acids. Bioinformatics analysis shows that the interferon-γ molecule of Nile tilapia contains one signal peptide and one nuclear localization signal. Its tertiary structure was similar with the crystal structure of human interferon-γ. Real-time fluorescent quantitative polymerase chain reaction (PCR) shows that the expression level of interferon-γ gene was the highest in the spleen of normal Nile tilapia, followed by the intestines, gills and kidneys (P < 0.05). Both the high expression of interferon-γ in immune-associated tissues and its upregulated expression after GBS infection reveal the significant role of interferon-γ in the immune defense of Nile tilapia. This study lays foundation for further research on the function of interferon-γ gene in Nile tilapia as well as its development and application in transgenesis and selective breeding for disease resistance.
-
南海北部资源状况对整个南海渔业的可持续开发至关重要,近年来,由于过度开发和海洋环境变化等因素,南海近海渔业资源严重衰退,呈现优质经济鱼类数量比例下降、种类组成小型化、低龄化、性成熟提早的严峻生物学表现[1]。为了恢复枯竭的近海渔业资源,1999年起中国在南海海域实行伏季休渔,每年6月1日—7月31日,在北纬12°以北的南海海域(含北部湾),禁止所有拖网(含拖虾、拖贝)、围网及掺缯作业。2000年伏季休渔的作业类型扩大为“除刺网、钓业外的其他所有作业类型”[2-3]。2009年伏季休渔的时间延长至两个半月,调整为5月16日—8月1日。2017年南海伏季休渔的时间进一步延长至5月1日—8月16日。至今南海的伏季休渔已连续实施了19年,取得了公认的生态效益、经济效益和社会效益[4-9]。相关研究主要以现场调查和声学调查为主[9-10],伏季休渔生态效应的定量研究还需要多学科交叉和多技术手段的综合应用。卫星遥感提供了从空间快速获取大量海面信息的途径,具有时效性高、客观性强、监测范围大等显著优势,已成功应用于资源评估、环境监测、污染灾害预警预报、海洋工程等领域[11-13]。利用卫星遥感技术开展伏季休渔效果研究,评估当前伏季休渔对渔业资源恢复和养护的作用,对于进一步完善休渔制度和提高渔业资源管理水平具有重要意义。
伏季休渔有效缓解了近海渔业资源衰退的局面、减少了对海域生态环境的破坏,为渔业资源的可持续利用奠定了良好的基础,但也存在对休渔对象和捕捞作业的管理不足等亟待解决的难点问题[4-8]。因此,本研究根据渔业环境卫星遥感资料和现场拖网调查的结果,从海域生态环境和渔业资源生物量变动等方面,评价大亚湾伏季休渔的实施效果,提出完善休渔制度的建议,为南海近岸渔业资源的可持续利用和管理提供科学依据。
1. 材料与方法
1.1 调查方法
休渔前(2015年5月)和休渔后(2015年8月)按照设置的站位对大亚湾海域进行了拖网调查 (图1)。各项监测和采样方法均按《海洋调查规范》(GB 12763—2007)和《海洋监测规范》(GB 17378—2007)规定方法进行。拖网调查船主机功率219.32 kW,总吨位104.98 t,拖网上纲46 m,下纲46 m,网口周长30.7 m,网口网目为4.2 cm,囊网网目为3.3 cm。渔业资源拖网调查参照《海洋渔业资源调查规范》(SC/T 9403—2012)的规定。在14个调查站位各拖网采样1次,各网次采样的拖速约为3.0 n mile·h–1,时间为1 h。起网后对渔获物进行抽样,取1/8进行种类鉴定、分类计数、称质量,并对渔获进行生物学测定,体长、甲宽等以mm为单位,体质量以g为单位。所有样品个体鉴定到种,体质量精确到0.1 g,其中渔获物体长、体质量由工作人员运用标尺及电子秤进行手动逐条测量、统计、汇总。
1.2 数据和分析方法
1)卫星遥感资料。2015年伏季休渔前后的大亚湾海表温度(sea surface temperature, SST)、海表叶绿素a (chlorophyll a, Chl-a) 浓度数据来自美国NASA的MODIS卫星数据产品(https://ocancolor.gsfc.nasa.gov/)。把2015年5月和8月每天的SST和Chl-a数据去除无效值、做月平均和数据融合,并进行克里金插值[14],得到月平均分布图。数据的时间分辨率为天,空间分辨率为4 km。应用R软件编程提取研究区域SST和Chl-a卫星遥感数据,并进行可视化。
2)单位捕捞努力量渔获量[15] (catch per unit effort,CPUE,单位是kg·h–1),计算公式为:
$$ \quad\quad\quad\quad\quad\quad\quad\quad\quad {\rm CPUE} = \frac{C}{t} $$ (1) 式中C为总渔获物质量(包括鱼类、虾类和蟹类等,kg);t为时间(h)。
3) CPUE分布密度曲线[16]。表示一组CPUE数据对应的概率密度值分布状况,即CPUE数据分布趋势,其中密度值表示数据分布和集聚状况的概率值,其范围为0~1,为无单位量纲。假设有n个CPUE为X1~Xn,要计算某一个CPUE的概率密度值,计算公式为:
$$ \quad\quad\quad\quad\quad\quad f(x) = \frac{1}{{nh}}\sum\limits_{i = 1}^n {k(\frac{{x - {X_i}}}{h}} ) $$ (2) 其中x为CPUE,k为核密度函数,本研究选取高斯分布函数;h为设定的窗口宽度,选取高斯核密度估计量的带宽,应用R语言的密度函数计算CPUE分布密度曲线。
4)多样性指数和优势度[17]。
Shannon-Wiener多样性指数:
$$ \quad\quad\quad\quad\quad\quad\quad\quad\quad H' = - \sum\limits_{i = 1}^S {{{{P}}_{{i}}}\ln {P_i}} $$ (3) Pielou均匀度指数:
$$ \quad\quad\quad\quad\quad\quad\quad\quad\quad\quad J' = \frac{{H'}}{{\ln S}} $$ (4) 优势度:
$$ \quad\quad\quad\quad\quad\quad\quad\quad\quad\quad Y = \frac{{\mathop n\nolimits_i }}{N} \times \mathop f\nolimits_i $$ (5) 式中S为各站渔获的种类总数,Pi为第i种的个体数与总个体数的比值,ni为第i种的个体数量,fi为种类出现的频率,N为样品中生物个体总数。
5)生物量谱。生物量谱是由Platter和Denman首次提出的、分析群落状况的方法和指标之一[18-19]:
$$ \quad\quad\quad\quad\quad\quad\quad\quad\quad\quad\; y = ax + b $$ (6) 式中x为对数化的渔获物平均个体体质量,y为对数化的各个区间总生物量,a为谱线的斜率表示群落的粒径结构,b为谱线截距表示群落的生物丰度。
2. 结果
2.1 伏季休渔前后SST、Chl-a及CPUE空间分布
对大亚湾伏季休渔前后卫星遥感SST、Chl-a及现场调查渔业资源CPUE进行空间叠加分析(图2),结果表明,休渔前SST变化范围为22~32 ℃,ρ (Chl-a)为2.5~7.5 mg·m–3,CPUE为0~30 kg·h–1,高CPUE值主要分布在SST (28~32 ℃)和ρ (Chl-a) (3.0~7.0 mg·m–3)较高的湾口区域。休渔后SST变化范围为24~36℃,ρ (Chl-a)为4~10 mg·m–3,CPUE为20~60 kg·h–1,海域SST、Chl-a及CPUE均增加,高CPUE值主要分布在SST为32~36 ℃、ρ(Chl-a)为4.0~8.0 mg·m–3的湾口区域。休渔后,大亚湾平均SST及Chl-a增加,湾内水域SST及Chl-a空间分布较一致;平均CPUE空间分布特征与休渔前一致,均为湾口大于湾内,平均CPUE约为休渔前的2倍。
2.2 伏季休渔前后CPUE变动
大亚湾伏季休渔前(5月) CPUE变化范围为0~30 kg·h–1,主要分布在0~10 kg·h–1,最高密度值为0.20 (图3)。休渔后(8月) CPUE变化范围为0~80 kg·h–1,主要分布在0~40 kg·h–1,最高密度值为0.08 (图3)。伏季休渔后,在CPUE低值范围 (0~10 kg·h–1)内CPUE密度降低到休渔前的一半,CPUE提高、变化范围增大(图3)。
2.3 伏季休渔前后渔业资源种类组成及其CPUE变动
大亚湾伏季休渔前后渔获种类数分别为30种和24种(表1)。伏季休渔前,主要渔获种类(平均CPUE≥1 kg·h–1)有14种,分别为中华小沙丁鱼(Sardinella nymphaea)、带鱼(Trichiuru haumela)、蓝圆鲹(Decapterus maruadsi)、斑逖(Clupanodon punctatus)、杜氏枪乌贼(Loligo duvaucelii)、刺鲳(Psenopsis anomala)、月腹刺鲀(Gastrophysus lunaris)、银鲳(Pampus argenteus)、丽叶鲹(Caranx kalla)、金色小沙丁鱼(S.aurita)、鹿斑鲾(Leiognathus ruconius)、黄鲫(Setipinna taty)、赤鼻棱鳀(Thrissa kammalensis)、黑鲷(Sparus macrocephalus)。其中中上层鱼类11种,底层鱼类3种。中华小沙丁鱼的平均CPUE最高,为28.84 kg·h–1 (图4)。伏季休渔后,主要渔获种类(平均CPUE≥1 kg·h–1)有8种,分别为黄斑篮子鱼(Siganus oramin)、黄吻棱鳀(T.vitirostris)、月腹刺鲀、中华小沙丁鱼、裘氏小沙丁鱼(S.jussieu)、蓝圆鲹、印度小公鱼 (Stolephorus indicus)、带鱼。其中中上层鱼类5种,底层鱼类3种。黄吻棱鳀的CPUE最高,为72.24 kg·h–1 (图4)。休渔期前后的主要渔获种类均为中上层鱼类,休渔后中上层及底层鱼类的CPUE明显增加(图4)。
表 1 大亚湾伏季休渔前后渔获种类数Table 1. Species number in Daya Bay in pre- and post-SFM调查时间
survey time总渔获
total catch鱼类
Fish虾类
Shrimp蟹类
Crab头足类
Cephalopods休渔前 (5月)
pre-SFM (May)30 25 1 2 2 休渔后 (8月)
post-SFM (August)24 22 0 1 1 2.4 伏季休渔前后渔业资源多样性指数及优势种变化
大亚湾伏季休渔前后渔业资源优势种及其优势度见表2。以Y>0.02为优势种,大亚湾海域休渔前优势种有6种,主要以蓝圆鲹、杜氏枪乌贼等为主。休渔后的优势种有7种,主要以中华小沙丁鱼、带鱼等为主。
表 2 大亚湾伏季休渔前后优势种和优势度Table 2. Dominant species and dominance in Daya Bay in pre- and post-SFM休渔前 (5月)
pre-SFM (May)休渔后 (8月)
post-SFM (August)种类
species优势度 (Y)
dominance种类
species优势度 (Y)
dominance鹿斑鲾 Leiognathus ruconius 0.07 中华小沙丁鱼 Sardinella nymphaea 0.21 赤鼻棱鳀 Thrissa kammalensis 0.04 斑条魣 Sphyraena jello 0.13 蓝圆鲹 Decapterus maruadsi 0.20 康氏马鲛 Scomberomorus commerson 0.05 杜氏枪乌贼 Loligo duvaucelii 0.11 带鱼 Trichiuru haumela 0.11 丽叶鲹 Caranx kalla 0.03 燕尾鲳 Hapaloyenys mucronatus 0.08 带鱼 Trichiuru haumela 0.10 金线鱼 Nemipterus virgatus 0.02 丽叶鲹 Caranx kalla 0.10 大亚湾休渔期前鱼类H'为2.32,J'为0.46;休渔后鱼类H'为2.68,J'为0.59 (图5)。
2.5 伏季休渔前后总渔获物体长、体质量及生物量谱变化
对大亚湾伏季休渔前后总渔获物(包括鱼类、头足类和虾类等)的体长和体质量关系进行线性拟合。结果表明,休渔前总渔获物体长范围为0~180 mm,体质量范围为0~150 g,体长和体质量拟合相关系数为0.50 (图6-a)。休渔后总渔获物体长范围为0~200 mm,体质量范围为0~180 g,体长和体质量拟合相关系数为0.58 (图6-a)。伏季休渔后总渔获物的体长、体质量范围增大,体长和体质量拟合相关系数增加了0.08。
大亚湾伏季休渔前后标准化生物量谱回归分析结果表明,伏季休渔前标准化生物量谱线性回归的斜率为 –1.17,小于 –1,说明伏季休渔前渔业资源群落的生物量随着体质量的增加呈不均匀分布,随着体质量的增加生物量减少。伏季休渔后标准化生物量谱线性回归的斜率为 –0.96,大于 –1,说明休渔后渔业资源群落的生物量随着体质量的增加而增加,其相关系数R2值及截距也明显高于休渔前(图6-b)。
3. 讨论
3.1 大亚湾伏季休渔后CPUE提高
伏季休渔是保护水生生物资源,促进资源可持续利用的重大举措,该措施为缓和渔业资源可捕量不足和捕捞强度过大这一矛盾,起到了一定的积极作用[20]。本研究表明,大亚湾伏季休渔后总渔获量增加,中上层及底层主要渔获种类CPUE大于休渔前;休渔期间总渔获物的体长和体质量范围增大,生长速度较快;休渔后生物量随着渔获物个体体质量的增加而增加。伏季休渔期间是大亚湾经济鱼类产卵高峰期[21],休渔制度彻底限制了对幼鱼资源破坏的捕捞渔具,降低了捕捞强度,使幼鱼的生长获得一个较为稳定的环境。
本研究表明,伏季休渔后大亚湾总渔获量比休渔前高。休渔后(8月),大亚湾海域SST升高且明显高于休渔前,海表温差较小,空间分布较均匀,水体Chl-a增加,水域初级生产力较高。这些为鱼类等海洋生物的生长提供了适宜的环境和相对充足的饵料,渔获物的体长和体质量不断增加,休渔后主要渔获物CPUE明显提高。每年5—8月是大亚湾主要经济鱼类的产卵期[20],休渔期间正值大亚湾海域由春季向夏季过渡,夏季大亚湾SST、Chl-a不断增加,生物群落结构和功能稳定性高,且大于春季[22-23],因此伏季休渔后渔获量比休渔前高。
本研究表明伏季休渔后渔获量与2007—2008年大亚湾海域伏季休渔前后渔获量变化结果一致[24-25]。但是,2015年伏季休渔后的渔获量比2007年和2008年的低,2008年的渔获量比2007年低,这主要是因为伏季休渔短期的效果显著,但休渔成果难以长期巩固[24-26]。此外,近30年来大亚湾附近海域工业、农业和养殖业等产业迅速发展,给大亚湾渔业生态环境带来巨大的压力,渔业资源严重衰退[11,26-28]。
3.2 伏季休渔后大亚湾渔业资源群落多样性增加
大亚湾伏季休渔后渔业资源H'增加了0.36,J'增加了0.14。休渔期间人为因素对鱼类生态群落干扰强度下降至最低[3-4],渔业资源群落结构得到改善。历史上大亚湾以中下层鱼类占优势,其次是中上层和底层鱼类[29-30]。2004—2005年大亚湾海域中下层鱼类最多,其次是中上层和底层鱼类;该时期夏季鱼类的H'为3.82,J'为0.65[29]。本研究对2015年大亚湾伏季休渔前后的研究表明,主要渔获种类以中上层鱼类最多,其次是底层鱼类。这可能是因为近年来随着大亚湾经济的发展,深水码头的兴建和航道的挖掘及拖网捕捞,大亚湾海域的底质环境的破坏和扰动现象较为显著,底层鱼类减少[11-12,29]。虽然伏季休渔使大亚湾渔业资源量有所恢复,休渔后的渔获量及单位时间捕捞努力量也有所增加,但是,休渔后鱼类H'和J'均低于2004—2005年同期水平[29]。1980—2007年期间大亚湾海域鱼类的种类数呈逐年减少的趋势,由1980年的157种减少至2004—2005年的107种;夏季鱼类的种类数一般高于春季[24,26,29]。本研究发现,伏季休渔后渔获物种类数比休渔前减少了6种。大亚湾渔业资源种类数量由夏季向秋季、冬季和春季递减[28],导致伏季休渔后鱼类的种类数量变动。另外,伏季休渔对恢复经济鱼类种群结构的效果有限,无法在短时期内扭转渔业资源衰退的状况[5,20]。伏季休渔为渔业资源增殖和养护提供了一段时间,但也缩短了捕捞季节,休渔期结束后,捕捞强度加剧,休渔期对资源养护的效果,当年很快就消失殆尽[3,20]。此外,由于资源调查的站位有限,休渔后渔获物种类数降低也可能与调查和取样误差有关,还需要积累长期的调查数据进行分析。
3.3 继续完善休渔制度的建议
伏季休渔是迄今为止最具实质性的渔业资源保护措施之一,基本保持了大亚湾渔业资源及捕捞生产的稳定,客观上延缓了大亚湾持续枯竭的生物资源状况,产生了显著的生态、经济和社会效益[3]。但大亚湾渔业捕捞生产本身也存在一定的局限性,如非休渔期间捕捞强度过大、近岸渔业资源衰退、捕捞生产监管不足等影响了休渔制度的效果[20]。笔者建议从以下3个方面进一步完善休渔制度。
1)严格执行伏季休渔,适当延长休渔期。从资源保护的角度,休渔时间越长对渔业资源的养护效果越好。目前,由于监管力量不足等方面的原因,休渔期非法渔业作业偶有发生,干扰休渔期间幼鱼的生长。因此,严格执行休渔制度,加大对伏季休渔违规作业,特别是涉及“三无”船舶、非法网具及“电毒炸”等违法捕捞行为的打击力度[3],确保伏季休渔对近海渔业资源的恢复和养护效果。适当延长休渔期,有助于幼鱼在休渔期间获得相对充足的生长时间,更好地保护鱼类的持续生长,养护近海渔业资源。休渔前后鱼类的种类变动较大,这可能是因为:①休渔后有部分种类从外海转入,或者非优势种经休渔后成为优势种,如黄吻棱鳀在休渔前并非优势种,休渔后成为优势种;②大亚湾海域渔业资源种类变动具有季节特征,春季和夏季优势种类有一定差异[22-23,29],休渔期正值春季向夏季过渡时期,季节变动也在一定程度上影响了大亚湾休渔前后优势种类。据报道,优质经济鱼类资源的恢复需要较长时间,休渔对改善大亚湾的渔业资源状况作用有限[26],大亚湾渔业资源呈现生命周期长、个体大和营养级高的鱼类减少,而生命周期短、个体小、营养级低的鱼类种类增多的趋势[22-23]。此外,由于全球气候变化和人类活动增加的影响,近海鱼类产卵期提前[4]。延长休渔期有利于更好地保护产卵群体和幼鱼,促进近海渔业资源的可持续发展。
2)减控近海渔船,发展外海渔业。虽然通过伏季休渔,把捕捞压力降到最低,使休渔后CPUE显著升高。但是休渔期结束后,捕捞压力增大,伏季休渔的成果短时间内消耗殆尽[25]。因此,控制近海渔船,缓解近海捕捞能力严重过剩,促进渔业资源可持续开发利用。此外,为缓解南海近海渔业资源衰退,引导渔民向外海开拓新的渔场。南海陆架区以外的深海海域中蕴藏着丰富的大洋性头足类和金枪鱼类资源,尤以鸢乌贼(Sthenoteuthis oualaniensis)和黄鳍金枪鱼(Thunnus albacares)最具开发潜力[30-31]。引导渔船向南海中南部深水区转移,带动加工、贸易等相关产业发展,不仅可以缓解渔民转产转业压力、降低近海捕捞强度、促进捕捞结构调整,还具有潜在的社会、经济和生态效益。
3)加强资源养护,推进生态修复。伏季休渔对恢复大亚湾渔业资源状况作用有限,人工鱼礁在资源增殖、养护和海域生态环境修复方面的作用长期存在,对伏季休渔是一种很好的补充[32-33]。此外,渔业资源增殖放流也是恢复渔业资源、优化生产结构、改善海域生态环境的有效措施之一[34]。自20世纪90年代以来,大亚湾海域持续多年进行伏季休渔期间渔业资源增殖放流,在改善渔业资源结构、补充经济鱼类数量等方面取得了较好的效果[35-36]。而且,每年5—8月是大亚湾主要经济鱼类的产卵期,适宜实施增殖放流[37-39]。因此,休渔期间开展增殖放流是加强渔业资源养护的有效措施。
4. 结论
本研究应用卫星遥感资料对大亚湾海域伏季休渔的效果进行评价,是卫星遥感应用于小尺度渔业领域的成功探索。伏季休渔后遥感SST、Chl-a增加,空间分布更均匀,鱼类适宜生活水域空间增大,大亚湾渔业资源CPUE增加,总渔获物体长、体质量范围增加,生长速度加快。渔业资源H'和J'分别增加了0.36和0.14,群落结构更加稳定。渔业资源群落的生物量谱研究表明,休渔后生物量随着个体体质量的增大而增加。伏季休渔降低了近海的捕捞强度,起到恢复和养护渔业资源的作用。建议采取适当延长休渔期、减控近海渔船数量、加强资源养护等措施,进一步完善休渔制度,促进近海渔业资源的可持续发展。
-
图 1 尼罗罗非鱼γ-干扰素基因的cDNA序列及其编码氨基酸序列
A.灰色背景框标注为信号肽序列;白色背景框标注为保守的四螺旋细胞因子类结构(four-helical cytokine-like/core);下划线标注为多腺苷酸化信号(AATAAAA);B.尼罗罗非鱼IFNγ与其他物种IFNγ氨基酸序列3′端IFNγ特征序列及核定位序列比对结果,D.rerio IFNγ,I.punctatus IFNγ,E.coioides IFNγ,O.mykiss IFNγ,T.rubripes IFNγ,C.aurtus IFNγ,H.sapiens IFNγ,M. musculus IFNγ GenBank登录号见图 3图注;虚线框标注为IFNγ特征序列和核定位序列(NLS)。On.O.nilloticus; Dr.D.rerio; Ip.I.punctatus; Ec.E.coioides; Om.O.mykiss; Tr.T.rubripes; Ca.C.aurtus; Cc.Cyprinus carpio;Hs.H.sapiens; Mm.M.musculus
Figure 1. cDNA and amino acid sequence of O.niloticus γIFN gene
A. The signal peptides are gray boxed; the conserved four-helical cytokine-like/core are white boxed; the putative polyadenylation signal (AATAAAA) is dot-lined. B. The IFNγ signature sequence and nuclear localization sequence (NLS) are dashed boxed; the GenBank accession NO. of D.rerio IFNγ, I.punctatus IFNγ, E.coioides IFNγ, O.mykiss IFNγ, T.rubripes IFNγ, C.aurtus IFNγ, H.sapiens IFNγ, M.musculus IFNγ are listed in Fig. 3.
图 3 尼罗罗非鱼与其他鱼类γ-干扰素基因的系统进化树
GenBank登录号:鲈形总目:红鳍东方鲀IFNi-CAE82301;斑点绿河豚IFNa-AHZ62714.1;牙鲆IFNl-AB435093;斜带石斑鱼IFNe-JX013936;骨鳔总目:斑点叉尾IFNal-AAZ40504,IFNγ2a-AAZ40505,IFNγ2b-AAZ40506;斑马鱼IFNio-NP_001018629,IFNγ2-NP_998029;兰氏鲫IFNas-BAM09181,IFNγ2-BAM66958;鲤鱼IFNγ-AM168523,IFNγrel-AM261214;金鱼IFNs-ACG68885,IFNγrel-ACV41807;其他:虹鳟IFNo-NP_001153976;人IFNγ-L07633;小鼠IFNγ-NM_008337
Figure 3. Phylogenetic tree based on γIFN gene of O.niloticus and other teleosts
GenBank accession NO.:Percomorpha: T.rubripes IFNb-CAE82301;T.nigroviridis IFNg-AHZ62714.1;P.olivaceus IFNa-AB435093; E.coioides IFNo-JX013936;Ostariophysi: I.punctatus IFNγ1-AAZ40504, IFNγ2a-AAZ40505, IFNγ2b-AAZ40506; D.rerio IFNio-NP_001018629, IFNγ2-NP_998029;C.auratus langsdorfii IFNγ1-BAM09181, IFNγ2-BAM66958;C.carpio IFNγ-AM168523, IFNγrel-AM261214;C.auratus IFNa-ACG68885, IFNγrel-ACV41807;O.mykiss IFNk-NP_001153976; H.sapiens IFNγ-L07633;M.musculus IFNγ-NM_008337
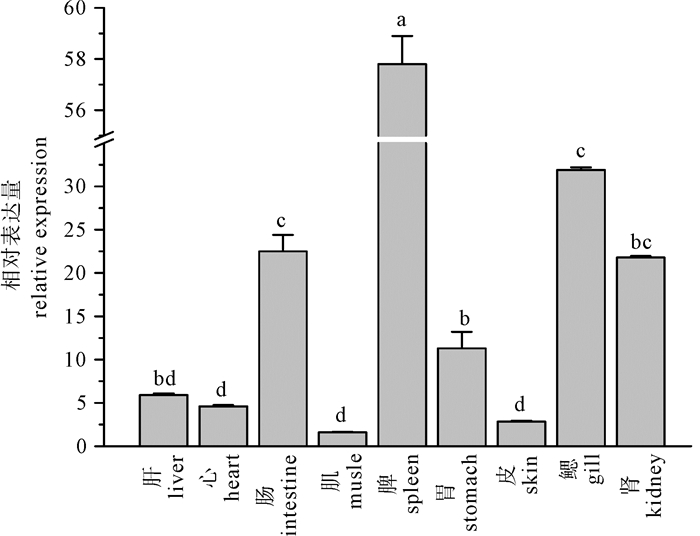
图 4 尼罗罗非鱼γ-干扰素基因mRNAs在不同组织中的表达
以18S rRNA基因为内参基因,计算各组织表达量与表达量最低组织的表达量的倍数(数据点表示平均值±标准误,n=6);标注具相同字母的各柱间,表示差异不显著(P>0.05);反之,表示差异显著(P < 0.05)。
Figure 4. Tissue distribution of O.niloticus γ-IFN mRNAs measured by qPCR
Expression values were normalized to those of 18S rRNA gene. Data were expressed as the mean fold change (X±SE, n=6). Bars with different letters indicate significant difference (P < 0.05).
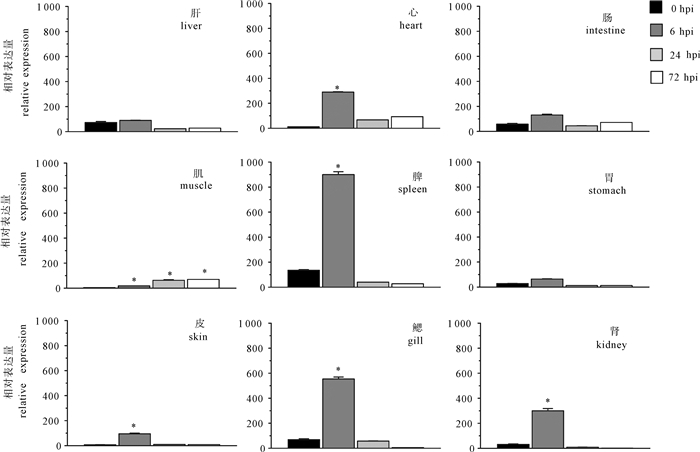
图 5 受无乳链球菌感染后尼罗罗非鱼γ-干扰素基因mRNAs组织表达的变化
以18S rRNA为内参,计算各组织表达量与空白组织的表达量的倍数。*表示差异显著(P < 0.05)。
Figure 5. Temporal expression profile of the γIFN mRNAs of O.niloticus challenged by S.agalactiae measured by qPCR
Expression values were normalized to those of 18S rRNA. Data were expressed as the mean fold change from the control group. Significant difference among the samples at different time in the same tissue is indicated with asterisk (P < 0.05).
表 1 尼罗罗非鱼γ-IFN基因的克隆及qPCR引物序列
Table 1 Primers for Nile tilapia γ-IFN gene clone and qPCR analysis
引物 primer 引物序列(5′→3′) primer sequence 用途 purpose F1 ATGGCTACCACAGTGAGGGC 扩增γ-IFN基因 R1 CCTTTTAAACTCTGGGGCGA 扩增γ-IFN基因 F2 GGGTGGTGTTTTGGAGTCGT qPCR R2 TAGCGAGCCTGAGTTGTTGGT qPCR 18S-F CCTGAGAAACGGCTACCACAT qPCR 18S-R CAGACTTGCCCTCCAATGGAT qPCR -
[1] ISAACS A, LINDENMANN J. Virus interference. I. The interferon [J]. Proc R Soc Lond B, 1957, 147(927):258-267. doi: 10.1098/rspb.1957.0048
[2] 杨生海, 殷宏, 刘永生, 等.干扰素-γ研究进展[J].生物技术通报, 2010(8):29-34. http://www.oalib.com/paper/4913523 [3] 丰宗洋, 陈书明.干扰素的研究及应用[J].畜牧与兽医, 2012, 44(S1):47-51. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=xmys2012s1017&dbname=CJFD&dbcode=CJFQ [4] LANGEVIN C, ALEKSEJEVA E, PASSONI G, et al. The antiviral innate immune response in fish:evolution and conservation of the IFN system [J]. Mol Biol, 2013, 425(24):4904 -4920. doi: 10.1016/j.jmb.2013.09.033
[5] CHAN Y J, JUNICHI H, MAKI O, et al. Recombinant interferon-γ activates immune responses against Edwardsiella tarda infection in the olive flounder, Paralichthys olivaceus [J]. Fish Shellfish Immunol, 2012, 33(2):197-203. doi: 10.1016/j.fsi.2012.04.015
[6] YAMASAKI M, ARAKI K, NAKANISHI T, et al. Role of CD4 (+) and CD8α (+) T cells inprotective immunity against Edwardsiella tarda infection of ginbuna crucian carp, Carassius auratus langsdorfii [J]. Fish Shellfish Immun, 2014, 36(1):299-304. doi: 10.1016/j.fsi.2013.11.016
[7] ZOU J, SECOMBES C J. Teleost fish interferons and their role in immunity [J]. Dev Comp Immunol, 2011, 35(12):1376-1387. doi: 10.1016/j.dci.2011.07.001
[8] ZOU J, YOSHIURA Y, DIJKSTRA J M, et al. Identification of an interferon gamma homologue in Fugu, Takifugu rubripes [J]. Fish Shellfish Immunol, 2004, 17(4):400-409. https://www.sciencedirect.com/science/article/pii/S1050464808002878
[9] IGAWA D, SAKAI M, SAVAN R. An unexpected discovery of two interferon gamma-like genes along with interleukin (IL)-22 and -26 from teleost:IL-22 and -26 genes have been described for the first time outside mammals [J].Mol Immunol, 2006, 43(7):999-1009. doi: 10.1016/j.molimm.2005.05.009
[10] ZOU J, CARRINGTON A, COLLET B, et al. Identification and bioactivities of IFN-gamma in rainbow trout Oncorhynchus mykiss:the first Th1-type cytokine characterized functionally in fish [J].J Immunol, 2005, 175(4):2484-2494. doi: 10.4049/jimmunol.175.4.2484
[11] ROBERTSEN B. The interferon system of teleost fish[J].Fish Shellfish Immunol, 2006, 20(2):172 -191. doi: 10.1016/j.fsi.2005.01.010
[12] MILEV-MILOVANOVIC I, LONG S, WILSON M, et al. Identification and expression analysis of interferon gamma genes in channel catfish [J].Immunogenetics, 2006, 58(1):70-80. doi: 10.1007/s00251-006-0081-x
[13] STOLTE E H, SAVELKOUL H F, WIEGERTJES G, et al. Differential expression of two interferon-gamma genes in common carp (Cyprinus carpio L.) [J]. Dev Comp Immunol, 2008, 32(12):1467-1481. doi: 10.1016/j.dci.2008.06.012
[14] GRAYFER L, BELOSEVIC M. Molecular characterization, expression and functional analysis of goldfish (Carassius aurutus L.) interferon gamma [J].Dev Comp Immunol, 2009, 33(2):235 -246. doi: 10.1016/j.dci.2008.09.001
[15] SHIBASAKI Y, YABU T, ARAKI K, et al. Peculiar monomeric interferon gammas, IFNγrel 1 and IFNγrel 2, in ginbuna crucian carp [J].FEBS J, 2013, 281(4):1046-1056. https://www.researchgate.net/publication/259489509_Peculiar...
[16] 程波, 李乐, 康铜, 等.中国罗非鱼质量安全现状调查分析[J].中国渔业质量与标准, 2014, 4(6):9-15. http://www.cnki.com.cn/Article/CJFDTotal-YYZL201406002.htm [17] 刘志刚, 可小丽, 卢迈新, 等.罗非鱼无乳链球菌强毒株基因组表达文库的构建及鉴定[J].南方水产科学, 2015, 11(6):34-40. http://www.schinafish.cn/CN/abstract/abstract9269.shtml [18] YANG J, YAN R, ROY A, et al. The ITASSER Suite:protein struction and function prediction [J].Nat Methods, 2015, 12(1):7-8. http://zhanglab.ccmb.med.umich.edu/I-TASSER
[19] De BERNARDEZ C E, SCHWARZ E, RUDOLPH R. Inhibition of aggregation side reactions during in vitro protein folding [J]. Methods Enzymol, 1999, 309(1):217-236. https://www.sciencedirect.com/science/article/pii/S0076687999090175
[20] HUMPHREY W, DALKE A, SCHULTEN K. VMD:Visual molecular dynamics [J]. J Mol Graph Model, 1996, 14(1):33-38. doi: 10.1016/0263-7855(96)00018-5
[21] 杜娟娟, 董浚键, 叶星, 等.尼罗罗非鱼Siglec-4b like基因的克隆与表达特性分析[J].南方水产科学, 2016, 12(1):67-76. http://www.schinafish.cn/CN/abstract/abstract9287.shtml [22] DONG J J, WU F, YE X, et al. β-defensin in Nile tilapia (Oreochromis niloticus):sequence, tissue expression, and anti-bacterial activity of synthetic peptides [J]. Gene, 2015, 566(1):23 -31. doi: 10.1016/j.gene.2015.04.025
[23] SLODOWSKI O, BÖHM J, SCHÖNE B, et al. Carboxy-terminal truncated rhuIFN-gamma with a substitution of Gln133 or Ser132 to leucine leads to higher biological activity than in the wild type [J].Eur J Biochem, 1992, 202(3):1133-1140. https://www.researchgate.net/publication/21492345_Carboxy-terminal...
[24] 黄贝, 陈善楠, 黄文树, 等.斜带石斑鱼IFN-γ基因的克隆与表达分析[J].中国水产科学, 2013, 20(2):269-275. http://www.cnki.com.cn/Article/CJFDTotal-ZSCK201302005.htm [25] SUN B, SKJÆVELAND I, SVINGERUD T, et al. Antiviral activity of salmonid gamma interferon against infectious pancreatic necrosis virus and salmonid alphavirus and its dependency on type I interferon [J]. J Virol, 2011, 85(17):9188-9198. doi: 10.1128/JVI.00319-11
[26] RODRIGUEZ I, NOVOA B, FIGUERAS A. Immune response of zebrafish (Danio rerio) against a newly isolated bacterial pathogen Aeromonas hydrophila [J].Fish Shellfish Immunol, 2008, 25(3):239-249. doi: 10.1016/j.fsi.2008.05.002
[27] SIEGER D, STEIN C, NEIFER D, et al. Role of gamma interferon in innate immunity in the zebrafish embryo[J]. Dis Model Mech, 2009, 581(11-12):571-581. http://www.ncbi.nlm.nih.gov/pubmed/19779068
[28] WANG Z E, REINER S L, ZHENG S, et al. CD4+ effector cells default to the Th2 pathway in interferon gamma-deficient mice infected with Leishmania major [J].J Exp Med, 1994, 179(4):1367-1371. doi: 10.1084/jem.179.4.1367
[29] HUANG S, HENDRIKS W, ALTHAGE A, et al. Immune response in mice that lack the interferon-gamma receptor [J].Science, 1993, 259(5102):1742-1745. doi: 10.1126/science.8456301
[30] COOPER A M, DALTON D K, STEWART T A, et al. Disseminated tuberculosis in interferon gamma gene-disrupted mice [J].J Exp Med, 1993, 178(6):2243-2247. doi: 10.1084/jem.178.6.2243
-
期刊类型引用(7)
1. 张磊,周艳波,马胜伟,黄应邦,高丽鹏,杜国昱,吴洽儿. 南海伏季休渔期秩序评估体系指标权重分析. 上海海洋大学学报. 2022(02): 491-501 .  百度学术
百度学术
2. Guangjie FANG,Haolin YU,Xinmeng WANG,Huaxiang SHENG,Yanli TANG,Changdong LIU,Chuanxi CHEN,Zhenlin LIANG. Impact of summer moratorium on set-net fishery in Haizhou Bay, China. Journal of Oceanology and Limnology. 2022(04): 1678-1691 .  必应学术
必应学术
3. 吴程宏,张羽翔,刘维,赵海龙,陈敏. 基于上岸渔获调查的海南岛近海渔场伏季休渔效果评价. 渔业研究. 2021(02): 200-206 .  百度学术
百度学术
4. 王言丰,胡启伟,余景,陈丕茂,舒黎明. 粤东柘林湾海洋牧场渔业资源增殖效果评估. 南方水产科学. 2019(02): 12-19 .  本站查看
本站查看
5. 苏莹佳,陈国宝,周艳波,马胜伟,吴洽儿. 2015—2017年南海海域伏季休渔制度实施效果评价. 南方水产科学. 2019(02): 20-28 .  本站查看
本站查看
6. 曾雷,陈国宝,李纯厚,于杰. 大亚湾湾口游泳生物群落季节异质特征与生态效应分析. 南方水产科学. 2019(03): 22-32 .  本站查看
本站查看
7. 王言丰,余景,陈丕茂,于杰,刘祝楠. 北部湾灯光罩网渔场时空分布与海洋环境关系分析. 热带海洋学报. 2019(05): 68-76 .  百度学术
百度学术
其他类型引用(9)




 下载:
下载:














 粤公网安备 44010502001741号
粤公网安备 44010502001741号
