Composition of stomach content of blue shark (Prionace glauca) in the tropical eastern Pacific Ocean
-
摘要:
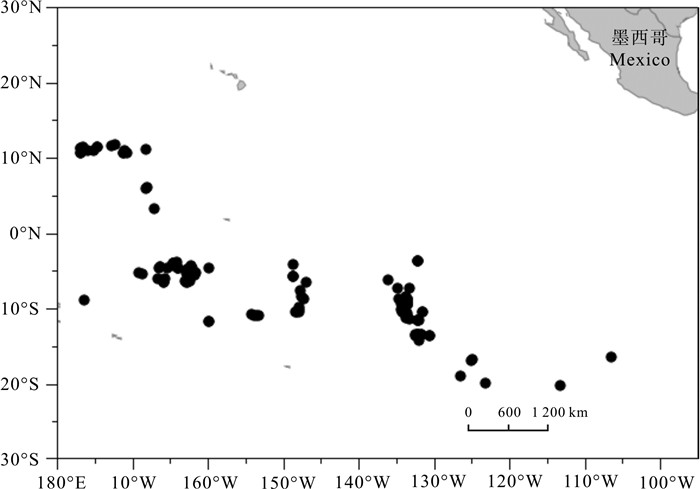
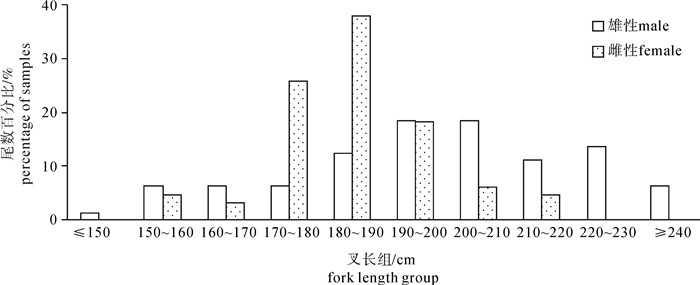
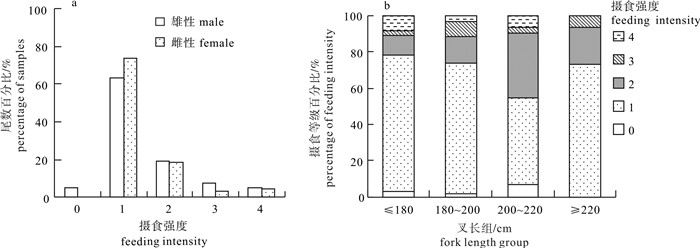
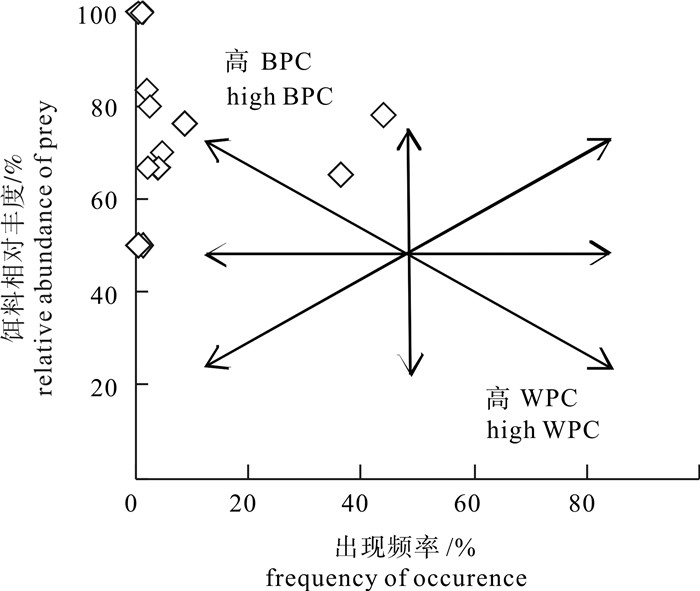
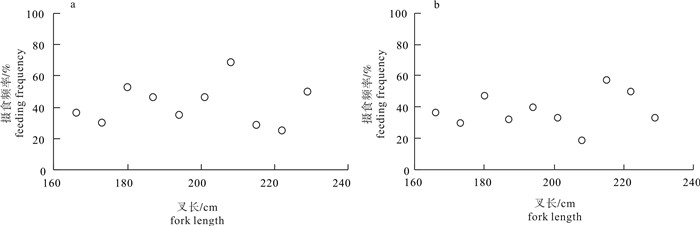
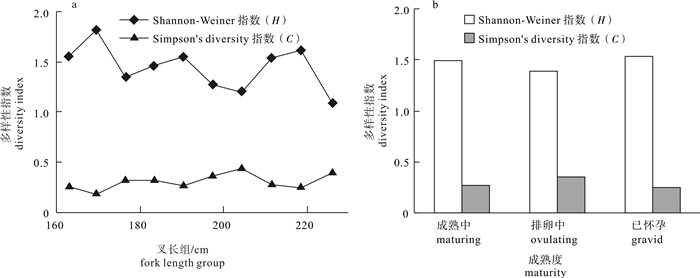
根据2011年10月~2013年12月期间金枪鱼延绳钓渔船海上兼捕采集的样品(雌性66尾、雄性81尾, 未鉴定性别1尾),首次对东太平洋公海海域(25°S~15°N,175°E~105°W)的大青鲨(Prionace glauca)胃含物组成及其多样性进行了探究。结果表明,摄食强度以1级为主(68%),雌雄间无显著差异(χ2,df=4,P>0.1);胃含物种类组成结构,硬骨鱼类占最大比例(占57.3%),其次是头足类(其中鱿占总饵料数的97.9%),雌雄间无显著差异(χ2检验,df=15,P>0.05),但个体间差异大,重叠率低。饵料总体多样性Shannon-Weiner指数(H)为1.78,Simpson指数(C)为0.28。随大青鲨叉长增加,H略呈下降趋势,C略呈上升趋势。成熟中、排卵中、已怀孕3个阶段的雌性个体饵料组成多样性略有差异。聚类分析显示,1月~3月、8月~10月和11月~12月的饵料组成结构中,8月~10月和11月~12月的相似性较高。
Abstract:Based on the samples collected by tuna long-line fishery in the tropical waters of the eastern Pacific Ocean (25°S~15°N, 175°E~105°W) during October 2011 to December 2013, we analyzed the stomach content and prey diversity of blue shark (Prionace glauca). The feeding intensity of blue shark was dominated by level one (68%). The composition of feeding intensity between female and male was not significantly different (χ2-test, P>0.1). Teleosts were major prey items (57.3%), followed by cephalopods (97.9% were squid). The diet composition was not significantly different between female and male, but significantly different among individuals. The Shannon-Weiner diversity index (H) and Simpson diversity index (C) for prey items were 1.78 and 0.28, respectively. The index H decreased but index C increased with increasing blue shark size. The prey diversity indices for female blue sharks in maturing, ovulating and gravid stages were slightly different. Cluster analysis shows that the diet compositions of August~October and November~December were more similar than that of January~March.
-
Keywords:
- Prionace glauca /
- stomach content /
- feeding intensity /
- longline /
- eastern Pacific Ocean
-
钝缀锦蛤 (Tapes dorsatus) 隶属软体动物门、瓣鳃纲、帘蛤目、帘蛤科、缀锦蛤属,俗称沙包螺,主要分布于西南太平洋热带、亚热带海区,常见于我国东海、南海和台湾海峡[1]。其主要栖息于海区潮间带中、低潮区至潮下带及浅海3~15 cm的泥沙底质中,营埋栖生活,在潮间带下部珊瑚块和碎石泥沙中亦有栖息[2-3]。钝缀锦蛤为中大型经济贝类,成体可达100 g以上,具有个体大、生长快、适应性强、品质优等特点,且味道鲜美、营养丰富。目前钝缀锦蛤养殖业主要兴起于北部湾浅海区,以底播养殖为主[4]。
国内外有关钝缀锦蛤的研究报道主要集中在生态习性[2-6]、分类学[7-8]、繁殖生物学[9-12]、育苗[13-14]等方面。对钝缀锦蛤的养殖实验仅见于不同养殖方式和底质对澳大利亚钝缀锦蛤生长与存活的影响[15]以及钝缀锦蛤在防城港海区中培期筐式养殖防风浪模式实验[16]。随着钝缀锦蛤养殖规模的逐渐扩大,传统底播养殖方式出现养殖成活率低、采捕时贝壳破碎率高、劳动量大、回捕率低等问题。探索高效且便于管理的养殖模式是解决这些问题的有效途径之一。已有研究表明,菲律宾蛤仔 (Ruditapes philippinarum)[17]、扁平钳蛤 (Isognomon ephippium)[18]等筏式吊养模式比底播养殖模式具有成活率高、生长速度快等优点。目前尚未见有关钝缀锦蛤在广西北部湾海域不同养殖密度及养殖模式的比较研究。本实验采用筐式养殖开展钝缀锦蛤中培期和养成期不同养殖密度的生长比较研究,并在防城港白龙珍珠湾首次进行网笼吊养,探索钝缀锦蛤在广西北部湾3个海区更为高效且方便管理的养殖模式和各海区的适宜养殖密度,为其在广西北部湾海域的规模化及高效养殖提供参考。
1. 材料与方法
1.1 实验材料
实验所用的钝缀锦蛤稚贝于2021年3月1日购自广东省雷州市覃斗苗场,平均壳长 (2.69±0.51) mm、平均壳高 (1.10±0.18) mm、平均壳宽 (2.21±0.45) mm、平均体质量 (2.17±0.17) mg,2021年3月1日—5月8日在防城港市广西富群海水种苗繁殖有限公司室内标粗68 d后,取大小均一、壳形完整、体质健康无损伤、活力好的钝缀锦蛤贝苗进行海区筐式中培实验,中培实验结束后继续进行海区养成实验。
海区中培和养成所用的实验筐均为聚乙烯塑料筐 (长45 cm×宽35 cm×高15 cm),并搭配孔径1 cm的塑料硬盖 (长45 cm×宽35 cm) (图1-a—1-b)。塑料筐四周的上部分有3排透水口,筐下部分及底部密闭。实验时为方便筐内外进行水流、物质交换,在筐底部钻9~12个孔径为0.50 cm的圆形透水口。
网笼吊养实验使用聚乙烯胶丝编织而成的单层网笼 (底径45 cm、高40 cm、网孔3 cm×3 cm),如图1-c所示。网笼内置养殖网袋 (底径35 cm、高30 cm、网孔1 cm×1 cm),网袋内装入1 kg浮石颗粒基质 (火山石比重为0.45 g·cm−3、孔隙率75%~80%、基质粒径1.50~2.50 cm)。
1.2 实验方法
1.2.1 海区中培期实验
钝缀锦蛤海区中培实验于2021年5月15日开始,至2021年7月14日结束,实验周期为60 d。海区中培实验前随机取室内中培稚贝30粒测量其初始规格:平均壳长 (6.01±0.56) mm、平均壳高 (2.22±0.18) mm、平均壳宽 (4.61±0.37) mm、平均体质量 (0.04±0.01) g。中培实验分别在广西钦州市犀牛脚镇渔港海区 (108.73°E, 21.63°N)、北海市营盘镇沙虫坪海区 (109.28°E, 21.26°N)、防城港市白龙珍珠湾海区 (108.22°E, 21.52°N) 潮间带低潮区近潮下带滩涂进行,大潮潮高约4~5 m。海区中培实验设计5个密度组:d1 (1 000 粒·筐−1)、d2 (1 500 粒·筐−1)、d3 (2 000 粒·筐−1)、d4 (2 500 粒·筐−1)、d5 (3 000 粒·筐−1),每个密度设置12个平行组。养殖实验场地见图2。实验过程中将塑料筐半埋入滩涂,筐上部的四周孔洞外露,并加盖孔径1 cm的塑料硬盖。
海区中培实验期间,每15 d退潮时对每个密度的3个平行组进行不重复取样测量,每个平行组随机取30粒稚贝测量壳长、壳宽、壳高以及体质量 (精确到0.01 g),并计算成活率。测量当日实验海区的水温、滩温、盐度、pH、透明度和溶解氧 (DO),分别用水银温度计、盐度计、CT-6023高精度pH计、塞氏盘、美国YSI ProPlus便携式水质分析仪测量。每次采样测量提前进入养殖实验场地,当海水还未完全退去时在实验场地四周及中心5个点使用1 L的玻璃采水器采集滩涂底层水样,混合均匀后装于1.5 L聚乙烯塑料瓶中,藻样采集后用3%~5% (体积分数) 甲醛固定,经藻类沉降器沉降,尼康倒置显微镜 (TS100) 观察藻属种类及数量。待滩涂露出后将温度计插入养殖实验场地滩涂表层下5~10 cm处测量滩温。
此外,对实验海区的滩涂底质粒径组成进行调查,分别取3个实验海区滩涂表层下约10 cm处的底质200 g,烘干机烘干,以标准检验筛 (GB/T 6003.1—2012) 筛分,参考赵东波等[19]和刘志刚等[20]的海砂粒级分类标准,按优势粒组命名法分类:底质粒径2.00~0.50 mm为粗砂,0.50~0.25 mm为中砂,0.25~0.063 mm为细砂,粒径<0.063 mm为粉砂质黏土。
1.2.2 海区养成期实验
钝缀锦蛤海区养成实验于2021年7月14日开始,至2022年7月19日结束,实验周期为370 d。海区养成前随机取30粒中培幼贝测量初始规格:平均壳长 (17.42±1.63) mm、平均壳宽 (12.01±1.16) mm、平均壳高 (6.95±0.73) mm、平均体质量 (0.87±0.24) g。海区养成与中培实验在相同地点,以筐式进行养殖。实验过程中塑料筐半埋入滩涂,筐上部的四周孔洞外露,并加盖孔径1 cm的塑料硬盖。海区养成实验设置4个密度组:D1 (20 粒·筐−1)、D2 (30 粒·筐−1)、D3 (40 粒·筐−1)、D4 (50 粒·筐−1),每个密度设25个平行组。实验期间,每2个月退大潮时对每个密度的3个平行组进行不重复取样测量,测量时将该平行组所有样本全部筛出,随机取30粒样本 (样本数量不足30粒时取该组的全部贝苗),测量壳长、壳宽、壳高和体质量,并计算成活率。每次取样测量时对当日该实验海区的环境因子进行调查,测量项目同海区中培期。
1.2.3 海区网笼吊养实验
钝缀锦蛤海区网笼吊养实验于2022年7月26日开始,至2023年1月20日结束,实验周期为178 d。海区网笼吊养前随机取30粒钝缀锦蛤1.5龄贝测量初始规格:平均壳长 (44.65±2.83) mm、平均壳宽 (18.27±1.25) mm、平均壳高 (30.06±1.82) mm、平均体质量 (14.48±2.84) g。海区网笼吊养实验地点在防城港市白龙珍珠湾海区,海区网笼吊养实验设置3个密度组: C1 (30 粒·笼−1)、C2 (40 粒·笼−1)、C3 (50 粒·笼−1),按密度梯度放入网笼内网袋基质中,每个密度设置12个平行组。网笼通过吊绳垂挂在珍珠贝养殖浮排上进行垂下式养殖,保持养殖网笼吊养深度为距水面约1.5 m (水深1.5 m)、笼间距20 cm。实验期间,每2个月退大潮时对每个密度的3个平行组进行不重复取样测量,测量方法及项目同海区养成。每次取样测量时对当日该实验海区的环境因子进行调查,项目同海区中培期。
1.3 数据处理
实验数据采用Excel 2019软件整理,结果以“平均值±标准差 (
$ \overline { x}\pm s$ )”表示,使用SPSS 26.0软件对数据进行单因素方差分析 (One-way ANOVA),通过Duncan's多重比较法检验不同组间的差异显著性 ,P<0.05表示差异显著。2. 结果
2.1 钝缀锦蛤中培期的生长与成活率比较
2.1.1 不同海区相同密度的生长和存活情况
钝缀锦蛤海区中培实验结束时在3个不同海区的生长指标和成活率见图3。北海海区d1组除壳宽外的生长指标和成活率均为最高,其中壳长为 (16.51±1.07) mm、壳高为 (11.64±1.11) mm、体质量为 (0.72±0.18) g、成活率为 (78.23±0.92)%。北海海区各密度组的成活率显著高于钦州和防城港海区 (P<0.05),除北海海区d5组的生长指标 (壳长、壳宽及体质量) 小于防城港和钦州海区外,其他各密度组生长指标均大于防城港和钦州海区。北海海区d1—d4密度组的壳长、壳宽、壳高和体质量均高于钦州海区相应组,北海海区d3组各生长指标显著高于钦州和防城港海区 (P<0.05)。
![]() 图 3 钝缀锦蛤在广西北部湾3个海区中培期的生长和成活率注:同一密度、不同海区大写字母不同表示组间差异显著(P<0.05),相同表示组间差异不显著 (P>0.05);同一海区、不同密度,小写字母不同表示组间差异显著(P<0.05),相同表示组间差异不显著 (P>0.05)。图4同此。Fig. 3 Growth and survival rate of nursery culture T. dorsatus in three sea areas of Beibu Gulf, GuangxiNote: Different capital letters for the same density and different sea areas represent significant differences between groups (P<0.05), while the same capital letters represents no significant differences between groups (P>0.05). Different lowercase letters for the same sea area, different densities represent significant differences between groups (P<0.05), while the same lowercase letters represents no significant differences between groups (P>0.05). The same case in Fig. 4.
图 3 钝缀锦蛤在广西北部湾3个海区中培期的生长和成活率注:同一密度、不同海区大写字母不同表示组间差异显著(P<0.05),相同表示组间差异不显著 (P>0.05);同一海区、不同密度,小写字母不同表示组间差异显著(P<0.05),相同表示组间差异不显著 (P>0.05)。图4同此。Fig. 3 Growth and survival rate of nursery culture T. dorsatus in three sea areas of Beibu Gulf, GuangxiNote: Different capital letters for the same density and different sea areas represent significant differences between groups (P<0.05), while the same capital letters represents no significant differences between groups (P>0.05). Different lowercase letters for the same sea area, different densities represent significant differences between groups (P<0.05), while the same lowercase letters represents no significant differences between groups (P>0.05). The same case in Fig. 4.2.1.2 同一海区不同密度的生长和存活情况
在海区水温27.50~30.30 ℃、滩温28.00~31.00 ℃、盐度28‰~29‰ 的条件下,中培实验结束时,北海海区d3组的成活率为 (76.30±1.01)%,与d1、d2组无显著性差异 (P>0.05),显著大于d4和d5组 (P<0.05)。d3组的壳长、体质量显著大于d4和d5组 (P<0.05) (图3)。结果表明,钝缀锦蛤在北海海区的适宜中培密度为2 000 粒·筐−1。
在海区水温27.50~31.70 ℃、滩温28.50~32.00 ℃、盐度27‰~28‰ 的条件下,防城港海区钝缀锦蛤各生长指标和成活率随着中培密度的增加呈下降趋势,中培实验结束时,d2组 (1500 粒·筐−1) 成活率为 (69.31±2.63)%,与d1组差异不显著 (P>0.05),但显著高于其余各密度组 (P<0.05)。d2组壳长、体质量显著高于d4和d5组 (P<0.05) (图3)。结果表明,钝缀锦蛤在防城港海区的适宜中培密度为1 500 粒·筐−1。
在海区水温29.50~30.00 ℃、滩温30.00~30.50 ℃、盐度23‰~27‰ 的条件下,中培实验结束时,钦州海区d2组成活率为66.31%,与d1组无显著性差异 (P>0.05),显著大于d3、d4和d5组 (P<0.05),且d2组壳长、体质量显著大于d4和d5组 (P<0.05) (图3)。结果表明,钝缀锦蛤在钦州海区的适宜中培密度为1 500 粒·筐−1。
2.2 钝缀锦蛤养成期的生长与成活率比较
3个海区结束养成时钝缀锦蛤各生长指标和成活率见图4,养成期钝缀锦蛤的体质量生长曲线见图5。
2.2.1 不同海区相同密度的生长和存活情况
北海D1组钝缀锦蛤的各生长指标和成活率均最高,其中壳长为 (55.65±3.98) mm、壳宽为 (22.09±1.55) mm、壳高为 (36.68±2.19) mm、体质量为 (27.98±4.98) g,成活率为 (95.00±5.00)%。Duncan's法多重比较分析表明,北海和防城港海区D1组的成活率无显著性差异 (P>0.05),但均显著大于钦州海区 (P<0.05),其余3个密度组的成活率在3个海区间差异显著 (P<0.05)。钝缀锦蛤在3个海区不同养殖密度下的壳长、壳宽、壳高、体质量差异均达到显著水平 (P<0.05),不同养殖密度下钝缀锦蛤各生长指标和成活率为北海>防城港>钦州。
2.2.2 同一海区不同密度的生长和存活情况
在海区水温19.50~27.90 ℃、滩温20.80~29.80 ℃、盐度27‰~31‰ 的条件下,北海海区养殖密度为D3时,产量最大 (平均861.03 g·筐−1)。D3组的壳长、体质量、成活率显著高于D4组 (P<0.05)。北海海区各密度组的体质量增长速度变化趋势相同,第6—第10个月水温较低 (19.50~25.30 ℃),体质量增长率从0.09 g·d−1降至0.04 g·d−1,第10—第12个月水温回升 (25.30~27.20 ℃),体质量增长速度加快,由0.04 g·d−1上升至0.08 g·d−1。结果表明,北海海区适宜的养成密度为40 粒·筐−1。
在海区水温17.80~29.30 ℃、滩温19.00~30.00 ℃、盐度26‰~27‰ 的条件下,防城港海区养殖密度为D3 (40 粒·筐−1) 时,平均产量最大 (390.15 g·筐−1),壳长为 (44.36±2.15) mm、体质量为 (14.45±2.55) g、成活率为 (67.50±6.61)%。Duncan's法多重比较分析表明,D3组的成活率显著大于D4组 (P<0.05)。防城港海区第8个月水温最低 (17.80 ℃),第8—第10个月各密度组的体质量增长率降低,由0.05 g·d−1降为0.01 g·d−1,第10—第12个月水温升高,体质量增长速度加快,由0.01 g·d−1上升至0.04 g·d−1。结果表明,防城港海区适宜的养成密度为40 粒·筐−1。
在海区水温16.70~29.80 ℃、滩温17.30~30.40 ℃、盐度23‰~26‰ 的条件下,钦州海区D1组的产量最高,平均122.65 g·筐−1,且成活率显著大于D2、D3和D4组 (P<0.05)。钦州海区第6—第10个月水温降低,4个密度组的体质量增长速度由0.03 g·d−1下降至0.01 g·d−1,第10—第12个月水温回升,体质量增长率回升,从0.01 g·d−1上升至0.03 g·d−1。结果表明,钦州海区钝缀锦蛤适宜的养成密度为20 粒·筐−1。
2.3 海区钝缀锦蛤网笼吊养
在水温18.50~28.90 ℃、盐度26‰~27‰条件下,钝缀锦蛤在防城港白龙珍珠湾海区网笼吊养模式的各生长指标和成活率见表1。C1组各生长指标均最大,C3组成活率最高、产量最大;各个密度组的壳长、壳宽、壳高、体质量及成活率无显著性差异 (P>0.05)。结果表明,网笼吊养钝缀锦蛤成活率均在90%以上,且产量随着密度的增加而升高。
表 1 防城港海区钝缀锦蛤网笼吊养模式的生长和成活率Table 1 Growth and survival rate of net cage culture of T. dorsatus in Fangchenggang sea area密度 Density/
(grains·cage−1)壳长
Final SL/mm壳宽
Final SW/mm壳高
Final SH/mm体质量
Final BG/g成活率
Survival rate/%产量
Yield/gC1 (30) 52.00±2.72a 20.67±1.23a 34.34±1.78a 22.13±3.73a 95.56±3.85a 634.42 C2 (40) 51.97±3.95a 20.39±1.64a 33.69±2.61a 21.77±4.96a 94.17±1.44a 901.20 C3 (50) 51.57±2.39a 20.67±1.29a 33.66±1.94a 21.98±3.46a 96.00±2.00a 1020.96 注:同列上标小写字母不同表示组间差异显著(P<0.05),相同表示组间差异不显著 (P>0.05)。 Note: Different and the same lowercase letters within the same column represent significant differences (P<0.05) and insignificant differences (P>0.05) between groups, respectively. 2.4 实验海区的环境条件
为进一步分析钝缀锦蛤在广西北部湾3个养殖海区中培及养成期的生长存活差异,对3个养殖海区的水温、滩温、盐度、透明度、pH、溶解氧 (DO)、滩涂底质以及浮游植物藻属丰度进行周年取样调查。3个海区理化因子调查结果见图6、图7和图8。实验期间北海海区水温19.50~30.30 ℃ (平均26.10 ℃)、滩温20.80~31.00 ℃ (平均27.40 ℃)、盐度27‰~31‰ (平均28.9‰)、pH 7.88~8.41 (平均8.17)、透明度1.50~1.70 m (平均1.61 m)、DO 6.84~8.33 mg·L−1 (平均7.55 mg·L−1);防城港海区水温17.80~31.70 ℃ (平均25.50 ℃)、滩温19.00~32.00 ℃ (平均26.30 ℃)、盐度26‰~28‰ (平均26.7‰)、pH 7.81~8.34 (平均8.07)、透明度1.50~1.65 m (平均1.55 m)、DO 6.73~8.13 mg·L−1 (平均7.33 mg·L−1);钦州海区水温16.70~30.00 ℃ (平均25.10 ℃)、滩温17.30~30.50 ℃ (平均26.10 ℃)、盐度23‰~27‰ (平均25‰)、pH 7.65~8.32 (平均7.97)、透明度1.35~1.50 m (平均 1.41 m)、DO 5.28~7.64 mg·L−1 (平均7.08 mg·L−1)。北海海区的年平均水温、滩温、盐度、透明度、pH、DO略高于防城港和钦州海区。北海海区滩温、水温、pH的变化最小。结果表明,北海海区水质环境变化较稳定,防城港次之,钦州较不稳定。
3个海区的滩涂底质调查结果见表2。钦州海区滩涂底质粒径以细砂为优势粒径组 (77.33%);北海海区滩涂底质粒径以粗砂 (49.00%) 和中砂 (29.05%) 为优势粒径组;防城港海区滩涂底质粒径以中砂 (59.28%) 和细砂 (36.17%) 为优势粒径组。
表 2 不同海区滩涂底质粒径组成比例Table 2 Composition of sand beach sediment particles size in different sea areas% 海区
Sea area砾
Gravel粗砂
Coarse sand中砂
Medium sand细砂
Fine sand粉砂质黏土
Silty clay> 2.00 mm 2.00~0.50 mm 0.50~0.25 mm 0.25~0.063 mm < 0.063 mm 钦州 Qinzhou 3.70 10.15 6.35 77.33 2.45 北海 Beihai 0.75 49.00 29.05 21.00 0.20 防城港 Fangchenggang 0.32 3.51 59.28 36.17 0.72 3个海区浮游植物藻属种类和生物量见图9。在北海海区的藻属种类共26种,其中24种属于硅藻门、2种属于甲藻门;防城港海区藻属种类23种,其中20种属于硅藻门、1种属于甲藻门、2种属于蓝藻门;钦州海区的藻属种类22种,其中20种属于硅藻门、1种属于甲藻门、1种属于蓝藻门。北海、防城港、钦州海区的浮游藻类生物量分别为 (13 775±613.90)、 (6 700±1 644.69)和 (4 825±601.56) 个·L–1。结果表明,海区浮游植物藻属的种类和数量均为北海>防城港>钦州。
3. 讨论
3.1 养殖密度对钝缀锦蛤生长及存活的影响
已有研究表明,养殖密度是影响贝类生长和存活的重要因素。养殖密度越大,贝类排泄物越多,更容易造成养殖环境污染,影响贝类生存空间。高密度也会加大贝类对空间和饵料的竞争、降低成活率;此外高密度养殖还会降低贝类抵御环境变化及病原侵袭的能力,但养殖密度过小则会降低空间利用率,减少经济效益。刘志刚等[20]研究表明皱肋文蛤 (Meretrix lyrate) 中培密度对种苗生长速度和成活率存在显著性影响 (P<0.05),即密度越低,生长速度越快,成活率越高。李永仁等[21]研究表明天津沿海菲律宾蛤仔 (Ruditapes philippinarum) 幼贝壳长大于22 mm时,高密度组生长缓慢,差异显著 (P<0.05),成贝养成期当壳长达到30 mm以上时,4 000 粒·m−2 密度组生长速度显著低于其他低密度组,死亡率高于50%,其他低密度组死亡率介于15%~22%。潘渊博等[22]对福建定海湾菲律宾蛤仔的研究表明,养殖密度影响菲律宾蛤仔的产量、形态构建和生长规律。于佐安等[23] 研究表明虾夷扇贝 (Pationopecten yessoensis) 低密度养殖组 (10和15枚·层−1) 的平均壳高大于高密度养殖组 (20、25和30枚·层−1),而累积死亡率则低于高密度养殖组。刘德经等[24] 研究表明西施舌 (Coelomactra antiquata) 稚贝的生长与放养密度关系密切,最终平均体长、平均体质量均随放养密度的增加而降低。何毛贤等[25]对马氏珠母贝 (Pinctada martensii) 的研究表明,在一定实验范围内养殖密度对体质量的增长有显著影响 (P<0.05),高密度组 (200只·笼−1) 的生长较低密度组慢。
本研究表明,北海、防城港和钦州海区养成密度为40、40、20 粒·筐−1时产量达到峰值,北海和防城港海区产量随着筐式养成密度的增加呈先增后降的峰值变化趋势。栗志民等[26]研究养成期墨西哥湾扇贝 (Argopecten irradians concentricus) 养殖密度对产量的影响,结果表明大板笼养殖密度为60个·层−1、小板笼养殖密度为50个·层−1时两种笼具单层产量最大,且随着密度的升高产量呈先增后降的峰值变化趋势。
本研究表明,当养殖密度超过筐式养殖最适密度时,钝缀锦蛤的生长和成活率均显著降低 (P<0.05),且在适宜筐式养殖密度范围内,养殖环境对钝缀锦蛤的生长和存活均产生影响,当养殖密度大于适宜养殖密度时,养殖密度成为制约钝缀锦蛤生长和存活的主要因素。廖锐等[27]研究了养殖密度对鱼类福利的影响,表明降低成活率是为了避免未来更为剧烈的种间竞争而采取的自我保护性调节措施。
本实验中培期北海海区适宜的中培密度为2000 粒·筐−1,钦州和防城港海区的为1500 粒·筐−1;养成期北海和防城港海区适宜的养成密度为40 粒·筐−1,钦州海区为20 粒·筐−1。结果表明,养殖密度对钝缀锦蛤中培和养成期的生长和存活产生显著影响 (P<0.05),即随着密度的增加,其生长和成活率均呈下降趋势。3个实验海区的适宜中培和养成密度有所不同,可能与其生长的环境因子不同有关。结合本实验的海区环境调查结果表明,北海海区水温、滩温和pH波动较小,水质环境更稳定,浮游植物藻属种类及数量占比相对钦州、防城港海区更多,底质粒径较大,更适宜钝缀锦蛤的生长存活。
3.2 养殖模式对中培、养成期钝缀锦蛤生长及存活的影响
目前广西北部湾海域钝缀锦蛤多以开放式底播养殖为主,养殖过程存在贝苗逃逸、敌害袭扰等问题,且采捕方式多为人工耙取,劳动强度大,采捕过程容易出现贝壳破碎等现象,采捕效率低、损耗大。为寻找便于管理且高效的养殖模式,本研究以筐式养殖模式开展中培、养成实验,并首次采用网笼进行钝缀锦蛤吊养实验,探讨了2种养殖模式对其生长和存活的影响。
本实验表明,筐式养殖钝缀锦蛤在北海海区中培期成活率可达78.23%,海区养成成活率可达95.00%,并且筐式养殖采收方便。杨凌等[16]采用筐式中培钝缀锦蛤+吊养马氏珠母贝防风浪养殖模式在150 m2的滩涂上养殖60 d获经济效益达3 260.93元。筐式养殖模式在其他底播贝类中已有研究报道,王超奇等[28]使用塑料筐 (长510 mm×宽350 mm×高170 mm) 和塑料箱 (长500 mm×宽350 mm×高230 mm) 进行施氏獭蛤 (Lutraria sieboldii) 海区中培实验,使用塑料筐 (长580 mm×宽420 mm×高290 mm ) 进行海区养成实验,结果表明,中培期北海和防城港海区箱式养殖表现更佳,钦州海区筐式养殖模式表现更佳。养成期适宜在北海进行,适宜养成密度为40 粒·筐−1。蔡德建等[29]使用长方形塑料筐 (长50 cm×宽35 cm×高15 cm)进行大獭蛤 (Lutmria maxima) 人工浅海沉筐式养殖,表明浅海沉筐中间培育生长速度快,成活率高。因此,筐式养殖模式可作为北部湾海域钝缀锦蛤的高效海区中培和养成模式。
滩涂调查表明,北海海区大部分滩涂平缓,退大潮几乎全部露空,北海网箱养殖一般都设在浅海区,不在滩涂低潮区;钦州竹筏式吊养牡蛎的海区为半咸淡水,盐度偏低,不适合钝缀锦蛤生长;防城港白龙珍珠湾滩涂低潮区常年浮排网笼吊养马氏珠母贝,吊养水深合适且盐度高,适宜钝缀锦蛤生长。本研究表明,网笼吊养可降低风浪以及退潮露空时间对钝缀锦蛤摄食及生长的影响,与筐式养殖相比,网笼吊养使贝类摄食、呼吸等不受退潮露空时间影响,可以缩短养殖时间,且其排泄物更容易扩散,避免了排泄物沉积对其生长环境的污染;同时采用轻便的浮石作为基质替代海沙,钝缀锦蛤加工时不需要进行吐沙处理,提高了钝缀锦蛤的品质。本研究结果表明,网笼吊养钝缀锦蛤成活率均在90%之上,最高可达96%。田园等[17]研究表明筏式养殖菲律宾蛤仔的成活率在90%以上,秋、冬季的成活率显著高于底播养殖 (P<0.05),这与本研究结果相似。陈瑞芳等[30]使用定制PVC养殖筐 (长80 cm×宽60 cm×高40 cm) 进行织锦巴非蛤 (Paphia textile) 海区悬挂养殖,结果表明海区悬挂模式可提高织锦巴非蛤的成活率,由30%左右提升至50%以上。
3.3 养殖环境对钝缀锦蛤生长及存活的影响
海水的理化性质对水生生物的生长分布起着至关重要的作用[31]。本实验在广西北部湾海域钦州犀牛脚、北海沙虫坪、防城港白龙珍珠湾3个海区同时开展钝缀锦蛤的生长对比实验,结果表明,海区中培和养成期相同密度条件下钝缀锦蛤的生长和成活率均为北海>防城港>钦州。
1) 水质因子。实验期间钦州海区周年水温16.70~30.00 ℃、滩温17.30~30.50 ℃、盐度23‰~27‰;北海海区周年水温19.50~30.30 ℃、滩温20.80~31.00 ℃;盐度27‰~31‰;防城港海区周年水温17.80~31.70 ℃、滩温19.00~32.00 ℃、盐度26‰~28‰。已有研究表明钝缀锦蛤生长的半致死低温为 (9.20±0.15) ℃、高温为 (34.25±0.09) ℃,适宜盐度为23.58‰~45.15‰,最适盐度为33.90‰[5]。本实验3个养殖海区的水温、滩温和盐度均在其适宜的存活范围。本研究表明,北海海区的水质环境相对较钦州和防城港海区更稳定,钝缀锦蛤在水质较稳定的环境中生长更快,成活率更高。
2) 底质粒径。底质粒径会影响贝类的生长、存活及分布[20,32]。本实验滩涂底质分析结果表明,北海滩涂底质以粗砂为主 (49.00%),防城港以中砂为主 (59.28%),钦州海区以细砂为主 (77.33%),中培期在北海和防城港实验海区效果较好,养成期在北海海区效果较好。此外,海区网笼吊养使用比重为0.45 g·cm−3、孔隙率为75%~80%、颗粒粒径为1.50~2.50 cm的浮石作为基质,钝缀锦蛤的成活率始终保持在90%以上。本实验表明钝缀锦蛤适宜在底质粒径为0.20 mm 以上的滩涂进行海区中培,在底质粒径为0.50 mm以上的滩涂进行海区养成。刘亦涵等[33]研究表明缀锦蛤 (Tapes literatus) 具有明显的底质选择性,大粒径 (15~30 目) 的基底对缀锦蛤的生长有促进作用,在致密的细砂粒径 (80~100目) 基质几乎没有生长。该研究结果与本实验结果相似。
3) 藻类的种类和数量。本研究表明,海区浮游植物的数量对钝缀锦蛤的生长具有显著性影响 (P<0.05)。3个养殖海区的周年浮游植物藻属种类和数量分布表明,北海养殖海区藻属种类最为丰富,钦州与防城港养殖海区相近。在藻属数量上北海海区占优势,其次为防城港海区,钦州海区最少。这与黄亚楠等[34]研究墨西哥湾扇贝选育系F7 在广西北部湾海域的生长比较,对广西北部湾海域的浮游植物数量调查结果相同。
4) 干露胁迫。邱清波等[35]研究了不同干露胁迫时间对缀锦蛤耗氧率的影响,结果表明缀锦蛤在干露72 h后耗氧率低于正常水平。本实验筐式养殖模式各实验地点位于潮间带低潮区,由于地理位置不同,退大潮后露空时间不同,北海沙虫坪海区退潮后露空时间约6 h,防城港白龙珍珠湾海区约7 h,钦州犀牛脚渔港海区约8 h。采用网笼吊养模式在浮排上进行垂下养殖,吊笼距离水面1.50 m,不存在露空时间,但浮排吊养模式抗风浪能力相对较差。滩涂筐式养殖模式的抗风浪能力相对较强,但其成活率相对较低,可能与退大潮时间在白天时有关,太阳直晒导致水温、滩温较高,露空胁迫影响了其摄食、生长和呼吸。黄洋等[2]研究湛江雷州半岛西部乌石及遂溪草潭海区的野生钝缀锦蛤生态习性,表明耐干露能力与气温成反比,气温越高,耐干露能力越弱,这与本实验结果相似。
4. 结论
本研究表明,钝缀锦蛤在广西北部湾3个海域低潮区适宜采用筐式进行海区中培和养成,其中北海海区适宜的中培密度为2 000 粒·筐−1、养成密度为40 粒·筐−1;防城港海区适宜的中培密度为1 500 粒·筐−1、养成密度为40 粒·筐−1;钦州海区适宜的中培密度为1 500 粒·筐−1、养成密度为20 粒·筐−1。北海中培和养成效果优于防城港和钦州,此外,在防城港白龙珍珠湾海区开展大规格钝缀锦蛤网笼吊养是可行的,各个密度组生长指标及成活率无显著性差异 (P>0.05) 且均在90%以上。本研究比较研究了筐式中培、养成和网笼吊养2种模式及其养殖效果,可为钝缀锦蛤在广西北部湾海区大规模养殖提供参考。
-
表 1 东太平洋公海大青鲨的胃含物饵料种类
Table 1 Stomach content of blue shark in the tropical eastern Pacific Ocean
饵料种类prey species (group) 相对多度/% percentage 出现频率/% frequency 鱿Squid 43.52 43.92 章鱼Octopoda 0.93 1.35 头足类Cephalopoda 44.44 45.27 鲐Pneumatophorus japonicus 27.78 36.49 沙丁鱼Sardine 7.41 8.78 帆蜥鱼Alepisaurus ferox 3.24 4.73 凹尾长鳍乌鲂Taractichthys steindachneri 2.78 4.05 异鳞蛇鲭Lepidocybium flavobrunneum 1.85 2.70 剑鱼Xiphias gladius 1.39 2.03 长鳍金枪鱼Thunnus alalunga 1.39 2.03 红棱鲂Taractes rubescens 0.93 1.35 长体翻车魨Ranzania laevis 0.93 1.35 棘鳞蛇鲭Ruvettus pretiosus 0.46 0.68 大鳞Sphyraena barracuda 0.46 0.68 鲯鳅Coryphaena hippurus 0.46 0.68 大眼金枪鱼Thunnus obesus 0.46 0.68 未知金枪鱼unknown tuna 2.31 2.70 未知鱼类unknown fish 1.85 2.70 硬骨鱼Osteichthyes 53.70 66.22 海鸟seabird 1.85 2.70 表 2 东太平洋公海大青鲨的胃含物饵料组成的性别间比较
Table 2 Stomach content by sex for blue shark in the tropical eastern Pacific Ocean
饵料种类
prey species (group)相对多度/% percentage 雌性female 雄性male 鱿Squid 47.37 40.83 鲐Pneumatophorus japonicus 25.26 30.00 沙丁鱼Sardine 10.53 5.00 帆蜥鱼Alepisaurus ferox 4.21 2.50 凹尾长鳍乌鲂Taractichthys steindachneri 4.21 1.67 未知金枪鱼unknown tuna - 4.17 异鳞蛇鲭Lepidocybium flavobrunneum 1.05 2.50 未知鱼类unknown fish 2.11 1.67 海鸟seabird 1.05 2.50 长鳍金枪鱼Thunnus alalunga - 1.67 剑鱼Xiphias gladius 2.11 0.83 长体翻车鲀Ranzania laevis - 1.67 章鱼Octopoda - 1.67 红棱鲂Taractes rubescens - 1.67 棘鳞蛇鲭Ruvettus pretiosus 1.05 - 鲯鳅Coryphaena hippurus - 0.83 大鳞Sphyraena barracuda 1.05 - 大眼金枪鱼Thunnus obesus - 0.83 -
[1] CAMHI M D, PIKITCH E K, BABCOCK E A. Sharks of the Open Ocean[M]. Oxford: Blackwell, 2008: 3-10.
[2] WORM B, LOTZE H K, MYERS R A. Predator diversity hotspots in the blue ocean[J]. PNAS, 2003, 100(17): 9884-9888. doi: 10.1073/pnas.1333941100
[3] 耿喆, 朱江峰, 陈彦, 等. 中部大西洋大青鲨胃含物组成及其多样性研究[J]. 上海海洋大学学报, 2015, 24(1): 108-114. http://shhydxxb.ijournals.cn/shhy/article/abstract/20140901179 [4] GALLAGHER A J, ORBESEN E S, HAMMERSCHLAG N, et al. Vulnerability of oceanic sharks as pelagic longline bycatch[J]. Global Eco Conser, 2014, 1(1): 50-59. https://www.sciencedirect.com/science/article/pii/S2351989414000055
[5] PORSMOGUER S B, BANARU D, BOUDOURESQUE C F, et al. Hooks equipped with magnets can increase catches of blue shark (Prionace glauca) by longline fishery[J]. Fish Res, 2015, 172(4): 345-351. doi: 10.1016/J.FISHRES.2015.07.016
[6] BUSTAMANTE C, BENNETT M B. Insights into the reproductive biology and fisheries of two commercially exploited species, shortfin mako (Isurus oxyrinchus) and blue shark (Prionace glauca), in the south-east Pacific Ocean[J]. Fish Res, 2013, 143(1): 174-183. https://www.sciencedirect.com/science/article/abs/pii/S0165783613000507
[7] MEJUTO J, GARCIA-CORTES B. Reproductive and distribution parameters of blue shark (Prionace glauca) on the Atlantic Indian and Pacific Ocean[J]. ICCAT Coll Vol Sci Pap, 2005, 58(3): 951-973.
[8] MONTEALEGRE Q S, CARDOSO A T C, SILVA R Z, et al. Sexual development, size at maturity, size at maternity and fecundity of the blue shark Prionace glauca (Linnaeus, 1758) in the Southwest[J]. Fish Res, 2014, 160(1): 18-32. https://www.sciencedirect.com/science/article/abs/pii/S016578361400085X
[9] ZHU J F, DAI X J, XU L X, et al. Reproductive biology of female blue shark Prionace glauca in the southeastern Pacific Ocean[J]. Environ Biol Fish, 2011, 91(1): 95-102. doi: 10.1007/s10641-010-9763-1
[10] 邓景耀, 赵传絪. 海洋渔业生物学[M]. 北京: 农业出版社, 1991: 58-60. https://www.zhangqiaokeyan.com/book-cn/081503751193.html [11] 薛莹, 金显仕. 鱼类食性和食物网研究综述[J]. 海洋水产研究, 2003, 24(2): 76-87. [12] 窦硕增. 鱼类摄食生态研究的理论及方法[J]. 海洋与湖沼, 1996, 27(5): 556-561. doi: 10.3321/j.issn:0029-814X.1996.05.016 [13] DAMBACHER J M, YOUNG J W, OLSON R J, et al. Analyzing pelagic food webs leading to top predators in the Pacific Ocean: a graph-theoretic approach[J]. Prog Oceanogr, 2010, 86(s1/s2): 152-165. doi: 10.1016/J.POCEAN.2010.04.011
[14] 颜云榕, 卢伙胜, 金显仕. 海洋鱼类摄食生态与食物网研究进展[J]. 水产学报, 2011, 35(1): 145-153. http://scxuebao.ijournals.cn/scxuebao/article/abstract/20101007162?st=article_issue [15] STEVENS J D. Stomach contents of the blue shark (Prionace glauca) off south-west England[J]. J Mar Biol Assoc UK, 1973, 53(2): 357-361. doi: 10.1017/S0025315400022323
[16] HAZIN F H V, LESSA R P, CHAMMAS M. First observations on stomach contents of the blue shark, Prionace glauca, from southwestern equatorial Atlantic[J]. Rev Bras Biol, 1994, 54(2): 195-198.
[17] MACNAUGHTON R, ROGAN E, HERNANDES G. The importance of cephalopods in the diet of blue sharks (Prionace glauca) south and west of Ireland[J]. ICES-Council Meeting, 1998, 7(1): 1-12.
[18] MCCORD M E, STEVEN E C. A quantitative assessment of the diet of the blue shark (Prionace glauca) off Nova Scotia Canada[J]. J Northw Atl Fish Sci, 2003, 32(2): 57-63.
[19] JUNIOR T V, LESSA R P, GADIG O B F. Feeding habits of the blue shark (Prionace glauca) off the coast of Brazil[J]. Biota Neotrop, 2009, 9(3): 55-60. doi: 10.1590/S1676-06032009000300004
[20] LOBNASSEUR R J. Stomach contents of blue shark (Prionace glauca) taken in the gulf of Alaska[J]. J Fish Res Board Can, 1964, 21(4): 861-862. doi: 10.1139/f64-079
[21] KUBODERA T, WATANABE H, ICHⅡ T. Feeding habits of the blue shark (Prionace glauca) and salmon shark (Lamna ditropis) in the transition region of the Western North Pacific[J]. Rev Fish Biol Fish, 2007, 17(2/3): 111-124. doi: 10.1007/s11160-006-9020-z
[22] GALVAN-MAGAÑA F, POLO-SILVA C, HERNÁNDEZ-AGUILAR S B, et al. Shark predation on cephalopods in the Mexican and Ecuadorian Pacific Ocean[J]. Deep-Sea Res Ⅱ, 2013(95): 52-62. https://www.sciencedirect.com/science/article/abs/pii/S0967064513001410
[23] PRETI A, SOYKAN C U, DEWAR H, et al. Comparative feeding ecology of shortfin mako, blue and thresher sharks in the California Current[J]. Environ Biol Fish, 2012, 95(1): 127-146. doi: 10.1007/s10641-012-9980-x
[24] LI Y K, GONG Y, CHEN X, et al. Tropic ecology of sharks in the mid-east Pacific Ocean inferred from stable isotopes[J]. J Ocean Univ China, 2014, 13(2): 278-282. doi: 10.1007/s11802-014-2071-1
[25] 朱江峰, 王洁, 戴小杰. 东太平洋大青鲨脊椎骨的稳定同位素比值研究[J]. 南方水产科学, 2015, 11(4): 40-45. doi: 10.3969/j.issn.2095-0780.2015.04.006 [26] 陈新军. 渔业资源与渔场学[M]. 北京: 海洋出版社, 2004: 78-90. [27] PRATT H L. Reproduction in the blue shark (Prionace glauca)[J]. Fish Bull, 1979, 77(2): 445-470.
[28] BRANSTETTER S. Age, growth and reproductive biology of the silky shark, Carcharhinus falciformis, and the scalloped hammerhead, Sphyrna lewini, from the northwestern Gulf of Mexico[J]. Environ Biol Fish, 1987, 19(3): 161-173.
[29] 郑颖, 戴小杰, 朱江峰. 长江河口定置张网渔获物组成及其多样性分析[J]. 安徽农业科学, 2009, 37(20): 9510-9513. https://www.zhangqiaokeyan.com/academic-journal-cn_journal-anhui-agricultural-sciences_thesis/020122153987.html [30] AMUNDSEN P A, GABLER H M, STALDVIK F J. A new approach to graphical analysis of feeding strategy from stomach contents data-modification of the Costello (1990) method[J]. J Fish Biol, 1996, 48(4): 607-614.
[31] JOYCE W N, CAMPANA S E, NATANSON L J. Analysis of stomach contents of the porbeagle shark (Lamnanasus bonnaterre) in the northwest Atlantic[J]. ICES J Mar Sci, 2002, 59(6): 1263-1269.
[32] LABORATORIO E P, CENTRO I, CIENTFCAY E, et al. Food and feeding habits of the blue shark Prionace glauca caught off Ensenada, Baja California, Mexico, with a review on its feeding[J]. J Mar Biol Assoc UK, 2010, 90(5): 977-994. doi: 10.1017/S0025315409991597
[33] HAMMERSCHLAG N, GALLAGHER A J, LAZARRE D M. A review of shark satellite tagging studies[J]. J Exp Mar Biol Ecol, 2011, 398(1): 1-8. https://www.sciencedirect.com/science/article/abs/pii/S0022098110005113
[34] STEVENS J D, BRADFORD R W, WEST G J. Satellite tagging of blue sharks (Prionace glauca) and other pelagic sharks off eastern Australia: depth behavior, temperature experience and movements[J]. Mar Biol, 2010, 157(3): 575-591.
-
期刊类型引用(6)
1. 陈颖,赵菊花,杨羽,王洁,杜秀君,刘海霞. 茶多酚调节AMPK/SIRT1/PGC-1信号通路对光老化小鼠模型氧化损伤的影响. 西部医学. 2025(02): 205-211 .  百度学术
百度学术
2. 宋玉琼,胡晓,李来好,陈胜军,相欢,杨贤庆,吴燕燕. 食物蛋白源酪氨酸酶抑制肽的研究进展. 陕西师范大学学报(自然科学版). 2023(03): 16-28 .  百度学术
百度学术
3. 姜红伶. 强脉冲光与CO_2点阵激光治疗面部皮肤光老化疗效对比分析. 中国医疗美容. 2022(02): 25-29 .  百度学术
百度学术
4. 许锋,陈得科,陈晓刚,聂金梅,马志浩,孙恢礼,陈忻. 坛紫菜防晒剂MAAs提取、鉴定及在化妆品体系的稳定性研究. 南方水产科学. 2022(04): 156-162 .  本站查看
本站查看
5. 罗艳,黄权新,蔡捷. 牡蛎酶解产物的种类、生物活性及应用研究进展. 中国食物与营养. 2022(11): 49-53 .  百度学术
百度学术
6. 张雪妍,秦小明,林海生,曹文红,郑惠娜,高加龙,章超桦. 牡蛎酶解超滤组分对TM4小鼠睾丸支持细胞的氧化损伤保护作用. 南方水产科学. 2021(05): 118-125 .  本站查看
本站查看
其他类型引用(10)




 下载:
下载:










 粤公网安备 44010502001741号
粤公网安备 44010502001741号
