Abundance of bacterioplankton and virioplankton in the central and northern South China Sea in autumn
-
摘要:
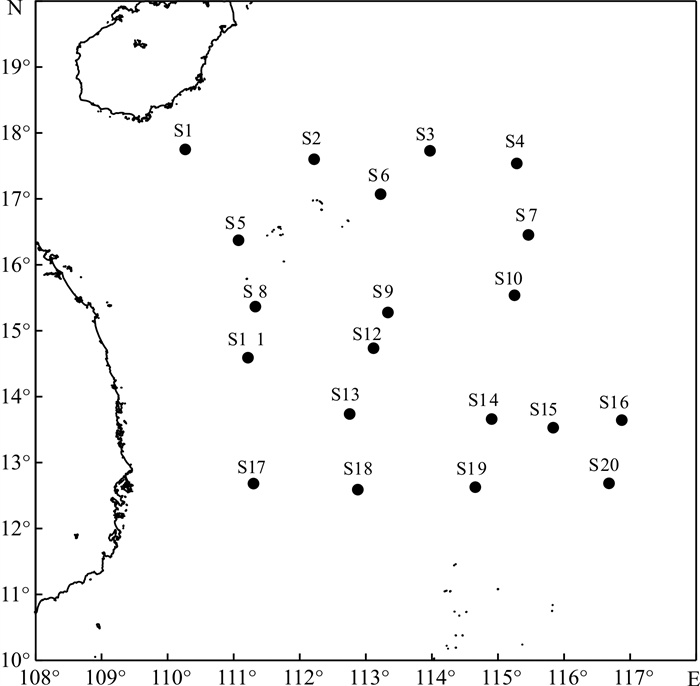
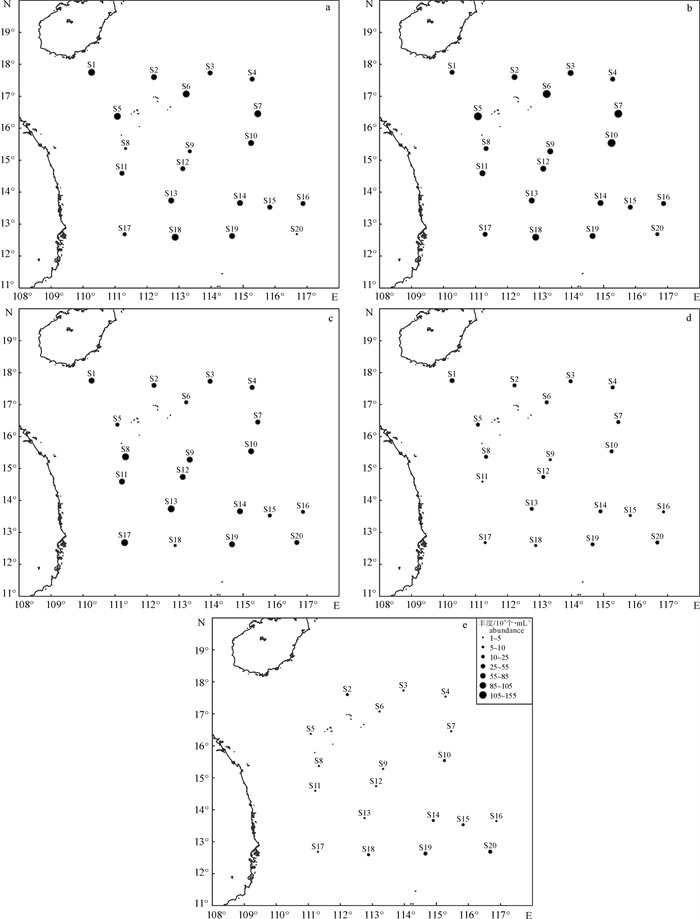
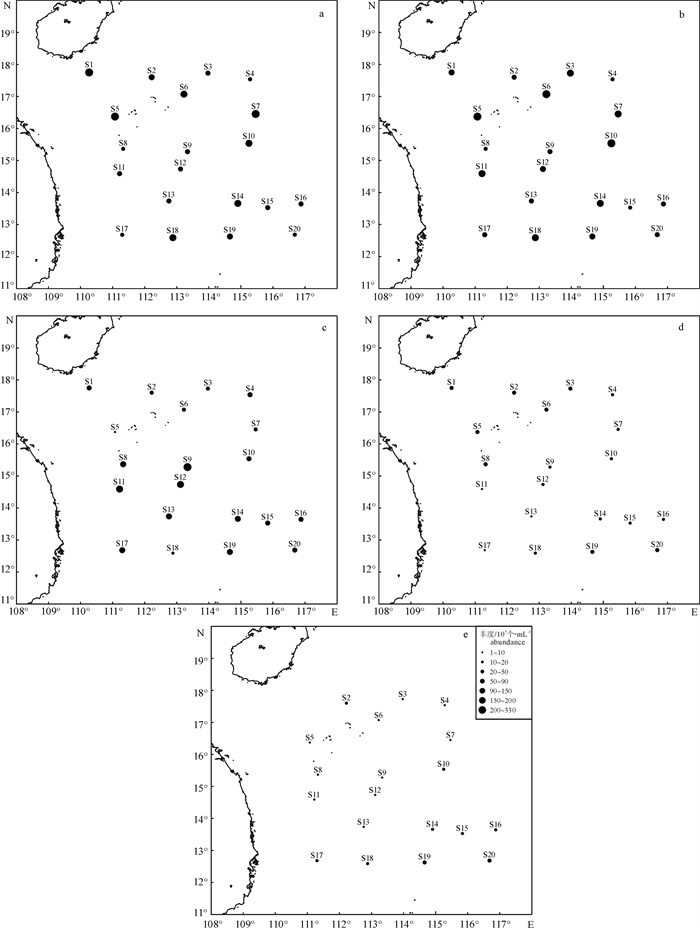
于南海中北部海域设置20个采样站位, 分别采集各站位5 m、25 m、75 m、150 m和200 m水层海水样品。应用流式细胞仪技术分析了浮游细菌和病毒的生态分布特征, 并对其与环境因子的相关性进行了分析。结果表明, 调查海区浮游细菌和病毒丰度分别为(1.19~151.65)×104个·mL-1和(1.37~326.70)×105个·mL-1。5 m和200 m层浮游细菌的平均丰度分别为(54.03±30.87)×104个·mL-1和(4.94±4.15)×104个·mL-1, 浮游病毒丰度则分别为(121.95±89.73)×105个·mL-1和(9.98±6.54)×105个·mL-1, 随水深的增加两者丰度基本呈现逐渐下降的趋势。5 m层和25 m层浮游细菌和病毒丰度均表现为北部区域大于南部区域的分布趋势。不同水层浮游细菌和病毒分布的影响因子存在一定差异。5 m层浮游细菌和病毒与磷酸盐显著正相关(P < 0.05), 说明南海中北部海域表层水存在磷限制。75 m层浮游细菌与硝酸盐、硅酸盐和总有机氮显著正相关, 而浮游病毒的分布则同时受到硝酸盐、硅酸盐、总有机氮和磷酸盐的影响, 说明该区域浮游细菌和病毒受到上行控制效应的影响。水深达到200 m时浮游细菌和病毒的主要限制因子是水温而不是营养盐。浮游细菌和病毒丰度之间在各个水层均极显著正相关(P < 0.01), 说明浮游细菌作为浮游病毒的寄主, 对浮游病毒的丰度产生较大的影响。
Abstract:A cruise was conducted during November 2014, and water samples in 20 stations in the middle-north of the South China Sea were collected at 5 m, 25 m, 75 m, 150 m and 200 m layers, respectively. The distribution of virioplankton and bacterioplankton abundances in horizontal and vertical direction were studied by flow cytometry, and their relationships with environmental factors were also analyzed. The results show that the bacterioplankton and virioplankton densities in the water column were (1.19~151.65)×104cells·mL-1and (1.37~326.70)×105 cells·mL-1, respectively. Bacterioplankton abundance at 5 m and 25 m layers were (54.03±30.87)×104 cells·mL-1 and (4.94±4.15)× 104cells·mL-1; the number of virioplankton were (121.95±89.73)× 105 cells·mL-1 and (9.98±6.54)×105 cells·mL-1, respectively. According to the increase of water depth, the number of bacterioplankton and virioplankton both decreased gradually. Horizontal distribution of bacterioplankton and virioplankton show a similar variation tendency. Bacterial and viral abundances in most of the northern area stations were higher than those in the south at 5 m and 25 m layers. Impact factors of bacterioplankton and virioplankton varied at different water layers. Bacterioplankton and virioplankton distributions were positively correlated with phosphate (P < 0.05), a limiting nutrient factor in the surface water of the South China Sea. Bacterial distribution was significantly correlated with nitrate, silicate and total organic nitrogen at 75 m, where positive correlations between virioplanktion abundance and nitrate, silicate, total organic nitrogen and silicate were also detected. Correlation between environmental factors and bacterial and viral distributions may demonstrate the existence of top-down control mechanism. Virioplankton was positively related to bacterioplankton, which reflects a closely coupling between viruses and host cell abundance (P < 0.01).
-
Keywords:
- virioplankton /
- bacterioplankton /
- nutrients /
- environmental factor /
- the South China Sea
-
黑鲷(Acanthopagrus schlegeli)隶属于鲷科、棘鲷属 [1],俗称乌格、黑立、海鲫、加吉鱼等,广泛分布于我国沿海区域,喜栖息在沙泥底或多岩礁生境,为近岸暖水性底层鱼类。由于具有广温广盐性、生长快、肉质鲜美、移动范围小等特点,使黑鲷成为主要渔业捕捞对象之一[2-3]。
大亚湾位于中国南海北部陆架区,具有丰富的亚热带生物资源[4-5]。黑鲷是该海湾主要经济鱼类[6-7],自20世纪80年代起,黑鲷资源已处于过度捕捞状态[8-9]。近20年来,尽管在该海湾连续开展了黑鲷增殖放流,但资源量并没有出现明显恢复。同时,随着大亚湾经济发展,近岸生态环境受到污染[10-15],已对黑鲷繁殖生长造成了明显威胁[16-18]。
繁殖生物学是开展渔业资源管理的基础,同时也是评估鱼类资源变化的主要依据[19]。目前对黑鲷的繁殖生物学已开展了许多研究。如Law和Mitchenson[20]发现香港附近海域黑鲷的繁殖期在11月至翌年3月,早期研究发现黑鲷雌雄同体并具有性逆转特征[21-23],且陈淑吟等[24]通过连续观察性腺切片提供了性逆转的科学依据。但这些研究主要集中在性逆转方面,未开展对黑鲷繁殖生物学的系统研究。本文拟通过研究黑鲷的全长体质量分布、繁殖时间、性成熟大小、繁殖类型和繁殖力,以期进一步补充和完善黑鲷的基础生物学资料,并从繁殖生物学方面为黑鲷种群保护和管理提供理论依据。
1. 材料与方法
1.1 样品来源
分别于2018年1月、3月、4月和8—12月(5—7月为大亚湾休渔期),持续定点在大亚湾澳头渔港,定向向捕捞渔民采购黑鲷样本,渔民捕获方式以单层流刺网(网目主要为5 cm)为主,潜捕为辅,偶见花蟹网和虾拖网。
1.2 样品采集与处理
样品采集后立即测量全长(TL,mm)、体质量(W,0.01 g)指标,随后进行解剖,根据《鱼类生态学》中的目测法判断性腺发育时期,用Ⅰ~Ⅵ表示[19],称量性腺质量(GW,0.01 g);随后性腺样品用4%甲醛溶液固定,用于繁殖力和卵径频率分布分析。
黑鲷繁殖力采用质量法估算,以Ⅳ期性腺作为研究材料,在左或右性腺的前中后段随机取一定量性腺组织样本,混合后计算卵粒数量。
卵径测量:各取前中后段一定量性腺材料,打散后在解剖镜下拍照,用FishBC 3.0软件测量卵粒的卵径。
各参数计算公式如下:
$$ A_{\rm GSI} = 100 \times W_{\rm GW}/W_{\rm EW} $$ $$\begin{array}{l} F = {F_{\rm j}}/W_{\rm GWj} \times W_{\rm GW} \end{array} $$ $$ {{F_{\rm{W}}}} = F/W $$ $$ {{F_{\rm{L}}}} = F/l_{\rm TL} $$ 其中,AGSI是性腺成熟系数,WGW是性腺质量,WEW是空壳质量,F是个体绝对繁殖力,Fj是计数卵粒数,WGWj是计数性腺质量,Fw是体质量的相对繁殖力,W是体质量,FL是全长的相对繁殖力,lTL是全长。50%性成熟全长及雌雄同体向雌性逆转全长基于繁殖期黑鲷雌、雄性分别成熟的情况进行评估,其中性腺Ⅲ~Ⅵ期均记为性成熟个体。将黑鲷的全长以5 mm的区间分组来计算50%的性成熟全长 ( L50)。以Logistic方程拟合各全长区间性成熟百分比,计算公式为:
$$ P = 100/\left\{ {1 + \exp \left[ { - {\rm{a}}*\left( {l_{\rm TL} - {L_{50}}} \right)} \right]} \right\} $$ 其中P代表成熟的百分比,a为参数,L50为50%性成熟全长。
以每月的成熟系数和性腺阶段(不小于50%性成熟全长来评估)的变化来确定繁殖周期和繁殖时间。
1.3 数据分析统计
所有数据分析处理在SPSS 22.0下进行,数值差异显著性采用ANOVA和t-test进行分析,当P<0.05时认为存在显著性差异。
2. 结果
2.1 性成熟全长
采样期间均观测到未成熟及雌雄同体的黑鲷个体,L50分别为248.52 mm和148.03 mm,雌性的初次性成熟全长远大于雄性。观察的最小雌、雄性成熟全长分别为232 mm、140 mm,相较于初次性成熟全长略小 (图1)。
2.2 性别模式
在繁殖期内,黑鲷雌性体质量为22.93~1 907.12 g,均值为 (561.89±283.90) g;全长为232~487 mm,均值为 (311.20±45.39) mm。雄性体质量为44.94~1 360 g,均值为 (248.22±205.34) g;全长为140~440 mm,均值为 (241.76±57.63) mm (图2)。雌雄同体(性腺图片见图3)体质量为95.20~458.94 g,均值为 (262.84±82.90) g;全长为190~297 mm,均值为 (246.65±27.86) mm。黑鲷未成熟时基本以雌雄同体与雄性为主,对于繁殖季节的黑鲷来说,性成熟的雌性无论是体质量还是全长均明显大于雄性(P<0.001)。表明黑鲷可能存在性逆转,并且是由雄性向雌性转变。
2.3 繁殖周期
2.3.1 成熟系数
选取50%性成熟个体,即雌、雄全长分别高于248.52 mm、148.03 mm,共448尾样本,其中雌、雄个体分别为152尾、336尾,统计大亚湾黑鲷的成熟系数和性腺阶段变化。结果显示,黑鲷全年雌雄的成熟系数变化趋势一致,均从10月开始出现升高,12月达到峰值,随后开始下降,4月降到最低点,并保持到11月(图4),表明大亚湾黑鲷10月进入繁殖初期,11月至竖年3月是黑鲷的繁殖期。
2.3.2 性腺发育
大亚湾黑鲷雌、雄性腺阶段的月变化见图5,雌、雄均达到Ⅳ期的季节,仅在11月、12月和3月出现,雄性在12月至翌年3月几乎所有个体均为Ⅳ和Ⅴ期,由此可推论其繁殖期为11—12月。
2.4 繁殖类型
随机选取繁殖早期的Ⅳ期性腺个体(全长298 mm,体质量507.75 g),分析了其卵径频率分布 (图 6),结果显示,卵径分布为0.17~0.63 mm,均值为 (0.43±0.09) mm。卵径大小为0.25~0.50 mm所占比例最大,各峰之间明显连接在一起,呈连续分布,表明黑鲷性腺发育是连续的,为分批产卵鱼类。
2.5 繁殖力
以采集到的92尾雌性Ⅳ期性腺个体为样本,进行了繁殖力分析,结果表明,个体绝对繁殖力为84 100 (221 mm) ~ 2 655 168 (321 mm)粒,均值为 (728 732±499 547) 粒,全长相对繁殖力为380.54~8 271.55 粒·mm−1,均值为 (2 731.44±1 630.93) 粒·mm−1,体质量相对繁殖力为277.58~3 592.83 粒·g−1,均值为 (1 443.87±766.82) 粒·g−1。
个体绝对繁殖力(F)与全长(lTL)、体质量(W)及性腺质量(WGW)均呈线性相关,函数关系如下:
$$ F = 0.850\;3l_{\rm{TL}} - 145.8\;{\normalsize{( {N = 93,\;{R^2} = 0.368\;7} )}} $$ $$ F = 0.116\;1W + 5.773\;2\;{\normalsize{({{{N}} = 93,\;{R^2} = 0.380\;6})}} $$ $$ F = 2.179\;6W_{\rm GW} + 4.835\;3\;{\normalsize{( {{{N}} = 93,\;{R^2} = 0.888\;9} )}} $$ 相关性分析显示,黑鲷个体绝对繁殖力随着全长、体质量、性腺质量的增加而均呈现增加的正相关趋势(图7,P<0.001)。
3. 讨论
为了保证资源群体后代的延续,鱼类在长期进化的过程中形成了种群内在因素和外界条件共同影响的繁殖策略,其中包括对繁殖季节和持续时间的选择[25]。通过对大亚湾黑鲷生物学特征(包括性腺发育状态、性成熟系数)的研究以及现场调研,发现大亚湾黑鲷产卵期为11月至3月。林昭进等[26]研究表明,大亚湾鲷科鱼卵在冬季占绝对优势,且在3月也有一定占比,5月则未发现,这与本研究相吻合,同时也与地理位置相近的香港附近海域研究结果[20, 27]一致,但与台湾(12月至翌年3月)[28]、福建(3月中至5月初)[29]、江苏(4月至5月)[30]、山东(5月初至6月初)[31]等附近海域研究结果差异较大。这种差异可能源于北方水域的繁殖季节为春夏之交,并且随纬度的增高,繁殖季节也越向夏季移动,繁殖的持续时间也越短,该特点与大部分广温性鱼类一致。地域不同导致繁殖期出现差异的现象,表明鱼类的繁殖季节及长短除了受自身生物学特征如种或种群的繁殖特性、产卵类型(分批或不分批产卵)、产卵群体年龄组成的影响外,还与外界环境因子如不同纬度[32]、水温[33]以及盐度[34]相关。
卵径分布说明黑鲷具有分批产卵特性[19],虽有明显的季节特性,但卵粒成熟时间不一致会延长繁殖时间,且分批产卵可以保证后代不会因一次偶然间的突发性灾难就全军覆没[35]。这是黑鲷的一种种群延续的繁殖策略,同时也增大了繁殖成功的可能性[19]。
鱼类的性成熟大小是繁殖策略的重要属性之一,除了受生长和遗传因素影响外,还受到外界因素影响,如捕捞强度、捕食者数量、饲料生物的丰度、种群组成和环境污染程度等[25]。因此,对于鱼类这些属性既有相对稳定性,也会有一定的可塑性[36]。本研究发现大亚湾黑鲷的雌性初次性成熟全长为248.52 mm,雄性为148.03 mm,与Law和Mitcheson[20]几乎处于同一纬度的香港附近海域的雌性黑鲷初次性成熟体长(291 mm)相比,远远小于对方,这一差异证明了黑鲷生活特征存在明显的可塑性,而这种可塑性可能与大亚湾近年来经济快速发展带来的环境压力及过度捕捞有直接联系。
据调查发现1994年大亚湾黑鲷大个体怀卵量超过50×104粒,小个体约15×104粒[37],而本研究结果为84 100~2 655 168粒,最高怀卵量是先前报道的5倍,表明目前大亚湾黑鲷个体绝对繁殖力显著增强,说明在环境多变且成鱼死亡率高的情况下,选择早繁殖和高繁殖力对群体的发展和延续有利,而在稳定环境中,稚、幼鱼死亡率更高时,选择晚繁殖、低繁殖投入,延长成鱼寿命则更有利[25]。
性腺发育程度、性周期、繁殖力等因素决定了鱼类繁殖后代的质和量,生殖腺大小及质量变化是生殖腺发育过程中最重要的特征之一[19]。本研究表明黑鲷的繁殖力与全长、体质量及性腺质量都呈显著正相关,说明雌性个体越大,越有利于提高繁殖力。黑鲷的个体绝对繁殖力与性腺质量的相关性最强,体质量次之,全长相较前两者最弱。黑鲷生活在近岸,定居性较强,移动范围较小[38],这可能会导致群体可利用资源有限,而在发生性逆转之前,黑鲷体型基本较小,可以使雌性黑鲷具有个体优势以得到更多的资源,分配给有效的生长与繁殖活动。同时,较大个体的黑鲷具有更强的种内与种间竞争力,可以避免因雌性死亡过多而导致种群繁殖力减小,进而影响整个种群的延续。
目前渔民对渔业资源的保护意识仍相对薄弱[39],且缺乏能兼顾渔业资源保护与渔民利益的管理措施[40],导致黑鲷资源的减少甚至衰退。为更好地保护黑鲷这一经济物种,本研究建议在大亚湾海域禁止捕捞规格(全长)小于148 mm的黑鲷。此外,对黑鲷的基本生物学特征如生长、繁殖等特点进行深入研究,结合该区域的生态特点,采取有效的区域保护以及定期渔业资源监测,对于黑鲷这一经济物种的资源可持续利用有着重要意义。同时黑鲷在大亚湾区域是重要的经济物种,随着养殖业的进步[41-42],人工养殖黑鲷在沿海区域已经普及。借鉴一些鱼类性别的人工控制技术[43-45],在对黑鲷性逆转机制足够了解之后,或可期待根据需求,人为改变性别。无论是对黑鲷进行增殖放流还是人工养殖,均在缓解捕捞压力、增加经济收入等方面有一定的可行性及实用性。
-
表 1 浮游细菌和病毒丰度与环境因子的相关性分析
Table 1 Correlation between environmental factors and bacterioplankton and virioplankton abundance
环境因子
environmental factor水深/m
water depth温度
temperature盐度
salinity溶解氧
dissolved oxygen亚硝酸盐
nitrite硝酸盐
nitrate铵盐
ammonium总有机氮
total organic nitrogen磷酸盐
phosphate硅酸盐
silicate病毒丰度
virioplankton abundance细菌丰度bacterioplankton abundance 5 -0.298 0.241 0.302 0.118 0.243 -0.158 0.172 0.560* -0.251 0.857** 25 -0.125 0.109 0.148 0.450* 0.101 -0.204 -0.059 -0.021 0.001 0.853** 75 -0.314 0.221 -0.183 0.332 0.542* 0.286 0.556* 0.404 0.446* 0.576** 150 0.512* 0.413 0.333 0.593** -0.303 0.276 -0.253 -0.427 -0.093 0.828** 200 0.611** -0.072 -0.538* -0.144 -0.001 -0.170 -0.019 0.421 -0.226 0.924** 病毒丰度virioplankton abundance 5 -0.310 0.269 0.341 -0.049 0.270 0.123 0.284 0.516* 0.168 1 25 -0.095 0.101 0.199 0.318 0.261 -0.104 0.119 0.125 -0.085 1 75 -0.533* 0.214 -0.425 0.037 0.763* 0.439 0.772** 0.606** 0.699** 1 150 0.609* 0.522* 0.399 0.393 -0.373 0.337 -0.316 -0.555* -0.247 1 200 0.728** 0.003 -0.468* -0.101 -0.55 -0.222 -0.079 0.266 -0.370 1 注:**.P < 0.01水平下极显著相关;*.P < 0.05水平下显著相关;其他均为P>0.05,相关性不明显
Note:Only significant r values are marked with probability level (*.P < 0.05,**.P < 0.01). -
[1] AZAM F, MALFATTI F. Microbial structuring of marine ecosystems[J]. Nat Rev Microbiol, 2007, 5(10): 782-791. doi: 10.1038/nrmicro1747
[2] 焦念志. 海洋固碳与储碳——并论微型生物在其中的重要作用[J]. 中国科学(地球科学), 2012, 42(10): 1473-1486. https://www.cnki.com.cn/Article/CJFDTOTAL-JDXK201210003.htm [3] WILHELM S W, SUTTLE C A. Viruses and nutrient cycles in the sea[J]. Bioscience, 1999, 49(10): 781-788. doi: 10.2307/1313569
[4] AZAM F, FENCHEL T, FIELD G, et al. The ecological role of water-column microbes in the sea[J]. Mar Ecol Prog Ser, 1983, 10(3): 257- 263. https://xueshu.baidu.com/usercenter/paper/show?paperid=1p4k0r90ms0g0c40cv6r0a10aw064327&site=xueshu_se&hitarticle=1
[5] SUTTLE C A. Marine viruses-major players in the global ecosystem[J]. Nat Rev Microbiol, 2007, 5(10): 801-812. doi: 10.1038/nrmicro1750
[6] 李洪波, 杨青, 周峰. 海洋微食物环研究新进展[J]. 海洋环境科学, 2012, 31(6): 927-932. https://www.cnki.com.cn/Article/CJFDTOTAL-HYHJ201206033.htm [7] 卢龙飞, 汪岷, 梁彦韬, 等. 东海、黄海浮游病毒及异养细菌的分布研究[J]. 海洋与湖沼, 2013, 44(5): 1339-1346. https://www.cnki.com.cn/Article/CJFDTOTAL-HYFZ201305032.htm [8] 白洁, 刘小沙, 侯瑞, 等. 南海南部海域浮游细菌群落特征及影响因素研究[J]. 中国环境科学, 2014, 34(11): 2950-2957. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGHJ201411040.htm [9] YUAN X C, HE L, YIN K D, et al. Bacterial distribution and nutrient limitation in relation to different water masses in the coastal and northwestern South China Sea in late summer[J]. Cont Shelf Res, 2011, 31(11): 1214-1223. doi: 10.1016/j.csr.2011.04.012
[10] ZHOU W, LONG A, TAO J, et al. Bacterioplankton dynamics along the gradient from highly eutrophic Pearl River Estuary to oligotrophic northern South China Sea in wet season: implication for anthropogenic inputs[J]. Mar Poll Bull, 2011, 62(4): 726-733. doi: 10.1016/j.marpolbul.2011.01.018
[11] CHEN B Z, LIU H B, HUANG B Q. Environmental controlling mechanisms on bacterial abundance in the South China Sea inferred from generalized additive models (GAMs)[J]. J Sea Res, 2012, 72: 69-76. doi: 10.1016/j.seares.2012.05.01211.01.018
[12] MARIE D, BRUSSAARD C P, THYRHAUG R, et al. Enumeration of marine viruses in culture and natural samples by flow cytometry[J]. Appl Environ Microbiol, 1999, 65(1): 45-52. doi: 10.1128/AEM.65.1.45-52.1999
[13] LASTERNAS S, AGUSTí S, DUARTE C M. Phyto- and bacterioplankton abundance and viability and their relationship with phosphorus across the Mediterranean Sea[J]. Aquat Microb Ecol, 2010, 60(2): 175-191. doi: 10.3354/ame01421
[14] ZHOU W H, LI T, CAI C H, et al. Spatial and temporal dynamics of phytoplankton and bacterioplankton biomass in Sanya Bay, northern South China Sea[J]. J Environ Sci-China, 2009, 21(5): 595-603. doi: 10.1016/S1001-0742(08)62313-X
[15] 姜发军, 胡章立, 胡超群. 大鹏湾浮游细菌时空分布与环境因子的关系[J]. 热带海洋学报, 2011, 30(1): 96-100. doi: 10.3969/j.issn.1009-5470.2011.01.013 [16] HE L, YIN K, YUAN X, et al. Spatial distribution of viruses, bacteria and chlorophyll in the northern South China Sea[J]. Aquat Microb Ecol, 2009, 54(2): 153-162. https://xueshu.baidu.com/usercenter/paper/show?paperid=f54740877a44ade1ae9d16021ba783f0&site=xueshu_se&hitarticle=1
[17] 刘晶晶, 曾江宁, 杜萍, 等. 长江口及邻近海域夏、冬季浮游病毒丰度分布[J]. 应用生态学报, 2011, 22(3): 793-799. https://www.cnki.com.cn/Article/CJFDTOTAL-YYSB201103034.htm [18] 王艳, 汪岷, 杨琳, 等. 南黄海秋季浮游病毒丰度分布及其与宿主和环境因子的相关性研究[J]. 海洋与湖沼, 2013, 44(1): 198-204. https://www.cnki.com.cn/Article/CJFDTOTAL-HYFZ201301031.htm [19] 赵苑, 武洪庆, 李洪波, 等. 胶州湾浮游病毒的分布研究[J]. 海洋科学, 2010, 34(7): 86-92. https://www.cnki.com.cn/Article/CJFDTOTAL-HYKX201007017.htm [20] WOMMACK K E, COLWELL R R. Virioplankton: viruses in aquatic ecosystems[J]. Microbiol Mol Biol Rev: MMBR, 2000, 64(1): 69-114. doi: 10.1128/MMBR.64.1.69-114.2000
[21] KUO N J, ZHENG Q A, HO C R. Satellite observation of upwelling along the western coast of the South China sea[J]. Remote Sens Environ, 2000, 74(3): 463-470. doi: 10.1016/S0034-4257(00)00138-3
[22] MORGAN J A, QUINBY H L, DUCKLOW H W. Bacterial abundance and production in the western Black Sea[J]. Deep-Sea Res Ⅱ, 2006, 53(17/18/19): 1945-1960. https://xueshu.baidu.com/usercenter/paper/show?paperid=c9327fdb1e2065f9b61ed4fab9219c68&site=xueshu_se&hitarticle=1
[23] HE J F, ZHANG F, LIN L, et al. Bacterioplankton and picophytoplankton abundance, biomass, and distribution in the Western Canada Basin during summer 2008[J]. Deep-Sea Res Ⅱ, 2012, 81/82/83/84(SI): 36-45. https://xueshu.baidu.com/usercenter/paper/show?paperid=1y6g06x0gm0r0r90k85v0x7060066646&site=xueshu_se
[24] MA W, CHAI F, XIU P, et al. Simulation of export production and biological pump structure in the South China Sea[J]. Geo-Marine Lett, 2014, 34(6): 541-554. doi: 10.1007/s00367-014-0384-0
[25] SHIAH F K, DUCKLOW H W. Temperature regulation of heterotrophic bacterioplankton abundance, production, and specific growth rate in Chesapeake Bay[J]. Limnol Oceanogr, 1994, 39(6): 1243-1258. doi: 10.4319/lo.1994.39.6.1243
[26] WU J F, CHUNG S W, WEN L S, et al. Dissolved inorganic Phosphorus, dissolved Iron, and Trichodesmium in the oligotrophic South China Sea[J]. Global Biogeochem Cycles, 2003, 17(1): 1-8. https://xueshu.baidu.com/usercenter/paper/show?paperid=c527dd7365128739b2300cc469cd57c3&site=xueshu_se&hitarticle=1
[27] MOUTIN T, RAIMBAULT P. Primary production, Carbon export and nutrients availability in western and eastern Mediterranean Sea in early summer 1996 (MINOS cruise)[J]. J Mar Syst, 2002, 33(6): 273-288.
[28] WONG G T F, PAN X, LI K, et al. Hydrography and nutrient dynamics in the Northern South China Sea Shelf-sea (NoDoCS)[J]. Deep-Sea Res Ⅱ, 2015, 117: 23-40. https://xueshu.baidu.com/usercenter/paper/show?paperid=e7a46048d392bcc1525109cda333076c&site=xueshu_se&hitarticle=1
[29] 高源, 何剑锋, 陈敏, 等. 北冰洋楚科奇海浮游细菌丰度和生产力及其分布特征[J]. 海洋学报(中文版), 2015, 37(8): 96-104. https://xueshu.baidu.com/usercenter/paper/show?paperid=b9e395c58583cf13b929483062ca2684&site=xueshu_se&hitarticle=1 [30] LAPOUSSIÉRE A, MICHEL C, STARR M, et al. Role of free-living and particle-attached bacteria in the recycling and export of organic material in the Hudson Bay system[J]. J Mar Syst, 2011, 88(3, SI): 434-445. doi: 10.1016/j.jmarsys.2010.12.003
[31] BAI X G, WANG M, LIANG Y T, et al. Distribution of microbial populations and their relationship with environmental variables in the North Yellow Sea, China[J]. J Ocean Univ China, 2012, 11(1): 75-85. doi: 10.1007/s11802-012-1799-8
[32] VANUCCI S, BRUNI V, PULICANÒ G. Spatial and temporal distribution of virioplankton and bacterioplankton in a brackish environment (Lake of Ganzirri, Italy)[J]. Hydrobiologia, 2005, 539(1): 83-92. doi: 10.1007/s10750-004-3368-7
-
期刊类型引用(5)
1. 韩庆,刘可可,黄艳飞,田汉,王文彬,刘良国. 鲇繁殖生物学特征分析. 南方水产科学. 2023(05): 154-161 .  本站查看
本站查看
2. 林军,李增光,万荣,黄承伟. 长江口凤鲚产卵群体繁殖力特征. 上海海洋大学学报. 2022(05): 1023-1031 .  百度学术
百度学术
3. 卫明亮,张志伟,张志勇,林志杰,祝斐,贾超峰,孟乾,徐大凤,张曹进. 冷应激对黑鲷组织损伤及细胞凋亡基因表达的影响. 南方水产科学. 2022(05): 110-117 .  本站查看
本站查看
4. 罗相忠,覃维敏,梁宏伟,沙航,邹桂伟. 长丰鲢繁殖生物学研究. 淡水渔业. 2021(05): 21-27 .  百度学术
百度学术
5. 何玉洁,朱书礼,武智,李新辉,李捷. 珠江中下游草鱼渔业生物学特征研究. 南方水产科学. 2021(05): 110-117 .  本站查看
本站查看
其他类型引用(7)









 下载:
下载:










 粤公网安备 44010502001741号
粤公网安备 44010502001741号
