Acoustic estimation of fishery resources in southern continental shelf of Nansha area
-
摘要:
基于2013年南沙海域渔业资源声学和底拖网调查资料,评估了南沙南部陆架区(4°N~6°N)春(3月~4月)、夏(6月~7月)、秋(9月~10月)、冬(11月~12月)4个季节主要渔获物的种类组成和资源量。结果表明,2013年春、夏、秋、冬季声学资源评估种类分别为146、121、77、60种,所有评估种类资源量密度(均值±标准差)和资源量分别为(11.10±14.43)t · nmile-2和3.64×105 t、(19.60±21.46)t · nmile-2和4.83×105 t、(8.70±3.87)t · nmile-2和2.23×105 t、(11.91±11.44)t · nmile-2和2.13×105 t。短尾大眼鲷(Priacanthus macracanthus)为各季节最重要的经济种类,其渔获量占总渔获量的比例均超过30%。分析了鱼类资源量的空间分布和季节变化以及积分值随水深的变动趋势。
Abstract:According to the acoustic survey and bottom trawl of fishery resources in Nansha area (4°N~6°N) in 2013, we estimated the stocks and species composition of fishery resources in spring (March to April), summer (June to July), autumn (September to Ocotober) and winter (November to December) in southern continental shelf of Nansha area. The results show that the estimated biomass density (X ±SD) and stocks of 146 species in spring were (11.10±14.43) t · nmile-2 and 3.64×105 t, respectively. The estimated biomass density and stocks of 121 species in summer were (19.60±21.46) t · nmile-2 and 4.85×105 t, respectively. The estimated biomass density and stocks of 77 species in autumn were (8.70±3.87) t · nmile-2 and 2.23×105 t, respectively. The estimated biomass density and stocks of 60 species in winter were (11.91±11.44) t · nmile-2 and 2.13×105 t, respectively. Priacanthus macracanthus was the most abundant commercial fish in weight and its percentage to total catch was more than 30% in four seasons. Additionally, we analyzed the spatial distribution and seasonal variation of stocks of the species.
-
南海是中国的最大外海,自然条件优越,渔业生态环境类型多样,蕴藏着丰富的渔业资源,形成了优良的捕捞渔场[1-3]。1974年~1981年中国大陆先后多次对南海渔业资源进行调查,并进行过一次南海大洋性渔业资源专业调查,即南海水产研究所1974年~1976年实施的“西、中沙、南沙北部海域大洋性鱼类资源调查”,所获的资料对发展南海外海渔业具有重要参考价值,由于当时船只条件的限制,探捕调查的资料在连续性和重复性方面尚不够完善,调查面积约为1.8×105 km2[1]。后南海水产研究所于1990年4月、1992年5月和11月~12月、1993年4月~5月对南沙群岛西南部陆架区进行了4个航次的底拖网渔业资源调查,调查面积约1.0×105 km2,捕获鱼类360余种(其中经济鱼类230余种)以及多种头足类等经济渔获物,发现许多优质渔业资源和重要渔场[2]。1997年~2000年中国大陆首次全面、系统、同步调查了南海渔业资源与栖息环境,取得了大量有价值的资料,并首次采用声学评估方法对南海多鱼种渔业资源进行调查和评估,但进行的13个航次调查中,仅2000年春季对中、南沙进行过1个航次的调查,且范围也没有覆盖中、南沙海域岛礁区,如南海南部(12°N以南)调查覆盖范围仅约18×106 km2[3]。
1997年~2000年南海专属经济区和大陆架渔业资源调查至今,中国大陆未对南海海域渔业资源及其栖息环境进行系统、全面、综合性的调查,对南海渔业资源与生态环境的变化缺乏科学的新的了解。为系统查清、有序开发、合理利用和科学管理南海海洋渔业资源和生态环境,中国2013年启动“南海渔业资源调查与评估”项目,并首先对南沙约60×104 km2海域的渔业资源及其栖息环境进行了春、夏、秋、冬季4个航次的调查。鉴于南沙海域面积大,鱼种多,渔业资源的内容丰富,故此文基于2013年南沙海域渔业资源声学调查资料并辅助底层拖网取样,仅首先对南沙南部陆架海域(4°N~7°N)春、夏、秋、冬4个季节渔业资源的种类组成、资源量和分布进行分析,以期为该海域渔业资源的开发、利用、管理和养护积累资料。关于南沙北部深海海域(7°N~12°N)渔业资源的评估将另文论述。
1. 材料与方法
1.1 研究海域、时间、调查船和采样网具
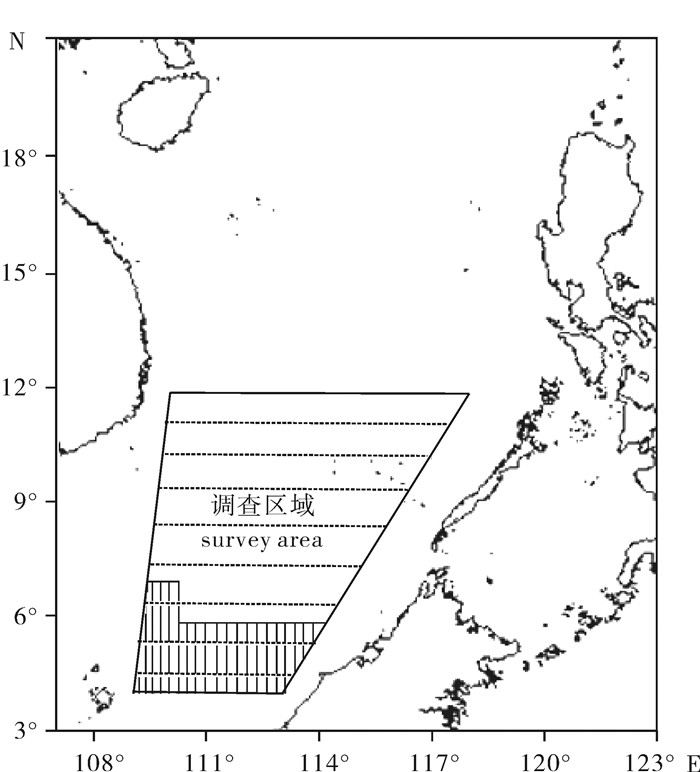
2013年4个季节调查范围覆盖南沙海域(图 1),春、夏季范围包括4°N~12°N,秋、冬季范围包括5°N~12°N。采用等间距平行断面方式沿航线进行走航调查,共布设4.5°N、5.5°N、6.5°N、…、11.5°N等8个断面(虚线段)。春、夏、秋、冬季调查时间分别为2013年3月~4月、6月~7月、9月~10月、11月~12月。图 1中竖线阴影区是此文研究区域,主要是200 m以浅海域。
调查船为“南锋”号。该船总吨位1 537 GT,船长66.7 m,船宽12.4 m,型深5.0 m。鱼类样品由底层拖网采集。底层拖网网口拉直周长150 m,网衣拉直总长度100 m,上纲长度51.5 m,网口网目数500,网口网目尺寸300 mm,网囊网目尺寸50 mm。
1.2 声学数据采集
声学数据由“南锋”号船载双频Simrad EK60分裂波束科学探鱼仪采集,工作频率分别为38 kHz和120 kHz,38 kHz声学数据用于计算资源量,120 kHz声学数据辅助映像分析。按照国际通用标准目标方法进行仪器校正[4],校准地点为南海万山岛锚地海域,春、夏、冬季校准时间分别为3月10~11日、6月8~9日、11月8~9日,秋季未进行校准。各季节38 kHz换能器主要技术参数见表 1。
表 1 Simrad EK 60探鱼仪主要技术参数设置Table 1 Main technical parameters of Simrad EK 60 echosounder技术参数
technical parameter38 kHz 换能器参数 38 kHz transducer 春季 spring 夏季 summer 秋季 autumn 冬季 winter 发射功率/W transmitting power 2 000 2 000 2 000 2 000 脉冲宽度/ms pulse duration 1 1 1 1 换能器增益/dB transducer gain 24.19 24.23 24.23 24.12 纵向波束宽度deg alongship 3 dB beam width 6.97 7.08 7.08 7.04 横向波束宽度deg athwardship 3 dB beam width 7.04 7.03 7.03 7.02 声速/m·s-1 sound speed 1 538 1 535 1 535 1 544 海水声波吸收系数/dB·m-1 absorption coefficient 0.006 6 0.006 6 0.006 6 0.005 7 波束等效立体角 steradians equivalent beam angle -20.60 -20.60 -20.60 -20.60 1.3 生物学样品采集
拖网取样采用定点和机动加站相结合的方式[5],定点站位经度距离1°,共布设定点站位10个。底层拖网取样与声学数据采集同步进行。
起网后在甲板上对渔获物进行挑选、分类和取样,渔获少(小于20尾)的鱼类全部取样,其余鱼类视渔获多寡按比例进行抽样,对所有鱼类进行计数。测量并记录每种鱼类样品的体长(叉长或胴长)和体质量,长度测定精度为1 mm,体质量测定精度为1 g。数据带回实验室进一步分析。
1.4 声学映像数据分析和资源量估算
借助Echoview软件分析声学数据。所有声学数据都被逐一检查,根据有关文献消除背景噪声和随机噪声[6-8]。声学数据分析水层是换能器表面之下5 m至海底0.5 m之上的所有水体,基本积分航程单元(elementary distance sampling unit,EDSU)设为10 nmile[5, 9],积分阈值设为-80 dB。
声学映像分析和积分值分配以底拖网取样资料为主要依据。每网渔获物数据代表该站位前后若干个10 nmile内的鱼类组成信息。根据渔获物的种类、数量、体长分布和反射声波能力大小,确定EDSU内的平均后向散射截面[5, 9]。采用断面法评估主要经济鱼种的资源量和所有鱼种的总资源量。分析断面水域第i种鱼类的数量密度ρi~a(尾· 海里-2,ind · nmile-2)和资源量密度ρi~b(t · nmile-2)分别为[5-7, 9]:
$$ \mathtt{ρ}^{i \sim a}=c_i \frac{\text { NASC }}{4 \pi \bar{\sigma}} $$ (1) $$ {\mathtt{ρ}^{i \sim b}} = {\mathtt{ρ}_{i \sim a}}{W_i}{10^{ - 6}} $$ (2) 其中
$$ \bar{\sigma}=\sum\limits_{i=1}^n c_i 10^{\frac{T S_i}{10}} $$ (3) $$ T S_i=20 \lg l_i+b_{20, i} $$ (4) 式中ci是分析断面水域内第i种鱼类占渔获物的百分比;NASC(nautical area scattering coefficient)是分析断面水域内参与积分值分配生物种类的总积分值(m2 · nmile-2);(mean backscattering cross-section)是分析断面水域内所有评估鱼种的平均后向声学截面(m2);wi是第i种鱼类的平均个体质量(g);TSi(target strength)是鱼种i的目标强度(dB);n是分析断面中所有评估鱼类的种数;li是第i种鱼体体长(cm);b20, i是第i种鱼的目标强度参数(dB)。通过前人研究结果,归纳主要评估种类的目标强度参数(表 2)[3, 5, 10-14]。
表 2 主要声学评估种类及b20Table 2 Main species for acoustic estimation and their b20 values种类 species b20/dB 种类 species b20/dB 种类 species b20/dB 种类 species b20/dB 大眼鲷类 Priacanthidae -68.0 笛鲷类 Emmelichthyidae -68.0 狗母鱼科 Synodontidae -72.5 金线鱼科 Nemipteridae -68.0 枪乌贼类 Loliginidae -78.0 裸颊鲷科 Scavengers -68.0 天竺鲷科 Apogonidae -68.0 石斑鱼类 Epinephelus -72.5 鲾类 Leiognathidae -72.5 发光鲷类 Acropomatidae -68.0 带鱼科 Trichiuridae -68.3 刺鲀类 Diodontidae -76.0 鲭科 Scombrida -76.0 蓝子鱼类 Siganidae -68.0 马面鲀类 Cantherines -76.0 鲀科 Tetraodontidae -76.0 鯻科 Theraponidae -72.5 鲷科 Sparidae -68.0 石首鱼科 Sciaenidae -68.0 小公鱼类 Stolephorus -72.5 鲹科 Carangidae -72.5 鲉科 Scorpaenidae -72.5 棱鳀类 Anchovy -72.5 沙丁鱼类 Sardinella -72.5 石鲈科 Pomadasyidae 68.0 鱼衔类 Callioymidae -72.5 鳗类 Anguillidae -76.0 鳂科 Holocentridae -68.0 鲻科 Mugilidae -72.5 鲈类 Percidae -72.5 眼镜鱼科 Menidae -76.0 方头鱼科 Branchiostegidae -68.0 鱚科 Sillaginidae -72.5 绯鲤类 Percoidea -72.5 鲳类 Pomfret -80.0 马鲅科 Polynemidae -80.0 蛇鲭科 Gempylidae -68.0 各断面所代表水域鱼种i的丰度Ai(尾)和资源量Bi(t)分别为:
$$ {A^i} = {\mathtt{ρ}^{i\sim a}}S $$ (5) $$ {B^i} = {\mathtt{ρ}^{i\sim b}}S $$ (6) 式中S是分析断面水域面积(nmile2)。得到各分析断面所代表水域Ai和Bi后,通过累加计算得到调查范围内各鱼种的总丰度和总资源量以及所有评估鱼种的总丰度资源量。
调查结果精度(precision)用变异系数(coefficient of variation,CV)表示,其计算公式为[9, 15]:
$$ {\rm{CV}} = \frac{{0.5}}{{\;\;\;\Lambda }} $$ (7) 其中
$$ \Lambda=\frac{D}{A} $$ (8) 式中Λ是调查覆盖度(degree of coverage),D是调查取样断面长度(nmile),A是调查海域面积(nmile2)。
1.5 积分值分布随水深变化
积分值(NASC)和体积反向散射强度(volume backscattering strength,Sv,dB)是指示鱼类分布的有用指数,一般与资源量成正相关[6]。为了解鱼类资源分布随水深变动情况,统计各基本积分航程单元的NASC、Sv及水深,分析两者之间的关系。因相同水深区域,NASC和Sv可能存在随机波动,故以10 m为步长,将每个深度区间内的水深、NASC和Sv作均值化处理,Sv运算于线性域内进行($\left. {\overline {{S_v}} = 10{{\log }_{10}}\left[ {\left( {\sum\limits_{i = 1}^n 1 {0^{(Sv, i\Lambda 0)}}} \right)} \right./n} \right] $)[9]。
2. 结果与分析
2.1 渔获种类组成
2013年各季节渔获物种类组成和渔获量信息见表 3。春、夏、秋、冬季捕获鱼类种类数依次降低,且仅春季捕获到海马1种(克氏大海马)。各季节鲆鲽类、
 表 3 2013年各季节渔获物种类组成和渔获量Table 3 Species composition and catches for each season in 2013
表 3 2013年各季节渔获物种类组成和渔获量Table 3 Species composition and catches for each season in 2013季节
season种类组成 species composition 渔获量/g
catch鱼类
fish头足类
Cephalopoda虾类
Decapod蟹类
Decapod海马
hippocampi鲨鱼shark 春季 spring 147 13 14 9 1 2 2 637 500 夏季 summer 120 13 6 6 - 3 1 263 808 秋季 autumn 76 8 7 4 - 7 978 289 冬季 winter 60 4 8 5 - 2 1 727 421 春、夏、秋和冬季前10位鱼类的渔获量合计占总渔获量的比例分别为68.6%、71.9%、69.7%和72.5%(表 4)。短尾大眼鲷为各季节最重要的经济种类,其渔获量占总渔获量的比例均超过30%。各季节渔获量列前10位的种类中,短尾大眼鲷和剑尖枪乌贼均有出现,多齿蛇鲻和深水金线鱼分别出现3次,大头狗母鱼、花斑蛇鲻、印度无齿鲳和长体圆鲹各出现2次,其余鱼类均出现1次;反映主要渔获物种类组成存在一定的季节变动。值得注意的是,春季于南沙西南陆架海域捕获到较多优质鱼类,如红笛鲷、黄条
 表 4 2013年各季节渔获量前10位鱼类生物学信息Table 4 Biological composition of most abundant 10 species for each season in 2013
表 4 2013年各季节渔获量前10位鱼类生物学信息Table 4 Biological composition of most abundant 10 species for each season in 2013季节
season种类
species数量/尾
number渔获量占比/%
percentage体长/mm body length 体质量/g body weight 范围 range 均值 mean 范围 range 均值 mean 春季 spring 短尾大眼鲷 Priacanthus macracanthus 7 366 33.7 85~416 189 10~510 121 多齿蛇鲻 Saurida tumbil 1 567 5.7 102~438 206 13~950 97 红笛鲷 Lutjanus sanguineus 47 4.9 385~540 469 1 620~4 010 2 723 颌圆鲹 Decapterus lajang 1 440 4.5 190~200 196 100~200 83 剑尖枪乌贼 Loligo edulis 1 648 4.3 20~473* 146* 8~600 69 黄条 
12 4.2 720~940 845 3 540~13 560 9 333 星斑裸颊鲷 Lethrinus nebulosus 25 4.1 390~550 476 1 065~7 020 4 280 深水金线鱼 Nemipterus bathybius 755 2.7 49~392 130 12~330 94 大头狗母鱼 Trachinocephalus myops 643 2.5 115~330 226 7~500 102 紫红笛鲷 Lutjanus argentimaculatus 17 2.0 412~660 528 1 700~5 150 3 129 夏季 summer 短尾大眼鲷 P.macracanthus 3 744 33.8 70~200 168 11~320 114 红鳍圆鲹 Decapterus russelli 971 10.0 145~258 164 66~216 130 印度无齿鲳 Ariomma indica 2 237 6.4 88~186 104 22~145 36 剑尖枪乌贼 L.edulis 1 379 5.6 35~232* 86* 4~300 42 深水金线鱼 N.bathybius 742 4.9 75~224 165 14~230 83 眼镜鱼 Mene maculata 172 3.48 204~233 208 260~320 256 花斑蛇鲻 Saurida undosquamis 280 2.1 75~333 236 5~370 95 多齿蛇鲻 S.tumbil 257 1.9 90~430 192 7~1 000 94 杜氏枪乌贼 Loligo duvaucelii 610 1.9 32~103* 93* 2.5~60 39 长体圆鲹 Decapterus macrosoma 147 1.8 97~210 192 13~204 157 秋季 autumn 短尾大眼鲷 P.macracanthus 4 631 34.0 83~207 165 10~330 72 大头狗母鱼 T.myops 1 388 9.0 110~330 197 14~500 63 长体圆鲹 D.macrosoma 1 449 6.2 136~164 151 40~76 42 鳞首方头鲳 Cubiceps squamiceps 683 5.8 130~160 149 50~105 83 大海鲢 Megalops cyprinoides 87 4.9 154~326 287 75~1075 552 剑尖枪乌贼 L.edulis 328 3.0 77~275* 129* 33~400 89 深水金线鱼 N.bathybius 254 2.2 107~190 143 39~165 84 宽带石斑鱼 Epinephelus latifasciatus 8 1.6 449~451 450 2 000~2 002 2 000 花斑蛇鲻 S.undosquamis 48 1.5 195~360 300 82~410 313 黑斑叉鼻鲀 Arothron nigropunctatus 235 1.5 59~114 91 13~140 61 冬季 winter 短尾大眼鲷 P.macracanthus 7 906 36.2 58~232 166 15~332 79 多齿蛇鲻 S.tumbil 1 252 6.7 103~305 207 14~290 92 黑鳍蛇鲭 Thyrsitoides marleyi 2 013 6.5 157~213 169 32~96 56 日本骨鰃 Ostichthys japonicus 164 5.7 115~302 214 66~1 250 603 印度无齿鲳 A.indica 972 5.1 123~179 142 63~165 90 海鳗 Muraenesox cinereus 128 3.1 2 15~350 292 230~600 420 霜点石斑鱼 Epinephelus rhyncholepis 192 2.9 170~249 211 138~360 245 黑斑叉鼻鲀 A.nigropunctatus 656 2.3 53~270 68 11~780 66 剑尖枪乌贼 L.edulis 359 2.2 58~132* 142* 6.5~220 104 单棘躄鱼 Chaunax fimbriatus 605 1.8 63~135 103 5~200 51 注:*. 胴长;
Note:*. donates mantle length2.2 资源密度和资源量
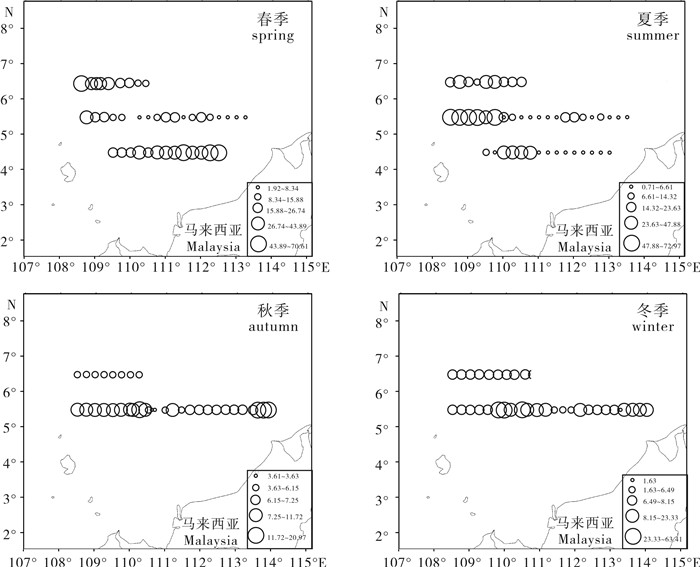
2013年南沙南部陆架海域各季节所有评估鱼类资源量密度分布见图 2,鱼类资源量密度空间和季节分布变化较大,如春季5.5°N断面海域的资源量密度明显低于其余2个断面;春季密度高值区位于4.5°N,111.3°E~112.5°E和6.5°N,108.6°E~109.4°E海域,而夏季则位于5.5°N,108.4°E~109.8°E海域。
4次调查中,秋季数量密度和资源量密度均最低,春、夏、冬季的数量密度和资源量密度分别是秋季的1.93、3.40、1.13倍和1.28、2.25、1.39倍;数量和资源量密度的季节分布并不完全一致(表 5)。短尾大眼鲷平均体质量秋季最低,春、夏、冬季分别是秋季的1.68、1.58、1.10倍,与平均资源密度的季节趋势一致(表 6)。冬季资源量最低,春、夏、秋季的资源量分别是冬季的1.70、2.27、1.05倍。从声学评估结果看,鲷类、蛇鲻类、枪乌贼类和金线鱼类的资源量合计占总资源量的比例超过60%(表 6)。南沙南部陆架海域短尾大眼鲷分布广泛;资源量夏季最高,为1.63×105 t,冬季最低,为7.22×104 t(表 6)。
表 5 各季节所有声学评估鱼类结果Table 5 Acoustic estimation of total species for each season季节
season平均数量密度/
个·nmile-2 mean ρa平均资源量密度/
t·nmile-2mean ρb资源丰度/个
abundance资源量/t
biomass覆盖面积/nmile2
survey area变异系数
CV春季 spring 179 806±123 229 11. 10±14.43 3.60×109 3.64×105 36 000 0.392 夏季 summer 316 663±323 847 19.60±21.46 1.22×1010 4.83×105 37 800 0.381 秋季 autumn 93 217±45 355 8.70±3.87 2.44×109 2.23×105 25 200 0.411 冬季 winter 105 756±36 389 11.91±11.41 2.72×109 2.13×105 27 000 0.425 注:ρa和ρb分别表示数量密度和资源量密度, 下表同此
Note:ρa and ρb donates abundance density and biomass density.The same case in the following table.表 6 2013年各季节渔获量前10位鱼类的资源丰度和资源量Table 6 Abundance and biomass of most abundant 10 species for each season in 2013季节
season种类
species平均数量密度/个·nmile-2
mean ρa平均资源量密度/t·nmile-2
mean ρb丰度/个
abundance资源量/
tbiomass春季 spring 短尾大眼鲷 48 186±33 024 3.74±4.86 8.39×108 9.20×104 多齿蛇鲻 10 251±7 025 0.36±0.82 2.06×108 2.11×104 红笛鲷 307±211 0.54±0.71 1.77×107 4.81×104 颌圆鲹 9 420±6 456 0.50±0.65 2.68×108 2.23×104 剑尖枪乌贼 10 781±7 389 0.48±0.62 3.44×108 2.12×104 黄条 
79±54 0.47±0.61 4.51×106 4.21×104 星斑裸颊鲷 164±112 0.46±0.59 4.40×106 4.02×104 深水金线鱼 5 345±3 663 0.30±0.39 1.04×108 8.35×103 大头狗母鱼 4 206±2 883 0.28±0.36 1.63×108 1.66×104 紫红笛鲷 111±76 0.22±0.29 3.30×106 1.02×104 夏季 summer 短尾大眼鲷 55 984±57 254 6.62±7.31 1.45×109 1.63×105 红鳍圆鲹 14 519±14 849 1.96±2.09 2.13×108 1.38×104 印度无齿鲳 11 155±11 408 1.25±1.42 2.90×108 1.03×104 剑尖枪乌贼 21 861±22 357 1.10±1.23 1.15×109 4.16×104 深水金线鱼 11 095±11 347 0.96±1.13 2.54×108 1.58×104 眼镜鱼 2 632±2 691 0.68±0.71 1.32×107 3.38×103 花斑蛇鲻 4 187±4 282 0.41±0.47 1.43×108 5.06×103 多齿蛇鲻 3 843±3 930 0.37±0.39 1.25×108 9.92×103 杜氏枪乌贼 9 211±9 420 0.37±0.41 4.70×108 1.38×104 长体圆鲹 2 198±2 248 0.35±0.39 3.73×107 3.52×103 秋季 autumn 短尾大眼鲷 36 377±17 692 2.96±1.32 1.42×109 9.44×104 大头狗母鱼 10 903±5 303 0.78±0.35 2.80×108 1.53×104 长体圆鲹 11 382±5 536 0.54±0.24 5.14×108 2.14×104 鳞首方头鲳 5 365±2 609 0.50±0.22 1.13×108 1.07×104 大海鲢 683±322 0.43±0.19 1.16×107 6.25×103 剑尖枪乌贼 2 576±1 253 0.26±0.12 6.99×107 7.95×103 深水金线鱼 1 995±970 0.19±0.09 5.22×107 5.02×103 宽带石斑鱼 63±31 0.14±0.06 1.43×106 2.86×103 花斑蛇鲻 377±183 0.13±0.06 1.70×107 5.31×104 黑斑叉鼻鲀 1 846±898 0.13±0.06 4.85×107 2.93×103 冬季 winter 短尾大眼鲷 44 910±15 453 4.31±4.13 9.80×108 7.22×104 多齿蛇鲻 3 912±1 346 0.80±0.76 1.15×108 1.43×104 蛇鲭 6 140±2 113 0.77±0.74 1.72×108 9.76×103 日本骨鰃 490±169 0.68±0.65 1.27×107 9.22×103 印度无齿鲳 3 663±1 260 0.61±0.58 1.62×108 1.12×104 海鳗 383±132 0.37±0.35 8.03×106 3.86×103 霜点石斑鱼 570±196 0.35±0.33 1.89×107 3.99×103 黑斑叉鼻鲀 1 970±678 0.27±0.26 6.71×107 5.01×103 剑尖枪乌贼 1 239±426 0.26±0.25 8.68×107 5.39×103 单棘躄鱼 1 845±635 0.21±0.21 5.32×107 2.49×103 2.3 积分值分布随水深变化
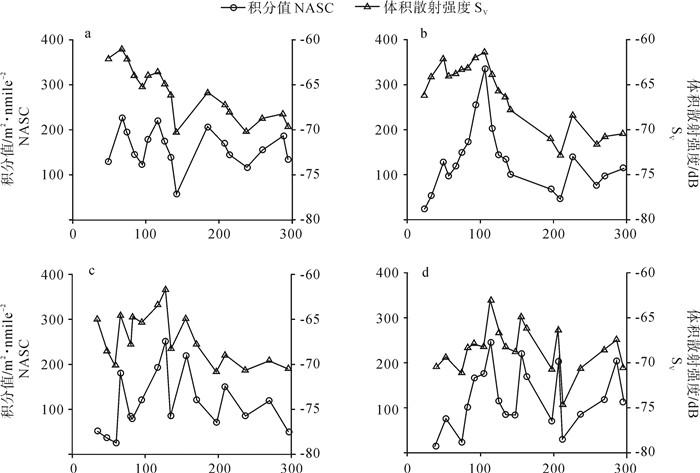
2013年南沙南部陆架海域春、夏、秋、冬季NASC和Sv随水深的变化趋势见图 3。Spearman秩相关检验显示,春季NASC和Sv呈显著正相关关系(P < 0.05),夏、秋、冬季NASC和Sv呈极显著正相关关系(P < 0.01),为避免重复,在此主要分析NASC随水深变化趋势。
根据NASC随水深变化特征,可将各季节水深分成不同组,如春季40~90 m、90~140 m、140~230 m、230~300 m水深组内,NASC随水深增加均呈先增加后减少。各季节积分值随水深分布的峰值和谷值也不相同(图 3),反映资源随深度分布的季节差异。总体而言,200 m以浅海域NASC值明显高于200 m以深海域。
3. 讨论
2013年4次调查中,从拖网渔获物和声学评估种类组成看,春、夏季有波动但相差不大,秋、冬季亦如此;但春、夏季与秋、冬季差别明显,前者种类数量约是后者的2倍,其主要原因应归于两者调查范围的差异;春、夏季调查范围是4°N~7°N,秋、冬季则是5°N~7°N之间的海域,间接反映出4°N~5°N海域具有丰富的鱼类多样性[16]。春季于南沙西南部陆架海域(中心位置4°30′N,109°30′E)采捕到较多优质鱼类,该区域水深70~100 m。根据环境要素调查数据的初步分析,该渔区所处的陆架区为上升流活跃区域,可能造就了其具有较高的初级生产力水平,并为多种鱼类的生长繁育提供了良好的栖息环境和物质基础。
各季节渔获量百分比前10位的种类基本都是传统经济种类,尤其是出现频率较高的种类,短尾大眼鲷是明显优势种类[17-21]。各季节资源量与资源丰度变化趋势并不完全一致,可能与不同鱼种在不同季节内尾平均体质量变化趋势不同有关,如春、夏、秋、冬季渔获物质量百分比前10位鱼类的加权平均体质量分别为134 g、85 g、75 g和88 g。基于此文底拖网数据和声学评估结果,各季节短尾大眼鲷在渔获物中所占比例均超过33%,春、夏、秋、冬季其在所有评估鱼类资源量中所占比例分别是25.3%、33.7%、42.3%、33.9%。短尾大眼鲷所占比例如此之高是一个有趣的新情况,值得继续探讨。钟智辉等[22]对1993年~2002年间南沙西南陆架区底拖网主要经济渔获种类组成和数量变动分析后,发现单一属种所占比例最高的年份是2000年(以质量计),是年大眼鲷属所占比例最高,但也仅为30.2%。
陈铮和李辉权[2]研究表明南沙西南陆架区底拖网捕获的主要经济鱼类,有在一定水深范围内明显聚集的现象,聚集的主要水深范围为70~130 m,此文积分值随水深的分布特征与以上现象吻合。李辉权[23]研究南沙西南部陆架海区花斑蛇鲻等17种主要经济鱼类渔业生物学时也发现,除侧斑副绯鲤(Parupeneus pleurospilos)外,其余种类普遍呈现出春、秋季分布水深的差异,秋季的分布移向浅水区,但此文积分值-水深分布图并未显示出此差异。这是否因渔业资源发生变动所致,抑或声学调查航线设计和数据采集变化所致尚需进一步研究。
经过数十年发展,水声学技术已成为研究海洋鱼类和浮游生物的有力工具[9, 24]。但由于探鱼仪安装于调查船底部和声学近场效应(nearfield),其无法探测到临近海表面的鱼类,形成声学调查的盲区(blind zone),如此文海面以下5 m水体;此外,积分仪存在死区,形成声学调查的死区(dead zone),而为排除海底的反射信号,声学评估水深一般终止于海底之上一定高度,如此文海底以上0.5 m,因此声学方法一般不适合有效评估底栖或非常贴底的鱼类[25-26]。国际上有关如何评估声学盲区和死区内鱼类资源量的研究已有不少报道[25-29],为对全水体鱼类资源量进行补偿提供了科学参考,值得借鉴和进行追踪研究。
渔业资源声学评估的误差主要有2类:1)随机误差,如调查航线设计差异引起的取样误差;2)系统误差,如网具选择性导致评估种类及平均目标强度变化所引起的误差[9]。此文公式(7)和(8)即是对第一类随机误差的经验统计。回声积分法评估鱼类资源时将积分值分配到具体鱼种的依据主要有2个:1)基于鱼类回波轨迹对映像进行判别[30];2)基于网具取样的渔获物组成[31]。如果通过映像判别直接进行积分值分配可行,当然是好的选择。但该方法对种类组成较为简单的生态系统(单种类或明显优势种类)可行,而对组成较为复杂的生态系统则很难实现。根据网具渔获物组成进行积分值分配能反映不同鱼种年龄和体长结构及目标强度的差异,被普遍采用。但该方法假设网具对所有鱼类有相同的捕获效率,可能成为重要的系统误差来源,如何对渔获物种类和比例组成进行校正是需要解决的重要问题[5, 10, 31-33]。南海陆架区(南沙南部和南海北部)鱼种繁多,组成复杂,通过分析鱼类声学映像轨迹进行种类判别和积分值分配几无可行性。拖网(或其他网具)取样(或结合新方法,如神经网络)可能仍是今后一段时间内陆架区鱼类声学积分值分配的主要依据。因此,在南海开展鱼类资源拖网(或其他网具)和声学评估的比较研究并通过理论模型探讨不同鱼类网具逃逸率对积分值分配及声学评估结果的影响非常必要。
致谢: 对“南锋”号调查船全体船员给予的支持,谨致谢忱! -
表 1 Simrad EK 60探鱼仪主要技术参数设置
Table 1 Main technical parameters of Simrad EK 60 echosounder
技术参数
technical parameter38 kHz 换能器参数 38 kHz transducer 春季 spring 夏季 summer 秋季 autumn 冬季 winter 发射功率/W transmitting power 2 000 2 000 2 000 2 000 脉冲宽度/ms pulse duration 1 1 1 1 换能器增益/dB transducer gain 24.19 24.23 24.23 24.12 纵向波束宽度deg alongship 3 dB beam width 6.97 7.08 7.08 7.04 横向波束宽度deg athwardship 3 dB beam width 7.04 7.03 7.03 7.02 声速/m·s-1 sound speed 1 538 1 535 1 535 1 544 海水声波吸收系数/dB·m-1 absorption coefficient 0.006 6 0.006 6 0.006 6 0.005 7 波束等效立体角 steradians equivalent beam angle -20.60 -20.60 -20.60 -20.60 表 2 主要声学评估种类及b20
Table 2 Main species for acoustic estimation and their b20 values
种类 species b20/dB 种类 species b20/dB 种类 species b20/dB 种类 species b20/dB 大眼鲷类 Priacanthidae -68.0 笛鲷类 Emmelichthyidae -68.0 狗母鱼科 Synodontidae -72.5 金线鱼科 Nemipteridae -68.0 枪乌贼类 Loliginidae -78.0 裸颊鲷科 Scavengers -68.0 天竺鲷科 Apogonidae -68.0 石斑鱼类 Epinephelus -72.5 鲾类 Leiognathidae -72.5 发光鲷类 Acropomatidae -68.0 带鱼科 Trichiuridae -68.3 刺鲀类 Diodontidae -76.0 鲭科 Scombrida -76.0 蓝子鱼类 Siganidae -68.0 马面鲀类 Cantherines -76.0 鲀科 Tetraodontidae -76.0 鯻科 Theraponidae -72.5 鲷科 Sparidae -68.0 石首鱼科 Sciaenidae -68.0 小公鱼类 Stolephorus -72.5 鲹科 Carangidae -72.5 鲉科 Scorpaenidae -72.5 棱鳀类 Anchovy -72.5 沙丁鱼类 Sardinella -72.5 石鲈科 Pomadasyidae 68.0 鱼衔类 Callioymidae -72.5 鳗类 Anguillidae -76.0 鳂科 Holocentridae -68.0 鲻科 Mugilidae -72.5 鲈类 Percidae -72.5 眼镜鱼科 Menidae -76.0 方头鱼科 Branchiostegidae -68.0 鱚科 Sillaginidae -72.5 绯鲤类 Percoidea -72.5 鲳类 Pomfret -80.0 马鲅科 Polynemidae -80.0 蛇鲭科 Gempylidae -68.0 表 3 2013年各季节渔获物种类组成和渔获量
Table 3 Species composition and catches for each season in 2013
季节
season种类组成 species composition 渔获量/g
catch鱼类
fish头足类
Cephalopoda虾类
Decapod蟹类
Decapod海马
hippocampi鲨鱼shark 春季 spring 147 13 14 9 1 2 2 637 500 夏季 summer 120 13 6 6 - 3 1 263 808 秋季 autumn 76 8 7 4 - 7 978 289 冬季 winter 60 4 8 5 - 2 1 727 421 表 4 2013年各季节渔获量前10位鱼类生物学信息
Table 4 Biological composition of most abundant 10 species for each season in 2013
季节
season种类
species数量/尾
number渔获量占比/%
percentage体长/mm body length 体质量/g body weight 范围 range 均值 mean 范围 range 均值 mean 春季 spring 短尾大眼鲷 Priacanthus macracanthus 7 366 33.7 85~416 189 10~510 121 多齿蛇鲻 Saurida tumbil 1 567 5.7 102~438 206 13~950 97 红笛鲷 Lutjanus sanguineus 47 4.9 385~540 469 1 620~4 010 2 723 颌圆鲹 Decapterus lajang 1 440 4.5 190~200 196 100~200 83 剑尖枪乌贼 Loligo edulis 1 648 4.3 20~473* 146* 8~600 69 黄条 
12 4.2 720~940 845 3 540~13 560 9 333 星斑裸颊鲷 Lethrinus nebulosus 25 4.1 390~550 476 1 065~7 020 4 280 深水金线鱼 Nemipterus bathybius 755 2.7 49~392 130 12~330 94 大头狗母鱼 Trachinocephalus myops 643 2.5 115~330 226 7~500 102 紫红笛鲷 Lutjanus argentimaculatus 17 2.0 412~660 528 1 700~5 150 3 129 夏季 summer 短尾大眼鲷 P.macracanthus 3 744 33.8 70~200 168 11~320 114 红鳍圆鲹 Decapterus russelli 971 10.0 145~258 164 66~216 130 印度无齿鲳 Ariomma indica 2 237 6.4 88~186 104 22~145 36 剑尖枪乌贼 L.edulis 1 379 5.6 35~232* 86* 4~300 42 深水金线鱼 N.bathybius 742 4.9 75~224 165 14~230 83 眼镜鱼 Mene maculata 172 3.48 204~233 208 260~320 256 花斑蛇鲻 Saurida undosquamis 280 2.1 75~333 236 5~370 95 多齿蛇鲻 S.tumbil 257 1.9 90~430 192 7~1 000 94 杜氏枪乌贼 Loligo duvaucelii 610 1.9 32~103* 93* 2.5~60 39 长体圆鲹 Decapterus macrosoma 147 1.8 97~210 192 13~204 157 秋季 autumn 短尾大眼鲷 P.macracanthus 4 631 34.0 83~207 165 10~330 72 大头狗母鱼 T.myops 1 388 9.0 110~330 197 14~500 63 长体圆鲹 D.macrosoma 1 449 6.2 136~164 151 40~76 42 鳞首方头鲳 Cubiceps squamiceps 683 5.8 130~160 149 50~105 83 大海鲢 Megalops cyprinoides 87 4.9 154~326 287 75~1075 552 剑尖枪乌贼 L.edulis 328 3.0 77~275* 129* 33~400 89 深水金线鱼 N.bathybius 254 2.2 107~190 143 39~165 84 宽带石斑鱼 Epinephelus latifasciatus 8 1.6 449~451 450 2 000~2 002 2 000 花斑蛇鲻 S.undosquamis 48 1.5 195~360 300 82~410 313 黑斑叉鼻鲀 Arothron nigropunctatus 235 1.5 59~114 91 13~140 61 冬季 winter 短尾大眼鲷 P.macracanthus 7 906 36.2 58~232 166 15~332 79 多齿蛇鲻 S.tumbil 1 252 6.7 103~305 207 14~290 92 黑鳍蛇鲭 Thyrsitoides marleyi 2 013 6.5 157~213 169 32~96 56 日本骨鰃 Ostichthys japonicus 164 5.7 115~302 214 66~1 250 603 印度无齿鲳 A.indica 972 5.1 123~179 142 63~165 90 海鳗 Muraenesox cinereus 128 3.1 2 15~350 292 230~600 420 霜点石斑鱼 Epinephelus rhyncholepis 192 2.9 170~249 211 138~360 245 黑斑叉鼻鲀 A.nigropunctatus 656 2.3 53~270 68 11~780 66 剑尖枪乌贼 L.edulis 359 2.2 58~132* 142* 6.5~220 104 单棘躄鱼 Chaunax fimbriatus 605 1.8 63~135 103 5~200 51 注:*. 胴长;
Note:*. donates mantle length表 5 各季节所有声学评估鱼类结果
Table 5 Acoustic estimation of total species for each season
季节
season平均数量密度/
个·nmile-2 mean ρa平均资源量密度/
t·nmile-2mean ρb资源丰度/个
abundance资源量/t
biomass覆盖面积/nmile2
survey area变异系数
CV春季 spring 179 806±123 229 11. 10±14.43 3.60×109 3.64×105 36 000 0.392 夏季 summer 316 663±323 847 19.60±21.46 1.22×1010 4.83×105 37 800 0.381 秋季 autumn 93 217±45 355 8.70±3.87 2.44×109 2.23×105 25 200 0.411 冬季 winter 105 756±36 389 11.91±11.41 2.72×109 2.13×105 27 000 0.425 注:ρa和ρb分别表示数量密度和资源量密度, 下表同此
Note:ρa and ρb donates abundance density and biomass density.The same case in the following table.表 6 2013年各季节渔获量前10位鱼类的资源丰度和资源量
Table 6 Abundance and biomass of most abundant 10 species for each season in 2013
季节
season种类
species平均数量密度/个·nmile-2
mean ρa平均资源量密度/t·nmile-2
mean ρb丰度/个
abundance资源量/
tbiomass春季 spring 短尾大眼鲷 48 186±33 024 3.74±4.86 8.39×108 9.20×104 多齿蛇鲻 10 251±7 025 0.36±0.82 2.06×108 2.11×104 红笛鲷 307±211 0.54±0.71 1.77×107 4.81×104 颌圆鲹 9 420±6 456 0.50±0.65 2.68×108 2.23×104 剑尖枪乌贼 10 781±7 389 0.48±0.62 3.44×108 2.12×104 黄条 
79±54 0.47±0.61 4.51×106 4.21×104 星斑裸颊鲷 164±112 0.46±0.59 4.40×106 4.02×104 深水金线鱼 5 345±3 663 0.30±0.39 1.04×108 8.35×103 大头狗母鱼 4 206±2 883 0.28±0.36 1.63×108 1.66×104 紫红笛鲷 111±76 0.22±0.29 3.30×106 1.02×104 夏季 summer 短尾大眼鲷 55 984±57 254 6.62±7.31 1.45×109 1.63×105 红鳍圆鲹 14 519±14 849 1.96±2.09 2.13×108 1.38×104 印度无齿鲳 11 155±11 408 1.25±1.42 2.90×108 1.03×104 剑尖枪乌贼 21 861±22 357 1.10±1.23 1.15×109 4.16×104 深水金线鱼 11 095±11 347 0.96±1.13 2.54×108 1.58×104 眼镜鱼 2 632±2 691 0.68±0.71 1.32×107 3.38×103 花斑蛇鲻 4 187±4 282 0.41±0.47 1.43×108 5.06×103 多齿蛇鲻 3 843±3 930 0.37±0.39 1.25×108 9.92×103 杜氏枪乌贼 9 211±9 420 0.37±0.41 4.70×108 1.38×104 长体圆鲹 2 198±2 248 0.35±0.39 3.73×107 3.52×103 秋季 autumn 短尾大眼鲷 36 377±17 692 2.96±1.32 1.42×109 9.44×104 大头狗母鱼 10 903±5 303 0.78±0.35 2.80×108 1.53×104 长体圆鲹 11 382±5 536 0.54±0.24 5.14×108 2.14×104 鳞首方头鲳 5 365±2 609 0.50±0.22 1.13×108 1.07×104 大海鲢 683±322 0.43±0.19 1.16×107 6.25×103 剑尖枪乌贼 2 576±1 253 0.26±0.12 6.99×107 7.95×103 深水金线鱼 1 995±970 0.19±0.09 5.22×107 5.02×103 宽带石斑鱼 63±31 0.14±0.06 1.43×106 2.86×103 花斑蛇鲻 377±183 0.13±0.06 1.70×107 5.31×104 黑斑叉鼻鲀 1 846±898 0.13±0.06 4.85×107 2.93×103 冬季 winter 短尾大眼鲷 44 910±15 453 4.31±4.13 9.80×108 7.22×104 多齿蛇鲻 3 912±1 346 0.80±0.76 1.15×108 1.43×104 蛇鲭 6 140±2 113 0.77±0.74 1.72×108 9.76×103 日本骨鰃 490±169 0.68±0.65 1.27×107 9.22×103 印度无齿鲳 3 663±1 260 0.61±0.58 1.62×108 1.12×104 海鳗 383±132 0.37±0.35 8.03×106 3.86×103 霜点石斑鱼 570±196 0.35±0.33 1.89×107 3.99×103 黑斑叉鼻鲀 1 970±678 0.27±0.26 6.71×107 5.01×103 剑尖枪乌贼 1 239±426 0.26±0.25 8.68×107 5.39×103 单棘躄鱼 1 845±635 0.21±0.21 5.32×107 2.49×103 -
[1] 国家水产总局南海水产研究所. 西、中沙、南海北部海域大洋性鱼类资源调查报告[R]. 广州: 国家水产总局南海水产研究所, 1978: 18-47. https://xueshu.baidu.com/usercenter/paper/show?paperid=4f2b8760f67882d84ace027f0f4e35d4 [2] 陈铮, 李辉权. 南沙群岛西南部陆架区底拖网渔获主要经济鱼类的数量分布特征及主要渔场[J]. 海洋水产研究, 1994, 15(2): 141-151. https://qikan.cqvip.com/Qikan/Article/Detail?id=1604481 [3] 贾晓平, 李永振, 李纯厚, 等. 南海专属经济区和大陆架渔业生态环境与渔业资源[M]. 北京: 科学出版社, 2004: 329-391. https://www.las.ac.cn/front/book/detail?id=42fe2fc1c537854dac87610b13d7d5a0 [4] SIMRAD. Simrad ER60 Scientific echo sounder software reference manual[Z]. Norway: Simrad Maritime AS Kongsberg, 2008: 19-31.
[5] 赵宪勇, 陈毓桢, 李显森, 等. 多种类海洋渔业资源声学评估技术与方法[C]//我国专属经济区和大陆架勘测研究论文集. 北京: 海洋出版社, 2002: 341-353. https://xueshu.baidu.com/usercenter/paper/show?paperid=35d24446d0fdf93d341c458df75ede46&site=xueshu_se&hitarticle=1 [6] HIGGINBOTTOM I, WOON S, SCHNEIDER P. Hydroacoustic data processing for standard stock assessment using Echoview: technical manual[M]. Australia: Myriax Software Pty Ltd Publication, 2008: 1-108. https://xueshu.baidu.com/usercenter/paper/show?paperid=de1e914dda04ae6f1893e825286f1f7e&site=xueshu_se&hitarticle=1
[7] 张俊. 基于声学数据后处理系统的黄海鳀鱼资源声学评估[D]. 上海: 上海海洋大学, 2011. https://apps.wanfangdata.com.cn/thesis/article:Y1946880 [8] ZHANG J, CHEN G B, CHEN P M, et al. Impact of subtracting Time Varied Gain Background Noise (TVGBN) on estimates of fisheries resources derived from post-processing acoustic data[J]. J Appl Ichthyol, 2013, 29(6): 1468-1472. doi: 10.1111/jai.12364
[9] SIMMONDS J, MACLENNAN D N. Fisheries acoustics: theory and practice[M]. New York: Wiley, 2005: 1-379. https://xueshu.baidu.com/usercenter/paper/show?paperid=1v3e0ma01j2104n0d1230ja0f4718733&site=xueshu_se
[10] 陈国宝, 李永振, 赵宪勇, 等. 南海北部海域重要经济鱼类资源声学评估[J]. 中国水产科学, 2005, 12(4): 445-51. doi: 10.3321/j.issn:1005-8737.2005.04.013 [11] 张俊, 陈作志, 陈国宝, 等. 南海鸢乌贼水声学测量和评估相关技术研究[J]. 南方水产科学, 2014, 10(6): 1-11. doi: 10.3969/j.issn.2095-0780.2014.06.001 [12] CHEN G B, LI Y Z, CHEN P M, et al. Measurement of single-fish target strength in the South China Sea[J]. Chin J Oceanol Limnol, 2012, 30(4): 554-562. doi: 10.1007/s00343-012-1218-4
[13] ZHANG J, CHEN P M, CHEN G B, et al. Acoustic target strength measurement of banded grouper[Epinephelus awoara (Temming & Schlegel, 1842)] and threadsial filefish[Stephanolepis cirrhifer (Temming & Schlegel, 1850)] in the South China Sea[J]. J Appl Ichthyol, 2013, 29(6): 1453-1455. doi: 10.1111/jai.12361
[14] ZHAO X Y. In situ target-strength measurement of young hairtail (Trichiurus haumela) in the Yellow Sea[J]. ICES J Mar Sci, 2006, 63(1): 46-51. doi: 10.1016/j.icesjms.2005.07.010
[15] AGLEN A. Random errors of acoustic fish abundance estimates in relation to the survey grid density applied[J]. FAO Fish Rep, 1983(300): 293-297. https://xueshu.baidu.com/usercenter/paper/show?paperid=00f973d591e819257ff00b069413504f&site=xueshu_se&hitarticle=1
[16] 陈文河, 刘学东, 卢伙胜. 南沙群岛海域鱼类群落结构的季节性变化研究[J]. 热带海洋学报, 2010, 29(4): 118-124. doi: 10.11978/j.issn.1009-5470.2010.04.118 [17] 陈真然. 南沙群岛邻近海域渔业资源研究综述[J]. 南海研究与开发, 1991(2): 23-33. https://xueshu.baidu.com/usercenter/paper/show?paperid=7a1331b8a218331e8d9a0d945604bf34&site=xueshu_se&hitarticle=1 [18] 张月平, 章淑珍. 南沙群岛西南陆架海域主要底层经济鱼类的食性[J]. 中国水产科学, 1999, 6(2): 57-60. doi: 10.3321/j.issn:1005-8737.1999.02.014 [19] 陈丕茂. 南沙群岛西南部陆架17种鱼类最佳开捕规格和多鱼种拖网最佳网目尺寸[J]. 中国水产科学, 2003, 10(1): 41-45. http://www.fishscichina.com/zgsckx/article/abstract/4369?st=search [20] 黄梓荣, 陈作志. 南沙群岛西南陆架区印度无齿鲳资源现状[J]. 上海水产大学学报, 2005, 14(4): 472-476. doi: 10.3969/j.issn.1004-7271.2005.04.023 [21] 黄梓荣, 陈作志. 南沙群岛西南陆架区深水金线鱼的资源现状[J]. 湛江海洋大学学报, 2005, 25(1): 35-38. doi: 10.3969/j.issn.1673-9159.2005.01.009 [22] 钟智辉, 陈作志, 刘桂茂. 南沙群岛西南陆架区底拖网主要经济渔获种类组成和数量变动[J]. 中国水产科学, 2005, 12(6): 796-800. http://www.fishscichina.com/zgsckx/article/abstract/3683?st=search [23] 李辉权. 南沙群岛西南部陆架海区主要经济鱼类渔业生物学的初步研究[J]. 中国水产科学, 1996, 3(1): 27-31. http://www.fishscichina.com/zgsckx/article/abstract/3285?st=search [24] MACLENNAN D N, SIMMONDS E J. Fisheries acoustics[M]. London: Chapman and Hall, 1992: 1-325.
[25] SCALABRIN C, MARFIA C, BOUCHER J. How much fish is hidden in the surface and bottom acoustic blind zones?[J]. ICES J Mar Sci, 2009, 66(6): 1355-1363. doi: 10.1093/icesjms/fsp136
[26] MELLO L G S, ROSE G A. The acoustic dead zone: theoretical vs. empirical estimates, and its effect on density measurements of semi-demersal fish[J]. ICES J Mar Sci, 2009, 66(6): 1364-1369. doi: 10.1093/icesjms/fsp099
[27] O'DRISCOLL R L, GAUTHIER S, DEVINE J A. Acoustic estimates of mesopelagic fish: as clear as day and night?[J]. ICES J Mar Sci, 2009, 66(6): 1310-1317. doi: 10.1093/icesjms/fsp015
[28] KOTWICKI S, DE ROBERTIS A, IANELLI J N, et al. Combining bottom trawl and acoustic data to model acoustic dead zone correction and bottom trawl efficiency parameters for semipelagic species[J]. Can J Fish Aquat Sci, 2012, 70(2): 208-219. doi: 10.3724/SP.J.1231.2012.27592
[29] TUŠER M, PRCHALOV M, MRKVI KA T, et al. A simple method to correct the results of acoustic surveys for fish hidden in the dead zone[J]. J Appl Ichthyol, 2013, 29(2): 358-363. doi: 10.1111/jai.12091
[30] PETITGAS P, MASSÉ J, BEILLOIS P, et al. Sampling variance of species identification in fisheries acoustic surveys based on automated procedures associating acoustic images and trawl hauls[J]. ICES J Mar Sci, 2003, 60(3): 437-445. doi: 10.1016/S1054-3139(03)00026-2
[31] O'DRISCOLL R L. Determining species composition in mixed-species marks: an example from the New Zealand hoki (Macruronus novaezelandiae) fishery[J]. ICES J Mar Sci, 2003, 60(3): 609-616. doi: 10.1016/S1054-3139(03)00034-1
[32] J ZA T, RAKOWITZ G, DRAŠTÍK V, et al. Avoidance reactions of fish in the trawl mouth opening in a shallow and turbid lake at night[J]. Fish Res, 2013, 147(5): 154-160. doi: 10.1016/j.fishres.2013.05.008
[33] De ROBERTIS A, HANDEGARD N O. Fish avoidance of research vessels and the efficacy of noise-reduced vessels: a review[J]. ICES J Mar Sci, 2013, 70(1): 34-45. doi: 10.1093/icesjms/fss155
-
期刊类型引用(24)
1. 吕硕,童剑锋,朱振宏,薛铭华,邱悦,李柏萱,刘必林. 基于声学的2023年夏季西北太平洋小型中上层鱼类时空分布. 上海海洋大学学报. 2025(02): 394-402 .  百度学术
百度学术
2. 鲁超,熊敏思,邢晓峰,张正楼,张献娟,宋云鹏,吴祖立,伍玉梅. 2023年冬季宁德核电冷源海域棘头梅童鱼(Collichthys lucidus)资源声学评估. 渔业信息与战略. 2024(01): 39-48 .  百度学术
百度学术
3. 汤勇. 中国渔业资源声学评估研究与进展. 大连海洋大学学报. 2023(02): 185-195 .  百度学术
百度学术
4. 李哲,朱文斌,陈峰,李德伟,刘连为,张洪亮. 近年我国渔业资源声学评估研究进展. 浙江海洋大学学报(自然科学版). 2021(01): 80-85+92 .  百度学术
百度学术
5. 李敏,孔啸兰,许友伟,陈作志. 基于线粒体控制区序列的花斑蛇鲻遗传多态性分析. 热带海洋学报. 2020(04): 42-49 .  百度学术
百度学术
6. 郭禹,章守宇,程晓鹏,林军. 马鞍列岛海域渔业资源声学评估. 水产学报. 2020(10): 1695-1706 .  百度学术
百度学术
7. 王腾,黄洪辉,张鹏,张书飞,吴风霞,刘庆霞,廖秀丽,谢斌. 珠海桂山风电场水域渔业资源声学评估与空间分布. 中国水产科学. 2020(12): 1496-1504 .  百度学术
百度学术
8. 马龙,马治忠,曾现敏,刘大川. 基于海洋声光综合探测技术的海洋牧场应用研究探讨. 海洋技术学报. 2020(06): 89-98 .  百度学术
百度学术
9. 陶雅晋,易木荣,李波,冯波,卢伙胜,颜云榕. 基于渔港抽样调查南海不同捕捞方式CPUE比较分析. 渔业科学进展. 2019(03): 1-10 .  百度学术
百度学术
10. 李敏,黄梓荣,许友伟,陈作志. 基于线粒体cytb序列的花斑蛇鲻种群遗传结构研究. 南方水产科学. 2019(06): 41-48 .  本站查看
本站查看
11. 张然,林龙山,李渊,宋普庆,陈永俊,张静. 南沙群岛西南部和北部湾口海域鲨鱼的种类组成和数量分布. 海洋渔业. 2018(01): 27-37 .  百度学术
百度学术
12. 曾雷,陈国宝,于杰. 南澳岛海域渔业资源声学评估与空间分布. 南方水产科学. 2018(02): 26-35 .  本站查看
本站查看
13. 郭禹,李纯厚,陈国宝. 南澳白沙湾海藻养殖区内外渔业资源声学评估. 水产学报. 2018(02): 226-235 .  百度学术
百度学术
14. 李斌,陈国宝,于杰,王东旭,郭禹,王志超. 海南陵水湾口海域不同季节鱼类资源声学探查. 水产学报. 2018(04): 544-556 .  百度学术
百度学术
15. 陆化杰,童玉和,刘维,刘凯,董增祥,程馨,陈新军. 厄尔尼诺年春季中国南海中沙群岛海域鸢乌贼的渔业生物学特性. 水产学报. 2018(06): 912-921 .  百度学术
百度学术
16. 丁苏阳,于壮状,林湘宁,张哲原,汪致洵,李正天,陈冲,陈哲,方家琨. 基于概率图像灰度比对算法的远洋海岛可再生能源机组配置方案优选策略研究. 中国电机工程学报. 2018(19): 5653-5667+5923 .  百度学术
百度学术
17. 王欢欢,毕福洋,曹敏,汤勇. 獐子岛海洋牧场秋季渔业资源声学调查与评估. 大连海洋大学学报. 2018(06): 802-807 .  百度学术
百度学术
18. 王东旭,陈国宝,汤勇,李斌,王志超. 大亚湾南部海域渔业资源水声学评估. 安徽农业科学. 2017(06): 95-98+159 .  百度学术
百度学术
19. 于鑫,单秀娟,李忠义,朱仁,陈云龙,金显仕. 渤海底拖网主要渔业生物类别时空分布的初步研究. 南方水产科学. 2017(02): 9-17 .  本站查看
本站查看
20. 武智,李新辉,李捷,陈方灿,朱书礼. 红水河岩滩水库鱼类资源声学评估. 南方水产科学. 2017(03): 20-25 .  本站查看
本站查看
21. 王栋,司纪锋. 无线分布式渔业资源声学监测系统. 计算机工程与设计. 2017(07): 1951-1955 .  百度学术
百度学术
22. 孙铭帅,陈作志,蔡研聪,张俊,孙志伟. 空间插值法在北部湾渔业资源密度评估中的应用. 中国水产科学. 2017(04): 853-861 .  百度学术
百度学术
23. 张俊,张鹏,陈作志,陈国宝,张魁,许友伟,孙铭帅. 南海外海鲹科鱼类资源量及其分布. 南方水产科学. 2016(04): 38-48 .  本站查看
本站查看
24. 李斌,陈国宝,郭禹,陈作志,张俊,王东旭. 南海中部海域渔业资源时空分布和资源量的水声学评估. 南方水产科学. 2016(04): 28-37 .  本站查看
本站查看
其他类型引用(6)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
