Effect of desiccation on antioxidant enzyme activities of kuruma (Marsupenaeus japonicus)
-
摘要:
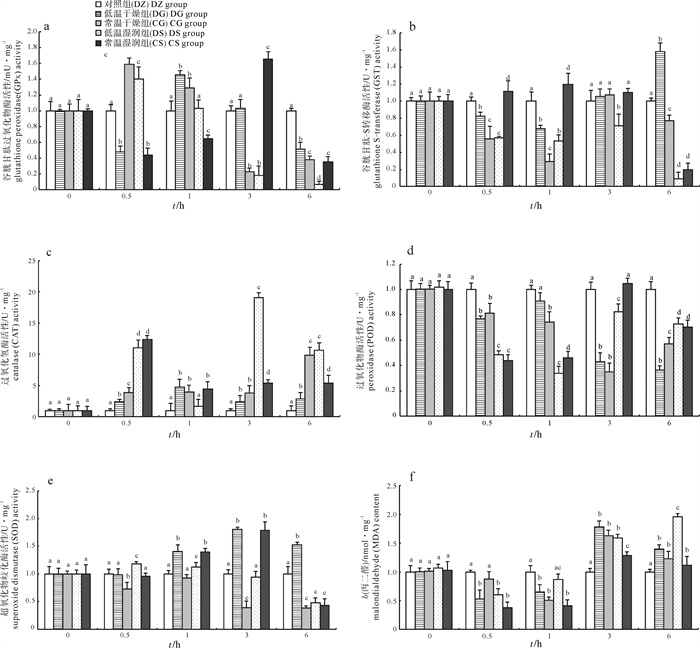
研究了干露胁迫对日本囊对虾(Marsupenaeus japonicus)抗氧化酶活性的影响。结果显示,与对照组相比,4个实验组的对虾均于干露胁迫5 h后出现大量死亡,而低温湿润组对虾成活率高于其他实验组;随干露胁迫时间的增加,4个实验组对虾肝胰腺中谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性呈现先升高后降低的趋势,但低温干燥(DG)和常温湿润(CS)组GPx活性在胁迫早期有显著降低现象(P<0.05);谷胱甘肽-S转移酶(GST)和过氧化物酶(POD)活性显著降低(P<0.05);丙二醛(MDA)含量呈现先降低后升高的趋势。结果表明,干露胁迫显著诱导日本囊对虾氧化应激反应,GPx、CAT、SOD和MDA可作为其应答干露胁迫反应的监测指标。适量的低温湿润条件可提高对虾干法运输的成活率,该条件下体质量约10 g的日本囊对虾在干露胁迫10 h内具有较高的成活率。
Abstract:We investgated the effect of desiccation on antioxidant enzyme activities of kuruma shrimp (Marsupenaeus japonicus). The results show that many shrimps died in the four treatment groups in 5 h after desiccation, and wet and low temperature improved the survival rate of shrimps significantly. Compared with the control, the activities of glutathione peroxidase (GPx), catalase (CAT) and superoxide dismutase (SOD) in hepatopancreas of the four treatment groups increased firstly and then decreased gradually, but GPx activities in the low temperature and dry (DG) and the normal temperature and wet (CS) groups decreased significantly at the beginning of the experiment (P < 0.05). The activities of glutathione S-transferase (GST) and peroxidase (POD) decreased significantly (P < 0.05). The contents of malondialdehyde (MDA) decreased firstly and then increased gradually. These results indicate that the response to oxidative stress of M.japonicus could be induced by desiccation. GPx, CAT, SOD and MDA were all sensitive to desiccation and could be regarded as monitor indices for desiccation in M.japonicus. It is beneficial to keep appropriate low and wet temperature during the transportation of M.japonicus without water, and the shrimps of average body weight of about 10 g would have a higher survival rate under such condition after 10-hour desiccation.
-
Keywords:
- Marsupenaeus japonicus /
- desiccation /
- antioxidant enzyme /
- survival
-
随着水产品产量的上升,水产品质量安全问题也不断出现[1]。其中水产品中的药物残留一直是人们担忧的问题。中国规定粘杆菌素在肌肉中的最大残留量为150 μg · kg-1[2]。粘杆菌素曾经因其有一定的毒性而被停止使用[3],但后来发现其对某些多重耐药性的菌株有很好的疗效又开始研究使用[4]。粘杆菌素又称多粘菌素E、粘菌素、抗敌素、克利斯汀等,产生于多粘芽孢杆菌(Paenibacillus polymyxa)抗敌素变株,是一种锁环状碱性多肽类抗生素[5-6]。它至少含有30多种不同成分,主要成分为粘杆菌素A(多粘菌素E1)和粘杆菌素B(多粘菌素E2)[7]。粘杆菌素的基本结构为十肽,由7个环肽和末端的三肽组成,末端的三肽由酰胺键与脂肪酸连接在一起[8]。粘杆菌素对大多数革兰氏阴性菌有较强的抑制作用,常用作动物饲料添加剂[9-11],水产上尚未见有其使用的报道。但是如果使用得不科学,将导致药物在水产品中残留情况严重,对动物性食品安全带来严重隐患,因此需要有效的残留检测方法。粘杆菌素的残留一般采用仪器检测法[12-13],但该药物成分复杂,需检测的标示物过多,仪器检测法目前只是检测其中的粘杆菌素A和粘杆菌素B,由于检测过程复杂和成本高,其他成分未作检测标示物。因此,该研究利用微生物法准确检测药物全部组分,首次在水产品可食性组织中建立了粘杆菌素残留测定的微生物方法。该方法能有效监测水产品可食性组织中粘杆菌素的残留量,对于保证中国水产品中粘杆菌素残留达到安全限量有重要意义。
1. 材料与方法
1.1 仪器与试剂
恒温培养箱(DN0-9162BS-Ⅲ,新苗医疗器械公司);超净工作台(Type A2,LABONCO);压力蒸汽灭菌锅(BL-50A,博讯实业有限公司);高速冷冻离心机(himac CR-21);氮吹仪(KD2002,上海舜宇恒平科学仪器有限公司);旋涡混合器(HQ-60-Ⅱ,北方同正);超声波清洗器(SK2210HP,上海科导);高效液相色谱-串联质谱仪(Thermo TSQ Quantum Acess MAX);Oasis HLB净化柱(Waters)。不锈钢牛津杯[高(10.0±0.1)mm,外径(8.0±0.1)mm,内径(6.0±0.1)mm];游标卡尺(精确度0.02 mm);一次性培养皿(15 mm×90 mm)。
粘杆菌素标准品(0.1 g,质量分数80.6%,Dr. Ehrenstorfera,主要成分为多粘菌素E1、E2、E3、E1-1、E1-7),其他药物硫酸链霉素、盐酸土霉素、恩诺沙星、磺胺二甲嘧啶、氨卡青霉素、替米考星、乙酰甲喹均为标准品,醇、甲酸、正己烷均为分析纯、蒸馏水,1% pH 6.0磷酸盐缓冲液(PBS)为磷酸氢二钾2 g与磷酸二氢钾8 g,加水定容至1 000 mL,灭菌。
空白水产样品,草鱼(Ctenopharyngodon idellus)、斑节对虾(Penaeus monodon)、中华鳖(Pelodiscus sinensis)、日本鳗鲡(Anguilla japonica)和蟹(Brachyura)均购自本地市场,实验室暂养4周,各样品取其肌肉搅碎,-20 ℃保存,杯碟法检测无抑菌圈。
1.2 细菌与培养基
气管炎鲍特氏菌(Bordetella bronchiseptica)1.248购自中国普通微生物菌种保藏中心,抗生素检定培养基Ⅵ号、LB琼脂培养基、LB培养基均购自海博生物技术有限公司。
1.3 实验方法
1.3.1 标准溶液配制与空白组织液制备
粘杆菌素标准溶液的配制,准确称取0.010 0 g(精确至0.000 1 g)粘杆菌素标准品,用PBS溶解并定容至100 mL,制得100 mg · L-1的标准储备液,4 ℃避光储存,有效期1个月。根据需要稀释成不同质量浓度的标准工作液,即用即配。其他药物配制方法同粘杆菌素。称取10 g匀浆好的空白样品于50 mL离心管中,加20 mL PBS,置于振荡器中中速振荡30 min,超声10 min,8 000 r · min-1离心5 min,分离的上清液用1 mol · L-1NaOH调节pH至6.0后,用0.22 μm针头式滤器除菌备用。
1.3.2 菌液和检定平板的制备
选用支气管炎鲍特氏菌为检测菌种。将灭过菌的LB培养基加入菌种安瓿瓶,溶解后,取少量到LB培养基中,混匀,(36±1)℃培养24 h后转接至斜面培养基培养约30 h,挑取少量菌落到LB培养基中再培养24 h,之后接种于LB琼脂平皿中培养24 h,用生理盐水洗下,调整到1×108 CFU · mL-1(麦氏浊度1.0)备用。4 ℃保存不超过1周。冷却灭过菌的抗生素检定培养基Ⅵ号至50~55 ℃,加适量检测菌液,混匀,取5 mL至培养皿内,凝固。用1.2 μg · mL-1粘杆菌素标准工作液预测试该菌液浓度的平板,如果培养后所呈现的抑菌圈直径大于10 mm,则该菌液浓度下的平板可使用,否则须重新调整菌液浓度,再制成能有效检定药物的平板。
1.3.3 标准曲线的绘制
吸取一定量粘杆菌素标准储备液,用PBS稀释成0.4 μg · mL-1、0.8 μg · mL-1、1.2 μg · mL-1、1.6 μg · mL-1、2.0 μg ·mL-1和2.4 μg · mL-1系列质量浓度,制作标准曲线。同时用空白组织提取液稀释粘杆菌素标准储备液,得到0.4 μg · mL-1、0.8 μg · mL-1、1.2 μg ·mL-1、1.6 μg · mL-1、2.0 μg · mL-1和2.4 μg · mL-1系列质量浓度制作粘杆菌素在各基质中的标准曲线,参考质量浓度溶液为1.2 μg · mL-1PBS的稀释液。以上稀释液均须当日配制。放置6个牛津杯于检定平板上,间隔加满参考质量浓度溶液和标准质量浓度溶液。4 ℃放置1 h后于(36±1)℃培养约30 h,精确测量各药物所产生的抑菌圈直径(精确到0.02 mm),最后用全部参考质量浓度抑菌圈直径的平均值减去各平板参考质量浓度抑菌圈直径平均值的差值作为各自平板的校正值,校正其他标准质量浓度抑菌圈直径的平均值。
1.3.4 样品前处理
准确称取匀浆好的肌肉试样4.00 g,加入提取液(甲醇和0.1%甲酸水溶液体积比3:7)10 mL,涡旋30 s,超声5 min,60 ℃加热5 min,8 000 r · min-1离心5 min,取上清液于另一离心管。重复提取一次,合并上清液,加入15 mL甲醇饱和正己烷,涡旋30 s,6 000 r · min-1离心5 min,弃去上层,重复一次。所得样液过Oasis HLB净化柱(小柱先用甲醇和水各6 mL预洗活化),用10 mL水洗涤,弃去流出液。再用3 mL甲醇洗脱,收集洗脱液于40 ℃氮气吹干。加入1 mL PBS复溶,过0.22 μm滤膜,用微生物法检测。浓缩后样液浓度为组织浓度的4倍。
1.3.5 杯碟法测定
定量检测,置6个牛津杯于检测平板内,间隔加入样液和1.2 μg · mL-1粘杆菌素标准液,(36±1)℃培养(30±2)h;定性检测,置4个牛津杯于检测平板内,对角加样液,余下2个牛津杯分别加0.8 μg · mL-1和1.2 μg · mL-1粘杆菌素标准液。每个样品3个平行。培养后测定抑菌圈大小(抑菌圈直径必须大于10 mm),参考标准曲线,计算药物质量浓度。
1.3.6 粘杆菌素的特异性测定
根据各类药物对细菌的不同抑菌效果(抑菌圈直径大于10 mm则判断为有抑菌效果)来区分粘杆菌素。选择药物为多肽类中的粘杆菌素,氨基糖苷类的硫酸链霉素,四环素类的盐酸土霉素,喹诺酮类的恩诺沙星,磺胺类的磺胺二甲嘧啶,β-内酰胺类的氨卡青霉素,大环内脂类的替米考星和喹噁啉类的乙酰甲喹,按照粘杆菌素的提取和检测方法,测定一定浓度下这些药物对支气管炎鲍特氏菌的抑菌效果。
1.3.7 粘杆菌素的仪器验证方法(色谱联用质谱法)
样品前处理方法同上,仪器的色谱检测条件:色谱柱为Hypersil Gold C18柱(2.0 mm×150 mm,5 μm);柱温20 ℃;流速200 μL · min-1;进样量为15 μL。流动相梯度洗脱条件:A相为0.1%甲酸水溶液,B相为0.1%甲酸乙腈;洗脱程序为90% A相0~4 min,25% A相4~10 min,90% A相10~12 min。质谱条件为电喷雾(ESI)离子源,正离子扫描。检测方式采用选择反应监测(SRM)模式,电喷雾电压4 500 V,加热毛细管温度为300 ℃,鞘气(氮气)压力241.3 kPa,辅气(氮气)压力13.8 kPa;碰撞气为氩气,定性离子对、定量离子对、碰撞气能量见表 1。
表 1 粘杆菌素的质谱参数Table 1. Parameters of MS for colistin母离子(m) quantitative ion 子离子(z) quantitative ion 碰撞能/(E/V) collision energy 585.6 576.83* 18 101.13 29 241.05* 20 578.6 569.59 15 101.15 28 227.08 25 528.55 16 注:*.定性离子
Note: *.qualitative iron2. 结果
2.1 粘杆菌素的标准曲线
以抑菌圈直径为横坐标,粘杆菌素稀释液质量浓度的对数为纵坐标,得到粘杆菌素在各基质中的标准曲线和相关系数。其中粘杆菌素在0.4~2.4 μg · mL-1,标准曲线的线性关系良好,R2均大于0.990 0,图 1为粘杆菌素在各基质中的标准曲线。
2.2 粘杆菌素的最低检测限
粘杆菌素的最低检测限是以能使检测细菌产生10 mm以上的抑菌圈的质量分数,并且标准液参考质量浓度抑菌圈清晰可见。粘杆菌素在不同肌肉组织中添加质量分数为0.050 μg · g-1、0.075 μg ·g-1、0.100 μg · g-1和0.125 μg · g-1下的抑菌圈数据结果见表 2。结果表明,草鱼和对虾肌肉中粘杆菌素最低检测限为100 μg · kg-1,鳖和鳗鲡肌肉中粘杆菌素最低检测限为75 μg · kg-1,蟹肌肉中粘杆菌素最低检测限为125 μg · kg-1。
表 2 各肌肉组织添加粘杆菌素不同粘杆菌素的抑菌圈大小(n=3)Table 2. Bacteriostatic ring size of different colistins added in muscle tissues of various aquatic samplesmm 添加质量分数/μg·g-1
spiked level草鱼
grass carp对虾
prawn鳖
turtle鳗鲡
eel蟹
crab0.050 ND ND ND ND ND 0.075 ND ND 10.02±0.97 10.87±1.23 ND 0.100 10.25±0.59 10.14±1.17 11.06±1.21 12.53±0.57 ND 0.125 11.25±1.57 12.04±1.88 12.06±1.19 13.79±1.01 10.26±0.74 注:ND指无抑菌圈,表 4同此
Note:ND indicates no detected. The same case in the Tab. 4.2.3 粘杆菌素的的添加回收率及精密度
粘杆菌素在不同肌肉组织中的回收率和变异系数见表 3。粘杆菌素在不同水产品肌肉组织添加质量分数为0.20 μg · g-1、0.40 μg · g-1和0.60 μg · g-1时,药物在各个组织的回收率随着药物浓度的增加而有所提高,总体平均回收率为70.23%~97.45%,变异系数为1.97%~14.54%,符合该方法检测验证回收率70%~120%和变异系数小于15%的要求。
表 3 粘杆菌素在各肌肉组织中的添加回收率和变异系数(n=5)Table 3. Average recovery and RSD of colistins added in muscle tissues of each group样品名称
sample添加质量分数/μg·g-1
spiked level平均回收率/%
average recovery变异系数/% RSD 日内within-day 日间day to day 草鱼肌肉grass carp muscle 0.20 80.84±7.59 6.12 9.39 0.40 84.15±6.80 4.38 8.08 0.60 93.39±6.08 4.33 6.51 对虾肌肉prawn muscle 0.20 74.81±8.37 9.34 11.19 0.40 85.73±8.18 8.44 9.54 0.60 90.55±4.87 3.76 5.38 鳖肌肉turtle muscle 0.20 77.23±7.92 6.36 10.26 0.40 82.86±11.61 8.42 14.01 0.60 89.79±8.94 5.23 9.96 鳗鲡肌肉eel muscle 0.20 70.59±8.93 6.23 13.65 0.40 86.21±7.09 5.87 8.22 0.60 91.58±4.87 3.22 5.32 蟹肌肉crab muscle 0.20 72.64±6.99 5.91 9.62 0.40 79.26±5.85 5.43 7.38 0.60 89.23±5.96 3.76 6.68 2.4 粘杆菌素的特异性检测结果
测定不同类别药物对支气管炎鲍特氏菌抑菌效果的结果见表 4。结果表明,不同类别的药物对检测细菌敏感性不同,药物质量浓度为0.4~1.0 μg · mL-1,支气管炎鲍特氏菌只对粘杆菌素有抑菌圈,对其他类药物无明显抑菌圈(抑菌圈直径小于10 mm)。
表 4 不同药物对支气管炎鲍特氏菌的抑菌圈大小(n=3)Table 4. Bacteriostatic ring size of different drugs for B.bronchisepticamm 药物类别
drug药物名称
drug′s name质量浓度/μg·mL-1
concentration支气管炎鲍特氏菌
B.bronchiseptica多肽类Methylmercadone 粘杆菌素Colistin 0.4~2.4 10~23 氨基糖苷类Aminoglycosides 硫酸链霉素Streptomycin sulfate 1~10 ND 四环素类Tetracyclines 盐酸土霉素Oxytetracycline hydrochloride 1~10 10~28 喹诺酮类Quinolones 恩诺沙星Enrofloxacin 1~10 10~31 磺胺类Sulfonamides 磺胺二甲嘧啶Sulfadimidine 1~10 10~19 β-内酰胺类Monobactams 氨卡青霉素Ampicillin 1~10 ND 大环内脂类Macrolide 替米考星Tilmicosin 1~10 ND 噁喹啉类Evil quinoline 乙酰甲喹Mequindox 1~10 10~21 2.5 色谱串联质谱检测结果
粘杆菌素的色谱串联质谱的加标结果见图 2。结果表明,粘杆菌素的定性离子m/z为585.6/576.83和578.6/241.05,再根据离子的保留时间为5.60 min和5.56 min可以确定检测物为粘杆菌素A和粘杆菌素B,检测限为0.05 μg · mL-1。
3. 讨论
药物残留检测法经过传统简单到复杂仪器的方法变化,现代仪器检测方法提高了药物残留的检测水平,满足了各种食品的安全检测。但是每种检测方法都有其局限性,适合的方法才是最佳的方法。微生物检测法是一种经典的药物残留检测方法[14-15],欧盟和美国早就把微生物检测法制定成了行业标准方法和官方标准方法[16-17]。粘杆菌素残留检测选择传统的微生物法主要是因为该类药物至少含有30种成分,成分复杂,需检测的标示物过多。中国规定粘杆菌素在肌肉中的最大残留量为150 μg · kg-1[2]。而目前,在液相串联质谱检测研究中虽然可以检测到粘杆菌素的全部组分,但是由于检测的复杂性,主要检测其中的粘杆菌素A和粘杆菌素B[18-19]。这样在仪器的检测中只确定了该药物的某一种或2种成分的质量分数,如果把单一药物成分质量分数当作所有成分的质量分数,就人为提高了药物的最高残留限量标准,不符合检测结果要求。而微生物法可以检测到药物的所有成分,能准确检测药物残留的总量,符合检测要求。除此之外,微生物检测所需的设备条件简单,检测成本低,适用于生产上的大批样检测。作为前期的筛选和基本检测方法,粘杆菌素残留的检测应选择微生物方法。文章首次在水产品残留检测中使用微生物法检测粘杆菌素的残留,对今后水产品中其他药物的检测及方法的选择以及商品化的微生物检测试剂盒研发具有一定的指导意义。
影响微生物法检测的因素有许多,其中最关键的在于找到合适的检测菌种。研究发现支气管炎鲍特氏菌对粘杆菌素最敏感,与药典中抗生素微生物检定法中粘杆菌素的效价测定检测用菌一致[20]。该研究发现,培养基含盐量的高低可以影响抑菌圈的清晰度。一般盐度适量提高,可以使抑菌圈更清晰,与宋杰等[21]在研究牛奶中氯霉素的检测法时发现葡萄糖可以使检测的抑菌环更清晰相类似。研究比较发现,单层培养基培养的抑菌圈要大于双层培养,双层培养不利于培养基的培养面的平整,对药物浓度的渗透有严重影响,单层有利于降低药物的检测限[22-23]。
检测方法的前处理也很关键,微生物方法对药物的检测低限较仪器方法要高,一般很难达到规定的药物检测残留限量,但是该法对药物进行了浓缩,最终满足检测要求。动物样品中粘杆菌素残留的提取溶剂很多,如甲醇/甲酸[24]、乙腈/三氯乙酸[25]、乙酸乙酯[26]。该研究比较上述某些提取溶剂的提取效果,发现甲醇/甲酸水提取效果较好,且最适体积比为3 : 7。提取后经正己烷脱脂,可去除大部分杂质,浓缩处理中研究了旋蒸、氮吹和固相萃取法后氮吹,发现前2种方法由于净化不彻底,导致水和杂质未除尽,蒸发浓缩耗时都较长,而使用固相萃取就经过了再次净化,之后氮吹浓缩,减少了处理时间,大大提高了效率,最后药物复溶过0.22 μm滤膜,终试液澄清,抑菌圈清晰。
分析回收率数据发现,药物在各个组织的回收率随着药物浓度的增加而提高,总体平均回收率为70.23% ~97.45%,变异系数为1.97% ~14.54%,符合回收率70%~120%和变异系数小于15%的要求。比较仪器分析检测的回收率结果,如梁雪琪等[27]使用液相色谱-串联质谱法测定牛奶中粘杆菌素的回收率为71.5%~98.1%,相对标准偏差为3.8%~9.5%;刘佳佳等[28]使用液相色谱-串联质谱法测定牛奶中多肽类的回收率为75.1%~120.1%,相对标准偏差小于15.7%,与微生物检测法的回收率差别不大,说明微生物检测方法回收率同样较好。
该微生物检测方法较仪器方法的缺点是不能准确定性最终药物类别,专一性差[29],微生物方法通过不同浓度的药物抑菌圈大小比对标准曲线结果确定药物类别具有一定的假阳性结果[30]。但是文中在对粘杆菌素的特异性试验中发现,该法在低浓度的粘杆菌素下具有一定的专一性。该研究因此考虑了仪器检测的结果,参照了罗方方[19]的色谱联用质谱法对粘杆菌素的检测方法,通过比对质谱标准结果图来进一步确定药物类别。微生物检测为主,质谱检测为辅,2种方法相互印证[31]。最终该微生物方法可以适用于水产品粘杆菌素残留的初筛,如果杯碟法检测结果符合粘杆菌素标准曲线(同一样品不同抑菌圈大小结果均在曲线上),则初步判断残留物为粘杆菌素,最后质谱法确证;如果结果不符,则可能残留物不是粘杆菌素或同时有其他药物干扰,需进一步使用仪器方法区别检测。
4. 结论
研究显示,粘杆菌素经过一定的前处理方法处理后,采用支气管炎鲍特氏菌检测,在各肌肉组织空白提取液0.4~2.4 μg · mL-1内,药物浓度对数与抑菌圈直径的线性关系良好(R2>0.990 0),平均回收率为70.59%~93.39%,变异系数小于15%。草鱼和对虾肌肉中粘杆菌素最低检测限为100 μg · kg-1,鳖和鳗鲡肌肉中粘杆菌素最低检测限为75 μg · kg-1,蟹肌肉中粘杆菌素最低检测限为125 μg · kg-1。综上,该法对5种水产样品的最低检测限为125 μg · kg-1,低于中国农业部颁布的残留限量的国家标准(150 μg · kg-1)。因此,该研究建立的检测水产品肌肉中粘杆菌素残留的微生物初筛方法是可行的,研究中使用的微生物检测法还适合制成广泛应用的检测试剂盒。
-
表 1 干露胁迫下日本囊对虾的累积成活率
Table 1 Cumulative survival of M.japonicus after desiccation
时间/htime 累积成活率/% cumulative survival 对照组(DZ)DZ group 低温干燥(DG)DG group 常温干燥(CG)CG group 低温湿润(DS)DS group 常温湿润(CS)CS group 1 100.0 100.0 100.0 100.0 100.0 2 100.0a 97.5±0.8b 97.5±1.1b 100.0a 100.0a 3 100.0a 92.3±1.1b 87.5±0.8c 98.5±0.4d 92.5±0.7b 4 100.0a 87.5±0.5b 82.5±0.6c 95.0±1.5d 75.0±0.9e 5 100.0a 75.0±1.8b 45.0±1.2c 75.0±0.8b 62.5±1.0d 6 100.0a 52.5±0.9b 25.0±1.5c 70.0±2.3d 57.5±1.3e 8 100.0a 42.5±0.6b - 55.3±1.9c 37.5±0.8d 10 100.0a 10.0±1.2b - 25.0±1.2c 12.5±2.1b 注:与对照组相比,同一时间内不同字母表示组间差异显著(P < 0.05),相同字母表示组间差异不显著(P>0.05);图 1同此
Note:Compared with the control,different letters indicate significant difference (P < 0.05),while the same letters indicate no significant difference
(P>0.05) in the same observed period. The same case in the Figure 1. -
[1] 谭树华, 王桂忠, 李少菁. 中国沿海日本囊对虾线粒体16S rRNA基因序列变异及遗传分化[J]. 生态学报, 2009, 29(12): 6805-6810. doi: 10.3321/j.issn:1000-0933.2009.12.059 [2] 蔡晓鹏, 游欣欣, 曾凡荣, 等. 中国沿海日本囊对虾5个地理群体间形态差异比较分析[J]. 中国水产科学, 2010, 17(3): 478-486. https://kns.cnki.net/kcms2/article/abstract?v=BkYFcxcfasCvJu1yDLi_Q3iWYCUO8f9MQvc84Ks8sySUg44HG9W-SfAlBUw7YcCPtOsvtAtAe3OYWFLNGXiIQwszbkEfsQbPRIBL9kyf9o_BhnEoWW0N0zLdUz2Sdivy4wWlcXDKsxWK2cmSE3CWr35PSXjbYf0vjNDTyr6h8zTx0wBhHF5C0KIwEYFzmM1_&uniplatform=NZKPT&language=CHS [3] 庄志猛, 孔杰, 石拓, 等. 日本对虾野生和养殖群体遗传多样性的RAPD分析[J]. 自然科学进展, 2011, 11(3): 250-255. https://kns.cnki.net/kcms2/article/abstract?v=BkYFcxcfasA7N4Wv7FLwX65lqfVxcGIIJdtDf2NTD18lcsRmI6AYLfgKv7nPDCnAcL2T4l78OsO9k1U50pvOI5Mg2XKG4CI-OaR4W0Qe1SsTHZkf33RKqKIusm3kkjnFdmV7tt1o1w3IV-1kaBHLciMqsLpOMSOmg3AIgwyiLfBH8sfQb50z_H25KJB5Omnp&uniplatform=NZKPT&language=CHS [4] 姜令绪, 刘群, 王仁杰, 等. 三疣梭子蟹(Portunus trituberculatus)幼体不同干露温度下死亡率的研究[J]. 海洋与湖沼, 2012, 43(1): 127-131. https://kns.cnki.net/kcms2/article/abstract?v=BkYFcxcfasCxVmjqKs7isBqtfdQfQqMj_cyZ2-bWxkD9CMYzSX0fRB35yhEk3bLkcJGT5SQRpV8OdSh2nGAwitcwO1yNA-BVoPt93QoOqV-whJpVC8koCl0GOwrv0tSrsx1-ufrDNE1lVdFMjvXbSp-SsRuLvA3WeWjPmZIg9P2qDwGmQuA9WNr80mw52kE7&uniplatform=NZKPT&language=CHS [5] CARLSON B E, ROWE M P. Temperature and desiccation effects on the antipredator behavior of Centruroides vittatus (Scorpiones: Buthidae)[J]. J Arachnol, 2009, 37, 321-330. doi: 10.1636/Hi09-06.1
[6] HAUPT P, BROUWER S, BRANCH G A, et al. Effects of exposure to air on the escape behaviour and haemolymph chemistry of the South African Cape lobster, Jasus lalandii[J]. Fish Res, 2006, 81(2/3): 210-218. doi: 10.1016/j.fishres.2006.07.004
[7] ALLEN B J, RODGERS B, TUAN Y H, et al. Size-dependent temperature and desiccation constraints on performance capacity: implications for sexual selection in a fiddler crab[J]. J Exp Mar Biol Ecol, 2012, 438: 93-99. doi: 10.1016/j.jembe.2012.09.009
[8] 姜娜, 王芳, 路允良, 等. 干露对三疣梭子蟹抗氧化和应激能力的影响[J]. 水产学报, 2014, 38(12): 1996-2004. doi: 10.3724/SP.J.1231.2014.49441 [9] SILBIGER N, MUNGUIA P. Carapace color change in Uca pugilator as a response to temperature[J]. J Exp Mar Biol Ecol, 2008, 355(1): 41-46. doi: 10.1016/j.jembe.2007.11.014
[10] 段亚飞, 张家松, 董宏标, 等. 副溶血弧菌对斑节对虾非特异性免疫酶活性的影响[J]. 水产学报, 2014, 38(9): 1557-1564. doi: 10.3724/SP.J.1231.2014.49254 [11] 亢玉静, 郎明远, 赵文. 水生生物体内抗氧化酶及其影响因素研究进展[J]. 微生物学杂志, 2013, 33(3): 75-80. https://kns.cnki.net/kcms2/article/abstract?v=BkYFcxcfasB1llvmeSXgOvZilE85vVYVLTi09yzY298uNQ_HCpwowUbVx1moFzZZb_qU3Q7Wcg6XFgOnvhPFmixbnSuDFywxOJmTyir6iiw5Dw9aNMBekFk5t6quZ3L5-309Kxqjymc3U2lS5Gq6anFjGs8JjHWaVAisxsmh-16pQWtgon2QNA7U2NYcZhc2&uniplatform=NZKPT&language=CHS [12] 陈百尧, 伏光辉, 安健, 等. 干露下三疣梭子蟹家系间血淋巴免疫因子活性差异分析[J]. 上海海洋大学学报, 2013, 22(2): 194-199. https://kns.cnki.net/kcms2/article/abstract?v=BkYFcxcfasDE-iLcKAUV3OhL9Ekr8P2ycIJQ6Zh1lyIW9AhsbtfpZQzKGJFkl2vDP9SJ0_rglplRWCZnYzcOvhHmh3I2B2Ue-_NVJ0nJUyAlG-bCpNoTnYUR7HgK66wKlGPiwI_w2thEaIGRFWibHSKQ2n7TkNxB9zvaNronqCjDUbgxg3hc_LqQEsE0YEM2&uniplatform=NZKPT&language=CHS [13] 高焕, 阎斌伦, 陈百尧, 等. 干露温度对三疣梭子蟹非特异免疫指标的影响[J]. 水产科学, 2013, 32(5): 280-283. doi: 10.3969/j.issn.1003-1111.2013.05.006 [14] 王琦, 李健, 李吉涛, 等. 干露胁迫对脊尾白虾(Exopalaemon carinicauda)HSP70和ferritin基因表达的影响[J]. 海洋与湖沼, 2013, 44(2): 409-414. https://kns.cnki.net/kcms2/article/abstract?v=BkYFcxcfasA87cVjqZtt3Ya6RHA2Zi5SkUezYAc9lNt4B3f_x_cex8AIgda7dA_yQ4gTDo_MBF7XRffzzyazL7vzrFK1tD53N2lLH6leVR9e25GhiPobEWwZtCvzdn9bcPuVKlCrln4JrNG831lDd8-oLn5UVa46aw2UDvAT_mlJKG1QzWMblD4rcmqZujjQ&uniplatform=NZKPT&language=CHS [15] 潘英, 陈锋华, 李斌, 等. 管角螺对几种环境因子的耐受性试验[J]. 水产科学, 2008, 27(11): 567-569. doi: 10.16378/j.cnki.1003-1111.2008.11.006 [16] OMORI K, IRAWAN B, KIKUTANI Y. Studies on the salinity and desiccation tolerances of Helice tridens and Helice japonica (Decapoda: Grapsidae)[J]. Hydrobiologia, 1998, 386(1): 27-36. doi: 10.1023/A:1003461911201
[17] 田相利, 何瑞鹏, 钱圆, 等. 干露胁迫对刺参体壁非特异性免疫的影响[J]. 河北渔业, 2014(7): 21-35. doi: 10.3969/j.issn.1004-6755.2014.07.006 [18] 平洪领, 李玉全. 干露对天津厚蟹水分代谢和死亡率的影响[J]. 湖北农业科学, 2014, 53(18): 4377-4380. doi: 10.14088/j.cnki.issn0439-8114.2014.18.105 [19] 张义浩, 梅文嚷, 王春琳, 等. 活虾蛄离水干露试验[J]. 浙江水产学院学报, 1996, 15(1): 43-45. https://kns.cnki.net/kcms2/article/abstract?v=BkYFcxcfasBz1cFbWzXnM4XBv6-JNQ83UDYGJq9DFsI7VpI6Bv4c-bWru1WiaKdGGy8wTPA2KULjxT-Sc7c7qsGEQMy5n1QUMf3wt7Q4egpbiVvol8I01Q1cErOI9VcjFmlcL7QRUeMSX6vtgsDXR_YidZntjZ8uCIrpWdtLcfz983yvKTKqKuAZqb_N0807&uniplatform=NZKPT&language=CHS [20] DUAN Y F, LIU P, LI J T, et al. Expression profiles of selenium dependent glutathione peroxidase and glutathione S-transferase from Exopalaemon carinicauda in response to Vibrio anguillarum and WSSV challenge[J]. Fish Shellfish Immunol, 2013, 35(3): 661-670. doi: 10.1016/j.fsi.2013.05.016
[21] 时少坤, 王瑞旋, 王江勇, 等. 盐度胁迫对近江牡蛎几种免疫因子的影响[J]. 南方水产科学, 2013, 9(3): 26-30. doi: 10.3969/j.issn.2095-0780.2013.03.005 [22] 王芸, 李正, 李健, 等. 绿原酸对凡纳滨对虾抗氧化系统及抗低盐度胁迫的影响[J]. 生态学报, 2013, 33(18): 5704-5713. doi: 10.5846/stxb201304160720 [23] 张涛, 黄建华, 温为庚, 等. WSSV+斑节对虾的血清免疫相关酶对人工感染WSSV粗提液的反应[J]. 南方水产科学, 2013, 9(1): 35-42. doi: 10.3969/j.issn.2095-0780.2013.01.006 [24] 彭士明, 施兆鸿, 高权新, 等. 增加饲料中VC质量分数对银鲳血清溶菌酶活性及组织抗氧化能力的影响[J]. 南方水产科学, 2013, 9(4): 16-21. doi: 10.3969/j.issn.2095-0780.2013.04.003 -
期刊类型引用(8)
1. 农源,杨洋,滕婷,陈林,孙彤彤,郑喜邦,李恭贺,杨磊,韦仁,吴文德. 罗非鱼源无乳链球菌ScpB蛋白的表达及IgM抗体间接ELISA方法的建立. 黑龙江畜牧兽医. 2024(02): 119-128 .  百度学术
百度学术
2. 王瑞,莫玉萍,雷爱莹,黄婷,陈明,李莉萍. 罗非鱼无乳链球菌弱毒疫苗不同免疫途径最适宜免疫温度的研究. 黑龙江畜牧兽医. 2024(08): 104-109 .  百度学术
百度学术
3. 布日额,吴金花,锡林高娃,陈金龙,王金良. 牛乳腺炎无乳链球菌PI-2a菌毛岛屿BP亚基单克隆抗体胶体金标记试纸条制备. 中国人兽共患病学报. 2020(01): 45-49 .  百度学术
百度学术
4. 谢云丹,冯娟,刘婵,邓益琴,王江勇,苏友禄. 自然感染无乳链球菌罗非鱼的比较病理学及毒力基因谱分析. 南方水产科学. 2019(02): 47-57 .  本站查看
本站查看
5. 黎铭,马春霞,黎建斌,雷爱莹,李莉萍,李大列,陈福艳,陈明. 无乳链球菌对罗非鱼肠道菌群的影响. 南方农业学报. 2019(08): 1647-1656 .  百度学术
百度学术
6. 赵欣,贾鹏,刘莹,王津津,史秀杰,潘广,郑晓聪,于力,何俊强,刘荭,吴志新. 鲤疱疹病毒2型微滴式数字PCR检测方法的建立及比较分析. 渔业科学进展. 2017(04): 126-133 .  百度学术
百度学术
7. 陈甜甜,房文红,王元,李新苍,赵姝,周俊芳. 梭子蟹肌孢虫SYBR Green I实时定量PCR检测方法的建立与应用. 南方水产科学. 2017(06): 22-29 .  本站查看
本站查看
8. 陆专灵,钟一治,赵忠添,卢智发,侯树鉴,李青,李登明,张益峰,韦友传. 龟源肺炎克雷伯菌SYBR-GreenⅠ荧光定量PCR检测方法的建立. 基因组学与应用生物学. 2016(05): 1137-1142 .  百度学术
百度学术
其他类型引用(7)



 下载:
下载:


 粤公网安备 44010502001741号
粤公网安备 44010502001741号
