Research progress of Polydora Complex
-
摘要:
才女虫属复合体(Polydora Complex)是典型的底质摄食者,多数种类栖居于潮间带、海湾、河口等近岸水域。其中一些种类是贝类上常见的多毛类寄生虫,能够钻入贝类的壳内营寄生生活,阻碍宿主的生长发育,感染严重时会导致贝类的大量死亡,是严重危害贝类养殖业发展的主要寄生虫类之一。文章从才女虫属复合体的形态分类、分子系统发育、栖居习性、生殖方式、幼体发育等5个方面综述才女虫属复合体的研究现状以及未来趋势。
Abstract:Polydora Complex, typically marine bottom deposit feeders, mostly inhabit in the coastal waters including intertidal zones, bays and estuaries. Some of Polydora Complex are main shellfish parasites which can bore into shells, and retard growth and development of the hosts. The shellfish heavily affected with Polydora Complex have high mortality. This paper reviews the researches on Polydora Complex from five aspects, including morphological taxonomy, molecular phylogeny, habitat type, reproduction and larval development. Research trends for Polydora Complex are also forecasted.
-
Keywords:
- Polydora Complex /
- morphological taxonomy /
- habitat type /
- reproduction
-
才女虫属复合体(Polydora Complex)隶属于环节动物门,多毛纲,游走目,海稚虫科,是海稚虫科中第五刚节发生变形的所有种类的合称。自1802年BOSC发现首例才女虫属复合体种类至今,全世界共发现147种[1]。其中有些种类能够掘洞钻入养殖贝类如扇贝[2]、牡蛎[3]、鲍[4]、文蛤[5]、贻贝[6]等的壳内,使贝壳变形、表面或壳内产生污垢,影响宿主呼吸、摄食,降低宿主的活力,阻碍宿主的生长发育,严重者甚至钻入宿主组织内部,引发器官炎症,造成宿主死亡,是严重危害贝类养殖业发展的主要寄生虫类之一[7-8]。
才女虫属复合体种类对贝类的生长和发育所造成的严重危害引起了众多研究者的高度重视,对它们的种类、分布、摄食方式、繁殖方式、幼体发育等作了较详细的研究,并取得了一系列的研究成果。近年来,研究者应用分子生物学技术,进一步探讨了才女虫属复合体种类的起源与进化等问题。但是在中国,才女虫属复合体种类的相关研究却十分薄弱,研究内容仅涉及才女虫属复合体种类的报道和虫体幼体发育情况的描述等,而应用分子手段探讨其系统进化的研究尚未见到。在中国,迄今仅报道16种才女虫属复合体种类,其中以中国海为模式产地发表的新种仅4种[9]。中国沿海分布的才女虫属复合体种类应不止这些,许多常见种类及新种有待发现。弄清才女虫属复合体的种类、分布及其宿主特异性,将为贝类有害才女虫属复合体的综合防控奠定理论基础。因此,开展中国沿海水域贝类寄生才女虫属复合体种类的调查研究工作势在必行。文章从形态分类、分子系统发育、栖居习性、生殖方式、幼体发育等5个方面对才女虫属复合体展开综述,以期为开展才女虫属复合体的研究提供参考。
1. 形态分类
早在19世纪初许多学者就开始了对才女虫属复合体的研究,但长期以来对才女虫属复合体的系统分类混乱。1802年,BOSC[10]在美国东岸查理斯敦港的潮间带中发现了一种具有触手、头部具缺刻且第五刚节具变形刚毛的蠕虫,将其命名为美角才女虫(Polydora cornuta)。随后,这些第五刚节具有变形刚毛的环节动物引起了研究者的重视。
MONTAGU[11]首次在贝壳上发现了才女虫属复合体种类,将其命名为Diplotis hyalina;JOHNSTON[12]亦观察到一种寄生于贝壳内的才女虫属复合体种类,将其命名为Leucodore ciliatus。事实上,Diplotis与Leucodore都是才女虫属(Polydora)的次异名,GRUBE [13]建立海稚虫科(Spionidae)时只将Polydora作为一个独立的属归入其中,而未提及Diplotis与Leucodore,后来亦鲜有学者用这2个属名描述才女虫属复合体种类。此后,虽然有很多才女虫属复合体种类相继被发现,但是不同学者对才女虫属复合体持不同的分类原则,导致才女虫属复合体的分类系统与命名相当混乱(表 1)。如美国学者VERRILL[14]建议建立Dipolydora属;俄国学者CZERNIAVSKY[15]提出才女虫属复合体应细分为3个属,即Pseudopolydora、Protopolydora和Pseudoleucodore。这些分类观点都未引起足够的重视,未被大多数分类学家接受。
表 1 才女虫属复合体相关属名汇总Table 1 List of related genera of Polydora Complex时间year 命名者namer 属名genus 模式种type species 是否沿用still in use or not 1802 BOSE Polydora P.cornuta 是 1813 MONTAGU Diplotis D.hyalina 否 1838 JOHNSTON Leucodore L.ciliatus 否 1866 KINBER Perialla P.claparedei 否 1874 MOBIUS Leipoceras L.uviferum 否 1879 VERRILL Dipolydora D.concharum 是 1881 CZERNIAVSKY Pseudopolydora P.antennata 是 1881 CZERNIAVSKY Protopolydora P.hamata 否 1881 CZERNIAVSKY Pseudoleucodore P.caecum 否 1893 CARAZZI Boccardia B.polybranchia 是 1896 MESNIL Carazzia C.antennata 否 1914 AUGENER Polydorella P.prolifera 否 1954 BERKELEY Neopygospio N.laminifera 否 1964 WOODWICK Tripolydora T.spinosa 是 1973 RAINER Paraboccardia P.syrtis 否 1978 BLAKE Boccardiella B.hamata 是 1978 BLAKE Carazziella C.citrona 是 1983 BLAKE Amphipolydora A.abranchiata 是 1985 BUZHINSKAJA Neoboccardia N.perata 否 直到19世纪90年代,CARAZZI[16]对才女虫属复合体种类进行了系统研究,并将鳃的出现位置和变形刚毛类型等特征引入到才女虫属复合体的分类中来,将那些鳃开始于第五刚节前、具2种变形刚毛的才女虫属复合体划分出来,形成一个新属,即蛇稚虫属(Boccardia)。MESNIL[17]进一步完善才女虫属复合体的系统分类,并注意到刚毛的种类以及排列方式对才女虫分类的重要性,将巾钩刚毛始于第八刚节的才女虫属复合体划归入新属Carazzia。自此以后,才女虫属复合体被划分为3个属,即Polydora、Boccardia与Carazzia。虽然这个系统分类原则被广泛接受,但Boccardia与Carazzia在此后很长一段时间内被当作是Polydora的2个亚属,并有大量的新种被发现[18-21]。
WOODWICK[22]首次明确定义了才女虫属复合体,将海稚虫科中第五刚节变形并且具有变形刚毛的种类统称为Polydorids,但并未提出具体的分类系统。美国学者BLAKE[23]系统总结了前人的研究,根据第五刚节的变形程度、粗足刺刚毛排列方式、鳃与巾钩刚毛最先出现的位置等特征对才女虫属复合体进行了细分,将才女虫属复合体划分为8个属,即才女虫属(Polydora)、伪才女虫属(Pseudopolydora)、蛇稚虫属(Boccardia)、小蛇稚虫属(Boccardiella)、卡氏才女虫属(Carazziella)、三齿才女虫属(Tripolydora)、范才女虫属(Amphipolydora)和双才女虫属(Dipolydora)。他还对前人使用过的才女虫属复合体相关的属和种进行了修订,使才女虫属复合体的系统分类更为合理。BLAKE提出的分类系统基本解决了一直以来在才女虫属复合体形态分类上的混乱,因此该分类系统被广泛接受,并一直沿用至今。
长期以来,由于不同学者对才女虫属复合体的分类持不同观点,且才女虫属复合体种类的形态具多变性,虫体经固定后一些重要形态特征亦会发生明显的变化,这使得准确鉴定才女虫属复合体种类变得异常困难。不同海域、不同宿主、不同栖居环境之间才女虫属复合体种类的同物异名或异物同名现象普遍存在,如Polydora cornuta Bosc,1802与Polydora ligni Webster,1879、Polydora amarincola Hartman,1936同物异名[24];钻入贝类壳内生活的凿贝才女虫(Polydora ciliata Johnston,1838)异物同名现象比较严重:Polydora limicola Annenkova,1934、Polydora aggregata Blake,1969、Polydora manchenkoi Radashevsky and Pankova,2006都曾被认为是P.ciliata[25-27]。基于形态特征的才女虫属复合体系统分类具有一定的局限性,有时很难辨别虫体种间与种内差异。因此,除了必要的形态学方法鉴定外,有必要引入分子生物学的手段对相似种类进行进一步区分,如利用核糖体RNA基因与线粒体基因等分子标记从分子水平上区分虫体种间或种内的差异。
2. 分子系统发育
才女虫属复合体的分子系统发育研究尚属起步阶段,相关研究甚少。迄今为止发现的147种才女虫属复合体中,只有不到20种具有分子序列数据。ROUSSET等[28]应用分子标记技术首次将P.ciliata和P.giardi纳入到环节动物分子系统进化分析之中。RICE等[29]以细胞色素氧化酶基因(COⅠ)为分子标记,发现分布于北美3个不同海域的美角才女虫(P.cornuta)具有3种不同的基因型,应分属3个不同的才女虫属复合体种类,对传统的形态鉴定方法的准确性提出了质疑。SIMON等[30]比较了采自北美和南非鲍壳上的Boccardia proboscidea的线粒体16S rRNA基因和细胞色素b(Cyt b)基因序列,发现它们具有完全相同的单倍型,用分子手段证实了南非的B.proboscidea是通过宿主鲍的运输由北美传入的。
SATO-OKOSHI和ABE[31]首次以小核糖体rRNA基因(18S rRNA)为分子标记,用以区分采自不同海域、不同宿主、形态特征相似的才女虫属复合体种类。SATO-OKOSHI和ABE[32]利用18S rRNA基因序列构建了系统发育树,探讨了才女虫属复合体种间的亲缘关系。RADASHEVSKY和PANKOVA[33]首次应用联合分子标记技术比较分析了具有管栖和洞栖习性的Dipolydora carunculata的核糖体18S rRNA、28S rRNA、线粒体16S rRNA基因序列,发现它们具有完全一致的单倍型,进一步证实了同种才女虫属复合体种类可同时具有2种栖居习性。
综上所述,才女虫属复合体的分子系统发育研究起步较晚,相关研究仅涉及区分其种间和种内的分子序列差异,用以辅助形态分类研究。在中国,关于才女虫属复合体的分子系统发育研究更是处于空白。
3. 栖居习性
大多数才女虫属复合体种类栖居于潮间带、海湾、河口等近岸水域,少数种类栖居于深海底质中[34-36]。才女虫属复合体有2种栖居类型,第一种类型是虫体利用其栖息环境周边中的碎屑或泥沙构筑泥管,并终生栖居于管内,称之为管栖型[23, 37];第二种类型是虫体通过挖掘,钻入各种石灰质的栖息地,如珊瑚、岩石、软体动物贝壳等,形成各种形状的洞穴并终生栖居于洞内,称之为洞栖型[34, 38]。长期以来,学者们将不同栖居方式的才女虫属复合体分开研究,并未关注管栖型和洞栖型种类之间是否有联系。因此,多数学者认为才女虫属复合体种类一般只具有一种栖息方式[23, 34, 39-41]。SATO-OKOSHI[37-38]发现这2种栖居类型的才女虫属复合体种类的形态和生物学特征差异明显,洞栖型种类第五刚节上变形刚毛一般具有辅助掘洞的侧齿,掘洞能力强爬行能力却很弱;而管栖型种类无侧齿,没有掘洞能力,但是爬行能力强,具有更灵活的触手和更粗壮的血管,因此认为才女虫属复合体种类不能兼有2种栖居类型。近年有学者发现才女虫属复合体种类能够兼具2种栖居类型。RADASHEVSKY和HSIEH[42]在牡蛎的壳内和潮间带的底质中同时发现了P.triglanda,因此推断P.triglanda同时具有洞栖和管栖习性。RADASHEVSKY和PANKOVA[33]利用分子标记技术同样发现D.carunculata亦能兼具2种栖居习性。
洞栖型才女虫属复合体种类是贝类养殖业中的重要病害生物,其凿贝行为阻碍了贝类的生长发育,极大降低贝类的品质和价值,严重时甚至导致贝类死亡[3, 43-46]。虽然经历了2个多世纪的研究,但洞栖型才女虫属复合体的掘洞机制至今仍未弄清。LANKESTER[47]观察了P.ciliata的凿洞情况后,认为才女虫属复合体并没有掘洞能力,洞穴是靠其体节上的腺体分泌酸性物质,腐蚀钙质贝壳而形成的。而M NTOSH[48]却发现P.ciliata在壳内形成明显的穴道,认为洞穴是通过虫体的机械摩擦作用形成,并非LANKESTER所认为的化学腐蚀作用形成。WHITELEGGE[49]研究了牡蛎壳上的P.iliata的凿洞行为后也认为才女虫复合体并没有掘洞能力。他认为才女虫幼体先游入牡蛎内部,附着于壳内,然后附着的幼体会刺激牡蛎分泌钙质,将虫体覆盖,进而形成洞穴。HANNERZ[50]认为才女虫属复合体掘洞是通过机械摩擦和化学腐蚀的共同作用完成,虫体腺囊分泌的酸性物质使贝壳变软,这样更有利于刚毛对贝壳的机械摩擦。DORSETT[51]赞同HANNERZ的观点,并认为才女虫属复合体第五刚节上粗壮的肌肉以及粗足刺参与了虫体的机械摩擦掘洞过程。但是,HAIGLER[52]去除P.websteri第五刚节上的粗足刺刚毛后,发现虫体仍可以掘洞,因此认为粗足刺刚毛并不是P.websteri掘洞过程中所必需的。BLAKE和EVAN[53]推测才女虫属复合体的粗足刺刚毛可能并不参与掘洞行为,其作用可能是固定虫体在洞穴内的位置,以便虫体呼吸与摄食。由此可见,关于洞栖型才女虫属复合体的掘洞机制目前学者们并没有达成一致观点。笔者推测才女虫属复合体可能并没有统一的掘洞机制,其可能会根据栖居地的不同组分选择不同的掘洞行为。
4. 生殖方式
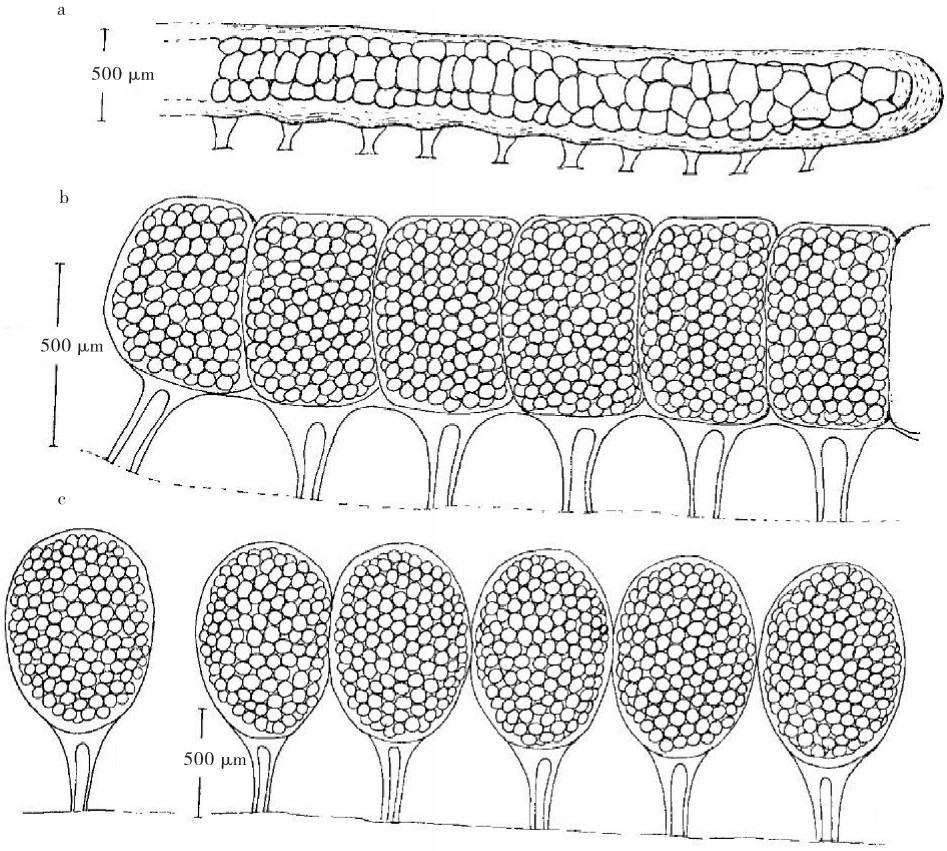
才女虫属复合体具有2种生殖方式,即有性生殖和无性生殖。有性生殖过程中,雌性个体的性腺位于体前部的腹部纵肌附近,一对含有卵细胞的棒状囊伸入体腔内[54]。卵细胞在囊内发育成熟后,排入到体腔内,随后后移至第17~第37体节,存储于受精囊(seminal receptacles)中,等待受精[23]。雄性个体的精子积聚在一起形成精板(sperm plates),精子成熟后脱离精板,流入到体腔内[23]。精子通过雄性个体体节上特化的肾管口(nephridiopore)排出体外。雌性个体通过触手收集体外分散的成熟精子,将精子拨入其筑造的洞穴或管道内。这时,精子将进入雌性个体体节背部的受精囊内,与成熟卵细胞结合,完成受精。雌性个体通过受精囊附近的肾管口将卵排出体外,粘附在洞穴或管道的沿壁。这些卵被雌性个体分泌的薄膜包裹保护,形成卵袋(egg capsules)。BLAKE[26]将才女虫属复合体的卵袋分为3种类型,第一种类型是所有卵都聚集在一个长的圆柱体内,依靠细纤维丝将卵袋粘附于沿壁上(图 1-a),如D.giardi,B.semibranchiata的卵袋;第二种类型是多个小卵袋聚集在一起,形成念珠状的一串,每个小卵袋依靠1根或2根纤维丝粘附于沿壁上(图 1-b),如P.websteri的卵袋;第三种类型是每个卵袋独立存在,依靠纤维丝粘附于沿壁上(图 1-c),如P.cornuta的卵袋[55-57]。大多数才女虫属复合体的卵袋属于第二种类型,第一种和第三种类型的卵袋较少。
![]() 图 1 才女虫属复合体的3种卵袋类型[57]a.第一种类型; b.第二种类型;c.第三种类型Fig. 1 Three types of egg capsules of Polydora Complexa. Type 1;b. Type 2;c. Type 3
图 1 才女虫属复合体的3种卵袋类型[57]a.第一种类型; b.第二种类型;c.第三种类型Fig. 1 Three types of egg capsules of Polydora Complexa. Type 1;b. Type 2;c. Type 3才女虫属复合体的无性生殖分为2种,即分裂生殖(architomy)与出芽生殖(paratomy)。分裂生殖是指才女虫属复合体分成多段体节后,每段体节都能再生,形成新的个体。出芽生殖是指才女虫属复合体一分为二形成2段体节,通过再生长出失去的部分[57]。具分裂生殖的才女虫属复合体种类有D.socialis、A.abranchiata、A.vestalis等[35, 58-59];具出芽生殖的才女虫属复合体种类有Pseudopolydora prolifera、P.stolonifera、P.smurovi、P.dawydoffi、P.tetrabranchia等[57, 60-62]。
才女虫属复合体以有性生殖为主,只有在受到外力作用或环境应激下虫体发生断裂后,才表现出一定的无性生殖能力。
5. 幼体发育
才女虫属复合体的幼体发育是指自受精卵发育开始至附着(settlement)为止的虫体生长发育过程。根据所需的营养类型差异,才女虫属复合体幼体发育可分为自养型和异养型[23]。自养型是指幼体发育所需的营养由虫体的卵内所储存的蛋黄提供;异养型是指虫体离开卵袋后转变为浮游生活的幼体,幼体依靠捕食环境中的浮游生物,为其生长发育提供营养。才女虫属复合体卵袋内的卵可分为2种,一种是受精卵,能够不断的发育分裂,最终形成幼体;另一种是未受精卵,虽然不能发育为幼体,但是能储存营养,可被已经发育的幼体吞食,为其提供营养,因此称为育幼卵(nurse eggs)。这种需要摄食育幼卵来维持幼体生长的发育方式称为食胞发育(adelphophagia),该发育方式普遍存在于海稚虫科的种类中[26, 63-64]。
RADASHEVSKY[65]进一步研究了才女虫属复合体幼体的营养方式,认为其幼体可分为外自养型(exolecithotrophic)和内自养型(endolecithotrophic)。外自养型是指幼体通过摄食育幼卵完成生长发育;内自养型是指幼体依靠吸收其自身卵内储存的蛋黄营养来完成生长发育,且没有浮游阶段,离开卵袋后即附着。但是,BLAKE[23]发现,B.proboscidea同时具有内自养型和外自养型,据此认为该定义具有局限性。由此看来,才女虫属复合体的幼体发育较为复杂,幼体发育的类型与其所处的环境,如食物、温度、光照时间等因素密切相关[23, 66]。
6. 研究展望
虽然经历了200多年的研究,但才女虫属复合体的系统分类至今仍未完善。首先,将第五刚节发生变形的海稚虫科种类全部归入才女虫属复合体是否合理还有待进一步研究。近年来,有学者质疑才女虫属复合体的这一分类原则,发现伪才女虫属(Pseudopolydora)的第五刚节与其相邻刚节并无明显差异[42]。他们认为以第五刚节上的刚毛特征以及后刚毛叶的变形特征来定义才女虫属复合体更为合理[1, 42, 67]。其次,同物异名和异物同名是才女虫属复合体系统分类的另一个棘手问题。仅仅依靠口前叶、脑后脊、触手、刚毛、尾部等形态特征的细微差别就定义才女虫属复合体新种是否合理值得商榷。才女虫属复合体在不同宿主、不同海域以及不同栖居环境下都很有可能导致同一物种在形态特征上发生或多或少的变化。因此,如何界定才女虫属复合体的种内差异和种间差异是当前乃至以后很长时间内需要解决的关键问题。
虽然分子生物学技术已经在多数生物的系统分类上得到了广泛的应用,但在才女虫属复合体的研究中却鲜有涉及。事实上,才女虫属复合体形态分类是否合理迫切需要分子生物学手段给予验证。因此,应用分子生物学手段探讨才女虫属复合体属种内的亲缘关系应给予更多的关注,也必将成为今后的研究热点。筛选保守、分辨率高的分子标记是当前迫切需要解决的问题。近年来,小亚基核糖体RNA(SSU rRNA)基因和线粒体细胞色素氧化酶基因(COⅠ)是最常用的2个分子标记,能很好地区分才女虫属复合体的种内差异和种间差异[31-33]。虽然分子标记技术在种类鉴定上的应用已有所报道[28-30],但还远远不够,对才女虫属复合体在不同宿主、不同海域、不同栖居环境下具有怎样的亲缘关系、才女虫属复合体的属种内的亲缘关系和各属间的进化次序等问题的研究尚未涉及,今后应给予足够的重视。目前才女虫属复合体的分子生物学研究还处于初级阶段,大多数才女虫属复合体都缺乏分子数据,因此,全面阐明才女虫属复合体属种内的亲缘关系、进化起源的研究还为时尚早。在今后的研究中,笔者认为很有必要在描述才女虫属复合体新种或重描述种类时提交相应的分子数据,以便后来者参考,并有助于对才女虫属复合体的系统发育进化的深入研究。
近年来,由于才女虫属复合体引起的贝类病害在中国、南非、新西兰、挪威、西班牙等沿海国家不断暴发,对贝类养殖业的发展造成了巨大的威胁[3, 68-71]。因此,笔者认为有必要在贝类才女虫病的防治方面进行更多的研究。由于贝类一般在开放式的浅海或滩涂上养殖,一旦发生病害,药物防治很难奏效。有学者曾用龙胆紫、甲苯咪唑、高锰酸钾等药物浸泡的方法来杀灭贝类寄生的才女虫属复合体种类,但是效果并不明显[72]。NEL等[68]将病贝浸泡于淡水数小时或70 ℃海水数十秒后发现既能杀灭才女虫属复合体种类,又不造成病贝死亡,能一定程度地防治才女虫病。LLEONART等[72]发现将病贝暴露于空气下数小时亦对杀灭才女虫属复合体种类有一定的效果。目前看来,化学浸泡法或物理治疗法虽然能一定程度地杀灭贝类寄生的才女虫属复合体种类,但是将病贝放回养殖环境后疾病复发率高,且处理后的病贝生长发育也受到影响,因此将来也应更多关注才女虫属复合体的检测技术,以防为主,治疗为辅。由于多数才女虫属复合体种类都具有浮游幼体阶段,因此,通过荧光定量PCR等技术监测养殖环境中才女虫属复合体种类的浮游幼体周年变化对防治贝类才女虫病具有重要意义。只有弄清了浮游幼体的流行规律,才能选择最佳时机,通过药物或者引入天敌等生态防治方法来杀灭幼体,切断才女虫属复合体的生活史,降低浮游幼体在贝类上的附着机率,有效地控制贝类才女虫病的暴发。
-
图 1 才女虫属复合体的3种卵袋类型[57]
a.第一种类型; b.第二种类型;c.第三种类型
Figure 1. Three types of egg capsules of Polydora Complex
a. Type 1;b. Type 2;c. Type 3
表 1 才女虫属复合体相关属名汇总
Table 1 List of related genera of Polydora Complex
时间year 命名者namer 属名genus 模式种type species 是否沿用still in use or not 1802 BOSE Polydora P.cornuta 是 1813 MONTAGU Diplotis D.hyalina 否 1838 JOHNSTON Leucodore L.ciliatus 否 1866 KINBER Perialla P.claparedei 否 1874 MOBIUS Leipoceras L.uviferum 否 1879 VERRILL Dipolydora D.concharum 是 1881 CZERNIAVSKY Pseudopolydora P.antennata 是 1881 CZERNIAVSKY Protopolydora P.hamata 否 1881 CZERNIAVSKY Pseudoleucodore P.caecum 否 1893 CARAZZI Boccardia B.polybranchia 是 1896 MESNIL Carazzia C.antennata 否 1914 AUGENER Polydorella P.prolifera 否 1954 BERKELEY Neopygospio N.laminifera 否 1964 WOODWICK Tripolydora T.spinosa 是 1973 RAINER Paraboccardia P.syrtis 否 1978 BLAKE Boccardiella B.hamata 是 1978 BLAKE Carazziella C.citrona 是 1983 BLAKE Amphipolydora A.abranchiata 是 1985 BUZHINSKAJA Neoboccardia N.perata 否 -
[1] WALKER L M. A review of the current status of the Polydora-complex (Polychaeta Spionidae) in Australia and a checklist of recorded species[J]. Zootaxa, 2011, 2751: 40-62. https://www.semanticscholar.org/paper/A-review-of-the-current-status-of-the-Polydora-in-a-Walker/c52ae7f4848f93a80e5327c0080afd1dcb879fa1
[2] EVANS J W. Borers in the shell of the sea scallop, Placopecten magellnnicus [J]. Amer Zool, 1969, 9 (3): 775-782. doi: 10.1093/icb/9.3.775
[3] HANDLEY S J, BERGQUIST P R. Spionid polychaete infestations of intertidal pacific oysters Crassostrea gigas (Thunberg), Mahurangi Harbour, northern New Zealand[J]. Aquaculture, 1997, 153 (3): 191-205. https://www.semanticscholar.org/paper/Spionid-polychaete-infestations-of-intertidal-gigas-Handley-Bergquist/0a508d3301f41753d18188efd3bef18940f3f137
[4] SATO-OKOSHI W, OKOSHI K, SHAW J. Polydorid species (Polychaeta: Spionidae) in south-western Australian waters with special reference to Polydora uncinata and Boccardia knoxi[J]. J Mar Biol Assoc UK, 2008, 88(3): 491-501. doi: 10.1017/S0025315408000842
[5] RIASCOS J M, HEILMAYER O, OLIVA M E, et al. Infestation of the surf clam Mesodesma donacium by the spionid polychaete Polydora bioccipitalis [J]. J Sea Res, 2008, 59 (4): 217-227. doi: 10.1016/j.seares.2008.01.003
[6] SEED R. The infestation of Mytilus edulis Linnaeus by Polydora ciliata (Johnston) in the Conwy Estuary, North Wales[J]. J Moll Stud, 1991, 57(4): 413-424. doi: 10.1093/mollus/57.4.413
[7] READ G B. Comparison and history of Polydora websteri and P. haswelli (Polychaeta: Spionidae) as mud-blister-worms in New Zealand shellfish[J]. New Zeal J Mar Fresh, 2010, 44(2): 83-100. doi: 10.1080/00288330.2010.482969
[8] 杨慧英, 吴开畅, 李有宁, 等. 海南新村港养殖合浦珠母贝主要多毛类寄生虫的流行病学调查[J]. 广东农业科学, 2012, 39(13): 170-173. doi: 10.3969/j.issn.1004-874X.2012.13.058 [9] ZHOU J, JI W, LI X. Records of Polydora complex spionids (Polychaeta: Spionidae) from China's coastal waters, with emphasis on parasitic species and the description of a new species[J]. Mar Fish, 2010, 32(1): 1-15. https://www.semanticscholar.org/paper/Records-of-Polydora-complex-spionids-(Polychaeta%3A-a-%E5%91%A8%E8%BF%9B-%E7%BA%AA%E8%96%87%E8%96%87/41cd012d2bc7cbb6978facf991210ab3bb74deed
[10] BOSC L A G. Histoire naturelle des vers, contenant leur description et leurs moeurs, avec figures dessinees d'apres nature[M]. Paris, France: Deterville, 1802, 1/2/3: 1-324. https://www.biodiversitylibrary.org/bibliography/9373
[11] MONTAGU G. An account of some new and rare marine British shells and animals[J]. Trans Linn Soc Lond, 1813, 11(2): 179-204. https://academic.oup.com/transactionslinnean/article-abstract/os-11/2/179/2374499
[12] JOHNSTON G. Miscellanea Zoologica Aricadae[J]. Mag Zool Botany Edinburgh, 1838, 2: 62-73. https://www.biodiversitylibrary.org/part/245175
[13] GRUBE A E. Die familien der Anneliden[J]. Archiv fur Naturgeschicht, 1850, 16: 249-364. https://www.biodiversitylibrary.org/bibliography/46818
[14] VERRILL A. Notice of recent additions to the marine invertebrata of the north-eastern coast of America, with descriptions of new genera and species and crucial remarks on others[J]. Proc US Nat Mus, 1879, 2: 165-205. doi: 10.5479/si.00963801.76.165
[15] CZERNIAVSKY V. Materialia ad zoographiam Ponticam comparatam. 3 Vermes[J]. Bulletin de la Societe Imperiale des Naturalistes, 1881, 56: 338-420. https://www.marinespecies.org/aphia.php?p=taxdetails&id=129621
[16] CARAZZI D. Revisione del genere Polydora Bosc e cenni su due specie che vivono sulle ostriche[J]. Mittheilungen aus der Zoologischen Station zu Neapel, 1893, 11: 4-45. https://www.semanticscholar.org/paper/Revisione-del-genere-Polydora-Bosc-e-cenni-su-due-Carazzi/a49a80b07ac0a64a452117d0878e766405676e04
[17] MESNIL F. Études de morphologie externe chez les annélides. I. Les spionidens des cotes de la manche[J]. Bulletin Scientifique de la France et de la Belgique, 1896, 29: 110-287. doi: 10.5962/bhl.part.19052
[18] MOORE J P. Descriptions of new species of spioniform annelids[J]. Proc Acad Nat Sci Philadelphia, 1907, 59(2): 195-207. https://research.si.edu/publication-details/?id=125559
[19] WILSON D P. The larvae of Polydora ciliata Johnston and Polydora hoplura Claparede[J]. J Mar Biol Assoc UK, 1928, 15(2): 567-603. doi: 10.1017/S0025315400009553
[20] OKUDA S. Spioniform polychaetes from Japan[J]. J Fac Sci Hokkaido Univ Ser (Series 6: Zoology), 1937, 5(3): 217-254. https://cir.nii.ac.jp/crid/1050282813967081856?lang=en
[21] LOOSANOFF V L, ENGLE J B. Polydora in oysters suspended in the water[J]. Biol Bull, 1943, 85(1): 69-78. doi: 10.2307/1538270
[22] WOODWICK K H. Comparison of Boccardia columbiana Berkeley and Boccardia proboscidea Hartman (Annelida, Polychaeta)[J]. Bull South Calif Acad Sci, 1963, 62: 132-139. https://www.semanticscholar.org/paper/Comparison-of-Boccardia-columbiana-Berkeley-and-Woodwick/7c542a23063093ae5b5c8660fed848c6874aeb43
[23] BLAKE J A. Family Spionidae Grube, 1850[J]. Taxonomic atlas of the benthic fauna of the Santa Maria Basin and Western Santa Barbara Channel, 1996, 6: 81-223. https://www.si.edu/object/siris_sil_471283
[24] BLAKE J A, MACIOLEK N J. A redescription of Polydora cornuta Bosc (Polychaeta: Spionidae) and designation of a neotype[J]. Bull Biol Soc Washington, 1987, 7: 11-15. https://www.semanticscholar.org/paper/A-redescription-of-Polydora-cornuta-Bosc-Spionidae)-Blake-Maciolek/2066971365d88cf3c77926f3dc2f5ffc36868999
[25] ANNENKOVA N V. Kurze Ubersicht der Polychaeten der Litoralzone der Bering-Insel (Kommandor-Inseln) nebst Beschreibung neuer Arten[J]. Zool Anz, 1934, 106(12): 322-331. https://bionames.org/references/34288789e5c41233b9dcf76615876e45
[26] BLAKE J A. Reproduction and larval development of Polydora from Northern New England (Polychaeta: spionidae)[J]. Ophelia, 1969, 7(1): 1-63. doi: 10.1080/00785326.1969.10419288
[27] RADASHEVSKY V I, PANKOVA V V. The morphology of two sibling sympatric Polydora species (Polychaeta: Spionidae) from the Sea of Japan[J]. J Mar Biol Assoc UK, 2006, 86(2): 245-252. doi: 10.1017/S0025315406013099
[28] ROUSSET V, PLEIJEL F, ROUSE G W, et al. A molecular phylogeny of annelids[J]. Cladistics, 2007, 23(1): 41-63. doi: 10.1111/j.1096-0031.2006.00128.x
[29] RICE S A, KARL S, RICE K A. The Polydora cornuta complex (Annelida: Polychaeta) contains populations that are reproductively isolated and genetically distinct[J]. Invertebr Biol, 2008, 127(1): 45-64. doi: 10.1111/j.1744-7410.2007.00104.x
[30] SIMON C A, THORNHILL D J, OYARZUN F, et al. Genetic similarity between Boccardia proboscidea from Western North America and cultured abalone, Haliotis midae, in South Africa[J]. Aquaculture, 2009, 294(1/2): 18-24. https://www.semanticscholar.org/paper/Genetic-similarity-between-Boccardia-proboscidea-in-Simon-Thornhill/78d54df94a689a9590350ccd2e683ac854cb3890
[31] SATO-OKOSHI W, ABE H. Morphological and molecular sequence analysis of the harmful shell boring species of Polydora (Polychaeta: Spionidae) from Japan and Australia[J]. Aquaculture, 2012, 368/369: 40-47. doi: 10.1016/j.aquaculture.2012.08.046
[32] SATO-OKOSHI W, ABE H. Morphology and molecular analysis of the 18S rRNA gene of oyster shell borers, Polydora species (Polychaeta: Spionidae), from Japan and Australia[J]. J Mar Biol Assoc UK, 2013, 93(5): 1279-1286. doi: 10.1017/S002531541200152X
[33] RADASHEVSKY V I, PANKOVA V V. Shell-boring versus tube-dwelling: is the mode of life fixed or flexible? Two cases in spionid polychaetes (Annelida, Spionidae)[J]. Mar Biol, 2013, 160(7): 1619-1624. doi: 10.1007/s00227-013-2214-8
[34] BLAKE J A. Revision of the genus Polydora from the east coast of North America (Polychaeta Spionidae)[J]. Smithson Contr Zool, 1971, 75: 1-32. https://repository.si.edu/handle/10088/5285
[35] BLAKE J A. Polychaetes of the family Spionidae from South America, Antarctica, and adjacent seas and islands[M]. American Geophysical Union: Antarctic Research Series (Biology of the Antarctic Seas XIV), 1983, 39: 205-287. doi: 10.1029/AR039p0205
[36] MACIOLEK N J. A new species of Polydora (Polychaeta: Spionidae) from deep water in the north-west Atlantic Ocean and new records of other polydorid species[J]. Sarsia, 1984, 69(2): 123-131. doi: 10.1080/00364827.1984.10420598
[37] SATO-OKOSHI W. Polydorid species (Polychaeta : Spionidae) in Japan, with descriptions of morphology, ecology and burrow structure. 2. Non-boring species[J]. J Mar Biol Assoc UK, 2000, 80(3): 443-456. doi: 10.1017/S0025315499002143
[38] SATO-OKOSHI W. Polydorid species (Polychaeta: Spionidae) in Japan, with descriptions of morphology, ecology and burrow structure. 1. Boring species[J]. J Mar Biol Assoc UK, 1999, 79(5): 831-848. doi: 10.1017/S0025315498001003
[39] READ G B. Systematics and biology of polydorid species (Polychaeta: Spionidae) from Wellington Harbour[J]. J Roy Soc New Zeal, 1975, 5(4): 395-419. doi: 10.1080/03036758.1975.10419361
[40] SATO-OKOSHI W, SUGAWARA Y, NOMURA T. Reproduction of the boring polychaete Polydora variegata inhabiting scallops in Abashiri Bay, North Japan[J]. Mar Biol, 1990, 104(1): 61-66. doi: 10.1007/BF01313158
[41] WILLIAMS J D, RADASHEVSKY V I. Morphology, ecology, and reproduction of a new Polydora species from the east coast of North America (Polychaeta: Spionidae)[J]. Ophelia, 1999, 51(2): 115-127. doi: 10.1080/00785326.1999.10409403
[42] RADASHEVSKY V I, HSIEH H L. Polydora (Polychaeta: Spionidae) species from Taiwan[J]. Zool Stud, 2000, 39(3): 203-217. https://www.semanticscholar.org/paper/Polydora-%28Polychaeta%3A-Spionidae%29-species-from-Radashevsky-Hsieh/6a17fda56b31ab53ae84ae26da868f7f26c590e7
[43] 姜卫国, 彭云辉, 谢玉坎. 合浦珠母贝多毛虫寄生病继发性脓疡(俗称"黑心肝病") 的研究Ⅲ. 凿贝才女虫的繁殖期, 附着高峰和附着过程的研究[M]//中国科学院南海海洋研究所珠贝文集. 北京: 科学出版社, 1984: 81-86. https://zh.z-lib.gs/book/30482383/ab650a/%E7%8F%8D%E7%8F%A0%E8%B4%9D%E6%96%87%E9%9B%86.html [44] 崔秀林. 扇贝养殖中黑壳病的发生和预防[J]. 河北渔业, 1995 (2): 16. https://www.doc88.com/p-0979787401292.html [45] 张树林, 李晓东, 刘青. 利氏才女虫幼虫对轮虫和河蟹蚤状幼体的影响[J]. 水产科学, 2002, 21(1): 14-16. https://doc.taixueshu.com/journal/20020072sckx.html [46] LLEONART M, HANDLINGER J, POWELL M. Spionid mudworm infestation of farmed abalone (Haliotis spp. )[J]. Aquaculture, 2003, 221(1/2/3/4): 85-96. https://www.semanticscholar.org/paper/Spionid-mudworm-infestation-of-farmed-abalone-spp.)-Lleonart-Handlinger/0261977fc128cd72bddaeac6241c68a8c7041125
[47] LANKESTER E R. On lithodomous Annelids[J]. Ann Mag Nat Hist, 1868, 1(4), 233-238. doi: 10.1080/00222936808695684
[48] MÍNTOSH W C. On the boring of certain Annelids[J]. Ann Mag Nat Hist, 1868, 2(10): 276-295. doi: 10.1080/00222936808695802
[49] WHITELEGGE T. Report on the worm disease affecting the oysters on the coast of New South Wales. Commissioners of Fisheries of New South Wales[J]. Rec Aust Mus, 1890, 1(2): 41-54. doi: 10.3853/j.0067-1975.1.1890.1224
[50] HANNERZ L. Larval development of the polychaete families Spionidae Sars, Disomidae Mesnil, and Poecilochaetidae n. fam. in the Gullmar Fjord (Sweden)[J]. Zoologiska bidrag från Uppsala, 1956, 31: 1-204. doi: 10.1023/A:1003784324125
[51] DORSETT D A. The behaviour of Polydora ciliata (Johnst. ). Tube-building and burrowing[J]. J Mar Biol Assoc UK, 1961, 41(3): 577-590. doi: 10.1017/S0025315400016167
[52] HAIGLER S A. Boring mechanism of Polydora websteri inhabiting Crassostrea virginica [J]. Amer Zool, 1969, 9(3): 821-828. doi: 10.1093/icb/9.3.821
[53] BLAKE J A, EVANS J W. Polydora and related Genera as borers in mollusk shells and other calcareous substrates: (Polychaeta: Spionidae)[J]. Veliger, 1973, 15(3): 235-249. https://www.researchgate.net/publication/279962050_Polydora_and_related_genera_Polychaeta_Spionidae_as_borers_in_mollusk_shells_and_other_calcareous_substrates
[54] DORSETT D A. The reproduction and maintenance of Polydora ciliata (Johnst. ) at Whitstable[J]. J Mar Biol Assoc UK, 1961, 41(2), 383-396. doi: 10.1017/S0025315400023985
[55] DAY R L, BLAKE J A. Reproduction and larval development of Polydora giardi Mesnil (Polychaeta: Spionidae)[J]. Biol Bull, 1979, 156(1): 20-30. doi: 10.2307/1541000
[56] GUÉRIN J P. Élevage de Spionides (Annélides, Polychètes) en cycle complet: 3. Description du développement larvaire de Boccardia semibranchiata[J]. Ann Inst Oceanogr, 1991, 67(2): 145-154.
[57] BLAKE J A, ARNOFSKY P L. Reproduction and larval development of the spioniform Polychaeta with application to systematics and phylogeny[J]. Hydrobiologia, 1999, 402: 57-106. doi: 10.1023/A:1003784324125
[58] STOCK M W. Anterior regeneration in Spionidae[D]. Connecticut, US: University of Connecticut, 1964: 91.
[59] GIBSON G D, PATERSON I G. Morphogenesis during sexual and asexual reproduction in Amphipolydora vestalis (Polychaeta: Spionidae)[J]. New Zeal J Mar Fresh, 2003, 37(4): 741-752. doi: 10.1080/00288330.2003.9517204
[60] BLAKE J A, KUDENOV J D. The Spionidae (Polychaeta) from southeastern Australia and adjacent areas with a revision of the genera[J]. Mem Natn Mus Vict, 1978, 39: 171-280. doi: 10.24199/j.mmv.1978.39.11
[61] TZETLIN A B, BRITAYEV T A. A new species of the Spionidae (Polychaeta) with asexual reproduction associated with sponges[J]. Zool Scripta, 1985, 14(3): 177-181. doi: 10.1111/j.1463-6409.1985.tb00188.x
[62] RADASHEVSKY V I. Morphology, ecology and asexual reproduction of a new Polydorella species (Polychaeta: Spionidae) from the South China Sea[J]. Bull Mar Sci, 1996, 58(3): 684-693. https://www.infona.pl/resource/bwmeta1.element.elsevier-f4916dab-bc5c-34cf-a117-6e9a8aed374b?locale=en
[63] BLAKE J A, WOODWICK K H. Reproduction and larval development of Pseudopolydora paucibranchiata (Okuda) and Pseudopolydora kempi (Southern) (Polychaeta: Spionidae)[J]. Biol Bull, 1975, 149: 109-127. doi: 10.2307/1540483
[64] BLAKE J A, KUDENOV J D. Larval development, larval nutrition and growth for two Boccardia species (Polychaeta Spionidae) from Victoria Australia[J]. Mar Ecol Prog Ser, 1981, 6: 175-182. doi: 10.3354/meps006175
[65] RADASHEVSKY V I. Life history of a new Polydora species from the Kurile Islands and evolution of lecithotrophy in polydorid genera (Polychaeta: Spionidae)[J]. Ophelia, 1994, 39(2): 121-136. doi: 10.1080/00785326.1994.10429539
[66] LEVIN L A, CREED E L. Effect of temperature and food availability on reproductive responses of Streblospio benedicti (Polychaeta: Spionidae) with planktotrophic or lecithotrophic development[J]. Mar Biol, 1986, 92(1): 103-113. doi: 10.1007/BF00392752
[67] RADASHEVSKY V I, FAUCHALD K. Chaetal arrangement and homology in spionids[J]. Bull Mar Sci, 2000, 67(1): 13-23. https://www.ingentaconnect.com/content/umrsmas/bullmar/2000/00000067/00000001/art00003
[68] NEL R, COETZEE P S, NIEKERK G V. The evaluation of two treatments to reduce mud worm (Polydora hoplura Claparede) infestation in commercially reared oysters (Crassostrea gigas Thunberg)[J]. Aquaculture, 1996, 141(1): 31-39. https://www.semanticscholar.org/paper/The-evaluation-of-two-treatments-to-reduce-mud-worm-Nel-Coetzee/66572eeab0d45dd5c1d462cdce34a5eda9a763c3
[69] MORTENSEN S, MEEREN T, FOSSHAGEN A, et al. Mortality of scallop spat in cultivation, infested with tube dwelling bristle worms, Polydora sp. [J]. Aquac Int, 2000, 8(2/3): 267-271. doi: 10.1023/A:1009287706756
[70] 高燕. 才女虫生物学特征及其寄生行为的基础研究[D]. 青岛: 中国科学院海洋研究所, 2013. [71] BILBAO A, NUNEZ J, VIERA M D, et al. Control of shell-boring polychaetes in Haliotis tuberculata Coccinea (Reeve 1846) aquaculture: species identification and effectiveness of Mebendazole[J]. J Shellfish Res, 2011, 30(2): 331-336. doi: 10.2983/035.030.0219
[72] LLEONART M, HANDLINGER J, POWELL M. Treatment of spionid mud worm (Boccardia knoxi Rainer) infestation of cultured abalone[J]. Aquaculture, 2003, 217(1/2/3/4): 1-10. https://europepmc.org/article/AGR/IND23330249
-
期刊类型引用(3)
1. 杭雲娜,孙红妍,唐安琪,毛俊霞,田莹,王许波,郝振林,丁君,常亚青. Cathepsin B在感染才女虫虾夷扇贝中表达规律的研究. 大连海洋大学学报. 2025(01): 55-64 .  百度学术
百度学术
2. 曹超,黄圣洲,叶灵通,何健,王江勇,王雨. 陵水才女虫与威氏才女虫的比较和地理分布研究. 南方水产科学. 2017(01): 33-42 .  本站查看
本站查看
3. 唐彬,叶灵通,曹超,杨宝丽,王江勇. 虾夷扇贝寄生短触手才女虫的形态与组织切片观察. 南方水产科学. 2015(04): 95-101 .  本站查看
本站查看
其他类型引用(2)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
