Study on distribution of hemocyanin in different tissues of Haliotis diversicolor
-
摘要:
利用Western blotting方法对血蓝蛋白(hemocyanin)抗体浓度进行优化,进而运用免疫组化方法对杂色鲍(Haliotis diversicolor)血蓝蛋白在肝胰脏、外套膜、鳃、消化道、腹足中的分布规律进行了研究。免疫组织学检测发现血蓝蛋白在杂色鲍各组织中均有分布,其中肝胰脏、外套膜和鳃中分布较多,消化道和腹足中相对较少。
Abstract:The distribution of hemocyanin in different tissues of Haliotis diversicolor was studied by immunohistochemistry. The optimum concentration of primary antibody was evaluated by Western blotting.Hemocyanin was shown to distribute in every issue, with stronger intensity of hybridization signal in hepatopancreas, mantle and branchia than in alimentary canal and pleopod.
-
Keywords:
- Haliotis diversicolor /
- hemocyanin /
- immunohistochemistry /
- distribution
-
杂色鲍(Haliotis diversicolor)属软体动物,腹足纲[1]。作为节肢和软体动物体内的一种多功能呼吸蛋白[2],血蓝蛋白(hemocyanin)在其血液中的含量非常丰富,除氧气运输[3-4]外,还在金属离子转运、蛋白质储存、渗透压调节、蜕皮激素载体和表皮固化等方面发挥作用。近年越来越多的证据表明,它还在酚氧化酶[5-6]、细胞凝集[7-8]和抗病毒[9]等免疫反应[10]中发挥多种多样的功能。
鲍血蓝蛋白的结构单元为十聚体,是由十或十的倍数亚基围成的中空圆柱状结构,十聚体的直径约35 nm,高约18 nm[11]。血蓝蛋白亚基分为Ⅰ、Ⅱ 2个亚型,均为400 kDa,是一条包含有8个结构域的超长肽链,分别由Hc1与Hc2编码,其中每个结构域分别结合1个铜离子[12]。孔细胞(Rhogocyte)是血蓝蛋白的主要合成部位,它是一种特化的软体动物细胞类型,分散于各器官的结缔组织中[13-14];软体动物孔细胞的组成、形状和结构变化多样[14],高尔基体活跃,分泌很多囊泡[15],电镜下可见其中很多晶格状血蓝蛋白分子[16]。孔细胞的共同特点是细胞表面的“孔”结构,可能是血蓝蛋白等蛋白输出细胞的分子通道[14]。一些学者还对血蓝蛋白的组织合成部位进行了研究,发现不同种类的差异较大。头足类(Cephalopoda)动物的鳃[17]和心部件[13, 18]可能是其主要的合成代谢部位。有学者利用全组织原位杂交方法对腹足类的耳鲍(H.asinina)2个血蓝蛋白基因(HaH1和HaH2)从担轮幼虫到稚鲍的发育表达规律进行了研究[19],发现担轮幼虫、面盘幼虫时期,两基因主要在少量内脏团、头和腹足区域的间质细胞中表达,HaH1表达略早于HaH2;在稚鲍时期,腹足成为HaH1和HaH2主要表达区域,HaH1还在内脏团前中部和中肠腺底部表达,而HaH2在这些部位之间和嘴部表达,生殖细胞等其他组织中则没有检测到2种基因的mRNA。
上述研究主要报道了部分软体动物血蓝蛋白的细胞和组织来源,但血蓝蛋白作为一种重要的多功能蛋白,对其成熟的蛋白分子在动物各组织中的分布情况了解较少,进行相关研究对深入理解血蓝蛋白分子功能多样性及软体动物对于血蓝蛋白的生理适应性变化具有重要意义。此研究通过免疫组织化学技术从组织水平对血蓝蛋白在杂色鲍体内的组织定位及分布规律进行了阐述。
1. 材料与方法
1.1 试验材料
1.1.1 试验动物
采自广东省惠州市某鲍鱼养殖场的壳长0.4~0.8 cm健康杂色鲍。
1.1.2 试剂及仪器
一抗(实验室自制兔抗杂色鲍血蓝蛋白多克隆抗体[20]),AP标记的山羊抗兔IgG(Sigma),免疫组化试剂盒SP-0023(北京博奥森生物技术有限公司出品),0.22 μm PVDF杂交膜(Waterman),PageRuler Plus蛋白预染Marker(Fermentas)等。离心机(Sigma 3k30)、电泳仪(BIO-RAD)、脱水机(Leica TP 1020)、包埋机(Leica EG 1160)、切片机(Leica RM 2135)等。
1.2 试验方法
1.2.1 抗体浓度试验
划开杂色鲍腹足,取血淋巴,按1 : 1加入4×SDS Loading Buffer,涡旋振荡混匀,沸水浴加热5 min,灰度分析法计算蛋白浓度,调整上样量为10 μg后电泳。电泳结束后进行Western杂交[20],显色后拍照。
1.2.2 免疫组化
取壳长0.4~0.8 cm杂色鲍幼苗直接放入10%福尔马林固定液中,固定24 h以上。石蜡切片脱蜡复水后,PBS浸泡5 min;高压热修复法进行抗原修复;PBS洗3 min×3次;3% H2O2去离子水37 ℃孵育10 min;PBS洗3 min×3次;滴加试剂A(封闭用正常山羊血清工作液),37 ℃孵育10 min,倾倒掉,勿洗;滴加PBS稀释12 000倍的一抗工作液,4 ℃过夜,同时以PBS代替一抗作为阴性对照;将4 ℃孵育一抗过夜的切片从冰箱中拿出,室温放置约45 min;PBS洗5 min×3次;滴加试剂B(生物素化二抗工作液IgG/Bio),37 ℃孵育30 min;PBS洗5 min×3次;滴加试剂C(辣根酶标记链霉卵白素工作液S-A/HRP),37 ℃孵育30 min;PBS洗5 min×3次;使用新鲜配置的DAB显色剂显色(可在切片下放一张白纸,方便观察显色),在显微镜下观察显色效果,杂交处应为棕色,观察到杂交处与背景对比明显后将切片放入超纯水中终止显色;苏木素复染,脱水,中性树脂封片。染色后的切片采用EVOS倒置显微镜观察并拍照。
2. 结果
2.1 杂交抗体浓度的优化
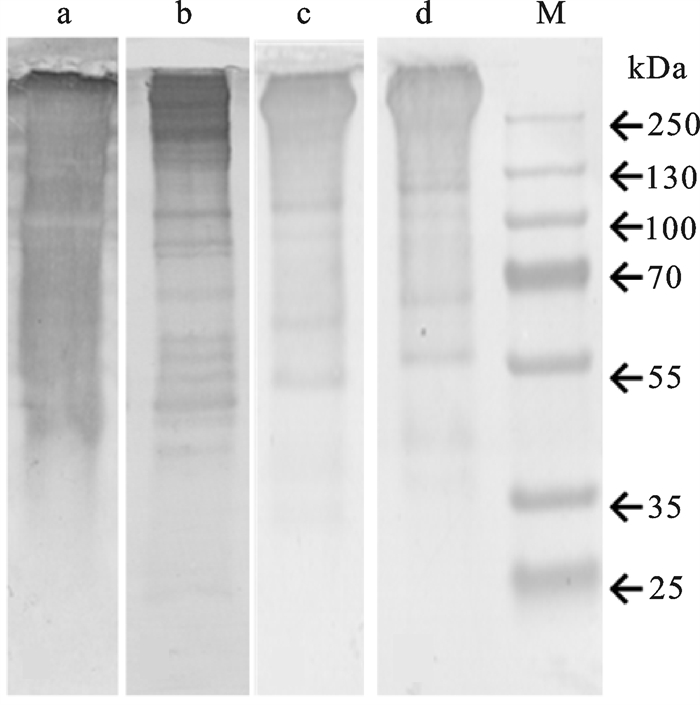
杂色鲍血淋巴中血蓝蛋白含量很高,450 kDa处的蛋白条带为完整血蓝蛋白分子,其下方为降解后的各种大小的血蓝蛋白肽段[20](图 1)。Western结果显示,在上样量一致(10 μg)的情况下一抗1 : 12 000的稀释度所见清晰条带最多;一抗稀释度为1 : 3 000时所有杂交信号连成一片,完全不能辨认出条带;一抗稀释度为1 : 40 000和1 : 80 000条件下可清晰辨认条带,但与1 : 12 000相比一些低丰度蛋白无法杂交出来。故在以后的试验中选择1 : 12 000的一抗稀释度。
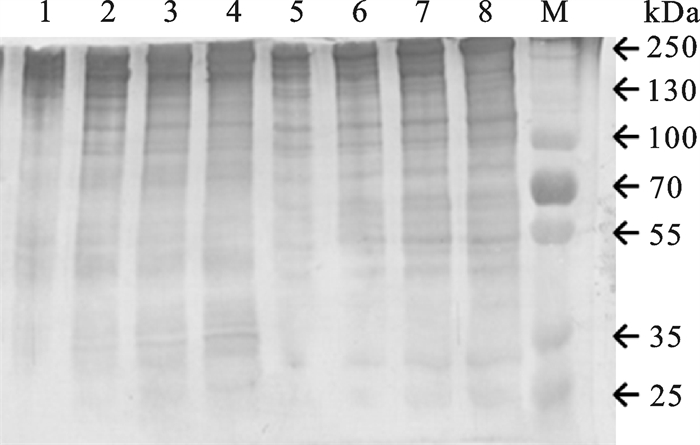
在一抗稀释度为1 : 12 000条件下,不同上样量(1 μg、2 μg、4 μg和8 μg)Western结果见图 2,不同上样量的杂交条带都比较清晰,上样量较多时低丰度蛋白条带更清晰,说明1 : 12 000的一抗稀释度适合较宽上样量范围。
2.2 血蓝蛋白的组织分布
经免疫组织化学染色的鲍各组织中均可看到黄褐色或棕色血蓝蛋白杂交信号,说明血蓝蛋白在鲍的各组织中均有分布,但杂交信号强弱不一。
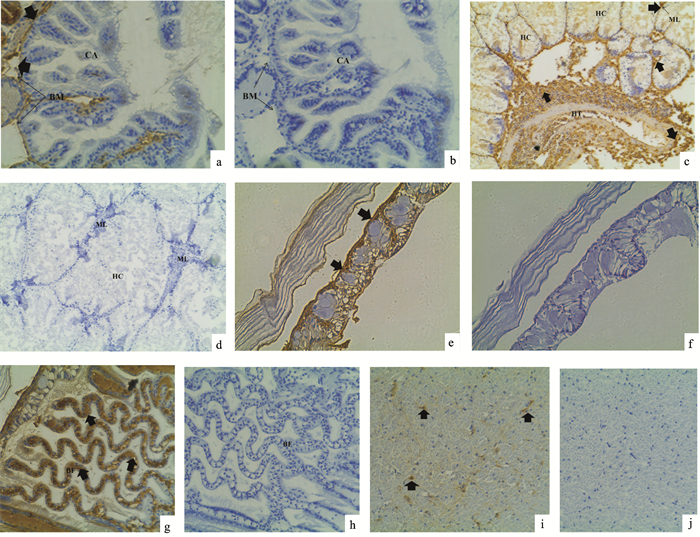
杂色鲍消化道由粘膜层、粘膜下层、肌层和基膜4个部分组成。血蓝蛋白阳性信号主要集中在消化道基膜处,而在消化道的腔面一侧几乎没有血蓝蛋白杂交信号(图 3-a、b)。
![]() 图 3 杂色鲍各组织血蓝蛋白免疫组化结果黑色箭头所指为血蓝蛋白免疫组化阳性信号;a. 消化道试验组(200×);b. 消化道对照组(200×);c. 肝胰脏试验组(400×);d. 肝胰脏对照组(400×);e. 外套膜试验组(400×);f. 外套膜对照组(400×);g. 鳃试验组(400×);h. 鳃对照组(400×);i. 腹足试验组(400×);j. 腹足对照组(400×);CA. 腔面;BM. 基膜;HT. 肝小管;HC. 肝小体;ML. 微管腔;BF. 鳃丝;Fig. 3 Immunohistochemical localization of hemocyanin in different tissues of H.diversicolorblack arrows show positive signals of hemocyanin; a. alimentary canal experimental group (200×); b. control group of alimentary canal (200×); c. experimental group of hepatopancreas (400×); d: control group of hepatopancreas (400×); e. experimental group of mantal (400×); f. control group of mantal (400×); g. experimental group of branchia (400×); h. control group of branchia (400×); i. experimental group of pleopod (400×); j. control group of pleopod (400×); CA. cavity; BM: basement membrane; HT. hepatopancreas tubules; HC. hepatopancreas corpuscle; ML. micro lumen; BF. branchial filament;
图 3 杂色鲍各组织血蓝蛋白免疫组化结果黑色箭头所指为血蓝蛋白免疫组化阳性信号;a. 消化道试验组(200×);b. 消化道对照组(200×);c. 肝胰脏试验组(400×);d. 肝胰脏对照组(400×);e. 外套膜试验组(400×);f. 外套膜对照组(400×);g. 鳃试验组(400×);h. 鳃对照组(400×);i. 腹足试验组(400×);j. 腹足对照组(400×);CA. 腔面;BM. 基膜;HT. 肝小管;HC. 肝小体;ML. 微管腔;BF. 鳃丝;Fig. 3 Immunohistochemical localization of hemocyanin in different tissues of H.diversicolorblack arrows show positive signals of hemocyanin; a. alimentary canal experimental group (200×); b. control group of alimentary canal (200×); c. experimental group of hepatopancreas (400×); d: control group of hepatopancreas (400×); e. experimental group of mantal (400×); f. control group of mantal (400×); g. experimental group of branchia (400×); h. control group of branchia (400×); i. experimental group of pleopod (400×); j. control group of pleopod (400×); CA. cavity; BM: basement membrane; HT. hepatopancreas tubules; HC. hepatopancreas corpuscle; ML. micro lumen; BF. branchial filament;杂色鲍肝胰脏由肝小管和肝小体2个部分组成。免疫组化结果显示,血蓝蛋白阳性信号主要集中在肝小管中央的管腔以及肝小体中央的微管腔,其中管腔区域的血蓝蛋白分布特别丰富,肝小体中有少量血蓝蛋白阳性信号(图 3-c、d)。
杂色鲍的外套膜包裹了整个内脏团并延伸至贝壳边缘,可分为3层:内外表皮、疏松结缔组织和肌肉纤维。外套膜有大量血蓝蛋白杂交信号,而且这些信号主要集中在外套膜边缘区域(图 3-e、f)。
杂色鲍的鳃位于外套腔内,心脏之前,以长条状的鳃轴为中心,两边分布许多排列整齐的鳃叶,呈波浪形,鳃丝由柱状上皮细胞及其围成的血腔构成。鳃丝血腔中血蓝蛋白杂交阳性信号很强,说明鳃丝血腔中有大量血蓝蛋白存在(图 3-g、h)。
杂色鲍腹足肌肉发达,从外向内由表皮、结缔组织和肌肉组成,最内层的肌纤维和致密结缔组织构成腹足的主体。免疫组化染色显示,腹足肌肉中血蓝蛋白阳性信号较少(图 3-i、j)。
3. 讨论
血蓝蛋白分子量超过400 kDa,抗原决定簇众多,由于研究所用血蓝蛋白抗体效价很高[18],且为多克隆抗体,为了降低免疫组化的假阳性,有必要对一抗使用浓度进行优化,Western杂交结果显示1 : 12 000的抗体稀释度最适合此研究。
笔者研究发现,血蓝蛋白主要存在于杂色鲍的肝胰脏、外套膜和鳃组织中。肝胰脏是杂色鲍物质合成和能量代谢最主要的器官,能够分泌大量的酶类[21]。RUTH等[22-23]认为肝胰脏是鹦鹉螺(Nautilus pompilius)血蓝蛋白的主要合成组织,也有一些学者分别用氨基酸标记法和Northern blotting法发现甲壳动物肝胰脏F-细胞是血蓝蛋白的主要合成部位[24]。由此可见,肝胰脏很可能也是杂色鲍血蓝蛋白的重要合成组织。杂色鲍的外套膜作为机体的一道重要免疫屏障,包裹了整个内脏团,延伸至贝壳的边缘,其上皮细胞间夹有大量的嗜中性和嗜酸性颗粒细胞[21],因受水流冲击较大还含有丰富的粘液细胞[25],推测贝类粘液细胞分泌的粘液与鱼类粘液具有相同作用,即免疫、防护、润滑等[26]。血蓝蛋白除具携氧功能外还具有诸如:酚氧化酶、抗菌肽、细菌凝集和抗病毒等多种免疫活性,是无脊椎动物中的一种重要的先天性免疫分子。在外套膜分布的血蓝蛋白可能主要参与了机体的免疫防御反应,从而阻挡海水等外环境中的病原等有害物质进入机体内。对欧洲鲍(H.tuberculata)外套膜的免疫组化研究也发现[13],外套膜孔细胞内集中的血蓝蛋白量要远远高于血淋巴中的含量,原位杂交也进一步证实,在这些孔细胞中含有血蓝蛋白mRNA。图 3-e显示杂色鲍外套膜的边缘区域有很多血蓝蛋白分布,上述结果与欧洲鲍的结果一致,这表明外套膜也是杂色鲍血蓝蛋白的重要合成组织。鳃作为杂色鲍的呼吸器官,主要作用是进行气体交换,其血腔中分布有大量的血淋巴,免疫组化检测到血蓝蛋白在鳃中也有大量的分布,主要集中在鳃丝的血腔中,这些阳性杂交信号很可能是血淋巴中游离的、用于气体交换的血蓝蛋白。同样利用免疫组化的技术,卢君辉等[27]发现中国明对虾(Fenneropenaeus chinensis)的鳃轴血腔和鳃丝腔内遍布血蓝蛋白阳性信号,上述证据均表明鳃是血蓝蛋白集中分布的组织。
血蓝蛋白在消化道和肌肉组织中的含量较少,其中消化道的作用是储存及消化食物,杂色鲍消化道的腔面一侧几乎没有血蓝蛋白分布,而在基膜处有杂交信号(图 3-a),主要原因可能是基膜下的薄层结缔组织中分布较多的孔细胞及血窦[28]。有研究发现中国明对虾的中肠壁纵肌层与结缔组织间隙的血窦中也有血蓝蛋白。利用电镜观察消化道结缔组织中的孔细胞,发现细胞周围的血腔中也有大量的血蓝蛋白分子[13]。由此可见,胃肠道基膜下结缔组织的血窦担负储存和运输营养物质的功能,血窦中的这些血蓝蛋白为消化道的持续蠕动提供了充足的氧气。鲍的腹足主要由肌纤维组成,较少见到孔细胞,因此腹足中血蓝蛋白分布较少。但由于鲍是开放式的循环系统,腹足中检测到的血蓝蛋白很可能是渗透的血淋巴中所携带的血蓝蛋白。
综上所述,笔者运用免疫组化方法对杂色鲍血蓝蛋白各组织的分布规律进行了研究,发现血蓝蛋白在鲍各组织中广泛分布,其中在外套膜、肝胰腺和鳃中血蓝蛋白分布较多,消化道和腹足中分布较少。血蓝蛋白是一种重要的多功能蛋白,其广泛的组织分布与其多样的生物学功能密切相关。此研究的结果可为深入了解血蓝蛋白的生物学功能以及鲍的生理学特征提供参考。
-
图 3 杂色鲍各组织血蓝蛋白免疫组化结果
黑色箭头所指为血蓝蛋白免疫组化阳性信号;a. 消化道试验组(200×);b. 消化道对照组(200×);c. 肝胰脏试验组(400×);d. 肝胰脏对照组(400×);e. 外套膜试验组(400×);f. 外套膜对照组(400×);g. 鳃试验组(400×);h. 鳃对照组(400×);i. 腹足试验组(400×);j. 腹足对照组(400×);CA. 腔面;BM. 基膜;HT. 肝小管;HC. 肝小体;ML. 微管腔;BF. 鳃丝;
Figure 3. Immunohistochemical localization of hemocyanin in different tissues of H.diversicolor
black arrows show positive signals of hemocyanin; a. alimentary canal experimental group (200×); b. control group of alimentary canal (200×); c. experimental group of hepatopancreas (400×); d: control group of hepatopancreas (400×); e. experimental group of mantal (400×); f. control group of mantal (400×); g. experimental group of branchia (400×); h. control group of branchia (400×); i. experimental group of pleopod (400×); j. control group of pleopod (400×); CA. cavity; BM: basement membrane; HT. hepatopancreas tubules; HC. hepatopancreas corpuscle; ML. micro lumen; BF. branchial filament;
-
[1] XIN Y, REN J F, LIU X. Mitogenome of the small abalone Haliotis diversicolor Reeve and phylogenetic analysis within Gastropoda[J]. Mar Genomics, 2011, 4(4): 253-262. doi: 10.1016/j.margen.2011.06.005
[2] 章跃陵, 罗芸, 彭宣宪. 血蓝蛋白功能研究新进展[J]. 海洋科学, 2007, 31(2): 77-80. doi: 10.3969/j.issn.1000-3096.2007.02.019 [3] JAENICKE E, PAIRET B, HARTMANN H, et al. Crystallization and preliminary analysis of crystals of the 24-meric hemocyanin of the emperor scorpion (Pandinus imperator)[J]. Plos ONE, 2012, 7(3): e32548. doi: 10.1371/journal.pone.0032548
[4] PANZER D, BECK C, HAHN M, et al. Water influences on the copper active site in hemocyanin[J]. J Phys Chem Lett, 2010, 1(10): 1642-1647. doi: 10.1021/jz100313q
[5] 彭文, 王江勇, 丁雪娟. 杂色鲍血蓝蛋白的分离纯化与酚氧化酶活性研究[J]. 中国水产科学, 2010, 17(1): 52-58. https://d.wanfangdata.com.cn/conference/ChxDb25mZXJlbmNlTmV3UzIwMjQxMTEzMTU1MjI0Egc3MjQ3NzE4Ggg2djgxNWVicg%3D%3D [6] 彭文, 姜敬哲, 王江勇, 等. 理化因子对杂色鲍血蓝蛋白酚氧化酶活性的影响研究[J]. 南方水产, 2010, 6(2): 1-6. doi: 10.3969/j.issn.1673-2227.2010.02.001 [7] 章跃陵, 陈俊, 林伯坤, 等. 南美白对虾血蓝蛋白血细胞凝集活性初探[J]. 汕头大学学报: 自然科学版, 2005, 20(3): 48-53. doi: 10.3969/j.issn.1001-4217.2005.03.008 [8] 章跃陵, 林伯坤, 陈俊, 等. 凡纳滨对虾血蓝蛋白的细菌凝集活性[J]. 中国水产科学, 2006, 13(6): 1006-1011. doi: 10.3321/j.issn:1005-8737.2006.06.021 [9] ZHUANG J, CAI G Q, LIN Q Y, et al. A bacteriophage-related chimeric marine virus infecting abalone[J]. Plos ONE, 2010, 5(11): e13850. doi: 10.1371/journal.pone.0013850
[10] GUO L L, ZHAO X L, ZHANG Y L, et al. Evidences of SNPs in the variable region of hemocyanin Ig-like domain in shrimp Litopenaeus vannamei[J]. Fish Shellfish Immunol, 2013, 35(5): 1532-1538. doi: 10.1016/j.fsi.2013.08.024
[11] 彭文, 王江勇. 软体动物血蓝蛋白的结构和免疫功能的研究进展[J]. 水产科学, 2011, 30(3): 182-186. doi: 10.3969/j.issn.1003-1111.2011.03.015 [12] NAGAI T, OSAKI T, KAWABATA S. Functional conversion of hemocyanin to phenoloxidase by horseshoe crab antimicrobial peptides[J]. J Biol Chem, 2001, 276: 27166-27170. doi: 10.1074/jbc.M102596200
[13] UTE A, HENNING K, GEBAUER W, et al. Rhogocytes (pore cells) as the site of hemocyanin biosynthesis in the marine gastropod Haliotis tuberculata[J]. Cell Tissue Res, 2001, 304(3): 455-462. doi: 10.1007/s004410100368
[14] SMINIA T. Structure and function of blood and connective tissue cells of the fresh water pulmonate Lymnaea stagnalis studied by electron microscopy and enzyme histochemistry[J]. Z Zellforsch, 1972, 130(4): 497-526. doi: 10.1007/BF00307004
[15] HASZPRUNAR G. The molluscan rhogocyte (pore cell, Blasenzelle, cellule nucale), and its significance for ideas on nephridial evolution[J]. Mollus Stud, 1996, 62(2): 185-211. doi: 10.1093/mollus/62.2.185
[16] SMINIA T, BOER H H. Haemocyanin production in pore cells of the freshwater snail Lymnaea stagnalis[J]. Z Zellforsch, 1973, 145(3): 443-445. doi: 10.1007/BF00307166
[17] LANG W H. cDNA cloning of the Octopus dofleini hemocyanin: sequence of the carboxyl-terminal domain[J]. Biochemistry, 1988, 27(19): 7276-7282. doi: 10.1021/bi00419a015
[18] BEUERLEIN K, SCHIMMELPFENNIG R, WESTERMANN B, et al. Cytobiological studies on hemocyanin metabolism in the branchial heart complex of the common cuttlefish Sepia officinalis (Cephalopoda, Dibranchiata)[J]. Cell Tissue Res, 1998, 292(3): 587-595. doi: 10.1007/s004410051088
[19] STREIT K, JACKSON D, BERNARD M, et al. Developmental expression of two Haliotis asinina hemocyanin isoforms[J]. Differentiation, 2005, 73(7): 341-349. doi: 10.1111/j.1432-0436.2005.00035.x
[20] 姜敬哲, 韩焘, 王江勇, 等. 杂色鲍血蓝蛋白多克隆抗体的制备与血蓝蛋白35 kDa片段鉴定[J]. 海洋科学, 2012, 36(3): 67-73. doi: 10.12677/BP.2015.53005 [21] 孙秀秀, 苏友禄, 冯娟, 等. 杂色鲍肌肉萎缩症的组织病理学研究[J]. 安徽农业科学, 2009, 37(3): 1098-1101. doi: 10.3969/j.issn.0517-6611.2009.03.082 [22] RUTH P, SCHIPP R, KLVSSENDORF B. Cytomorphology and copper content of the basal cells in the midgut gland of Nautilus (Cephalopoda, Tetrabranchiata). A contribution to the localization of hemocyanin synthesis[J]. Zoomorphology, 1988, 108(1): 1-11. doi: 10.1007/BF00312209
[23] RUTH P, BLUM W, BILLE J. Immunocytochemical reaction of a haemocyanin antibody in the midgut gland of Nautilus (Cephalopoda, Tetrabranchiata)[J]. Experientia, 1996, 52(6): 549-553. doi: 10.1007/BF01969726
[24] 潘鲁青, 金彩霞. 甲壳动物血蓝蛋白研究进展[J]. 水产学报, 2008, 32(3): 484-491. doi: 10.3724/SP.J.00001 [25] 孙虎山, 王宜艳, 王平, 等. 栉孔扇贝外套膜和鳃的粘液细胞的类型和作用[J]. 中国水产科学, 2002, 9(4): 27-30. http://qikan.cqvip.com/Qikan/Article/Detail?id=7163667&from=Qikan_Search_Index [26] 任素莲, 张艳艳, 宋微波. 文蛤(Meretrix meretrix Linnaeus)外套膜的组织学与组织化学研究[J]. 青岛海洋大学学报, 2003, 33(5): 701-706. doi: 10.3969/j.issn.1672-5174.2003.05.007 [27] 卢君辉, 邢婧, 唐小千, 等. 中国明对虾血蓝蛋白的组织器官分布特点[J]. 海洋湖沼通报, 2013, 34(2): 51-61. http://qikan.cqvip.com/Qikan/Article/Detail?id=46140814 [28] 陈志胜, 吕军仪, 吴金英. 杂色鲍急性坏死症的组织显微病理学研究[J]. 中山大学学报: 自然科学版, 1999, 38(增刊): 95-98. https://www.cqvip.com/QK/94631X/1999S1/4000771887.html



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
