Causes and countermeasures of corrosion in steel fishing vessel
-
摘要:
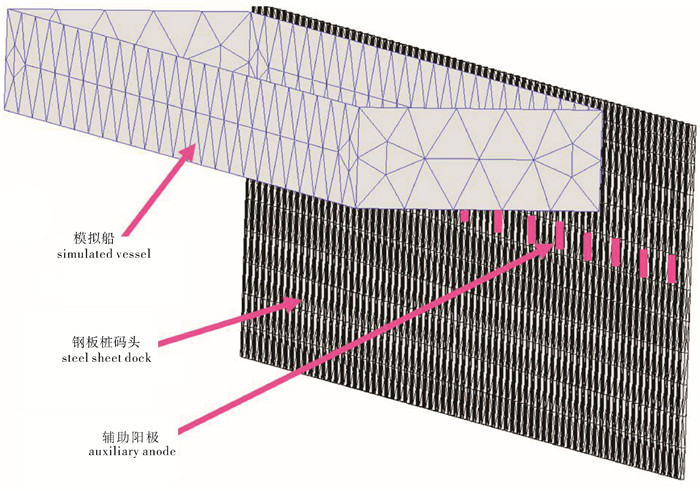
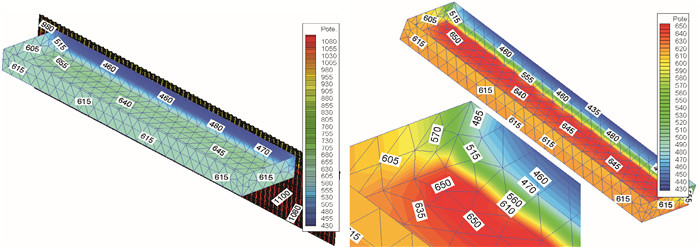
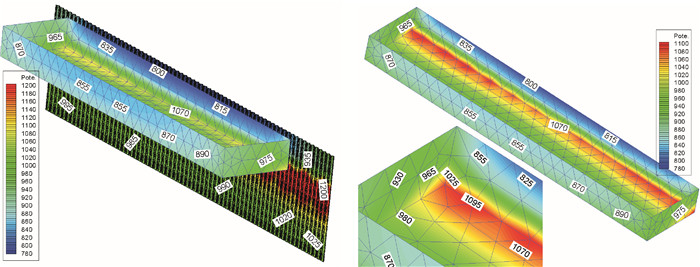
钢质渔船船体经常出现腐蚀现象,文章系统阐述了其腐蚀的原因和对策,查明了船体腐蚀主要是由电化学腐蚀引起的,其根本原因是电位梯度产生电流,通常采用涂层保护和阴极保护2种方法进行腐蚀防护。文章从工艺、安装、系统维修和经济性4个方面对阴极保护中的牺牲阳极和外加电流2种阴极保护方法进行对比。在渔船靠泊情况下,对阴极保护中外加电流保护法进行数值模拟计算,采用ANSYS软件建立海区电场计算模型,通过边界元数值计算求得海区电场的电位分布情况,进一步提出新的消除靠泊渔船电化学腐蚀的解决方案。
Abstract:We discuss the mechanism of corrosion in steel fishing vessel mainly caused by electrochemical corrosion, and the primary cause is voltage gradient producing electric current.Besides, we compare sacrificial anodes protection method and impressed current protection method in the aspects of technology, installation, system maintenance and economy.Based on the numerical simulation conducted for impressed current protection in the case of fishing vessel berthing, we establish an electrostatic field numerical model by the software ANSYS, and use boundary element method (BEM) to solve potential distribution problem.Thus, new strategies are proposed to eliminate electrochemical corrosion in berthing steel fishing vessel.
-
Keywords:
- fishing vessel /
- corrosion /
- protection /
- numerical simulation calculation
-
大伙房水库地处辽河支流浑河中上游,辽宁省抚顺市境内,位于41°47′N~41°57′N,124°05′E~124°22′E,为带状河谷型水库。东西长约35 km,最大水深37 m,最大蓄水面积114 km2,总库容21.87×109 m3。水库渔获鱼类11种,主要经济鱼类5种,为鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys nobilis)、鲤(Cyprinus carpio)、鲫(Carassius auratus)、草鱼(Ctenopharyngodon idellus)。鲢、鳙为该水库主要增殖品种,约占总量的85%。每年10月投放鱼苗40 t左右,其中鳙58%、鲢27%,规格为35~100 g·尾-1。作为中国9大重点饮用水源保护地,合理的鱼类放养捕捞既可以优化水质、维持水库生态稳定,又能创造较高的经济价值。对库区鱼类资源不同季节现存量以及分布状况的把握,可为制定增殖放养和捕捞计划提供科学依据。
由于淡水水域多采用人工增殖放养和定置网箔大规格体长鱼类选择性捕捞,传统的渔业资源调查评估方法较难实施。近年来随着渔业声学测量技术在中国推广,渔业资源声学评估方法在淡水的应用逐渐增多且收到较好效果。包括武汉东湖、长江葛洲坝、新疆塞里木湖、青海湖、辽宁清河水库、三峡水库和楠溪江等不同种类鱼类的声学资源调查和空间分布[1-7]。中国虽然在2007年编制了针对海洋调查的《渔业声学资源调查与评估》规范[8],但是由于湖泊江河相对海洋水域范围狭窄且鱼类组成各异,目前已成熟的海洋声学评估技术尚不能简单复制于淡水调查,需要针对调查水域实际情况开展研究,获得最佳的调查方法。国外淡水渔业声学研究较少,鱼种与中国差异较大,可参考的结果也较少[9-13]。
因此该研究选择春、夏、秋(冬季冰层较厚不能进行声学调查)季节,在2012年7月19~21日、9月14~16日和2013年5月12~14日分别对水库进行鱼类资源声学调查,对鱼类的回波特征、单体目标大小和分布、资源现存量和分布及主要水文参数进行分析,考察鱼类资源分布随季节和水文参数变化的规律,为确定北方水库合理的声学调查方法提供科学依据。
1. 材料与方法
1.1 调查航线和站位的设定
大伙房水库为T型交叉带状河谷型水库,综合考虑水库形状、水深分布、采样点及网箱位置等因素,声学调查采用“之”字形航线对库区(上游有网箱的区域除外)进行断面声学回波采样。水文参数采样按上、中、下游设置共计8个采样站位,分别为位于上游支流交汇处的A1、A2,位于中游断面点B1、B2、B3,以及位于两主流交汇处C1、南侧C2及北侧大坝附近的C3,图 1为7月的调查航迹线和站位分布图,其余2次调查航线与7月航线基本相同。
1.2 调查方法和数据后处理
使用多参数水质分析仪(美国YSI,6100型)在设置站位对水温、pH、溶解氧(DO)等参量进行垂直剖面测量,叶绿素a使用荧光法测量。声学调查使用小艇(长6 m,宽2.5 m)走航测量,平均航速6 kn。分裂波束科学鱼探仪(挪威Simrad,EY60型,70 kHz)的波束半功率指向全角为7°、脉冲宽度0.256 ms、发射功率300 W、脉冲收发间隔0.1 s。换能器放置于导流罩内,使用钢管悬挂固定于船弦右侧,吃水1 m。调查前用水质分析仪测量水温、盐度,计算声速和吸收系数,使用直径38.1 mm钨钢合金标准球对科学鱼探仪进行校正。使用GPS导航仪(美国Garmin,60CS型)测量位置信息,数据通过RS232接口与科学鱼探仪数据进行同步显示和保存。使用专用声学数据后处理软件Echoview 4.0(澳大利亚,Myriax)进行单体目标统计和资源评估。
1.3 鱼类资源声学评估方法
库区鱼类资源声学评估主要参考《渔业资源声学调查与评估》规范[8]中回波积分法进行。由于大伙房历年捕捞渔获物中鲢、鳙种类的比例占绝对优势(2011年鳙为52%,鲢为22%),且库区在6月~11月期间主要以定置网箔方式进行活鱼捕捞,无法提供对应声学回波的网具采样,因此现阶段暂按鳙的声学参数对整体资源量进行评估。
鳙的姿态平均目标强度(target strength,TS)与体长的关系式,使用基尔霍夫近似射线(KRM)模型计算的姿态平均TS结果[14-15]:
$$ T S_{\mathrm{a}}=21.1 \log L_{\mathrm{cm}}-67.1 $$ (1) 其中Lcm为鱼标准体长(cm)。分裂波束科学渔探仪调查时,TSa可以直接对单体回波进行检测后现场测量。
资源质量可以利用体长与体质量的拟合关系式进行换算,该研究使用鲢鳙的关系式为[14]:
$$ W=0.0167 L^{2.9806} $$ (2) 其中W表示质量(g);L为标准体长(cm)。最终在面积As(m2)内鱼类资源总质量为:
$$ W_T=A_S \sum\limits_{i=1}^k<n_i>W_i $$ (3) 其中下标i表示不同体长鱼类, < n>为单位水面的鱼类平均密度。在回波积分处理单元内,不同体长鱼类的密度为下式[15-17]:
$$ n_i=\frac{S_a}{<\mathsf{σ}_{b s}>} \frac{p_i<\mathsf{σ}_{b s}>_i}{^i\sum\limits_{i=1}^k p_i<\mathsf{σ}_{b s}>_i} $$ (4) 其中sa为回波积分值(单位水面的散射强度),p为通过单体检测并进行目标跟踪后,不同TS鱼类数量的频度值, < σbs>为姿态平均后向散射截面(与TS的线性值相等)。
在数据后处理过程中,根据库区鱼类回波分散分布以及库区狭长的地理特征,选择积分处理单元水平距离为100 m。使用Echoview软件数据处理按以下步骤进行:1)进行气泡和干涉信号等剔除;2)进行单体目标检测、跟踪和频度计算,获得不同TSa(< σbs>)频度p值;3)在积分处理单元内进行回波积分,获得积分值sa;4)利用公式(4)计算不同TS鱼类的密度(尾·m-2);5)根据公式(2)和(3)计算上、中、下游的鱼类资源体质量;6)统计库区内不同体长鱼类水平和垂直空间密度分布。
2. 结果
2.1 主要水文参数
不同季节各站位水温剖面见图 2。2013年5月和2012年7月有较明显的温跃层,5月上游6~8 m,中下游8~10 m,7月15~20 m,温跃层下的等温层水温为4~6 ℃。2012年9月15 m以深水温逐渐降低,无明显温跃层变化。表层水温5月、7月和9月别分为10~15 ℃,18~27 ℃和20~22 ℃,7月水温的下降梯度最大。
不同季节ρ(DO)剖面见图 3。ρ(DO)随深度增加而逐渐减小。7月表层ρ(DO)明显高于5月和9月。7月5 m以浅水层ρ(DO)为10~14 mg·L-1,5 m以深水层ρ(DO)随深度下降逐渐降低。5月ρ(DO)随深度变化不大,从表层至底层均维持在3~5 mg·L-1。9月15 m以浅水层ρ(DO)维持在7~10 mg·L-1,15 m之后ρ(DO)随深度下降逐渐减少。5月和9月下游ρ(DO)要低于中上游,7月上游ρ(DO)最低。其他水文参数均值:5月pH为7.71、叶绿素a质量浓度为12.09 μg·L-1、透明度为1.96 m。7月pH为8.27、叶绿素a质量浓度为27.7 μg·L-1、透明度为1.50 m。9月pH为7.62、叶绿素a质量浓度为12.06 μg·L-1,透明度为2.25 m。
大伙房水库水质呈弱碱性,pH夏季高于春秋季。受春季融冰等因素影响,5月ρ(DO)较低,7月夏季受高温、降水和径流影响,表层较高,9月蓄水后表层ρ(DO)减少。浮游植物夏季受降水径流和高日照影响呈峰值状态。7月受降水和径流影响透明度较低。
2.2 声学调查结果
2.2.1 鱼类声学回波及单体目标强度特征
不同季节鱼类回波特征见图 4~图 6。2012年7月鱼类回波密度较大,回波信号分层分布,主要集中于在0~5 m及5~15 m水层,15 m以下有分散的单体回波信号(图 4),偶尔有鱼群回波(图 4中c回波)。9月回波较7月分散,10 m以下水层有带状回波,中游区域偶尔出现鱼群,底层也有鱼类回波(图 5)。2013年5月整个水库单体回波信号较少,鱼群回波较多,主要分布在5~10 m水层,集中在中游(图 6)。
目标识别主要通过单体目标检测、不同鱼类的捕捞方式和渔获物水层分布的经验来判断。0~5 m层的TS较小(-70~-58 dB)、结合


不同季节单体目标检测结果见图 7。检测的数量,7月数量最多、9月次之、5月受鱼类集群的影响检测数量最小。7月调查TS峰值主要集中在-66~ -62 dB区域;9月调查TS主要集中分布在-64 dB附近;5月TS存在-54 dB、-48 dB和-42 dB 3个峰值。库区投放鲢、鳙鱼苗规格大于10 cm,根据公式(1)小于-46 dB的单体目标为非鲢、鳙的其他小型鱼类等。因此,在资源评估中该部分不计入资源量内。根据不同季节目标强度的频度能够反映出浮游动物数量夏季最多、秋季数量略为降低但规格增大、春季大幅度减少的特征。7月表层1~4 m为浮游动物的散射层。5~15 m水层浮游动物和鱼类混在一起。
2.2.2 鱼类资源密度和资源量
不同季节不同体长规格鱼类所对应的平均密度见图 8。2012年7月上游鱼类密度较高,9月体长大于20 cm规格鱼类下游密度高。2013年5月上、中、下游鱼类密度差异不大。因此,5月鱼类在库区分布比较均匀;7月主要集中在较浅的上、中游,下游分布较少;9月主要在较深的下游分布,上、中游较少。资源量调查结果见图 9。7月、9月和5月分别在4 634 t,1 522 t和1 012 t左右。7月由于上游调查时间进入夜间、船上灯光的诱集效果以及浮游动物和小气泡等影响,造成评估结果过大。5月由于鱼类以小型集群形式存在,单体检测较少且航线短,资源量评估偏小。9月水文环境垂直变动小,鱼类呈单体分散状态,较为适合单体目标检测和声学评估。调查结果与利用历年各龄鱼渔获尾数和最大年龄和最后一年的资源尾数的POPO(1972)方法推算的资源量结果1 513 t基本一致[16]。
2.2.3 渔业资源的垂直分布
通过对不同水层的单体目标回波检测,分析获得不同体长鱼类在不同季节的垂直分布特征,分布频度特征见图 10。5月鱼类主要集中在0~10 m水层;7月鱼类集中在5~15 m水层。体长小于50 cm的鱼类主要分布在0~15 m水层,大于50 cm的鱼类主要分布在5~15 m水层;9月鱼类主要分布于10~20 m水层,其中5~15 m水层较为集中,0~5 m水层鱼类分布密度较5月和7月少,而15 m以深水层鱼类密度较5月和7月大。
2.3 水文参数对鱼类垂直分布的影响
5月库区鱼类主要分布在0~10 m水层,即温跃层以浅水层,水温在6~12 ℃(图 2-a);7月主要集中在5~15 m的温跃层以浅水层,相比于表层较高的水温,鲢、鳙更适宜中层的水温16~21 ℃;9月主要分布在10~20 m附近水层,表层的分布少,9月水温垂直梯度变化不大(18~21 ℃)。与7月相比鱼类分布的水层范围进一步扩大(图 2-c)。不同季节的DO、pH及叶绿素a质量浓度等对鲢、鳙的分布影响不明显,受温度影响较大。
3. 讨论
该研究选取夏季、初秋和春末季节进行调查,对应库区融冰对流结束(5月)、放水(7月)和储水(9月)的水体变化过程。结合各季节主要水文参数剖面和声学调查的水平及垂直鱼类目标空间分布结果,可以获得鱼类在不同季节的行为变动规律[17-19]。该方法对研究北方冬季结冰型水库湖泊鱼类资源季节变动有较好的效果。
3.1 鱼类的垂直分布特征
对于鲢、鳙的垂直分布规律,传统的捕捞经验一般认为鲢、鳙鱼类主要分布于10 m附近的水层且较大个体分布在相对较深的水层。该研究结果显示鲢、鳙主要集中在10~15 m之间的水层,这与传统经验相吻合。而

3.2 声学调查季节的选择
秋季库区蓄水,上游径流水的影响相对夏季少,库区整体水文环境较稳定,水温随深度增加变化不是明显,声学调查结果显示,整个库区鱼类回波呈均匀分散分布,无集群现象。通过对比各季节库区水文和声学调查所得数据,再结合放苗量、渔获物抽样对2012年2~5龄资源量推算所得的结果(1 513 t,未公开),秋季进行声学调查结果1 522 t与渔获物抽样推算的资源量结果基本一致,因此大伙房水库进行声学调查的最适季节为秋季。
3.3 库区声学调查与资源量评估
根据库区狭长的地形特点,该研究声学调查采用“之”字型走航方法,其优点是可以简单避开库区内设置的定置网箔。由于调查范围相对海洋调查较小,航线的断面间隔也远小于一般海洋调查[8]。从调查结果看,夏秋季节库区内的鲢、鳙基本分布较为密集和连续,调查航线基本满足随机性和相邻航线的非相关性的声学采样要求,能够较好地反映鱼类在库区内的水平和垂直分布。由于使用较小的快艇调查,航行稳定性较差,航迹线与设计航线相比存在偏差。但是考虑到夏秋季节鱼类较均匀分布的现状,对资源量评估影响不大。
《渔业资源声学调查与评估》规范[8]要求配合网具的生物采样,用于识别鱼种和确定体长分布。由于该研究中无法进行拖网采样,参考定置网箔渔获数据进行鱼种分配。但网具的大规格鱼类选择性导致评估产生误差,今后可以使用无选择性的三重刺网进行采样,配合声学调查。大伙房鱼类种类较多,约11种,根据历年的生产,鳙占52%以上,因此资源评估模型按鳙的声学参数进行,虽有一定的偏差,但考虑到其他鱼类的体长范围较大规格鲢、鳙要小很多,对较大个体鱼类资源量评估影响较小。
淡水鱼类的TS测量相对较少[10-11],现在一般参考相近鱼类或者使用理论模型进行TS计算,影响了声学资源评估的精度[4-7],该文使用公式(1)进行其他鱼种和鲢、鳙幼鱼等的体长推算也尚不够严密,还需要在今后的工作中对不同鱼种和体长的TS进行精密测量。另外,一般水库会有植物淹没而产生的小气泡,对声学调查会有一定的影响,该研究通过连续垂直分布回波(图 4的a、b型回波)的观测进行消除[20-21]。对于气泡的自动识别还需要在将来研究。图 4和图 6中的斜线规律回波为干涉噪声,来自于小型船艇的部分材料共振,在数据后处理中消除。
声学测量技术的应用提高了淡水鱼类资源分布和资源量调查的效率,且鱼类回波数据可以长期保存,通过数据的累计和对比分析可以为揭示淡水鱼类的生态行为规律提供科学依据。
-
表 1 牺牲阳极保护和外加电流保护方法对比
Table 1 Comparison between sacrificial anodes protection and impressed current protection
牺牲阳极
sacrificial anodes protection外加电流
impressed current protection工艺对比 technical contrast 不需要外部电流,保护电流不可调 需要外部电流,输出电流连续可调 受交流电干扰,高电阻率环境不宜使用 不受环境电阻率限制 保护面积小,驱动电位低 保护面积大,驱动电位高 受环境污染影响大,本身也是污染源 环保 安装对比 installation contrast 水下安装焊接难度大,时间较长。在未获得要求的效果之前,要继续进行补充安装 易安装,安装后电流输出可以调节,能够满足额外或变化的情况 为保证阳极不脱落焊接质量要求较高,水质浑浊时,焊缝质量水下检查困难 阳极水下安装焊接工作量较少,质量容易保证,水质浑浊时同样适用 系统维修对比 service contrast 保护年限相对短,坞修时需更换阳极 保护年限相对长,可大于10年 通过潜水调查牺牲阳极,只能做到监视 管理要求较高,可通过电脑监控随时了解保护状况,能做到监视和控制 经济性对比 economic contrast 初始费用较低,但安装人工费逐年增长 初始费用较高 牺牲阳极金属价格越来越昂贵 辅助阳极材料越来越耐久,均价越来越低 -
[1] TREVELYAN J, HACK H P. Analysis of stray current corrosion problems using the boundary element method[J]. Comput Mech, 2002, 1(4): 1-10. https://xueshu.baidu.com/usercenter/paper/show?paperid=99a89e57dd1e91058305e26c747a58c9&site=xueshu_se&hitarticle=1
[2] 任厚珉, 张振邦, 梁成浩. 杂散电流对船体腐蚀影响[C]//大连国际海事技术交流会论文集第一卷. 大连: 大连海事大学出版社, 1998: 1-2. [3] 郑楚明. 钢质渔船船体腐蚀的原因及对策[J]. 实用技术, 2006(10): 37. https://xueshu.baidu.com/usercenter/paper/show?paperid=30df64c456552cdb40465140cde1ab0f&site=xueshu_se [4] 曲广善, 潘祖文, 祝国芹. 钢质渔船的腐蚀研究[J]. 大连水产学院学报, 1998, 10(2): 53-61. https://xueshu.baidu.com/usercenter/paper/show?paperid=b64063db63f94d604754a6fd7de399e6&site=xueshu_se&hitarticle=1 [5] 秦志高. 船舶腐蚀及其防腐[J]. 南通航运职业技术学院, 2008, 7(4): 68-70. doi: 10.3969/j.issn.1671-9891.2008.04.022 [6] 营恒康, 赵俊, 张文喆, 等. 船舶防腐蚀阴极保护法系统稳定性设计[J]. 设计应用, 2012, 1(5): 125-137. [7] 丁文达. 渔轮船体钢板的腐蚀及检验[J]. 中国船检, 1994(4): 36-37. https://xueshu.baidu.com/usercenter/paper/show?paperid=499c269f23f6bf92166e61cf6db87b93&site=xueshu_se&hitarticle=1 [8] 陈德福. 钢质海洋渔船的损坏腐蚀和预防措施[J]. 天津船舶, 1992(1): 27-28. https://xueshu.baidu.com/usercenter/paper/show?paperid=626146c628198458334342486856e1ea&site=xueshu_se&hitarticle=1 [9] 贝克曼W V, 施文克W, 普林兹W. 阴极保护手册[M]. 北京: 化学工业出版社, 2005: 55-156. https://xueshu.baidu.com/usercenter/paper/show?paperid=e8c86945e7f50acb1315e843094c1e0d&site=xueshu_se [10] MELCHERS R E. Mathematical modeling of the diffusion controlled phase in marine immersion corrosion of mild steel[J]. Corrosion, 2003, 45(5): 923-940. doi: 10.1016/S0010-938X(02)00208-1
[11] 王涛, 刘斌, 方志刚. 海洋工程设施和船舶防腐蚀涂料与涂装技术现状和发展趋势[J]. 上海涂料, 2012, 50(9): 26-29. doi: 10.3969/j.issn.1009-1696.2012.09.011 [12] 付治深. 钢质海船的腐蚀与阴极保护[J]. 船海工程, 2004, 161(4): 18-19. doi: 10.3963/j.issn.1671-7953.2004.04.008 [13] 念大海. 阴极保护技术应用现状分析[J]. 石油和化工设备, 2008, 7(4): 68-70. doi: 10.3969/j.issn.1674-8980.2012.11.021 [14] 杨清勇. 杂散电流腐蚀问题基础研究[D]. 大连: 大连理工大学, 2005: 10-21. 10.7666/d.y825082 [15] 孙序珂. 远洋渔船船体严重腐蚀的原因及防护[J]. 齐鲁渔业, 1998, 15(3): 44-46. [16] KESSLER R J, POWERS R G, LASA I R. Sacrificial anode cathodic protection of an underground steel reinforced concrete structure[J]. Mater Perform, 1998, 37(3): 10-13. https://www.semanticscholar.org/paper/Sacrificial-Anode-Cathodic-Protection-Of-An-Steel-Kessler-Powers/f8dde294a0db6132f469e594b9f23bf26e36526d
[17] 王璐, 黄一. 钢板桩码头靠泊船杂散电流腐蚀研究[D]. 大连: 大连理工大学, 2008: 47-59. https://www.xueweilunwen.com/doc/772739 [18] KAGAMI S, FUKAI I. Application of boundary-element method to electromagnetic field problems[J]. Microw Theory Tech, 1984, 32(4): 355-461. https://ui.adsabs.harvard.edu/abs/1984ITMTT..32..455K/abstract
[19] TANG Xiao, ZHANG Yuzhi, LIU Meng, et al. Boundary element method (BEM) analysis for galvanic corrosion of hot dip galvanized steel immersed in seawater[J]. J Mater Sci Technol, 2009, 25(2): 194-198.
[20] 于寿海. 数值模拟在阴极保护工程中应用[J]. 全面腐蚀控制, 1998(1): 15-17. [21] 刘颖, 黄一. 复杂海洋结构物防腐研究[D]. 大连: 大连理工大学, 2005: 7-12. https://www.xueweilunwen.com/doc/863748 [22] DAVID H. Cathodic protection anodes underground[J]. Mater Perform, 1989, 28(1): 1-7.
[23] 栾桂涛, 唐聪. 牺牲阳极和包覆材料联合保护在友谊港的防腐应用[J]. 中国海湾建设, 2012, 179(2): 106-109. https://www.doc88.com/p-7704792501581.html [24] LAN Zhigang, WANG Xiutong, HOU Baorong, et al. Simulation of sacrificial anode protection for steel platform using boundary element method[J]. Eng Anal Bound Elem, 2012, 36(5): 903-906. https://www.sciencedirect.com/science/article/abs/pii/S0955799711001810
[25] 唐聪, 秦铁男. 锦州港301B油品泊位钢管桩牺牲阳极阴极保护[J]. 中国海湾建设, 2012, 179(2): 127-129. https://www.fx361.cc/page/2012/0121/15802638.shtml [26] 樊华. 阴极保护监测系统在海洋石油平台上的应用[J]. 中国造船, 2012, 53(11): 489-493. https://www.doc88.com/p-9703790428868.html [27] 任志杰. 港口工程钢管桩阴极保护全寿命期方案[J]. 水运工程, 2012, 469(8): 77-81. https://cstj.cqvip.com/Qikan/Article/Detail?id=43150252&from=Qikan_Article_Detail [28] 李天. 外加电流阴极保护在港口钢结构工程的应用[J]. 全面腐蚀控制, 2008, 22(1): 44-46. https://wenku.baidu.com/view/19bca40eb7360b4c2e3f645f.html?_wkts_=1732005241110




 下载:
下载:









 粤公网安备 44010502001741号
粤公网安备 44010502001741号
