Antioxidation effects of polypeptides from intestines and gonads of sea cucumber (Apostichopus japonicus) by enzymatic hydrolyzation
-
摘要:
刺参(Apostichopus japonicus)肠和性腺是刺参加工过程中的副产物, 为丰富其高值化利用的基础理论, 研究了刺参肠、性腺酶解过程中可溶性蛋白和氨基酸态氮质量浓度变化, 分析了酶解多肽对1, 1-二苯基苦基苯肼(DPPH·)、羟基自由基(·OH)和超氧阴离子自由基(O2-·)的体外清除效果。结果显示, 刺参肠和性腺经生物酶水解后, 水解度分别为53.63%和63.40%, 酶解液中可溶性蛋白质量浓度分别为4.62 mg·mL-1和5.01 mg·mL-1, 氨基酸态氮质量浓度分别为0.43 mg·mL-1和0.56 mg·mL-1。刺参肠和刺参性腺酶解多肽清除DPPH·的半抑制质量浓度(IC50)分别为3.31 mg·mL-1和0.88 mg·mL-1, 清除·OH的IC50分别为9.53 mg·mL-1和8.81 mg·mL-1, 清除O2-·的IC50分别为6.42 mg·mL-1和3.22 mg·mL-1。刺参肠和刺参性腺酶解多肽具有一定的体外抗氧化效果, 应用前景广阔。
Abstract:Intestine and gonad of sea cucumber (Apostichopus japonicus) are by-products during its processing process.In order to utilize them better, we analyze the changes in contents of soluble protein and amino acid nitrogen during enzymatic hydrolyzation as well as study their free radical scavenging effects against 1, 1-Diphenyl-2-picrylhydrazyl radical (DPPH·), hydroxyl free radical (·OH) and superoxide anion free radical (O2-·) in vitro.Results show that the degree of hydrolysis (DH%) of intestine and gonad after enzymatic hydrolyzation are 53.63% and 63.40% respectively; the contents of soluble protein are 4.62 mg·mL-1 and 5.01 mg·mL-1, respectively; the contents of amino acid nitrogen are 0.43 mg·mL-1 and 0.56 mg·mL-1, respectively.The half maximal inhibition concentrations (IC50) of polypeptides prepared from intestine and gonad are 3.31 mg·mL-1 and 0.88 mg·mL-1 against DPPH·, respectively, 9.53 mg·mL-1 and 8.81 mg·mL-1 against ·OH, respectively, 6.42 mg·mL-1 and 3.22 mg·mL-1 against O2-·, respectively.The polypeptides from intestine and gonad of sea cucumber have remarkable antioxidation functions with good application prospects.
-
Keywords:
- Apostichopus japonicus /
- intestine /
- gonad /
- enzymatic hydrolyzation /
- polypeptide /
- antioxidation activity
-
刺参(Apostichopus japonicus)属棘皮动物门、海参纲、楯手目、刺参科、仿刺参属,具有很高的经济和营养价值,同时富含多种有益于人体健康的生理活性物质[1]。随着人民生活水平的提高和健康意识的增强,对刺参的消费需求不断增长,中国的刺参产业呈现出迅猛的发展势头[2-3]。
刺参肠、性腺是加工过程中的副产物,其中含有蛋白质、皂苷、海参多糖等营养物质和功效成分,具有较高的开发利用价值,尤其是蛋白质含量较高,是优质的多肽来源[4]。目前对海参多肽的研究多以低值海参种类为研究对象,如虎纹海参(Holothuria pervicax)[5]、海棒槌(Paracaudina chinens var.)[6]等。有关刺参肠、性腺酶解多肽的研究报道较少。该研究前期以蛋白水解度为主要指标,确立了刺参肠、性腺的高效酶解工艺[7-8],在此基础上,笔者研究了刺参肠、性腺酶解过程中可溶性蛋白和氨基酸态氮质量浓度变化,分析了酶解产物中多肽的体外抗氧化活性,以期为刺参肠、性腺的加工利用提供理论依据和技术参考。
1. 材料与方法
1.1 试验材料与主要设备
试验材料刺参肠、性腺由大连棒棰岛海产企业集团有限公司提供。中性蛋白酶(1.3×105 U ·g-1)、木瓜蛋白酶(5.0×105 U · g-1)由吉宝(青岛)生物科技有限公司提供。1, 1-二苯基苦基苯肼(DPPH ·)标准品(美国Sigma公司出品)。其他试剂,均为分析纯。
主要设备为SHA-B型恒温震荡水浴锅(常州国华电器有限公司出品);5804R型冷冻离心机(德国Eppendorf公司出品);UV-2800型紫外可见分光光度计(上海尤尼克仪器有限公司出品);旋转蒸发仪(上海爱朗仪器有限公司出品);真空冷冻干燥机(丹麦SCANLAF公司出品);Labscale研发型切向流超滤系统(美国Millipore公司出品)。
1.2 试验方法
1.2.1 刺参肠、性腺酶解液的制备
刺参肠酶解条件参照文献[7],采用中性蛋白酶与木瓜蛋白酶复配(酶活比为1.5 : 1,总酶量为3 000 U ·g-1),底物质量分数为8.0%,水解时间为2.5 h。刺参性腺酶解条件参照文献[8],采用中性蛋白酶(酶用量1 154 U · g-1),底物质量分数为10.4%,水解时间为90 min。
1.2.2 可溶性蛋白质量浓度测定[9]
取5.0 mL酶解液加入等体积的三氯乙酸(TCA)溶液(质量分数15%),静置20 min后,10 000 r · min-1离心10 min。取上清液,采用双缩脲比色法[10]测可溶性蛋白质量浓度。
1.2.3 氨基酸态氮质量浓度测定
参照GB/T 5009.39-2003[11],采用比色法测定。
1.2.4 水解度的测定
按照如下公式计算水解度:
$$ \operatorname{DH}(\%)=\frac{N_2-N_1}{N_0-N_1} \times 100 $$ 式中DH(degree of hydrolysis)为水解度;N2为酶解液中15%TCA可溶性蛋白质量浓度;N1为水解前15%TCA可溶性蛋白质量浓度;N0为总蛋白质量浓度。总蛋白质量浓度的测定采用微量凯氏定氮法[10]。
1.2.5 刺参肠、性腺酶解产物中多肽的分离
酶解液灭酶离心后添加95%乙醇至乙醇体积达到总体积的60%,4 ℃静置12 h使多糖沉淀,离心取上清液,真空浓缩除去乙醇,浓缩液过0.22 μm滤膜,采用Labscale切向流超滤系统(膜截留量10 kDa)进行过滤,渗透液真空冷冻干燥后得刺参多肽。
1.2.6 酶解多肽体外抗氧化活性分析
DPPH ·清除能力的测定参照文献[12]。羟基自由基(· OH)清除能力的测定采用Fenton体系法,以水杨酸作为Fenton试剂反应产生的· OH的捕捉剂[13]。超氧阴离子自由基(O2- ·)清除能力的测定采用邻苯三酚自氧化法[14]。
1.3 数据处理
采用SPSS 11.0进行试验数据的统计分析,试验结果以平均值±标准偏差(X±SD)表示,显著性界值以P < 0.01为非常显著,P < 0.05为显著,P>0.05为不显著。
2. 结果
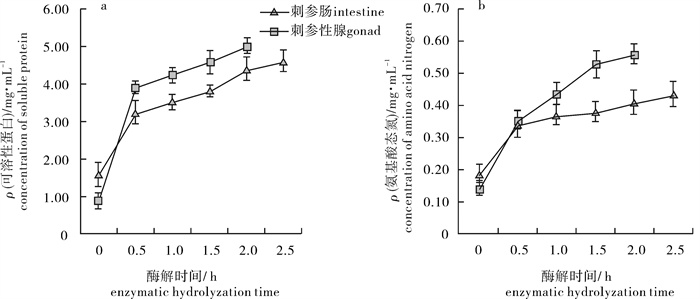
2.1 酶解过程可溶性蛋白、氨基酸态氮含量变化
刺参肠和性腺酶解过程中可溶性蛋白质量浓度均随水解时间的延长而增加,且都是在最初的0.5 h内迅速增加,之后增速变缓(图 1-a)。酶解前刺参肠和刺参性腺中可溶性蛋白的质量浓度分别为1.60 mg · mL-1和0.91 mg · mL-1,总蛋白的质量浓度分别为7.23 mg · mL-1和7.38 mg · mL-1,至酶解结束刺参肠、性腺酶解液中可溶性蛋白的质量浓度分别为4.62 mg · mL-1和5.01 mg · mL-1,对应的水解度分别为53.63%和63.40%,说明刺参肠和性腺已经得到较为充分的水解。
蛋白酶作用于肽键,往往会对特定的氨基酸残基进行水解,产生小分子氨基酸。如果氨基酸含量过高,会影响酶解产物中的多肽得率。刺参肠、性腺酶解过程中氨基酸态氮质量浓度随水解时间的变化情况见图 1-b。结果表明,刺参肠、性腺在酶解过程中均会产生一定量的氨基酸,氨基酸态氮质量浓度随水解时间的延长而增加,至水解结束其质量浓度分别为0.43 mg · mL-1和0.56 mg · mL-1。
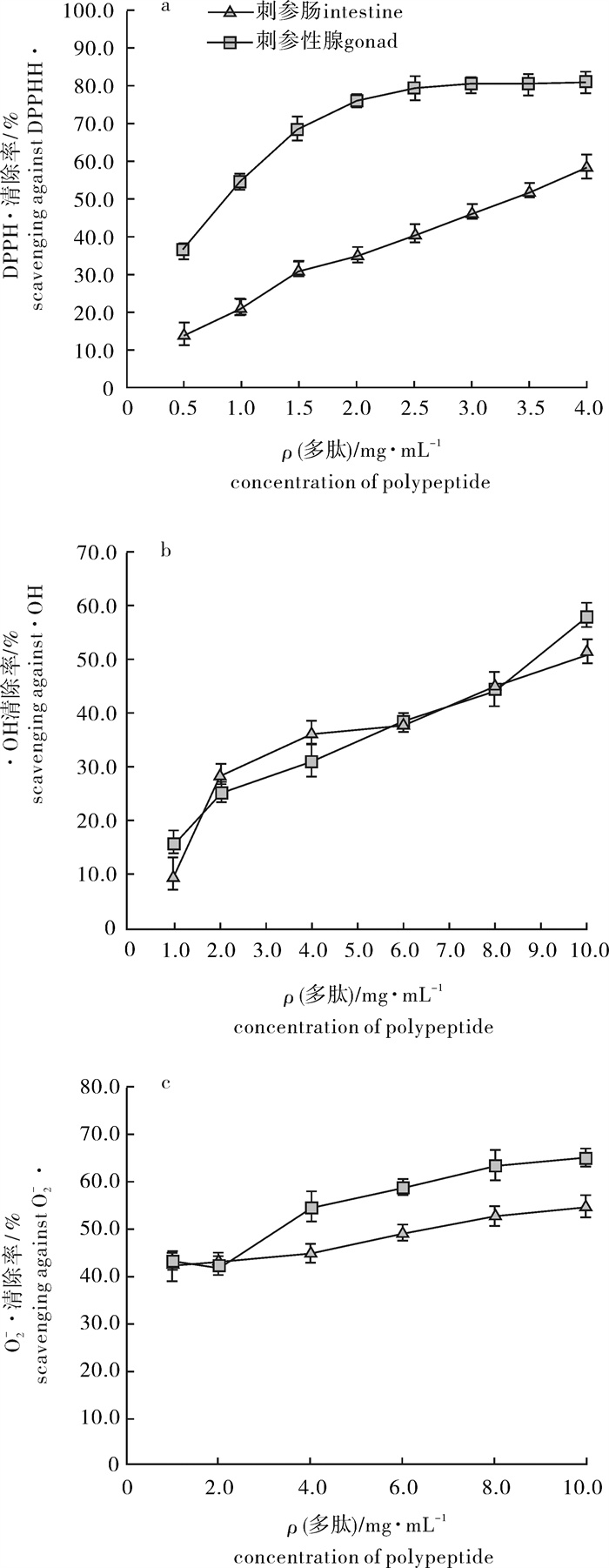
2.2 酶解多肽对DPPH·、·OH和O2-·的清除作用
多肽抗氧化能力的评价方法很多,其中体外自由基测定法因其方便、快捷等优点,被广泛用作抗氧化活性的评判指标。
DPPH·是一种稳定的有机自由基,其乙醇溶液在525 nm处具有紫红色的特征吸收峰,当溶液中加入自由基清除剂时,吸光值下降,由此评价该物质的抗氧化活性[15]。相同质量浓度下刺参性腺酶解多肽对DPPH · 的清除率明显高于刺参肠(P < 0.05)(图 2-a)。0.5~4.0 mg · mL-1范围内随着质量浓度的增大,刺参肠酶解多肽对DPPH · 的清除率几乎呈直线上升,其半抑制质量浓度(IC50)为3.31 mg · mL-1。刺参性腺酶解多肽对DPPH · 的清除率随多肽质量浓度增加呈现先快速上升,后趋于平缓的趋势;0.5~2.0 mg · mL-1范围内不同质量浓度的多肽对应的DPPH · 清除率之间具有显著性差异(P < 0.05);2.5~4.0 mg · mL-1范围内不同质量浓度的多肽对应的DPPH · 清除率间差异不显著(P>0.05),其IC50为0.88 mg · mL-1。
·OH可以引起生物细胞的氧化性损伤,被认为是毒性最强的自由基[16]。基于水杨酸可以捕获· OH生成2, 3-二羟基苯甲酸和2, 5-二羟基苯甲酸,在波长510 nm处有最大吸收的原理,采用分光光度法检测自由基清除剂对· OH的清除效果。在选取的质量浓度范围内,随多肽质量浓度的增大,酶解多肽对· OH的清除率呈上升趋势(图 2-b)。1.0~10.0 mg · mL-1范围内不同质量浓度的多肽对应的· OH清除率间具有显著性差异(P < 0.05),刺参肠和刺参性腺酶解多肽清除· OH的IC50分别为9.53 mg · mL-1和8.81 mg · mL-1。
O2- · 是活性氧的一种,在体内由过氧化物歧化酶清除,如果体内过氧化物歧化酶活力下降或O2- · 产生过量,都会对机体造成危害[17]。邻苯三酚在碱性条件下能发生自氧化,生成O2- · 和中间物,中间物又与O2- · 反应,生成有色产物且在325 nm处有最大吸收波长,因而可以依据有色中间产物生成量来判断O2- · 的生成量。自由基清除剂存在时有色产物的生成量减少,由此可测定其抗氧化活性[14]。刺参肠酶解多肽对O2- · 的清除率在1.0~4.0 mg ·mL-1内无显著性差异(P>0.05),多肽质量浓度为6.0 mg · mL-1时O2- · 清除率显著增大(P<0.05);刺参性腺酶解多肽质量浓度为1.0 mg · mL-1和2.0 mg · mL-1L时O2- · 清除率无显著性差异(P>0.05),当多肽质量浓度为4.0 mg · mL-1时O2- · 清除率显著增大(P<0.01),之后随着多肽质量浓度的上升O2- · 清除率呈增大的趋势(图 2-c)。刺参肠和刺参性腺酶解多肽清除O2- · 的IC50分别为6.42 mg ·mL-1和3.22 mg · mL-1。
3. 讨论
海洋生物富含优质蛋白,酶解后产生的多肽不仅有利于人体吸收,且具有多种生理活性,国内外学者以鱼、虾、贝等为研究对象,在生物酶法制备活性多肽方面进行了广泛研究[18-21]。近年来,海参中的活性多肽引起了科研工作者的关注,已证实具有降血压、提高免疫力、抗肿瘤、延缓衰老等多种功效[22]。
在海参多肽的抗氧化研究方面,苏永昌等[23]利用中性蛋白酶制备海地瓜(Acaudina molpadioide)多肽,发现其清除· OH和O2- · 的IC50分别为12.5 mg · mL-1和23.6 mg · mL-1;陈卉卉等[24]发现东海海参(Acaudina mobpadioides)酶解多肽清除· OH和O2- · 的IC50分别为27.8 mg · mL-1和49.3 mg · mL-1。笔者研究发现刺参肠、性腺酶解产物以刺参肠、性腺为原料制备酶解多肽,其清除· OH和O2- · 的IC50明显低于海地瓜和东海海参制备的多肽,这说明不同种类海参制备的多肽,其抗氧化作用存在差异。赵玲等[25]分析对比了刺参、大西洋海参(Holothuria coluber)、东海海参和加州拟刺参(Parastichopus californicus)4种海参多肽的抗氧化效果,研究结果也表明不同种类海参的酶解多肽对自由基的清除作用存在较大差异。目前有关海参肠、性腺多肽方面的研究报道还较少。郑杰等[26]对刺参肠自溶水解物的抗氧化活性进行了分析,发现其清除DPPH· 的IC50为4.04 mg · mL-1。笔者研究利用外源酶水解海参肠,所获多肽清除DPPH · 的IC50为3.31 mg· mL-1,这种差异可能与内源性自溶酶或外源酶制备的刺参肠多肽分子量存在差异有关。关于刺参性腺酶解产物抗氧化活性的研究尚未见报道。
不同种类海参制备的多肽在抗氧化方面的差异可能与多肽分子量、氨基酸组成及序列等多个因素有关,如刘程惠等[12]以鲜参为原料制备海参多肽,得到不同分子质量范围的酶解物,发现分子质量在1 000~3 000 U的海参肽具有较强的DPPH · 自由基的清除能力,其抗氧化效果甚至优于维生素E(VE);QIAN等[27]提出由于巯基可直接与自由基作用,因此多肽中的半胱氨酸含量对其抗氧化作用有显著影响;RAJAPAKSE等[28]认为酸性氨基酸侧链上的羧基能钝化金属离子,终止由由基链式反应,因此含酸性氨基酸的短肽具有更好的抗氧化效果。笔者研究证实了刺参肠、性腺酶解多肽具有清除DPPH ·、· OH和O2- · 等自由基的能力,为其开发利用提供了参考依据,而有关抗氧化的机制还有待进一步研究。
4. 结论
1) 刺参肠和性腺经生物酶解后,水解度分别为53.63%和63.40%;酶解液中可溶性蛋白质量浓度较高,分别为4.62 mg · mL-1和5.01 mg · mL-1;而氨基酸态氮质量浓度较低,分别为0.43 mg ·mL-1和0.56 mg · mL-1。因此,刺参肠和刺参性腺酶解液可作为优质的多肽来源。
2) 刺参肠、性腺酶解多肽清除DPPH · 的IC50分别为3.31 mg · mL-1和0.88 mg · mL-1,清除· OH的IC50分别为9.53 mg · mL-1和8.81 mg · mL-1,清除O2- · 的IC50分别为6.4 mg · mL-1和3.2 mg · mL-1,由此看出刺参肠、性腺酶解多肽具有一定的体外抗氧化效果。以刺参肠、性腺作为食品或化妆品原料,具有广阔的应用前景。
-
-
[1] 宋迪, 吉爱国, 梁浩. 刺参生物活性物质的研究进展[J]. 中国生化药物杂志, 2006, 27(5): 316-319. doi: 10.3969/j.issn.1005-1678.2006.05.019 [2] 李成林, 宋爱环, 胡炜, 等. 山东省刺参养殖产业现状分析与可持续发展对策[J]. 渔业科学进展, 2010, 31(4): 126-33. doi: 10.3969/j.issn.1000-7075.2010.04.018 [3] 隋锡林, 刘学光, 王军. 辽宁省刺参养殖现状及对若干关键问题的思考[J]. 水产科学, 2010, 29(11): 688-690. doi: 10.3969/j.issn.1003-1111.2010.11.014 [4] SUN W H, LENG K L, LIN H, et al. Analysis and evaluation of chief nutrient composition in different parts of Stichopus japonicus[J]. Chin J Animal Nutr, 2010, 22(1): 212-220. https://xueshu.baidu.com/usercenter/paper/show?paperid=55be9758bd323e5baf42fcf85b16163a&site=xueshu_se&hitarticle=1
[5] 李志英, 许喜林, 陈健. 虎纹海参多肽酶解制备工艺及抗氧化性研究[J]. 食品研究与开发, 2012, 33(6): 159-161. doi: 10.3969/j.issn.1005-6521.2012.06.045 [6] 肖枫, 曾名勇. 海棒槌胶原蛋白的酶解工艺及其产物清除自由基活性的研究[J]. 食品科学, 2006, 27(11): 336-339. doi: 10.3321/j.issn:1002-6630.2006.11.077 [7] 李冬燕, 曹荣, 刘淇, 等. 海参肠高效酶解工艺研究[J]. 湖南农业科学, 2012(3): 84-86. doi: 10.3969/j.issn.1006-060X.2012.03.024 [8] 曹荣, 刘淇, 殷邦忠. 响应面法优化海参性腺酶解工艺[J]. 食品科学, 2012, 33(2): 29-33. https://xueshu.baidu.com/usercenter/paper/show?paperid=57c5283ae2174f7235d49db2be7e0131&site=xueshu_se&hitarticle=1 [9] 檀志芬, 生庆海. 蛋白质水解度的测定方法[J]. 分析检测, 2005, 26(7): 174-175. https://xueshu.baidu.com/usercenter/paper/show?paperid=0e2736a995e6359c33784ca1851ceec7&site=xueshu_se&hitarticle=1 [10] 无锡轻工业学院, 天津轻工业学院. 食品分析[M]. 北京: 中国轻工业出版社, 1996: 75. [11] 中华人民共和国国家标准. GB/T 5009.39-2003酱油卫生标准的分析方法[S]. 北京: 中国标准出版社, 2003. [12] 刘程惠, 朱蓓薇, 董秀萍, 等. 海参酶解产物的分离及其体外抗氧化作用的研究[J]. 食品与发酵工业, 2007, 33(9): 50-53. https://xueshu.baidu.com/usercenter/paper/show?paperid=59ed9a7e03a6277880721321469b1cd2&site=xueshu_se&hitarticle=1 [13] 颜军, 苟小军, 邹全付, 等. 分光光度法测定Fenton反应产生的羟基自由基[J]. 成都大学学报: 自然科学版, 2009, 28(2): 91-93, 103. https://xueshu.baidu.com/usercenter/paper/show?paperid=eb72d39d9b435db15c2da149d0a263ce&site=xueshu_se&hitarticle=1 [14] 郭雪峰, 岳永德, 汤锋, 等. 用清除超氧阴离子自由基法评价竹叶提取物抗氧化能力[J]. 光潽学与光潽分析, 2008, 28(8): 1823-1826. https://xueshu.baidu.com/usercenter/paper/show?paperid=5489026fedb49aea0bfe762c60f9e872&site=xueshu_se&hitarticle=1 [15] 彭长连, 陈少薇, 林植芳, 等. 用清除有机自由基DPPH法评价植物抗氧化能力[J]. 生物化学与生物物理进展, 2000, 27(6): 658-661. doi: 10.3321/j.issn:1000-3282.2000.06.022 [16] 崔剑, 李兆陇, 洪啸吟. 自由基生物抗氧化与疾病[J]. 清华大学学报: 自然科学版, 2000, 40(6): 9-12. doi: 10.3321/j.issn:1000-0054.2000.06.004 [17] 许静, 解秋菊. 海参脏器多糖体外抗氧化活性研究[J]. 食品研究与开发, 2011, 32(12): 29-31. doi: 10.3969/j.issn.1005-6521.2011.12.009 [18] MENDIS E, RAJAPAKSE N, KIM S K. Antioxidant properties of a radical scavenging peptide purified from enzymatically prepared fish skin gelatin hydrolysate[J]. J Agric Food Chem, 2005, 53(3): 581-587. doi: 10.1021/jf048877v
[19] JORGE M O, FERNANDES V, SMITH J, et al. A novel antimicrobial function for a ribosomal peptide from rainbow trout skin[J]. Biochem Biophys Res Commun, 2002, 29(6): 167-171. https://xueshu.baidu.com/usercenter/paper/show?paperid=07f68f5816fed7c1dd212a0b76078b73&site=xueshu_se&hitarticle=1
[20] CHEN J Y, PAN C Y, KUO C M. cDNA sequence encoding an 11.52 kDa antibacterial peptide of the shrimp Penaeus monodon[J]. Fish Shellfish Immunol, 2004, 16(5): 659-664. doi: 10.1016/j.fsi.2003.10.006
[21] 车勇良, 孙谧, 欧阳五庆, 等. 扇贝多肽对氧化所致胸腺细胞凋亡的影响[J]. 海洋水产研究, 2004, 25(3): 33-38. https://xueshu.baidu.com/usercenter/paper/show?paperid=545a9b4d6bf3ea276b4d9675db7178af&site=xueshu_se&hitarticle=1 [22] 赵兴坤. 海参肽的功能特性及其应用[J]. 中国食物与营养, 2003(12): 31-33. https://xueshu.baidu.com/usercenter/paper/show?paperid=15000d9c6eff286854197204c18d969c&site=xueshu_se [23] 苏永昌, 刘淑集, 吴成业. 海参多肽的制备工艺优化及其抗氧化测定[J]. 福建水产, 2009(2): 6-10. https://xueshu.baidu.com/usercenter/paper/show?paperid=1j4v0xp01v3x0mf0ex3q0x20jt146533&site=xueshu_se&hitarticle=1 [24] 陈卉卉, 于平, 励建荣. 东海海参胶原蛋白多肽的制备及清除自由基功能研究[J]. 中国食品学报, 2010, 10(1): 19-25. https://xueshu.baidu.com/usercenter/paper/show?paperid=f31f00ebafb5e7d0d3d3a533035a79bb&site=xueshu_se&hitarticle=1 [25] 赵玲, 殷邦忠, 刘淇, 等. 4种海参多肽抗氧化活性的比较研究[J]. 中国海洋药物杂志, 2012, 31(2): 19-24. https://xueshu.baidu.com/usercenter/paper/show?paperid=43af0ee6766916b29337d963c30a88d8&site=xueshu_se&hitarticle=1 [26] 郑杰, 吴海涛, 朱蓓薇, 等. 海参肠自溶水解物抗氧化活性的研究[J]. 大连工业大学学报, 2011, 30(5): 313-317. https://xueshu.baidu.com/usercenter/paper/show?paperid=f167e651ad03d55be8d10cd7917f1d3b&site=xueshu_se [27] QIAN Z J, JUNG W K, KIM S K. Free radical scavenging activity of a novel antioxidative peptide purified from hydrolysate of bullfrog skin, Rana catesbeiana shaw[J]. Bioresour Technol, 2008, 99(6): 1690-1698. https://xueshu.baidu.com/usercenter/paper/show?paperid=714b8fc9df7f5ad7f7d3e9d303374583&site=xueshu_se&hitarticle=1
[28] RAJAPAKSE N, MENDIS E, JUNG W K, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Res Int, 2005, 38(2): 175-182. https://xueshu.baidu.com/usercenter/paper/show?paperid=cbc63bea90e50824047627d2c7abb5ef&site=xueshu_se
-
期刊类型引用(10)
1. 米锐,周遵春,孟楠. 海参内脏酶解物和体壁溶出物的护肤功效评价. 现代食品科技. 2023(01): 222-229 .  百度学术
百度学术
2. 刘文亮,周永波,曾荣急,单勇军,黄世英,李健. 海参内脏精深加工难点与对策. 食品工业科技. 2023(20): 458-466 .  百度学术
百度学术
3. 颜琳,姜双双,闫欣,姚艳艳,常丽荣,李长青. 皱纹盘鲍腹足抗氧化肽的制备及其工艺优化. 食品与发酵工业. 2019(17): 123-128 .  百度学术
百度学术
4. 张金杨,胡晓,李来好,杨贤庆,吴燕燕,林婉玲,邓建朝,荣辉,黄卉. 罗非鱼酶解物矿物离子结合能力及其结合物抗氧化活性. 食品与发酵工业. 2018(05): 76-81 .  百度学术
百度学术
5. 姜卉,金文刚,许景光,吴海涛,王笑涵,商文慧,韩佳润,唐越. 热变性对海参肠酶解物活性的影响. 食品工业科技. 2018(14): 29-33 .  百度学术
百度学术
6. 何传波,邵杰,魏好程,熊何健,吴国宏,马英,吴建勇. 鲍内脏蛋白肽抗氧化和免疫调节活性. 食品科学. 2018(05): 206-212 .  百度学术
百度学术
7. 吴燕燕,张婉,李来好,王锦旭,胡晓,杨少玲. 海萝藻中类菌胞素氨基酸的种类分析及抗氧化性能. 中国食品学报. 2018(05): 264-272 .  百度学术
百度学术
8. 潘南,吴靖娜,苏永昌,陈贝,苏捷,郑昇阳,刘智禹. 福建养殖仿刺参抗氧化多肽的酶解工艺优化及其对过氧化氢诱导的血管内皮细胞EA.hy926损伤的保护作用. 食品工业科技. 2018(24): 183-191 .  百度学术
百度学术
9. 杨伊然,胡晓,杨贤庆,李来好,陈胜军,吴燕燕,林婉玲,黄卉,马海霞. 蓝圆鲹蛋白酶解物的螯合矿物离子活性研究. 食品科学. 2017(03): 88-93 .  百度学术
百度学术
10. 陶海英,闫鸣艳,尹利端. 刺参内脏蛋白酶解液抗氧化活性研究. 食品研究与开发. 2015(11): 58-61 .  百度学术
百度学术
其他类型引用(12)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
