Effect of Fenpropathrin on Na+-K+-ATPase and histomorphology of Cyprinus carpio gills
-
摘要:
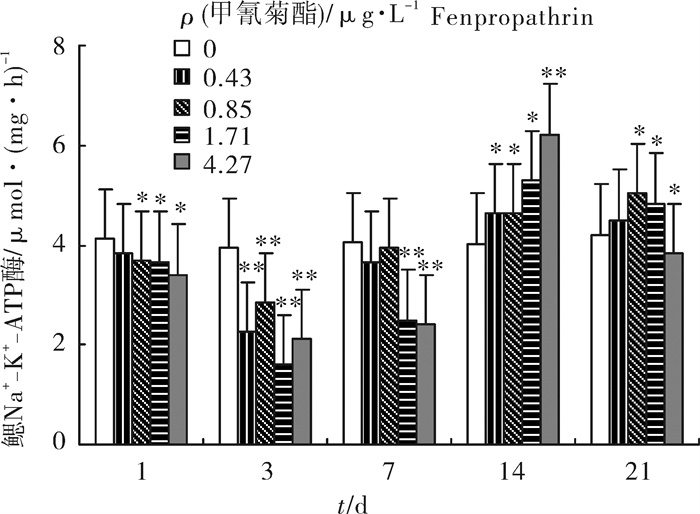
采用半静止染毒法, 探讨甲氰菊酯对鲤(Cyprinus carpio)的急性毒性和对鳃组织Na+-K+-ATP酶活性的影响及组织的病理损伤。急性毒性结果表明, 甲氰菊酯对鲤的96 h半致死质量浓度(LC50)为8.53 μg·L-1, 安全质量浓度(SC)为0.853 μg·L-1。设置1/2 96 h LC50以下的5个质量浓度0、0.43 μg·L-1、0.85 μg·L-1、1.71 μg·L-1、4.27 μg·L-1作用于鲤21 d, 分别在第1、第3、第7、第14和第21天采集组织样品进行酶活测定以及组织病理学观察。结果表明, 鳃组织中Na+-K+-ATP酶活性随着暴露时间的推移其动态变化呈先下降后上升、之后又有所回落的趋势。暴露第3天各组酶活性降至最低点, 与对照组相比差异极显著(P < 0.01), 其抑制率分别达到42.49%、27.48%、59.03%和46.31%;第14天各组酶活达最高值并显著(P < 0.05)或极显著(P < 0.01)高于对照组; 第21天除最高浓度组显著低于对照组外, 其余3组仍高于对照组。H-E染色显示, 鳃组织学损伤主要是鳃小片扭曲, 上皮细胞和柱状细胞脱落, 鳃小片毛细血管扩张充血, 粘液细胞和基部细胞增生, 严重时鳃小片粘连, 呈棍棒状病变。以上损伤具有剂量相关性和时间积累效应。
-
关键词:
- 甲氰菊酯 /
- 鲤 /
- 鳃 /
- Na+-K+-ATP酶活性 /
- 组织损伤
Abstract:The study explores the effect of Fenpropathrin on the acute toxicity and Na+-K+-ATPase activity and histopathological changes of carp (Cyprinus carpio) gills.According to the acute toxicity result, the 96 hour lethal concentration (96 h LC50) is 8.53 μg·L-1and the safe concentration (SC) is 0.853 μg·L-1.Exposed to Fenpropathrin at concentrations of 0, 0.43 μg·L-1, 0.85 μg·L-1, 1.70 μg·L-1 and 4.27 μg·L-1, the gill tissue of carp were collected at the 1st, 3rd, 7th, 14th, 21st day, respectively.Results indicate that the activities of Na+-K+-ATP enzyme in gill tissue during different exposure periods vary in a wave shape, i.e., first decrease, then increase, and decrease again as the exposing time progresses at the same concentration.The ATPase activities reach the lowest at 3rd day, which are very significantly different from the control (P < 0.01), with inhibition rates of 42.49%, 27.48%, 59.03% and 46.31%, respectively.The enzyme activities of all concentration groups reach the highest at 14th day, which are significantly (P < 0.05) or very significantly (P < 0.01) higher than that of the control. At 21st day, the enzyme activities of the highest concentration group are significantly lower than that of the control except the other 3 concentration groups.The HE staining histological changes in the gills include gill-amells distortion, epithelial cell and pillar cell shedding, blood capillary of gill-amells expanding and hyperaemia, mucilage cell and basal cell hyperplasia, sometimes even gill-amells adhesion and gill filament becoming club-shape.The damages of gill are related to concentration and effect of time accumulation.
-
Keywords:
- Fenpropathrin /
- Cyprinus carpio /
- gill /
- Na+-K+-ATPase /
- histological damage
-
甲氰菊酯(Fenpropathrin)是第三代拟除虫菊酯杀虫剂。这类药物因具有杀虫面广、药效期长、性质稳定及环境污染小等特点而被广泛使用。由于拟除虫菊酯属于高亲脂性杀虫剂,在水中能够直接进入鱼鳃和血液中,对鱼、虾等水生生物伤害严重,属于剧毒性药物[1]。但随着现代农业的发展,菊酯类杀虫剂在农业生产中的作用越来越重要,用量也越来越大。大量使用的拟除虫菊酯农药通过地表径流、雨水冲刷、土壤淋溶等途径进入水体环境,给养殖的水产经济动物造成重大损失[2-3]。另外,一些拟除虫菊酯类农药也用于鱼塘的清整和鱼类寄生虫病的治疗,由于用药不当造成的损失也时有发生。
目前针对该类农药对鱼类的毒性研究较多,但大多为急性毒性的探讨,这很难对菊酯类药物在水产养殖中的影响作出全面评价。闫海燕等[4]报道了氰戊菊酯长时间暴露对鲤(Cyprinus carpio)的抗氧化酶的影响,陈秀荣等[5-6]探讨了氰戊菊酯长时间暴露对草鱼(Ctenopharyngodon idellus)肝微粒体活性的影响和外周血红细胞的微核率。鳃是鱼类的主要呼吸器官,同时还具有排泄废物、调节渗透压等重要的生理功能[7]。Na + -K+ -ATP酶广泛存在于多种细胞质膜上,也是鳃丝细胞重要的功能膜蛋白,主要作用有维持细胞内外的Na+、K+的浓度梯度,维持细胞膜电位以及渗透压的平衡等,在细胞的渗透调节、物质吸收和跨细胞离子运动中也起着至关重要的作用[8-10]。谢文平等[11]用氯氰菊酯对草鱼作用72 h,发现鳃、肝、肾组织中的Na + -K+ -ATP酶活性均受到抑制。王朝晖等[12]用甲氰菊酯对鲢(Hypophthalmichthys molitrix)作用,认为鳃的组织病理学损伤破坏了鳃组织中的Na + -K+ -ATP酶,使其活性下降,从而破坏了鱼体的离子代谢和渗透平衡。目前该类农药对鳃组织的影响都只局限于急性效应的研究,还未发现亚急性与慢性的相关报道。为了解该类农药对鱼类的损伤机理及对鱼类的毒性,笔者做了一些尝试性的研究。文章旨在通过急性试验确定甲氰菊酯对鲤的安全质量浓度(SC)以及鱼类中毒的行为表现,并通过亚急性试验对暴露于不同质量浓度的甲氰菊酯下鲤鳃组织中Na + -K+ -ATP酶活性的变化及组织病理学观察,探讨该类药品对鱼类鳃的慢性致毒机理,为此类药物在湿地环境的安全使用提供参考。
1. 材料与方法
1.1 材料
甲氰菊酯乳油,质量分数为20%,由武汉农大生物科技有限公司提供。ATP试剂盒及考马斯亮蓝G250蛋白试剂盒均购自南京建成生物研究所。
试验用鱼购于湖北仙桃渔场,暂养2周后选取规格相近[体长(4.36±0.28)cm,体质量(2.45±0.66)g],健康活泼、体表无伤的个体进行试验。
1.2 试验方法与步骤
1.2.1 急性毒性试验
试验液药物质量浓度根据预试验结果确定急性试验的上限和下限,按等对数间距设置1个对照组及6个浓度处理组(1 μg ·L-1、2 μg · L-1、4 μg · L-1、8 μg · L-1、16 μg · L-1和32 μg · L-1)[13],均设3个平行,每组随机放入8尾鱼,共168尾鱼。试验在直径为0.8 m的水族箱中进行,有效水量为36 L。试验前禁食24 h,试验期间不喂食。每24 h半静止换药,前8 h连续观察鱼的反应情况并记录。水温(20±2)℃,溶解氧质量浓度为(5.8±0.5)mg · L-1,每天定时记录鱼的死亡情况,运用寇氏法计算96 h的半致死质量浓度(LC50)。
1.2.2 亚急性毒性试验
参照急性毒性试验求出甲氰菊酯对鲤的96 h LC50值为8.53 μg · L-1,设定1个对照组和4个浓度组(0.43 μg · L-1、0.85 μg · L-1、1.71 μg · L-1和4.27 μg · L-1),每组均设3个平行,每组15尾鱼,每天定时投食、吸便。试验采用半静止换药。水温为(20±2)℃,溶解氧质量浓度为(5.8±0.5)mg · L-1。分别在第1、第3、第7、第14和第21天随机挑选3尾鱼,迅速解剖取出鳃组织,用冰冻的生理盐水漂洗后除去多余水分,自封袋密封,-80 ℃保藏,用于酶活测定。
1.2.3 Na + -K+ -ATP酶的测定
从-80 ℃冰箱中取出组织,称质量,按质量体积比加入0.75%的生理盐水制成2%的匀浆液,3 500 r · min-1离心10 min,取上清液待测。蛋白质质量分数采用brandford法(考马斯亮蓝G250)测定,Na + -K+ -ATP酶用酶标仪测定。
1.2.4 石蜡切片制作
取新鲜鳃组织,大小在0.5 cm2以内,拭干表面的血渍后于Bouin′s液中固定,用常规梯度酒精(70%、80%、85%、95%和100%)脱水,二甲苯透明,石蜡包埋,德国Leica RM2135半自动切片机连续切片,厚度为5 μm,经苏木素-伊红染色,脱水封片后,于Nikon ECLIPSE 80i倒置显微镜下观察并拍照记录样品。
1.3 数据处理
急性毒性试验运用寇氏法计算求出LC50,SC按96 h LC50 ×0.1所得。酶活测定的所有数据采用Excel 2007和SPSS 17.0处理。
2. 结果
2.1 急性试验结果
2.1.1 甲氰菊酯中毒症状
通过观察得出,整个试验过程中对照组和最低浓度组的试验鱼未见异常,其他浓度组则有明显的中毒症状,最高浓度组在试验结束后全部死亡。试验期间,用药4 h后高浓度组的鱼体首先出现反应,主要表现为鱼体发黑、旋游、极度不安、在水体里冲撞等,随后其他各组也陆续出现上述症状。随着时间的推移,试验鱼体出现侧游、侧翻、头朝下游动、肌肉抽搐等失去平衡现象,最终反应迟钝,游动缓慢,之后沉入水底,躺卧,偶尔旋游后又躺卧在水底,随后死亡。
2.1.2 甲氰菊酯对鲤的急性效应
暴露在不同质量浓度甲氰菊酯下鲤的死亡情况如表 1。根据寇氏法可求出96 h LC50为8.53 μg · L-1。SC通过96 h LC50×0.1计算为0.853 μg · L-1。依据GB/T 21281-2007危险化学品鱼类急性毒性分级试验标准可得出,甲氰菊酯对鲤属于高毒。
表 1 鲤经甲氰菊酯半静置染毒96 h死亡情况Table 1 Mortality of carp exposed to Fenpropath for 96 hρ(甲氰菊酯)/μg·L-1
concentration of Fenpropathrin96 h死亡数/尾mortality after 96 h 死亡率/%
mortalityⅠ Ⅱ Ⅲ 0 0 0 0 0.00 1 0 0 0 0.00 2 0 0 4 16.67 4 2 1 0 12.50 8 3 3 4 41.67 16 8 7 8 95.83 32 8 8 8 100.00 2.2 亚急性毒性甲氰菊酯对鳃组织Na + -K+ -ATP酶活性的影响
甲氰菊酯暴露对鲤鳃组织Na + -K+ -ATP酶活性的影响结果趋势见图 1。甲氰菊酯的质量浓度越高,对鳃Na + -K+ -ATP酶活性的影响越大,随着时间的延长,其总体变化呈先下降后上升的趋势。暴露第3天试验组Na + -K+ -ATP酶活性降到最低值,与对照组相比差异显著(P < 0.01),其抑制率分别达到42.49%、27.48%、59.03%和46.31%。第7天酶活性有所回升,但与对照组相比,高浓度组还是呈显著抑制状态(P < 0.01)。第14天各浓度组Na + -K+ -ATP酶活性显著回升,且随着浓度的增大,活性上升幅度越大。第21天Na + -K+ -ATPase活性有所回落。
2.3 亚急性毒性甲氰菊酯对鳃组织损伤的观察
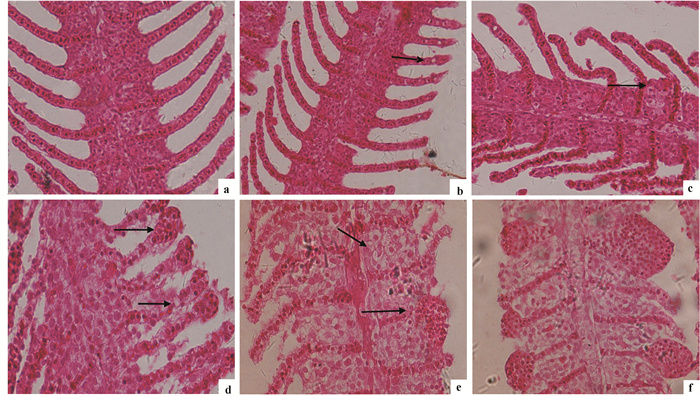
对照组的鳃小片清晰整齐,无扭曲增生现象(图 2-a)。甲氰菊酯暴露第1天,低浓度组鳃组织变化不明显,高浓度组(1.71μg · L-1和4.27 μg ·L-1)鳃小片轻微充血,4.27 μg · L-1浓度组部分支柱细胞出现空泡变性(图 2-b)。暴露第3天0.43 μg · L-1浓度组变化不明显,0.85μg · L-1和1.71 μg· L-1浓度组的鳃小片充血,且随着剂量的增大,充血也越严重。4.27 μg · L-1浓度组鳃小片扭曲,部分上皮细胞坏死脱落,基部细胞增生(图 2-c)。暴露第7天低浓度组0.43 μg · L-1鳃小片充血;0.85 μg · L-1浓度组的鳃小片细胞增生严重,末端膨大,细胞肿胀,胞质轻微疏松(图 2-d)。暴露第14天0.43 μg · L-1浓度组鳃小片基部细胞局部增生,部分上皮细胞脱落;0.85 μg · L-1浓度组细胞肿胀,胞浆透明;1.71 μg · L-1浓度组鳃小片的上皮细胞坏死严重,细胞质肿胀透明,出现水样变性(图 2-e)。暴露第21天各浓度组细胞均出现不同程度空泡,鳃小片顶端增生膨大,基部细胞增生严重,形成棍棒状病变;局部细胞出现溶解,界限不明显(图 2-f)。
![]() 图 2 暴露于甲氰菊酯后鲤鳃组织的病理变化a.空白对照组(H-E,×400);b. 4.27 μg · L-1暴露1d鳃小片支柱细胞空泡变形(H-E, ×400);c. 4.27 μg · L-1暴露3 d,鳃小片扭曲,基部增生(H-E,×400);d. 0.85 μg · L-1暴露7 d,鳃小片末端膨大,上皮细胞脱落(H-E,×400);e. 1.71μg · L-1暴露14 d,细胞肿大,水样变性(H-E,×400);f. 1.71 μg · L-1暴露21 d,鳃瓣棒状病变(H-E,×400)Fig. 2 Pathological changes of carp gills exposed to Fenpropathrina. control (H-E, ×400);b. exposed to 4.27 μg · L-1 for 1 d, pillar cell vacuolar degeneration(H-E, ×400);c. exposed to 4.27 μg · L-1 for 3 d, gill-amella warping, basal cell hyperplasia(H-E, ×400);d.exposed to 0.85 μg · L-1for 7 d, terminal gill-amella intamescentia, epithelial cell fall off(H-E, ×400);e. exposed to 1.71 μg · L-1for 14 d, cells swelling, hydropic degeneration(H-E, ×400);f.exposed to 1.71 μg · L-1for 21 d, gill-lamella club shape(H-E, ×400)
图 2 暴露于甲氰菊酯后鲤鳃组织的病理变化a.空白对照组(H-E,×400);b. 4.27 μg · L-1暴露1d鳃小片支柱细胞空泡变形(H-E, ×400);c. 4.27 μg · L-1暴露3 d,鳃小片扭曲,基部增生(H-E,×400);d. 0.85 μg · L-1暴露7 d,鳃小片末端膨大,上皮细胞脱落(H-E,×400);e. 1.71μg · L-1暴露14 d,细胞肿大,水样变性(H-E,×400);f. 1.71 μg · L-1暴露21 d,鳃瓣棒状病变(H-E,×400)Fig. 2 Pathological changes of carp gills exposed to Fenpropathrina. control (H-E, ×400);b. exposed to 4.27 μg · L-1 for 1 d, pillar cell vacuolar degeneration(H-E, ×400);c. exposed to 4.27 μg · L-1 for 3 d, gill-amella warping, basal cell hyperplasia(H-E, ×400);d.exposed to 0.85 μg · L-1for 7 d, terminal gill-amella intamescentia, epithelial cell fall off(H-E, ×400);e. exposed to 1.71 μg · L-1for 14 d, cells swelling, hydropic degeneration(H-E, ×400);f.exposed to 1.71 μg · L-1for 21 d, gill-lamella club shape(H-E, ×400)3. 分析与讨论
甲氰菊酯是带有氰基的环丙烷羧酸,是一种神经毒剂,其作用机理是通过对钠泵的干扰使神经膜动作电位的去极化期延长,且氰基可与机体中带正电荷的基团结合,从而使毒性增强[14]。有研究表明甲氰菊酯对黄鳝(Monopterus albus)的96 h LC50为6.55 μg · L-1,对泥鳅(Misgurnus anguillicaudatus)的96 h LC50为38.02 μg · L-1,对尼罗罗非鱼(Tilapia nilotica)的96 h LC50为5.90 μg · L-1[15-17],属于剧毒级。试验中甲氰菊酯对鲤的96 h LC50为8.53 μg · L-1,同属于剧毒级。至于不同文献中LC50的差异在急性毒性试验中很正常,因为LC50不仅与试验动物种类有关,还与环境如水温、溶氧、pH以及性别、个体大小的差异等均有关系[18],故评价药物的毒性或安全性还须根据其他毒理性指标综合评价。
黄鳝、泥鳅、尼罗罗非鱼、斑马鱼(Danio rerio)甲氰菊酯中毒后都表现为抽搐、狂游等神经中毒症状[15-17],鲤初期中毒也表现出侧翻、头朝下游动,肌肉抽搐等失去平衡的现象,最终反应迟钝,沉入水底躺卧,偶尔旋游,随后死亡,是典型的神经中毒症状。
Na + -K+ -ATP酶,也称钠泵,广泛存在于真核生物细胞膜上的跨膜蛋白,是细胞能量转换的重要系统[19]。Na + -K+ -ATP酶与膜上磷脂的结合状态可影响膜的其他功能,因此其可作为评价污染压力的生物学指标。拟除虫菊酯类杀虫剂的作用靶标主要是神经膜上的钠离子通道和维持膜内外离子浓度稳定的Na + -K+ -ATP酶、Ca2+ -ATP酶和Ca2+ -Mg2+ -ATP酶等,且目前已证实,无论在细胞离体还是活体条件下菊酯类农药都能对ATP酶产生抑制作用[20-21]。王朝晖等[12]用甲氰菊酯作用于鲢,鳃组织中Na + -K+ -ATP酶也呈抑制趋势,认为组织病理学损伤造成了Na + -K+ -ATP酶活性的降低。笔者试验对鳃组织Na + -K+ -ATP酶活性的测定结果显示,前3 d甲氰菊酯对鲤鳃组织Na + -K+ -ATP酶活性呈极显著的抑制作用,但随着暴露时间的延长,Na + -K+ -ATP酶活性又逐渐上升,第21天除最高浓度组呈显著抑制状态外,其余仍高于对照组,这和病理学观察结果似乎不太一致,即在组织细胞损伤较严重时,酶活性反而上升,这可能是机体一种适应环境的代偿反应。甲氰菊酯暴露初期直接破坏了酶的构象,使其活性下降,接着鳃组织发生一系列的损伤和抗损伤反应,其中包括细胞的变性、坏死和增生等。虽然鳃小片上皮细胞的坏死脱落会造成部分膜功能的丧失,但在药物的持续刺激下,鱼体可通过自我调节以适应病理条件下的生存,比如伴随着鳃组织的增生,原有机能会产生亢进的现象;通过增加鳃氯细胞的密度和相应的Na + -K+ -ATP酶活性来维持体内的离子平衡[22]等,这可能是Na + -K+ -ATP酶后期活性升高的原因之一。当然,对于Na + -K+ -ATP酶在不同病理状况下是否需要其他物质的参与和协调,遵循怎样的信号通路,是怎样驱使机体处于自稳态与外界不断进行着物质和能量交换以适应不同环境的生理要求还需更加深入的研究。
甲氰菊酯属于高亲脂性杀虫剂,即使在水中浓度很低,鱼体也有较高的吸收率,且在水中可以直接进入鱼鳃,破坏Na + -K+ -ATP酶系统,引起细胞的离子跨膜运转障碍,能量代谢和物质代谢紊乱以及胞浆内Ca2+的聚集,导致细胞形态和结构的异常,甚至细胞凋亡[23]。通过切片观察,甲氰菊酯对鲤鳃组织学损伤主要为鳃小片扭曲,上皮细胞和柱状细胞脱落,鳃小片毛细血管扩张充血,粘液细胞和基部细胞增生,胞浆疏松透明,鳃小片顶端增生膨大,严重时鳃小片粘连呈棍棒状等。鳃小片末端及基部细胞的增生现象是其对未受损伤的组织抵御外界刺激的一种保护反应,是致炎因子长期作用或组织变质分解产物的刺激结果,增生虽然可使原有机能产生亢进,但同时细胞层的加厚减少了氧吸收的有效面积,必然影响鳃的呼吸、分泌、排泄等功能,造成鱼类呼吸困难等[24]。笔者试验中病理损伤具有剂量相关性和时间积累效应。
笔者试验表明,安全质量浓度只是相对的。1/2 SC(0.43 μg · L-1)连续暴露3 d即对鲤鳃的Na + -K+ -ATP酶活性有极显著的抑制作用,并且呈现组织病理变化,提示在养殖水体中要严格控制甲氰菊酯的污染;使用甲氰菊酯杀灭鱼类寄生虫时,严格按剂量使用,使用后食用鱼上市要严格遵循休药制度;对用甲氰菊酯毒鱼,破坏环境等行为应坚决禁止。
-
图 2 暴露于甲氰菊酯后鲤鳃组织的病理变化
a.空白对照组(H-E,×400);b. 4.27 μg · L-1暴露1d鳃小片支柱细胞空泡变形(H-E, ×400);c. 4.27 μg · L-1暴露3 d,鳃小片扭曲,基部增生(H-E,×400);d. 0.85 μg · L-1暴露7 d,鳃小片末端膨大,上皮细胞脱落(H-E,×400);e. 1.71μg · L-1暴露14 d,细胞肿大,水样变性(H-E,×400);f. 1.71 μg · L-1暴露21 d,鳃瓣棒状病变(H-E,×400)
Figure 2. Pathological changes of carp gills exposed to Fenpropathrin
a. control (H-E, ×400);b. exposed to 4.27 μg · L-1 for 1 d, pillar cell vacuolar degeneration(H-E, ×400);c. exposed to 4.27 μg · L-1 for 3 d, gill-amella warping, basal cell hyperplasia(H-E, ×400);d.exposed to 0.85 μg · L-1for 7 d, terminal gill-amella intamescentia, epithelial cell fall off(H-E, ×400);e. exposed to 1.71 μg · L-1for 14 d, cells swelling, hydropic degeneration(H-E, ×400);f.exposed to 1.71 μg · L-1for 21 d, gill-lamella club shape(H-E, ×400)
表 1 鲤经甲氰菊酯半静置染毒96 h死亡情况
Table 1 Mortality of carp exposed to Fenpropath for 96 h
ρ(甲氰菊酯)/μg·L-1
concentration of Fenpropathrin96 h死亡数/尾mortality after 96 h 死亡率/%
mortalityⅠ Ⅱ Ⅲ 0 0 0 0 0.00 1 0 0 0 0.00 2 0 0 4 16.67 4 2 1 0 12.50 8 3 3 4 41.67 16 8 7 8 95.83 32 8 8 8 100.00 -
[1] 张征, 李今, 梁威, 等. 拟除虫菊酯杀虫剂对水生态系统的毒性作用[J]. 长江流域资源与环境, 2006, 15(1): 125-129. doi: 10.3969/j.issn.1004-8227.2006.01.025 [2] 秦文秀, 颜冬云, 王春光, 等. 拟除虫菊酯在底泥中的归趋及其生物效应[J]. 土壤, 2011, 43(5): 703- 709. https://xueshu.baidu.com/usercenter/paper/show?paperid=67fd5e8dc199979a852aca52b242484c&site=xueshu_se&hitarticle=1 [3] 王朝晖, 尹伊伟, 林小涛, 等. 拟除虫菊酯农药对水生态系统的生态毒理学研究综述[J]. 暨南大学学报: 自然科学版, 2000, 21(3): 65- 89. https://xueshu.baidu.com/usercenter/paper/show?paperid=110m0rc0me190th0w1320pa0cm418092&site=xueshu_se&hitarticle=1 [4] 闫海燕, 曾令兵, 罗宇良, 等. 氰戊菊酯对鲤SOD活性和MDA含量以及肝肾细胞形态的影响[J]. 华中农业大学学报, 2012, 31(4): 499-505. doi: 10.3969/j.issn.1000-2421.2012.04.019 [5] 陈秀荣, 罗宇良, 曾令兵, 等. 氰戊菊酯对草鱼肝微粒体CYP3A活性的影响[J]. 华中农业大学学报, 2010, 29(6): 768-771. https://xueshu.baidu.com/usercenter/paper/show?paperid=e25f6d7609c16b1320d098cbdc572b70&site=xueshu_se&hitarticle=1 [6] 陈秀荣, 罗宇良, 顾泽茂, 等. 氰戊菊酯对理科鱼类致突变效应的研究[J]. 淡水渔业, 2010, 40(1): 21-25. doi: 10.3969/j.issn.1000-6907.2010.01.004 [7] 孟庆闻, 缪学祖, 俞泰济, 等. 鱼类学[M]. 上海: 上海科学技术出版社, 1987: 87-90. [8] 徐文琳. Na+ -K+ ATPase研究进展[ J]. 国外医学·生理、病理科学与临床分册, 2003, 23(5): 531-534. https://xueshu.baidu.com/usercenter/paper/show?paperid=170x0ar0ms4202f02u2n0cr0cw645207&site=xueshu_se&hitarticle=1 [9] 徐立红, 张甬元, 陈宜瑜. 分子毒理学的研究进展及其在水环境保护中的意义[J]. 水生生物学报, 1995, 19(2): 171-185. doi: 10.3321/j.issn:1000-3207.1995.02.011 [10] TOWLE D W. Role of Na+-K+ATPase in ionic regulation by marine and estuarine animals[J]. Mar Biol Lett, 1981, 2 (1): 1072-1221.
[11] 谢文平, 朱新平, 陈昆慈等. 氯氰菊酯对草鱼鳃组织Na+/K+-ATP酶活性及肝、鳃超显微结构的影响[J]. 中国水产科学, 2009, 16(1): 120-126. doi: 10.3321/j.issn:1005-8737.2009.01.017 [12] 王朝晖, 尹伊伟. 甲氰菊酯对白鲢(Hypophthalmichthys molitrix)鳃组织病理学研究[J]. 暨南大学学报: 自然科学版, 1996, 17(1): 74-79. https://xueshu.baidu.com/usercenter/paper/show?paperid=79687b32b87ae11f4b16cb5c4e112156&site=xueshu_se&hitarticle=1 [13] 王心如. 毒理学基础[M]. 4版. 北京: 人民卫生出版社, 2003: 103-111. [14] SODERLUND D M, CLARK J M, SHEETS L P, et al. Mechanisms of pyrethroid neurotoxicity: implications for cumulative risk assessment[J]. Toxicology, 2002, 171(1): 3-59. doi: 10.1016/S0300-483X(01)00569-8
[15] 林曙, 余曙明, 陈开健, 等. 甲氰菊酯对黄鳝的急性毒性实验[J]. 水利渔业, 2005, 25(3): 77-78. doi: 10.3969/j.issn.1003-1278.2005.03.036 [16] 黄辨非. 甲氰菊酯对泥鳅的急性毒性试验[J]. 淡水渔业, 1998, 28(5): 20-22. doi: 10.3969/j.issn.1000-6907.1998.05.008 [17] 谭娟, 尚蕾, 肖雅元. 甲氰菊酯对尼罗罗非鱼组织乙酰胆碱酯酶、谷丙转氨酶和谷胱甘肽活性的影响[J]. 淡水渔业, 2011, 41(3): 39-42. doi: 10.3969/j.issn.1000-6907.2011.03.007 [18] 高平, 陈昌福, 胡琼予, 等. 不同条件下高效氯氰菊酯对鲫的急性毒性研究[J]. 淡水渔业, 2007, 37(2): 48-52. doi: 10.3969/j.issn.1000-6907.2007.02.013 [19] EINER-BOBIS G. The sodium pump. Its molecular properties and mechanics of ion transport[J]. Eur J Biochem, 2002, 269(10): 2424-2243. doi: 10.1046/j.1432-1033.2002.02909.x
[20] NARAHASHU T. Neuronal ion channels as the target sites of insecticides[J]. Pharmacol Toxicol, 1996, 79: 1-14. doi: 10.1111/j.1600-0773.1996.tb00234.x
[21] KAKKO I, TOIMELA T, TÄHTI H. The synaptosomal membrane bound ATPase as target for the neurotoxic effects pyrethriods, permethrin and cypermethrin[J]. Chemosphere, 2003, 51(6): 425-480.
[22] KARNAKY K J Jr., ERNST S A, PHILPOTT C W. Teleost chloride cell. Ⅰ. response of pupfish Cyprindon varieatrus gill Na, K-ATPase and chloride cell fine structure to various high salinity environments[ J]. Cell Biol, 1976, 70(1): 144. doi: 10.1083/jcb.70.1.144
[23] VAGUE P, COSTE T C, JANNOT M F, et al. Cpeptide, Na+-K-ATPase and Diabetes[ J]. Exp Diabesity Res, 2004, 5(1): 37-50.
[24] 刘振荣. 水产动物病理学[M]. 厦门: 厦门大学出版社, 2009: 25-27. -
期刊类型引用(8)
1. 郭晏汝,丁丽花,葛家春,张曹旸,刘茂松. 河蟹在三种清塘剂下的生长、耐缺氧能力和趋避行为. 水产学杂志. 2023(01): 65-71 .  百度学术
百度学术
2. 刘昊宇,郑友,丁淑燕,刘国兴,史杨白,孙龙生. 溴氰菊酯对河川沙塘鳢的毒性效应研究. 水产养殖. 2022(06): 27-32 .  百度学术
百度学术
3. 陈旭,王一福,周胜杰,于刚,杨蕊,马振华. 低温胁迫下甘草对尖吻鲈幼鱼血清和肝脏免疫酶及鳃Na~+-K~+-ATP酶活性的影响. 中国渔业质量与标准. 2020(05): 18-24 .  百度学术
百度学术
4. 王玥鑫,张立钢,安晶晶,马明,刘宁. 胰岛素样生长因子-Ⅰ对乙酰水杨酸诱导小肠上皮细胞损伤的修复作用. 食品科学. 2019(11): 182-187 .  百度学术
百度学术
5. 常静,李海平,周晓榕. 5种杀虫剂对3个种群马铃薯桃蚜ATPase的抑制作用. 农药. 2017(09): 692-695 .  百度学术
百度学术
6. 张新铖,朱新平,刘毅辉,洪孝友,黄俭城,曾敏玲. 甲苯咪唑、溴氰菊酯和硫酸铜对美洲鲥的急性毒性研究. 南方水产科学. 2015(02): 66-71 .  本站查看
本站查看
7. 吴楠,魏华,沈竑,徐克怀,陈金民. 溴氰菊酯对克氏原螯虾肌肉组织的毒性研究. 水产学报. 2015(09): 1412-1421 .  百度学术
百度学术
8. 叶乐,赵旺,吴开畅. 3种抗寄生虫药对方斑东风螺稚螺的急性毒性试验. 南方水产科学. 2014(04): 22-26 .  本站查看
本站查看
其他类型引用(4)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
