Isolation and identification of lipid-producing microalgae and effect of different trophic modes on its oil accumulation
-
摘要:
为了获得高产油微藻, 以从海南水体样本中分离得到微藻C67为出发株, 考察其在不同营养方式下生长及油脂积累情况。形态观察及Lsu(large subunit)基因分析鉴定其为微芒藻C67(Micractinium reisseri C67);微芒藻C67主要脂肪酸为C18:1、C16:0、C18:3和C18:2, 分别占总脂肪酸的33%、26%、18%和11%;微芒藻C67在混合营养方式下藻体质量浓度及油脂质量分数明显高于自养与异养方式, 在以葡萄糖为碳源的混合营养方式下微芒藻藻体质量浓度最高(7.0 g·L-1), 以甘氨酸(Gly)为碳源的混合营养方式下微芒藻C67油脂质量分数最高(40.2%), 以葡萄糖为碳源的混合营养方式下微芒藻C67总脂质量浓度为2.2 g·L-1, 分别是自养和异养方式的7.3倍和7.9倍。
Abstract:The freshwater microalga, strain C67, was isolated from a freshwater lake in Hainan and selected as a high lipid producer. The biomass productivity and lipid content of the microalgal strain were analyzed under different trophic cultivation modes including autophototrophic, mixotrophic and heterotrophic cultivations. The strain was tentatively identified as Micractinium reisseri C67 based on microscopic examination and Lsu (large subunit) rDNA sequence analysis. Major fatty acids in the microalgae were C18:1, C16:0, C18:3 and C18:2, comprising 33%, 26%, 18% and 11% of the total fatty acids, respectively. The biomass productivity and lipid content of M.reisseri C67 under mixotrophic cultivation were higher than those of under autotrophic and heterotrophic cultivations. The maximum biomass productivity (7.0 g·L-1) and the maximum lipid content (40.2%) of M.reisseri C67 were achieved under mixotrophic cultivation with glucose and glycine (Gly), respectively. The lipid productivity of M.reisseri C67 was 2.2 g·L-1, 7.3 and 7.9 folds of those obtained under autophototrophic and heterotrophic conditions, respectively.
-
Keywords:
- microalgae /
- fatty acid /
- large subunit /
- trophic mode
-
随着世界经济的发展和人口的快速增长,油脂与人类的关系越来越密切,无论是作为保健食品或是制备生物柴油,油脂都起着至关重要的作用。以高等植物、动物为原材料获取油脂已经不能满足人们日常生活及工业生产的需要[1]。微藻由于其光合效率高、生长速率快、不占用耕地、易于实现大规模工业化生产等优势而成为开发油脂的新途径,利用微藻生产油脂已成为目前研究的热点[2-4]。自然界藻类种类繁多,其中微藻资源尤为丰富。获得易于规模化培养、生长速度快和油脂产量高的藻种是利用微藻生产油脂的前提条件。国外分离和筛选产油微藻的工作起步较早,1978年美国就针对高产油微藻进行过藻种的筛选(水生生物物种计划),筛选出300多株产油微藻,成功证明了藻类物种作为油脂来源的可行性[5];从1990年到2000年,日本启动了一项名为“地球研究更新技术计划”的项目,分离出了上万株微藻[6]。中国微藻生物能源方向的首个“973”计划项目“微藻能源规模化制备的科学基础”于2011年正式启动,但产油微藻的研究还处于初始阶段,尤其是大规模的藻种筛选。微藻细胞能够利用二氧化碳(CO2)进行光合自养生长,在培养液碳源充足的条件下部分微藻可以在有光照情况下利用有机和无机碳源进行混合营养生长或是在无光照条件下异养生长,兼养和异养已经成为一种快速、大量培养微藻的有效方法[7]。笔者研究从海南热带湖泊和海洋近海中分离微藻,分析其产油脂能力和油脂成分,研究其在自养、混合营养和异养的方式下生长和油脂积累情况,以期为产油微藻的工业化应用提供参考。
1. 材料与方法
1.1 材料与设备
试验所用藻种为笔者实验室分离得到,水样采自于海南海口和儋州,在BG-11(淡水)和F/2(海水)固体平板培养基上采用平板涂布法筛选,经过反复的纯化直到显微镜检无菌为止。
光照细胞培养器(Labfors-3,瑞士Infors公司出品);光照摇床(Minitron,瑞士Infors公司出品);毛细管气相色谱-质谱联用仪(HP6890/5973MSD,美国Hewlett-Packark公司出品);显微镜(Olympus IX71,日本奥林巴斯公司出品);紫外可见分光光度计(TU-1810,中国普析通用公司出品);高速冷冻离心机(CR22GⅡ,日本日立公司出品)。
1.2 培养基及培养条件
微藻的培养采用以下2种方式:1)光照细胞培养器,培养基为BG-11(淡水)和F/2(海水)液体培养基,高温灭菌冷却后按体积分数为10%接种,生长条件设定为温度26 ℃,搅拌速度300 r · min-1,植物生长灯连续光照,光照强度为10 000 lx,通入无菌空气,通气压力为1.6 bar;2)光照摇床培养,培养基为BG-11液体培养基,以10%体积分数接种子于2 000 mL三角瓶中,三角瓶中装1 000 mL经高温灭菌后培养液,置于光照摇床里,生长条件设定为温度26 ℃,100 r · min-1,连续光照,光照强度为4 000 lx。培养结束后离心收集藻液,冻干后藻粉保存于-20 ℃冰箱。
1.3 微芒藻C67 DNA的提取、PCR扩增及序列分析
取藻粉0.1 g,按DNA提取试剂盒(康为世纪植物基因组提取试剂盒)说明书所述提取DNA,Lsu区域扩增引物采用真核生物通用扩增引物[8]:上游5′-AGCGGAGGAAAAGAAACTA-3′,下游5′-TACTAGAAGGTTCGATTAGTC-3′。PCR扩增体系为模板DNA 2 μL,Taq DNA聚合酶0.4 μL,引物各2 μL,dNTP 4 μL,10×buffer 5 μL,补加灭菌蒸馏水至总体积50 μL。PCR反应条件为95 ℃预变性5 min进入循环,95 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸10 min。PCR产物经电泳检测后送上海生工公司测序。用BLAST软件对获得的基因序列的同源性进行分析,从NCBI下载同源序列,用Clustal X2.0软件进行多序列对齐排列,用MEGA 5.0以邻位相连法构建系统发育树。
1.4 微藻油脂含量测定及成分分析
1.4.1 油脂含量测定
参照LUYEN等[9]总脂测定方法并稍加改进,称取光照细胞培养器培养收获的藻粉0.1 g,加入V(氯仿) : V(甲醇) : V(水)为1 : 2 : 1的混合液20 mL,50 ℃超声提取15 min,然后加入V(氯仿) : V(水)为1 : 1的混合液10 mL,50 ℃超声提取15 min,取氯仿层于旋转蒸发器上蒸干,得到微藻油在50 ℃下干燥至恒质量,计算出油率,3个平行试验,取平均值。按照下面公式计算油脂质量分数和总脂质量浓度:
$$ \begin{array}{l} \;\;\;\;\text{油脂质量分数}(\% ) = ({m_1}/0.1) \times 100\\ \;\;\;\;\text{总脂质量浓度}(g \cdot {{\rm{L}}^{{\rm{ - 1}}}}) = \text{微藻藻体质量浓度} \times \\ \text{油脂质量分数} \end{array} $$ 式中m1表示0.1 g藻粉提取所得到的油脂质量(g);微藻藻体质量浓度(g · L-1)为单位体积培养液所收获的微藻量。
1.4.2 微芒藻C67样品甲酯化及气相色谱柱条件
称取光照细胞培养器培养收获的微芒藻C67藻粉0.5 g,加入0.5 mol · L-1的氢氧化钠-甲醇溶液5 mL,震荡混合10 min,60 ℃水浴10 min,待溶液冷却后加入1%硫酸甲醇溶液8 mL,震荡混合10 min,50 ℃水浴10 min,依次加入2 mL水和3 mL正己烷,分层后收集上层溶液(正己烷),重复萃取1次,合并正己烷溶液,氮吹仪浓缩至1 mL,密封保存待检测。气相色谱柱条件为石英毛细管柱HP-FFAP(30 m×0.25 mm,0.25 μm),程序升温为从160 ℃开始,以6 ℃ · min-1升到250 ℃,保持5 min;载气为氦(He),柱流量1.0 mL · min-1,进样口温度250 ℃,分流比50 : 1。质谱条件为EI源;电离电压70 eV,离子源温度230 ℃,扫描范围10~500 aum,进样量1.0 μL。
1.5 营养方式对微芒藻C67生长及油脂产量的影响
微芒藻C67的培养在3种营养方式下进行:1)光合自养(BG-11基本培养基,光照);2)混合营养(BG-11基本培养基,葡萄糖、蔗糖、Gly和乙酸钠,最终有效碳质量浓度均为2 g · L-1,光照);3)异养(BG-11基本培养基,质量浓度20 g · L-1的葡萄糖,黑暗)。试验均采用摇床培养,设2组平行试验,培养周期为12 d,培养过程中每天测定光密度(OD680 nm),离心收集第12天的藻液,冻干后测定干质量及总脂质量分数。
2. 结果与分析
2.1 产油微藻的分离和鉴定
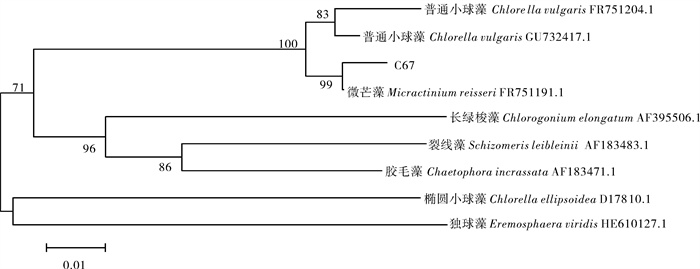
从水样中共分离得到微藻30株,挑选其中生长状态较好的微藻,采用光照细胞培养器培养,油脂质量分数测定结果见表 1。C67号藻种藻体质量浓度最大,油脂质量分数最高,分别为3.75 g · L-1和35.5%,总脂质量浓度为1.33 g · L-1,因此选取C67作为试验的出发藻株。经显微镜观察,该藻体绿色,细胞卵圆形(图 1),初步鉴定该藻可能属于栅藻科(Scenedesmaceae)。用Lsu通用引物对该藻株基因组DNA进行PCR扩增,得到长度为840 bp的Lsu基因片段,通过BLAST软件对微藻Lsu基因片段进行同源性分析,该序列与NCBI数据库中微芒藻(Micractinium reisseri FR751191.1)的28S部分序列同源性最高,相似度为99%。下载相关序列,利用MEGA构建进化树(图 2)。结合形态及分子鉴定结果,确定该微藻为微芒藻C67(M.reisseri C67)。
表 1 微藻的藻体质量浓度、油脂质量分数和总脂质量浓度Table 1 Biomass productivity, lipid content and lipid productivity of microalgal strains藻株
microalgal strain藻体质量浓度/g·L-1
biomass productivity油脂质量分数/%
lipid content总脂质量浓度/g·L-1
lipid productivityC67 3.75 35.5 1.33 C24 1.69 28.8 0.49 C59 2.30 20.5 0.47 C86 2.75 21.9 0.60 B19 1.50 15.8 0.24 B28 2.10 31.6 0.66 B31 0.61 27.2 0.17 B49 2.90 25.6 0.74 2.2 微芒藻C67油脂成分分析
微芒藻C67脂肪酸组成见表 2。此次试验共检测出10种脂肪酸,主要为十八碳脂肪酸,占总脂肪酸的62%,另外检测出极少量的烷烃和烯烃。其中饱和脂肪酸占总量的34.5%,以C16:0为主,其占总脂肪酸含量的26%,另外含有5%的C17:0,以及少量的C14:0、C15:0、C24:0和C26:0;单不饱和脂肪酸占总量的33.5%,主要为C18:1,其占总脂肪酸含量的33%,另外含有0.5%的C20:1;多不饱和脂肪酸占总量的29%,主要是C18:2和C18:3,分别占总含量的11%和18%。
表 2 微芒藻C67脂肪酸组成Table 2 Fatty acids composition (percent of total fatty acids) of M.reisseri C67脂肪酸
fatty acid相对比例/%
fatty acid composition饱和脂肪酸saturated fatty acids (SFA) 14:0 2.0 15:0 1.0 16:0 26.0 17:0 5.0 24:0 0.5 26:0 1.0 单不饱和脂肪酸monounsaturated fatty acids (MUFA) 18:1 n-9 33.0 20:1 n-11 0.5 多不饱和脂肪酸polyunsaturated fatty acids (PUFA) 18:2 n-6 11.0 18:3 n-3 18.0 其他other 2.0 总共total 100.0 2.3 营养方式对微芒藻C67生长及油脂产量的影响
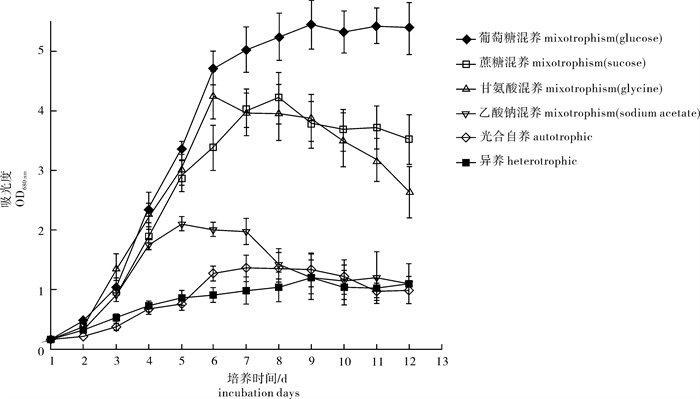
微芒藻C67在不同营养方式下的生长曲线见图 3。混合营养方式下微芒藻C67生长状况明显好于自养方式和异养方式。微芒藻C67在以葡萄糖、Gly和蔗糖为碳源的混合营养方式下生长速率有明显提升,其中以葡萄糖影响最为显著,微芒藻C67在接种第2天后进入指数生长期,第6天后生长减缓,随后进入静止期; 以乙酸钠为碳源则影响相对较小,微芒藻C67在经过2 d的指数期后生长减缓,随后便迅速衰退。异养方式下微芒藻C67生长情况与自养方式下差别较小。不同营养方式下微芒藻C67藻体质量浓度和油脂质量分数也有明显差异(表 3)。微芒藻C67最终藻体质量浓度与其生长状况基本保持一致,混合营养方式下微芒藻C67藻体质量浓度明显高于自养方式和异养方式。微芒藻C67在以葡萄糖为碳源的混合营养方式下藻体质量浓度最高(7.0 g · L-1),分别为自养方式和异养方式的7倍和5.8倍。微芒藻C67在以Gly为碳源的混合营养方式下油脂质量分数最高(40.2%),分别为自养方式和异养方式的1.6倍和1.5倍。微芒藻C67在以葡萄糖为碳源的混合营养方式下总脂质量浓度最高(2.2 g · L-1),分别是自养和异养的7.3倍和6.9倍。微芒藻C67异养能力较差,其在异养状况下藻体质量浓度和油脂质量分数略高于自养。微芒藻C67最适合的营养方式为添加少量的葡萄糖或Gly下的混合营养模式。
表 3 不同营养方式下微芒藻C67细胞生物量、油脂质量分数和总脂质量浓度Table 3 Biomass productivity, lipid content and lipid productivity of M.reisseri C67 in different trophic modes碳源
carbon source藻体质量浓度/g·L-1
biomass productivity油脂质量分数/%
lipid content总脂质量浓度/g·L-1
lipid productivity葡萄糖glucose 7.0 31.9 2.2 蔗糖sucrose 3.4 30.7 1.0 甘氨酸Gly 3.3 40.2 1.3 乙酸钠sodium acetate 1.6 33.8 0.5 自养autotrophic 1.0 25.6 0.3 异养heterotrophic 1.2 27.0 0.32 3. 讨论
相对于传统油料作物,微藻具有明显的优势,微藻不仅是生物柴油生产的理想原料,在食品领域也得到了广泛应用,一些微藻不仅油脂含量高,且油脂中含有较高比例的DHA、EPA等高附加值脂肪酸[10-11]。硅藻(Amphiprora hyalina)中EPA含量占总脂肪酸含量的30%,甲藻(Gymnodinium sp.)中DHA含量占总脂肪酸含量的32%[12]。从自然界中分离微藻已经成为获得优良藻种的重要手段,国内外开展了大量关于高产油微藻的筛选工作,其中部分高油脂产率微藻具有较大的应用潜力,经过培养优化或基因改造后有望作为工业产油藻株[13-15]。MOAZAMI等[16]从波斯湾分离出一株拟微绿球藻(Nannochloropsis sp.),在自养培养状况下其藻体质量浓度和油脂质量分数高达50 g · L-1和52%。MATSUNAGA等[17]分离得到一株海水栅藻(Scenedesmus sp.),其在未添加营养元素的人工海水培养基中油脂质量分数高达73%。美国Martek公司筛选出硅藻(Nitzschia alba)和隐甲藻(Crythecodinium cohnii),硅藻的EPA最终产率为0.25 g · (L · d)-1,隐甲藻的DHA的产率为1.2 g · (L · d)-1[18]。
目前关于微芒藻(M.reisseri)产油情况的报道较少,国内外研究较多的为同属微芒藻(M.pusillum),辜博等[19]从海南分离得到微芒藻(M.reisseri Y-002),并研究其在缺氮情况下添加醋酸钠对其自养生长和油脂积累的影响,发现额外添加15 mmol · L-1的醋酸钠比未添加时生物量提高51%,油脂含量提高10倍。笔者研究分离筛选得到微藻株C67,经形态观察及分子鉴定为微芒藻C67(M.reisseri C67),藻体质量浓度和油脂质量分数分别为3.75 g · L-1和35.5%,均高于ABOU-SHANAB等[20]分离得到微芒藻(M.reisseri YSW07);脂肪酸成分分析可知,微芒藻C67主要脂肪酸为C18:1和C16:0,分别占总脂肪酸的33%和26%,与同属的M.reisseri YSW07相差较大;初步试验结果显示,M.reisseri C67最佳培养方式为添加葡萄糖的混合营养,且混合营养方式下其生长状况明显高于异养和自养方式,这一结果与BOUARAB等[21]研究类似。由于生产成本的限制,微芒藻的工业化应用还有较长的路要走,如何在提高培养效率的情况下降低其生产成本将是今后研究的重点。
-
表 1 微藻的藻体质量浓度、油脂质量分数和总脂质量浓度
Table 1 Biomass productivity, lipid content and lipid productivity of microalgal strains
藻株
microalgal strain藻体质量浓度/g·L-1
biomass productivity油脂质量分数/%
lipid content总脂质量浓度/g·L-1
lipid productivityC67 3.75 35.5 1.33 C24 1.69 28.8 0.49 C59 2.30 20.5 0.47 C86 2.75 21.9 0.60 B19 1.50 15.8 0.24 B28 2.10 31.6 0.66 B31 0.61 27.2 0.17 B49 2.90 25.6 0.74 表 2 微芒藻C67脂肪酸组成
Table 2 Fatty acids composition (percent of total fatty acids) of M.reisseri C67
脂肪酸
fatty acid相对比例/%
fatty acid composition饱和脂肪酸saturated fatty acids (SFA) 14:0 2.0 15:0 1.0 16:0 26.0 17:0 5.0 24:0 0.5 26:0 1.0 单不饱和脂肪酸monounsaturated fatty acids (MUFA) 18:1 n-9 33.0 20:1 n-11 0.5 多不饱和脂肪酸polyunsaturated fatty acids (PUFA) 18:2 n-6 11.0 18:3 n-3 18.0 其他other 2.0 总共total 100.0 表 3 不同营养方式下微芒藻C67细胞生物量、油脂质量分数和总脂质量浓度
Table 3 Biomass productivity, lipid content and lipid productivity of M.reisseri C67 in different trophic modes
碳源
carbon source藻体质量浓度/g·L-1
biomass productivity油脂质量分数/%
lipid content总脂质量浓度/g·L-1
lipid productivity葡萄糖glucose 7.0 31.9 2.2 蔗糖sucrose 3.4 30.7 1.0 甘氨酸Gly 3.3 40.2 1.3 乙酸钠sodium acetate 1.6 33.8 0.5 自养autotrophic 1.0 25.6 0.3 异养heterotrophic 1.2 27.0 0.32 -
[1] 宋东辉, 侯李君, 施定基. 生物柴油原料资源高油脂微藻的开发利用[J]. 生物工程学报, 2008, 24(3): 341-348. doi: 10.3321/j.issn:1000-3061.2008.03.001 [2] 王蒙, 李纯厚, 戴明. 以海洋微藻为原料提取生物燃料的研究进展与发展趋势[J]. 南方水产, 2009, 5(1): 74-80. https://xueshu.baidu.com/usercenter/paper/show?paperid=08b602d28088cd49a34a17dfd96bade4&site=xueshu_se&hitarticle=1 [3] 姜进举, 苗凤萍, 冯大伟, 等. 微藻生物柴油技术的研究现状及展望[J]. 中国生物工程杂志, 2010, 30(2): 134-140. https://xueshu.baidu.com/usercenter/paper/show?paperid=2199e7df74e17c123bb83215e1673feb&site=xueshu_se&hitarticle=1 [4] CHISITI Y. Biodiesel from microalgae beats bioethanol[J]. Trends Biotechnol, 2008, 26(3): 126-131. doi: 10.1016/j.tibtech.2007.12.002
[5] SHEEHAN J, DUNAHAY T, BENEMANN J, et al. A look back at the U.S. Department of Energy's aquatic species program: biodiesel from algae[R]//Close-Out report. Report number NREL/TP-580-24190. Golden, Colorado, U.S. A: National Renewable Energy Lab, Department of Energy; 1998.
[6] 李元广, 谭天伟, 黄英明. 微藻生物柴油产业化技术中的若干科学问题及其分析[J]. 中国基础科学: 工业生物技术专刊, 2009(5): 64-70. doi: 10.3969/j.issn.1009-2412.2009.05.013 [7] XU H, MIAO X L, WU Q Y. High quality biodiesel production from a microalga Chlorella protothecoides by heterotrophic growth in fermenters[J]. J Biotechnol, 2006, 126(4): 499-507. doi: 10.1016/j.jbiotec.2006.05.002
[8] ABOU-SHANAB R A I, MATTER I A, KIM S N, et al. Characterization and identification of lipid-producing microalgae species isolated from a freshwater lake[J]. Biomass Bioenerg, 2011, 35(7): 1-7. https://xueshu.baidu.com/usercenter/paper/show?paperid=558c40bf9f68eeea483f180a8079887c&site=xueshu_se&hitarticle=1
[9] LUYEN H Q, CHO J Y, SHIN H W, et al. Microalgal growth enhancement by levoglucosan isolated from the green seaweed Monostroma nitidum[J]. J Appl Phycol, 2007, 19(2): 175-180. doi: 10.1007/s10811-006-9123-x
[10] 陈梅, 唐运来. 高油脂产量微藻的选育方法及研究进展[J]. 安徽农业科学, 2012, 40(24): 12196-12198. doi: 10.3969/j.issn.0517-6611.2012.24.096 [11] 孙协军, 王珍, 李秀霞. 三种微藻油脂肪酸组成和理化性质分析[J]. 食品科学, 2012, 33(16): 212-215. https://xueshu.baidu.com/usercenter/paper/show?paperid=40c8f3eb2a9b12d7679d2b5233081f32&site=xueshu_se&hitarticle=1 [12] 梁英, 麦康森. 微藻EPA和DHA的研究现状及前景[J]. 水产学报, 2000, 24(3): 289-296. https://xueshu.baidu.com/usercenter/paper/show?paperid=72fdd3bfa799fa47408aecd23c0ba173&site=xueshu_se&hitarticle=1 [13] 周晓琴, 苏翔, 王涛, 等. 微藻生物柴油在国内外的研究[J]. 重庆工商大学学报: 自然科学版, 2012, 29(6): 79-84. doi: 10.3969/j.issn.1672-058X.2012.06.016 [14] 许进, 徐旭东, 方仙桃, 等. 高产油小球藻的筛选及油脂分析[J]. 水生生物学报, 2012, 36(3): 426-432. https://xueshu.baidu.com/usercenter/paper/show?paperid=cdd5abb097b2e7b5c6bc3fee64369ee6&site=xueshu_se&hitarticle=1 [15] 黄雄超, 朱荣丽. 利用海洋微藻制备生物柴油的研究进展[J]. 海洋科学, 2012, 36(1): 108-116. https://xueshu.baidu.com/usercenter/paper/show?paperid=ba9c13d9930937af1d77c558bff2b548&site=xueshu_se&hitarticle=1 [16] MOAZAMI N, RANJBAR R, ASHORI A, et al. Biomass and lipid productivities of marine microalgae isolated from the Persian Gulf and the Qenshm Island[J]. Biomass Bioenerg, 2011, 35(5): 1935-1939. doi: 10.1016/j.biombioe.2011.01.039
[17] MATSUNAGA T, MATSUMOTO M, MAEDA Y, et al. Characterization of marine microalga, Scenedesmus sp. strain JPCC GA0024 toward biofuel production[J]. Biotechnol Lett, 2009, 31(9): 1367-1372. doi: 10.1007/s10529-009-0029-y
[18] 古绍彬, 虞龙, 向砥, 等. 利用海洋微藻生产DHA和EPA的研究现状及前景[J]. 中国水产科学, 2011, 8(3): 90-93. https://xueshu.baidu.com/usercenter/paper/show?paperid=e764699f20de57f85f3e12db3a438e2f&site=xueshu_se&hitarticle=1 [19] 辜博, 费晓雯, 胡文新, 等. 营养元素限制对微芒藻Y-002油脂积累的影响[J]. 热带作物学报, 2011, 32(5): 789-795. doi: 10.3969/j.issn.1000-2561.2011.05.003. [20] ABOU-SHANAB R A I, HWANG J H, CHO Y, et al. Characterization of microalgal species isolated from fresh water bodies as a potential source for biodiesel production[J]. Appl Energ, 2011, 88(10): 3300-3306. doi: 10.1016/j.apenergy.2011.01.060
[21] BOUARAB L, DAUTA A, LOUDIKI M. Heterotrophic and mixotrophic growth of Micractinium pusillum Fresenius in the presence of acetate and glucose: effect of light and acetate gradient concentration[J]. Water Res, 2004, 38(11): 2706-2712. doi: 10.1016/j.watres.2004.03.021
-
期刊类型引用(8)
1. 荣辉,邓建朝,陈胜军,杨贤庆,艾红,闫帅,江睿,章丽萍. 二十二碳六烯酸标准样品的研制. 化学分析计量. 2023(11): 1-6+15 .  百度学术
百度学术
2. 王天强,周林宗,王紫荆,王江鹏,王子敬,张伟,田海燕. 富油微藻分离鉴定技术研究进展. 云南化工. 2020(07): 22-25+27 .  百度学术
百度学术
3. 荣辉,吴兵兵,杨贤庆,李来好,陈胜军,吴燕燕,郝淑贤,胡晓. 天然抗氧化剂对裂壶藻油氧化稳定性影响的研究. 中国油脂. 2018(07): 23-26+31 .  百度学术
百度学术
4. 王朋云. 莆田南日岛泥东风螺的形态、DNA条形码和同工酶初步分析. 渔业研究. 2017(04): 249-263 .  百度学术
百度学术
5. 荣辉,吴兵兵,杨贤庆,李来好,胡晓. 水酶法提取生物油脂的研究进展. 食品工业科技. 2017(02): 374-378 .  百度学术
百度学术
6. 荣辉,吴兵兵,杨贤庆,李来好,邓建朝,李春生. 高速逆流色谱分离纯化脂肪酸的研究进展. 食品工业科技. 2017(13): 319-323 .  百度学术
百度学术
7. 吴兵兵,荣辉,杨贤庆,李来好,戚勃,马海霞,杨少玲. 两步酶法提取裂壶藻油的工艺优化. 食品工业科技. 2017(24): 84-88+94 .  百度学术
百度学术
8. 杨贤庆,武琼,胡晓,李来好,吴燕燕,林婉玲,黄卉. 微藻综合加工利用研究进展. 食品工业科技. 2015(10): 360-364 .  百度学术
百度学术
其他类型引用(6)



 下载:
下载:

 粤公网安备 44010502001741号
粤公网安备 44010502001741号
