Effects of temperature and irradiance on early development of Grateloupia livida
-
摘要:
舌状蜈蚣藻(Grateloupia livida)是一种具有较高应用价值的红藻。文章研究了不同的温度(15 ℃、20 ℃、25 ℃和30 ℃)和光照强度(500 lx、2500 lx、5 000 lx和10 000 lx)对舌状蜈蚣藻早期发育的影响。试验结果表明, 舌状蜈蚣藻适合果孢子发育为盘状体的条件为温度25 ℃、光照5 000 lx。果孢子在25~30 ℃条件下首先形成盘状体, 15 ℃下形成最慢; 盘状体在25 ℃首先长出直立枝, 其次是20 ℃、15 ℃和30 ℃。果孢子在5 000~10 000 lx的光照强度下首先形成盘状体, 2 500 lx次之; 在盘状体发育过程中较高光强可以促进盘状体的生长发育, 低光强培养条件显著抑制了盘状体的生长发育。
Abstract:Grateloupia livida is a kind of commercial and scientific red alga with potential value in nutraceuticals and pharmaceuticals. We investigate the early development of G.livida at different temperatures (15 ℃, 20 ℃, 25 ℃ and 30 ℃) and light intensities (500 lx, 2 500 lx, 5 000 lx and 10 000 lx). The results show that the optimal conditions for the development of carpospores are temperature 25 ℃ and illumination 5 000 lx. The discoid crusts form were firstly at 25~30 ℃ and lastly at 15 ℃. Seedings cultured from discoid crusts were firstly observed at 25 ℃, then at 20 ℃, 15 ℃ and 30 ℃. The discoid crusts form firstly at 5 000~10 000 lx and then at 2 500 lx. In conclusion, high light intensity significantly accelerates the growth and development of discoid crusts. Low light intensity of 500 lx retards the growth and development of discoid crusts of G.livida.
-
Keywords:
- Grateloupia livida /
- carpospore /
- discoid crust /
- temperature /
- light intensity
-
舌状蜈蚣藻(Grateloupia livida)隶属于红藻门、隐丝藻目、海膜科、蜈蚣藻属,是暖温带性海藻。主要生长在高潮带附近的岩礁、低潮带的石沼及海水养殖时的筏架和绠绳上。主要分布于东亚、东南亚及印度洋国家,在中国北方及南方都有分布[1]。舌状蜈蚣藻具有重要的药用、食用及生态学价值,在中国一直被作为中药材之一。舌状蜈蚣藻中含有糖类、脂类、多萜类、舌状蜈蚣藻氨酸、蜈蚣藻氨酸、牛磺酸、维生素及微量元素等多种化学成分,在抗病毒、抗炎、抗癌、抗凝血等多方面都具有重要作用[2-7]。舌状蜈蚣藻既是喂养鲍鱼的替用饵料,也是提取卡拉胶的原料[8-9]。研究表明,同一属的蜈蚣藻(G.filicina)可以明显吸收海水中的氮(N)、磷(P)[10],而舌状蜈蚣藻的藻体和生物量较大,广泛分布于中国等国家的沿海地区,其资源值得进一步开发利用。舌状蜈蚣藻的生活史属于同形世代交替,果孢子的发育属于有性生殖的重要部分。且由于果孢子囊相比于四分孢子囊在形态上更容易观察,可以通过采集果孢子进行苗种培养。目前中国尚未见舌状蜈蚣藻苗种的早期发育研究报道,笔者通过研究温度与光照强度等培养条件对舌状蜈蚣藻早期发育的影响,确定其盘状体发育的适合条件,以为舌状蜈蚣藻的繁育生物学和人工育苗技术研究提供科学依据。
1. 材料与方法
1.1 材料来源
舌状蜈蚣藻采自广东省汕头市南澳岛深澳湾养殖筏架的绠绳上,采取表面具有明显囊果的成熟藻体作为试验材料。采回后用软毛刷轻轻刷去表面的污渍及杂藻,用消毒海水冲刷数次后暂养于消毒海水中。
1.2 果孢子采苗与培养
舌状蜈蚣藻成熟藻体暂养3~5 d后进行果孢子采苗,采苗前需先对载玻片、玻璃染色缸进行灭菌,对采苗所用的器械进行消毒。试验中佩戴一次性手套进行操作。采苗前再次洗刷舌状蜈蚣藻藻体表面,阴干2~3 h,然后加入灭菌海水,每隔10 min在显微镜的10×10视野下计数一次,待每个视野中果孢子数量在10个以上后进行载玻片采苗。将孢子水倒入灭菌好的载玻片上,再将其置于培养箱与20 ℃、5 000 lx下进行果孢子附着,附着4~6 h后进行镜检观察,用水轻轻冲刷载玻片表面,确认为有效附着后将载玻片置于玻璃染色缸中培养,培养条件为温度18 ℃,光照强度2 500 lx,光周期为光(H) : 暗(D)=12 : 12。
1.3 试验设计及方法
温度和光照强度试验和培养条件的设置:1)温度组试验为光照强度2 500 lx,光周期H : D=12 : 12,温度梯度设置为15 ℃、20 ℃、25 ℃和30 ℃。2)光照组试验为温度20 ℃,光周期H : D=12 : 12,光照强度梯度设置为500 lx、2 500 lx、5 000 lx和10 000 lx。光照强度的测量使用照度计TES-1330A(台湾泰仕TES公司出品)。将采好果孢子的载玻片置于设置好条件的培养箱中进行培养,每天对载玻片进行观察,每隔1周对果孢子的发育情况进行拍照记录一次,并测量果孢子发育成盘状体后的直径。每个实验组设置3个平行,测量时每个平行组随机取10个盘状体进行直径的测量。
盘状体的相对生长速率(RGR)计算公式为:$ \operatorname{RGR}(\%)=\left[\left(\ln N_t-\ln N_0\right) / t\right] \times 100$
式中N0为盘状体初始直径,t为培养天数,Nt为培养t天后盘状体直径。
1.4 数据处理与分析
使用统计分析软件SPSS 19.0处理各组之间盘状体直径的平均数及标准差,并采用单因素方差分析及Tukey多重检验进行差异显著性分析,以分析在不同的温度及光照条件下盘状体直径的变化情况。
2. 结果
2.1 温度对早期发育的影响
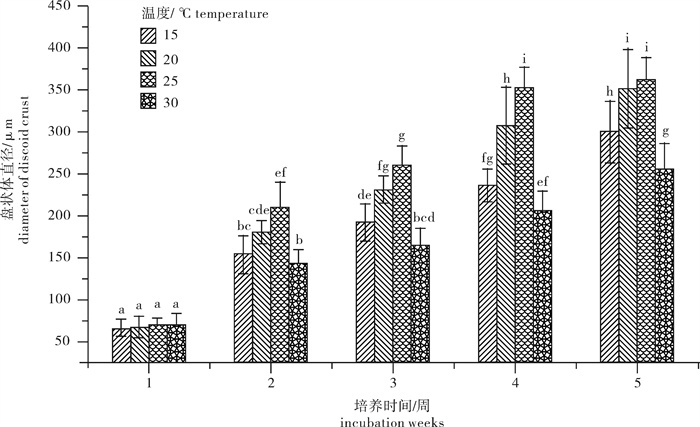
通过对附着后的果孢子进行观察,发现不同的温度条件下果孢子发育的速度也不相同。舌状蜈蚣藻早期发育过程主要经过分裂期、盘状体和直立枝3个阶段。在高温条件下易较早形成盘状体和直立枝,随着温度的降低直立枝形成的天数逐渐延长(表 1)。在25~30 ℃培养条件下果孢子经过3~4 d即可形成盘状体,而盘状体在25 ℃下最先发出直立枝,在第23天时即可看到直立枝的出现。在试验的4个温度梯度下,舌状蜈蚣藻的盘状体均可以发出直立枝,在低温及高温下盘状体长出直立枝的天数均有所延长。
表 1 不同温度条件下盘状体形成及长出直立枝的天数Table 1 Early development of seedings cultured from carpospores at different temperatures温度/℃ temperature 15 20 25 30 盘状体形成的天数/d days of discoid crust formation 4~7 4~6 3~4 3~4 盘状体长出直立枝的天数/d days of seedings curtured from discoid crusts 32 27 23 36 舌状蜈蚣藻果孢子在不同温度条件下培养5周的盘状体直径变化及差异性分析结果见图 1。25 ℃培养条件下盘状体直径增长最快。第4周时盘状体直径达(353.22±23.19)μm,20 ℃时发育也较快,第4周时盘状体直径达(307.85±45.31)μm,第5周时20 ℃下的盘状体直径与25 ℃下所测到的直径已无明显差异。25 ℃培养条件下第4周直径达到350 μm时舌状蜈蚣藻盘状体的直径增长速度开始放缓,这一现象也出现在其他温度培养条件下。适合舌状蜈蚣藻盘状体发育的温度为25 ℃,在低温下盘状体直径的增长速度显著降低,高温也可抑制舌状蜈蚣藻盘状体的生长。
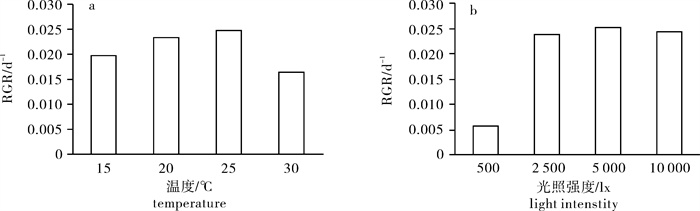
由于第4周至第5周时在25 ℃条件下盘状体直径生长放缓,取前4周的盘状体直径计算盘状体的相对生长速率(图 2-a)。25 ℃时舌状蜈蚣藻盘状体的相对生长速率达到最大(2.47%),其次为20 ℃条件下的2.34%,15 ℃条件下的1.97%,30 ℃条件下的1.65%。25~30 ℃时盘状体的相对生长速率呈现明显下降。
2.2 光照对早期发育的影响
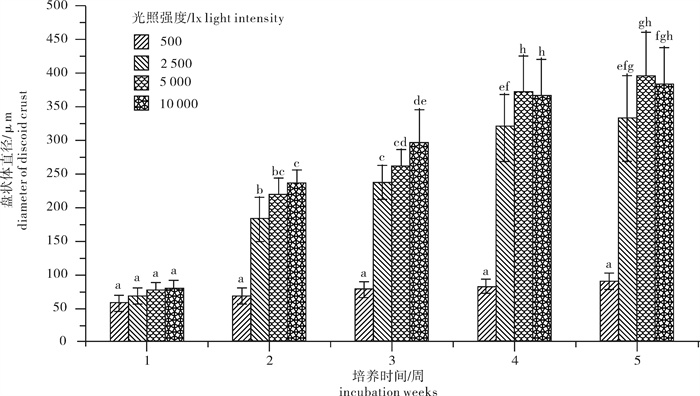
舌状蜈蚣藻果孢子发育形成盘状体的速度受到光照强度的影响(表 2)。随着光照强度的增加,果孢子的发育速率也相应加快。5 000~10 000 lx培养条件下果孢子在3~4 d即可发育成盘状体,而在低光照的500 lx条件下6~10 d盘状体才可以形成。10 000 lx培养条件下盘状体在第21天即可长出直立枝。5 000 lx的培养条件下24 d后盘状体可以长出直立枝,500 lx条件下盘状体发育的异常缓慢,80 d后才见到盘状体的生成。
表 2 不同光照强度条件下盘状体长出直立枝的天数Table 2 Days of seedings cultured from discoid crusts at different light intensities光照强度/lx light intensity 500 2 500 5 000 10 000 盘状体形成的天数/d days of discoid crust formation 6~10 4~6 3~4 3~4 盘状体发育出直立枝的天数/d days of seedings curtured from discoid crusts 80 27 24 21 不同光照条件下舌状蜈蚣藻盘状体的直径变化情况见图 3。盘状体在低光照500 lx下发育缓慢,5周后盘状体直径平均仅仅增长了23.14 μm,而其他3个光照条件都有>250 μm的增长,最大增长值在5 000 lx条件下,盘状体直径5周后平均增长了322 μm。前3周时经观察在10 000 lx条件下盘状体发育最快并长出直立枝,此时的盘状体直径为(296.13±49.48)μm,其次是5 000 lx,盘状体直径为(261.67±24.13)μm,而2 500 lx培养条件下盘状体直径为(237.74±25.01)μm,Tukey分析比较3组之间存在显著性差异(F=20.828,P < 0.01)。5周后观察测量5 000 lx条件下的盘状体直径为最大值,其次为10 000 lx,但这两者之间没有显著性差异,其次是2 500 lx条件下,5周后盘状体直径为(332±63.32)μm,而生长最为缓慢的是在500 lx培养下的盘状体,此时其直径只有(83±10.63)μm。
舌状蜈蚣藻盘状体在不同光照强度条件下的相对生长速率见图 2-b。舌状蜈蚣藻盘状体直径在5 000 lx条件下相对生长速率最大(2.53%),其次为10 000 lx条件下(2.43%),2 500 lx条件下相对生长速率为2.39%,500 lx条件下相对生长速率最低(0.56%)。在低光照下盘状体的相对生长速率明显放缓,虽然在高光强下盘状体的生长速率有所提高,但升高幅度并不大,只是缓慢上升。虽然盘状体的生长速率在低光强下受到显著抑制,但并不随着光照强度的提高直线上升,其相对生长速率在500~2 500 lx呈直线式升高,之后则平缓地提升。
3. 讨论
研究结果表明,温度和光照强度对舌状蜈蚣藻的早期生长发育有显著影响,在由分裂期向盘状体时期发育的过程中,高温、高光强的培养条件较低温、低光强条件下发育的更快;在早期发育中同时显示出果孢子对温度及光照强度有较宽广的耐受性,在2 500~10 000 lx及15~30 ℃下果孢子都可以长成盘状体进而萌发出直立枝,最适宜果孢子发育盘状体及萌发出直立枝的条件为温度25 ℃、光照强度5 000 lx。舌状蜈蚣藻在自然生境中发生、生长和消退规律与笔者的试验结果有较好的相符性。汕头南澳岛海区舌状蜈蚣藻在每年12月份开始出现,至第二年3~4月份形成很大的个体和生物量,在5~6月份藻体成熟并放散出果孢子或者四分孢子后逐渐腐烂消失。舌状蜈蚣藻适合果孢子发育为盘状体的条件为温度25 ℃、光照强度5 000 lx。海区舌状蜈蚣藻成熟繁殖的时间为每年5月~6月,符合这一条件的要求。盘状体在30 ℃时生长受到抑制,缓慢生长,温度下降到25 ℃以下盘状体长出直立枝的时间缩短,随着水温的下降,直立枝的生长加快。南澳岛夏季水温为30 ℃以上的时间长达40多天,舌状蜈蚣藻的盘状体发育受到明显的抑制,到12月份海区水温下降至20 ℃以下才能肉眼见到舌状蜈蚣藻的幼苗,这一现象与笔者的试验结果相一致。马凌波等[11]的研究也证实蜈蚣藻和带形蜈蚣藻(G.turuturu)的盘状体生长的适宜温度在20 ℃之上,15 ℃时生长变缓慢。
试验中发现舌状蜈蚣藻盘状体的直径并不能一直增大,在盘状体平均直径达到350 μm时生长开始变缓慢,此后虽也有生长但增长明显减缓。这可能是在室内培养下盘状体直径的生长极限,也可能与直立枝的生长有关。试验观察到舌状蜈蚣藻的直立枝一般在盘状体的直径为250~300 μm时长出,以后营养物质可能转向供应直立枝的生长,导致盘状体的生长减缓。研究报道显示,不同的藻类萌发出直立枝时盘状体的直径大小也不同,带形蜈蚣藻(G.turuturu)与舌状蜈蚣藻类似,直立枝都是在盘状体在200~300 μm左右时长出[12],角叉菜(Chondrus ocellatus)在200~320 μm时可以长出直立枝[13],金膜藻(Chrysymenia wrightii)盘状体发出直立枝也需在200 μm以上[14],隅江蓠(Gracilaria cornea)的直立枝在盘状体300 μm左右时长出[15],石斑藻属(Petrocelis)的直立枝在盘状体发育至200 μm后开始发育[16]。由此可推测,虽然各个物种在发出直立枝时盘状体的直径不同,但考虑到环境因素对直立枝生成的影响,200~300 μm可能是大部分红藻物种由盘状体发育转至直立枝发育时的直径。
在舌状蜈蚣藻早期发育中可以经常观察到盘状体愈合(coalescence)现象。盘状体愈合现象不仅出现在蜈蚣藻属中,在江蓠属(Gracilaria)和角叉菜属(Chondrus)的果孢子与四分孢子早期发育中也可观察到[13, 17-21]。因此盘状体愈合现象不能做为鉴别种类的标准。值得注意的是,有研究指出不同种类的海藻之间也可以发生盘状体愈合现象[19]。由于海区中舌状蜈蚣藻的四分孢子体及果孢子体是同时存在的,而且蜈蚣藻或者带形蜈蚣藻的生活环境与舌状蜈蚣藻较为类似,在繁殖时两者有可能同时释放出大量的果孢子与四分孢子,如果发生相互愈合现象,有可能会形成具有共同基部的植株,这也可以解释在海区能够采集到有共同固着器的舌状蜈蚣藻和带形蜈蚣藻或者蜈蚣藻的个体。另一个盘状体愈合的问题是,愈合之后不同的盘状体是否还能够分别发育出直立枝。笔者在试验中也观察发现,舌状蜈蚣藻的盘状体相互愈合之后,不同个体的盘状体能够各自长出直立枝,出现多个直立枝,但是也有一些盘状体愈合之后只发育出一个直立枝,这可能与盘状体愈合的时期有关。至于两者之间在愈合后是否有遗传物质的交换则需要进一步研究。舌状蜈蚣藻等海藻盘状体的融愈合有可能是对海洋环境适应性的体现,当不同个体的盘状体愈合之后使其附着面积增大,更有利于其在具有强烈流动性的海水环境下生存[22]。
4. 结论
研究表明,温度及光照强度对舌状蜈蚣藻的早期发育均有影响。在由分裂期向盘状体时期发育的过程中,高温(25~30 ℃)、高光照强度(5 000~10 000 lx)可以促进分裂期的发育,低温(15 ℃)、低光照强度(500 lx)下分裂期向盘状体的发育则受到抑制。而在盘状体时期向直立枝时期发育的过程中最适条件为温度25 ℃及光照强度5 000 lx,低温(15 ℃)及高温(30 ℃)均显著抑制盘状体,低光照强度(500 lx)也显著抑制盘状体的发育,但是高光强下(10 000 lx)盘状体的发育并未受到抑制。
-
表 1 不同温度条件下盘状体形成及长出直立枝的天数
Table 1 Early development of seedings cultured from carpospores at different temperatures
温度/℃ temperature 15 20 25 30 盘状体形成的天数/d days of discoid crust formation 4~7 4~6 3~4 3~4 盘状体长出直立枝的天数/d days of seedings curtured from discoid crusts 32 27 23 36 表 2 不同光照强度条件下盘状体长出直立枝的天数
Table 2 Days of seedings cultured from discoid crusts at different light intensities
光照强度/lx light intensity 500 2 500 5 000 10 000 盘状体形成的天数/d days of discoid crust formation 6~10 4~6 3~4 3~4 盘状体发育出直立枝的天数/d days of seedings curtured from discoid crusts 80 27 24 21 -
[1] 夏邦美. 中国海藻志·第二卷·红藻门·第三册[M]. 北京: 科学出版社, 2004: 118-122. [2] 芮雯, 岑颖洲, 李药兰, 等. 带形蜈蚣藻硫酸多糖的提取, 分析及其抗病毒活性[J]. 中国海洋药物, 2006, 25(2): 12-13. doi: 10.3969/j.issn.1002-3461.2006.02.003 [3] 严君, 施松善, 王顺春, 等. 蜈蚣藻中一种硫酸半乳聚糖的分离纯化, 结构鉴定及其抗新生血管生成活性[J]. 高等学校化学学报, 2008, 29(9): 1755-1759. doi: 10.3321/j.issn:0251-0790.2008.09.010 [4] 唐为萍, 陈树思. 潮汕地区的抗癌低等植物资源[J]. 时珍国医国药, 2010, 21(3): 711-712. doi: 10.3969/j.issn.1008-0805.2010.03.099 [5] 方玉春, 赵峡, 王顺春. 蜈蚣藻药用研究进展[J]. 中国海洋药物, 2011, 30(2): 58-61. https://xueshu.baidu.com/usercenter/paper/show?paperid=0cb17ab866fe16a7175c32031df12ccb&site=xueshu_se&hitarticle=1 [6] 周玲, 白志川, 丁侃. 蜈蚣藻的活性成分及其药理活性研究进展[J]. 中药材, 2011, 34(1): 147-150. https://xueshu.baidu.com/usercenter/paper/show?paperid=7264fab825b84fc6e679600a72172662&site=xueshu_se&hitarticle=1 [7] GUPTA S, ABU-GHANNAM N. Probiotic fermentation of plant based products: possibilities and opportunities[J]. Critical Rev Food Sci Nutri, 2012, 52(1/2/3): 183-199. https://xueshu.baidu.com/usercenter/paper/show?paperid=b8579a22ef42753579f9e0bb9165dfef&site=xueshu_se&hitarticle=1
[8] 张汉华, 李敏, 朱长波, 等. 不同饵料对黑鲍幼鲍生长及存活的影响[J]. 中国水产科学, 2008, 14(6): 903-910. https://xueshu.baidu.com/usercenter/paper/show?paperid=f54c376e59d24c8f413164fd6782f2c6&site=xueshu_se&hitarticle=1 [9] 史升耀. 卡拉胶及其在食品上的应用[J]. 水产学报, 1989, 5(3): 18-24. https://xueshu.baidu.com/usercenter/paper/show?paperid=97c487e8610eee78ab7536a149c0bafb&site=xueshu_se&hitarticle=1 [10] 李恒, 李美真, 徐智广, 等. 不同营养盐浓度对3种大型红藻氮、磷吸收及其生长的影响[J]. 中国水产科学, 2012, 19(3): 462-470. https://xueshu.baidu.com/usercenter/paper/show?paperid=3ab7fea1e942af92de442314d0c6c00a&site=xueshu_se&hitarticle=1 [11] 马凌波, 王素娟, 何培民. 大型经济红藻-蜈蚣藻类的室内人工育苗[J]. 上海水产大学学报, 1995, 4(2): 93-98. https://xueshu.baidu.com/usercenter/paper/show?paperid=c99dc45c085f8a8b046573eacb42c96a&site=xueshu_se&hitarticle=1 [12] WANG G G, JIANG C M, WANG S S, et al. Early development of Grateloupia turuturu (Halymeniaceae, Rhodophyta)[J]. Chin J Oceanol Limnol, 2012, 30(2): 264-268. doi: 10.1007/s00343-012-1071-5
[13] LI X, ZHAO P, WANG G, et al. Effects of temperature and irradiance on early development of Chondrus ocellatus Holm (Gigartinaceae, Rhodophyta)[J]. Chin J Oceanol Limnol, 2010, 28(3): 508-513. doi: 10.1007/s00343-010-9043-0
[14] ZHAO F J, ZHAO Z G, WANG A H, et al. Carpospore early development and callus-like tissue induction of Chrysymenia wrightii (Rhodymeniaceae, Rhodophyta) under laboratory conditions[J]. J Appl Phycol, 2010, 22(2): 195-202. doi: 10.1007/s10811-009-9442-9
[15] ORDUNA-ROJAS J, ROBLEDO D. Effects of irradiance and temperature on the release and growth of carpospores from Gracilaria cornea J. Agardh (Gracilariales, Rhodophyta)[J]. Botanica Marina, 2005, 42(4): 315-319. https://xueshu.baidu.com/usercenter/paper/show?paperid=36a3a35abec309b009ff6b70b397508d&site=xueshu_se&hitarticle=1
[16] POLANSHEK A R, WEST J A. Culture and hybridization studies on Petrocelis (RHODOPHYTA) from Alaska and California[J]. J Phycol, 1975, 11(4): 434-439. https://xueshu.baidu.com/usercenter/paper/show?paperid=de6e61ba6783df34e3169cdac6dd1117&site=xueshu_se
[17] JONES W E. Effect of spore coalescence in the early development of Gracilaria verrucosa (Huds. ) Papenfuss[J]. Nature, 1956, 178: 426-427. https://xueshu.baidu.com/usercenter/paper/show?paperid=f46e5b2cd9bfac50725749c87e2a73dd&site=xueshu_se&hitarticle=1
[18] KOMIYAMA T, SASAMOTO M. Studies on the propagation of Gracilaria verrucosa (Huds. ) Papenfuss I. On the settling of the spores and development of the early stage[J]. Ariakekai Kenkyu Hokoku, 1957(4): 25-34.
[19] 陈美琴, 任国忠. 江蓠幼苗的早期发育过程[J]. 海洋与湖沼, 1985, 16(3): 181-187. https://xueshu.baidu.com/usercenter/paper/show?paperid=90cc31f6c70c68bbfe32dd2c766bb2d5&site=xueshu_se&hitarticle=1 [20] VERA C, LOBOS P, ROMO H. Gametophyte-sporophyte coalescence in populations of the intertidal carrageenophyte Mazzaella laminarioides (Rhodophyta)[J]. J Appl Phycol, 2008, 20(5): 883-887. https://xueshu.baidu.com/usercenter/paper/show?paperid=e2d4f98e523c4832bf1c7e95bc7267b0&site=xueshu_se&hitarticle=1
[21] SANTELICES B, HORMAZABAL M, CORREA J, et al. The fate of overgrown germlings in coalescing Rhodophyta[J]. Phycologia, 2004, 43(4): 346-352. https://xueshu.baidu.com/usercenter/paper/show?paperid=e206568ff11f0086c33ed604ee1e38a1&site=xueshu_se&hitarticle=1
[22] WANG A H, SHUAI L, DUAN D L. Filament induction in Halymenia sinensis (Halymeniaceae, Rhodophyta)[J]. Botanica Marina, 2006, 49(4): 352-354.
-
期刊类型引用(11)
1. 唐海梦,赵露,王昊林,方鵾鹏,王宏伟. 外来入侵海洋红藻——具孔斯帕林藻的早期发育、生活史及环境因子对其生长发育的影响. 水生生物学报. 2025(03): 67-74 .  百度学术
百度学术
2. 陈胜军,刘欢,杨少玲,杨贤庆,戚勃,胡晓. 舌状蜈蚣藻多糖提取工艺及抗氧化活性分析. 上海海洋大学学报. 2020(01): 153-160 .  百度学术
百度学术
3. 陈素文,冯彬,李婷,张博,朱长波,杨贤庆. 蜈蚣藻属生物学与养殖研究进展. 南方水产科学. 2019(01): 119-123 .  本站查看
本站查看
4. 冯彬,李婷,张博,朱长波,苏家齐,陈素文,杨贤庆. 广东汕头南澳和福建东山浮筏的蜈蚣藻属调查. 南方水产科学. 2019(05): 48-54 .  本站查看
本站查看
5. 马欠,邓春暖,郭锋锋. 温度对小球藻和铜绿微囊藻生长及叶绿素荧光特性的影响. 中州大学学报. 2018(04): 108-112 .  百度学术
百度学术
6. 刘欢,陈胜军,杨贤庆,戚勃,李春生. 舌状蜈蚣藻营养成分分析与品质评价. 南方水产科学. 2018(06): 99-104 .  本站查看
本站查看
7. 陈素文,张文文,郭永坚,朱长波,李俊伟,颉晓勇,陈利雄. 水流和光照条件对舌状蜈蚣藻Grateloupia livida(Harv)Yamad果孢子萌发生长的影响. 渔业科学进展. 2017(06): 112-118 .  百度学术
百度学术
8. 姜朋,赵树雨,李芳,王宏伟. 单条胶黏藻(Dumontia simplex Cotton)孢子早期发育及其生活史的研究. 海洋与湖沼. 2016(01): 151-157 .  百度学术
百度学术
9. 贾潇博,姜朋,周汝金,关云,王宏伟. 大连蜈蚣藻孢子发育及生活史的研究. 海洋科学. 2016(10): 25-32 .  百度学术
百度学术
10. 曹翠翠,赵凤琴,郭少茹,王宏伟. 主要环境因子对细弱蜈蚣藻(Grateloupia tenuis)孢子发育的影响及生活史的研究. 海洋与湖沼. 2015(02): 298-304 .  百度学术
百度学术
11. 王宏伟,李雅卓,曹翠翠,邓璐. 亚洲蜈蚣藻(Grateloupia asiatica Kawaguchi et Wang)孢子发育及生活史的研究. 辽宁师范大学学报(自然科学版). 2014(02): 246-251 .  百度学术
百度学术
其他类型引用(5)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
