Study on shell length and survival of orange strain of Manila clam (Ruditapes philippinarum) with different inbreeding coefficient
-
摘要:
以不同遗传背景的蛤仔(Ruditapes philippinarum)橙色品系为材料,采用建立半同胞家系子一代H1(F=0.125)、全同胞家系子一代F1(F=0.250)、全同胞家系子四代F4(F=0.594)及自然对照组C1(F=0)的方法,进行了不同近交系数蛤仔橙色品系生长和成活的研究。结果表明,在整个养殖周期中F1组的壳长生长最慢,在稚贝期和养成期均显著小于F4和C1组(P < 0.05),H1、F4和C1组之间的壳长生长差异不显著(P>0.05)。C1组的成活率在整个养殖周期中为最小,除幼虫期3日龄外,其他各日龄均显著小于其他试验组(P < 0.05),而H1、F1和F4组之间的成活率则差异不显著(P>0.05)。试验组F1壳长生长的衰退率为2.92%~18.33%,平均值为(12.05±6.54)%,试验组H1在稚贝期、养成期显现出一定的衰退现象,而试验组F4在整个养殖周期中均未表现出近交衰退现象;各试验组的成活性状在各日龄均未出现近交衰退。该研究为橙色品系的选育奠定一定的理论基础。
Abstract:We observed the shell length and survival between different coefficients of inbreeding to study the inbreeding depression for orange strain of Manila clam (Ruditapes philippinarum) through experiments. Four experimental groups were established, including first generation of half-sib (H1, F=0.125), first generation of full-sib (F1, F=0.250), fourth generation of full-sib (F4, F=0.594) and the control group (C1, F=0). The results show that the shell length of F1 is smaller than that of other groups at larval, juvenile, and grow-out stages. One-way ANOVA indicates that the difference in shell length is significant (P < 0.05) between F1 and other groups at juvenile and grow-out stages, and that there are no significant differences among H1, F4 and C1. The growth rate of shell length in F1 decreases significantly, with a inbreeding depression rate ranging from 2.92% to 18.33%, of which the mean value is (12.05±6.54) %. Shell length in H1 has a depression at juvenile and grow-out stages as well. However, there is no inbreeding depression of length in F4 at any stages. There are no inbreeding depression of survival for H1, F1 and F4, as of which the survival rates are higher than that of control group C1. The results in this study suggest a basic theory to select the strain of Manila clam with orange shell color using the full-sib family.
-
近交(inbreeding)是育种者改变群体遗传结构的方法之一,是遗传育种研究领域中的热点问题。近交可以使生物活力和生长性状的显性基因得到纯合的机会增加,加快基因的纯化速度,这是近交在育种中的有利一面,但也会引起与繁殖能力或与生理机能相关的性状表型平均值降低而引起近交衰退[1]。近交系数(coefficient of inbreeding)可以用来度量个体或群体的近交程度,其定义是指某一个体(二倍体生物)任何基因座上2个等位基因来自父母共同祖先的同一基因的概率,也就是该个体是由近交造成的纯合子(同源纯合子)的概率,用F表示[2]。目前对贝类近交的研究主要集中在近交衰退方面。张国范等[3]发现海湾扇贝(Argopecten irradians)自交家系(F=0.500)的幼虫生长速率、附着变态时间明显低于对照组,幼虫阶段自交衰退率为25.9%,成体阶段平均为12.7%;BEAUMOUNT和BUDD[4]研究发现欧洲大扇贝(Pecten maximus)自交组的幼虫生长存在明显的近交衰退;BEATTIE等[5]发现近交(F=0.250)对2龄长牡蛎(Crassostrea gigas)具有显著的影响;WADA[6]报道了日本珠母贝(Pinctada funcata martensii)经过6代选择的近交系仍具有较快的生长速度,并未表现出近交衰退现象;郑怀平[7]对不同近交水平的海湾扇贝的研究发现,自交二代的近交衰退率要小于自交一代。此外闫喜武等[8]报道了通过对蛤仔(Ruditapes philippinarum)全同胞家系壳长进行连续上选的方法建立近交子二代和子三代的近交衰退情况,其中子二代生长性状出现衰退现象,而全同胞子三代生长性状却得到了提高,2代的存活性状均未出现衰退。
蛤仔是重要的贝类养殖品种,中国的蛤仔产量巨大,年产量在320×104 t左右,占据中国贝类产量的30%,世界贝类产量的90%以上[9]。蛤仔属双壳纲帘蛤科、缀锦亚科、蛤仔属,为广温、广盐性品种,宜养面积大,因此受到各国学者的广泛关注。近年来随着研究的深入,蛤仔在遗传育种方面的研究也取得了一定成果,如蛤仔选择育种、杂交育种、壳色、壳型选育等研究均有报道[10-13],笔者以不同近交系数的蛤仔橙色品系为研究材料,拟探明近交对蛤仔橙色品系生长及成活的影响,为橙色品系的选育奠定一定的理论基础。
1. 材料与方法
1.1 亲本来源
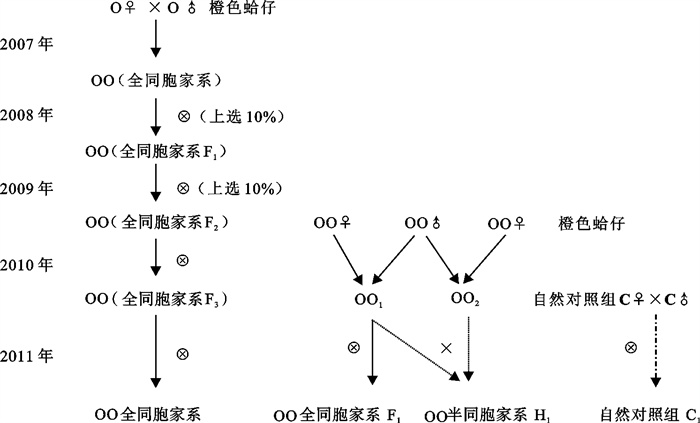
试验亲贝为2010年建立的蛤仔橙色半同胞、全同胞及全同胞子三代家系,利用三段法[14]经1周年的养成。其中全同胞子三代家系为2007建立的橙色家系,经2代连续上选(按照壳长10%留种率)所获得。半同胞、全同胞家系为2010年通过1对2的交配方式建立形成(图 1)。
2011年5月随机选取1龄的3种橙色家系亲本以及在同一环境养殖的1龄自然群体各100个,分装到网目为20目的网袋(40 cm×60 cm)中,调整合适的密度,采取吊养的方式在大连海量水产食品有限公司的室外生态池中进行自然促熟。试验期间水温12~24 ℃,盐度25~28,pH 7.64~8.62。待亲贝性腺成熟后移入室内待产。
1.2 试验设计与处理
2011年8月中旬将性腺成熟的亲贝阴干8 h,放入新鲜的海水中,3 h后亲贝开始产卵排精,把正在产卵排精的亲贝拣出,用淡水把壳表面粘有的精卵冲洗干净,再放到盛有新鲜海水的小塑料桶(2.0 L)中,大约经过10~15 min单独放置的亲贝会再次产卵排精。取橙色家系半同胞、全同胞、全同胞子三代及自然群体雌、雄各1个,共8个亲贝(表 1),按照图 1中的组合方式进行受精,建立橙色家系半同胞子一代(H1)、全同胞子一代(F1)、全同胞子四代(F4)及自然对照组(C1)。受精前镜检卵子是否受精,若卵子已受精则弃掉换用未受精的卵子进行受精。受精后收集受精卵于大塑料桶(100 L)中孵化,孵化密度10~12个·mL-1,孵化期间保持充气。每组设置3组重复,各试验组之间保持孵化密度和环境条件一致,各试验组严格隔离,防止混杂。
表 1 各试验组亲贝壳长Table 1 Shell length of each experimental groupmm 类别item 半同胞家系half-sib 全同胞家系full-sib 全同胞家系子三代third generation of full-sib 自然对照组control group 雌female(♀) 22.13 22.43 19.36 20.83 雄male(♂) 21.58 21.29 22.38 22.19 1.3 幼虫及稚贝培育
培育期间试验用水为沙滤海水,水温为25~30 ℃,盐度为25~28,pH为7.8~8.2。每2 d全量换水1次,为防止不同试验组之间相互污染,每换完一组后要将所用的筛绢网在淡水中浸泡后再进行下一组的换水工作。每天投饵2次,浮游期饵料为等鞭金藻(Isochrysis galbana),附着后改为等鞭金藻和小球藻(Chlorella vulgaris)混合投喂(体积比为1 : 1),浮游期投喂量2 000~5 000细胞·mL-1,附着后投喂量(1~2)×104细胞· mL-1,并根据实际的摄食情况适当增减投喂量,保证水中有足够的饵料。浮游期的幼体培育密度为6~8个· mL-1,随着蛤仔的变态,逐渐减少为2~3个· mL-1。为了消除培育密度的影响,在培育阶段每3 d对密度进行调整,保持各个试验组密度基本一致。稚贝生长至40日龄后将各试验组蛤仔按每袋500个的数量分装入80目网袋(40 cm×60 cm),做好标签挂养于生态池中进行中间育成,期间水温为19~25 ℃,盐度为28~29,pH为7.8~8.4。稚贝中间育成阶段随着壳长不断增加定期更换网袋(60目、40目和20目),消除网目对稚贝生长的影响,同时调整密度,使各试验组的密度保持一致。
1.4 数据测量及分析
分别测量橙色品系各试验组及对照组的3日龄、6日龄、9日龄、30日龄、60日龄、90日龄、120日龄、240日龄和360日龄的壳长和成活率。幼虫和稚贝的壳长小于300 μm时在100倍显微镜下测量,稚贝壳长大于300 μm小于3.0 mm时在40倍显微镜下进行测量,壳长大于3.0 mm后用游标卡尺测量(精确度0.01 mm)。每次测量设3个重复,每个重复随机测量30个个体。幼虫成活率为单位体积幼虫数与D形幼虫数的百分率;稚贝成活率为不同日龄成活稚贝的数量与变态稚贝数的百分率[8]。
参照郑怀平[7]计算全同胞家系近交系数,公式为:
$$ F_t=\frac{1}{4}\left(1+2 F_{t-1}+F_{t-2}\right) $$ 在第一个世代中,Ft-1和Ft-2两者都为0,因此,全同胞第一代的F(t=1)=0.25。
参照赵寿元和乔守怡[15]对半同胞家系子一代近交系数的计算得:
$$ F_1=2 \times\left(\frac{1}{2}\right)^4=0.125 $$ 参照ZHENG等[16]计算橙色家系各日龄的生长和成活的近交衰退率,公式为:
$$ I D \%=\left(1-\frac{S_x}{P_x}\right) \times 100 \% $$ 式中Sx为橙色家系壳长或成活率,Px为对照组壳长或成活率。
使用SPSS 17.0软件对试验数据进行处理,用单因素方差分析(One-Way ANOVA)对各试验组数据进行差异性检验(P < 0.05),并用Excel 2003作图。
2. 结果
2.1 不同橙色品系的近交系数
不同遗传背景的蛤仔橙色品系近交系数见表 2,其中自然对照组的亲本并无任何亲缘关系,因此其近交系数F=0,但随着近交程度的增加近交系数越来越大。该研究中近交系数大小顺序为C1 < H1 < F1 < F4。
表 2 各试验组近交系数Table 2 Coefficient of inbreeding for each experimental group类别item 半同胞子一代half-sib (H1) 全同胞子一代full-sib (F1) 全同胞子四代third generation of full-sib (F4) 自然对照组control group (C1) 近交系数coefficient of inbreeding 0.125 0.250 0.594 0 2.2 不同近交系数的橙色品系生长性状
试验组H1、F1、F4和C1各日龄壳长生长比较见表 3。方差分析及显著性检验表明,在幼虫期各试验组壳长之间无显著差异(P>0.05),但F1组的壳长生长最小。在稚贝期,F1组壳长的生长慢于其他试验组,除在60日龄时与H1组差异不显著(P>0.05),在稚贝期各日龄与其他各试验组差异显著(P < 0.05)。在养成期,F1组的壳长生长仍慢于其他试验组,除在240日龄时与H1组差异不显著(P>0.05),在养成期各日龄与其他各试验组差异显著(P < 0.05)。在幼虫期和稚贝期,试验组H1、F1和F4相互之间的壳长生长差异均不显著(P>0.05)。在养成期,H1组的壳长生长慢于F1、F4组,除在360日龄时与F1、F4组差异不显著(P>0.05),在养成期各日龄的差异显著(P < 0.05)。
表 3 各试验组幼虫期、稚贝期及养成期壳长的方差分析及差异性检验(X ±SD)Table 3 Analysis of variance and difference test for the shell length of each experimental group at larval, juvenile, and grow-out stages日龄/dages 壳长shell length H1 F1 F4 C1 幼虫期/μm larval 3 126.67±6.07a 121.67±9.50b 126.33±11.59ab 125.33±8.60ab 6 153.00±15.57ab 146.00±11.02b 154.67±18.52a 152.67±15.30ab 9 201.33±19.07ab 195.00±15.03b 204.33±19.77a 201.33±11.67ab 稚贝期/mm juvenile 30 0.67±0.13a 0.57±0.10b 0.70±0.13a 0.68±0.16a 60 2.61±0.72ab 2.31±0.56b 2.81±0.62a 2.69±0.79a 90 3.81±0.83a 3.24±0.98b 4.10±0.77a 3.91±0.94a 养成期/mm grow-out 120 4.00±0.99a 3.43±0.71b 4.36±1.06a 4.20±1.28a 240 4.17±1.19ab 3.74±0.95b 4.57±0.76a 4.44±1.27a 360 13.84±1.99b 12.54±1.78c 15.48±1.26a 15.02±2.02a 注:同一行中具有相同上标字母的表示差异不显著(P>0.05),后表同此
Note:The same superscript letters within the same row indicate not-significant differences (P>0.05),the same case in the following tables.2.3 不同近交系数的橙色品系成活性状
试验组H1、F1、F4和C1各日龄成活率见表 4。在幼虫期、稚贝期、养成期,自然对照组C1的成活率为最低,方差分析和差异性检验结果表明,幼虫期3日龄时各试验组之间成活率差异不显著(P>0.05),在其他各日龄试验组H1、F1和F4的成活率均显著高于对照组C1(P<0.05)。而H1、F1和F4组之间的成活率则差异不显著(P>0.05)。
表 4 各试验组幼虫期、稚贝期及养成期成活率的方差分析及差异性检验Table 4 Analysis of variance and difference test for the survival rate of each experimental group at larval, juvenile, and grow-out stages日龄/dages 成活率/% survival rate H1 F1 F4 C1 幼虫期/μm larval 3 91.67±0.58a 91.33±0.58a 91.67±1.53a 90.33±0.58a 6 87.00±0.58a 87.67±1.20a 86.33±1.33a 80.33±1.20b 9 82.00±1.16a 82.00±0.57a 80.67±1.16a 66.33±0.88b 稚贝期/mm juvenile 30 80.00±1.16a 79.33±0.67a 78.67±0.67a 64.67±0.88b 60 76.67±0.67a 75.33±1.76a 75.33±1.33a 63.33±0.67b 90 72.00±1.16a 71.67±0.88a 71.00±0.58a 61.00±0.58b 养成期/mm grow-out 120 65.00±1.16a 62.33±1.45a 61.67±0.88a 56.00±1.16b 240 61.67±0.88a 61.33±0.88a 60.00±0.58a 52.00±1.16b 360 59.67±0.88a 60.00±1.16a 58.67±0.67a 50.33±0.33b 2.4 近交衰退率
试验组H1、F1和F4各日龄生长的近交衰退率见表 5。结果表明,试验组H1在幼虫期并未表现出近交衰退,但在稚贝期、养成期显现出一定的衰退现象。试验组F1在幼虫期、稚贝期及养成期均表现出一定的近交衰退,其衰退率为2.92%~18.33%,平均为(12.05±6.54)%。试验组F4在整个养殖周期中均未表现出近交衰退现象,其近交衰退率均为负值。近交衰退率的大小顺序为F1>H1>F4,并随着日龄的增长F1和H1的衰退增加,而试验组F4则基本保持不变。试验组H1、F1和F4各日龄成活的近交衰退率见表 6。结果表明,各试验组的成活衰退率均为负值,都未出现衰退现象。各试验组的成活衰退率随日龄的变化的规律基本一致。
表 5 各试验组壳长生长的近交衰退率Table 5 Magnitudes of inbreeding depression for growth of each experimental group日龄/dages 近交衰退率/% ID magnitudes of inbreeding depression H1 F1 F4 幼虫期larval 3 -1.07 2.92 -0.80 6 -0.22 4.37 -1.31 9 0.00 3.14 -1.49 稚贝期juvenile 30 1.47 16.18 -2.94 60 2.97 14.12 -4.46 90 2.56 17.14 -4.86 养成期grow-out 120 4.76 18.33 -3.81 240 6.08 15.77 -2.93 360 7.86 16.51 -3.06 表 6 各试验组成活性状的近交衰退率Table 6 Magnitudes of inbreeding depression for survival of each experimental group日龄/dages 近交衰退率/% ID magnitudes of inbreeding depression H1 F1 F4 幼虫期larval 3 -1.48 -1.11 -1.48 6 -8.30 -9.14 -7.47 9 -23.62 -23.62 -21.62 稚贝期juvenile 30 -23.70 -22.67 -21.65 60 -21.06 -18.95 -18.95 90 -18.03 -17.49 -16.39 养成期grow-out 120 -16.07 -11.30 -10.13 240 -18.60 -17.94 -15.38 360 -18.56 -19.21 -16.57 3. 讨论
近交衰退是指子代的繁殖或生理机能相关的性状平均值降低的现象。其衰退程度的进化依赖于近交的程度、近交衰退的遗传基础(即显性对超显性)、对近交衰退有贡献的基因位点数和这些位点上等位基因作用的大小[17]。该研究中试验组H1、F1和F4的近交系数分别为0.125、0.25和0.594。其生长的近交衰退率顺序为H1 < F1,并随着日龄的增长呈逐渐增大的趋势。这说明生长性状的近交衰退首先是随着近交系数的增加而增大,这与以往的近交对生长和成活的研究结果一致。如SHIKANO等[18]研究发现孔雀鱼(Poecilia reticulate)随着近交系数的增加其对盐度的耐受性呈线性下降趋势,表现出衰退现象。RYE和MAO[19]对大西洋鲑(Salmo salar)的研究发现,近交系数每增加10%,生长的近交衰退就增加0.6%~2.3%。SU等[20]报道了虹鳟(Oncorhynchus mylciss)随年龄的增加鱼体质量的近交衰退有增加的趋势。张国范等[3]发现海湾扇贝自交家系(F=0.500)的幼虫生长速率、附着变态时间明显低于对照组,幼虫阶段自交衰退率为25.9%,成体阶段平均为12.7%。BEAUMOUNT和BUDD[4]研究欧洲大扇贝发现自交组的幼虫生长存在明显的近交衰退。BEATTIE等[5]发现近交(F=0.250)对2龄的长牡蛎具有显著的影响。试验组F4并未出现近交衰退现象,这说明当多代近交后,近交程度达到一定值近交衰退就会受到抑制。该研究中F4组的亲本是经过2代的壳长个体选择(上选10%),这也是试验组F4未出现生长近交衰退的原因之一。此结果与许多学者的研究结果相似,例如WADA[6]报道了日本珠母贝经过6代选择的近交系仍具有较快的生长速度,并未表现出近交衰退现象;郑怀平[7]对不同近交水平的海湾扇贝的研究发现,自交二代的近交衰退率要小于自交一代;此外闫喜武等[8]报道了通过对蛤仔全同胞家系壳长进行连续上选的方法建立近交子二代和子三代的近交衰退情况,其中子二代生长性状出现衰退现象,而全同胞子三代生长性状却得到了提高,2代的成活性状均未出现衰退。
从成活性状来看,试验组H1、F1和F4均为橙色品系,除3日龄外,其他各时期均显著高于自然对照组C1,未表现出近交衰退现象。4组试验组在9日龄成活率都有明显的降低,这是由于蛤仔幼虫在这一时期开始进行附着变态,幼虫要经历足的生长、面盘脱落等复杂过程,对环境变化非常敏感,抗逆性差的蛤仔会大量死亡。在稚贝期的室内培育阶段,水环境相对稳定,各试验组的成活率较稳定。在养成期稚贝被转入生态池中,室外水环境变化剧烈,自然对照组C1的成活率明显下降,但其他3组试验组成活率相对稳定。这些现象说明橙色家系抵抗外部环境变化的能力较强,相对于对照组,具有较强的抗逆性,这与学者们报道过的蛤仔橙色品系具有较强抗逆性的结果一致[8, 21]。就笔者的研究而言,这种结果表明控制该品系成活性状的基因处于高度纯合的状态,在这种状态下近交不能使该性状出现衰退现象,同时该性状也不会再得到提高。MALLET和HALEY[22]的研究发现美洲牡蛎(C.virginica)全同胞家系幼虫的成活率大于对照组,没有近交衰退现象的显现,幼虫和早期稚贝的生长无显著差异,但稚贝的生长存在6%~10%的近交衰退。LANNAN[23]发现长牡蛎全同胞家系幼虫的成活率没有表现出衰退现象。类似的结果还出现在对壳长进行个体选择(上选10%)的蛤仔家系中[8]。
关于近交衰退的原因,很多学者支持部分显性假说(partial dominance),近交使在杂合状态下被显性等位基因掩盖的有害隐性基因纯合,这种隐性基因得到完全表达后被自然选择所净化,导致表型性状衰退[16, 24]。这一假说也说明了近交衰退在杂合度高的群体中应该较高,在杂合度低的群体中应该较低[16, 24-25]。笔者研究中试验组F1(F=0.250)的近交系数要大于H1(F=0.125),即F1的近交程度相对较高,基因的杂合度低;H1的近交程度较低,基因的杂合度应相对较高。但基因杂合度较高的H1的近交衰退率却要小于杂合度较低的F1。这一结果并不违背部分显性假说理论,原因在于试验组F1和H1都为近交子一代,并未进行过任何的人工选择或自然选择。虽然F1组的杂合度较低,但有害隐性基因的纯合度就相对较高,而H1组的杂合度高,有害隐性基因纯合度就相对低,在没有经过自然或人工淘汰的情况下,表现出杂合度高的群体中的近交衰退要高于杂合度低的群体的现象。试验组F4为全同胞家系自交子四代,繁育其亲本时经过连续2代的壳长10%上选,具有更低的杂合度,而试验结果表明其近交衰退率最低,在整个养殖周期中均为负值,符合部分显性假说理论,并表现出一定的生长优势,这也证明了对壳长进行上选的育种工作是有效且可行的。通过该研究的试验验证,丰富了近交衰退部分显性假说的理论,为蛤仔橙色品系的性状测试及遗传改良奠定了理论与实践基础。
-
表 1 各试验组亲贝壳长
Table 1 Shell length of each experimental group
mm 类别item 半同胞家系half-sib 全同胞家系full-sib 全同胞家系子三代third generation of full-sib 自然对照组control group 雌female(♀) 22.13 22.43 19.36 20.83 雄male(♂) 21.58 21.29 22.38 22.19 表 2 各试验组近交系数
Table 2 Coefficient of inbreeding for each experimental group
类别item 半同胞子一代half-sib (H1) 全同胞子一代full-sib (F1) 全同胞子四代third generation of full-sib (F4) 自然对照组control group (C1) 近交系数coefficient of inbreeding 0.125 0.250 0.594 0 表 3 各试验组幼虫期、稚贝期及养成期壳长的方差分析及差异性检验(X ±SD)
Table 3 Analysis of variance and difference test for the shell length of each experimental group at larval, juvenile, and grow-out stages
日龄/dages 壳长shell length H1 F1 F4 C1 幼虫期/μm larval 3 126.67±6.07a 121.67±9.50b 126.33±11.59ab 125.33±8.60ab 6 153.00±15.57ab 146.00±11.02b 154.67±18.52a 152.67±15.30ab 9 201.33±19.07ab 195.00±15.03b 204.33±19.77a 201.33±11.67ab 稚贝期/mm juvenile 30 0.67±0.13a 0.57±0.10b 0.70±0.13a 0.68±0.16a 60 2.61±0.72ab 2.31±0.56b 2.81±0.62a 2.69±0.79a 90 3.81±0.83a 3.24±0.98b 4.10±0.77a 3.91±0.94a 养成期/mm grow-out 120 4.00±0.99a 3.43±0.71b 4.36±1.06a 4.20±1.28a 240 4.17±1.19ab 3.74±0.95b 4.57±0.76a 4.44±1.27a 360 13.84±1.99b 12.54±1.78c 15.48±1.26a 15.02±2.02a 注:同一行中具有相同上标字母的表示差异不显著(P>0.05),后表同此
Note:The same superscript letters within the same row indicate not-significant differences (P>0.05),the same case in the following tables.表 4 各试验组幼虫期、稚贝期及养成期成活率的方差分析及差异性检验
Table 4 Analysis of variance and difference test for the survival rate of each experimental group at larval, juvenile, and grow-out stages
日龄/dages 成活率/% survival rate H1 F1 F4 C1 幼虫期/μm larval 3 91.67±0.58a 91.33±0.58a 91.67±1.53a 90.33±0.58a 6 87.00±0.58a 87.67±1.20a 86.33±1.33a 80.33±1.20b 9 82.00±1.16a 82.00±0.57a 80.67±1.16a 66.33±0.88b 稚贝期/mm juvenile 30 80.00±1.16a 79.33±0.67a 78.67±0.67a 64.67±0.88b 60 76.67±0.67a 75.33±1.76a 75.33±1.33a 63.33±0.67b 90 72.00±1.16a 71.67±0.88a 71.00±0.58a 61.00±0.58b 养成期/mm grow-out 120 65.00±1.16a 62.33±1.45a 61.67±0.88a 56.00±1.16b 240 61.67±0.88a 61.33±0.88a 60.00±0.58a 52.00±1.16b 360 59.67±0.88a 60.00±1.16a 58.67±0.67a 50.33±0.33b 表 5 各试验组壳长生长的近交衰退率
Table 5 Magnitudes of inbreeding depression for growth of each experimental group
日龄/dages 近交衰退率/% ID magnitudes of inbreeding depression H1 F1 F4 幼虫期larval 3 -1.07 2.92 -0.80 6 -0.22 4.37 -1.31 9 0.00 3.14 -1.49 稚贝期juvenile 30 1.47 16.18 -2.94 60 2.97 14.12 -4.46 90 2.56 17.14 -4.86 养成期grow-out 120 4.76 18.33 -3.81 240 6.08 15.77 -2.93 360 7.86 16.51 -3.06 表 6 各试验组成活性状的近交衰退率
Table 6 Magnitudes of inbreeding depression for survival of each experimental group
日龄/dages 近交衰退率/% ID magnitudes of inbreeding depression H1 F1 F4 幼虫期larval 3 -1.48 -1.11 -1.48 6 -8.30 -9.14 -7.47 9 -23.62 -23.62 -21.62 稚贝期juvenile 30 -23.70 -22.67 -21.65 60 -21.06 -18.95 -18.95 90 -18.03 -17.49 -16.39 养成期grow-out 120 -16.07 -11.30 -10.13 240 -18.60 -17.94 -15.38 360 -18.56 -19.21 -16.57 -
[1] FALCONER D S. Introduction to quantitative genetics[M]. 3rd edition. London: Longman, 1981: 265-287.
[2] 杨业华. 普通遗传学[M]. 北京: 高等教育出版社, 2008: 329-332. [3] 张国范, 刘述锡, 刘晓, 等. 海湾扇贝自交家系的建立和自交效应[J]. 中国水产科学, 2003, 10(6): 441-445. doi: 10.3321/j.issn:1005-8737.2003.06.001 [4] BEAUMONT A R, BUDD M D. Effects of self-fertilization and other factors on the early development of the scallop Pecten maximus[J]. Mar Biol Res, 1983, 76(3): 285-289. doi: 10.1007/BF00393030
[5] BEATTIE J H, PERDUE J, HERSHBERGER W, et al. Effects of inbreeding on growth in the Pacific oyster Crassostrea gigas[J]. J Shellf Res, 1987, 6(1): 25-28. https://www.researchgate.net/publication/313165204_Effects_of_inbreeding_on_growth_in_the_Pacific_oyster_Crassostrea_gigas
[6] WADA K T. Genetic selection for shell traits in the Japanese pearl oyster, Pinctada fucata martensii[J]. Aquaculture, 1986, 57(1/2/3/4): 171-176. doi: 10.1016/0044-8486(86)90194-8
[7] 郑怀平. 海湾扇贝两个养殖群体数量性状及壳色遗传研究[D]. 青岛: 中国科学院海洋研究所, 2005: 61-63. https://d.wanfangdata.com.cn/thesis/ChhUaGVzaXNOZXdTMjAyNDA5MjAxNTE3MjUSB1k2ODk2MjgaCHk3dWlteDk5 [8] 闫喜武, 张跃环, 孙焕强, 等. 菲律宾蛤仔(Ruditapes philippinarum)海洋橙品系两个世代的杂交与近交效应[J]. 海洋与湖沼, 2011, 42(2): 309-316. https://www.zhangqiaokeyan.com/academic-journal-cn_oceanologia-limnologia-sinica_thesis/0201253919122.html [9] 张国范, 闫喜武. 蛤仔养殖学[M]. 北京: 科学出版社, 2010: 10. https://www.zhangqiaokeyan.com/book-cn/08150513695.html [10] 闫喜武, 张跃环, 霍忠明, 等. 不同壳色蛤仔品系间双列杂交的研究[J]. 水产学报, 2008, 32(6): 864-875. [11] 闫喜武, 张跃环, 金晶宇, 等. 大连群体两种壳型菲律宾蛤仔的双列杂交[J]. 水产学报, 2009, 33(3): 389-395. doi: 10.3724/SP.J.00001 [12] 张跃环, 闫喜武, 杨凤. 菲律宾蛤仔大连群体两种壳型家系生长发育比较[J]. 生态学报, 2008, 28(9): 4246-4252. doi: 10.3321/j.issn:1000-0933.2008.09.022 [13] 霍忠明, 闫喜武, 张跃环, 等. 菲律宾蛤仔(Ruditapes philippinarum)大连群体家系建立及生长比较[J]. 海洋与湖沼, 2010, 41(3): 334-340. doi: 10.11693/hyhz201003006006 [14] ZHANG G F, YAN X W. A new three-phase culture method for Manila clam, Ruditapes philippinarum, farming in northern China[J]. Aquaculture, 2006, 258(1/2/3/4): 452-461. doi: 10.1016/j.aquaculture.2006.04.046
[15] 赵寿元, 乔守怡. 现代遗传学[M]. 北京: 高等教育出版社, 2001: 279-285. [16] ZHENG H P, ZHANG G F, GUO X M. Inbreeding depression for various traits in two cultured populations of the American bay scallop, Argopecten irradians irradians Lamarck (1819) introduced into China[J]. J Exp Mar Biol Ecol, 2008, 364(1): 42-47. doi: 10.1016/j.jembe.2008.06.027
[17] CHARLESWORTH D, CHARLESWORTH B. Inbreeding depression and its evolutionary consequences[J]. Annu Rev Ecol Systemat, 1987, 18(1): 237-268. doi: 10.1146/annurev.es.18.110187.001321
[18] SHIKANO T, CHIYOKUBO T, TANIGUCHI N. Effect of inbreeding on salinity tolerance in the guppy (Poecilia reticulata)[J]. Aquaculture, 2001, 202(1/2): 45-55. doi: 10.1016/S0044-8486(01)00568-3
[19] RYE M, MAO I L. Nonadditive genetic effects and inbreeding depression for body weight in Atlantic salmon (Salmo salar L. )[J]. Livestock Prod Sci, 1998, 57(1): 15-22. doi: 10.1016/S0301-6226(98)00165-1
[20] SU G S, LIJEDAHL L E, Gall G. Effects of inbreeding on growth and reproductive traits in rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1996, 142(3/4): 139-148. doi: 10.1016/0044-8486(96)01255-0
[21] 霍忠明. 菲律宾蛤仔数量遗传及家系育种研究[D]. 大连: 大连水产学院, 2009: 14-26. [22] MALLET A L, HALEY L E. Growth rate and survival in pure population matings and crosses of the oyster Crassostrea virginica[J]. Can J Fish Aquat Sci, 1983, 40(7): 948-954. doi: 10.1139/f83-121
[23] LANNAN J E. Broodstock management of Crassostrea gigas: I. Genetic and environmental variation in survival in the larval rearing system[J]. Aquaculture, 1980, 21(4): 323-336. doi: 10.1016/0044-8486(80)90067-8
[24] CHEPTOU P O, BERGER A, BLANCHARD A, et al. The effect of drought stress on inbreeding depression in four populations of the Mediterranean outcrossing plant Crepis sancta (Asteraceae)[J]. Evolution, 2000, 85(1): 294-302. https://www.nature.com/articles/6887590
[25] HUSBAND B, SCHEMSKE D W. Evolution of the magnitude and timing of inbreeding depression in plants[J]. Evolution, 1996, 50(1): 54-70. doi: 10.2307/2410780
-
期刊类型引用(3)
1. 徐成勋,李琪,张景晓,孔令锋. 近交对壳金长牡蛎(Crassostrea gigas)幼虫期与稚贝期生长和存活的影响. 海洋与湖沼. 2016(05): 977-981 .  百度学术
百度学术
2. 袁瑞鹏,刘建勇,张嘉晨,陈晓敏,郑静静,刘加慧. 近交对凡纳滨对虾(Litopenaeus vannamei)生长、存活及抗逆性的影响. 海洋与湖沼. 2016(06): 1250-1256 .  百度学术
百度学术
3. 范嗣刚,王婧璇,黄桂菊,刘宝锁,郭奕惠,喻达辉. 合浦珠母贝选育家系的遗传多样性分析. 南方水产科学. 2016(05): 90-96 .  本站查看
本站查看
其他类型引用(2)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
