Immune response of enzymes activities in Penaeus monodon serum with WSSV in latent period on reinfection
-
摘要:
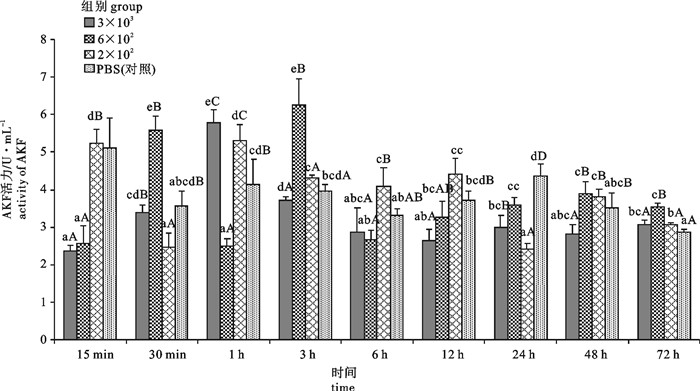
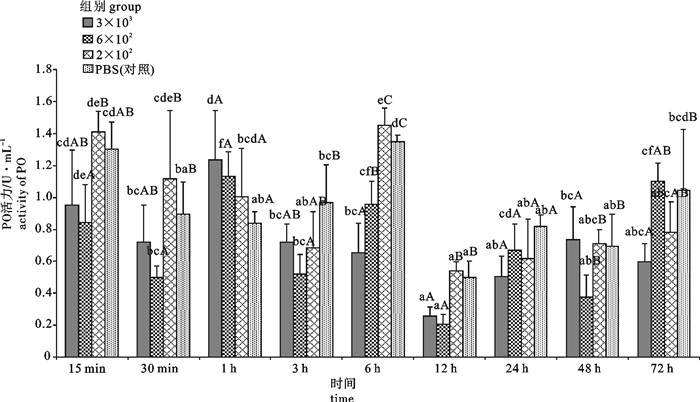
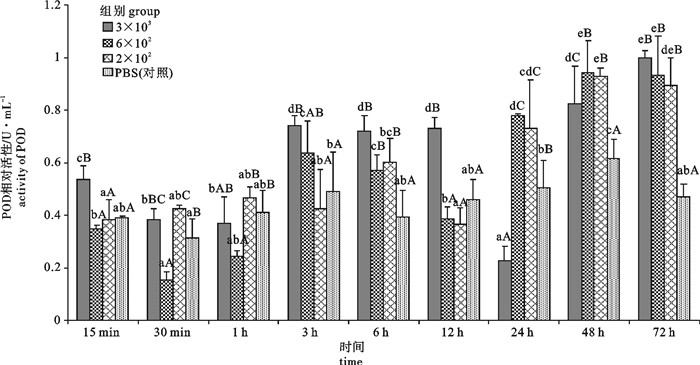
用含3×103 拷贝·mL-1、6×102 拷贝·mL-1和2×102 拷贝·mL-1的对虾白斑综合征病毒(white spot syndrome virus,WSSV)粗提液和PBS液(对照)注射感染病毒携带量约1×105 拷贝·g-1的斑节对虾(Penaeus monodon),分别于第15分钟、第30分钟、第1小时、第3小时、第6小时、第12小时、第24小时、第48小时、第72小时取样,研究了WSSV感染对斑节对虾血清内酸性磷酸酶(acid phosphatase,ACP)、碱性磷酸酶(alkaline phosphatase,AKP)、酚氧化酶(phenoloxidase,PO)、过氧化物酶(peroxidase,POD)和超氧化物歧化酶(superoxide dismutase,SOD)活性的影响。结果表明,在3种感染浓度下ACP、AKP、SOD活性总体呈现先上升后下降随后上升的趋势,其中SOD活性后期水平显著高于初期;PO、POD活性总体呈现先下降后上升随后下降最后上升的趋势,但PO后期活性水平与初期相当,而POD后期活性水平显著高于初期。各免疫相关酶的反应强度与WSSV的感染浓度存在一定关系,除ACP外其余4种酶的活性变化均以6×102拷贝·mL-1浓度组最为敏感。PBS组5种免疫酶活性变化幅度均显著小于3种WSSV浓度感染组。
Abstract:We studied the responses of 5 immuno-enzymes [acid phosphatase (ACP), alkaline phosphatase (AKP), phenoloxidase (PO), peroxidase (POD), superoxide dismutase (SOD)] activities in serum of Penaeus monodon (with 1×105 copies·g-1 WSSV) to the injection with crude WSSV solution containing 3×103 copies·mL-1, 6×102 copies·mL-1 and 2×102 copies·mL-1 virus and PBS at 15th minute, 30th minute, 1th hour, 3th hour, 6th hour, 12th hour, 24th hour, 48th hour, 72th hour. The activities of ACP, AKP and SOD first increased then decreased and then increased in the 3 groups of WSSV infection, while SOD activity was higher than the initial level significantly; the activities of PO and POD first decreased then increased then decreased and finally increased in the 3 groups of WSSV infection; the PO activity in later and earlier periods were equally the same, but POD activity was higher than the initial level significantly. The reactions of immuno-enzymes are related with the infection concentrations of WSSV, and the most sensitive changes of 4 enzymes activities except acid phosphatase are in the 6×102 copies·mL-1 WSSV group. The range of variation in the PBS group is smaller than that of 3 groups of WSSV infection.
-
Keywords:
- Penaeus monodon /
- WSSV /
- latent infection /
- reinfection /
- immune response
-
龙须菜(Gracilaria lemaneiformis)为江蓠属中的一种大型红藻,是适于近海大规模栽培的优良品种之一。其具有适应范围广、生长速度快、含胶量高[1]和经济价值高[2]等优点,且具有较高的蛋白质含量[3]和丰富的游离氨基酸组成,并含有丰富的活性物质,如海藻多糖[4]和甘露糖醇等[5],其营养物质大都以有机物形式存在,容易被动物消化吸收[6]。
海藻作为饲料添加剂的研究始于20世纪50年代[7],目前海藻粉作为畜禽饲料添加剂在美国、法国、英国等一些发达国家得到了广泛应用,且已建立相关的机构和生产厂家。在中国,海藻粉作为水产动物的饲料添加剂的技术才刚刚起步,且研究报道非常有限[8]。截止目前大型海藻在水产动物上的应用主要集中在鲍上,对鲍生长特别是幼体鲍的生长和成活起着至关重要的作用[9-10]。有研究表明,海藻作为饲料添加剂能有效地提高饲料效率[11],增强鱼虾抗病、抗应激能力[12-14],同时对鱼虾无不良反应。
眼斑拟石首鱼(Sciaenops ocellatus),又名美国红鱼、红拟石首鱼、红鼓鱼、黑斑红鲈、斑点尾鲈等, 隶属脊索动物门、辐鳍鱼纲、鲈鱼目、石首鱼科、拟石首鱼属[15]。此鱼肉质鲜美,含有丰富的预防心血管疾病的n-3多不饱和脂肪酸(PUFA),而且能完全适应中国内陆地区养殖,有着良好的发展前景[16]。目前不少研究机构正在开展眼斑拟石首鱼的研究工作,以促进这一优良品种的健康养殖和可持续利用。然而目前关于大型海藻应用于眼斑拟石首鱼上的研究还未见报道。因此,实验以眼斑拟石首鱼为研究对象,通过在饲料中添加龙须菜考察其对鱼体生长、免疫和肠道方面的影响。
1. 材料与方法
1.1 配方及饲料制备
实验饲料以面粉为主要糖源,以进口鱼粉、去皮豆粕和花生麸为主要蛋白源,以鱼油、豆油和磷脂油为主要脂肪源,以龙须菜为添加剂,配制成6种粗蛋白41%、粗脂肪10%的饲料,分别在饲料中添加0(对照组)、1%、2%、3%、4%和5%的龙须菜,将各原料混匀粉碎后过60目筛,按照表 1配方准确称量,混匀搅拌10 min后缓慢加入油源再搅拌10 min,最后加水搅拌至混合均匀。将搅拌均匀的混合物用双螺杆挤条机制粒,挤压并打磨成直径1.2 mm的颗粒,置于90 ℃烘箱中熟化90 min,室温风干至水分10%左右,用封口塑料袋分装,保存于-20 ℃冰箱备用。
表 1 饲料配方及营养成分Table 1. Formulation and proximate composition of basal diet% 原料
raw ingredientw(龙须菜) G. lemaneiformis 对照组
control1% 2% 3% 4% 5% 面粉wheat flour 20 19 18 17 16 15 进口鱼粉fish meal 30 30 30 30 30 30 啤酒酵母beer yeast 3 3 3 3 3 3 去皮豆粕dehulled soybean meal 17.4 17.4 17.4 17.4 17.4 17.4 花生麸peanut bran 12 12 12 12 12 12 谷朊粉wheat gluten 5 5 5 5 5 5 磷虾粉shrimp bran powder 2 2 2 2 2 2 进口鱼油fish oil 2.5 2.5 2.5 2.5 2.5 2.5 豆油soybean oil 1.5 1.5 1.5 1.5 1.5 1.5 磷脂油soybean lecithin 2 2 2 2 2 2 磷酸二氢钙calcium dihydrogenphosphate 2 2 2 2 2 2 海水鱼预混料① vitamin and mineral premix 2 2 2 2 2 2 氯化胆碱choline chiorlde 0.5 0.5 0.5 0.5 0.5 0.5 维C磷酸酯vitamin C phosphate 0.1 0.1 0.1 0.1 0.1 0.1 龙须菜Gracilaria lemaneiformis 0 1 2 3 4 5 营养成分(干物质)nutritional component (dry matter) 粗蛋白crude protein 40.68 40.50 41.50 41.06 40.42 41.52 粗脂肪crude lipid 10.70 10.68 10.30 9.88 10.09 10.35 粗灰分ash 10.20 10.47 10.65 10.86 11.51 11.47 水分moisture 9.24 9.21 8.59 9.79 9.26 9.06 注: ①每1 000 g饲料中含有以下成分:维生素A 25 000 IU,维生素D3 65 000 IU,维生素E 3.75 g,维生素K3 250 mg,维生素B1 300 mg,维生素B2 700 mg,维生素B6 400 mg,维生素B12 1 mg,肌醇2.5 g,维生素C 7 000 mg,烟酰胺2 000 mg,D-泛酸钙1 250 mg,叶酸125 mg,生物素10 mg,镁3 000 mg,碘250 mg,铜840 mg,锌4500 mg,硒20 mg,钴70 mg
Note: ① In 1 000 g diet contains: retinyl acetate 25 000 IU,vitamin D3 65 000 IU,phytogermine 3.75 g,menadione 250 mg,thiamin hydrochloride 300 mg,riboflavin 700 mg,pyridoxine hydrochloride 400 mg,cyanocobalamin 1 mg,inositol 2.5 g,ascorbicacid 7 000 mg,nicotinamide 2 000 mg,D-calcium pantothenate 1 250 mg,folic acid 125 mg,biotin 10 mg,Mg 3 000 mg,I 250 mg,Cu 840 mg,Zn 4 500 mg,Se 20 mg,Co 70 mg1.2 实验用鱼及管理
眼斑拟石首鱼取自实验室珠海鱼虾营养研究基地同一批当年孵化的鱼苗。正式实验前将眼斑拟石首鱼暂养于250 L水族箱中2周以适应养殖环境,暂养期间投喂商业饲料。经过驯化喂养,从600尾体格健壮、规格一致的实验鱼中随机挑选出360尾[平均体质量(9.38±0.06)g]分在6组共18个室内水族箱(250 L)内,每个箱放养20尾鱼(即每种饲料3个随机重复)。
将鱼苗分养后进行养殖实验,养殖周期为8周。每天分别于8: 30、17: 30进行投喂。实验期间定期进行水质测定,溶解氧为6~7 mg · L-1;pH为7.0~7.4;硫酸物为0~0.05 mg · L-1;亚硝酸氮为0.05~0.10 mg · L-1;氨氮为0.20~0.40 mg · L-1。
1.3 样品采集及分析
养殖实验结束后饥饿处理24 h,称量每箱鱼的终末总体质量并记录成活量,再从每箱中随机取出2尾鱼,-20 ℃保存用作全鱼体成分分析。另取5尾鱼,分别测量全长、体长、体质量、内脏质量、肝质量及肠脂质量用以形态学指标和生长指标计算;并对这5条鱼进行血液采集,采用肝素钠润湿注射器,从静脉窦取血,血样5 000 r · min-1离心10 min后取上清液,冻存到液氮中,取样结束后转移到-80 ℃保存以备血液生化指标测定。另取3尾鱼进行解剖,取其新鲜肝组织保存到-80 ℃以备肝脏超氧化物歧化酶(SOD)活性测定;同时取这3尾鱼的肠道,用去离子水冲洗干净,固定于10%甲醛固定液中,常温保存,用于肠道组织观察。相关计算公式为:
特定生长率(specific growth ratio,SGR,%)=100×[(ln末均质量-ln初始均质量)/实验天数];
增重率(weight gain,WG,%)=100×(终末体质量-初始体质量)/初始体质量;
成活率(survival,%)=100×成活尾数/初始尾数;
饲料效率(feed efficiency)=(终末体质量-初始体质量)/投喂饲料干质量;
肝体比(hepatosomatic index,HSI,%)=100×肝脏质量/体质量;
肥满度(condition factor,CF,%)=100×鱼体质量(g)/[体长(cm)]3;
脏体比(viscerasomatic index,VSI,%)=100×内脏质量/体质量;
肠脂比(intraperitoneal fat ratio,IPF,%)=100×肠脂质量/体质量
全鱼体成分分析指标(包括水分、灰分、粗脂肪和粗蛋白) 按照AOAC方法进行测定[17]。全鱼脂肪酸组成由中国广州分析测试中心运用气相色谱法进行测定,并采用峰面积归一化法计算脂肪酸的相对百分含量。血清生化指标[包括总蛋白(TP)、胆固醇(CHO)、低密度脂蛋白(LDL)]在自动生化测定仪上测定。肝脏SOD活性采用南京建成生物工程研究所生产的试剂盒测定。10%甲醛固定液中的肠道组织经苏木精-伊红染色制成肠道横切片后在Nikon正置荧光显微镜下观察。
1.4 数据统计
实验指标均以“平均数±标准差”表示,数据统计分析采用SPSS 19.0软件,经单因子方差分析(One-Way ANOVA),Duncan′s多重检验比较实验结果平均数之间的显著性差异(P < 0.05)。
2. 结果
2.1 生长指标及全鱼体成分
各组间增重率和特定生长率不存在显著性差异(P>0.05),但1% ~4%组眼斑拟石首鱼的增重率均高于对照组;1%组饲料效率显著高于5%组(P < 0.05);所有龙须菜添加组的HSI、VSI和IPF均低于对照组,且3%组HSI显著低于对照组(P < 0.05),2%和5%组VSI显著低于对照组(P < 0.05)(表 2)。各组间的成活率和肥满度不存在显著性差异(P>0.05)。从全鱼体成分分析可以看出,全鱼的粗蛋白和粗灰分在各组间均不存在显著性差异,而5%组全鱼水分显著高于对照组(P < 0.05);全鱼的粗脂肪质量分数为3.20%~4.87%,最高值出现在对照组且显著高于5%组(P < 0.05)。
表 2 饲料中添加龙须菜对眼斑拟石首鱼生长指标及全鱼体成分的影响Table 2. Effect of dietary G. lemaneiformis on growth performance and whole-body composition of S. ocellatusw(龙须菜) G. lemaneiformis 对照组control 1% 2% 3% 4% 5% 生长指标growth performance 初始质量/g initial body weight 9.40±0.03 9.40±0.03 9.37±0.09 9.34±0.12 9.40±0.09 9.37±0.03 终末质量/g final body weight 66.48±5.36 71.95±0.87 67.69±1.85 67.32±5.03 72.25±9.68 62.25±3.65 成活率/% survival 81.67±15.28 81.67±5.77 83.33±2.89 77.50±3.54 78.33±7.64 81.67±7.64 增重率/% weight gain 607.37±57.40 665.83±8.70 622.64±16.20 621.37±62.90 668.84±100.4 564.47±38.30 饲料效率feed efficiency 0.95±0.08ab 1.02±0.06a 0.95±0.01ab 0.95±0.02ab 0.97±0.08ab 0.87±0.08b 特定生长率/%·day-1 specific growth ratio 3.55±0.15 3.70±0.02 3.60±0.04 3.59±0.16 3.70±0.23 3.44±0.11 肝体比/% hepatosomatic index 1.47±0.06a 1.29±0.16ab 1.31±0.11ab 1.13±0.19b 1.35±0.09ab 1.23±0.18ab 脏体比/% viscerasomatic index 4.84±0.21a 4.38±0.24ab 4.17±0.33b 4.29±0.51ab 4.57±0.21ab 4.22±0.29b 脂体比/% intraperitoneal fat ratio 1.27±0.09 1.09±0.02 0.92±0.38 1.03±0.35 1.16±0.09 1.06±0.12 肥满度/% condition factor 1.65±0.03 1.62±0.03 1.59±0.03 1.63±0.04 1.62±0.05 1.61±0.06 全鱼体成分whole-body proximate composition 水分/% moisture 72.72±0.77b 74.26±0.19ab 73.49±0.89ab 73.77±0.16ab 74.26±1.08ab 75.02±1.22a 粗蛋白/% protein 17.55±0.09 17.91±0.62 17.28±0.19 17.46±0.16 17.16±0.72 17.32±0.24 粗脂肪/% lipid 4.87±1.03a 3.80±0.51ab 4.53±0.58a 4.23±0.08ab 4.43±0.18a 3.20±0.82b 粗灰分/% ash 5.77±0.12 6.43±1.04 5.92±0.23 5.81±0.21 5.65±0.04 5.57±0.11 注: 同一行数据后的不同上标字母表示在P < 0.05水平差异显著,后表同此
Note: Different superscript letters in the same row indicate significant difference among groups (P < 0.05). The same case in the following tables.2.2 全鱼的脂肪酸组成
全鱼脂肪酸中棕榈酸(C16 : 0)、油酸(C18 : 1)、亚油酸(C18 : 2)含量均超过10%(表 3)。各组间全鱼饱和脂肪酸(Saturated fatty acid,SFA)、单不饱和脂肪酸(Monounsaturated fatty acid,MUFA)、多不饱和脂肪酸(Polyunsaturated fatty acid,PUFA)、n-3 PUFA、n-6 PUFA、EPA+DHA均不存在显著性差异(P>0.05),但在0~3%添加组中,随着龙须菜添加的增加,EPA+DHA和n-3 PUFA呈上升趋势,所有龙须菜添加组的DHA、n-3 PUFA、n-6 PUFA、不饱和脂肪酸均高于对照组。1%组的油酸显著高于对照组(P < 0.05),1% ~4%组的亚油酸含量均高于对照组。2% ~4%组EPA含量高于对照组,1% ~3%组DPA含量高于对照组,DHA含量在2.81 ~3.31,最高值出现在5%组且显著高于对照组(P < 0.05)。
表 3 饲料中添加龙须菜对眼斑拟石首鱼全鱼脂肪酸组成的影响Table 3. Effect of dietary G. lemaneiformis on whole-body fatty acid composition of S. ocellatus% 脂肪酸
fatty acidw(龙须菜) G. lemaneiformis 对照组control 1% 2% 3% 4% 5% C14:0 1.70±0.03bc 1.68±0.06c 1.73±0.03b 1.73±0.01bc 1.79±0.03a 1.69±0.01bc C15:0 0.26±0.01b 0.27±0.01ab 0.27±0.01ab 0.28±0.02ab 0.28±0.01ab 0.29±0.01a C16:0 19.89±0.88 19.61±0.18 19.94±0.50 19.62±0.37 20.01±0.13 19.61±0.62 C16:1 3.69±0.20ab 3.55±0.15ab 3.60±0.14ab 3.70±0.24a 3.68±0.16ab 3.30±0.14b C17:0 0.55±0.02b 0.58±0.02b 0.56±0.02b 0.57±0.02b 0.56±0.01b 0.61±0.02a C17:1 0.37±0.04 0.34±0.02 0.34±0.02 0.35±0.02 0.37±0.05 0.33±0.03 C18:0 5.61±0.20 5.50±0.14 5.62±0.06 5.54±0.03 5.43±0.26 5.41±0.12 C18:1 32.75±0.68b 33.47±0.34a 32.65±0.34b 32.64±0.16b 33.12±0.06ab 33.11±0.38ab C18:2 21.28±0.74 21.76±0.52 21.52±0.73 21.55±0.62 21.30±0.64 22.15±0.33 C20:0 0.48±0.05 0.42±0.05 0.45±0.07 0.47±0.07 0.49±0.06 0.40±0.04 C18:3 1.86±0.20a 1.73±0.04ab 1.84±0.11a 1.79±0.03a 1.77±0.05ab 1.54±0.20b C20:1 1.41±0.16 1.24±0.12 1.31±0.19 1.41±0.23 1.38±0.18 1.13±0.15 C21:0 0.27±0.02 0.21±0.04 0.22±0.04 0.22±0.04 0.22±0.04 0.22±0.05 C20:2 0.54±0.04 0.54±0.03 0.54±0.03 0.56±0.01 0.52±0.03 0.50±0.05 C22:0 0.47±0.02a 0.43±0.03b 0.46±0.01ab 0.45±0.01ab 0.46±0.01ab 0.44±0.03ab ARA(C20:4) 0.70±0.04 0.68±0.03 0.81±0.15 0.78±0.08 0.71±0.04 0.84±0.07 C23:0 0.35±0.03a 0.33±0.05ab 0.36±0.01a 0.38±0.02a 0.34±0.01ab 0.29±0.04b EPA(C20:5) 1.88±0.13 1.87±0.07 1.93±0.08 1.93±0.03 1.91±0.04 1.85±0.13 C24:1 0.45±0.10 0.39±0.09 0.42±0.09 0.45±0.09 0.37±0.09 0.46±0.20 DPA(C22:5) 1.34±0.06 1.38±0.03 1.35±0.02 1.40±0.15 1.30±0.07 1.28±0.12 DHA(C22:6) 2.81±0.27b 3.01±0.30ab 2.99±0.21ab 3.07±0.31ab 2.94±0.10ab 3.31±0.12a EPA+DHA 4.68±0.39 4.88±0.36 4.92±0.29 5.01±0.32 4.85±0.09 5.15±0.06 SFA 29.79±1.05 29.11±0.53 29.72±0.69 29.25±0.48 29.56±0.29 29.10±0.57 MUFA 38.94±0.52 39.26±0.34 38.50±0.29 38.83±0.59 39.21±0.51 38.62±0.25 PUFA 31.27±1.29 31.64±0.86 31.78±0.96 31.93±1.05 31.23±0.76 32.28±0.41 n-3 PUFA 7.89±0.64 7.99±0.42 8.11±0.34 8.20±0.37 7.92±0.07 7.97±0.09 n-6 PUFA 22.52±0.79 22.99±0.51 22.88±0.87 22.88±0.70 22.54±0.70 23.48±0.44 2.3 血清生化指标及肝SOD活性
各组间的血清总蛋白(TP)和胆固醇(CHO)不存在显著性差异(P>0.05),且所有龙须菜添加组均低于对照组;而1%组血清中LDL含量显著低于5%组和对照组(P < 0.05),其他各组间不存在显著性差异(表 4)。肝脏SOD活性为14.74~24.25,各添加组均高于对照组,在0~4%组呈上升趋势,且4%组肝脏SOD活性显著高于对照组(P < 0.05)(图 1)。
表 4 饲料中添加龙须菜对眼斑拟石首鱼血清生化指标的影响Table 4. Effect of dietary G. lemaneiformis on several haemolymph parameters of S. ocellatus生化指标
haemolymph parameterw(龙须菜) G. lemaneiformis 对照组control 1% 2% 3% 4% 5% ρ(总蛋白)/g·L-1 TP 40.20±1.55 35.17±3.16 36.57±1.79 36.47±1.69 38.33±2.24 34.73±5.67 c(胆固醇)/mmol·L-1 CHO 5.91±0.47 4.76±0.70 5.37±0.35 5.29±0.41 5.42±0.42 4.74±1.17 c(低密度脂蛋白)/mmol·L-1 LDL 0.42±0.08b 0.23±0.08a 0.38±0.15ab 0.38±0.05ab 0.39±0.02ab 0.49±0.13b 2.4 肠道组织学
眼斑拟石首鱼肠道组织学切片中各组间的环肌层厚度不存在显著性差异(P>0.05),但在0~4%组呈上升趋势。各组间的黏膜皱数量无显著性差异(P>0.05)(表 5)。2%和3%组的肠道黏膜褶高度显著高于5%组(P < 0.05),且其他各组间不存在显著性差异(P>0.05)。饲料中添加3%龙须菜后,肠道绒毛较对照组和5%组发育良好,杯状细胞明显增多(图 2)。
表 5 饲料中添加龙须菜对眼斑拟石首鱼肠道组织学的影响Table 5. Effect of dietary G. lemaneiformis on intestinal histology of S. ocellatusw(龙须菜) G. lemaneiformis 对照组control 1% 2% 3% 4% 5% 黏膜褶高/μm mucosa fold height 667.2±77.45ab 673.5±81.92ab 742.1±39.30a 706.8±21.50a 653.5±99.72ab 536.8±111.26b 环肌层厚度/μm muscular ring thickness 37.1±15.03 37.2±16.57 41.0±12.96 42.1±2.85 53.7±13.35 40.0±17.32 黏膜皱数量mucosa fold quantity 16.0±2.65 20.0±4.36 16.5±0.71 16.7±1.53 16.3±2.31 15.3±2.08 3. 讨论
3.1 添加龙须菜对眼斑拟石首鱼生长及全鱼脂肪酸组成的影响
实验1%~4%组增重率分别比对照组提高了9.63%、3.19%、2.98%和10.12%,证明添加适量龙须菜对眼斑拟石首鱼有一定的促生长效果,但随着龙须菜添加量提高,5%组体增重反而出现了下降。这与海藻在其他水产动物上的研究结果类似。PEN AFLORIDA和GOLEZ[18]在斑节对虾(Penaeus monodon)饲料中添加5%长心卡帕藻(Kappaphycus alvarezii)增重率比对照组有所提高;周歧存和肖风波[19]添加不同水平的海藻粉到罗氏沼虾(Macrobrachium rosenbergii)饲料中,发现添加海藻粉具有显著的促生长效果,但是随着添加海藻粉水平的上升,罗氏沼虾的体增重反而下降;在最近的报道中,VALENTE等[20]发现在舌齿鲈(Dicentrarchus labrax)饲料中脆江蓠(Gracilaria bursa-pastoris)和硬石莼(Ulva rigida)的添加量超过10%时不利于鱼体生长;SOLER-VILA[21]研究发现虹鳟(Oncorhynchus mykiss)饲料中紫菜(Porphyra dioica)添加量不宜超过10%,否则不利于鱼体生长。龙须菜添加量5%时增重率出现下降可能与其丰富的多糖有关,有研究报道称海藻中丰富的多糖能够影响水产动物对蛋白质和干物质的消化率[22-23]。可见龙须菜的添加有一个适宜范围,过量添加可能会对生长产生不利影响。
n-3系列和n-6系列脂肪酸被认为是水产动物的必需脂肪酸(EFA)[24],是维持动物正常组织细胞结构和生理机能所必需的。实验结果中1%~5%组粗脂肪含量均低于对照组,且5%组较对照组降低了34.3%。所有龙须菜添加组的全鱼多不饱和脂肪酸和DHA含量均高于对照组。徐树德等[25]在黄斑篮子鱼(Siganus canaliculatus)中投喂浒苔(Enteromorpha prolifra)、龙须菜、冰鲜鱼、配合饲料(自制)等4种饲料,发现海藻投喂组全鱼脂肪含量明显低于配合饲料组和冰鲜鱼组,而肌肉中的多不饱和脂肪酸含量高于配合饲料组和冰鲜鱼组。与该实验的结果相近。已知的关于海藻添加到水产动物饲料中对其脂肪酸组成影响的报道较少,主要还是集中在哺乳动物方面。唐秀敏[26]提到奶牛基础日粮中添加深海野生海藻能明显改变奶牛乳脂肪中脂肪酸的组成,功能性脂肪酸DHA的含量显著增加。OR-RASHID等[27]发现随日粮中海藻添加水平的增加,牛瘤胃液中DHA含量显著升高。均与实验结果中所有龙须菜添加组全鱼DHA含量均高于对照组,且当龙须菜添加量为5%时DHA含量显著性高于对照组(P < 0.05)较为相似。
3.2 添加龙须菜对眼斑拟石首鱼血清生化指标及肝脏SOD的影响
胆固醇可以反映鱼体全身脂类代谢状况,一般认为血液中70% ~80%的胆固醇来源于肝脏,少量来源于消化道,当肝细胞发生功能障碍或者损伤时,血清的胆固醇含量迅速升高[28]。LDL在血液中起转运内源性胆固醇及胆固醇酯的作用,主要功能是把胆固醇运输到全身各处细胞。有研究表明,海藻多糖具有降低胆固醇和甘油三酯的作用[29]。此实验结果中,LDL在1% ~4%龙须菜添加组低于对照组,CHO在1% ~5%龙须菜添加组都低于对照组,与孙建凤等[30]在肉鸡日粮中添加3%和4%浒苔能够显著降低总胆固醇和甘油三酯的实验结果相近。说明饲料中添加一定量的龙须菜可以降低血清中LDL含量,降低血脂。
SOD是机体过氧化物酶系统的一种,可特异性地催化机体由于自身代谢或在外界胁迫下耗氧细胞在氧化还原反应中产生的一系列有毒的超氧化物,将其转化为过氧化氢和氧,再由过氧化氢酶系统的其他成员转化过氧化氢为无毒的水和氧,从而保障机体正常的生理功能[31]。龙须菜中含有的多酚类物质对过氧化氢、超氧阴离子、羟基自由基等具有清除作用,从而增强机体的免疫应答[32]。且有报道称,龙须菜含有的海藻多糖类物质能显著提高SOD活性[33-34]。此实验中随着饲料中龙须菜水平的增加,眼斑拟石首鱼肝脏的SOD活性呈升高的趋势,并在龙须菜水平达到4%时其SOD活性达到峰值。说明添加龙须菜中含有的多酚和海藻多糖类物质可以提高眼斑拟石首鱼的抗氧化能力,从而增强机体清除自由基的能力,减少脂质的过氧化损伤。
3.3 添加龙须菜对眼斑拟石首鱼肠道组织学的影响
有研究表明,在斑节对虾中添加1%和3%裙带菜(Undaria pinnatifida)有助于提高肠道绒毛高度[35]。肠道中黏膜褶和微绒毛等结构是动物吸收营养物质的重要渠道及防御屏障,绒毛高度可以反映肠道吸收面积,有助于对营养物质的消化吸收[36-37]。此结果表明,添加1% ~3%的龙须菜对肠道绒毛的高度有一定的提高,添加2% ~4%的龙须菜对于肠绒毛的脱落情况和绒毛密度有所改善,其中以添加2%和3%的龙须菜效果最佳,绒毛整齐完整,绒毛密度相对于对照组增高,有利于肠道吸收面积的增加和营养物质消化利用率的提高。
肠道环肌通过波状收缩形成肠蠕动,进而推动食团向后移动,其节律性舒缩是肠道运动的主要动力,有利于肠道营养物质的消化[38]。结果表明,添加龙须菜对于肠道的环肌层的厚度有一定的改善,其中以添加4%龙须菜最佳,有利于肠道蠕动,促进肠道营养物质的吸收。杯状细胞能分泌黏液和消化酶,黏液起润滑作用,且能与消化酶共同作用帮助消化,故杯状细胞的多少可间接反映鱼类的消化能力[39]。结果表明,添加3%的龙须菜的肠道绒毛中杯状细胞的数量明显多于其他组;添加3% ~5%的龙须菜对肠道的炎症反应有所改善,其中以3%最佳,有助于肠道营养物质的消化吸收。
此实验结果表明,饲料中添加龙须菜对眼斑拟石首鱼生长有一定的促进作用,且添加适量龙须菜可以改善眼斑拟石首鱼肝脏和肠道健康,提高全鱼DHA含量。
-
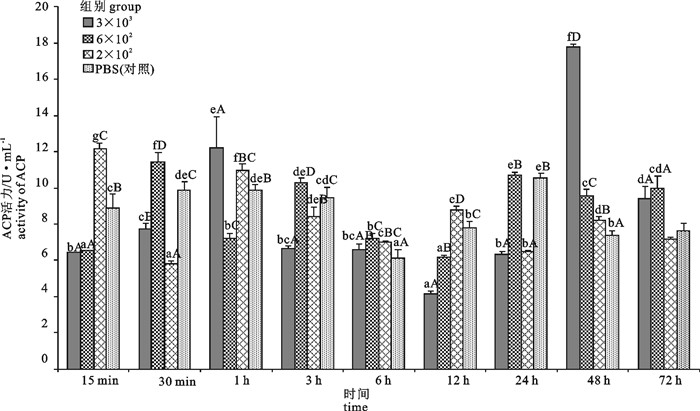
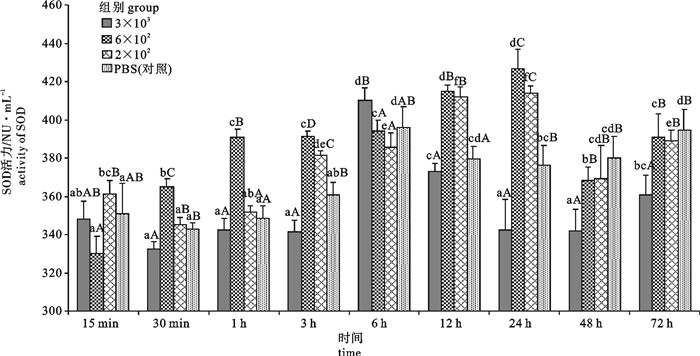
图 1 感染不同浓度的WSSV后不同时间潜伏期斑节对虾血液中ACP活性变化
不同小写字母表示同一WSSV浓度下不同时间点时活性差异显著,n=3,P < 0.05;不同大写字母表示同一时间点不同WSSV浓度间活性差异显著,P < 0.05;下图同此
Figure 1. Change of ACP activity of P.monodon with different concentrations of WSSV solution in different latent periods
Different small letters indicate significant difference among different periods with the same WSSV concentrations, n=3, P < 0.05;different captial letters indicate significant difference in the same period with different WSSV concentrations, P < 0.05. The same case in the following figures.
-
[1] 张家明, 刘志昕. 对虾白斑综合症的研究进展[J]. 华南热带农业大学学报, 2002, 8(3): 22-27. doi: 10.3969/j.issn.1674-7054.2002.03.005 [2] 雷质文, 黄倢, 杨冰, 等. 感染白斑综合症病毒(WSSV)对虾相关免疫因子的研究[J]. 中国水产科学, 2001, 8(4): 46-51. doi: 10.3321/j.issn:1005-8737.2001.04.011 [3] LO C F, LEU J H, HO C H, et al. Detection of baculovirus associated with spot syndrome (WSBV) in Penaeid shrimps using polymerase chain reaction[J]. Dis Aquat Org, 1996, 25(1/2): 133-141. doi: 10.3354/dao025133
[4] WITHYACHUMNARNKUL B. Results from black tiger shrimp Penaeus monodon culture ponds stocked with postlarvae PCR-positive or -negative for white-spot syndrome virus (WSSV)[J]. Dis Aquat Org, 1999, 39(1): 21-27.
[5] 邱德全, 谢数涛, 齐雪娟, 等. 斑节对虾虾苗白斑综合症杆状病毒的检测和养殖跟踪[J]. 湛江海洋大学学报, 1999, 19(4): 11-15. https://lib.cqvip.com/Qikan/Article/Detail?id=4784741&from=Qikan_Search_Index [6] 孙成波, 李婷, 王平, 等. 高位池养殖对虾携带白斑综合症病毒变化[J]. 海洋通报, 2009, 28(2): 116-120. doi: 10.3969/j.issn.1001-6392.2009.02.017 [7] 张涛, 郭志勋, 黄建华, 等. 低剂量对虾白斑综合症病毒粗提液对斑节对虾体内潜伏期病毒及血细胞的影响[J]. 水产学报, 2012, 36(10): 1544-1553. [8] 赵红霞, 詹勇, 许梓荣. 水产动物免疫增强剂的研究[J]. 饲料研究, 2001(8): 1-4. https://lib.cqvip.com/Qikan/Article/Detail?id=5753348&from=Qikan_Search_Index [9] 李光友. 中国对虾疾病与免疫机制[J]. 海洋科学, 1995(4): 1-3. [10] 王建平, 吴雄飞. 虾类血细胞及体液免疫的研究现状[J]. 浙江海洋学院学报: 自然科学版, 2000, 19(4): 354-360. doi: 10.3969/j.issn.1008-830X.2000.04.011 [11] 吴垠, 邢殿楼, 祝国芹, 等. 中国对虾暴发性流行病的血液病理研究[J]. 中国水产科学, 1998, 5(3): 53-57. [12] 宋林生, 苏建国, 蔡中华, 等. 正常与感染白斑病的凡纳滨对虾几项免疫指标变化的初步研究[M]. 北京: 科学出版社, 2003: 335-340. https://xueshu.baidu.com/usercenter/paper/show?paperid=7bccca753f2139165cca82e8d7b83fb7&site=xueshu_se&hitarticle=1 [13] ASHIDA M. Purification and characterization of pre-pheonoloxidase from hemolymph of the silkworm Bombyx mori[J]. Arch Biochem Biophy, 1971, 144(2): 749-762. https://www.sciencedirect.com/science/article/abs/pii/0003986171903833
[14] 宋晓玲, 黄倢, 王秀华, 等. 白斑综合征病毒感染与对虾的免疫防御反应[J]. 中国水产科学, 2006, 13(6): 1033-1039. doi: 10.3321/j.issn:1005-8737.2006.06.026 [15] 陈清西, 陈素丽, 朱凌翔, 等. 长毛对虾碱性磷酸酶功能集团的研究[J]. 厦门大学学报: 自然科学版, 1996, 35(4): 589-591. https://xueshu.baidu.com/usercenter/paper/show?paperid=3421510f256703d1ed1bfe1e3e7caf89&site=xueshu_se [16] 刘庆慧, 黄倢, 杨冰, 等. 人工选育中国对虾两个群体WSSV感染相关免疫与生化因子的变化[J]. 海洋水产研究, 2005, 26(6): 22-27. doi: 10.3969/j.issn.1000-7075.2005.06.005 [17] 刘树青, 江晓路, 牟海津, 等. 免疫多糖对日本对虾血清酶活性的影响[J]. 中国水产科学, 1999, 6(3): 111-113. doi: 10.3321/j.issn:1005-8737.1999.03.027 [18] 刘晓云, 张志峰, 马洪明. 中国对虾血细胞酶细胞化学的初步研究[J]. 青岛海洋大学学报, 2002, 32(2): 259-265. doi: 10.3969/j.issn.1672-5174.2002.02.012 [19] DONG C H, ZHAO J M, SONG L S, et al. The immune responses in Chinese mitten crab Eriocheir sinensis challenged with double-stranded RNA[J]. Fish Shellfish Immun, 2009, 26(3): 438-442. doi: 10.1016/j.fsi.2009.01.005
[20] 张曼, 宋维彦, 王军. 白斑综合征病毒对日本囊对虾仔虾免疫相关酶活性的影响[J]. 厦门大学学报: 自然科学版, 2011, 50(1): 117-122. [21] 李国荣, 张士璀, 李红岩, 等. 酚氧化酶研究概况Ⅰ——特性、功能、分布和胚胎发育中的变化[J]. 海洋科学, 2003, 27(4): 4-8. doi: 10.3969/j.issn.1000-3096.2003.04.002 [22] 丁秀云, 李光友, 翟玉梅. 皱纹盘鲍经诱导后血淋巴中一些因子变化的研究[J]. 海洋与湖沼, 1996, 27(4): 362-367. doi: 10.1007/BF02029074 [23] 王雷, 李光友. 甲壳动物的体液免疫研究进展[J]. 海洋科学, 1992(3): 18-19. https://lib.cqvip.com/Qikan/Article/Detail?id=770039&from=Qikan_Search_Index [24] HUNG H S, HUNG J C, CHENG H H, et al. Phenoloxidase activity of hemocytes derived from Penaeus monodon and Macrobrachoum rosenbergii[J]. J Invertebr Pathol, 1998, 71(1): 26-33. doi: 10.1006/jipa.1997.4703
[25] 汪小锋, 雷廷俊, 从日山, 等. 几种免疫促进剂对中国对虾血细胞数量、形态结构以及酚氧化酶产量和活性的影响[J]. 水产学报, 2005, 29(1): 66-73. https://lib.cqvip.com/Qikan/Article/Detail?id=15053542&from=Qikan_Search_Index [26] 邱德全, 杨士平, 邱明生. 氨氮促使携带白斑综合症病毒凡纳滨对虾发病及其血细胞、酚氧化酶和过氧化氢酶变化[J]. 渔业现代化, 2007(1): 36-39. https://lib.cqvip.com/Qikan/Article/Detail?id=23912290&from=Qikan_Search_Index [27] SHINN P Y, YING N C, SHU L H, et al. Immune response of white shrimp, Litopenaeus vannamei, after a concurrent infection with white spot syndrome virus and infectious hypodermal and hematopoietic necrosis virus[J]. Fish Shellfish Immunol, 2009, 26(4): 582-588. doi: 10.1016/j.fsi.2008.09.010
[28] 王秀华, 宋晓玲, 黄倢. 肽聚糖制剂对南美白对虾体液免疫因子的影响[J]. 中国水产科学, 2004, 11(1): 26-30. https://lib.cqvip.com/Qikan/Article/Detail?id=9092748&from=Qikan_Search_Index [29] 王专伟, 黄建华, 杨其彬, 等. 感染白斑综合症病毒的斑节对虾免疫酶变化特征[J]. 湖北农业科学, 2011, 50(9): 1851-1854. https://lib.cqvip.com/Qikan/Article/Detail?id=38302281&from=Qikan_Search_Index [30] 林庆斌, 廖升荣, 熊亚红, 等. 超氧化物歧化酶(SOD) 的研究和应用进展[J]. 化学世界, 2006(6): 378-381. doi: 10.3969/j.issn.0367-6358.2006.06.016 [31] 张明, 王雷, 郭振宇, 等. 脂多糖和弧菌对中国对虾血清磷酸酶、超氧化物歧化酶和血蓝蛋白的影响[J]. 海洋科学, 2004, 28(7): 22-25. https://lib.cqvip.com/Qikan/Article/Detail?id=10029850&from=Qikan_Search_Index [32] 孙虎山, 李光友. 硒多糖和酵母聚糖对栉孔扇贝血淋巴中二种抗氧化酶活力的影响[J]. 中国海洋药物, 2000(5): 20-23. https://lib.cqvip.com/Qikan/Article/Detail?id=4717273&from=Qikan_Search_Index [33] 黄旭雄, 周洪琪. 不同规格中国明对虾的非特异性免疫水平[J]. 上海水产大学学报, 2006, 15(1): 7-11. https://lib.cqvip.com/Qikan/Article/Detail?id=21027845&from=Qikan_Search_Index [34] 丁美丽, 林林, 李光友, 等. 有机污染对中国对虾体内外环境影响的研究[J]. 海洋与湖沼, 1997, 28(1): 7-12. https://lib.cqvip.com/Qikan/Article/Detail?id=2881978&from=Qikan_Search_Index [35] 鄢庆枇, 张俊杰, 邹文政, 等. 人工感染溶藻弧菌对大黄鱼免疫功能的影响[J]. 水产学报, 2007, 31(2): 96-102. https://lib.cqvip.com/Qikan/Article/Detail?id=24481216&from=Qikan_Search_Index [36] 黄永春. 凡纳滨对虾抗WSSV家系选育及抗病特性和遗传性状研究[D]. 广州: 中山大学, 2007. https://xueshu.baidu.com/usercenter/paper/show?paperid=5b7c399072f21c78bd90d2346e3114c8&site=xueshu_se -
期刊类型引用(12)
1. 杨勇,陈林,王耀华,颜庆云,贺厚雄,李旭宁,张松. 3种大型海藻对加州鲈幼鱼生长性能和生理生化指标的影响. 饲料研究. 2024(17): 61-66 .  百度学术
百度学术
2. 胡晓娟,赵秀,杨宇峰,曹煜成. 大型海藻龙须菜(Gracilaria lemaneiformis)藻段凋落分解对环境的影响及细菌群落演替特征. 海洋学报. 2023(08): 130-142 .  百度学术
百度学术
3. 周胜杰,杨蕊,韩明洋,王一福,于刚,马振华. 海南近海青干金枪鱼Thunnus tonggol和小头鲔Euthynnus affinis幼鱼的营养成分分析及评价. 水产学杂志. 2021(01): 23-28 .  百度学术
百度学术
4. 宣雄智,李文嘉,朱文婷,苏杰南. 龙须菜对翘嘴红鲌生长、消化和血液生化指标的影响. 中国饲料. 2020(19): 74-81 .  百度学术
百度学术
5. 郭斌,梁萌青,徐后国,卫育良,张庆功,李本相,廖章斌. 江蓠、浒苔、藻渣和菌渣替代鱼粉对红鳍东方鲀幼鱼生长性能、相关生化指标的影响. 渔业科学进展. 2019(03): 141-150 .  百度学术
百度学术
6. 郭斌,梁萌青,徐后国,卫育良. 江蓠、浒苔、藻渣和菌渣替代鱼粉对大菱鲆幼鱼生长性能、血清和肝脏生化指标、体组成和肠道组织结构的影响. 动物营养学报. 2018(01): 299-312 .  百度学术
百度学术
7. 宣雄智,李文嘉,卢玉标. 龙须菜对异育银鲫消化吸收、免疫及抗氧化性能的影响. 中国畜牧兽医. 2018(06): 1526-1534 .  百度学术
百度学术
8. 林亚楠,涂丹,沈清,张益奇,薛静,戴志远. 美国生长的鲫营养品质及关键风味物质研究. 南方水产科学. 2018(03): 99-106 .  本站查看
本站查看
9. 宣雄智,李文嘉,卢玉标. 龙须菜对异育银鲫生长、体组成及营养代谢的影响. 河南农业科学. 2018(10): 130-136 .  百度学术
百度学术
10. 黄忠,周传朋,林黑着,谭小红,彭景书,周文川,赵书燕,戚常乐. 饲料异亮氨酸水平对卵形鲳鲹消化酶活性和免疫指标的影响. 南方水产科学. 2017(01): 50-57 .  本站查看
本站查看
11. 武宇辉,王庆,魏南,刘之威,欧林坚,杨宇峰. 不同鲍养殖模式下浮游植物群落结构与水质特征的比较. 南方水产科学. 2017(06): 73-81 .  本站查看
本站查看
12. 陈洪彬,杨敏,宋露露,董乐. 龙须菜多酚提取工艺优化及其体外抗氧化活性. 食品与机械. 2017(04): 139-143+194 .  百度学术
百度学术
其他类型引用(5)



 下载:
下载:


 粤公网安备 44010502001741号
粤公网安备 44010502001741号
