Comparison of phytoplankton community structure and water quality in different modes of abalone mariculture
-
摘要:
为研究不同鲍养殖模式对浮游植物群落结构和水环境的影响,于2016年5月至6月初大型海藻龙须菜(Gracilaria lemaneiformis)收获前后,选取汕头市南澳县深澳湾海域鲍单养区(A)、鲍与龙须菜混养区(GA)、过渡海区(M)和对照海区(C),对浮游植物群落及水体理化因子进行了6次高频调查。结果表明,调查海区共记录浮游植物4门45属84种,其中硅藻为优势类群,共37属71种。时间上比较,龙须菜收获后所有调查海区浮游植物细胞密度都显著高于龙须菜收获前(P < 0.05);各养殖区域间比较,龙须菜收获前鲍单养区浮游植物细胞密度显著高于鲍-龙须菜混养区(P < 0.05)。龙须菜收获前,鲍-龙须菜混养区总氮(TN)、总磷(TP)、氨氮(NH4+-N)和叶绿素a(Chl-a)浓度最低,多样性指数(H′)及均匀度指数(J′)最高; 龙须菜收获后各区无显著差异(P>0.05)。影响浮游植物群落结构特征的理化因子为TN、TP、水温和叶绿素a。该研究表明,鲍-大型海藻复合养殖模式可降低鲍养殖水体中氮、磷的浓度,并维持浮游植物群落结构相对的稳定。
Abstract:To study the effects of different modes of abalone mariculture on phytoplankton community structure and water environment, we carried out six surveys on the phytoplankton community and environmental factors in four mariculture areas (abalone culture area, Gracilaria lemaneiformis-abalone polyculture area, transition area and control area) in Shen′ao Bay, Nan′ao Island of Shantou City, from May to June, 2016. Altogether 84 species belonging to 45 genera of 4 phyla were recorded. The diatoms were the most dominant population with 37 genera and 71 species. For all culture areas, the average density of phytoplankton in after-harvest-period was higher than that in before-seaweed-harvest-period significantly (P < 0.05).The average density of phytoplankton in abalone culture area in before-harvest-period was higher than that in G.lemaneiformis-abalone polyculture area in after-harvest-period significantly (P < 0.05).In before-harvest-period, the concentrations of total nitrogen (TN), total phosphorus (TP), ammonia nitrogen (NH4+-N) and chlorophyll-a (Chl-a) in G.lemaneiformis-abalone polyculture area were the lowest, while the values of Shannon-Wiener index and Pielou′s were the highest. No significant difference was found in different culture areas in after-harvest-period. The phytoplankton community structure was affected by TN, TP, water temperature (T) and chlorophyll a significantly. It is indicated that G.lemaneiformis-ablone polyculture system can reduce the concentrations of nitrogen and phosphorus, maintaining relative stable community structure of phytoplankton.
-
Keywords:
- Gracilaria lemaneiformis /
- abalone /
- phytoplankton /
- integrated aquaculture /
- water quality
-
鲍经济价值高,近年来在福建、广东的养殖发展很快。但随着鲍养殖产业规模不断扩大,养殖海区污染问题逐渐显露且日益突出[1]。针对海水养殖区存在的水体富营养化和有害藻华频发等生态环境问题,一些学者提出用大型海藻规模栽培对海域进行生态修复[2]。
浮游植物是海洋生态系统重要的初级生产者,其种类组成、群落结构、生物量等可反映环境变化情况,是评价水体质量的重要指标[3]。大型海藻龙须菜(Gracilaria lemaneiformis)在汕头南澳海域已有10多年的栽培历史,在环境调控方面有重要作用[4]。近年来,在南澳一些海区开展了鲍-大型海藻混养,取得了良好的经济效益,但尚未见到环境评估方面的报道。因此,为了解鲍养殖对水环境的影响及龙须菜栽培对鲍养殖环境的改善,该研究针对深澳湾鲍单养区、鲍-龙须菜混养区及相邻水域浮游植物和水质环境的动态变化进行了连续2个月6个航次调查,以期为海上鲍-龙须菜复合养殖模式推广提供基础数据和科学依据。
1. 材料与方法
1.1 研究区域及采样点分布
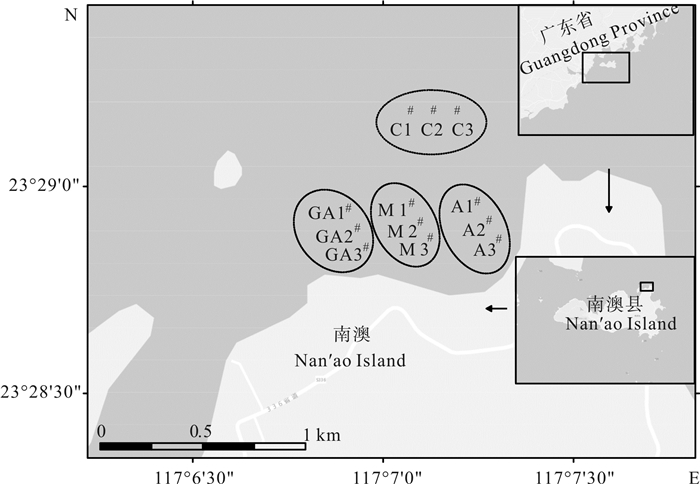
于2016年5月至6月初对深澳湾鲍养殖区及邻近水体进行连续6个航次调查,其中5月12日、5月15日、5月18日、5月23日4个航次为龙须菜收获前时段,5月28日、6月7日2个航次为龙须菜收获后时段。采样点分4个海区,共12个,其中鲍单养区3个(A1、A2、A3);鲍-龙须菜混养区3个(GA1、GA2、GA3);过渡海区3个(M1、M2、M3),位于A区与GA区之间的非养殖海区; 对照海区3个(C1、C2、C3),位于湾外的非养殖海区,各样点具体位置见图 1。
1.2 理化指标采集与分析
水温(T)和盐度(Sal)使用YSI Pro Plus现场测定; 水化样品使用有机玻璃采水器采集表层0.5 m水样,低温保存后带回实验室分析。总氮(TN)、总磷(TP)、氨氮(NH4+-N)、硝酸氮(NO3--N)、亚硝酸氮(NO2--N)的测定参照《海洋调查规范第4部分:海水化学要素调查》; 叶绿素a(Chl-a)的测定采用丙酮萃取法[5]。
1.3 浮游植物样品采集与分析
浮游植物定性样品采集使用40 μm浮游生物网采集,用于种类鉴定; 定量样品使用有机玻璃采水器采集表层0.5 m水样1 L,现场用鲁哥氏液固定,带回实验室静置、浓缩后,再用甲醛溶液固定至终体积分数5%。定量样品使用0.1 mL浮游生物计数框在显微镜下计数。
1.4 数据处理与分析
生物多样性指数使用物种数(S)、Shannon-Wiener多样性指数(H′)和Pielou′s均匀度指数(J′)表示。其中Shannon-Wiener多样性指数是种类和种类中个体分配上均匀性的综合指标[6],Pielous均匀度指数代表群落内物种分布的均匀程度[7]。
选取优势度(Y)>0.02的种类为优势种[8]。浮游植物细胞密度数据首先经4次开方降低优势物种的优势度,然后使用PRIMER 5.0软件的等级聚类分析CLUSTER和非参数多维尺度分析MDS进行聚类。使用REALTE功能检验群落结构数据矩阵与理化因子矩阵是否相关,然后用BEST/BIOENV进一步分析影响浮游生物群落结构最佳的理化因子组合。浮游植物群落与各理化因子之间的关系,使用CANOCO 4.5软件的典范对应分析冗余分析(redundancy analysis,RDA)的序标图表示。使用SPSS 16.0软件分析浮游植物细胞密度和理化因子在不同时间点和不同养殖模式之间的差异。
2. 结果
2.1 水质理化指标
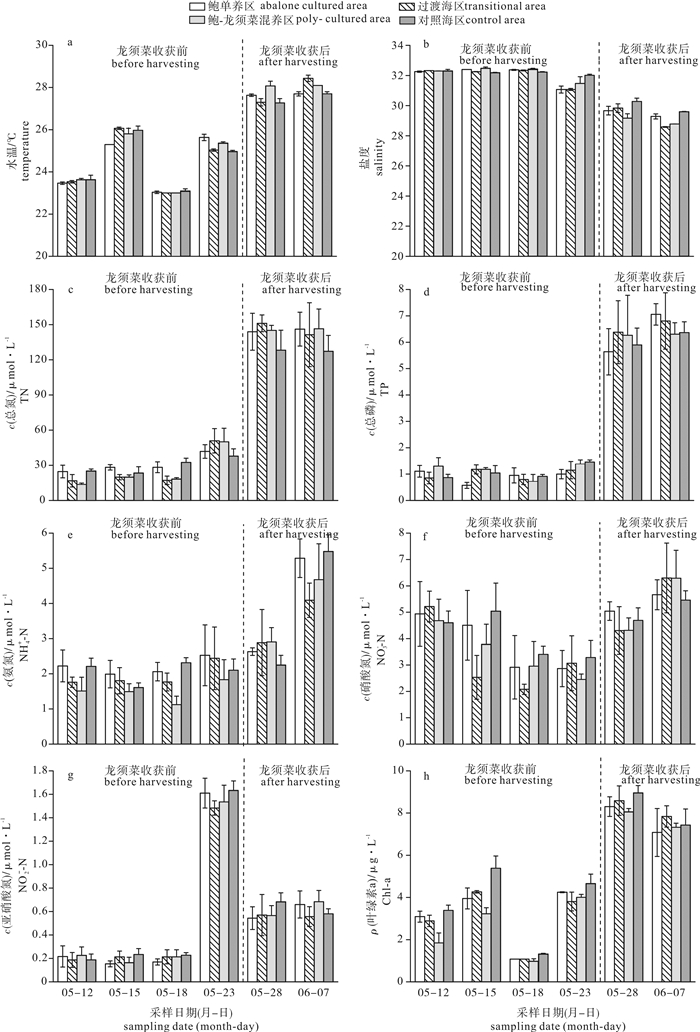
水温在龙须菜收获后[(27.78±0.40)℃]显著高于龙须菜收获前[(24.41±1.17)℃](P < 0.01),随调查时间呈升高趋势(图 2-a); 盐度为龙须菜收获前(32.09±0.47)显著高于龙须菜收获后(29.40±0.56)(P < 0.01),呈降低趋势(图 2-b)。而各海区之间温度和盐度均无显著差异(P>0.05)。
龙须菜收获前后TN平均浓度分别为(28.00±12.23)μmol·L-1和(141.20±15.69)μmol·L-1(图 2-c),TP平均浓度分别为(1.03±0.29)μmol·L-1和(6.34±0.87)μmol·L-1(图 2-d),TN、TP浓度均表现出龙须菜收获后显著高于收获前(P < 0.01)。龙须菜收获前各功能区TN的平均浓度分别为(30.77±7.92)μmol·L-1(鲍单养区)、(26.19±15.88)μmol·L-1(过渡海区)、(25.33±15.81)μmol·L-1(鲍-龙须菜混养区)和(29.71±7.20)μmol·L-1(对照海区),空间分布表现为鲍单养区>对照海区>过渡海区>鲍-龙须菜混养区,且鲍单养区TN浓度显著高于鲍-龙须菜混养区(P < 0.05),但TP各区之间无显著差异(P>0.05);龙须菜收获后TN、TP鲍单养区与鲍-龙须菜混养区均无显著差异(P>0.05)。龙须菜收获前后NH4+-N平均浓度为(1.92±0.52)μmol·L-1和(3.77±1.31)μmol·L-1(图 2-e),龙须菜收获后NH4+-N浓度显著高于收获前(P < 0.01)。龙须菜收获前NH4+-N空间分布为鲍单养区>过渡海区>鲍-龙须菜混养区且鲍单养区NH4+-N浓度显著高于鲍-龙须菜混养区(P < 0.01)。龙须菜收获前后NO3--N平均浓度分别为(3.64±1.23)μmol·L-1和(5.25±1.00)μmol·L-1(图 2-f),NO2--N平均浓度分别为(0.54±0.60)μmol·L-1和(0.61±0.10)μmol·L-1(图 2-g)。龙须菜收获后各区NH4+-N、NO3--N、NO2--N浓度均无显著差异。
龙须菜收获后叶绿素a质量浓度[(7.95±0.81)μg·L-1]显著高于龙须菜收获前[(3.07±1.40)μg·L-1](P < 0.01)(图 2-h),龙须菜收获前Chl-a质量浓度整体呈现出对照海区>鲍单养区>过渡海区>鲍-龙须菜混养区,鲍单养区显著高于鲍-龙须菜混养区(P < 0.05)。龙须菜收获后各区之间无显著差异(P>0.05)。
2.2 浮游植物种类组成及细胞密度变化
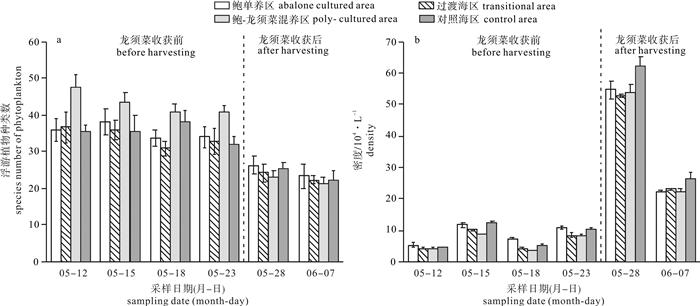
调查期间共鉴定出浮游植物4门45属84种,其中硅藻种类数最多,计37属71种,占84.52%;甲藻有6属11种,占13.10%;着色鞭毛藻和蓝藻各鉴定出一种,分别是小等刺硅鞭藻(Dictyocha fibula)和红海束毛藻(Trichodesmium erythaeum)。优势种有16种(15种硅藻,1种甲藻),其中收获前优势种为旋链角毛藻(Chaetoceros curvisetus)、中肋骨条藻(Skeletonema costatum)、菱形藻(Nitzschia sp.)等; 收获后优势种为海链藻(Thalassiosira sp.)、尖刺拟菱形藻(Pseudo-nitzschia pungens)、中肋骨条藻等。龙须菜收获前后优势种总种数变化较大,且收获前优势种和总种数远高于收获后(图 3-a, 表 1)。
表 1 深澳湾浮游植物优势种类名录Table 1 Catalogue of phytoplankton species in Shen′ao Bay编号No. 种名species name 龙须菜收获前before harvesting 龙须菜收获后after harvesting 1 中肋骨条藻Skeletonema costatum + + 2 旋链角毛藻Chaetoceros curvisetus + + 3 尖刺拟菱形藻Pseudo-nitzschia pungens + + 4 海链藻Thalassiosira sp. + + 5 菱形藻Nitzschia sp. + + 6 劳式角毛藻Chaetoceros lorenzianus + 7 冕胞角毛藻Chaetoceros diadema + 8 丹麦细柱藻Leptocylindrus danicus + 9 刚毛根管藻Rhizosolenia setigera + 10 柔弱角毛藻Chaetoceros debilis + 11 笔尖形根管藻Rhizosolenia styliformis + 12 短角弯角藻Eucampia zodiacus + 13 具槽直链藻Melosira sulcata + 14 优美旭式藻Schroderella delicatula + + 15 海洋原甲藻Prorocentrum micans + 16 多甲藻Peridinium sp. + 注:+.优势种
Note:+. dominant species调查期间深澳湾海区浮游植物细胞密度变化范围为(3.32~64.36)×104个·L-1,龙须菜收获后浮游植物细胞密度[(39.74±16.86)×104个·L-1]显著高于收获前[(7.43±3.03)×104个·L-1](P < 0.01)。龙须菜收获前,浮游植物的平均细胞密度趋势为鲍单养区[(8.80±2.72)×104个·L-1]>对照海区[(8.11±3.64)×104个·L-1]>过渡海区[(6.79±2.73)×104个·L-1]>鲍-龙须菜混养区[(5.99±2.47)×104个·L-1],其中鲍单养区浮游植物细胞密度显著高于鲍-龙须菜混养区(P < 0.05)(图 3-b); 龙须菜收获后,浮游植物的平均细胞密度趋势为对照海区[(44.33±19.73)×104个·L-1]>鲍单养区[(38.53±17.80)×104个·L-1]>鲍-龙须菜混养区[(38.17±17.32)×104个·L-1]>过渡海区[(37.93±16.35)×104个·L-1](图 3-b),其中对照海区浮游植物平均细胞密度相对较高,鲍单养区与鲍-龙须菜混养区无显著差异(P>0.05)。
2.3 浮游植物群落结构聚类分析
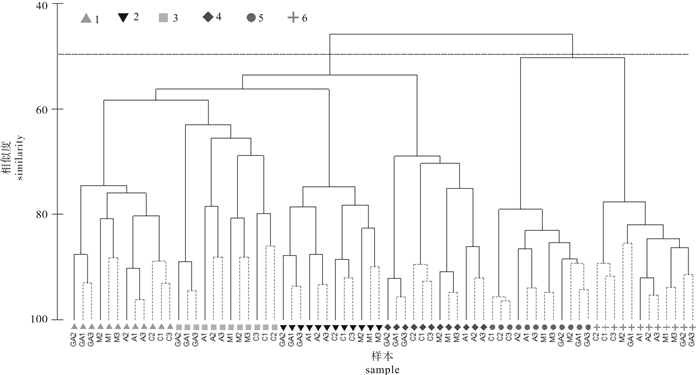
对6次调查的浮游植物时空分布进行等级聚类分析,结果显示时间上按龙须菜收获前、龙须菜收获后分为两组,龙须菜收获前组的4个小类中各站点均聚类明显,GA1、GA2和GA3,M1、M2和M3,A1、A2和A3,C1、C2和C3;龙须菜收获后组的2个小类中各站点无明显聚类规律(图 4)。
2.4 浮游植物多样性分析
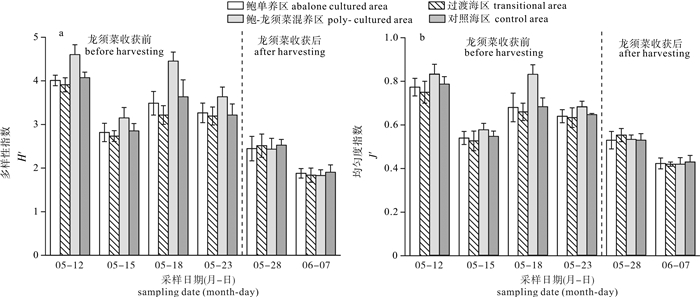
鲍单养区龙须菜收获前浮游植物H′和J′分别为3.40和0.66,龙须菜收获后的平均值分别为2.16和0.48;鲍-龙须菜混养区龙须菜收获前的平均值分别为3.95和0.73,龙须菜收获后的平均值为2.13和0.48(图 5)。浮游植物多样性指数和均匀度指数均表现为龙须菜收获前高于龙须菜收获后,且在龙须菜收获前鲍-龙须菜混养区H′和J′均显著高于鲍单养区(P < 0.05),但龙须菜收获后两者差异不显著(P>0.05)。
2.5 浮游植物群落结构与理化因子的关系
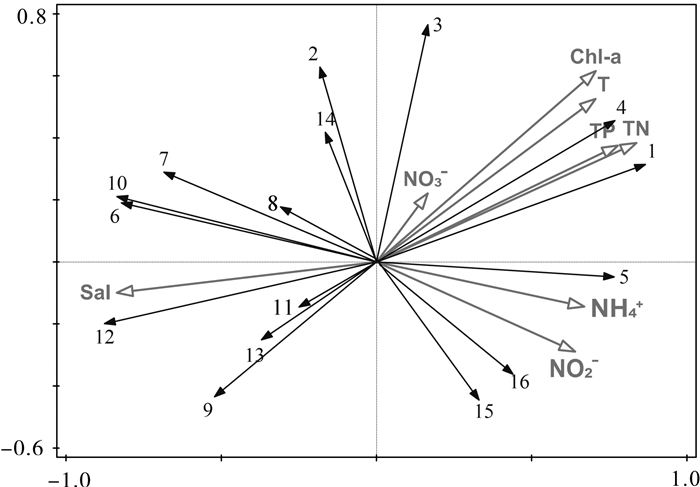
PRIMER RELATE功能检验浮游植物细胞密度矩阵与理化因子矩阵的相关性,得出两者具有较高的相关性(rho=0.728;P < 0.01);BIOENV/BEST功能进一步分析得出影响浮游植物群落结构特征的最佳理化因子组合为Chl-a、TN、TP和T(rho=0.742,P < 0.01),各因子相关性从高至低的顺序为TN>Chl-a>T>TP(TN:R=0.665;Chl-a:R=0.641;T:R=0.618;TP:R=0.589)。筛选Y>0.02的种类作为优势种进行RDA(表 1),结果显示,优势物种海链藻、中肋骨条藻均与TN、TP、Chl-a、T呈显著正相关,与Sal均呈显著负相关。Chl-a、TN、TP、T和Sal对浮游植物群落结构的影响相对较大(图 6)。
3. 讨论
3.1 不同调查海区水质营养盐特征
调查发现,TN、TP浓度均表现出龙须菜收获前显著高于收获后(P < 0.01)。这可能是因为5月是龙须菜生长最快的时期,其快速生长的同时将水体中大量的氮(N)、磷(P)同化到了体内,随着大面积收获,大量氮、磷营养盐也被转移出水体[9]。龙须菜收获前各功能区TN浓度空间分布整体表现为鲍单养区>对照海区>过渡海区>鲍-龙须菜混养区,且鲍单养区TN浓度显著高于鲍-龙须菜混养区(P < 0.05),但TP各区之间无显著差异(P>0.05),这可能是因为鲍养殖排出的代谢物会造成养殖环境氮营养盐的积累,污染水质,从而导致鲍单养区的TN浓度最高。鲍的含氮排泄物主要以NH4+-N为主[10],该调查发现,龙须菜收获前鲍单养区NH4+-N浓度显著高于鲍-龙须菜混养区(P < 0.01),而NO3--N和NO2--N浓度在各区之间无显著差异(P>0.05),这可能是在鲍-龙须菜混养区,与鲍混养的龙须菜有效吸收了鲍在养殖的过程中释放出的NH4+-N营养盐。孙伟等[11]在2个月的鲍-藻混养实验中发现,实验末期,鲍养殖水体中NH4+-N相比对照组降低了85.9%。由此可见,龙须菜栽培对鲍养殖海区水质的改善有着重要作用。
3.2 不同调查海区浮游植物群落结构特征及其影响因素
深澳湾调查海域主要优势种有旋链角毛藻、中肋骨条藻、尖刺拟菱形藻、菱形藻、海链藻等。与前几年的调查结果比较,中肋骨条藻的优势地位没有改变,一直为该海域的优势种[12-14]。龙须菜收获前深澳湾浮游植物细胞密度总体较低,种类丰富,形成以旋链角毛藻、中肋骨条藻等为主的浮游植物群落结构,其中鲍-龙须菜混养区浮游植物细胞密度最低,种类数最多(47种); 龙须菜收获后该海域形成了以海链藻、尖刺拟菱形藻、中肋骨条藻为绝对优势的浮游植物群落,群落结构单一化明显,浮游植物细胞密度高但种类少。
浮游植物群落结构季节变化较为明显,在龙须菜收获前,鲍-龙须菜混养区浮游植物细胞密度显著低于鲍单养区,造成这种分布趋势的原因可能是鲍-龙须菜混养区的龙须菜为筏式养殖,龙须菜生物量大,大面积龙须菜栽培导致水体透光性降低,抑制浮游植物光合作用; 大型海藻与浮游植物之间对光、空间、营养盐均有竞争,龙须菜通过遮光效应、营养竞争、化感作用等影响了浮游植物的生长繁殖[15],上述因素的综合结果导致鲍-龙须菜混养区浮游植物细胞密度低。在龙须菜被收获后,浮游植物的细胞密度迅速升高。在原鲍-龙须菜混养区,没有了龙须菜对浮游植物的抑制作用以后,该海域的浮游植物细胞密度与鲍单养区的细胞密度没有显著差别。对照海区的浮游植物细胞密度在整个调查期间均为最高,可能原因是对照海区位于塔屿外海域,水流交换活跃,营养盐充足,光照条件好,利于浮游植物生长繁殖,使其成为浮游植物细胞密度高值区。H′和J′整体表现为龙须菜收获前>龙须菜收获后,在龙须菜收获前鲍-龙须菜混养区H′和J′均显著高于其他海区(P < 0.05)。等级聚类分析显示,在龙须菜收获前的4次调查中,各调查站位按鲍-龙须菜混养区、鲍单养区、过渡海区和对照海区分别聚类在一起,群落结构组成差异明显; 而龙须菜收获后的2次调查则显示各站位聚类不明显,各海区之间群落结构无显著差异。各功能区浮游植物群落分析表明,鲍-龙须菜混养区浮游植物群落结构最稳定。
RDA分析表明,该调查的几种环境因子中,除NO3-外,其他环境因子均对浮游植物细胞密度产生了较大影响,其中TN、TP、水温和盐度是影响浮游植物分布的关键因子。氮磷的增加促进海域浮游植物的增长[16],在复合养殖系统浮游植物与环境因子关系的研究中,TN、TP被证明是影响浮游植物种类丰度的重要因子[17]。水温的升高和盐度的降低导致优势种发生改变,中肋骨条藻和海链藻的密度升高[18-24]。该次调查结果表明在龙须菜收获后南澳海区的持续降雨天气导致海水盐度下降,与此同时海链藻和中肋骨条藻细胞密度迅速升高,这与之前国内外文献报道结果相一致。
3.3 鲍藻混养模式
传统的单一品种高密度鱼、贝类养殖造成水域环境恶化,大力推广生态系统水平复合海水养殖模式将是今后海水养殖发展的方向之一[25]。大型海藻是天然的生物过滤器,它可以去除养殖生物的可溶性代谢物,改善水质,综合调控养殖环境[26-28]。大型海藻龙须菜可抑制浮游植物生长,对环境起到修复作用[29-30]; 许多实验也证明了龙须菜具有抑制海洋微藻、增加浮游植物种类数、防治赤潮的作用[9, 31],且以龙须菜作为饲料添加成分可促进养殖动物的生长[32]。在鲍藻生态系统中,处于不同生态位的两者在生态功能上相互补充,构成一种复合式的养殖系统。鲍的代谢消耗水体溶解氧,释放N、P等无机营养盐并降低水体pH; 大型海藻则吸收养殖水体中的营养盐,促进自身的生长; 还可通过光合作用,吸收利用鲍在代谢中排放的二氧化碳(CO2),产生氧气(O2)并提高水体pH。在这种养殖系统中,因饵料输入、养殖生物代谢造成的营养负荷,可以通过大型藻类的吸收净化得到减缓。龙须菜等大型海藻生产力高、吸收作用强,可以通过 规模化栽培平衡鲍养殖排泄物等的环境负面效应, 可有效改善鲍养殖区的水质。大型海藻生产力高, 对营养盐的吸收作用强,可以通过大型海藻的规模 化养殖来改善海水养殖区的水质状况,防治赤潮风 险等。龙须菜的快速生长将水体中大量的氮、磷营 养物质同化吸收。随着龙须菜的大面积收获,大量 营养盐也被转移出海洋生态系统[33]。另外,鲍排泄物主要以氨氨(NH4+-N)为主,游离态氮(NH3-N)与海水NH4+-N浓度呈正相关,而NH3对鲍毒性很大,随着NH3质量浓度增加,鲍的摄食量也直线下降[34]。孙伟等[11]对龙须菜在贝藻混养系统中的生态作用研究发现,2个月的时间,养殖水体中NH4+-N降低86%。由此可见,龙须菜在鲍藻混养系统中对氨氮的吸收,使鲍-龙须菜混养区的NH4+-N浓度低于鲍单养区。在鲍-龙须菜混养模式下,龙须菜可有效利用鲍排泄物NH4+-N,降低NH3对鲍的毒性。
鲍藻混养中的鲍养殖利用现有筏式养殖海藻设施,节省了固定资产投资,且混养的海藻作为鲍的饵料,降低其饲料和饲料运费成本,在混养中鲍藻养殖期部分重叠,节省劳动力费用。通过皱纹盘鲍(Haliotis discus hannai)与海藻混养实验发现,混养鲍的成活率、肥满度均比单养高,且混养鲍的发病率较低,混养组的经济收益也比单养组多了70余万元,还可鲍藻混养,有较高的生态效益与经济效益[35]。模拟研究杂色鲍(H.discus discus)与灰叶马尾藻(Sargassum cinereum)、细基江蓠繁枝变种(Gracilaria tenuistiptitata var.liui)生态混合养殖效果结果表明,鲍与这2种大型海藻混合养殖可明显提高鲍的成活率[36]。
南澳海域鲍藻混养利用现有海藻养殖设施, 以养殖龙须菜为鲍的饵料,鲍的排泄物作为海藻的营养,鲍藻互利共生,可促进海洋生态系统营养物质良性循环,促进海藻和鲍养殖的共同发展,增加渔民收入,具有良好的经济和生态效益。因此,鲍-大型海藻混养是值得推崇的健康养殖模式。
-
表 1 深澳湾浮游植物优势种类名录
Table 1 Catalogue of phytoplankton species in Shen′ao Bay
编号No. 种名species name 龙须菜收获前before harvesting 龙须菜收获后after harvesting 1 中肋骨条藻Skeletonema costatum + + 2 旋链角毛藻Chaetoceros curvisetus + + 3 尖刺拟菱形藻Pseudo-nitzschia pungens + + 4 海链藻Thalassiosira sp. + + 5 菱形藻Nitzschia sp. + + 6 劳式角毛藻Chaetoceros lorenzianus + 7 冕胞角毛藻Chaetoceros diadema + 8 丹麦细柱藻Leptocylindrus danicus + 9 刚毛根管藻Rhizosolenia setigera + 10 柔弱角毛藻Chaetoceros debilis + 11 笔尖形根管藻Rhizosolenia styliformis + 12 短角弯角藻Eucampia zodiacus + 13 具槽直链藻Melosira sulcata + 14 优美旭式藻Schroderella delicatula + + 15 海洋原甲藻Prorocentrum micans + 16 多甲藻Peridinium sp. + 注:+.优势种
Note:+. dominant species -
[1] 柯才焕.我国鲍鱼养殖产业现状与展望[J].中国水产, 2013(1):27-30. http://d.wanfangdata.com.cn/Periodical/zhongguosc201301010 [2] 杨宇峰.近海环境生态修复与大型海藻资源利用[M].北京:科学出版社, 2016:14-21. [3] 王朝晖, 韩博平, 胡韧, 等.广东省典型水库浮游植物群落特征与富营养化研究[J].生态学杂志, 2005, 24(4):402-405. http://d.wanfangdata.com.cn/Periodical/stxzz200504012 [4] 张学成, 费修绠, 王广策, 等.江蓠属海藻龙须菜的基础研究与大规模栽培[J].中国海洋大学学报(自然科学版), 2009, 39(5):947-954. http://d.wanfangdata.com.cn/Periodical/qdhydxxb200905017 [5] 陈宇炜, 高锡云.浮游植物叶绿素a含量测定方法的比较测定[J].湖泊科学, 2000, 12(2):185-188. doi: 10.18307/2000.0215 [6] SHANNON C E. The mathematical theory of communication (Reprinted)[J].Q Rev Biol, 1997, 14(4):306-317.
[7] PIELOU E C. An introduction to mathematical ecology[J].Bioscience, 1969, 24(2):7-12.
[8] 孙军, 刘东艳.多样性指数在海洋浮游植物研究中的应用[J].海洋学报, 2004, 26(1):62-75. http://d.wanfangdata.com.cn/Periodical/hyxb200401007 [9] YANG Y F, LIU Q, CHAI Z Y, et al. Inhibition of marine coastal bloom-forming phytoplankton by commercially cultivated Gracilaria lemaneiformis (Rhodophyta)[J].J Appl Phycol, 2015, 27(6):2341-2352. doi: 10.1007/s10811-014-0486-0
[10] 赖龙玉, 严正凛, 钟幼平. 4种不同藻类与鲍混养的初步试验[J].集美大学学报(自然科学版), 2014, 19(2):89-94. http://d.wanfangdata.com.cn/Periodical/jmdxxb-zr201402002 [11] 孙伟, 张涛, 杨红生, 等.龙须菜在滩涂贝藻混养系统中的生态作用模拟研究[J].海洋科学, 2006, 30(12):72-76. doi: 10.3969/j.issn.1000-3096.2006.12.015 [12] 周凯, 黄长江, 姜胜, 等. 2000-2001年拓林湾浮游植物群落结构及数量变动的周年调查[J].生态学报, 2003, 22(5):688-698. http://www.cnki.com.cn/Article/CJFDTotal-STXB200205010.htm [13] 王亮根, 杜虹, 陈伟洲, 等.深澳湾浮游植物群落特征及其多样性研究[J].生态科学, 2010, 29(3):200-206. http://d.wanfangdata.com.cn/Periodical/stkx201003002 [14] 张俊梅, 刘擎, 王庆, 等.汕头南澳白沙湾浮游植物群落结构及水体营养盐分布特征[J].水生态学杂志, 2012, 33(2):61-68. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=scan201202011&dbname=CJFD&dbcode=CJFQ [15] 汤坤贤, 游秀萍, 林亚森, 等.龙须菜对富营养化海水的生物修复[J].生态学报, 2005, 25(11):3044-3051. doi: 10.3321/j.issn:1000-0933.2005.11.035 [16] 陈露, 李纯厚, 戴明, 等.西沙永兴岛附近海域秋末氮磷营养盐加富对浮游植物生长限制的影响[J].南方水产科学, 2016, 12(4):125-130. http://www.schinafish.cn/CN/abstract/abstract9348.shtml [17] 王璐, 李冰, 孙盛明, 等.复合养殖系统中浮游植物群落结构及其与水环境因子的关系[J].水生态学杂志, 2015, 36(5):81-88. http://d.wanfangdata.com.cn/Periodical/sstxzz201505013 [18] GOLDMAN J C, MANN R. Temperature-influenced variations in speciation and chemical composition of marine phytoplankton in outdoor mass cultures[J].J Exp Mar Bio Ecol, 1980, 46(1):29-39. doi: 10.1016/0022-0981(80)90088-X
[19] 王妍, 张永, 王玉珏, 等.胶州湾浮游植物的时空变化特征及其与环境因子的关系[J].安全与环境学报, 2013, 13(1):163-170. http://d.wanfangdata.com.cn/Periodical/aqyhjxb201301036 [20] 杨晓改, 薛莹, 昝肖肖, 等.海州湾及其邻近海域浮游植物群落结构及其与环境因子的关系[J].应用生态学报, 2014, 25(7):2123-2131. http://d.wanfangdata.com.cn/Periodical/yystxb201407038 [21] MIYAHARA K, NAGAI S, ITAKURA S, et al. First record of a bloom of Thalassiosira diporocyclus in the Eastern Seto Inland Sea[J].Fish Sci, 1996, 62(6):878-882. doi: 10.2331/fishsci.62.878
[22] 陈善文, 高亚辉, 杜虹, 等.双环海链藻(Thalassiosira diporocyclus Hasle)赤潮[J].海洋与湖沼, 2004, 35(2):130-137. http://www.cnki.com.cn/Article/CJFDTotal-HYFZ200402003.htm [23] YAMAMOTO T, TSUCHIYA H. Physiological responses of Si-limited Skeletonema costatum to silicate supply with salinity decrease[J].Bull Plankton Soc Jpn, 1995, 42(1):1-17.
[24] 郭永坚, 罗昭林, 朱长波, 等.水产养殖对流沙湾浮游植物群落特征的影响[J].南方水产科学, 2015, 11(2):57-65. http://www.schinafish.cn/CN/abstract/abstract9197.shtml [25] ABREU M H, PEREIRA R, YARISH C, et al. IMTA with Gracilaria vermiculophylla:productivity and nutrient removal performance of the seaweed in a land-based pilot scale system[J].Aquaculture, 2011, 312(1/2/3/4):77-87.
[26] NEORI A, KROM M D, ELLNER S P, et al. Seaweed biofilters as regulators of water quality in integrated fish-seaweed culture units[J].Aquaculture, 1996, 141(3):183-199.
[27] 岳维忠, 黄小平, 黄良民, 等.大型藻类净化养殖水体的初步研究[J].海洋环境科学, 2004, 23(1):13-15. http://d.wanfangdata.com.cn/Periodical/hyhjkx200401004 [28] KEMP J, BRITZ P J, AGUEERO P. The effect of macroalgal, formulated and combination diets on growth, survival and feed utilisation in the red abalone Haliotis rufescens[J].Aquaculture, 2015, 448:306-314. doi: 10.1016/j.aquaculture.2015.06.016
[29] MULDERIJ G, SMOLDERS A P, DONK E. Allelopathic effect of the aquatic macrophyte, Stratiotes aloides, on natural phytoplankton[J].Freshw Biol, 2006, 51(3):554-561. doi: 10.1111/fwb.2006.51.issue-3
[30] 杨宇峰, 宋金明, 林小涛, 等.大型海藻栽培及其在近海环 境的生态作用[J].海洋环境科学, 2005, 24(3):77-80. http://d.wanfangdata.com.cn/Periodical/hyhjkx200503020 [31] 刘婷婷, 杨宇峰, 叶长鹏, 等.大型海藻龙须菜对两种海洋赤潮藻的生长抑制效应[J].暨南大学学报(自然科学与医学版), 2006, 27(5):754-759. http://d.wanfangdata.com.cn/Periodical/jndxxb200605022 [32] 李雅婷, 陈明, 曾帅霖, 等.饲料中添加龙须菜对眼斑拟石首鱼生长、脂肪酸组成、免疫及肠道的影响[J].南方水产科学, 2016, 12(1):85-93. http://www.schinafish.cn/CN/abstract/abstract9290.shtml [33] 李宵, 杨宇峰, 陈伟洲.大型海藻龙须菜对浮游植物群落结构影响的实验研究[J].生态科学, 2009, 28(2):102-106. http://d.wanfangdata.com.cn/Periodical/stkx200902002 [34] 李顺志, 张言怡, 王宝捷, 等.扇贝海带间养试验研究[J].海洋湖沼通报, 1983(4):71-77. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hyfb198304009&dbname=CJFD&dbcode=CJFQ [35] 欧俊新, 严正凛.南方鲍藻混养技术研究及其效益分析[J].集美大学学报(自然版), 2011, 16(3):172-177. http://d.wanfangdata.com.cn/Periodical/jmdxxb-zr201103003 [36] 赵素芬, 孙会强.杂色鲍与2种海藻混养效果研究[J].水产养殖, 2017, 38(1):40-46. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=scyz201701014&dbname=CJFD&dbcode=CJFQ -
期刊类型引用(3)
1. 林青,张东升,魏亚南,孙广伟,雷兆霖,陈济丰,郭超,周玮. 3种水质调控方式对刺参池塘浮游植物种群结构的影响. 大连海洋大学学报. 2019(04): 566-572 .  百度学术
百度学术
2. 杨蕊,吴开畅,于刚,温为庚,陈旭,赵旺,叶乐. 养殖模式对方斑东风螺生长及主要环境因子的影响. 水产科学. 2019(05): 610-615 .  百度学术
百度学术
3. 刘陈,魏南,王庆,刘之威,罗洪添,杨宇峰. 广东汕头南澳岛近岸海域浮游植物群落结构与环境特征. 应用与环境生物学报. 2019(05): 1091-1098 .  百度学术
百度学术
其他类型引用(4)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
