Types and distribution of mucous cells in digestive tracts of wild and cultivated yellowfin black porgy (Sparus latus)
-
摘要:
采用常规石蜡组织切片及AB-PAS的染色方法对野生和养殖黄鳍鲷(Sparus latus)消化道中粘液细胞的类型及分布情况进行了比较观察研究。黄鳍鲷粘液细胞在消化道各部位均有分布,不同部位粘液细胞的类型和分布均有差异。食道中以Ⅰ、Ⅱ型粘液细胞为主;贲门部和胃体部只有Ⅰ、Ⅱ型粘液细胞分布,幽门部只有Ⅰ型粘液细胞;幽门盲囊、肠道及直肠都是Ⅱ型粘液细胞最多。野生与养殖黄鳍鲷粘液细胞的区别在于消化道的相同部位养殖鱼比野生鱼粘液细胞数量更多。根据研究结果推测粘液细胞的类型和分布与鱼的生活环境及食物相关,也可能与消化道中各种菌群的分布有关。
Abstract:We study the types and distribution of mucous cells in the digestive tract of wild and cultivated yellowfin black porgy (Sparus latus) by using routine paraffin tissue section and AB-PAS staining method. The mucous cells distribute at every section of the alimentary canal of yellowfin black porgy; however, the types and distribution of cells vary at different sections. Type Ⅰ and Ⅱ mucous cells are in the majority in esophagus; cardiac stomach and fundic stomach only have Type Ⅰ and Ⅱ; pyloric stomach only has Type Ⅰ; Type Ⅱ is in the majority in pyloric caeca, intestine and rectum. The difference of wild and cultivated yellowfin black porgy lies in the number of mucous cells which are more in wild fish than in cultivated fish at the same section of digestive tract. It is concluded that the types and distribution of mucous cells in the digestive tract are related with the living condition and food of fish, and probably with the distribution of flora.
-
Keywords:
- yellowfin black porgy (Sparus latus) /
- digestive tract /
- mucous cells
-
鱼类粘液细胞是普遍存在于鱼类消化道上皮中的一种腺体细胞,能分泌大量粘液,粘液中的粘多糖、糖蛋白、免疫球蛋白和各种水解性酶类等活性物质对鱼类的许多生理功能有重要作用。深入研究鱼类粘液细胞,不仅能帮助人们理解鱼类生长、发育以及自我保护等方面的一些基本理论问题,而且对于防治鱼类在养殖过程中出现的病害问题也具有重要的指导意义。黄鳍鲷(Sparus latus)隶属鲈形目、鲈亚目、鲷科,广东俗称黄脚



1. 材料与方法
1.1 试验材料
2010年9月,野生黄鳍鲷5尾购于深圳市盐田农贸市场,该鱼为当地渔民用刺网在大鹏湾海区捕获所得,体质量为215.0~265.0 g,体长为17.5~19.5 cm。养殖黄鳍鲷5尾购于广州市番禺清河市场,该鱼由番禺龙穴岛养殖区的池塘捕获上市,体质量为205.0~275.0 g,体长为17.3~20.8 cm。10尾鱼均健康无病,活动状态正常。根据鱼体特征可区分野生型和养殖型。
1.2 试验方法
迅速解剖试验用鱼,取出整个消化道,观察其形态特征、拍照并测量相关数据。取消化道组织,取材部位为食道、胃、幽门盲囊和肠道。用Carnoy液固定24 h。常规石蜡包埋、切片,切片厚5 μm,AB-PAS染色,中性树胶封片。在ZEISS显微镜下对消化道不同部位上皮中的粘液细胞着色情况进行观察,取10个不同的视野对粘液细胞的类型和数量进行计算,利用显微镜中的标尺,用每个视野中的粘液细胞数除以此视野的面积即是1 mm2中的粘液细胞数量。采用Excel 2003和SPSS 18.0软件进行数据分析。
2. 结果
2.1 消化道中粘液细胞的类型
根据试验中AB-PAS的染色结果,参考尹苗等[5]对粘液细胞的分类方法,野生与养殖黄鳍鲷消化道粘液细胞都可分为4种类型。Ⅰ型:AB-PAS染色呈红色,含有PAS阳性的中性粘多糖;Ⅱ型:AB-PAS染色呈蓝色,含有AB阳性的酸性粘多糖;Ⅲ型:AB-PAS染色呈紫红色,主要含有PAS阳性的中性粘多糖,同时含有少量AB阳性的酸性粘多糖;Ⅳ型:AB-PAS染色呈蓝紫色,主要含有AB阳性的酸性粘多糖,同时含有少量PAS阳性的中性粘多糖。
2.2 消化道中粘液细胞的分布
黄鳍鲷消化道中不同部位的粘液细胞类型不同,数量也存在差异。养殖黄鳍鲷消化道各部位粘液细胞的总量均比野生黄鳍鲷多,前肠和后肠差异显著(P < 0.05),其他部位差异均不显著(P>0.05)。
2.2.1 食道中粘液细胞的分布
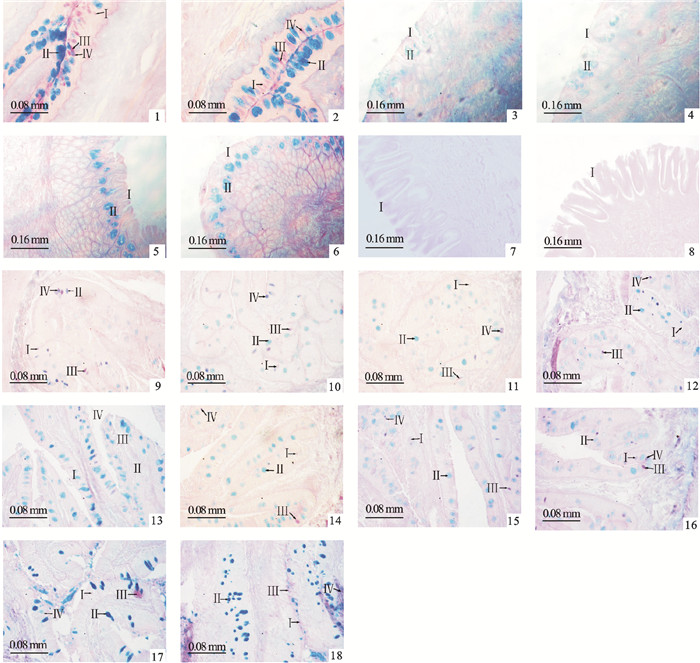
黄鳍鲷食道的粘膜上皮为复层扁平上皮,表层为一层扁平细胞,其下为一层大而高的杯状细胞和粘液细胞。AB-PAS染色结果显示其粘液细胞呈红色、蓝色、紫红色、蓝紫色4种颜色,红色和蓝色居多(图版Ⅰ-1~2),由此可知黄鳍鲷食道中有Ⅰ、Ⅱ、Ⅲ和Ⅳ型粘液细胞且Ⅰ、Ⅱ型居多,含中性粘多糖和酸性粘多糖。野生鱼食道中Ⅰ和Ⅲ型粘液细胞分别比养殖鱼多14.71%和22.26%,Ⅱ和Ⅳ型粘液细胞分别比养殖鱼少9.42%和11.16%,且差异均不显著(P>0.05)。
2.2.2 胃中粘液细胞的分布
黄鳍鲷胃粘膜上皮为单层柱状上皮,无杯状细胞,贲门部和胃体部胃腺发达,幽门部无胃腺。AB-PAS染色显示野生与养殖黄鳍鲷贲门部和胃体部的粘液细胞都呈红色和蓝色2种颜色(图版Ⅰ-3~6),说明其贲门部和胃体部的粘液细胞有Ⅰ、Ⅱ型2种。Ⅱ型粘液细胞均位于胃腺的开口处,在上皮下形成一条规则的蓝细胞线;幽门部染色结果只含有Ⅰ型粘液细胞且细胞分界不清,在粘膜上皮层形成连续的浅红色边缘(图版Ⅰ-7~8), 导致无法计数。结果表明黄鳍鲷胃部含中性粘多糖和酸性粘多糖。
2.2.3 幽门盲囊和肠道中粘液细胞的分布
黄鳍鲷幽门盲囊粘膜上皮为单层柱状上皮,其间嵌有杯状细胞和其他粘液分泌细胞。AB-PAS染色结果表明粘液细胞有Ⅰ、Ⅱ、Ⅲ和Ⅳ型且Ⅱ型最多(图版Ⅰ-9~10),含中性粘多糖和酸性粘多糖。野生鱼幽门盲囊中Ⅰ型粘液细胞比养殖鱼多28.63%,Ⅱ、Ⅲ和Ⅳ型粘液细胞分别比养殖鱼少5.93%、42.87%和2.85%,且差异均不显著(P>0.05)。黄鳍鲷小肠上皮为单层柱状上皮,其间散布较多杯状细胞和粘液细胞。通过AB-PAS染色可知其粘液细胞有Ⅰ、Ⅱ、Ⅲ和Ⅳ型且Ⅱ型最多(图版Ⅰ-11~16),含中性粘多糖和酸性粘多糖。野生与养殖鱼小肠中粘液细胞总数都是中肠>后肠>前肠。黄鳍鲷直肠粘膜上皮为单层柱状上皮,杯状细胞和粘液细胞丰富。AB-PAS染色显示粘液细胞呈红色、蓝色、紫红色、蓝紫色4种颜色,蓝色最多(图版Ⅰ-17~18),可知黄鳍鲷直肠与小肠相同,其粘液细胞有Ⅰ、Ⅱ、Ⅲ和Ⅳ型且Ⅱ型最多,含中性粘多糖和酸性粘多糖。野生鱼直肠中4种粘液细胞的数量均少于养殖鱼。直肠中粘液细胞多于小肠。野生与养殖黄鳍鲷消化道各部位中粘液细胞的数量见表 1。
表 1 野生与养殖黄鳍鲷消化道不同部位粘液细胞的数量(X ±SD)Table 1 Tab. 1 Number of mucous cells at different sections of digestive tract of wild and cultivated S.latus细胞个数· mm-2 部位
sectionⅠ型
TypeⅠⅡ型
TypeⅡⅢ型
Type ⅢⅣ型
Type Ⅳ总和
total食道esophagus 野生 191.02±41.48a 450.61±61.19a 17.96±12.05a 14.69±12.05a 674.29±58.13a 养殖 166.53±25.29a 493.06±79.16a 14.69±12.05a 16.33±10.88a 690.61±78.88a 幽门盲囊pyloric caeca 野生 14.69±12.05a 440.82±78.86a 11.43±11.02a 114.29±18.85a 581.22±98.02a 养殖 11.42±11.02a 466.94±57.70a 16.33±13.33a 117.55±18.54a 612.24±58.74a 前肠foregut 野生 39.18±11.42a 532.24±53.43a 13.06±10.33a 42.45±8.43a 626.94±55.61a 养殖 47.35±12.05a 568.16±80.28a 11.43±11.02a 50.61±12.05b 677.55±74.72b 中肠midgut 野生 16.33±10.88a 672.65±95.14a 11.43±11.02a 32.65±10.88a 733.06±94.40a 养殖 21.22±11.02a 705.31±67.45a 14.69±12.05a 39.18±11.42a 780.41±78.03a 后肠hindgut 野生 17.96±12.05a 591.02±54.31a 14.69±12.05a 26.12±11.42a 649.80±52.09a 养殖 19.59±10.33a 659.59±64.94b 17.96±12.05a 24.49±8.60a 721.63±59.52b 直肠rectum 野生 11.43±7.89a 721.63±83.53a 11.43±11.02a 13.06±10.33a 757.55±81.52a 养殖 13.06±10.33a 744.49±93.38a 11.43±7.89a 14.69±12.05a 783.67±102.68a 注:相同部位同一型粘液细胞上标字母相同表示差异不显著,不同表示差异显著(P < 0.05)
Note: Values with same superscripts within the same section and type indicate no significant difference,while those with different superscripts indicate significant difference (P < 0.05).3. 讨论
3.1 鱼类消化道粘液细胞的分类
利用PAS染色方法可显示不同糖类的技术,KITZAN和SWEENY[6]通过光镜及电镜对非洲肺鱼(Protopterus annectens)上皮的粘液细胞进行观察,根据PAS反应的不同程度将粘液细胞分为亮红色、淡红色及深红色3种类型。SIBBING和URIBE[7]通过多种染色方法相结合对鲤(Cyprinus carpio)粘液细胞进行观察,结果显示鲤上皮中含有囊状、梨状和杯状3种形态的粘液细胞,且这3种粘液细胞的化学成分不同。尹苗等[8]认为粘液细胞在不同的发育时期其形态有所不同,囊状细胞为发育的早期,梨状细胞为发育的中期,而杯状细胞为成熟期。这种分类方法在科学性和合理性上都存在很多不足。袁金铎等[9]通过阿尔辛蓝和希夫试剂联合染色法研究了短盖巨脂鲤(Colossoma brachypomum)的粘液细胞,将粘液细胞的分型做了更详细的描述。尹苗等[5]利用AB-PAS染色方法研究了鲤粘液细胞的类型,结果将鲤粘液细胞分成红色、蓝色、紫红色和蓝紫色4种类型。这种分类方法得到了很多学者的赞同,王吉等[10]对匀斑裸胸鳝(Gymnothorax reevesii)及王永波等[11]对波纹唇鱼(Cheilinus undulates)消化道内粘液细胞的分类都与之一致。笔者也参考此分类方法对黄鳍鲷消化道上皮中的粘液细胞进行了分类研究。
3.2 消化道粘液细胞分布与其功能的关系
对于鱼类粘液细胞在消化道中的分布,国内外都进行了许多研究[12-13]。不同鱼类的粘液细胞在消化道中的分布类型和数量都不同,同种鱼类的粘液细胞在消化道不同部位的分布类型和数量也不同,这与粘液细胞在消化道中的不同功能有着必然的联系。
黄鳍鲷食道上皮中以Ⅱ型粘液细胞含量最多,Ⅰ型次之,这些细胞在扁平细胞下紧密排列,所分泌的粘液物质在食物通过食道时起润滑作用,防止食物对食道上皮的机械损伤[14]。一般说来,食道上皮中粘液细胞的数量肉食性鱼类<杂食性鱼类<草食性鱼类[15]。黄鳍鲷食道上皮中粘液细胞分泌的水解酶等溶菌抗菌类物质可以杀灭随着摄食食物带进的病原微生物[16],从而减少因摄食不卫生带来的病害死亡等问题。野生黄鳍鲷食道中Ⅰ、Ⅲ型粘液细胞多于养殖黄鳍鲷,Ⅱ、Ⅳ型粘液细胞少于养殖鱼,Ⅱ、Ⅳ型粘液细胞能分泌更多的酸性粘多糖来维持食道内的酸性环境,因为酸性粘液物质可以增加粘液的粘性,对食道内的食物起到润滑作用,这都有利于食物顺利地从食道转移到胃里。
黄鳍鲷整个胃部上皮含有大量粘液细胞,AB-PAS染色显示为Ⅰ型粘液细胞,含中性粘多糖,可以中和胃中过量的酸性胃液,平衡pH值,对高浓度酸性胃容物起到一定的缓冲作用[17],并且胃中的中性粘液物质与碱性磷酸酶共同作用有帮助消化的功能[12]。胃是糖类和脂肪酸吸收的主要部位,中性粘液物质可以将较大的食物消化成较小的食物,使食物中的大分子物质、二糖及短链脂肪酸都能在短时间内更快地吸收进入血液以供给鱼类能量所需[18]。同时,中性粘液物质不易被酸性胃液破坏,在整个胃粘膜上皮形成一层具有保护作用的粘膜,对于防止胃酸和胃蛋白酶对上皮细胞的侵蚀起到重要作用[19]。贲门部和胃体部胃腺开口处都有一层Ⅱ型粘液细胞,分泌酸性粘多糖,这与冯晓燕等[18]对许氏平鲉(Sebastes schlegeli)的研究结果一致。在黄鳍鲷贲门部和胃体部胃腺的开口处含有酸性粘液物质,何敏等[20]认为胃中酸性粘液物质可以与胃蛋白酶形成复合物,起到促进胃蛋白酶原的分泌和稳定酶的作用。
黄鳍鲷幽门盲囊组织结构与小肠的相似,一般认为能分泌与肠壁相同的分泌物,是用来扩大肠道的吸收表面积的[21]。所以,幽门盲囊和小肠一样都含有4种粘液细胞,且以Ⅱ型为主,此结果与勾效伟等[22]对平鲷(Rhabdosargus sarba)的研究结论一致。这可能是因为幽门盲囊和小肠是蛋白质消化和吸收的主要场所,同时要不断地润滑未消化的物质向后推进到后肠,所以要求有较高的酸性粘多糖含量。野生黄鳍鲷幽门盲囊和小肠中粘液细胞总数少于养殖黄鳍鲷,其原因和胃相似,更多的粘液细胞可以帮助养殖鱼更好地消化吸收足量的人工饲料。
黄鳍鲷直肠上皮中粘液细胞分布情况与小肠相似,其数量多于小肠。原因可能与直肠的生理功能有着紧密的联系,细菌等病原体易侵入与肛门相连的直肠,粘液中所分泌的免疫性物质可有效地杀死病原体,同时,大量的粘液物质可以帮助直肠顺利地形成和排出粪便[23]。野生黄鳍鲷直肠中粘液细胞总量少于养殖黄鳍鲷。原因可能是养殖鱼所摄食的食物要多于野生鱼,其食物残渣和粪便也要多于野生鱼,所以粘液细胞数量要更多。
粘液物质在各种鱼类消化道中的含量和分布都不尽相同,FIERTAK和KILARSKI[24]认为这可能与消化道中各种菌群的分布有关,菌群可以诱导粘多糖的产生。正如前所述,黄鳍鲷摄食时可能会随着食物带进病原微生物,直肠因为与肛门相连,细菌等病原体很容易侵入,所以食道及直肠中各种菌群的分布和胃部及肠道不同,含量也不同,这是否成为影响其消化道不同部位粘液细胞类型和分布的重要原因,还需进一步的研究探讨。
![]() 图版Ⅰ 黄鳍鲷消化道中粘液细胞的显微镜观察(AB-PAS染色)1. 野生黄鳍鲷(WY)食道(×200);2. 养殖黄鳍鲷(CY)食道(×200);3. WY贲门胃(×100);4. CY贲门胃(×100);5. WY胃体(×100);6. CY胃体(×100);7. WY幽门胃(×100);8. CY幽门胃(×100);9. WY幽门盲囊(×200);10. CY幽门盲囊(×200);11. WY前肠(×200);12. CY前肠(×200);13. WY中肠(×200);14. CY中肠(×200);15. WY后肠(×200);16. CY后肠(×200);17. WY直肠(×200);18. CY直肠(×200); Ⅰ、Ⅱ、Ⅲ和Ⅳ.Ⅰ、Ⅱ、Ⅲ和Ⅳ型粘液细胞图版Ⅰ Light microscopical observation of mucous cells in digestive tract of S.latus (AB-PAS staining)1. esophagus of wild yellowfin black porgy (WY)(×200);2. esophagus of cultivated yellowfin black porgy (CY)(×200); 3. cardiac stomach of WY (×100);4. cardiac stomach of CY (×100);5. fundic stomach of WY(×100); 6. fundic stomach of CY(×100);7. pyloric stomach of WY(×100);8. pyloric stomach of CY(×100); 9. pyloric caeca of WY(×200);10. pyloric caeca of CY(×200);11. foregut of WY(×200); 12. foregut of CY(×200);13. midgut of WY(×200);14. midgut of CY(×200);15. hindgut of WY(×200); 16. hindgut of CY(×200);17. rectum of WY(×200);18. rectum of CY(×200); Ⅰ, Ⅱ, Ⅲ and Ⅳ.Type Ⅰ, Ⅱ, Ⅲ and Ⅳ mucous cells
图版Ⅰ 黄鳍鲷消化道中粘液细胞的显微镜观察(AB-PAS染色)1. 野生黄鳍鲷(WY)食道(×200);2. 养殖黄鳍鲷(CY)食道(×200);3. WY贲门胃(×100);4. CY贲门胃(×100);5. WY胃体(×100);6. CY胃体(×100);7. WY幽门胃(×100);8. CY幽门胃(×100);9. WY幽门盲囊(×200);10. CY幽门盲囊(×200);11. WY前肠(×200);12. CY前肠(×200);13. WY中肠(×200);14. CY中肠(×200);15. WY后肠(×200);16. CY后肠(×200);17. WY直肠(×200);18. CY直肠(×200); Ⅰ、Ⅱ、Ⅲ和Ⅳ.Ⅰ、Ⅱ、Ⅲ和Ⅳ型粘液细胞图版Ⅰ Light microscopical observation of mucous cells in digestive tract of S.latus (AB-PAS staining)1. esophagus of wild yellowfin black porgy (WY)(×200);2. esophagus of cultivated yellowfin black porgy (CY)(×200); 3. cardiac stomach of WY (×100);4. cardiac stomach of CY (×100);5. fundic stomach of WY(×100); 6. fundic stomach of CY(×100);7. pyloric stomach of WY(×100);8. pyloric stomach of CY(×100); 9. pyloric caeca of WY(×200);10. pyloric caeca of CY(×200);11. foregut of WY(×200); 12. foregut of CY(×200);13. midgut of WY(×200);14. midgut of CY(×200);15. hindgut of WY(×200); 16. hindgut of CY(×200);17. rectum of WY(×200);18. rectum of CY(×200); Ⅰ, Ⅱ, Ⅲ and Ⅳ.Type Ⅰ, Ⅱ, Ⅲ and Ⅳ mucous cells -
图版Ⅰ 黄鳍鲷消化道中粘液细胞的显微镜观察(AB-PAS染色)
1. 野生黄鳍鲷(WY)食道(×200);2. 养殖黄鳍鲷(CY)食道(×200);3. WY贲门胃(×100);4. CY贲门胃(×100);5. WY胃体(×100);6. CY胃体(×100);7. WY幽门胃(×100);8. CY幽门胃(×100);9. WY幽门盲囊(×200);10. CY幽门盲囊(×200);11. WY前肠(×200);12. CY前肠(×200);13. WY中肠(×200);14. CY中肠(×200);15. WY后肠(×200);16. CY后肠(×200);17. WY直肠(×200);18. CY直肠(×200); Ⅰ、Ⅱ、Ⅲ和Ⅳ.Ⅰ、Ⅱ、Ⅲ和Ⅳ型粘液细胞
图版Ⅰ. Light microscopical observation of mucous cells in digestive tract of S.latus (AB-PAS staining)
1. esophagus of wild yellowfin black porgy (WY)(×200);2. esophagus of cultivated yellowfin black porgy (CY)(×200); 3. cardiac stomach of WY (×100);4. cardiac stomach of CY (×100);5. fundic stomach of WY(×100); 6. fundic stomach of CY(×100);7. pyloric stomach of WY(×100);8. pyloric stomach of CY(×100); 9. pyloric caeca of WY(×200);10. pyloric caeca of CY(×200);11. foregut of WY(×200); 12. foregut of CY(×200);13. midgut of WY(×200);14. midgut of CY(×200);15. hindgut of WY(×200); 16. hindgut of CY(×200);17. rectum of WY(×200);18. rectum of CY(×200); Ⅰ, Ⅱ, Ⅲ and Ⅳ.Type Ⅰ, Ⅱ, Ⅲ and Ⅳ mucous cells
表 1 野生与养殖黄鳍鲷消化道不同部位粘液细胞的数量(X ±SD)
Table 1 Tab. 1 Number of mucous cells at different sections of digestive tract of wild and cultivated S.latus
细胞个数· mm-2 部位
sectionⅠ型
TypeⅠⅡ型
TypeⅡⅢ型
Type ⅢⅣ型
Type Ⅳ总和
total食道esophagus 野生 191.02±41.48a 450.61±61.19a 17.96±12.05a 14.69±12.05a 674.29±58.13a 养殖 166.53±25.29a 493.06±79.16a 14.69±12.05a 16.33±10.88a 690.61±78.88a 幽门盲囊pyloric caeca 野生 14.69±12.05a 440.82±78.86a 11.43±11.02a 114.29±18.85a 581.22±98.02a 养殖 11.42±11.02a 466.94±57.70a 16.33±13.33a 117.55±18.54a 612.24±58.74a 前肠foregut 野生 39.18±11.42a 532.24±53.43a 13.06±10.33a 42.45±8.43a 626.94±55.61a 养殖 47.35±12.05a 568.16±80.28a 11.43±11.02a 50.61±12.05b 677.55±74.72b 中肠midgut 野生 16.33±10.88a 672.65±95.14a 11.43±11.02a 32.65±10.88a 733.06±94.40a 养殖 21.22±11.02a 705.31±67.45a 14.69±12.05a 39.18±11.42a 780.41±78.03a 后肠hindgut 野生 17.96±12.05a 591.02±54.31a 14.69±12.05a 26.12±11.42a 649.80±52.09a 养殖 19.59±10.33a 659.59±64.94b 17.96±12.05a 24.49±8.60a 721.63±59.52b 直肠rectum 野生 11.43±7.89a 721.63±83.53a 11.43±11.02a 13.06±10.33a 757.55±81.52a 养殖 13.06±10.33a 744.49±93.38a 11.43±7.89a 14.69±12.05a 783.67±102.68a 注:相同部位同一型粘液细胞上标字母相同表示差异不显著,不同表示差异显著(P < 0.05)
Note: Values with same superscripts within the same section and type indicate no significant difference,while those with different superscripts indicate significant difference (P < 0.05). -
[1] 麦贤杰, 黄伟键, 叶富良, 等. 海水鱼类繁殖生物学和人工繁育[M]. 北京: 海洋出版社, 2005: 222-231. MAI Xianjie, HUANG Weijian, YE Fuliang, et al. Marine fish breeding biology and artificial breeding[M]. Beijing: Ocean Press, 2005: 222-231. (in Chinese)
[2] 李希国, 李加儿, 区又君. pH值对黄鳍鲷主要消化酶活性的影响[J]. 南方水产, 2005, 1(6): 18-22. doi: 10.3969/j.issn.2095-0780.2005.06.003 LI Xiguo, LI Jia'er, OU Youjun. Effect of pH on the activity of major digestive enzymes in yellowfin black porgy Sparus latus[J]. South China Fish Sci, 2005, 1(6): 18-22. (in Chinese) doi: 10.3969/j.issn.2095-0780.2005.06.003
[3] 李希国, 李加儿, 区又君. 温度对黄鳍鲷主要消化酶活性的影响[J]. 南方水产, 2006, 2(1): 43-48. doi: 10.3969/j.issn.2095-0780.2006.01.009 LI Xiguo, LI Jia'er, OU Youjun. Effect of temperature on the activity of major digestive enzymes in yellowfin black porgy Sparus latus[J]. South China Fish Sci, 2006, 2(1): 43-48. (in Chinese) doi: 10.3969/j.issn.2095-0780.2006.01.009
[4] MOHAMMAD Z, PREETA K, JASEM G M, et al. Effects of dietary n-3 HUFA concentrations on spawning performance and fatty acids composition of broodstock, eggs and larvae in yellowfin sea bream, Acanthopagrus latus[J]. Aquaculture, 2011, 310(3/4): 388-394. doi: 10.1016/J.AQUACULTURE.2010.11.009
[5] 尹苗, 安利国, 杨桂文, 等. 鲤鱼粘液细胞类型的研究[J]. 动物学杂志, 2000, 35(1): 8-9. http://dwxzz.ioz.ac.cn/dwxb/article/abstract/00010008 YIN Miao, AN Liguo, YANG Guiwen, et al. Study on the type of mucous cells of Cyprinus carpio[J]. Chin J Zool, 2000, 35(1): 8-9. (in Chinese) http://dwxzz.ioz.ac.cn/dwxb/article/abstract/00010008
[6] KITZAN S M, SWEENY P R. A light and electron microscope study of the structure of Protopterus annectens epidermis. Ⅰ. Mucus production[J]. Can J Zool, 1968, 46(4): 767-772. doi: 10.1139/z68-106
[7] SIBBING F A, URIBE R. Regional specializations in the oro-pharyngeal wall and food processing in the carp (Cyprinus carpio L. )[J]. Netherl J Zool, 1985, 35(3): 377-422. doi: 10.1163/002829685X00280
[8] 尹苗, 杨桂文, 安利国. 胡子鲶粘液细胞类型及其在消化道中的分布[J]. 动物学报, 2001, 47(S1): 116-119. https://cstj.cqvip.com/Qikan/Article/Detail?id=1000502268&from=Qikan_Article_Detail YIN Miao, YANG Guiwen, AN Liguo. Study on the type of mucous cells and its distribution in alimentary tract of Clarias fuscus[J]. Acta Zoologca Sinica, 2001, 47(S1): 116-119. (in Chinese) https://cstj.cqvip.com/Qikan/Article/Detail?id=1000502268&from=Qikan_Article_Detail
[9] 袁金铎, 张明, 王钦东. 淡水白鲳黏液细胞类型和分布的研究[J]. 细胞生物学杂志, 1997(增刊): 70-72. YUAN Jinduo, ZHANG Ming, WANG Qindong. Study on the type of mucous cells and its distribution of Colossoma brachypomum[J]. Chin J Cell Biol, 1997(Suppl): 70-72. (in Chinese)
[10] 王吉, 骆剑, 张本. 匀斑裸胸鳝消化道粘液细胞的类型与分布[J]. 现代渔业信息, 2010, 25(5): 14-17. doi: 10.3969/j.issn.1004-8340.2010.05.004 WANG Ji, LUO Jian, ZHANG Ben. Type and distribution of mucous cells in digestive tract of Gymnothorax reevesii[J]. Mod Fish Info, 2010, 25(5): 14-17. (in Chinese) doi: 10.3969/j.issn.1004-8340.2010.05.004
[11] 王永波, 陈国华, 王珺, 等. 波纹唇鱼消化道黏液细胞的类型与分布[J]. 渔业科学进展, 2010, 31(5): 22-28. https://www.zhangqiaokeyan.com/academic-journal-cn_progress-fishery-sciences_thesis/0201261468712.html WANG Yongbo, CHEN Guohua, WANG Jun, et al. Types and distribution of mucous cells in the digestive tracts of Cheilinus undulates Rüppell[J]. Prog Fish Sci, 2010, 31(5): 22-28. (in Chinese) https://www.zhangqiaokeyan.com/academic-journal-cn_progress-fishery-sciences_thesis/0201261468712.html
[12] GONA O. Mucous glycoproteins of teleostean fish: a comparative histochemical study[J]. Histochem J, 1979, 11(6): 709-718. doi: 10.1007/BF01004734
[13] 区又君, 勾效伟, 李加儿. 驼背鲈消化系统组织学与组织化学研究[J]. 海洋渔业, 2011, 33(3): 289-296. doi: 10.3969/j.issn.1004-2490.2011.03.007 OU Youjun, GOU Xiaowei, LI Jia'er. Histological and histochemical studies on digestive system of Cromileptes altivelis[J]. Mar Fish, 2011, 33(3): 289-296. (in Chinese) doi: 10.3969/j.issn.1004-2490.2011.03.007
[14] 林旋, 张伟妮, 林树根, 等. 欧洲鳗鲡皮肤、鳃及消化道粘液细胞的分布与类型[J]. 福建农业学报, 2008, 23(1): 39-43. https://lib.cqvip.com/Qikan/Article/Detail?id=27207200&from=Qikan_Search_Index LIN Xuan, ZHANG Weini, LIN Shugen, et al. Type and distribution of mucous cells in skin, gills and digestive tracts of Anguilla anguilla[J]. Fujian J Agric Sci, 2008, 23(1): 39-43. (in Chinese) https://lib.cqvip.com/Qikan/Article/Detail?id=27207200&from=Qikan_Search_Index
[15] 杨桂文, 安利国. 鱼类粘液细胞研究进展[J]. 水产学报, 1999, 23(4): 403-408. http://scxuebao.ijournals.cn/scxuebao/article/abstract/19990414 YANG Guiwen, AN Liguo. A review on the researches of fish mucous cells[J]. J Fish China, 1999, 23(4): 403-408. (in Chinese) http://scxuebao.ijournals.cn/scxuebao/article/abstract/19990414
[16] 谢湘筠, 林淑慧, 林树根. 花鲈消化道粘液细胞的类型及分布[J]. 福建农业学报, 2007, 22(3): 271-275. https://www.fjnyxb.cn/article/id/733?articlIndex=11 XIE Xiangjun, LIN Shuhui, LIN Shugen. Types and distribution of mucous cells in the digestive tracts of Lateolabrax japonicus[J]. Fujian J Agric Sci, 2007, 22(3): 271-275. (in Chinese) https://www.fjnyxb.cn/article/id/733?articlIndex=11
[17] ZDRAVKO P, SREBRENKA N, SNJEZANA K, et al. Mucosubstances of the digestive tract mucosa in northern pike (Esox lucius L. ) and European catfish (Silurus glanis L. )[J]. Veterinarski Arhiv, 2005, 75(4): 317-327. https://www.semanticscholar.org/paper/Mucosubstances-of-the-digestive-tract-mucosa-in-L.)-Petrinec-Nejedli/8072829fd241c7a21f6c21363e26f76b0a42ff89
[18] 冯晓燕, 郑家声, 王梅林. 许氏平鲉消化道的组织化学研究[J]. 青岛海洋大学学报, 2003, 33(3): 399-404. https://lib.cqvip.com/Qikan/Article/Detail?id=10543674&from=Qikan_Article_Detail FENG Xiaoyan, ZHENG Jiasheng, WANG Meilin. A study of the histochemistry on the digestive tract of the Sebastes schlegeli[J]. J Qingdao Ocean Univ, 2003, 33(3): 399-404. (in Chinese) https://lib.cqvip.com/Qikan/Article/Detail?id=10543674&from=Qikan_Article_Detail
[19] MURRAY H M, WRIGHT G M, GOFF G P. A comparative histological and histochemical study of the post-gastric alimentary canal from three species of pleuronectid, the Atlantic halibut, the yellowtail flounder and the winter flounder[J]. J Fish Biol, 1996, 48(2): 187-206. doi: 10.1111/j.1095-8649.1996.tb01112.x
[20] 何敏, 张宇, 方静. 重口裂腹鱼消化道黏液细胞类型及分布研究[J]. 淡水渔业, 2007, 37(2): 24-26, 33. doi: 10.3969/j.issn.1000-6907.2007.02.006 HE Min, ZHANG Yu, FANG Jing. The study of the mucous cells in the digestive of Schizothorax davidi[J]. Freshw Fish, 2007, 37(2): 24-26, 33. (in Chinese) doi: 10.3969/j.issn.1000-6907.2007.02.006
[21] 关海红, 匡友谊, 徐伟, 等. 哲罗鱼消化系统形态学和组织学观察[J]. 中国水产科学, 2008, 15(5): 873-879. GUAN Haihong, KUANG Youyi, XU Wei, et al. Morphological and histological observations of digestive system in Hucho taimen[J]. J Fish Sci China, 2008, 15(5): 873-879. (in Chinese)
[22] 勾效伟, 区又君, 廖锐. 平鲷消化系统形态学、组织学及组织化学研究[J]. 南方水产, 2008, 4(5): 28-36. https://www.schinafish.cn/cn/article/id/f55b2f70-269d-4009-b97e-030e402d910d GOU Xiaowei, OU Youjun, LIAO Rui. Histological and histochemical study of digestive system of Rhabdosargus sarba[J]. South China Fish Sci, 2008, 4(5): 28-36. (in Chinese) https://www.schinafish.cn/cn/article/id/f55b2f70-269d-4009-b97e-030e402d910d
[23] 张伟妮, 林旋, 林树根, 等. 褐牙鲆消化道粘液细胞的类型及分布[J]. 福建农林大学学报: 自然科学版, 2009, 38(3): 280-284. https://www.doc88.com/p-4032290767950.html ZHANG Weini, LIN Xuan, LIN Shugen, et al. Types and distribution of mucous cells in the digestive tract of Paralichthys olivaceus[J]. J Fujian Agri Fore Univ: Natural Science, 2009, 38(3): 280-284. (in Chinese) https://www.doc88.com/p-4032290767950.html
[24] FIERTAK A, KILARSKI W M. Glycoconjugates of the intestinal goblet cells of four cyprinids[J]. Cell Mol Life Sci, 2002, 59(10): 1724-1733. doi: 10.1007/pl00012500
-
期刊类型引用(17)
1. 童立豪,谭凡民,罗砚,倪孔平. 红树林人工湿地生态养殖黄鳍鲷形态性状对体质量的影响. 广西科学院学报. 2021(03): 248-255 .  百度学术
百度学术
2. 李艳菲,狄桂兰,王宁,裴超,孔祥会. 鱼类黏液细胞研究进展. 水产科学. 2020(01): 143-150 .  百度学术
百度学术
3. 谢文婷. 地塞米松对仔猪十二指肠黏膜免疫的影响. 福建畜牧兽医. 2019(01): 17-19+24 .  百度学术
百度学术
4. 赵彦花,区又君,李加儿,温久福,周慧. 黄唇鱼消化系统组织结构及黏液细胞分布特征. 渔业科学进展. 2019(03): 80-86 .  百度学术
百度学术
5. 陈寅儿,郑学斌,高心明,王景倩,谢庆平,詹炜,楼宝,竺俊全. 小黄鱼(Larimichthys polyactis)消化道形态与组织学结构特征及其消化酶活性的研究. 海洋与湖沼. 2019(05): 1116-1126 .  百度学术
百度学术
6. 赵柳兰,陈侨兰,杨淞,符红梅,叶星,李胜杰,杨世勇,杜宗君. 大口黑鲈消化道组织结构及黏液细胞的类型和分布. 四川农业大学学报. 2018(04): 549-554 .  百度学术
百度学术
7. 谢木娇,李加儿,区又君,温久福,李活. 四指马鲅胃肠道内分泌细胞免疫组织化学的定位. 生物学杂志. 2018(02): 48-51 .  百度学术
百度学术
8. 谢木娇,钟金香,颉晓勇,朱长波,李俊伟,王,叶国玲,鲍虞园. 饥饿对高体革鯻消化道黏液细胞分布的影响. 中国细胞生物学学报. 2018(10): 1685-1691 .  百度学术
百度学术
9. 谢木娇,区又君,温久福,李加儿,周慧,王鹏飞,刘奇奇. 四指马鲅消化道黏液细胞的发育规律. 南方农业学报. 2016(07): 1222-1227 .  百度学术
百度学术
10. 王永波,张杰,李向民. 豹纹鳃棘鲈消化道粘液细胞的类型与分布. 海洋渔业. 2016(05): 478-486 .  百度学术
百度学术
11. 区又君,刘江华,李加儿,吴水清. 驼背鲈幼鱼消化系统组织学结构研究. 生物学杂志. 2016(02): 81-85 .  百度学术
百度学术
12. 吴红松. 三聚氰胺对鲤鱼鳃、消化道粘液细胞分布与类型的影响. 毒理学杂志. 2016(06): 451-454 .  百度学术
百度学术
13. 张贵生,吴红松,楚德昌. 硝酸铈对鲤鱼鳃及消化道黏液细胞的影响. 安徽农业科学. 2015(34): 217-218+243 .  百度学术
百度学术
14. 西超群,钱静,唐洪玉,郑永华,李芹. 野生与养殖大鳍鳠肠刷状缘膜消化酶活性的比较. 淡水渔业. 2015(06): 34-38 .  百度学术
百度学术
15. 李加儿,吴水清,区又君,刘江华,温久福,王鹏飞. 斜带石斑鱼(♀)×鞍带石斑鱼(♂)杂交子代幼鱼消化道粘液细胞和胃泌素细胞的研究. 南方水产科学. 2015(03): 67-73 .  本站查看
本站查看
16. 谢木娇,区又君,李加儿,温久福,王鹏飞,王雯,陈世喜. 四指马鲅稚鱼、幼鱼和成鱼消化道黏液细胞组织化学研究. 中国细胞生物学学报. 2015(09): 1226-1234 .  百度学术
百度学术
17. 李海东,白雪峰,孙虎山,林强. 两种海马鳃组织和消化道的黏液细胞类型及分布. 动物学杂志. 2014(04): 552-559 .  百度学术
百度学术
其他类型引用(10)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
