Effects of salinity stress and diurnal variation on digestive enzyme activity of juvenile grey mullet (Mugil cephalus)
-
摘要:
研究了S0(盐度为0)、S10、S20、S33(对照)和S40 5个盐度梯度14 d内盐度胁迫及其昼夜变化对鲻鱼(Mugil cephalus)幼鱼蛋白酶和淀粉酶比活力的影响。结果显示:1)盐度胁迫对鲻鱼幼鱼的消化酶活力有显著影响(P < 0.05)。不同盐度的蛋白酶和淀粉酶活力的变化规律都是在第0天~第7天升高,第7天~第14天降低,最终时(第14天)S0~S33蛋白酶活力呈上升趋势,S33~S40下降;S0~S20淀粉酶活力差异不显著(P>0.05),S20~S33呈上升,S33~S40下降,且差异显著(P < 0.05);2)对鲻鱼幼鱼消化酶活性昼夜变化的测定表明,蛋白酶和淀粉酶活性的最高值分别在12 : 00和15 : 00,最低值均出现在6 : 00。因此,夜间设置定时投喂,可促进鱼类快速健康生长。
Abstract:We studied the effects of salinity stress and diurnal variation on the protease and amylase activity of juvenile grey mullet (Mugil cephalus).Five different salinities were set: S0 (salinity is 0), S10, S20, S33 (control) and S40, respectively. The results indicate: 1) salinity stress has significant effects on activity of digestive enzymes (P < 0.05).Activity of protease and amylase increased within 0~7 d, then decreased within 7~14 d. At the last day (14th day), protease activity of S0~S33 increased while that of S33~S40 decreased. The difference of amylase activity of S0~S20 is insignificant (P>0.05), and amylase activity of S20~S33 increased while that of S33~S40 decreased significantly (P < 0.05); 2) The diurnal variation in activity of digestive enzyme of M.cephalus reveals that the protease and amylase activity reached the maximum at 12 : 00 and 15 : 00, respectively, while bottomed at 6: 00. Thus, feeding periodically at night can help the fish grow fast and healthily.
-
Keywords:
- Mugil cephalus /
- juvenile /
- salinity stress /
- diurnal variation /
- activity of digestive enzymes
-
罗非鱼是世界性养殖鱼类之一, 具有生长速度快、耐低氧、适应性强的特点, 目前已经成为中国主要养殖鱼类[1]。然而, 近年来实际生产中的罗非鱼多出现肝脏及腹腔脂肪过度蓄积等现象, 究其原因可能是罗非鱼市场价格偏低, 饲料生产厂商为降低生产成本, 多倾向于选择添加廉价的糖类物质作为饲料能量来源, 导致饲料糖含量过高[2]。
糖类和脂肪均是鱼体的非蛋白能量供体, 饲料中的糖类经消化吸收后可以直接为鱼类的生理活动提供所需的能量, 多余的糖也可以转化为糖原贮存于肝脏和肌肉中, 或者在鱼体内转化为脂肪[3], 同时糖类又是三大营养物质中最为廉价的能量来源, 在鱼类饲料中添加适宜水平的糖类可以节约蛋白, 降低饲料成本, 减少氨氮排放, 缓解对环境的污染[4]。然而脂肪能值高, 且能够提供必需脂肪酸, 目前仍然是鱼体最主要的能量来源。现在虽已有较多研究表明, 饲料中糖类物质在一定程度上可以替代部分的脂肪作为鱼体能量来源[5], 但鱼类对糖的消化和代谢能力较差, 摄入过多的糖类能够引起鱼体及其肝脏的脂肪过度沉积、生长性能下降、免疫力降低、肝脏损伤等问题[6]。目前对于罗非鱼糖类方面的研究已有不少, 但主要是在饲料糖水平、糖源等方面的研究, 从能量角度上探讨罗非鱼高糖利用的研究尚不多见。因此该实验以吉富罗非鱼(GIFT Oreochromis niloticus)为研究对象, 设置对照组、高糖高能组以及高糖等能组, 探讨高糖饲料对其生长性能、饲料利用和糖脂代谢的影响, 以期为高糖饲料在实际生产中的利用提供基础数据和理论依据。
1. 材料与方法
1.1 实验饲料
以酪蛋白和明胶为所需蛋白源, 糊精作为糖源, 大豆油和玉米油为脂肪源配制3组纯化饲料。其中对照组(C组)饲料糖水平为34%, 脂肪为8.23%, 能量水平13.68 kJ · g-1; 高糖高能组(HCE组)饲料糖水平为48%, 脂肪为8.23%, 能量水平16.03 kJ · g-1; 高糖等能组(HE组)饲料糖水平为48%, 脂肪为2.35%, 能量水平13.81 kJ · g-1, 其中脂肪水平为实测值, 糖和能量水平为理论计算值, 饲料配方和基本组成见表 1。饲料原料粉碎后, 过60目筛, 准确称质量并逐步混匀, 加适量水用饲料机制成粒径约2.0 mm、长约4.0 mm的柱形颗粒, 避光风干, 储存于-20 ℃低温冰箱备用。
表 1 基础饲料组成及基本营养成分组成Table 1. Formulation and proximate analysis of basal diets成分
ingredient对照组
(C)高糖高能组
(HCE)高糖等能组
(HE)酪蛋白/% casein 29.00 29.00 29.00 明胶/% gelatin 7.00 7.00 7.00 糊精/% dextrine 34.00 48.00 48.00 玉米油/% corn oil 4.20 4.20 1.20 大豆油/% soybean oil 4.20 4.20 1.20 氯化胆碱/% choline chloride 0.25 0.25 0.25 维生素预混料①/% vitamin premix 1.00 1.00 1.00 无机盐预混料②/% mineral premix 2.00 2.00 2.00 磷酸二氢钙/% calcium phosphate 2.00 2.00 2.00 膨润土/% bentonite 1.60 1.60 1.60 微晶纤维素/% micro-cellulose 14.65 0.65 6.65 三氧化二钇/% Y2O3 0.1 0.1 0.1 营养成分 proximate composition 粗蛋白/% crude protein 28.93 28.63 28.73 粗脂肪/% crude lipid 8.23 8.23 2.35 总能/kJ·g-1 gross energy 13.68 16.03 13.81 总糖/% gross carbohydrate 34.11 49.01 48.78 注:营养水平中总能按粗蛋白23.64 kJ · g-1, 粗脂肪39.54 kJ · g-1, 总糖17.15 kJ · g-1计算, 其他均为实测值; ①维生素预混料可为每千克饲料提供, 维生素A 5 000 IU, 维生素D3 2 000 IU, 维生素E 60 mg, 维生素C 120 mg, 维生素K 5 mg, 维生素B2 20 mg, 维生素B1 5 mg, 维生素B6 10 mg, 烟酸120 mg, 泛酸钙10 mg, 叶酸1 mg, 生物素0.1 mg, 肌醇400 mg; ②矿物质预混料可为每千克饲料提供磷酸氢钙6 000 mg, L-乳酸钙6 540 mg, 硫酸铁42.5 mg, 硫酸镁1 340 mg, 磷酸氢钠1 744 mg, 氯化钠870 mg, 氯化铝3 mg, 碘化钾2.5 mg, 氯化钾1 500 mg, 氯化铜2 mg, 硫酸镁16 mg, 氯化钴20 mg, 硫酸锌60 mg
Note:Gross energy:crude protein 23.64 kJ · g-1, crude fat 39.54 kJ · g-1, total carbohydrate 17.15 kJ · g-1, and the others are measured values; ①The vitamin premix provids the following per kg of diets:VA 5 000 IU, VD3 2 000 IU, VE 60 mg, VC 120 mg, VK 5 mg, VB2 20 mg, VB1 5 mg, VB6 10 mg, nicotinic acid 120 mg, calcium pantothenate 10 mg, folic acid 1 mg, biotin 0.1 mg, inositol 400 mg; ②The mineral premix provids the following per kg of diets:Ca(HPO4)2 6 000 mg, Ca(CH3CHOHCOO)2 6 540 mg, FeSO4 42.5 mg, MgSO4 1 340 mg, NaHPO4 1 744 mg, NaCl 870 mg, AlCl3 3 mg, KIO3 2.5 mg, KCl 1 500 mg, CuCl2 2 mg, MnSO4 16 mg, CoCl2 20 mg, ZnSO4 60 mg.1.2 实验用鱼和饲养条件
实验所用吉富罗非鱼来自湖北省罗非鱼原良种场, 运回后对鱼苗进行消毒, 暂养于中国水产科学研究院长江水产研究所室内循环水养殖系统中。
实验正式开始前用商品饲料驯化2周, 挑选体质良好、规格相近的实验鱼225尾(20.34±0.42)g, 放养于9个养殖桶中, 每桶放鱼25尾。随机分为3组, 每组饲料投喂3个重复。养殖实验进行60 d, 每天投喂3次(8:30、12:00和17:00), 表观饱食法投喂。养殖实验期间, 每天记录摄食、死亡情况, 以及水体温度, 每日换水1次。实验期间水温保持在28~33 ℃, pH 7.1~7.3, 连续不间断充氧, 确保水体溶解氧(DO)质量浓度大于5 mg ·L-1, 氨氮质量浓度小于0.05 mg · L-1, 自然光照周期。
1.3 样品采集
养殖实验进行到最后2周, 于每日下午投喂1 h后清除水中残饵, 3 h后用虹吸法收集粪便, 挑选包膜且结构完整的粪便, 真空冷冻干燥机中干燥48 h后置于-20 ℃冰箱, 用于表观消化率的测定; 采样前禁食24 h, 以桶为单位, 统计死亡情况、总质量、尾数以及投喂饲料质量, 用于计算增重率、成活率、特定生长率和饲料系数。每桶随机取3尾实验鱼用于样品的采集:测定每尾鱼的体质量和体长, 用于计算肥满度; 采用尾部静脉取血法抽取新鲜血液, 4 ℃下放置4 h, 以3 000 r · min-1速率离心15 min, 取上层血清, 储存于-80 ℃冰箱, 用于测定血清生化指标; 打开实验鱼腹腔, 取出完整的内脏, 分离出肝脏, 称质量, 用于计算肝体比、脏体比, 肝脏储存于-40 ℃冰箱, 用于测定肝脏营养成分以及代谢酶活性; 采集鱼体侧线上方背部肌肉储存于-40 ℃冰箱, 用于测定肌肉基础营养成分。每个重复再随机取2尾鱼, 用绞肉机制作全鱼样品, 用于测定全鱼基本营养成分。
1.4 指标测定
1.4.1 生长性能测定相关计算公式:
成活率(SR, %)=100×nt/n
增重率(WGR, %)=100×(mt-m0)/m0
饲料系数(FCR)=FI/(mTt-mT0)
特定生长率(SGR, % · d-1)=100×[(lnmt-lnm0)]/d
肥满度(CF, g · cm-3)=100×m/l3
肝体比(HSI, %)=100×mH/m
脏体比(VSI, %)=100×mV/m
蛋白质效率(PER, %)=100×(mt-m0)(FI×Np)
式中nt为终末尾数; n为初始尾数; m0为初始体质量(g); mt为终末体质量(g); m为鱼体质量(g); l为鱼体长(cm); mH为肝脏质量(g); mV为内脏质量(g); FI为饲料摄入量; mT0为初始总体质量(g); mTt为终末鱼体总质量(g); d为饲喂天数; Np为饲料中蛋白质含量。
1.4.2 常规营养成分测定
全鱼、肌肉、饲料、粪便及肝脏的常规营养成分测定:粗脂肪测定采用索氏抽提法(GB/T 5009.6);粗蛋白测定采用凯氏定氮法(GB/T 5009.3);灰分测定采用马弗炉灰化法(GB/T 5009.4);水分测定采用105 ℃恒温干燥失重法; 饲料和粪便总糖测定采用蒽酮-硫酸法[7], 肝糖原测定根据ANDERSEN等[8]的方法。
1.4.3 血清生化指标测定
血清总胆固醇(T-CHO)、血糖(GLU)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)采用Sysmex全自动生化分析仪(CHEMIX-800)分析, 所用试剂均购自Sysmex公司。
1.4.4 肝脏酶活性测定
肝脏样品在4 ℃下解冻后剪碎, 按质量体积比1:9加入生理盐水, 于冰水浴中匀浆后, 3 000 r · min-1转速离心10 min, 取上清, 用于进行酶活性测定。葡萄糖激酶(GK, EC 2.7.1.2)活性测定依照PANSERAT等[9]的方法; 苹果酸酶(ME, EC 1.1.1.40)活性测定采用DIAS等[10]的方法; 葡萄糖-6-磷酸脱氢酶(G-6-PDH, EC 1.1.1.49)活性测定依照BAUTISTA等[11]的方法; 脂肪酸合成酶(FAS, EC 2.3.1.85)、激素敏感性脂肪酶(HSL, EC 3.1.1.1)采用南京建成生物工程有限公司的酶联反应试剂盒进行测定。GK和ME活性单位定义为:每克组织蛋白在该反应体系中每分钟生成1 mmol ·L-1的NADPH; G-6-PDH和HSL活性单位定义为:每克组织蛋白在该反应体系中每分钟氧化水解1 μmol底物; FAS活性单位定义为:每克组织蛋白在该反应体系中每分钟氧化14 nmol NADPH的酶量。
1.4.5 表观消化率的测定
测定采用三氧化二钇(Y2O3)指示剂法, 样品经硝酸消化法处理后, 使用电感耦合等离子体原子发射光谱仪(VISTA-MPX, 美国瓦里安)测定样品中Y2O3质量分数。
营养成分表观消化率的计算公式为:
干物质表观消化率(ADC, %)=100×(1-Md/Mf)
营养物质表观消化率(ADCd, %)=100×[1-(Nf/Nd)×(Md/Mf)]
式中Md为饲料中标记物Y2O3质量分数(%); Mf为粪便中标记物Y2O3质量分数(%); Nd为饲料中营养成分质量分数(%); Nf为粪便中营养成分质量分数(%)。
1.5 数据处理
实验结果以“平均数±标准误(X ±SE)”表示, 采用Duncan′s多重比较法分析实验结果的差异显著性, 所有统计分析均采用SPSS 22.0软件, 显著水平为P < 0.05。
2. 结果
2.1 高糖饲料对生长和饲料利用的影响
高糖饲料对吉富罗非鱼的生长和饲料利用的影响见表 2。HCE和HE组的终末体质量、增重率、特定生长率、蛋白质效率显著低于C组(P < 0.05), 而饲料系数、肝体比显著高于C组(P < 0.05);各组间肥满度差异不显著(P>0.05)。HCE组的脏体比显著高于C组(P < 0.05), 而HE组则显著低于C组(P < 0.05)。
表 2 高糖饲料对吉富罗非鱼生长性能和饲料利用的影响Table 2. Effect of high carbohydrate level in diets on growth performance and feed utilization of GIFT O.niloticus指标indicator 对照组
(C)高糖高能组
(HCE)高糖等能组
(HE)初始体质量/g IBM 20.20±0.28 19.80±0.06 20.62±0.51 终末体质量/g FBM 101.90±8.31c 90.21±1.39b 87.21±3.68a 增重率/% WGR 404.40±3.01c 340.47±2.11b 327.83±2.54a 特定生长率/%·d-1 SGR 2.97±0.13b 2.47±0.03a 2.46±0.09a 蛋白质效率 PER 2.15±0.11b 1.98±0.08a 2.01±0.10a 饲料系数 FCR 1.48±0.11a 1.88±0.16b 1.95±0.03b 肝体比/% HSI 2.93±0.07a 3.23±0.02b 3.01±0.16b 肥满度/% CF 3.54±0.17 3.98±0.18 3.41±0.29 脏体比/% VSI 9.77±0.12b 10.51±0.15c 9.31±0.11a 注:同行上标字母不同代表差异显著(P < 0.05);后表同此
Note:Values with different superscript letters have significant difference (P < 0.05).The same case in the following tables.2.2 高糖饲料对体成分和肝脏营养成分的影响
高糖饲料对吉富罗非鱼全鱼、肌肉和肝脏基础营养成分的影响见表 3。各组间实验鱼的肌肉营养成分未出现显著差异(P>0.05);全鱼粗蛋白、灰分和水分均差异不显著(P>0.05), 但HCE组全鱼粗脂肪显著高于C组和HE组(P < 0.05), HE组则显著低于C组(P < 0.05)。高糖组(HCE组和HE组)的肝糖原和粗脂肪均显著高于C组(P < 0.05), 而粗蛋白则显著低于C组(P < 0.05), HCE组的肝糖原显著高于HE组(P < 0.05)。
表 3 高糖饲料对吉富罗非鱼全鱼和肌肉常规成分的影响Table 3. Effect of high carbohydrate level in diets on whole body and muscle composition of GIFT O.niloticus% 成分
ingredient对照组
(C)高糖高能组
(HCE)高糖等能组
(HE)全鱼 whole fish 粗蛋白 crude protein 12.80±0.20 13.24±0.10 12.78±0.11 粗脂肪 crude lipid 6.42±0.11a 9.37±0.62b 4.97±0.54a 粗灰分 ash 4.23±0.31 3.88±0.33 4.18±0.16 水分 moisture 68.22±1.35 67.07±2.14 69.40±0.21 肌肉 muscle 粗蛋白 crude protein 18.91±0.43 18.32±0.65 18.14±0.58 粗脂肪 crude lipid 1.51±0.17 1.46±0.11 1.43±0.21 粗灰分 ash 1.18±0.25 1.25±0.02 1.23±0.07 水分 moisture 76.52±0.67 77.24±1.29 77.58±0.42 肝脏 liver 粗蛋白 crude protein 12.25±0.08b 11.21±0.09a 11.16±0.10a 粗脂肪 crude lipid 10.15±0.11a 12.21±0.09b 12.05±0.13b 糖原 glycogen 6.03±0.15a 8.74±0.11b 7.25±0.10c 2.3 高糖饲料对血液指标的影响
高糖饲料对吉富罗非鱼血液生化指标的影响见图 1。各组的血糖差异不显著(P>0.05)。HCE组的血清TG、TCHO、LDL-C水平显著高于C组(P < 0.05), HE组仅LDL-C显著高于C组, 而TG水平显著低于C组(P < 0.05), HDL-C则HCE组含量最低, HE组显著低于C组(P < 0.05)。
2.4 高糖饲料对营养物质表观消化率的影响
各组实验营养物质表观消化率见表 4。高糖饲料未对实验鱼的粗蛋白表观消化率(ADC)产生显著影响(P>0.05)。高糖组对干物质的ADC显著高于C组(P < 0.05);各组中HCE组和C组粗脂肪ADC差异不显著(P>0.05), HE组则显著低于其他两组(P < 0.05);高糖饲料显著降低了饲料中糖ADC(P < 0.05), HCE组与HE组差异不显著(P < 0.05)。
表 4 高糖饲料对吉富罗非鱼营养物质表观消化率的影响Table 4. Effect of high carbohydrate level in diets on apparent digestibility of nutrients of GIFT O.niloticus% 成分
ingredient对照组
(C)高糖高能组
(HCE)高糖等能组
(HE)干物质 dry matter 65.32±0.12a 77.26±0.17b 76.15±0.13b 蛋白质 protein 95.65±0.19 96.06±0.21 95.87±0.11 脂肪 lipid 85.23±0.82b 84.59±0.74b 74.51±0.15a 总糖 carbohydrate 72.52±0.16b 65.71±0.83a 67.48±0.80a 2.5 高糖饲料对肝脏组织结构的影响
高糖饲料对吉富罗非鱼肝脏组织的影响见图 2。C组肝细胞完整, 细胞膜和细胞核清晰可见, 出现了少量的细胞核偏移和空泡现象; HCE组肝细胞严重肿大变形, 并有大量空泡出现, 细胞核被挤压至一侧, 偏移严重; HE组肝脏细胞稍微变形, 有细胞核偏移的现象。
![]() 图 2 高糖饲料对吉富罗非鱼肝脏组织的影响1.对照组(C组)肝脏切片(×200);2.高糖高能组(HCE组, ×200);3.高糖等能组(HE组, ×200); N.细胞核; NM.细胞核偏移; VD.空泡变性Figure 2. Effect of high carbohydrate level in diets on hepatic tissue of GIFT O.niloticus1.liver section from the control group (×200);2.liver section from the high-carbohydrate-high-fat group (×200); 3.liver section from high-carbohydrate-isoenergy group (×200);N.nucleus; NM.nucleus migration; VD.vacuolar degeneration
图 2 高糖饲料对吉富罗非鱼肝脏组织的影响1.对照组(C组)肝脏切片(×200);2.高糖高能组(HCE组, ×200);3.高糖等能组(HE组, ×200); N.细胞核; NM.细胞核偏移; VD.空泡变性Figure 2. Effect of high carbohydrate level in diets on hepatic tissue of GIFT O.niloticus1.liver section from the control group (×200);2.liver section from the high-carbohydrate-high-fat group (×200); 3.liver section from high-carbohydrate-isoenergy group (×200);N.nucleus; NM.nucleus migration; VD.vacuolar degeneration2.6 高糖饲料对肝脏糖脂代谢相关酶活性的影响
高糖饲料对吉富罗非鱼糖脂代谢相关酶活性的影响见图 3。高糖组实验鱼肝脏的GK、G-6-PDH、ME和FAS活性显著高于C组(P < 0.05), 但HCE组与HE组的GK活性差异不显著(P>0.05), HE组G-6-PDH、ME和FAS活性则显著高于HCE组(P < 0.05);HCE组和C组HSL活性差异不显著(P>0.05), 均显著高于HE组(P < 0.05)。
3. 讨论
3.1 高糖饲料对吉富罗非鱼生长和鱼体营养成分的影响
刘泓宇等[12]研究发现, 相对于肉食性和草食性鱼类, 杂食性的罗非鱼对饲料中糖物质的利用更好; 吴凡等[13]的研究表明奥尼罗非鱼(O.niloticus ×O.aureus)和吉富罗非鱼[14]的饲料糖水平以34%~41%为宜。因此, 该实验中C组饲料糖水平设定为34%是适宜的。
该实验中HE组的增重率和特定生长率均显著低于HCE组(P < 0.05), 这可能与饲料中脂肪水平有关, 在非洲鲶(Clarias gariepinus)[15]、尼罗罗非鱼[16]等的研究中均有此类结果。鱼体对糖类利用率不高, 高糖提供的能量不能有效地替代脂肪, 导致低脂的HE组罗非鱼能量供应不足, 可能是其生长性能降低的原因。
对吉富罗非鱼[14]和非洲鲶[17]的研究发现, 鱼体粗蛋白、水分和灰分含量并不因饲料糖水平的变化而产生显著的变化, 而粗脂肪却有明显的差异。该实验结果与之类似, HCE组除了粗脂肪显著高于C组外(P < 0.05), 全鱼和肌肉的其余营养成分均与C组无显著差异(P>0.05), 说明高糖饲料能够导致吉富罗非鱼脂肪蓄积。该实验中HE组粗脂肪显著低于HCE组和C组(P < 0.05), 这与虹鳟(Oncorhynchus mykiss)[18]、白鲈(Atractoscion nobilis)[19]的结果相似, 高糖饲料引起鱼体脂肪蓄积, 但过量的糖类并不能替代饲料中的脂肪, 脂肪水平是造成鱼体脂肪蓄积的主要因素。虽然相对于脂肪, 糖类更容易被鱼体消化吸收, 但鱼类对糖类利用率不高, 摄食高糖饲料可能会导致大部分糖类能量最终以热量消耗的方式散失, 造成鱼体能量保留值(energy retention)过低[20]。
3.2 高糖饲料对吉富罗非鱼表观消化率的影响
该实验中高糖组实验鱼总糖的表观消化率显著低于C组(P < 0.05), 在印度野鲮(Labeo rohita)[21]和军曹鱼(Rachycentron canadum)[22]的研究中也发现, 饲料总糖表观消化率随饲料中添加水平的升高而降低; HE组对脂肪的消化率显著低于其他两组(P < 0.05), HCE组和C组差异不显著。从结果可以看出, 吉富罗非鱼对糖和脂肪的表观消化率分别受各自营养水平的影响。王朝阳等[23]和STONE[24]均指出随着糖和脂肪含量的增加鱼体消化率降低, 可能是因为底物已达到饱和, 超过了消化酶的消化能力。C组干物质消化率显著低于高糖组, 可能是因为C组中纤维素含量较高, 导致饲料在消化道中通过的速率加快, 降低了鱼体对饲料成分的消化吸收率[25]。
3.3 高糖饲料对吉富罗非鱼血清生化指标的影响
在翘嘴鲌(Culter alburnus Basilewsky)研究中, 提高饲料糖含量均使得鱼体血糖水平升高[26]。该实验中高糖饲料并未影响到实验鱼的血糖水平, 在异育银鲫(Carassius auratus gibelio)的研究中也有同样的发现[27]。原因可能是采样前对鱼体饥饿了24 h, 血糖已降至正常水平。大多数鱼类在摄食含糖饲料后, 血糖峰值出现在第2~第8小时, 之后逐渐降低至正常[28], 这可能是导致各组间未出现显著性差异的原因; 另外, 可能与该实验采用糊精为糖源有关, 许多研究表明杂食性鱼类如异育银鲫[27]、罗非鱼[29]等对于糊精等结构复杂的多糖的利用要弱于结构简单的单糖, 表现在肠道对其消化吸收缓慢, 使得血糖水平始终处于较低的水平。
血清中HDL-C的作用是把机体内的胆固醇运回肝代谢, LDL-C则相反, 是向组织转运肝合成的内源性胆固醇[30]。HCE组血清TG、TCHO和LDH-C均显著高于C组和HE组(P < 0.05), 表明高糖饲料促进了脂肪的合成, 增加了血脂含量。GAO等[31]认为血清中TG和TCHO含量高低主要是对饲料中相关营养物质即脂肪水平的响应。一般而言, 血清TG含量的升降都会伴随着TCHO的升降[32], HE组TG显著低于C组也印证了该观点。而HE组TCHO与C组差异不显著, 可能是由于肝脏脂肪蓄积过多, 抑制了胆固醇的转运, 这由LDL-C和HDL-C的含量变化也可以得到证实。吴凡等[13]认为高糖饲料能够导致奥尼罗非鱼肝脏脂肪蓄积, 使得HDL-C运送回肝脏代谢的TCHO减少, 不利于血液中TCHO的清除。
3.4 高糖饲料对吉富罗非鱼糖脂代谢酶的影响
糖酵解是鱼体葡萄糖分解产生能量的重要过程, 己糖激酶(HK)及其同工酶GK是该过程的关键酶。HK活性因受产物G6P的反馈抑制, 受营养状态的调节较少, GK无反馈抑制现象, 受摄入的糖水平调节[9]。该实验中发现高糖组的GK活性均显著高于C组, 而HCE组和HE组则差异不显著(P < 0.05), 表明摄入过多的糖类增强了吉富罗非鱼糖酵解过程。对尼罗罗非鱼[33]、青鱼(Mylopharyngodn piceus)和鲫(C.anratus)的研究中[34]也均发现高糖饲料能够增强鱼体肝脏GK活性, 促进糖酵解过程。
G-6-PDH和ME是磷酸戊糖途径和柠檬酸-丙酮酸循环中的关键酶, 产生的NADPH是脂肪酸从头合成的主要能量来源。FAS是脂肪酸从头合成的关键酶, 因此, G-6-PDH、ME与FAS的活性是反映糖脂代谢关联的重要指标。该实验中, HCE组和HE组G-6-PDH、ME和FAS活性均显著高于C组(P < 0.05), 表明鱼体摄入过多的糖类能够促进糖类向脂肪的转化。HE组则显著高于HCE组, 说明提高饲料糖含量和降低饲料脂肪水平均能促进脂肪酸的从头合成。摄入高糖日粮能提高肝脏中NADPH合成酶类(G-6-PDH、ME等)[35]和FAS的活性[36], 促进脂肪酸从头合成。然而, LIKIMANI和WILSON[37]的研究发现, 高糖低脂饲料能够显著提高鲶鱼(Parasiluyus asotus)的G-6-PDH和ME活性。
HSL是脂肪分解过程的限速酶, 能够水解脂肪和胆固醇以及其他脂质。该实验中HCE组和C组的HSL活性差异不显著(P>0.05), 而HE组则显著低于C组和HCE组(P < 0.05)。HSL水平变化趋势与全鱼脂肪变化趋势一致, 由此推测, HSL活性大小与饲料中脂肪水平联系密切。原因可能是HE组鱼体摄入的脂肪含量较少, 而饲料中糖类转化成脂肪能力有限, 故全鱼脂肪较低, 导致HSL活性降低; JOCKEN等[38]的研究也发现, 低脂高糖日粮能够引起HSL活性显著降低, 而高脂低糖日粮的则显著升高。
3.5 高糖饲料对吉富罗非鱼肝脏组织结构的影响
鱼体摄入多过的糖类会导致肝脏负担加重, 出现肝组织肿大等现象[39]。该实验中HCE组和HE组的肝体比均显著高于C组, 且摄食HCE组饲料的吉富罗非鱼肝脏细胞变形肿大, 空泡化严重; 尤其是HE组饲料中脂肪含量仅为2.35%, 但其实验鱼肝细胞变形情况依然高于C组, 说明高糖饲料可能会导致吉富罗非鱼的肝脏损伤。类似的研究结果在异育银鲫的研究中也有发现, 高糖饲料能引起其肝脏细胞中线粒体等超微结构的变形损伤, 导致肝脏功能下降[27]。蒋利和等[40]也发现, 随着饲料糖水平的升高, 吉富罗非鱼肝脏出现脂滴、空泡等现象, 损伤严重。
4. 小结
鱼体肝脏中脂肪酸的从头合成能力极其有限, 然而饲料中糖水平和脂肪水平均能够显著影响吉富罗非鱼的脂肪代谢。相对于对照组, 48%糖水平的饲料显著降低了吉富罗非鱼的生长性能, 影响饲料利用以及鱼体糖脂代谢, 造成鱼体脂肪蓄积, 并且对肝脏造成损伤, 过多的糖类不利于吉富罗非鱼的生长。
-
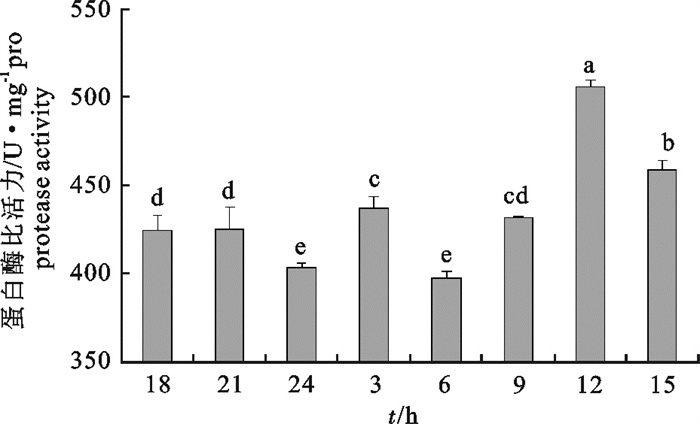
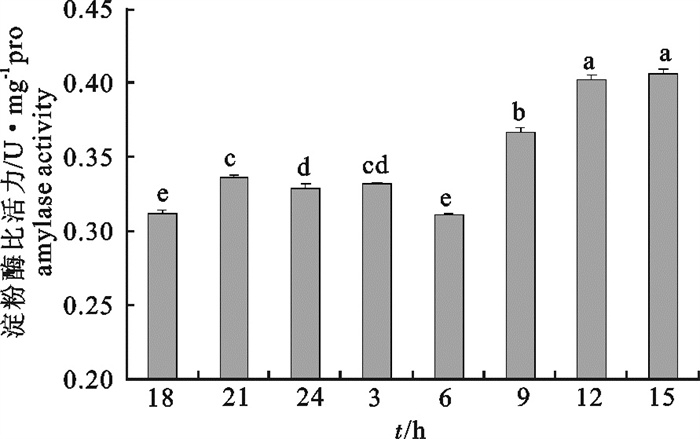
图 1 鲻鱼幼鱼蛋白酶比活力的昼夜变化
图标上方不同小写字母表示不同时间鲻鱼幼鱼消化酶活力差异显著(P < 0.05),后图同此
Figure 1. Diurnal variation in protease activity of juvenile M.cephalus
Different lowercases on the above figures mean significant difference in activity of digestive enzyme of juvenile M.cephalus at different time (P < 0.05); the same case in the following figure.
表 1 盐度对鲻鱼幼鱼蛋白酶比活力的影响(X±SD)
Table 1 Effect of salinity on protease activity of juvenile M.cephalus
时间/d
time盐度salinity S0 S10 S20 S33 S40 0 280.22±0.69dA 280.22±0.69cA 280.22±0.69eA 280.22±0.69dA 280.22±0.69dA 1 296.13±1.14cB 295.31±2.10cB 340.19±2.40cA 329.62±3.80bA 278.16±5.52dB 2 386.36±4.91bB 438.22±10.02bA 284.82±0.97dD 299.51±3.32cD 340.99±1.94cC 7 602.81±5.55aA 549.17±6.20aB 476.88±5.18aC 452.54±6.56aC 485.62±3.72aC 14 291.01±0.584cD 312.22±6.20cD 366.19±2.39bC 446.27±1.91aA 402.41±2.06bB 注: 数据右上角的小写字母表示同一处理不同时间下对蛋白酶比活力的影响,数据右上角的大写字母表示不同处理在同一时间下对蛋白酶比活力的影响,具有相同字母的数据表示差异不显著(P>0.05),后表同此
Note: Different small letters on the top right corner of the data mean significant difference in protease activity at different time under the same salinity (P < 0.05),and different capital letters mean significant difference in protease activity at the same time under different salinity (P < 0.05); the same case in the following table.表 2 盐度对鲻鱼幼鱼淀粉酶比活力的影响(X±SD)
Table 2 Effect of salinity on amylase activity of juvenile M. cephalus
时间/d
time盐度salinity S0 S10 S20 S33 S40 0 0.113±0.002cA 0.113±0.002dA 0.113±0.002cA 0.113±0.002dA 0.113±0.002eA 1 0.236±0.003bB 0.246±0.014cB 0.283±0.001bA 0.237±0.001cB 0.239±0.005dB 2 0.242±0.005bBC 0.316±0.002bA 0.217±0.029bB 0.246±0.006cB 0.261±0.002cB 7 0.430±0.005aAB 0.447±0.010aA 0.352±0.006aB 0.381±0.005aB 0.452±0.005aA 14 0.242±0.004bC 0.238±0.002cC 0.241±0.010bC 0.348±0.004bA 0.296±0.004bB -
[1] 李希国, 李加儿, 区又君. pH对黄鳍鲷主要消化酶活性的影响[J]. 南方水产, 2005, 1(6): 18-22. doi: 10.3969/j.issn.2095-0780.2005.06.003 LI Xiguo, LI Jia'er, OU Youjun. Effect of pH on the activity of major digestive enzymes in yellowfin black porgy Sparus latus[J]. South China Fish Sci, 2005, 1(6): 18-22. (in Chinese) doi: 10.3969/j.issn.2095-0780.2005.06.003
[2] 李希国, 李加儿, 区又君. 温度对黄鳍鲷主要消化酶活性的影响[J]. 南方水产, 2006, 2(1): 43-48. doi: 10.3969/j.issn.2095-0780.2006.01.009 LI Xiguo, LI Jia'er, OU Youjun. Effect of temperature on the activity of major digestive enzymes in yellowfin black porgy Sparus latus[J]. South China Fish Sci, 2006, 2(1): 43-48. (in Chinese) doi: 10.3969/j.issn.2095-0780.2006.01.009
[3] 林浩然. 鱼类生理学[M]. 广州: 广东高等教育出版社, 2002: 127-134. LIN Haoran. Physiology of fishes[M]. Guangzhou: Guangdong Higher Education Press, 2002: 127-134. (in Chinese).
[4] 黄银燕, 康斌, 刘华忠. 鲻鱼肌肉蛋白质的营养价值[J]. 湛江海洋大学学报, 2003, 23(3): 68-70. doi: 10.3969/j.issn.1673-9159.2003.03.013 HUANG Yinyan, KANG bin, LIU Huazhong. The nutritional value of muscle protein in grey mullet[J]. J Zhanjiang Ocean Univ, 2003, 23(3): 68-70. (in Chinese) doi: 10.3969/j.issn.1673-9159.2003.03.013
[5] PERERA P A B, De SILVA S S. Studies on the chemical biology of young grey mullet, Mugil cephalus L[J]. Fish Biol, 1978, 13(3): 297-304. doi: 10.1111/j.1095-8649.1978.tb03437.x
[6] De SILVA S S. Biology of juvenile grey mullet: a short review[J]. Aquaculture, 1980, 19(1): 21-36. doi: 10.1016/0044-8486(80)90004-6
[7] 区又君, 李加儿. 人工培育条件下鲻鱼早期发育的生理生态研究[J]. 热带海洋, 1998, 17(4): 29-39. OU Youjun, LI Jia'er. Study on ecological physiology of early development of grey mullet Mugil cephalus under artificial rearing conditions[J]. Trop Oceanol, 1998, 17(4): 29-39. (in Chinese)
[8] 李加儿, 区又君, 丁彦文, 等. 广东池养鲻鱼的繁殖生物学[J]. 中国水产科学, 1998, 5(3): 39-42. https://www.fishscichina.com/zgsckx/article/abstract/4314?st=article_issue LI Jia'er, OU Youjun, DING Yanwen, et al. The reproductive biology of grey mullet pond culture in Guangdong province[J]. J Fish Sci China, 1998, 5(3): 39-42. (in Chinese) https://www.fishscichina.com/zgsckx/article/abstract/4314?st=article_issue
[9] 区又君, 李加儿. 鲻鱼胚胎和卵黄囊期仔鱼的发育与营养研究[J]. 海洋学报, 1997, 19(3): 102-110. https://d.wanfangdata.com.cn/periodical/Ch9QZXJpb2RpY2FsQ0hJTmV3UzIwMjQxMTA1MTcxMzA0Eg5RSzE5OTcwMDQ3MTUxNhoIMXNmenIyNjM%3D OU Youjun, LI Jia'er. Study on development and nutrition under fish embryos and yolk sac larvae period of grey mullet[J]. Actc Ocean Sinica, 1997, 19(3): 102-110. (in Chinese) https://d.wanfangdata.com.cn/periodical/Ch9QZXJpb2RpY2FsQ0hJTmV3UzIwMjQxMTA1MTcxMzA0Eg5RSzE5OTcwMDQ3MTUxNhoIMXNmenIyNjM%3D
[10] 王福荣. 生物工程分析与检测[M]. 北京: 中国轻工业出版社, 2005: 204-207. WANG Furong. Analysis and test in bioengineering[M]. Beijing: China Light Industry Press, 2005: 204-207. (in Chinese)
[11] 田宏杰, 庄平, 章龙珍, 等. 水温对施氏鲟幼鱼消化酶活力的影响[J]. 中国水产科学, 2007, 14(1): 126-131. doi: 10.3321/j.issn:1005-8737.2007.01.018 TIAN Hongjie, ZHUANG Ping, ZHANG Longzhen, et al. Effects of water temperature on activities of digestive enzymes of juvenile Acipenser schrenckii[J]. J Fish Sci China, 2007, 14(1): 126-131. (in Chinese) doi: 10.3321/j.issn:1005-8737.2007.01.018
[12] FANG L S, CHIOU S F. Effect of salinity on the activities of digestive protease from the tilapia fish, Oreochromis niloticus, in different culture environments[J]. Comp Biochem Physiol, 1989, 93A: 439-443.
[13] SANCHEZ-CHIANG L, CISTEMAS E, PONCE O. Partial purification of pepsins from adult and juvenile salmon fish Oncorhynchus keta, effect of NaCl on proteolytic activities[J]. Comp Biochem Physiol, 1987, 87B: 793-797. doi: 10.1016/0305-0491(87)90390-7
[14] SQUIRES E J, HAARD N F, FELTHAM L A W. Gastric proteases of the Greenland cod Gadus ogac Ⅱ. Structural properties[J]. Biochem Cell Biol, 1986, 64(3): 2l5-222. doi: 10.1139/o86-031
[15] 李希国, 李加儿, 区又君. 盐度对黄鳍鲷幼鱼消化酶活性的影响及消化酶活性的昼夜变化[J]. 海洋水产研究, 2006, 27(1): 40-45. doi: 10.3969/j.issn.1000-7075.2006.01.007 LI Xiguo, LI Jia'er, OU Youjun. Effects of salinity on digestive enzyme activity and diurnal variation of digestive activity of yellowfin black porgy Sparus latus[J]. Mar Fish Res, 2006, 27(1): 40-45. (in Chinese) doi: 10.3969/j.issn.1000-7075.2006.01.007
[16] 陈品健, 王重刚, 郑森林. 盐度影响真鲷幼鱼消化酶活力的研究[J]. 厦门大学学报: 自然科学版, 1998, 37(5): 754 -756. doi: 10.3321/j.issn:0438-0479.1998.05.025 CHEN Pinjian, WANG Chonggang, ZHEN Senlin. Effects of salinity on digestive enzyme activity of Pagrosomus major young fish[J]. J Xiamen Univ: Natural Science, 1998, 37(5): 754 -756. (in Chinese) doi: 10.3321/j.issn:0438-0479.1998.05.025
[17] 强俊, 王辉, 李瑞伟, 等. 盐度对奥尼罗非鱼仔、稚鱼生长、存活及其消化酶活力的影响[J]. 南方水产, 2009, 5(5): 8-14. doi: 10.3969/j.issn.1673-2227.2009.05.002 QIANG Jun, WANG Hui, LI Ruiwei, et al. Effects of salinities on growth, survival and digestive enzymes activity of larval hybrid tilapia(Oreochromis niloticus×O. aureus)[J]. South China Fish Sci, 2009, 5(5): 8-14. (in Chinese) doi: 10.3969/j.issn.1673-2227.2009.05.002
[18] 陈慕雁. 大菱鲆不同发育阶段消化生理的研究[D]. 青岛: 中国海洋大学, 2004. 10.7666/d.y647037 CHEN Muyan. The physiology of digestion in different developmental stages of turbot[D]. Qingdao: Ocean University of China, 2004. (in Chinese) 10.7666/d.y647037
[19] 白东清, 龙良启, 贾林, 等. 黄鳝肠组织消化酶初探[J]. 湖北农业科学, 1997(5): 56-59. BAI Dongqing, LONG Liangqi, JIA Lin, et al. Study on intestinal digestive enzyme activities of ricefield eel(Monopterus ablus)[J]. Hubei Agric Sci, 1997(5): 56-59. (in Chinese)
[20] 蔡良候, 林向阳, 温凭, 等. 盐度对鲻鱼前期仔鱼生长与存活的影响[J]. 福建水产, 2003, 27(1): 20-24. https://d.wanfangdata.com.cn/periodical/Ch9QZXJpb2RpY2FsQ0hJTmV3UzIwMjQxMTA1MTcxMzA0Eg5RSzIwMDIwMTI4MzY5MxoING1zdmF1cXQ%3D CAI Lianghou, LIN Xiangyang, WEN Ping, et al. Effect of salinity on growth and survival of grey mullet pre-larvae[J]. J Fujian Fish, 2003, 27(1): 20-24. (in Chinese) https://d.wanfangdata.com.cn/periodical/Ch9QZXJpb2RpY2FsQ0hJTmV3UzIwMjQxMTA1MTcxMzA0Eg5RSzIwMDIwMTI4MzY5MxoING1zdmF1cXQ%3D
[21] HELAMAN G S. Fish behavior by day, night and twilight[M]//PITCHER T J. The behaviour of teleost fishes. Bathimore, Maryland: The Johns Hopkins Liniv Press, 1986: 366-387. 10.1007/978-1-4684-8261-4_14
[22] OKADA X. On the feeding activity of the young sea bream Chrysophrys major Temminck et Schleget in the Yellow Sea[J]. Bull Jpn Soc Sci Fish, 1965, 31(12): 999-1005. doi: 10.2331/suisan.31.999
[23] SCHWASSMAN H O. Biological rhythms: their adaptive significance[M]//ALIED M A. Environmental physiology of fishes. New York: Plenum Press, 1980: 613-630. doi: 10.1007/978-1-4899-3659-2_24
[24] 郑微云, 苏永金, 李文权, 等. 真鲷幼体的摄食与营养[J]. 水产学报, 1994, 18(2): 124-130. https://d.wanfangdata.com.cn/periodical/Ch9QZXJpb2RpY2FsQ0hJTmV3UzIwMjQxMTA1MTcxMzA0Eg5RSzE5OTQwMDcwNDU5OBoIdm1kNm1qZjQ%3D ZHENG Weiyun, SU Yongjin, LI Wenquan, et al. Feeding and nutrition of juvenile Pagrosomus major[J]. J Fish China, 1994, 18(2): 124-130. (in Chinese) https://d.wanfangdata.com.cn/periodical/Ch9QZXJpb2RpY2FsQ0hJTmV3UzIwMjQxMTA1MTcxMzA0Eg5RSzE5OTQwMDcwNDU5OBoIdm1kNm1qZjQ%3D
[25] 王重刚, 陈品健, 郑森林. 真鲷幼鱼消化酶活性的昼夜变化[J]. 水产学报, 1999, 23(2): 199-201. https://d.wanfangdata.com.cn/periodical/Ch9QZXJpb2RpY2FsQ0hJTmV3UzIwMjQxMTA1MTcxMzA0Eg5RSzE5OTkwMDU1MzQyMBoIbWl2eGVpNmo%3D WANG Chonggang, CHEN Pinjian, ZHENG Senlin. Diurnal variation of digestive enzyme activity of Pagrosomus major young fish[J]. J Fish China, 1999, 23(2): 199-201. (in Chinese) https://d.wanfangdata.com.cn/periodical/Ch9QZXJpb2RpY2FsQ0hJTmV3UzIwMjQxMTA1MTcxMzA0Eg5RSzE5OTkwMDU1MzQyMBoIbWl2eGVpNmo%3D
[26] 罗奇, 区又君, 李加儿, 等. 卵形鲳鲹消化酶活性的研究Ⅱ. 盐度和昼夜变化对幼鱼消化酶活性的影响[J]. 海洋渔业, 2010, 32(1): 54-58. doi: 10.3969/j.issn.1004-2490.2010.01.008 LUO Qi, OU Youjun, LI Jia'er, et al. Study on digestive enzymes activities of Trachinotus ovatusⅡ: effect of salinity and diurnal variation on digestive enzyme activity[J]. Mar Fish, 2010, 32(1): 54-58. (in Chinese) doi: 10.3969/j.issn.1004-2490.2010.01.008
[27] 乔志刚, 张国梁, 张英英, 等. 不同光照周期下鲇幼鱼的日摄食节律[J]. 水产科学, 2008, 27(10): 511-515. doi: 10.3969/j.issn.1003-1111.2008.10.003 QIAO Zhigang, ZHANG Guoliang, ZHANG Yingying, et al. Diel feeding rhythm of oriental sheatfish Silurus asotus in different photoperiods[J]. Fish Sci, 2008, 27(10): 511-515. (in Chinese) doi: 10.3969/j.issn.1003-1111.2008.10.003
[28] 李大勇, 何大仁, 刘晓春. 光照对真鲷仔稚幼鱼摄食的影响[J]. 台湾海峡, 1994, 13(1): 26-31. https://cstj.cqvip.com/Qikan/Article/Detail?id=1494306&from=Qikan_Article_Detail LI Dayong, HE Daren, LIU Xiaochun. Influence of light on feeding of larval, juvenile and young red bream[J]. J Oceangr Taiwan Strait, 1994, 13(1): 26-31. (in Chinese) https://cstj.cqvip.com/Qikan/Article/Detail?id=1494306&from=Qikan_Article_Detail
-
期刊类型引用(8)
1. 刘志强,郭绍健,王禹程,周成,吴峰,万荣. 中西太平洋金枪鱼延绳钓钓钩深度分布及其影响因素. 上海海洋大学学报. 2024(04): 1020-1030 .  百度学术
百度学术
2. 宋利明,李轶婷. 基于龙格库塔法的漂流延绳钓沉降过程数值模拟. 中国水产科学. 2022(01): 157-169 .  百度学术
百度学术
3. 周胜杰,杨蕊,于刚,马振华. 黄鳍金枪鱼幼鱼日周期性及摄食期间的运动行为规律. 南方农业学报. 2022(05): 1407-1414 .  百度学术
百度学术
4. 周胜杰,杨蕊,于刚,马振华. 黄鳍金枪鱼体质量与消化酶和免疫相关酶活性的关系研究. 南方水产科学. 2022(03): 163-169 .  本站查看
本站查看
5. 方伟,周胜杰,赵旺,杨蕊,胡静,于刚,马振华. 黄鳍金枪鱼5月龄幼鱼形态性状对体质量的相关性及通径分析. 南方水产科学. 2021(01): 52-58 .  本站查看
本站查看
6. 宋利明,周旺. 基于ANSYS Workbench力学仿真的金枪鱼延绳钓钓钩深度. 渔业现代化. 2021(04): 85-94 .  百度学术
百度学术
7. 周胜杰,杨蕊,于刚,马振华. 黄鳍金枪鱼幼鱼体长与血液指标关系研究. 南方水产科学. 2021(05): 126-132 .  本站查看
本站查看
8. 王书献,张胜茂,朱文斌,孙永文,杨昱皞,隋江华,沈烈,沈介然. 基于深度学习YOLOV5网络模型的金枪鱼延绳钓电子监控系统目标检测应用. 大连海洋大学学报. 2021(05): 842-850 .  百度学术
百度学术
其他类型引用(4)



 下载:
下载:



 粤公网安备 44010502001741号
粤公网安备 44010502001741号
