Determination of sulfate group in agar by ion chromatography
-
摘要:
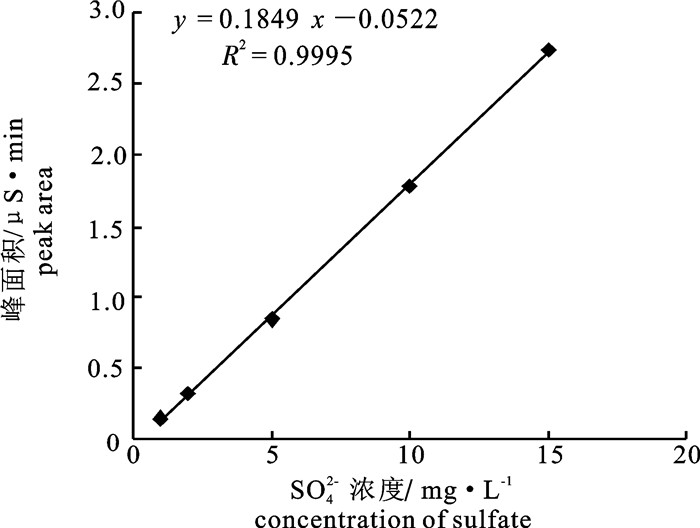
确立了离子色谱法检测琼胶中硫酸基含量的样品处理方法和检测条件。样品前处理采用灰化降解琼胶粉中的有机成分,超纯水溶解定容、过膜后测定;检测时利用戴安ICS-3000型离子色谱仪、电导检测器、ASRS 4 mm抑制器和IonPac®AS23型分离柱,淋洗液组成为9.0 mmol · L-1 Na2CO3溶液和1.6 mmol · L-1 NaHCO3溶液,流速1.0 mL · min-1。此方法硫酸根(SO42-)在1.0~15.0 mg · L-1浓度范围内呈良好的线性关系(R2=0.9995),检出限为0.01 mg · L-1,样品加标回收率为89.0%~102.0%,分析快速准确。离子色谱法与传统方法相比,操作快速简便,灵敏度高,重现性好。
Abstract:An ion chromatography method for the determination of sulfate content in agar was established. After being degraded the organic components of agar via ashing, the samples were dissolved in ultrapure water, then filtrated by a membrane of 0.45 μm.The sulfate was detected by DIONEX ICS-3000 ion chromatography equipped with a conductivity detector, ASRS 4 mm suppressor and IonPac AS23 column, using 9.0 mmol · L-1 Na2CO3 and 1.6 mmol · L-1 NaHCO3 as eluents. The flow rate of eluent was 1.0 mL · min-1. The results showed that the detection of sulfate had good linearity within concentration range of 1.0 mg · L-1 to 15.0 mg · L-1 (R2=0.9995). The detection limit of this method was 0.1 mg · L-1, and the recoveries of spiked matrix ranged from 89% to 102%. Compared with the traditional methods, ion chromatography was simple, rapid, accurate and sensitive.
-
Keywords:
- ion chromatography /
- agar /
- sulfate group
-
海洋是地球上最大的碳库,地球上超过一半(55%)的生物碳或绿色碳是由海洋生物捕获的[1]。由于海洋动物的呼吸过程将光合作用固定的碳(C)返回到大气中,从而被认为是减弱了海洋生物泵的效率,但近些年越来越多的研究表明海洋动物在海洋碳移动和储存上都有显著贡献[2-4]。海洋动物对海洋碳汇作用主要表现为通过自身的生理活动影响海洋中碳的运输和循环、起着封存碳的作用[5]。值得注意的是,海洋生物固碳不等于生物储碳,海洋中浮游生物和植物通过光合作用将大气中的二氧化碳(CO2)转化为有机碳,并由食物链将有机碳在海洋中传递的过程,称为生物固碳。而有机碳在生产、消费、沉降等一系列过程中,将一部分碳封存或沉积在海洋中,并长期不再参与大气中CO2的循环,称之为海洋储碳[6]。
海洋牧场是一个相对特殊的近海生态系统,海域内渔业资源量丰富,生物固碳效果明显[7]。但目前对海洋牧场生物固碳研究较少,且主要集中在浮游生物和大型藻类的固碳能力上,对海洋动物的固碳能力以及海洋动物碳沉积的研究还比较少见。因此,该研究将柘林湾海洋牧场海洋生物分为不同组织器官并进行灰化处理,分别测定了海洋生物灰化前后C含量,筛选出固碳能力较强的物种,并估算了柘林湾海洋牧场的生物固碳和储碳,以期为今后海洋牧场的模块化建设、碳汇估算和经营管理提供科学依据。
1. 材料与方法
1.1 研究区域概况
研究区域位于广东省饶平县境内柘林湾海洋牧场示范区,该示范区总面积2.067×104 hm2,分为人工鱼礁区、网箱养殖区、增殖放流区、贝类底播区和海藻养殖区等5个区域。截止2014年底,投放礁体96 823×104空方米,建成贝壳导流堤510 m,形成生态型海底构建区示范面积798.67 hm2。建立浅水浮式聚鱼构件示范区面积666.67 hm2,深水浮式聚鱼构件示范区面积126.67 hm2。增殖放流鱼苗720×104尾,虾苗1.4×108尾,资源产出是投入的7倍、回补率19.2%。建立贝床示范面积519.99 hm2,贝类平均密度11个·m-2以上。建立海藻区示范面积333.33 hm2,海藻场平均生物量达1 000 kg·hm-2以上[8-10]。
1.2 样品采集
2013年在柘林湾海洋牧场示范区海域布设13个站位进行游泳生物调查(图 1)。选取柘林湾常见物种,共采集样品18目44科71种(表 1)。
表 1 柘林湾海洋生物样品种类Table 1. Number of marine organism samples in Zhelin Bay纲Class 目Order 科Family 种species 硬骨鱼纲Osteichihyes 7 23 40 甲壳纲(虾) Crustacea(shrimp) 1 3 7 甲壳纲(蟹)Crustacea(crab) 4 6 头足纲Cephalopoda 2 2 2 双壳纲Bivalvia 6 6 9 腹足纲Gastropoda 2 6 7 合计total 18 44 71 1.3 样品处理与C质量分数测定
1.3.1 灰化前C质量分数测定
首先将生物样品用传统形态学分类方法进行分类,清理干净并称取湿质量。再将生物样品分解为肌肉、骨骼/壳、鳍条、鳞片、内脏等不同组织器官,称取不同部分湿质量。以65 ℃烘干样品,分别称取不同组织器官干物质质量。计算不同物种不同组织器官的干质量比率,以及不同组织器官的所占湿质量比重,即部分湿比重。
$\begin{split} R_{ij}=d_{ij}/w_{ij} \end{split}$
$\begin{split} r_{ij}=w_{ij}/w_i \end{split}$
式中Rij为i种类j组织器官的干质量比率;dij为i种类j组织器官的干质量;wij为i种类j组织器官的湿质量;rij为i种类j组织器官湿质量比;wi为i种类的总湿质量。
将烘干后的样品进行研磨处理,称取(5±0.005)mg样品,采用德国Vario EL cube元素分析仪,测出海洋生物不同组织器官C质量分数(%)。
1.3.2 灰化后C质量分数测定
将烘干研磨后的样品称取2~3 g放入坩锅中,先以小火加热使样品充分炭化至无烟,然后置于马弗炉中550 ℃高温煅烧4 h至无炭粒,即灰化完全。待冷至200 ℃以下后取出放入干燥器中冷却至室温,称取质量。计算样品灰分质量分数与灰分比率。
$\begin{split} x=m_1-m_3 \end{split}$
$\begin{split} f=x/(m_2-m_3) \end{split}$
式中x为样品中灰分质量;f为灰分比率;m1为坩埚和灰分的质量;m2为坩埚和样品的质量;m3为坩埚质量。
将已灰化后的样品,称取(5±0.005)mg用锡箔纸将样品包好,用德国Vario EL cube元素分析仪测出样品中C质量分数(%)。
1.3.3 灰化前后湿样含碳率计算
$\begin{split} V_{i前}=∑r_{ij}×R_{ij}×C_{ij前} \end{split}$
$\begin{split} V_{i后}=∑r_{ij}×R_{ij}×f_{ij}×C_{ij后} \end{split}$
式中Vi前为灰化前i种类湿样含碳率(以下简称含碳率);Vi后为灰化后i种类湿样含碳率;rij为i种类j组织器官湿质量比;Rij为i种类j组织器官的干质量比率;fij为i种类j组织器官的灰分比率;Cij前为灰化前i种类j组织器官干样C质量分数;Cij后为灰化后i种类j组织器官干样C质量分数。
1.4 生物量与C储量的估算
1.4.1 现存生物量估算
$\begin{split} B=c/(q×a)×s \end{split}$
式中B为现存生物量;c为平均每小时拖网渔获量;a为每小时网具取样面积;q为网具捕获率(取0.5);s为研究区域面积。
捕捞生物量来源于2014年广东省统计年鉴中渔业捕捞数据[11]。自然死亡生物量数据采用1龄鱼类自然死亡率0.09[12]乘以现存生物量估算,主要是由于渔获物中硬骨鱼类生物量占总生物量的70%以上。
1.4.2 碳储量估算
$\begin{split} C_{现存}=B×V_前 \end{split}$
$\begin{split} C_{捕捞}=E×V_前 \end{split}$
$\begin{split} C_{沉积}=B×M×V_前 \end{split}$
$\begin{split} C_{实际埋藏}=B×M×V_后 \end{split}$
$\begin{split} C_总=C_{现存}+C_{捕捞}+C_{沉积} \end{split}$
式中C现存为柘林湾海洋牧场年生物现存C储量;B为柘林湾海洋牧场生物现存量;V前为灰化前海洋生物含碳率;C捕捞为柘林湾海洋牧场年捕捞C储量;E为柘林湾海洋牧场年捕捞量;C沉积为年生物沉积C储量;M为自然死亡率;V后为灰化后海洋生物含碳率;C实际埋藏为年生物实际埋藏C量;C总为柘林湾海洋牧场海洋生物总C储量。
1.5 数据分析
采用Excel 2010软件对数据进行整理和分析,利用SPSS 16.0软件对数据进行单因素方差分析,并结合Duncan法比较不同组织器官的含碳量差异显著性,P<0.01表示极显著差异,0.01<P<0.05表示差异显著,P>0.05表示差异不明显。
2. 结果与分析
2.1 海洋生物各器官C含量特征
柘林湾海洋牧场海洋生物灰化前主要组织器官肌肉、骨骼/壳、内脏C质量分数均值变化分别为37.72%~47.41%、11.23%~34.91%、27.58%~33.95%,总体而言,海洋生物肌肉组织C质量分数高于其他组织器官,其中双壳纲和腹足纲肌肉的C质量分数显著高于骨骼/壳(P<0.05),说明肌肉组织是海洋生物固碳的重要器官(表 2和表 3)。
表 2 灰化前海洋生物各器官碳质量分数均值(平均值±标准误)Table 2. Average carbon content in different organs of marine organisms before ashing (X±SE)% 纲
Class碳质量分数carbon content 肌肉
meat骨骼/壳
bone/shell鳞片
scale鳍条
fin内脏
viscera硬骨鱼纲Steichihyes 47.41±0.98 34.22±1.91 19.19±1.88 23.35±2.17 33.95±2.58 甲壳纲(虾)Crustacea(shrimp) 42.28±0.84 34.91±1.85 - - - 甲壳纲(蟹)Crustacea(crab) 37.95±2.44 27.88±0.45 - - - 头足纲Cephalopoda 41.38±1.81 - - - 27.58±2.41 双壳纲Bivalvia 41.45±1.12 11.23±0.64 - - - 腹足纲Gastropoda 38.12±3.13 14.16±0.79 - - - 表 3 灰化前海洋生物不同科各器官碳质量分数Table 3. Carbon content in different organs of families of marine organisms before ashing% 科
Family碳质量分数carbon content 总含碳率
total肌肉
meat骨骼/壳
bone/shell鳞片
scale鳍条
fin内脏
viscera龙头鱼科Harpodontidae 22.75 36.56 17.54 31.30 28.36 5.60 海鳗科Muraenesocidae 39.05 37.99 0.00 23.70 41.04 5.13 鲻科Mugilidae 50.27 22.01 12.24 3.14 0.00 7.76 鮨科Serranidae 49.61 34.36 16.72 2.89 21.35 11.51 鲹科Caranginae 49.47 41.64 0.00 0.06 30.22 15.93 石首鱼科Sciaenidae 46.70 41.64 16.18 15.39 21.92 10.08 鲾科Leiognathidae 46.96 30.71 0.00 29.96 31.07 10.82 银鲈科Gerridae 46.94 46.74 13.36 12.02 46.91 11.86 鲷科Sparidae 49.58 13.41 13.75 34.53 24.03 10.69 金钱鱼科Scatophagidae 49.00 49.46 9.28 5.43 18.43 10.96 石鲈科Pomadasyidae 53.60 6.34 20.93 34.97 6.85 7.78 鯻科Theraponidae 31.66 39.07 - 27.88 38.54 12.56 䲗科Callionymidae 49.24 44.28 - 23.92 55.26 12.11 篮子鱼科Siganidae 56.84 44.65 - 33.76 46.05 9.24 带鱼科Trichiuridae 55.35 56.15 - 41.70 44.11 13.07 鲭科Scombridae 52.33 28.70 - 29.32 43.85 7.70 无齿鲳科Ariommidae 53.44 7.72 - 54.74 7.46 8.73 鲳科Stromateidae 48.71 42.23 - 37.63 41.45 14.11 鳗鰕虎鱼科Taenioididae 46.22 26.68 38.05 16.81 40.86 8.51 鲉科Scorpaenoidae 44.02 39.65 17.18 27.94 57.55 13.81 菱鲆科Scophthalmidae 41.56 43.56 0.00 23.87 8.11 9.64 鳎科Soleidae 42.16 28.88 20.80 32.26 45.25 8.61 舌鳎科Cynoglossidae 39.75 37.93 39.70 20.88 16.07 9.58 对虾科Penaeidae 45.92 37.42 - - 0.05 9.40 长臂虾科Palaemonidae 44.17 33.89 - - - 12.52 鼓虾科Alpheidae 38.96 31.02 - - - 11.25 梭子蟹科Portunidae 37.58 26.86 - - - 8.68 关公蟹科Dorippidae 34.54 27.54 - - - 7.80 方蟹科Grapsidae 37.48 28.22 - - - 7.67 玉蟹科Leucosiidae 38.41 30.03 - - - 8.15 锥螺科Turritellidae 26.39 12.05 - - - 10.68 蛾螺科Buccinidae 36.59 10.08 - - - 10.05 盔螺科Galeodidae 37.38 10.31 - - - 7.69 玉螺科Naticidae 41.95 16.98 - - - 14.29 蛙螺科Bursidae 40.83 15.83 - - - 15.14 塔螺科Turridae 37.86 13.32 - - - 10.33 鲍科Haliotidae 40.04 12.02 - - 44.71 5.88 蚶科Arcidae 41.32 11.09 - - - 9.48 江珧科Pinidae 40.73 13.16 - - - 4.24 贻贝科Mytilidae 42.79 12.02 - - - 18.77 海月蛤科Placunidae 39.25 11.22 - - - 8.22 帘蛤科Veneridae 44.58 11.25 - - - 9.80 枪乌贼科Loliginidae 42.91 - - - 27.13 5.10 蛸科Octopodidae 41.03 - - - 28.02 3.86 根据不同组织器官湿比重和干质量比率,估算出不同种类海洋生物的含碳率。灰化前硬骨鱼纲、腹足纲、甲壳纲(虾)含碳率均值较高,但除头足纲外,总体差别不大。大致为硬骨鱼纲11.48%,腹足纲11.36%,甲壳纲(虾)11.05%,双壳纲9.40%,甲壳纲(蟹)8.08%,头足纲4.02%。说明硬骨鱼纲、甲壳纲(虾)、腹足纲、双壳纲等固碳能力较强。
灰化后海洋生物主要组织器官中肌肉、骨骼/壳、内脏C质量分数均值变化分别为1.83%~8.28%、1.90%~12.54%、0.62%~8.29%。其中除硬骨鱼纲肌肉C质量分数显著高于骨骼/壳外(P<0.05),双壳纲、腹足纲等骨骼/壳C质量分数都显著高于肌肉(P<0.05),且腹足纲骨骼/壳C质量分数最高。说明骨骼/壳中无机碳含量较高,在海洋生物碳沉积中扮演重要角色(表 4和表 5)。
表 4 灰化后海洋生物各器官碳质量分数均值(平均值±标准误)Table 4. Average carbon content in different organs of marine organisms after ashing (X±SE)% 纲
Class碳质量分数carbon content 肌肉
meat骨骼/壳
bone/shell鳞片
scale鳍条
fin内脏
viscera硬骨鱼纲Steichihyes 7.01±1.30 1.90±0.67 0.89±0.49 1.13±0.59 8.29±1.38 甲壳纲(虾)Crustacea(shrimp) 6.72±2.43 8.04±0.62 - - - 甲壳纲(蟹)Crustacea(crab) 8.28±0.98 10.36±0.05 - - - 头足纲Cephalopoda 1.83±0.26 - - - 0.62±0.2 双壳纲Bivalvia 6.47±1.34 9.93±0.22 - - - 腹足纲Gastropoda 1.83±1.08 12.54±0.76 - - - 表 5 灰化后海洋生物不同科各器官碳质量分数Table 5. Carbon content in different organs of families of marine organisms after ashing% 科
Family碳质量分数carbon content 总含碳率
total肌肉
meat骨骼/壳
bone/shell鳞片
scale鳍条
fin内脏
viscera龙头鱼科Harpodontidae 3.65 0.25 1.27 0.83 4.00 0.04 海鳗科Muraenesocidae 0.29 0.52 0.00 0.38 17.40 0.04 鲻科Mugilidae 1.49 0.43 0.85 3.63 0.00 0.04 鮨科Serranidae 20.63 0.49 0.36 0.58 1.57 0.28 鲹科Caranginae 0.36 0.46 0.00 0.59 2.39 0.02 石首鱼科Sciaenidae 7.58 2.10 0.90 0.61 7.90 0.13 鲾科Leiognathidae 5.71 0.28 0.00 0.50 0.00 0.05 银鲈科Gerridae 18.40 1.45 0.41 1.13 0.32 0.22 鲷科Sparidae 3.11 0.49 0.71 0.67 19.23 0.13 金钱鱼科Scatophagidae 13.11 2.11 1.03 0.61 0.67 0.16 石鲈科Pomadasyidae 0.41 0.47 0.89 0.36 34.73 0.14 鯻科Theraponidae 4.26 0.94 - 0.95 0.28 0.08 䲗科Callionymidae 0.61 0.61 - 0.37 0.22 0.05 蓝子鱼科Siganidae 0.56 0.94 - 0.74 0.43 0.03 带鱼科Trichiuridae 19.32 0.00 - 0.46 0.00 0.17 鲭科Scombridae 6.06 0.56 - 0.34 10.85 0.08 无齿鲳科Ariommidae 25.07 0.86 - 12.14 0.00 0.39 鲳科Stromateidae 1.07 0.00 - 0.17 0.47 0.01 鳗鰕虎鱼科Taenioididae 0.48 0.54 0.58 0.26 0.80 0.02 鲉科Scorpaenoidae 0.18 0.92 0.37 0.00 0.79 0.03 菱鲆科Scophthalmidae 4.61 5.17 0.00 0.35 22.40 0.16 鳎科Soleidae 29.21 0.65 2.08 0.32 0.46 0.77 舌鳎科Cynoglossidae 23.86 0.73 2.15 1.75 13.21 0.33 对虾科Penaeidae 14.83 6.48 - - 0.77 0.32 长臂虾科Palaemonidae 2.05 9.48 - - - 0.55 鼓虾科Alpheidae 4.21 8.65 - - - 0.71 梭子蟹科Portunidae 4.70 8.38 - - - 0.91 关公蟹科Dorippidae 8.30 10.36 - - - 1.07 方蟹科Grapsidae 5.20 10.32 - - - 1.07 玉蟹科Leucosiidae 9.66 9.86 - - - 0.92 锥螺科Turritellidae 8.27 11.09 - - - 8.67 蛾螺科Buccinidae 6.55 11.14 - - - 7.20 盔螺科Galeodidae 1.85 13.42 - - - 6.35 玉螺科Naticidae 9.62 13.26 - - - 10.35 蛙螺科Bursidae 10.20 14.01 - - - 8.45 塔螺科Turridae 9.35 12.55 - - - 9.78 鲍科Haliotidae 1.76 9.82 - - 2.10 2.33 蚶科Arcidae 1.93 12.12 - - - 7.44 江珧科Pinidae 0.52 10.88 - - - 0.02 贻贝科Mytilidae 1.24 12.24 - - - 4.95 海月蛤科Placunidae 2.93 12.26 - - - 3.95 帘蛤科Veneridae 2.00 11.82 - - - 5.76 枪乌贼科Loliginidae 10.61 - - - 0.56 0.02 蛸科Octopodidae 2.93 - - - 0.83 0.13 除此之外,根据估算得出灰化后,各种类含碳率大致为腹足纲最高(8.43%),双壳纲次之(4.07%),而硬骨鱼纲(0.14%),甲壳纲(虾)(0.52%),甲壳纲(蟹)(0.99%),头足纲(0.08%)含碳率均值不超过1%。总体来说,腹足纲与双壳纲生物储碳能力较强。
灰化前后除腹足纲外,各种类含碳率变化都较为明显,其中硬骨鱼纲、甲壳纲(虾)和头足纲变化最大(图 2)。说明在灰化过程中,大部分的有机碳被灼烧,无机碳含量较少;进入碳循环的C较多,而沉积在海底并永久封存的C较少。
2.2 柘林湾海洋牧场海洋生物碳储量
海洋生物储碳的年限大致为100年[6],因此,笔者认为海洋中的有机碳可以通过生物地化作用重新进入碳循环,而无机碳由于进入碳循环的周期较长,可以认为是埋藏在海洋中的碳,不再进入碳循环。在此基础上,将柘林湾海洋牧场海洋生物储C分为3个部分:1)被人类捕获,从而移出海域的C;2)通过海洋生物自然死亡封存的C;3)现存于海域中的C。
根据不同种类资源密度,柘林湾海洋牧场的海域面积,捕捞量以及自然死亡率估算出柘林湾海洋牧场的C储量。结果表明2013年柘林湾海洋牧场海洋生物储碳为6.728×104 t,其中沉积在海底的C为0.516×104 t,占总储碳量的7.11%;人类通过捕捞从海洋中移除的C为0.155×104 t;封存在海洋内的并不断进入碳循环的C为6.46×104 t(表 6)。
表 6 柘林湾海洋生物碳储量Table 6. Carbon storage in marine organisms in Zhelin Bay104 t 纲
Class碳储量carbon storage 现存
exist现存沉积
exist sedimentary捕捞
catch捕捞沉积
catch sedimentary自然死亡
mortality自然死亡沉积
mortality sedimentary硬骨鱼纲Steichihyes 3.314 0.047 0.050 0.001 0.298 0.004 甲壳纲(虾)Crustacea(shrimp) 2.121 0.101 0.041 0.002 0.191 0.009 甲壳纲(蟹)Crustacea(crab) 0.149 0.018 0.014 0.002 0.013 0.002 头足纲Cephalopoda 0.187 0.097 0.023 0.012 0.017 0.009 双壳纲Bivalvia 0.225 0.175 0.027 0.021 0.020 0.016 腹足纲Gastropoda 0.036 0.001 0.001 0.000 0.003 0.000 总计total 6.030 0.439 0.155 0.037 0.543 0.040 硬骨鱼纲和甲壳纲(虾)现存碳储量较高,达5.435×104t,占碳储量的80.78%,主要由于柘林湾海洋牧场硬骨鱼纲和虾类资源密度和生物量较高,加之硬骨鱼纲和虾类含碳率高。而腹足纲和双壳纲年沉积碳储量较高,则是由于骨骼所占比重大,含碳率高所造成的。
3. 讨论
3.1 不同海洋生物C含量特征不同
柘林湾海洋牧场海洋生物主要组织器官肌肉、骨骼/壳、内脏灰化前C质量分数均值变化分别为37.72%~47.41%、11.23%~34.91%、27.58%~33.95%。不同物种肌肉、内脏C质量分数相差不大,但骨骼C质量分数相差20%以上,这与周毅等[13]、张继红等[14]和CZAMANSKI等[15]的研究结果基本一致。且海洋生物不同组织器官C含量整体上大于海藻、海带C含量[16],稍低于红树林和陆地植被各器官C含量[17-18]。但在以往海洋生物碳汇研究中,更多地关注红树林、浮游生物、大型藻类和贝类的固碳[19-24],而忽略了海洋动物对海洋固碳的影响。该研究结果进一步表明海洋动物在海洋储碳的过程中扮演着重要的角色。灰化后,海洋生物主要组织器官C质量分数均值变化大致为1.83%~8.28%、1.90%~12.54%、0.62%~8.29%。对比发现灰化前后不同物种不同组织器官C含量差别较大。其中肌肉C含量变化最大,这主要由于肌肉中蛋白质含量较高,有机碳含量高。在各物种含碳率的估算上,灰化前各物种湿质量含碳率均值变化为4.02%~11.36%,这比卢振彬等[25]的鲜样含碳率略低,主要是由于海洋生物不同组织器官含水率与C含量差异较大,卢振彬等将海洋生物作为一个整体,而该研究将海洋生物分为不同组织器官来测定。灰化后含碳率变化为0.08%~8.43%,除腹足纲外,各种类含碳率变化都较为明显,主要由于腹足纲骨骼/壳所占比重大,且骨骼/壳中无机碳含量较高。
3.2 不同统计方法对碳汇结果估算有较大的影响
在海洋生物碳汇估算上,不同的统计方法对碳汇结果影响较大。解绶启等[26]认为精确地估算需要大量生态学数据做基础,包括捕捞群体、死亡群体、现存群体、繁殖群体等,以及鱼体固碳归趋与周转速率和营养级之间的转换规律,因此各种计算方法之间会存在一定差异。吴斌等[27]根据不同物种C含量估算出2010-2014年全国淡水渔业通过捕捞平均每年移出碳29.4×104 t。吕为群等[28]根据鱼类生物量和碳酸盐排泄率估算出全球海洋鱼类每年可产生大约1.1×108 t的碳酸钙(CaCO3),在海洋总碳酸盐岩泥中占14%以上。宋金明等[29]根据大型藻类的C含量,估算出中国大型经济藻类养殖产量在(120~150)×104 t左右,固碳量平均每年约40×104 t。张莉等[30]采用异速生长法估算中国热带红树林湿地的碳储量平均高达1 023 mg·hm-2,碳汇能力较强。ALONG[31]估算出占全球沿海区域0.5%的红树林,对沿海沉积物储碳贡献率为10%~15%(每年24 t)。公丕海等[32]估算了莱州湾金城海域64.25 hm2海洋牧场礁体附着牡蛎总固碳量平均每年约59.5 t。李纯厚等[7]研究了大亚湾海洋牧场的固碳能力,发现人工鱼礁投放后,礁区固碳能力提高了1 144.69 kg。张波等[33]根据营养级方法估算出,2009年渤海回捕中国对虾(Fenneropenaeus chinensis)2 377 t,固碳1.66×104 t。不同种群、不同固碳能力以及不同估算方法都会造成碳储量估算结果不同。这就要求在今后海洋碳储量的估算中要增强估算结果的可比性。
3.3 海洋牧场构建将有效提高区域碳汇能力
近海碳汇的过程包括海—气界面转移,生物泵过程,沉降物沉降与释放过程,渔业捕捞和人工养殖碳转移过程等[34]。该研究仅考虑海洋动物的碳循环,即近似认为海洋动物摄食植物,吸收溶解有机碳(dissolved organic carbon,DOC), 吞食颗粒有机碳(particulate organic carbon,POC)为海洋动物固碳过程,并将这些C储存在生物体内。而海洋动物体内封存的C,一部分通过摄食损失、排泄或微生物的酶作用重新分解为DOC;另一部分死亡后成为有机碎屑转化为POC。溶解有机碳和颗粒有机碳之间相互转化,形成一个循环[35]。而POC的垂直升降过程,就是有机碳的沉降过程。在这个过程中,真正沉降出真光层的POC不足表层初级生产力的15%, 而到达海底被埋葬的POC只有初级生产力的0.1%,而其他的部分则会再悬浮重新进去碳循环[36]。
2013年柘林湾海洋牧场海洋生物储碳约6.728×104 t。这部分C是通过植物光合作用从大气中吸收CO2并转化为有机碳储存在生物体内,也即海洋生物从大气中移除的C[37]。人类通过捕捞从海洋中移除的C约0.155×104 t,占碳储量的2.31%。这就进一步提高了海域的碳汇能力。沉积在海底的C为0.11×104 t,占总碳储量的1.7%,海洋中沉积的碳既包含了POC的沉降,还包含了生物体中的无机碳成分,而这部分无机碳中有很大一部分是CaCO3的沉淀,也即海洋碳汇中的CaCO3固碳[38]。封存在海洋内的并不断进入碳循环的C约6.46×104 t,占总碳储量的95.98%。封存在海洋中的C包含了有机碳和无机碳两部分,在未来的碳循环中仍然有一部分C会沉积在海底,这部分C占碳储量的7.11%。海洋生物通过人类捕捞和自然沉积等方式,将CO2彻底移出大气,这就提高了区域海洋的碳汇能力。
4. 结论
海洋生物尤其是海洋动物是海洋碳储存和碳沉积的重要参与者。不同的物种、不同的组织器官C含量特征不同,固碳能力也不同。在今后海洋牧场的物种选择上不仅要考虑其经济价值,也要更多地考虑其生态价值,提高海洋牧场的固碳能力。此外,不同海域、不同资源密度、不同生物量以及不同的估算方法都会造成碳储量结果的差异。需要在今后海洋生物碳储量的估算中提高估算结果的可比性。
2013年柘林湾海洋牧场海洋生物储碳约6.728×104 t;其中通过人类捕捞移出C约0.155×104 t,占总碳储量的2.31%;通过自然死亡或生物活动沉积在海底的C约0.11×104 t,占总碳储量的1.7%;封存在海洋内的并不断进入碳循环的C约6.46×104 t,占总碳储量的95.98%。海洋牧场可以显著改善海域内资源状况,增加海域内生物量,有效提高海域内的碳汇能力。
-
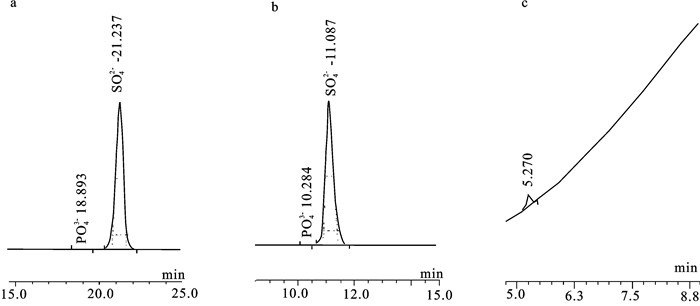
图 1 不同淋洗液浓度对SO42-保留时间的影响
a. 淋洗液组成:4.5 mmol · L-1Na2CO3,0.8 mmol · L-1 NaHCO3;b. 淋洗液组成:9.0 mmol · L-1 Na2CO3,1.6 mmol · L-1 NaHCO3;c. 淋洗液组成:13.5 mmol · L-1Na2CO3,2.4 mmol · L-1 NaHCO3
Figure 1. Effect of different eluent concentration on retention time of sulfate
a. composition of eluent: 4.5 mmol · L-1Na2CO3, 0.8 mmol · L-1 NaHCO3; b. composition of eluent: 9.0 mmol · L-1 Na2CO3, 1.6 mmol · L-1 NaHCO3; c. composition of eluent: 13.5 mmol · L-1 Na2CO3, 2.4 mmol · L-1 NaHCO3
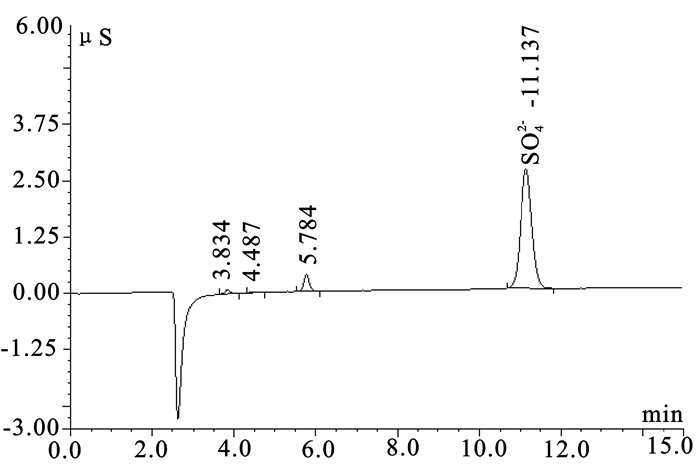
表 1 SO42-的离子色谱测定法的精密度(n=6)
Table 1 Determination precision of sulfate detection by IC
浓度/mg·L-1
concentration保留时间/min
retention time峰面积/μS·min
peak area of SO42-SO42-浓度/mg·L-1
concentration of SO42-t±t RSD/% S±S RSD/% c±c RSD/% 1.0 11.16±0.00 0.02 0.19±0.00 1.40 1.10±0.01 1.30 5.0 11.14±0.00 0.01 1.02±0.02 1.47 5.22±0.08 1.56 15.0 11.09±0.01 0.04 3.30±0.02 0.65 16.18±0.13 0.83 表 2 3种不同琼胶样品中SO42-含量及加标回收率(n=6)
Table 2 Contents of sulfate in three agar samples and results of recovery
样品
sample本底值/mg·g-1
background value加标水平/mg·g-1
adding standard level实测值/mg·g-1
measured value回收率/%
recoveryRSD/% A 4.15±0.13 0.25 4.38±0.07 92.0 1.65 1.00 5.09±0.04 94.0 0.76 5.00 8.95±0.19 96.0 2.13 B 3.56±0.13 0.25 3.79±0.15 92.0 3.84 1.00 4.58±0.12 102.0 2.62 5.00 8.52±0.09 99.2 1.04 C 5.48±0.42 0.25 5.72±0.11 96.0 1.96 1.00 6.37±0.15 89.0 2.32 5.00 10.39±0.07 98.2 0.64 -
-
期刊类型引用(27)
1. 曾粤,李永娟,黄进强,吴深基,赵璐,孙同振,马九菊. 低氧胁迫对虹鳟心脏组织抗氧化和细胞凋亡的影响. 农业生物技术学报. 2025(01): 166-178 .  百度学术
百度学术
2. 刘思炜,钟家美,范秀萍,秦小明,沈建,徐文其. 电晕休眠对卵形鲳鲹的生理应激和保活运输中主要营养成分的影响. 渔业科学进展. 2025(01): 210-221 .  百度学术
百度学术
3. 马九菊,黄进强,李永娟,吴深基,赵璐,曾粤. 低氧胁迫对虹鳟心脏生化指标和低氧相关基因表达的影响. 渔业科学进展. 2025(01): 82-92 .  百度学术
百度学术
4. 孟艳莎,杨哲,李欣阳,高居杰,艾力扎提·哈力夫,姜晨. 低氧胁迫对绿鳍马面鲀鳃组织抗氧化酶、呼吸相关酶及磷酸酶活性的影响. 水产科技情报. 2025(01): 20-25 .  百度学术
百度学术
5. 余欣欣 ,郑国栋 ,陈杰 ,邹曙明 . 低氧胁迫对鱼类影响的研究进展. 水产科学. 2024(02): 333-340 .  百度学术
百度学术
6. 林欣,谢希尧,区又君,李加儿,吴水清. 不同温度下四指马鲅幼鱼耗氧率及其窒息点研究. 渔业研究. 2024(02): 121-128 .  百度学术
百度学术
7. 李谣,杨智茹,程景颢,李杰,王涛,张凯,张国松,尹绍武. 低氧胁迫和复氧对长吻鮠鳃组织低氧应答基因和生理生化指标的影响. 中国农学通报. 2023(02): 107-116 .  百度学术
百度学术
8. 王文雯,杨静茹,付正祎,于刚,马振华. 运输时间对高体鰤幼鱼应激、代谢、抗氧化和免疫的影响. 中国渔业质量与标准. 2023(02): 25-36 .  百度学术
百度学术
9. 程顺,蒋文枰,刘士力,迟美丽,郑建波,杭小英,彭苗,李飞. 溶氧水平对翘嘴鲌及其新品种全雌1号的影响研究. 浙江农业科学. 2023(06): 1332-1337 .  百度学术
百度学术
10. 王文杰,陈博锦,姜欣彤,顾祎鑫,张正,魏艳超,王伟. 氧氟沙星慢性胁迫对黄盖鲽不同组织氧化应激的影响. 安徽农业科学. 2023(22): 80-83 .  百度学术
百度学术
11. 杜欢,秦小明,范秀萍,张家胜,李盛基. CO_2协同低温有水对卵形鲳鲹麻醉保活效果的影响. 广东海洋大学学报. 2022(01): 35-43 .  百度学术
百度学术
12. 段鹏飞,田永胜,李振通,李子奇,陈帅,黎琳琳,王心怡,王林娜,刘阳,李文升,王晓梅,李波. 棕点石斑鱼(♀)×蓝身大斑石斑鱼(♂)杂交后代与棕点石斑鱼低氧耐受能力初步研究. 中国水产科学. 2022(02): 220-233 .  百度学术
百度学术
13. 卢军浩,李兰兰,权金强,赵桂研,孙军,蒋常平,刘哲. 小瓜虫对虹鳟组织病理变化及TLR信号通路基因表达影响. 农业生物技术学报. 2022(04): 739-750 .  百度学术
百度学术
14. 钟智明,陈家宇,张静,汤保贵,于非非,赖文琪,朱洁雄. 基于代谢组学分析光强胁迫对卵形鲳鲹代谢的影响. 农业生物技术学报. 2022(04): 751-761 .  百度学术
百度学术
15. 陈恺琳,马鹏生,黄建盛,黄德,王婷,黄小洲. 低氧胁迫对珍珠龙趸幼鱼组织超氧化物歧化酶SOD含量的影响. 江西水产科技. 2021(04): 16-18 .  百度学术
百度学术
16. 徐畅,丁炜东,曹哲明,邴旭文,张晨光,谷心池,刘雨. 急性低氧胁迫对翘嘴鳜抗氧化酶、呼吸相关酶活性及相关基因表达的影响. 南方农业学报. 2020(03): 686-694 .  百度学术
百度学术
17. 李洪娟,陈刚,郭志雄,王维政,黄建盛,曾泽乾. 军曹鱼(Rachycentron canadum)幼鱼对环境低氧胁迫氧化应激与能量利用指标的响应. 海洋学报. 2020(04): 12-19 .  百度学术
百度学术
18. 王维政,曾泽乾,黄建盛,郭志雄,李洪娟,陈刚. 低氧胁迫对军曹鱼幼鱼抗氧化、免疫能力及能量代谢的影响. 广东海洋大学学报. 2020(05): 12-18 .  百度学术
百度学术
19. 王文豪,董宏标,孙彩云,段亚飞,李华,刘青松,张家松,曾祥兵. 石菖蒲挥发油和水溶性氮酮对鱼用麻醉剂的促皮渗透效果研究. 南方水产科学. 2020(04): 62-68 .  本站查看
本站查看
20. 张倩,黄进强,权金强,吴深基,王晓谰,潘玉财. 急性低氧胁迫和复氧对鲫鱼氧化应激的影响. 水产科学. 2020(05): 649-656 .  百度学术
百度学术
21. 黄小林,戴超,虞为,杨洁,杨育凯,李涛,林黑着,黄忠,孙莘溢,舒琥. 丁香酚对卵形鲳鲹幼鱼的麻醉效果. 广东海洋大学学报. 2020(04): 124-131 .  百度学术
百度学术
22. 陈德举,强俊,陶易凡,包景文,朱昊俊,胡乐佳,徐跑. 不同溶氧水平对吉富罗非鱼幼鱼生长、血液生化、脂肪酸组成及其抗海豚链球菌病的影响. 淡水渔业. 2019(04): 83-89 .  百度学术
百度学术
23. 刘思迅,周胜杰,韩明洋,王一福,洪嘉炜,顾志峰,马振华. 密度胁迫对卵形鲳鲹鱼苗运输水质、存活率、免疫酶活力和血清指标的影响. 海洋科学. 2019(04): 70-80 .  百度学术
百度学术
24. 王海锋,成永旭,李京昊,奚业文,李嘉尧. 干露和再入水对克氏原螯虾抗氧化应激能力的影响. 南方水产科学. 2019(05): 69-76 .  本站查看
本站查看
25. 孙莘溢,黄小林,黄忠,曹晓聪,周婷,林黑着,舒琥,虞为,杨育凯,李涛. 卵形鲳鲹摄食、耗氧节律和胃肠排空时间的研究. 南方水产科学. 2019(05): 77-83 .  本站查看
本站查看
26. 陈旭,马振华,周胜杰,蒋伟明,杨其彬,杨蕊,彭晓瑜,刘思迅,于刚. 丁香酚对卵形鲳鲹鱼苗运输水质、成活率和生理生化指标的影响. 中国渔业质量与标准. 2019(06): 39-47 .  百度学术
百度学术
27. 武晓会,刘洋,狄治朝,赵文静,王丛丛,许强华. 低氧对斑马鱼细胞存活能力的影响. 南方农业学报. 2018(08): 1641-1647 .  百度学术
百度学术
其他类型引用(27)




 下载:
下载:

 粤公网安备 44010502001741号
粤公网安备 44010502001741号
