Artificial breeding of Chinese sanguin(Hiatula chinensis)
-
摘要:
在繁殖季节对中国紫蛤Hiatuala chinensis亲贝进行营养强化培育可促使性腺在1周内成熟并自然排放精卵。在水温26.0~28.0℃条件下, 卵子受精约30min出现第一极体, 1h后进行第一次分裂发育至2细胞, 5h后发育至囊胚期, 12h后发育至担轮幼虫期, 19h发育至D形幼虫。D形幼虫培育密度控制在1 ind·mL-1, 采用不同饵料种类进行培育效果的比较, 结果表明, 一直投喂小球藻Chlorella vulgaris的效果最差, 幼虫发育至第7天陆续死亡; D形幼虫初期投喂金藻Dicrateria zhanjiangensis饵料, 从壳顶幼虫期开始混合投喂牟氏角毛藻Chaetoceros muelleri和亚心形扁藻Platymonas subcordiformis, 幼虫发育正常, 壳长平均增长10μm·d-1, 幼虫培育17d后开始进入附着变态阶段, 从附着变态的稚贝开始, 培育50d, 幼贝平均壳长可达4625μm, 壳长平均增长87.5μm·d-1。
Abstract:Artificial breeding of Chinese sanguin(Hiatula chinensis) was described in this article. During breeding season, the broodstocks of Chinese sanguin could mature and naturally spawn in one week after they were collected from the wild and fed with rich algae in an indoor rearing tank. Under water temperature range of 26.0~28.0℃, cleavage of zygotes and morula occurred in 1 h and 5 h, respectively; trocophore and D-larvae occurred in 12 h and 19 h, respectively, after fertilization. The D-larvae were reared at a density of 1 ind·mL-1 and fed with different algae. When fed with alga Chlorella vulgaris, the larvae died gradually after 7 days′ culture. When fed with Dicrateria zhanjiangensis at D-larvae and added with Platymonas subcordiformis along with Chaetoceros muelleri the larvae grew well. When D-larvae changed to early umbone veligers, the larvae grew at average 10 μm·d-1 in shell length and started metamorphosis on the 17th day after rearing. The mean shell length of the spat grew at 87.5 μm·d-1 and reached to 4 625 μm by 50 days′ rearing after larval settlement and metamorphosis.
-
Keywords:
- Chinese sanguin(Hiatula chinensis) /
- artificial breeding /
- growth /
- development
-
中国紫蛤Hiatula chinensis隶属于瓣鳃纲Lamellibranchia,异齿亚纲Heterodonta,帘蛤目Veneroida,紫云蛤科Psammobiidae。主要分布于台湾地区以南的西太平洋海区,中国的台湾、广东、海南及印度尼西亚等沿岸有分布。中国紫蛤肉质鲜美,价格约为60元· kg-1,为紫云蛤科中经济价值最高的种类之一,具有很好的增养殖开发前景。到目前为止,中国已对紫云蛤科的紫彩血蛤Nuttallia olivacea、尖紫蛤H.acuta和紫蛤H.violacea等种类的生物学和人工繁殖进行了研究[1-11],但目前国内外未见有关中国紫蛤人工繁殖方面的报道。此文对中国紫蛤人工繁殖进行了研究,旨在为进一步开展增养殖提供参考。
1. 材料与方法
1.1 试验的时间地点
试验于2008年7月5日至9月17日在广东省惠来县资深海水育苗场进行。
1.2 亲贝来源
2008年7月5日购进产自广东省饶平县大埕湾潮间带2~3龄(壳长7 cm以上)的野生亲贝12 kg,将亲贝洗刷干净后进行促熟培养。
1.3 培育设施与环境条件
培育设施为室内水泥池,规格(长×宽×深)为亲贝培育池5 m×4 m×0.6 m,育苗池4 m×2 m×1.5 m。海水为过滤水,盐度30~33,水温25.7~28.0℃,室内白天光照150 lx左右。亲贝和稚贝的生活基质为直径0.13~0.25 mm细砂。
1.4 培育管理
1.4.1 亲贝培育
采用铺砂培育,培育密度0.7 kg · m-2。刚放养时拨洒1×106~2×10-6土霉素,暂养2 d后进入营养强化培育。每天混合投喂亚心形扁藻(Platymonas subcordiformis)、牟氏角毛藻(Chaetoceros muelleri)和湛江叉鞭金藻(Dicrateria zhanjiangensis)4~6次,每次投至出现淡淡藻色为止。日流水量为200%,每5 d全换水并清洗底砂。
1.4.2 幼虫培育
亲贝自然排放精卵后移走亲贝,受精卵发育至D形幼虫时用300目筛绢网箱收集幼虫移入培育池中进行培育,起始培育密度为1 ind · mL-1,后期调节到0.5 ind · mL-1。每天换水2次,每次1/3(前期)~1/2(后期)。采用投喂不同饵料种类进行培育效果的比较,每天投喂4次,每2个水池为1组,具体分组情况见表 1。
表 1 投喂不同饵料的分组情况Table 1 Different groups fed with different algae×104 ind · mL-1 组别group 1~2 d 3~4 d 5~12 d A 金藻1.0 金藻、角毛藻共2.0 金藻、角毛藻共2.0,扁藻0.3~0.4 B 食用酵母0.1~0.2,小球藻1.0 小球藻、角毛藻共2.0 小球藻、角毛藻共3.0 C 小球藻1.0 小球藻2.0 小球藻3.0 1.4.3 稚贝培育
当幼虫进入壳顶后期后用200目筛绢网箱收集幼虫移入铺有1 cm厚细砂并预先进为过滤海水的育苗池中培育,培育密度为0.20 ind ·mL-1。当幼虫基本附着变态后将水深由1.4 m降到0.4 m,改为流水培育,日流水量150%。日投饵4次,投喂金藻和角毛藻6×104~8×104 ind · mL-1,扁藻2×104 ind · mL-1。
1.5 日常观察测量
每天测量水温2次,下雨后测量盐度;每天观察幼虫摄食活动情况并测量其大小,每10 d测量稚贝大小,幼虫和稚贝每次测量数为10个。
2. 结果
2.1 亲贝培育及催产
2008年7月5日购进亲贝后暂养2 d进入促熟培养阶段,至8月31日结束亲贝培育试验,亲贝的成活率达92%,在这期间水温25.8~28.0℃,亲贝出现3次较大的自然排放现象,排放时间为7月14日、7月17日和7月20日,排放间隔时间3~7 d,7月20日后排放量减少,间隔时间延长。试验期间采用亲贝阴干加流水刺激的催产方法,但不排放。
2.2 胚胎与幼虫发育
在水温26.0~28.0℃条件下,自然排放的卵子受精30 min出现第一极体;受精1 h后进行第一次分裂发育至2细胞;受精5 h后发育至囊胚期,球形胚体表面出现短小纤毛开始转动;受精12 h后发育至担轮幼虫期,胚体逐渐呈梨形,顶部膨大出现纤毛环,并在中央出现一长鞭毛,开始进行定向运动; 受精19 h后发育至D形面盘幼虫,这时的幼虫运动能力明显增强,健康的幼虫浮游于水体中、上层,24 h后便具有摄食能力。发育24 h的D形幼虫大小平均为112 μm×90 μm,这时壳高与壳长之比为1:1.5,4 d后幼虫壳顶部开始隆起,进入壳顶幼虫初期;10 d后进入壳顶幼虫后期,壳顶隆起更为明显,足逐渐形成,眼点出现;第13天进入匍匐幼虫期,这时足较发达,能伸出作短暂爬行,幼虫主要分布于水体中、下层,时而爬行,时而浮游,其大小为225 μm×205 μm,壳高与壳长之比为1:1.1;第17天幼虫大小达250 μm×220 μm,面盘逐渐消失,足发达,开始变态为营底栖生活的稚贝。
2.3 浮游期投喂不同饵料对幼虫的影响
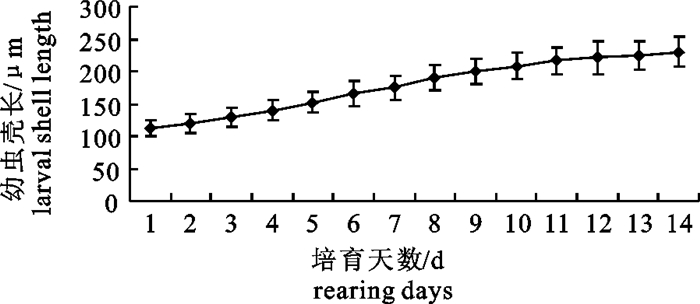
采用不同饵料进行浮游期培育效果的比较(表 2)。结果表明,一直投喂小球藻的C组效果最差,幼虫发育至第7天陆续死亡;采用多种单胞藻混合投喂的A组幼虫发育正常,幼虫壳长的平均增长速度为8.6 μm · d-1,其中D形幼虫期增长速度与平均增长速度接近,进入壳顶初期生长速度加快,可达10 μm · d-1以上,壳顶后期壳长生长速度明显减缓。幼虫生长曲线呈“S”走势(图 1)。
表 2 饵料对幼虫生长发育的影响Table 2 The effect of different algae on larval growth and development组别
group幼虫发育/d larval development 幼虫壳长日增长/μm·d-1
mean daily growth of larval shell length1~4 5~6 7~9 10~12 13~16 A D形 壳顶初期 壳顶中期 壳顶后期 匍匐期 8.6±0.63 B D形 D形 壳顶初期 死亡 3.2±0.34 C D形 D形 死亡 2.6±0.28 2.4 稚贝生长
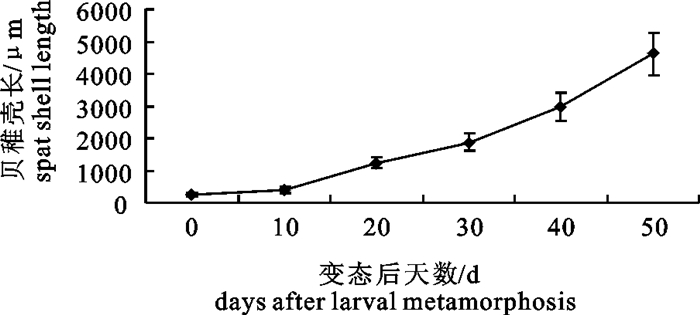
在水温25.7~28.0℃条件下,从附着变态稚贝起培育50 d,幼贝的平均规格达到4 625 μm×3 085 μm,壳长平均增长速度为87.5 μm · d-1(图 2),共育出幼贝32万,成活率达到10%。由壳长生长曲线可见,附着后10 d内,稚贝生长缓慢,但后期生长逐步加快。刚变态稚贝壳高与壳长之比为1:1.1,当幼贝大小达4 625 μm×3 085 μm时,其壳高与壳长之比约为1:1.5,这与1龄贝1:1.7较为接近,表明随着个体生长,其壳长增长速度快于壳高增长速度。
3. 讨论
3.1 关于亲贝培育与诱导排放
中国紫蛤主要栖息于细砂质潮间带低潮区至5 m水深浅海,属埋栖生活型贝类,成贝可潜入50 cm左右的砂层内,由于伸出水管很长,在挖捕时容易使水管受伤而导致亲贝培育的死亡率较高。亲贝刚放养时在培育海水中泼洒土霉素等抗菌素可提高其成活率。
在繁殖季节内通过控制亲贝放养密度和强化饵料投喂可有效促进亲贝性腺成熟并达到自然排放精卵的目的,符韶等[10]在进行尖紫蛤人工育苗时也采用该方法获得成功,蔡英亚等[9]则采用氨海水浸泡和温差刺激等方法诱导紫蛤排放。大多滩涂双壳贝类可采用阴干加流水刺激的方法诱导精卵排放,笔者曾多次采用该法进行中国紫蛤的诱导均未取得成功,其原因有待研究。
3.2 关于胚胎发育与幼虫饵料
亲贝性腺成熟度、水温和盐度等均是影响贝类胚胎发育的主要原因[2-3, 9, 12],由于胚胎发育时间较短,一般来说,在繁殖季节内从事人工育苗生产时水温等环境因子容易得到控制,胚胎能否正常发育关键看亲贝性腺成熟度。该试验采用自然排放的方法可确保排放出的卵子质量。
胚胎发育至D形幼虫后,需要进行投饵,因此,影响幼虫生长发育的因素除水温和盐度等条件外,饵料的大小适口性及质量直接影响到幼虫生长发育及人工育苗的成败[5, 12]。在D形幼虫阶段投喂小球藻,幼虫不能发育至壳顶初期,这与小球藻细胞壁厚,在幼虫初期阶段难消化有关[6, 12],金藻、小球藻和酵母均可以被初期D形幼虫摄食,但试验证明,只有金藻是最合适的开口饵料,这与有关报道一致[5]。该试验以金藻为主要饵料,进入壳顶期后再混合投喂角毛藻和扁藻,中国紫蛤幼虫发育正常、生长较快、大小整齐,证明在人工育苗生产上,除了应考虑幼虫不同发育阶段的饵料大小适口性外,采用多种单胞藻混合投喂可更好保证饵料的营养平衡,促进幼虫的生长发育。
3.3 关于稚贝生长
大多埋栖性贝类对所栖息的底质颗粒性状有明显的选择性[13],该试验使用的附着基质的粒径与亲贝来源地基本一致,可基本满足稚贝对底质的要求。该试验从附着稚贝长至壳长4 600 μm左右,平均壳长增长为87.5 μm · d-1,达到较高的生长速度,但在稚贝培育过程中,稚贝常产生较多粘液,这可能与底质环境逐步恶化有关[14],因此,定期更换底质对稚贝正常生长应更有利。
-
表 1 投喂不同饵料的分组情况
Table 1 Different groups fed with different algae
×104 ind · mL-1 组别group 1~2 d 3~4 d 5~12 d A 金藻1.0 金藻、角毛藻共2.0 金藻、角毛藻共2.0,扁藻0.3~0.4 B 食用酵母0.1~0.2,小球藻1.0 小球藻、角毛藻共2.0 小球藻、角毛藻共3.0 C 小球藻1.0 小球藻2.0 小球藻3.0 表 2 饵料对幼虫生长发育的影响
Table 2 The effect of different algae on larval growth and development
组别
group幼虫发育/d larval development 幼虫壳长日增长/μm·d-1
mean daily growth of larval shell length1~4 5~6 7~9 10~12 13~16 A D形 壳顶初期 壳顶中期 壳顶后期 匍匐期 8.6±0.63 B D形 D形 壳顶初期 死亡 3.2±0.34 C D形 D形 死亡 2.6±0.28 -



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
