Comparison and geographical distribution of Polydora lingshuiensis and P.websteri
-
摘要:
采用形态学与分子生物学方法相结合,对陵水才女虫(Polydora lingshuiensis)和威氏才女虫(P.websteri)进行了比较与鉴定研究,并调查了它们的地理分布。在形态上,陵水才女虫的脑后脊上具中触角、粗足刺刚毛近末端具凹陷;而威氏才女虫无中触角、粗足刺刚毛具侧凸缘。遗传距离分析结果显示,基于核糖体18S基因、线粒体COⅠ基因、线粒体Cyt b基因的陵水才女虫和威氏才女虫的种间遗传距离明显大于其种内遗传距离。基于COⅠ、Cyt b的才女虫的种间种内遗传距离比率远大于基于18S的遗传距离比率。才女虫的COⅠ与Cyt b基因的条形码间隔比18S的更宽,分辨率更高,更适用于形态相似种的辅助鉴定。在中国海域,陵水才女虫和威氏才女虫均属于宿主特异性低、地理分布性广的才女虫种类,其传播途径可能与其宿主的养殖方式以及商业运输密切相关。
Abstract:Polydora lingshuiensis and P.websteri were compared for precise identification by techniques of morphology and molecular biology. Their geographical distributions were also investigated. Morphologically, P.lingshuiensis are differentiated from P.websteri in that P.lingshuiensis have one median antenna on the caruncle and one concavity at subterminal end of major spine, whereas P.websteri have no median antenna, and have lateral flange on major spine. Distance analyses reveal that the interspecific distance between P.lingshuiensis and P.websteri is obviously longer than their intraspecific distance based on nucleus 18S gene, mitochondrial COⅠ and Cyt b gene. Distance ratio between interspecific and intraspecific polydorins is much greater based on mitochondrial COⅠ and Cyt b gene than nucleus 18S gene. Mitochondrial COⅠ and Cyt b gene have wider barcoding gap and higher resolution than nucleus 18S gene, so they are more suitable for assistant identification of morphologically similar polydorins. P.lingshuiensis and P.websteri are of low host-specificity and widespread along China′s coastal waters. Their transmissions may be closely related to the breeding manner and commercial transportation of their hosts.
-
才女虫属复合体(Polydora Complex)是环节动物门海稚虫科中第五刚节发生变形的所有种类的合称[1]。一部分才女虫能钻入贝壳,在壳表面或壳内产生污垢,不仅阻碍宿主的生长与发育,还影响其品质,降低贝类的经济价值,是严重危害贝类养殖业发展的主要寄生虫类之一[2-4]。长期以来,才女虫的鉴定主要依赖于形态学特征,如触手、口前叶、粗足刺刚毛、鳃的起始位置、色素分布等特征[5]。但是,作为低等生物,才女虫在形态上的趋同进化和表型可塑性的特点对其分类带来了巨大的挑战,即使经验丰富的分类学家也容易错误鉴定种类,造成同物异名或异物同名现象,引起才女虫分类上的混乱。如曾被认为世界广布的凿贝才女虫(Polydora ciliata),经过俄罗斯学者的初步鉴定,至少存在P.manchenkoi、P.calcarea、P.aggregata、P.brevipalpa等4种才女虫[4, 6]。
近年来,分子标记技术的应用为才女虫的系统分类提供了一个特征更稳定的判断依据。SATO-OKOSHI和ABE[7]首次以核糖体18S基因为分子标记,比较研究了韩国水域分布的形态特征相似的才女虫种类。RICE等[8]首次以线粒体细胞色素C氧化酶Ⅰ为分子标记,证明了北美地区分布的美角才女虫(P.cornuta)至少包括3种隐存种。SIMON等[9]应用细胞色素b基因证明南非地区鲍寄生的Boccardia proboscidea并非土著种,而是通过感染宿主的运输由北美传入。核糖体18S基因、线粒体细胞色素C氧化酶Ⅰ、细胞色素b基因等分子标记的应用极大地提高了才女虫鉴定的准确性和可信度。尤其是对那些形态相似种的鉴定,分子标记技术的辅助鉴定不可或缺
陵水才女虫(P.lingshuiensis)首先在马氏珠母贝(Pinctada martensii)和企鹅珍珠贝(Pteria penguin)上发现,是一种常见的才女虫种类[10]。威氏才女虫(P.websteri)是世界广布性的才女虫种类,在美国、墨西哥、厄尔多瓜、澳大利亚、日本、韩国、英国等沿海海域均有报道[5, 11-14]。陵水才女虫和威氏才女虫的形态特征非常相似,且均表现出较高的形态可塑性,仅通过形态特征鉴定区分极易混淆。该研究通过调查中国沿海的贝类,弄清陵水才女虫和威氏才女虫的宿主多样性和地理分布;比较它们的形态特征,并辅以核糖体18S基因、线粒体细胞色素C氧化酶Ⅰ、细胞色素b基因序列数据比较这两种才女虫的遗传距离并加以鉴定区分。该研究旨在通过将形态学与分子标记技术相结合,为才女虫的系统分类提供一种可靠、准确有效的方法。
1. 材料与方法
1.1 样品采集
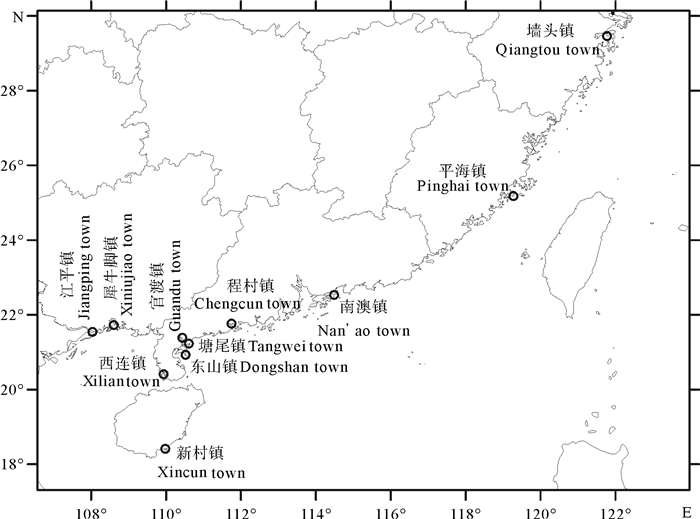
该研究的贝类样品主要收集于大连、秦皇岛、烟台、南通、宁波、温州、莆田、泉州、厦门、汕尾、深圳、阳江、湛江、钦州、东兴、陵水等中国沿海城市,其中具有威氏才女虫和陵水才女虫的采集地点如图 1所示。采集的贝类包括虾夷扇贝(Patinopecten yessoensis)、马氏珠母贝、企鹅珍珠贝、香港牡蛎(Crassostrea hongkongensis)、太平洋牡蛎(C.gigas)、熊本牡蛎(C.sikamea)、僧帽牡蛎(Saccostrea cucullata)、华贵栉孔扇贝(Mimachlamys nobilis)等,其中具有威氏才女虫和陵水才女虫的样品采集信息见表 1。将养殖贝类从贝架上拉起,收集各种规格贝体约60只,带回岸上收集才女虫样品。对于野生贝类,主要通过渔船在入海的江河、港湾处的桥墩、石缝等拾取的方式收集,或通过当地的水产市场、沿海的渔民购买获取。用钳子或螺丝刀将贝体小心地撬开,去除贝壳内表面的贝肉,在有明显的黑色孔道、结痂等处,配合使用钳子、解剖针、镊子等工具,将才女虫从贝壳表面的洞穴或管道中取出,置于盛有原采集地海水的平皿中。待活体形态观察完成后,将才女虫样品进行固定,一部分样品固定于10%中性甲醛溶液中,用于后续形态学观察;一部分样品固定于80%乙醇中,用于分子生物学实验;一部分样品固定于2.5%戊二醛溶液中,用于扫描电镜样品的制备。
表 1 贝类寄生陵水才女虫与威氏才女虫的样品采集信息Table 1 Sampling information of shell-infested P.lingshuiensis and P.websteri种类
species采集地点
location采集日期
sampling date宿主
host感染类型
infection type陵水才女虫P.lingshuiensis 海南陵水新村镇 2012-10, 2013-06, 2015-05 马氏珍珠贝、企鹅珍珠贝 管栖、贝壳间隙、泥疱型 广西东兴江平镇 2015-10 香港牡蛎 泥疱型 广西钦州犀牛脚镇 2015-11 香港牡蛎 泥疱型 广东湛江西连镇 2013-06 马氏珍珠贝 泥疱型 广东湛江官渡镇 2015-08 香港牡蛎 泥疱型 广东湛江塘尾镇 2015-11 香港牡蛎 泥疱型 广东湛江东山镇 2015-08 香港牡蛎、熊本牡蛎、僧帽牡蛎 贝壳间隙、泥疱型 广东阳江程村镇 2015-02 香港牡蛎 泥疱型 广东深圳南澳镇 2014-08 香港牡蛎、石头荣螺、华贵栉孔扇贝 贝壳间隙、泥疱型 福建莆田平海镇 2014-07 太平洋牡蛎 贝壳间隙、泥疱型 威氏才女虫P.websteri 广西东兴江平镇 2015-10 香港牡蛎 泥疱型 广东阳江程村镇 2015-02 香港牡蛎 泥疱型 广东深圳南澳镇 2014-08 香港牡蛎 贝壳间隙、泥疱型 浙江宁波墙头镇 2014-07 太平洋牡蛎 泥疱型 1.2 形态观察
将活体才女虫置于预先装有海水的单凹载玻片上,滴少许5%氯化镁(MgCl2)溶液麻醉虫体,然后在体视显微镜下对其口前叶、脑后脊、鳃、肛部等形态特征进行观察。对于粗足刺刚毛等较为微小的结构,可将虫体压片,置于生物显微镜下观察。
将经戊二醛固定的样品置于自来水中冲洗2 h以上,然后样品置于梯度乙醇中逐级脱水。乙醇脱水后入100%醋酸异戊酯中置换,临界点干燥仪进行干燥,Eiko IB-3型离子溅射仪喷金,在Hitachi S-3400N SEM扫描电镜下观察、拍照。
1.3 总DNA的提取、扩增与测序
每个才女虫样品切取约2 cm长的虫体部分,置于1.5 mL离心管内,空气中将乙醇晾干。才女虫总基因组DNA的提取参照百泰克细胞/组织基因组提取试剂盒(百泰克,北京)的使用说明进行操作。根据不同要求,使用不同的引物进行才女虫的序列扩增(表 2)。扩增的3个基因片段分别为核糖体小亚基(18S)、线粒体细胞色素C氧化酶Ⅰ(COⅠ)、细胞色素b(Cyt b)。PCR扩增体系为50 μL,包括2 μL模板DNA、0.4 μL ex Taq酶(TaKaRa,大连)、上下游引物各1 μmol · L-1(终浓度)、dNTP 0.2 μmol · L-1(终浓度)、标准扩增缓冲液、适量灭菌双蒸水。扩增反应程序为95 ℃预变性5 min;94 ℃变性50 s,50~54 ℃退火50 s,72 ℃延伸120 s,35个循环;72 ℃延伸10 min。扩增产物在1%的琼脂糖凝胶中电泳检测,将单一条带的PCR样品直接送测序公司进行测序。
表 2 该研究中使用的扩增与测序引物Table 2 PCR primers used in amplification and sequencing in this study引物名称
primer引物序列(5′→3′)
primer sequence引物出处
Reference18S 18SA AYCTGGTTGATCCTGCCAGT MEDLIN等[15] 18SR TCACCTACGGAAACCTTGTTACG TERAMOTO等[16] COⅠ X1-FF2 CCTWGTDATACCTRTCWTAATT 该研究 X1-R6 CCTGTAAATARAGGGAATCA 该研究 X1-F2 CCWGATATRGCATTCCC 该研究 X1-R2 GCKARYCADCTAAATACTTTAA 该研究 Cyt b Cob-F1 GCRACAGTAATTACTAAYATA 该研究 Cob-Rev CAGGKYGMCCHCCAATTCAKG 该研究 CobF424 GGWTAYGTWYTWCCWTGRGGWCARAT BOORE和BROWN[17] CobR876 GCRTAWGCRAAWARRAARTAYCAYTCWGG OYARZUN等[18] 注:反向引物序列以斜体字母表示。 Note:The sequences in italics indicate reverse primers. 1.4 序列分析
测序所得到序列经过拼接后,利用Bioedit软件包[19]中的CLUSTAL W对DNA序列进行多重比对,比对好的序列用Bioedit软件进行手工校对。校正后的序列提交至GenBank数据库中,获取相应的序列登录号(表 3)。分别选取4种才女虫相应的18S、COⅠ、Cyt b基因序列,通过比对、手工校正后,应用MEGA 6.06默认参数设置计算它们的种内、种间遗传距离[20]。
表 3 该研究中4种才女虫的核糖体18S、线粒体COⅠ、Cyt b基因序列登录号Table 3 Genbank accession No. of nuclear 18S gene, mitochondrial COⅠ and Cyt b genes of four polydorins in this study种类
species登录号Genbank accession No. 18S COⅠ Cyt b 陵水才女虫P.lingshuiensis KF562236-40 KU525630-7 KU525622-9 威氏才女虫P.websteri KP231302 KP231331;KR337461-71 KP231318 短触手才女虫P.brevipalpa KP231289-96 KP231319-25;KR052121-4;KR052126-7;KR052130-5 KP231306-13 才女虫未定种Polydora sp. KP231297-1301 KP231327-32 KP231314-7 2. 结果
2.1 形态特征
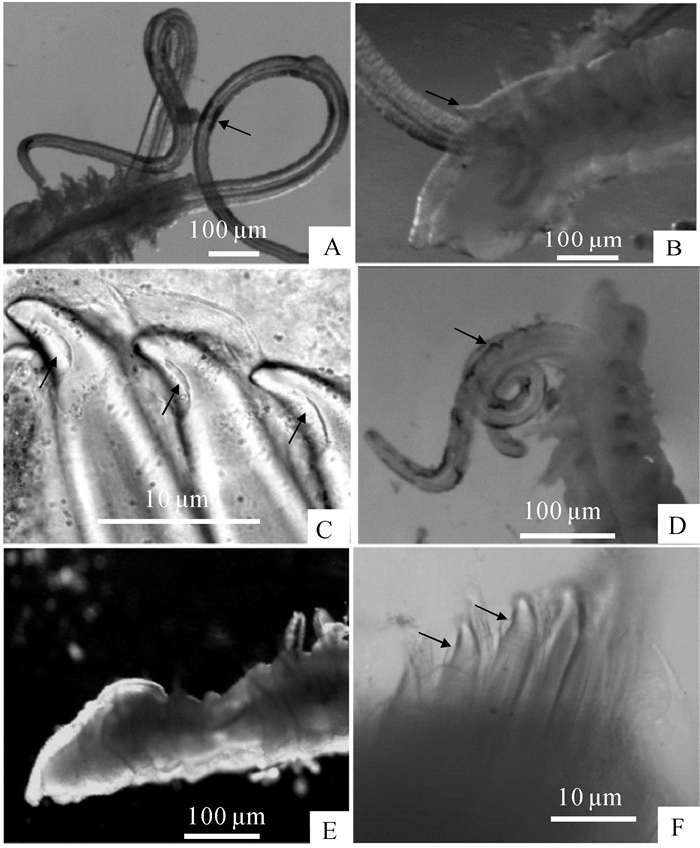
2.1.1 陵水才女虫(YE等[10];图 2-A~C;图 3-A~B)
最大完整虫体长48 mm,宽约1 mm,触手长约3 mm,共160体节。触手上的色素带有或无,若有时位于触手边缘,长条形,呈灰色(图 2-A);活体样本呈棕红色;口前叶前端中央钝圆或微裂,向后延伸为脑后脊,延至第3体节末端;眼点2对,呈梯形排列,前对之间间距较大;脑后脊前部具中触角,呈指状,位于两触手基部中间(图 2-B,图 3-A)。
![]() 图 2 陵水才女虫与威氏才女虫的活体形态比较A~C.陵水才女虫;A.顶面观,触手边缘具长条形色素带(箭头处);B.左侧面观,脑后脊上具指状中触角(箭头处);C.侧面观,第五刚节粗足刺刚毛末端具凹陷(箭头处);D~F.威氏才女虫;D.左侧面观,触手边缘具花纹状色素带(箭头处);E.左侧面观,脑后脊上无中触角;F.侧面观,第五刚节粗足刺刚毛末端具侧凸缘(箭头处)。Fig. 2 Morphological comparison of living P.lingshuiensis and P.websteriA~C. P.lingshuiensis; A. apical view, elongate pigmentation (indicated by arrow) scattered along the palps; B. left lateral view, the digitiform nuchal antenna (indicated by arrow) located on the middle of caruncle; C. lateral view, subterminal ends of major spines in chaetiger 5 having one concavity (indicated by arrow); D~F. P.websteri; D. left lateral view, striated pigmentation (indicated by arrows) scattered along the palps; E. left lateral view, no nuchal antenna on the caruncle; F. lateral view, showing lateral flange (indicated by arrows) at the end of major spines in chaetiger 5.
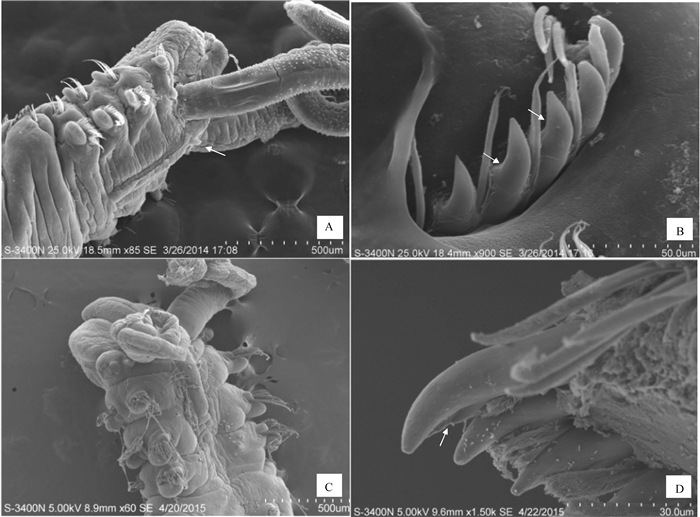
图 2 陵水才女虫与威氏才女虫的活体形态比较A~C.陵水才女虫;A.顶面观,触手边缘具长条形色素带(箭头处);B.左侧面观,脑后脊上具指状中触角(箭头处);C.侧面观,第五刚节粗足刺刚毛末端具凹陷(箭头处);D~F.威氏才女虫;D.左侧面观,触手边缘具花纹状色素带(箭头处);E.左侧面观,脑后脊上无中触角;F.侧面观,第五刚节粗足刺刚毛末端具侧凸缘(箭头处)。Fig. 2 Morphological comparison of living P.lingshuiensis and P.websteriA~C. P.lingshuiensis; A. apical view, elongate pigmentation (indicated by arrow) scattered along the palps; B. left lateral view, the digitiform nuchal antenna (indicated by arrow) located on the middle of caruncle; C. lateral view, subterminal ends of major spines in chaetiger 5 having one concavity (indicated by arrow); D~F. P.websteri; D. left lateral view, striated pigmentation (indicated by arrows) scattered along the palps; E. left lateral view, no nuchal antenna on the caruncle; F. lateral view, showing lateral flange (indicated by arrows) at the end of major spines in chaetiger 5.![]() 图 3 陵水才女虫与威氏才女虫的扫描电镜图A~B.陵水才女虫;A.头部左侧面观,脑后脊上具中触角(箭头处);B.顶面观,第五刚节粗足刺刚毛末端具凹陷(箭头处);C~D.威氏才女虫;C.头部顶面观,脑后脊上无中触角;D.侧面观,第五刚节粗足刺刚毛末端具侧凸缘(箭头处)。Fig. 3 SEM images of P.lingshuiensis andP.websteriA~B. P.lingshuiensis; A. head in left lateral view, nuchal antenna (indicated by arrow) located on the caruncle; B. apical view, one concavity (indicated by arrow) present at subterminal ends of major spines in chaetiger 5;C~D. P.websteri; C. head in apical view, nuchal antenna absent on the caruncle; D. lateral view, lateral flange (indicated by arrows) present at the end of major spines in chaetiger 5.
图 3 陵水才女虫与威氏才女虫的扫描电镜图A~B.陵水才女虫;A.头部左侧面观,脑后脊上具中触角(箭头处);B.顶面观,第五刚节粗足刺刚毛末端具凹陷(箭头处);C~D.威氏才女虫;C.头部顶面观,脑后脊上无中触角;D.侧面观,第五刚节粗足刺刚毛末端具侧凸缘(箭头处)。Fig. 3 SEM images of P.lingshuiensis andP.websteriA~B. P.lingshuiensis; A. head in left lateral view, nuchal antenna (indicated by arrow) located on the caruncle; B. apical view, one concavity (indicated by arrow) present at subterminal ends of major spines in chaetiger 5;C~D. P.websteri; C. head in apical view, nuchal antenna absent on the caruncle; D. lateral view, lateral flange (indicated by arrows) present at the end of major spines in chaetiger 5.第1体节疣足背叶呈指状,无背刚毛;腹叶呈耳状,具一束毛状刚毛。第2~第4及第6体节后疣足背叶刚毛呈3行排列,毛状刚毛,后排刚毛比前排长;体后部的背刚毛明显少于体前部。第2~第4及第6体节后疣足腹叶具毛状刚毛,从第7体节起被巾钩刚毛所替代。巾钩刚毛每排约10根,双齿,柄上半部具收缩部,附齿与主齿形成锐角,无伴随的毛状刚毛。
第5体节膨大变形,明显大于相邻体节,粗足刺刚毛呈微斜排列,5~8根,刚毛间具叶状伴随刚毛(图 3-B),同时有4~6根毛状背、腹刚毛。粗足刺刚毛呈钩状,近末端具明显凹陷(图 2-C,图 3-B),两侧无小齿或侧凸缘。
鳃始于第7体节,至尾部前数体节,呈长条状,与背叶分离;肛部活体时呈白色,呈碟状或喇叭状,背部中央具明显肛口。
2.1.2 威氏才女虫(LOOSANOFF和ENGLE[21];SATO-OKOSHI[22];READ[13];SATO-OKOSHI和ABE[14];图 2-D~F;图 3-C~D)
中等大小虫体体长约15 mm,第5体节宽约1 mm,触手长约3 mm,100体节以上。触手上的色素带有或无,若有时位于触手边缘,呈花纹状(图 2-D);活体样本呈棕色;口前叶前端中央微裂或明显缺刻,向后延伸为脑后脊,延至第3~第4体节之间;眼点有或无,有时为2对,呈梯形排列,前对之间间距较大;无中触角(图 2-E,图 3-C)。
第1体节疣足腹叶具毛状刚毛,背叶刚毛缺失。第2~第4及第6体节后疣足背叶、腹叶均具毛状刚毛。从第7体节起腹叶毛状刚毛被巾钩刚毛所替代,近肛部少数体节无巾钩刚毛。巾钩刚毛每排约10根,双齿,柄上半部具收缩部,附齿与主齿形成锐角,无伴随的毛状刚毛。
第5体节明显变形,大小约为相邻体节的2倍。粗足刺刚毛呈微斜排列,5~8根,刚毛间具翅旗状伴随刚毛(图 2-F,图 3-D),同时有4~6根毛状背、腹刚毛。粗足刺刚毛呈钩状,近末端具侧凸缘或鞘(图 2-F,图 3-D)。
鳃始于第7体节,至尾部前数体节;肛部呈碟状或杯状,背部中央具狭窄肛口。
2.2 形态学比较
陵水才女虫的脑后脊上具中触角,第5刚节粗足刺刚毛近末端具凹陷;而威氏才女虫的脑后脊上无中触角,第5刚节粗足刺刚毛近末端具明显侧凸缘(图 2,图 3,表 4)。活体标本中,若这两种才女虫的触手均有色素时,陵水才女虫的色素带呈长形,颜色偏淡,而威氏才女虫触手上的色素呈花纹状,非连续状分布于边缘(图 2-A,2-D)。
表 4 陵水才女虫与威氏才女虫的形态特征比较Table 4 Comparison of morphological characteristics of P.lingshuiensis with P.websteri形态特征
morphological characteristics陵水才女虫
P.lingshuiensis威氏才女虫
P.websteri触手色素带(palp pigmentation) 有或无,有时位于边缘,呈灰色,长形 有或无,有时位于边缘,呈花纹状 口前叶(prostomium) 前缘钝圆或微裂 前缘微裂 中触角(median antenna) 有,呈指状 无 脑后脊(caruncle) 延至第3体节末端 延至第3~第4体节之间 第5刚节粗足刺刚毛(major spines on chaetiger 5) 钩状,近末端具凹陷,无侧凸缘 钩状,近末端具侧凸缘或鞘 第5刚节背刚毛(notochaetae on chaetiger 5) 有,4~6根 有,4~6根 第5刚节腹刚毛(neurochaetae on chaetiger 5) 有,4~6根 有,4~6根 肛部(pygidium) 碟状或喇叭状 碟状或喇叭状 2.3 宿主特异性与地理分布
在该研究调查中,陵水才女虫的宿主包括马氏珠母贝、企鹅珍珠贝、香港牡蛎、太平洋牡蛎、熊本牡蛎、僧帽牡蛎、石头荣螺、华贵栉孔扇贝等7种软体动物;威氏才女虫的宿主包括香港牡蛎和太平洋牡蛎(表 1)。陵水才女虫主要分布于广西东兴、钦州,广东湛江、阳江、深圳,福建莆田等区域;威氏才女虫主要分布于广西东兴,广东阳江、深圳,浙江宁波等地(表 1)。在广西东兴,广东阳江、深圳均发现同时感染陵水才女虫和威氏才女虫的香港牡蛎。在广东阳江的许多香港牡蛎的同一个贝壳上同时发现这两种才女虫的感染。
2.4 分子序列特征
分别对103条陵水才女虫、26条威氏才女虫、30条短触手才女虫和36条才女虫未定种(Polydora sp.)进行了核糖体18S、线粒体COⅠ、Cyt b的PCR扩增与测序(表 5)。经序列校正和比对后,用于遗传距离分析的18S、COⅠ、Cyt b序列集的长度分别为1 694 bp、634 bp、346 bp。根据Kimura 2-parameter模型计算的遗传距离显示,基于18S、COⅠ、Cyt b的陵水才女虫种内遗传距离分别为(0.00±0.00)%、(0.58±0.10)%、(0.10±0.03)%;威氏才女虫的种内遗传距离分别为(0.00±0.00)%、(0.09±0.06)%、(0.27±0.19)%(表 5)。基于18S、COⅠ、Cyt b的陵水才女虫与威氏才女虫之间的遗传距离分别为(1.98±0.33)%、(21.90±2.06)%、(22.16±2.73)%。基于18S、COⅠ、Cyt b的才女虫种内遗传距离变化范围分别为0.00%~0.06%、0.09%~0.58%、0.10%~1.27%;种间遗传距离变化范围分别为1.14%~2.63%、20.01%~23.35%、20.80%~25.77%(表 5)。
表 5 基于核糖体18S、线粒体COⅠ、Cyt b基因的4种才女虫种类的种内与种间遗传距离比较Table 5 Intraspecific variation and interspecific distances concerning nuclear 18S gene, mitochondrial COⅠand Cyt b genes of four polydorins种名
species样品数量
number of specimens种内遗传距离/%
intraspecific variation种间遗传距离/%
interspecific distance18S COⅠ Cyt b 18S COⅠ Cyt b 1 2 3 4 陵水才女虫
P.lingshuiensis5 77 103 0.00±0.00 0.58±0.10 0.10±0.03 - 1.98±0.33 1.86±0.30 1.35±0.27 威氏才女虫
P.websteri3 25 26 0.00±0.00 0.09±0.06 0.27±0.19 21.90±2.06
22.16±2.73- 1.14±0.26 2.63±0.39 短触手才女虫
P.brevipalpa7 21 30 0.01±0.01 0.16±0.06 0.43±0.18 23.35±2.23
23.91±2.8120.01±2.05
20.80±2.61- 2.51±0.36 才女虫未定种
Polydora sp.6 36 30 0.06±0.05 0.45±0.12 1.27±0.38 21.31±2.05
20.95±2.5720.46±1.93
25.77±3.0920.52±2.05
24.88±2.93- 注:遗传距离以平均值±标准差表示;种间遗传距离矩阵中对角线上为基于核糖体18S的遗传距离;对角线下的顶端和底端分别为基于线粒体COⅠ、Cyt b的遗传距离。 Note:Genetic distances are expressed as X ±SD;interspecific distances above diagonal are based on nuclear 18S gene of polydorins;interspecific distances below diagonal are based on mitochondrial COⅠ gene (on top) and mitochondrial Cyt b (on bottom) gene of polydorins,respectively. 3. 讨论
目前,才女虫系统分类的主要依据是各种不同的形态性状特征的差异,如第1体节的背足和背刚毛是否缺失、第5体节的变形程度及其粗足刺刚毛的形态、鳃与巾钩刚毛的起始体节及结构、触手形态、色素类型等[5]。毫无疑问,这种经典的分类方法具有很强的科学性,操作简单且实用合理。但是,当遇到形态非常相似的才女虫种类时,应用这种传统分类方法来鉴别区分显得尤其困难。另外,才女虫的某些性状特征的多变性是经典形态分类方法的一大瓶颈。这些难点很容易让研究者鉴定相似种类时出现错误判断,从而主观地鉴定才女虫种类,造成不少种类的同物异名现象[13]。
触手和虫体体节上的色素类型与分布是才女虫的系统分类中一个重要的性状特征[5, 7, 16]。但是,除少数才女虫种类,如短触手才女虫触手上的黑色斑带[4]、哈氏才女虫(P.haswelli)前4体节的色斑[13, 23]具有稳定的色素特征外,多数才女虫的色素形态可塑性强。如女川才女虫(P.onagawaensis)体节和触手上的色素特征都不稳定,有些虫体色素多而明显,有些虫体色素少甚至无色素[16]。该研究中,陵水才女虫和威氏才女虫的触手上的色素同样不稳定,两者中的一些虫体均有色素,而另一些虫体则无色素(表 4)。两者的触手均具色素时,陵水才女虫触手上的色素带的形状及分布与威氏才女虫的色素差异较大,容易区分。但是,触手均无色素时,色素这个性状特征不能将陵水才女虫和威氏才女虫鉴别区分。另外,研究表明,色素观察依赖于才女虫活体标本,一旦用固定液保存,虫体色素的颜色可能变淡,甚至完全褪去[7, 13, 24]。传统的采样一般将才女虫标本保存于固定液后,在实验室显微镜下观察与鉴定。因此,在鉴定才女虫种类时,为避免鉴定错误,色素变化这个性状特征的应用需非常谨慎。
第5体节上的粗足刺刚毛的形态特征差异是鉴定区分陵水才女虫与威氏才女虫的一个重要性状特征。陵水才女虫的粗足刺刚毛近末端具有明显凹陷,而威氏才女虫的粗足刺上具有明显的侧凸缘。但是,在才女虫形态分类中,不同类型的粗足刺刚毛末端结构之间形态差异并不明显。根据末端凹凸情况及程度不同,粗足刺刚毛分为简单型(simple)、凹陷型(concave)、侧凸缘型(flange)、侧齿型(tooth)等4种[25]。这些类型的界限比较模糊,尤其是侧凸缘型与侧齿型非常相似,其区别只在于齿的尺寸要比凸缘更大。但是,齿或凸缘的大小与才女虫的年龄、生活习性、粗足刺刚毛破损程度密切相关,仅根据少数虫体的粗足刺刚毛鉴定才女虫种类也不太合理。另外,观察角度和技术的差异也是判断粗足刺刚毛类型的一个重要影响因素[13]。如BLAKE和KUDENOV[24]观察到哈氏才女虫的粗足刺刚毛具有1个侧齿和1个凸缘,BLAKE和MACIOLEK[26]发现美角才女虫有1个小侧齿。而KUDENOV[27]观察发现哈氏才女虫的粗足刺具有2个凸缘,而美角才女虫具有1个凸缘和1个侧齿。在观察样本中,笔者发现陵水才女虫和威氏才女虫的粗足刺类型也有类似的变化。但是,陵水才女虫粗足刺凹陷型的结构特征比较稳定,容易将其与威氏才女虫鉴定区分开。
与形态分类性状的多变性以及性状特征的难辨性相比,分子标记具有序列特征稳定、种间界限较为明显的优势,是辅助才女虫形态鉴定的理想工具。核糖体18S、28S,线粒体16S、COⅠ、Cyt b是才女虫系统分类鉴定中常用的分子标记[7-10, 28-29],不同的分子标记对才女虫物种的分辨率差异较大。SATO-OKOSHI和ABE[7]研究表明,应用核糖体18S分子标记很容易将威氏才女虫与哈氏才女虫区分开来。但随着才女虫核糖体18S数据的增多,笔者发现,威氏才女虫(GenBank登录号AB705405)与哈氏才女虫(GenBank登录号AB705402)的遗传距离为0.53%,而艳丽才女虫(P.aura, GenBank登录号:AB705409、KR052141)的种内遗传距离为0.35%,才女虫的种间与种内遗传距离非常接近,不容易区分。RADASHEVSKY和PANKOVA[29]研究同样表明,核糖体相关基因的种间种内分辨率低于线粒体16S。线粒体COⅠ基因与Cyt b基因均属于中度保守基因,且均为蛋白编码基因,不存在插入与缺失,作为DNA条形码广泛应用于各种动物类群种属间的物种鉴定与系统发育研究[30-31]。RICE等[8]基于线粒体COⅠ基因序列研究表明,才女虫种类的种间遗传距离是种内遗传距离的50倍以上,条形码间隙非常明显。DAVID等[28]应用线粒体Cyt b基因研究发现形态差异较大的两种浮游幼体的遗传距离非常小,甚至共享1种单倍型,证实它们是呼普拉才女虫(P.hoplura)的两种不同幼体形态型。该研究通过比较才女虫的核糖体18S、线粒体COⅠ、Cyt b基因序列同样发现,基于线粒体COⅠ、Cyt b基因的种间遗传距离是其种内遗传距离的30倍以上(表 5),明显高于核糖体18S的种间种内遗传距离比。对于形态鉴定难以区分的陵水才女虫和威氏才女虫,通过比较线粒体COⅠ和Cyt b基因序列的遗传距离很容易将它们区分开来。虽然线粒体COⅠ和Cyt b基因标记具有高分辨率的优势,但是,世界上报道的140多种才女虫[5]中,仅有上述不到10种才女虫具有线粒体COⅠ和Cyt b序列。事实上,基于形态学分类的才女虫种类存在许多错误鉴定,同物异名现象较为严重[1, 5, 25]。在今后的才女虫系统分类研究中,尤其对于形态相似种的鉴定时,迫切需要应用线粒体COⅠ和Cyt b基因序列来辅助鉴定,以避免才女虫物种的错误鉴定。
该研究表明,陵水才女虫和威氏才女虫的宿主特异性都较低,几乎能在任何具壳的软体动物上寄生,陵水才女虫甚至能在珍珠贝贝笼表面的污泥上生存[10]。才女虫这种对环境的高度适应性是其分布广泛的重要原因之一。陵水才女虫是一种广布性才女虫种类,在华南沿海、福建等地均有发现;威氏才女虫是一种世界性广布种类,在太平洋、大西洋、印度洋等沿岸海域均有发现[5, 11-14]。但是在中国,陵水才女虫的分布区域比威氏才女虫更广。才女虫依靠贝壳寄生生活,其活动能力和生活区域十分有限。陵水才女虫和威氏才女虫的分布广泛性可能与其宿主的养殖方式以及商业运输密切相关。通过人为运输将香港牡蛎等贝类宿主在采苗海区、育肥海区、成品销售海区等海域的不断转换中,间接促使陵水才女虫和威氏才女虫在各个海区互相传播。因此,在养殖贝类成品转移与运输过程中,应谨慎检查贝类是否带有有害才女虫种类,避免才女虫通过宿主的转移入侵未发病海域贝类而造成巨大经济损失。
-
图 2 陵水才女虫与威氏才女虫的活体形态比较
A~C.陵水才女虫;A.顶面观,触手边缘具长条形色素带(箭头处);B.左侧面观,脑后脊上具指状中触角(箭头处);C.侧面观,第五刚节粗足刺刚毛末端具凹陷(箭头处);D~F.威氏才女虫;D.左侧面观,触手边缘具花纹状色素带(箭头处);E.左侧面观,脑后脊上无中触角;F.侧面观,第五刚节粗足刺刚毛末端具侧凸缘(箭头处)。
Figure 2. Morphological comparison of living P.lingshuiensis and P.websteri
A~C. P.lingshuiensis; A. apical view, elongate pigmentation (indicated by arrow) scattered along the palps; B. left lateral view, the digitiform nuchal antenna (indicated by arrow) located on the middle of caruncle; C. lateral view, subterminal ends of major spines in chaetiger 5 having one concavity (indicated by arrow); D~F. P.websteri; D. left lateral view, striated pigmentation (indicated by arrows) scattered along the palps; E. left lateral view, no nuchal antenna on the caruncle; F. lateral view, showing lateral flange (indicated by arrows) at the end of major spines in chaetiger 5.
图 3 陵水才女虫与威氏才女虫的扫描电镜图
A~B.陵水才女虫;A.头部左侧面观,脑后脊上具中触角(箭头处);B.顶面观,第五刚节粗足刺刚毛末端具凹陷(箭头处);C~D.威氏才女虫;C.头部顶面观,脑后脊上无中触角;D.侧面观,第五刚节粗足刺刚毛末端具侧凸缘(箭头处)。
Figure 3. SEM images of P.lingshuiensis andP.websteri
A~B. P.lingshuiensis; A. head in left lateral view, nuchal antenna (indicated by arrow) located on the caruncle; B. apical view, one concavity (indicated by arrow) present at subterminal ends of major spines in chaetiger 5;C~D. P.websteri; C. head in apical view, nuchal antenna absent on the caruncle; D. lateral view, lateral flange (indicated by arrows) present at the end of major spines in chaetiger 5.
表 1 贝类寄生陵水才女虫与威氏才女虫的样品采集信息
Table 1 Sampling information of shell-infested P.lingshuiensis and P.websteri
种类
species采集地点
location采集日期
sampling date宿主
host感染类型
infection type陵水才女虫P.lingshuiensis 海南陵水新村镇 2012-10, 2013-06, 2015-05 马氏珍珠贝、企鹅珍珠贝 管栖、贝壳间隙、泥疱型 广西东兴江平镇 2015-10 香港牡蛎 泥疱型 广西钦州犀牛脚镇 2015-11 香港牡蛎 泥疱型 广东湛江西连镇 2013-06 马氏珍珠贝 泥疱型 广东湛江官渡镇 2015-08 香港牡蛎 泥疱型 广东湛江塘尾镇 2015-11 香港牡蛎 泥疱型 广东湛江东山镇 2015-08 香港牡蛎、熊本牡蛎、僧帽牡蛎 贝壳间隙、泥疱型 广东阳江程村镇 2015-02 香港牡蛎 泥疱型 广东深圳南澳镇 2014-08 香港牡蛎、石头荣螺、华贵栉孔扇贝 贝壳间隙、泥疱型 福建莆田平海镇 2014-07 太平洋牡蛎 贝壳间隙、泥疱型 威氏才女虫P.websteri 广西东兴江平镇 2015-10 香港牡蛎 泥疱型 广东阳江程村镇 2015-02 香港牡蛎 泥疱型 广东深圳南澳镇 2014-08 香港牡蛎 贝壳间隙、泥疱型 浙江宁波墙头镇 2014-07 太平洋牡蛎 泥疱型 表 2 该研究中使用的扩增与测序引物
Table 2 PCR primers used in amplification and sequencing in this study
引物名称
primer引物序列(5′→3′)
primer sequence引物出处
Reference18S 18SA AYCTGGTTGATCCTGCCAGT MEDLIN等[15] 18SR TCACCTACGGAAACCTTGTTACG TERAMOTO等[16] COⅠ X1-FF2 CCTWGTDATACCTRTCWTAATT 该研究 X1-R6 CCTGTAAATARAGGGAATCA 该研究 X1-F2 CCWGATATRGCATTCCC 该研究 X1-R2 GCKARYCADCTAAATACTTTAA 该研究 Cyt b Cob-F1 GCRACAGTAATTACTAAYATA 该研究 Cob-Rev CAGGKYGMCCHCCAATTCAKG 该研究 CobF424 GGWTAYGTWYTWCCWTGRGGWCARAT BOORE和BROWN[17] CobR876 GCRTAWGCRAAWARRAARTAYCAYTCWGG OYARZUN等[18] 注:反向引物序列以斜体字母表示。 Note:The sequences in italics indicate reverse primers. 表 3 该研究中4种才女虫的核糖体18S、线粒体COⅠ、Cyt b基因序列登录号
Table 3 Genbank accession No. of nuclear 18S gene, mitochondrial COⅠ and Cyt b genes of four polydorins in this study
种类
species登录号Genbank accession No. 18S COⅠ Cyt b 陵水才女虫P.lingshuiensis KF562236-40 KU525630-7 KU525622-9 威氏才女虫P.websteri KP231302 KP231331;KR337461-71 KP231318 短触手才女虫P.brevipalpa KP231289-96 KP231319-25;KR052121-4;KR052126-7;KR052130-5 KP231306-13 才女虫未定种Polydora sp. KP231297-1301 KP231327-32 KP231314-7 表 4 陵水才女虫与威氏才女虫的形态特征比较
Table 4 Comparison of morphological characteristics of P.lingshuiensis with P.websteri
形态特征
morphological characteristics陵水才女虫
P.lingshuiensis威氏才女虫
P.websteri触手色素带(palp pigmentation) 有或无,有时位于边缘,呈灰色,长形 有或无,有时位于边缘,呈花纹状 口前叶(prostomium) 前缘钝圆或微裂 前缘微裂 中触角(median antenna) 有,呈指状 无 脑后脊(caruncle) 延至第3体节末端 延至第3~第4体节之间 第5刚节粗足刺刚毛(major spines on chaetiger 5) 钩状,近末端具凹陷,无侧凸缘 钩状,近末端具侧凸缘或鞘 第5刚节背刚毛(notochaetae on chaetiger 5) 有,4~6根 有,4~6根 第5刚节腹刚毛(neurochaetae on chaetiger 5) 有,4~6根 有,4~6根 肛部(pygidium) 碟状或喇叭状 碟状或喇叭状 表 5 基于核糖体18S、线粒体COⅠ、Cyt b基因的4种才女虫种类的种内与种间遗传距离比较
Table 5 Intraspecific variation and interspecific distances concerning nuclear 18S gene, mitochondrial COⅠand Cyt b genes of four polydorins
种名
species样品数量
number of specimens种内遗传距离/%
intraspecific variation种间遗传距离/%
interspecific distance18S COⅠ Cyt b 18S COⅠ Cyt b 1 2 3 4 陵水才女虫
P.lingshuiensis5 77 103 0.00±0.00 0.58±0.10 0.10±0.03 - 1.98±0.33 1.86±0.30 1.35±0.27 威氏才女虫
P.websteri3 25 26 0.00±0.00 0.09±0.06 0.27±0.19 21.90±2.06
22.16±2.73- 1.14±0.26 2.63±0.39 短触手才女虫
P.brevipalpa7 21 30 0.01±0.01 0.16±0.06 0.43±0.18 23.35±2.23
23.91±2.8120.01±2.05
20.80±2.61- 2.51±0.36 才女虫未定种
Polydora sp.6 36 30 0.06±0.05 0.45±0.12 1.27±0.38 21.31±2.05
20.95±2.5720.46±1.93
25.77±3.0920.52±2.05
24.88±2.93- 注:遗传距离以平均值±标准差表示;种间遗传距离矩阵中对角线上为基于核糖体18S的遗传距离;对角线下的顶端和底端分别为基于线粒体COⅠ、Cyt b的遗传距离。 Note:Genetic distances are expressed as X ±SD;interspecific distances above diagonal are based on nuclear 18S gene of polydorins;interspecific distances below diagonal are based on mitochondrial COⅠ gene (on top) and mitochondrial Cyt b (on bottom) gene of polydorins,respectively. -
[1] 叶灵通, 唐彬, 姜敬哲, 等.才女虫属复合体的研究进展[J].南方水产科学, 2014, 10(6):93-100. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CJFQ&dbname=CJFDLAST2015&filename=NFSC201406015&v=MjQ5OTdXTTFGckNVUkwyZVplZHRGeTNsVjcvQUt5dlliYkc0SDlYTXFZOUVZWVI4ZVgxTHV4WVM3RGgxVDNxVHI= [2] HANDLEY S J, BERGQUIST P R.Spionid polychaete infestations of intertidal Pacific oysters Crassostrea gigas (Thunberg), Mahurangi harbour, northern New Zealand[J].Aquaculture, 1997, 153(3/4):191-205. https://www.sciencedirect.com/science/article/pii/S004484869700032X
[3] SATO-OKOSHI W, OKOSHI K, SHAW J.Polydorid species (Polychaeta :Spionidae) in south-western Australian waters with special reference to Polydora uncinata and Boccardia knoxi[J].J Mar Biol Assoc UK, 2008, 88(3):491-501.
[4] 唐彬, 叶灵通, 曹超, 等.虾夷扇贝寄生短触手才女虫的形态与组织切片观察[J].南方水产科学, 2015, 11(4):95-101. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CJFQ&dbname=CJFDLAST2015&filename=NFSC201504015&v=MjMzNjFYMUx1eFlTN0RoMVQzcVRyV00xRnJDVVJMMmVaZWR0RnkzbFc3L09LeXZZYmJHNEg5VE1xNDlFWVlSOGU= [5] WALKER L M. A review of the current status of the Polydora-complex (Polychaeta:Spionidae) in Australia and a checklist of recorded species[J].Zootaxa, 2011(2751):40-62. doi: 10.1080/17451000.2012.706306?scroll=...
[6] RADASHEVSKY V I, PANKOVA V V.The morphology of two sibling sympatric Polydora species (Polychaeta :Spionidae) from the Sea of Japan[J].J Mar Biol Assoc UK, 2006, 86(2):245-252. doi: 10.1017/S0025315406013099
[7] SATO-OKOSHI W, ABE H. Morphological and molecular sequence analysis of the harmful shell boring species of Polydora (Polychaeta:Spionidae) from Japan and Australia[J].Aquaculture, 2012, 368:40-47. https://www.sciencedirect.com/science/article/pii/S0044848612005273
[8] RICE S A, KARL S, RICE K A.The Polydora cornuta complex (Annelida:Polychaeta) contains populations that are reproductively isolated and genetically distinct[J].Invertebr Biol, 2008, 127(1):45-64. doi: 10.1111/j.1744-7410.2007.00104.x
[9] SIMON C A, THORNHILL D J, OYARZUN F A.Genetic similarity between Boccardia proboscidea from Western North America and cultured abalone, Haliotis midae, in South Africa[J].Aquaculture, 2009, 294(1/2):18-24.
[10] YE L T, TANG B, WU K C, et al.Mudworm Polydora lingshuiensis sp.n is a new species that inhabits both shell burrows and mudtubes[J].Zootaxa, 2015, 3986(1):88-100. doi: 10.11646/zootaxa.3986.1
[11] BLAKE J A. Reproduction and larval development of Polydora from Northern New England (Polychaeta:spionidae) [J].Ophelia, 1969, 7(1):1-63. doi: 10.1080/00785326.1969.10419288
[12] HANDLEY S J, BERGQUIST P R.Spionid polychaete infestations of intertidal Pacific oysters Crassostrea gigas(Thunberg), Mahurangi Harbour, northern New Zealand[J].Aquaculture, 1997, 153(3/4):191-205. https://www.sciencedirect.com/science/article/pii/S004484869700032X
[13] READ G B.Comparison and history of Polydora websteri and P. haswelli (Polychaeta:Spionidae) as mud-blister worms in New Zealand shellfish[J].New Zeal J Mar Freshw, 2010, 44(2):83-100. doi: 10.1080/00288330.2010.482969
[14] SATO-OKOSHI W, ABE H. Morphology and molecular analysis of the 18S rRNA gene of oyster shell borers, Polydora species (Polychaeta:Spionidae), from Japan and Australia[J].J Mar Biol Assoc UK, 2013, 93(5):1279-1286. doi: 10.1017/S002531541200152X
[15] MEDLIN L, ELWOOD H J, STICKERL S, et al.The characterization of enzymatically amplified eukaryotic 16S-like rRNA-coding regions[J].Gene, 1988, 71:491-499. doi: 10.1016/0378-1119(88)90066-2
[16] TERAMOTO W, SATO-OKOSHI W, ABE H, et al.Morphology, 18S rRNA gene sequence and life history of a new Polydora species(Polychaeta:Spionidae)from northeastern Japan[J].Aquat Biol, 2013, 18:31-45. doi: 10.3354/ab00485
[17] BOORE J L, BROWN W M.Mitochondrial genomes of Galathealinum, Helobdella and Platynereis:sequence and gene arrangement comparisons indicate that Pogonophora is not a phylum and annelida and arthropoda are not sister taxa[J].Mol Biol Evol, 2000, 17(1):87-106. doi: 10.1093/oxfordjournals.molbev.a026241
[18] OYARZUN F X, MAHON A R, SWALLA B J.Phylogeography and reproductive variation of the poecilogonous polychaete Boccardia proboscidea (Annelida:Spionidae) along the West Coast of North America[J].Evol Dev, 2011, 13(6):489-503. doi: 10.1111/ede.2011.13.issue-6
[19] THOMPSON J D, GIBSON T J, PLEWNIAK F, et al.The CLUSTAL_ X Windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Res, 1997, 25(24):4876-4882. doi: 10.1093/nar/25.24.4876
[20] TAMURA K, STECHER G, PETERSON D, et al.MEGA6:Molecular Evolutionary Genetics Analysis version 6.0[J].Mol Biol Evol, 2013, 30(12):2725-2729. doi: 10.1093/molbev/mst197
[21] LOOSANOFF V L, ENGLE J B.Polydora in oysters suspended in the water[J].Biol Bull, 1943, 85:69-78. doi: 10.2307/1538270
[22] SATO-OKOSHI W.Polydorid species(Polychaeta:Spionidae)in Japan, with descriptions of morphology, ecology and burrow structure.1.Boring species[J].J Mar Biol Assoc UK, 1999, 79(5):831-848. doi: 10.1017/S0025315498001003
[23] SATO-OKOSHI W, OKOSHI K, KOH B S, et al.Polydorid species(Polychaeta:Spionidae)associated with commercially important mollusk shells in Korean waters[J].Aquaculture, 2012, 350/351/352/353:82-90. https://www.sciencedirect.com/science/article/pii/S0044848612002177
[24] BLAKE J A, KUDENOV J D.The Spionidae(Polychaeta)from southeastern Australia and adjacent areas with a revision of the genera[J].Mem Natn Mus Vict, 1978, 39:171-280. doi: 10.24199/j.mmv.1978.39.11
[25] BLAKE J A.Family Spionidae Grube, 1850:including a review of the genera and species from California and a revision of the genus Polydora BOSC, 1802[M]//BLAKE J A, HILBIG B, SCOTT P H.Taxonomic atlas of the benthic fauna of the Santa Maria Basin and Western Santa Barbara Channel.Volume 6.The Annelida Part 3.Polychaeta:Orbiniidae to Cossuridae.Santa Barbara:Santa Barbara Museum of Natural History, 1996:81-223.
[26] BLAKE J A, MACIOLEK N J.A redescription of Polydora cornuta Bosc(Polychaeta:Spionidae)and designation of a neotype[J].Bull Biol Soc Washington, 1987, 7:11-15. https://repository.si.edu/bitstream/handle/10088/5511/SCtZ-0221...
[27] KUDENOV J D. Redescription of the major spines of Polydora ligni Webster (Polychaeta:Spionidae)[J].Proc Biol Soc Wash, 1982, 95(3):571 -574. https://repository.si.edu/bitstream/handle/10088/5511/SCtZ-0221...
[28] DAVID A A, MATTHEE C A, SIMON C A.Poecilogony in Polydora hoplura (Polychaeta:Spionidae) from commercially important molluscs in South Africa[J].Mar Biol, 2014, 161(4):887-898. doi: 10.1007/s00227-013-2388-0
[29] RADASHEVSKY V I, PANKOVA V V.Shell-boring versus tube-dwelling:is the mode of life fixed or flexible? Two cases in spionid polychaetes (Annelida, Spionidae)[J].Mar Biol, 2013, 160(7):1619-1624. doi: 10.1007/s00227-013-2214-8
[30] HEBERT P D, CYWINSKA A, BALL S L, et al.Biological identifications through DNA barcodes[J].Proc Biol Sci, 2003, 270(1512):313-321. doi: 10.1098/rspb.2002.2218
[31] BUCKLIN A, STEINKE D, BLANCO-BERCIAL L. DNA barcoding of marine metazoa[J].Ann Rev Mar Sci, 2011, 3:471-508. doi: 10.1146/annurev-marine-120308-080950



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
