The effect of recombinant growth hormone (GH)on insulin-like growth factor-Ⅰ (IGF-Ⅰ) expression in mud carp, Cirrhinus molitorella
-
摘要:
使用半定量RT-PCR方法,研究了鲮(Cirrhinus molitorella)各组织中IGF-ⅠmRNA组织表达,并分析重组鲮GH处理后鲮IGF-Ⅰ表达变化情况。结果表明,鲮IGF-ⅠmRNA在肝组织中表达最高,其次是肾和脑,另外在肠、鳃、脾、性腺和心脏组织中也有表达,而在肌肉、皮肤中没有检测到鲮IGF-ⅠmRNA的表达;按120 μg·g-1鱼体重的剂量经腹腔注射重组鲮GH,观察12 h后鲮IGF-Ⅰ表达变化情况,发现经重组鲮GH处理后,鲮肝组织IGF-ⅠmRNA表达水平显著升高,脑组织IGF-ⅠmRNA表达水平也稍有升高,而在肌肉中仍未检测到IGF-ⅠmRNA的表达;重组鲮GH处理前后,对照组中鲮血清中IGF-Ⅰ的含量为145.59±21.84 ng·mL-1,试验组中鲮血清中IGF-Ⅰ的含量为247.71±2.83 ng·mL-1,经t检验,P=0.043 < 0.05,表明重组鲮GH处理前后鲮血清中IGF-Ⅰ的含量存在显著性差异。
-
关键词:
- 鲮 /
- 胰岛素样生长因子-Ⅰ /
- 生长激素
Abstract:Expression patterns of IGF-ⅠmRNA in different tissues of mud carp (Cirrhinus molitorella)were studied using semi-quantitative RT-PCR method and the effects of recombinant mud carp growth hormone(rmcGH)on expression of IGF-Ⅰin mud carp were investigated. The IGF-ⅠmRNA was detected successfully in liver, kidney, brain, intestine, gill, spleen, gonad, and heart, and no IGF-ⅠmRNA was detected in skin and muscle. The IGF-Ⅰ mRNA detected was higher in liver than in other tissues. Mud carp were received either intra-peritoneal injections of rmcGH (120 μg·g-1 body weight) or vehicle, tissue samples and blood were collected 12 hour later. Total RNA was isolated and assayed for IGF-ⅠmRNA using semi-quantitative RT-PCR. Blood was extracted to determine the levels of IGF-Ⅰ in serum. IGF-Ⅰlevels increased from 145.59±21.84 to 247.71±2.83 ng·mL-1 (P=0.043) in the serum after rmcGH injection.
-
Keywords:
- mud carp /
- Cirrhinus molitorella /
- insulin-like growth factor-Ⅰ /
- growth hormone
-
巴基斯坦海域位于阿拉伯海北部,与伊朗和印度所属海域相邻,拥有1 100 km的海岸线以及24×104 km2的专属经济区[1]。海洋渔业在国民经济中起着重要作用,体现在提供动物蛋白、解决就业和出口创汇等方面。海洋渔业产量自20世纪60年代到20世纪末为高速增长阶段,产量从1961年的5.38×104 t增加到1999年的47.47×104 t,1993年产量最高,为49.91×104 t,近10余年产量维持在34.80×104 t左右 (图1)。2016年,巴基斯坦海洋渔业产量为37.63×104 t,占捕捞水产品的73.3%和全部水产品的56.2%,渔业产品出口额为3.52亿美元,占商品出口贸易总额的1.7%[2]。巴基斯坦的海洋渔业资源捕捞技术比较落后,其海洋渔业主管部门积极推动了多种渔业发展模式,包括开放专属经济区与他国渔船合作开发海洋渔业资源[3-4],为我国远洋渔业发展和“一带一路”倡议的实施带来机遇[5]。
目前,巴基斯坦海洋渔业资源中仅有少数种类存在资源评估[1-2, 6-8],大部分经济种类缺乏最大可持续产量 (maximum sustainable yield, MSY) 和可捕量等的评估,难以进行有效管理。另外,巴基斯坦缺乏渔业调查数据,已有MSY评估研究多基于剩余产量模型[6, 9-10],单位捕捞努力量渔获量 (catch per unit effort, CPUE) 数据未经过标准化处理,评估结果存在一定的不确定性[11]。对于渔业数据缺乏,国际上通常采用基于产量统计数据的评估模型,如depletion-corrected average catch (DCAC)[12]、depletion-based stock reduction analysis (DB-SRA)[13]等,但是以上方法多针对长寿命鱼类[14],对于巴基斯坦近海多数经济鱼类不适用。本研究采用一种基于统计产量数据和种群参数先验信息的Catch-MSY模型[15]对巴基斯坦海洋渔业总可捕量及24个重要经济类群的可捕量和MSY进行评估,以期为巴基斯坦海洋渔业管理和我国在阿拉伯海的远洋渔业提供科学依据。
1. 材料与方法
1.1 数据来源
用于模型分析的1950—2015年巴基斯坦海洋渔业产量数据由卡拉奇大学 (University of Karachi) 巴方专家Sher Khan Panhwar等提供,经过联合国粮农组织(FAO)统计数据库(http://www.fao.org/statistics/databases/en/) 校准。评估的24个重要经济类群分别为鳀类(Anchovies,英文名称均按照FAO数据库中类群名称,下同)、魣类 (Barracudas)、乌鲳 (Formio niger)、鲳类 (Butterfishes)、鲹类 (Carangids)、军曹鱼 (Rachycentron canadum)、鲯鳅 (Coryphaena hippurus)、石首鱼类 (Croakers)、宝刀鱼 (Chirocentrus dorab)、石斑鱼类 (Groupers)、石鲈类 (Grunts)、长头小沙丁鱼 (Sardinella longiceps)、马鲹 (Caranx hippos)、白带鱼 (Trichiurus lepturus)、银纹笛鲷 (Lutjanus argentimaculatus)、鲻类 (Mullets)、康氏马鲛 (Scomberomorus commerson)、海鳗 (Muraenesox cinereus)、鲷类 (Porgies)、鳐类 (Rays)、海鲇 (Arius thalassinus)、金线鱼类 (Threadfin breams)、舌鳎类 (Tonguefishes)和大甲鲹 (Megalaspis cordyla)。
1.2 评估模型
评估模型采用一种简化的产量模型Catch-MSY模型,评估过程不需要CPUE数据,而以资源量水平和内禀增长率 (r) 的先验分布代替[15],产量数据和模型参数均可按照类群得到,符合巴基斯坦渔业资源特征以及数据现状。Catch-MSY模型为:
$${B_t} = {\lambda _0}k\exp ({\nu _t})$$ (1) $${B_{t + 1}} = [{B_t} + r{B_t}(1 - {B_t}/k) - {C_t}]\exp ({\nu _t})$$ (2) 其中Bt为t年的资源量,k为环境容量,Ct为t年的渔获量;假定过程误差符合对数正态分布,因此νt为均值为0,方差为σ2的标准正态分布;λ0为起始资源量水平B1/k。
采用如下伯努利分布作为似然函数:
$$\begin{gathered} L(\Theta |{C_t}) = 1{\rm{ }}\qquad{\lambda _{01}} \leqslant {B_{n + 1}}/k \leqslant {\lambda _{02}} \\ \qquad\quad \; {\rm{ = 0 }}\qquad{\lambda _{01}} > {B_{n + 1}}/k > {\lambda _{02}} \\ \end{gathered} $$ (3) 其中Θ为模型中的参数向量,[λ01, λ02] 为最终年份资源量水平的先验分布区间。这样的似然函数可以保证r-k参数组合可以得到种群状态的有效解[5]。
研究采用重要性重抽样 (SIR)[16]方法计算参数的后验分布,每次计算的迭代次数50 000次。利用得到的r-k联合后验分布计算MSY,MSY=0.25rk,采用MSY的90%作为可捕量的设置标准[15]。
1.3 参数先验分布设置
模型中参数内禀增长率和资源量水平的先验分布均采用均匀分布形式[14-15]。其中内禀增长率的先验分布根据Fishbase数据库的鱼类恢复力分级法[14,17]确定。资源量水平的先验分布则根据评估对象的开发状态以及产量与数据中最大产量的比值确定[14-15]。如1954年巴基斯坦渔业开发皆为小型木船,石首鱼类捕捞努力量和产量都很低,因此初始年份1954年资源量水平设置为0.5~0.9,石首鱼类的产量在2002年达到顶峰后有所下滑,最终年份2015年资源量水平设置为0.3~0.7。
由于巴基斯坦渔业种类繁多,难以确定其海域渔业资源综合内禀增长率的先验分布,本研究参考中国南海区综合种群内禀增长率评估结果[14],设置了4种不同的先验分布(0.6~1.5;0.4~1.5;0.6~1.7;0.4~1.7),以评估不同内禀增长率先验分布区间对MSY评估结果的影响。研究中评估类群的产量数据序列以及参数先验分布设置见表1。建模和数据分析都在R语言3.3.1中完成。
表 1 评估对象产量数据序列及参数先验分布设置Table 1. Catch data series and prior distribution for fish groups in stock assessment类群
fish group数据序列
data series先验分布 prior distribution 内禀增长率
r起始年份资源量水平
first year B1/k最终年份资源量水平
final year Bn/k鳀类 Anchovies 1988—2015 [0.6, 1.5] [0.5, 0.9] [0.01, 0.4] 魣类 Barracudas 1978—2015 [0.05, 0.5] [0.5, 0.9] [0.3, 0.7] 乌鲳 Formio niger 1962—2015 [0.2, 1] [0.5, 0.9] [0.01, 0.4] 鲳类 Butterfishes 1985—2015 [0.2, 1] [0.5, 0.9] [0.3, 0.7] 鲹类 Carangids 1962—2015 [0.2, 1] [0.5, 0.9] [0.01, 0.4] 军曹鱼 Rachycentron canadum 1962—2015 [0.05, 0.5] [0.5, 0.9] [0.3, 0.7] 鲯鳅 Coryphaena hippurus 1983—2015 [0.6, 1.5] [0.5, 0.9] [0.3, 0.7] 石首鱼类 Croakers 1954—2015 [0.2, 1] [0.5, 0.9] [0.3, 0.7] 宝刀鱼 Chirocentrus dorab 1971—2015 [0.2, 1] [0.5, 0.9] [0.01, 0.4] 石斑鱼类 Groupers 1962—2015 [0.05, 0.5] [0.5, 0.9] [0.3, 0.7] 石鲈类 Grunts 1962—2015 [0.2, 1] [0.5, 0.9] [0.01, 0.4] 长头小沙丁鱼 Sardinella longiceps 1950—2015 [0.2, 1] [0.5, 0.9] [0.01, 0.4] 马鲹 Caranx hippos 1981—2015 [0.2, 1] [0.5, 0.9] [0.01, 0.4] 白带鱼 Trichiurus lepturus 1980—2015 [0.05, 0.5] [0.5, 0.9] [0.01, 0.4] 银纹笛鲷 Lutjanus argentimaculatus 1962—2015 [0.05, 0.5] [0.5, 0.9] [0.01, 0.4] 鲻类 Mullets 1970—2015 [0.2, 1] [0.5, 0.9] [0.01, 0.4] 康氏马鲛 Scomberomorus commerson 1950—2015 [0.2, 1] [0.5, 0.9] [0.3, 0.7] 海鳗 Muraenesox cinereus 1978—2015 [0.05, 0.5] [0.5, 0.9] [0.01, 0.4] 鲷类 Porgies 1970—2015 [0.2, 1] [0.5, 0.9] [0.01, 0.4] 鳐类 Rays 1962—2015 [0.05, 0.5] [0.5, 0.9] [0.01, 0.4] 海鲇 Arius thalassinus 1950—2015 [0.05, 0.5] [0.5, 0.9] [0.01, 0.4] 金线鱼类 Threadfin breams 1985—2015 [0.2, 1] [0.5, 0.9] [0.01, 0.4] 舌鳎类 Tonguefishes 1950—2015 [0.2, 1] [0.5, 0.9] [0.01, 0.4] 大甲鲹 Megalaspis cordyla 1987—2015 [0.2, 1] [0.5, 0.9] [0.3, 0.7] 注:[ ]. 均匀分布区间 Note: Square brackets represent uniform distributions. 2. 结果
2.1 巴基斯坦海域渔业资源总可捕量
当内禀增长率先验分布服从均匀分布[0.6, 1.5]情况下的模型评估结果见图2。结果显示,巴基斯坦海洋渔业在1992—2002年间产量超过MSY,处于过度捕捞状态,近年来产量有所下降,但是仍在MSY附近 (图2-a)。内禀增长率 (r) 环境容量 (k) 具有明显的负相关关系 (图2-b),ln(r) 和ln(k) 则具有明显的线性关系 (图2-c)。MSY的后验概率密度分布要比参数r和k的相对范围窄,即变异系数CV要低 ( 图2-d~f)。
![]() 图 2 内禀增长率参数先验分布为 [0.6, 1.5] 情况下巴基斯坦海洋渔业资源最大可持续产量评估结果a. 1950—2015年统计产量与MSY评估结果(实线为几何平均数,虚线为正负2倍标准差,下同;b. 参数r–k的先验均匀分布,黑色点为后验组合;c. 为ln(r) 和 ln(k)的线性关系以及MSY的几何平均数 (实线);d~f. 为参数r、k以及MSY的后验概率密度Figure 2. Model outputs for fisheries in Pakistani waters with r of [0.6, 1.5]a. catch history from 1950 to 2015 with MSY estimation (solid line) ± 2SD (dash line); b. prior uniform distribution of r–k, and the black dots are posterior combinations; c. the relationship between ln(r) and ln(k) with geometric mean MSY (solid line) ± 2SD (dash line); d~f. posterior densities of r, k and MSY
图 2 内禀增长率参数先验分布为 [0.6, 1.5] 情况下巴基斯坦海洋渔业资源最大可持续产量评估结果a. 1950—2015年统计产量与MSY评估结果(实线为几何平均数,虚线为正负2倍标准差,下同;b. 参数r–k的先验均匀分布,黑色点为后验组合;c. 为ln(r) 和 ln(k)的线性关系以及MSY的几何平均数 (实线);d~f. 为参数r、k以及MSY的后验概率密度Figure 2. Model outputs for fisheries in Pakistani waters with r of [0.6, 1.5]a. catch history from 1950 to 2015 with MSY estimation (solid line) ± 2SD (dash line); b. prior uniform distribution of r–k, and the black dots are posterior combinations; c. the relationship between ln(r) and ln(k) with geometric mean MSY (solid line) ± 2SD (dash line); d~f. posterior densities of r, k and MSY4种不同内禀增长率先验分布评估的巴基斯坦海洋渔业MSY分别为40.88×104 t、40.30×104 t、40.13×104 t和40.80×104 t (表2),相差不大,取平均值40.53×104 t;海洋渔业总可捕量为36.47×104 t。2015年巴基斯坦海洋渔业产量为36.10×104 t,目前未处于过度捕捞状态。
表 2 4种不同内禀增长率先验分布评估的巴基斯坦海洋渔业最大可持续产量和可捕量评估结果Table 2. Estimated MSY and allowable catch under four prior levels of intrinsic rate of increase for marine fisheries in Pakistani waters内禀增长率先验分布
prior of intrinsic rate of increase评估结果 assessment result 内禀增长率
r最大可持续产量/104 t
MSY可捕量/104 t
allowable catch[0.6, 1.5] 0.976 (CV=0.31) 40.88 (CV=0.023) 36.79 [0.4, 1.5] 0.637 (CV=0.37) 40.30 (CV=0.027) 36.27 [0.4, 1.7] 0.654 (CV=0.39) 40.13 (CV=0.026) 36.11 [0.6, 1.7] 0.905 (CV=0.28) 40.80 (CV=0.022) 36.72 注:CV. 变异系数 Note: CV. coefficient of variation 2.2 重要经济种类群可捕量
巴基斯坦24个重要经济类群的评估结果显示,所有类群的内禀增长率介于0.11~0.85,营养级较高的鱼类如鳐类、银纹笛鲷、海鳗和石斑鱼类内禀增长率较低,在0.2以内 (表3)。有8个类群 (军曹鱼、魣类、石斑鱼类、鲳类、鲯鳅、宝刀鱼、马鲹和白带鱼) 2015年产量超过MSY,处于过度捕捞状态,其中军曹鱼、魣类、石斑鱼类和鲯鳅产量超过MSY 20%以上,过度捕捞状态严重 (图3)。其他16个类群2015年产量小于MSY,未处于过度捕捞状态,其中金线鱼类、鳀类、鳐类和鲹类2015年产量低于MSY的40%以上。24个类群中可捕量超过104 t的类群有鳀类、石首鱼类、石斑鱼类、长头小沙丁鱼、白带鱼、鳐类和海鲇 (表3)。
表 3 巴基斯坦24个重要经济类群评估结果Table 3. Assessment results of 24 important commercial fish groups in Pakistani waters类群
fish group内禀增长率
r最大可持续产量/104 t
MSY可捕量/104t
allowable catch2015年产量/104t
catch in 2015鳀类 Anchovies 0.73 14.37 (0.09) 12.93 6.45 魣类 Barracudas 0.26 4.46 (0.12) 4.01 6.69 乌鲳 Formio niger 0.26 2.91 (0.13) 2.62 2.29 鲳类 Butterfishes 0.54 4.37 (0.08) 3.93 4.93 鲹类 Carangids 0.28 10.09 (0.06) 9.08 2.61 军曹鱼 Rachycentron canadum 0.22 2.31 (0.03) 2.08 3.89 鲯鳅 Coryphaena hippurus 0.85 3.58 (0.07) 3.22 4.61 石首鱼类 Croakers 0.41 18.77 (0.11) 16.89 16.16 宝刀鱼 Chirocentrus dorab 0.26 2.68 (0.13) 2.41 2.78 石斑鱼类 Groupers 0.20 11.46 (0.17) 10.31 15.98 石鲈类 Grunts 0.30 4.84 (0.09) 4.36 4.01 长头小沙丁鱼 Sardinella longiceps 0.38 35.98 (0.13) 32.38 27.78 马鲹 Caranx hippos 0.32 6.70 (0.05) 6.03 7.32 白带鱼 Trichiurus lepturus 0.26 12.46 (0.06) 11.21 12.66 银纹笛鲷 Lutjanus argentimaculatus 0.13 1.56 (0.03) 1.40 1.26 鲻类 Mullets 0.29 9.82 (0.09) 8.84 9.53 康氏马鲛 Scomberomorus commerson 0.52 9.89 (0.18) 8.90 9.79 海鳗 Muraenesox cinereus 0.14 3.16 (0.21) 2.84 2.76 鲷类 Porgies 0.29 2.90 (0.14) 2.61 1.96 鳐类 Rays 0.11 13.92 (0.03) 12.53 4.72 海鲇 Arius thalassinus 0.33 21.57 (0.22) 19.41 19.29 金线鱼类 Threadfin breams 0.35 5.06 (0.08) 4.55 2.89 舌鳎类 Tonguefishes 0.30 1.42 (0.09) 1.28 1.12 大甲鲹 Megalaspis cordyla 0.47 3.75 (0.10) 3.38 3.63 注:括号内为变异系数CV值 Note: Value in brackets are coefficient of variations. 3. 讨论
渔业的量化管理是保证渔业可持续发展的重要举措[18-20],然而全球仅有不足1%的渔业种类进行过资源评估[21],大多数渔业资源由于缺乏调查数据,难以用传统的方法评估MSY和可捕量[22]。基于产量的评估模型可以利用统计产量数据和渔业种群的生活史特征参数等对MSY进行评估,不再需要调查数据,其中比较常用的几种如DCAC、DBSRA和only reliable catch stocks (ORCS) 等[23],但是这些方法对评估对象的种群生活史参数等有所限制[14]。巴基斯坦产量多以类群进行统计,并且许多种类的自然死亡系数大于0.2[1,6,9],无法利用以上方法进行评估。本研究采用的Catch-MSY模型对渔业种群生物学特征没有选择性,模型所需的统计产量数据允许按类群给出,更适合用于当前巴基斯坦海域的资源评估。
内禀增长率先验分布的设置是模型评估过程中不确定性的重要来源,本研究采用Fishbase数据库对每个类群的内禀增长率进行分级,主要依靠von Bertallanffy生长方程[24]中的生长参数、性成熟年龄、最大年龄以及繁殖力等参数确定[17]。但是巴基斯坦海洋渔业资源综合种群内禀增长率缺乏相关研究,因此本研究以与巴基斯坦海域相近纬度的南海近海评估结果为依据[14],设置了4种不同的内禀增长率先验分布评估其不确定性。结果显示,4种不同的内禀增长率先验分布评估的MSY分别为40.88×104 t、40.30×104 t、40.13×104 t和40.80×104 t,变动幅度在2%以内,说明内禀增长率的先验分布对MSY的评估结果影响不大,这一结果与南海的评估结果一致[14]。因此,利用Catch-MSY模型进行评估时,评估结果更受制于统计产量数据的精确度,本研究采用的统计产量数据来自巴基斯坦官方统计并在FAO数据库中逐条验证。
模型评估的巴基斯坦海洋渔业MSY为40.53×104 t,总可捕量为36.47×104 t,而2015年巴基斯坦海洋渔业产量为36.10×104 t,虽然当前的捕捞产量未超过MSY,但是已经达到总可捕量,需要进行适当的管理,控制捕捞产量。24个重要经济类群的评估结果显示,8个类群处于过度捕捞状态,但是16个未处于过度捕捞状态的类群中,康氏马鲛、鲻类和大甲鲹2015年的产量超过了可捕量,需要进行管理控制产量。另外,金线鱼类、鳀类、鳐类和鲹类等4个类群虽然2015年产量低于MSY的40%以上,但是从产量时间序列来看(图4),这4个类群捕捞产量均在过去一段时期内超过MSY,过度捕捞后资源崩溃导致目前的产量处于低位。因此,这4个类群虽然产量低于MSY,但是资源仍未恢复,需要实行禁捕等措施,待资源恢复。该模型对与巴基斯坦海域相近纬度的南海近海海域渔业资源进行了评估,得到了总可捕量和11个重要类群可捕量的评估结果[14]。结果显示,南海近海石斑鱼类等低内禀增长率、高营养级鱼类的过度捕捞比较严重,而巴基斯坦中较低内禀增长率的石斑鱼类、军曹鱼和魣类等也有类似结果。低内禀增长率的渔业种群对应着其低繁殖力和低恢复力,一旦种群崩溃便很难恢复[25]。
评估结果显示,当前巴基斯坦海洋渔业资源已处于充分开发状态,多数经济类群已处于过度捕捞状态或者崩溃后的恢复状态,开发潜力较小。与我国南海深海区类似,阿拉伯海现有丰富的渔业资源,如鸢乌贼、金枪鱼和鲣等[26-27],尤其是鸢乌贼最具开发潜力[28]。我国多次对阿拉伯海鸢乌贼资源进行了探捕[28],南海区也已形成了以灯光罩网渔船为主的捕捞作业船队[29];因此,以阿拉伯海的鸢乌贼渔业作为切入点,充分利用中巴全天候战略合作伙伴关系加强合作,与巴基斯坦共同开发印度洋公海渔业资源,对“一带一路”倡议的推动,中国和巴基斯坦渔业的可持续发展,以及中巴双方渔业领域科学家的交流与合作均有重要意义。
-
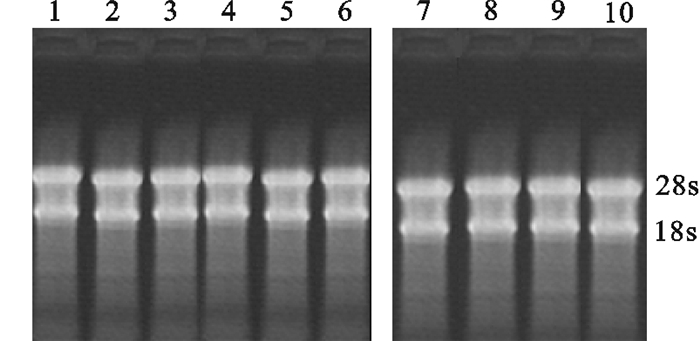
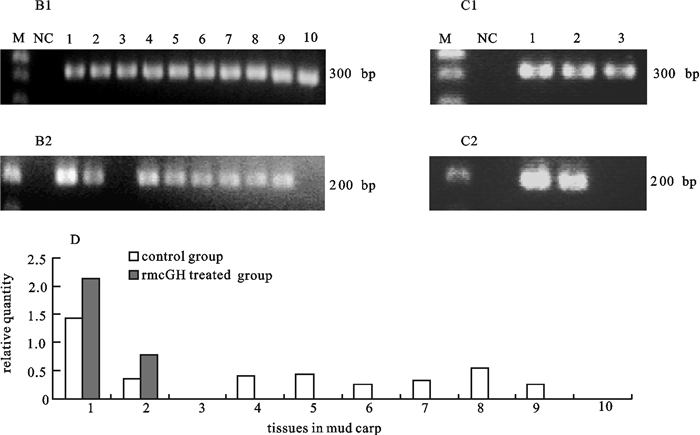
图 3 半定量RT-PCR检测重组鲮GH处理前后鲮actin和IGF-ⅠmRNA的组织表达
B1. 半定量RT-PCR检测对照组中鲮各组织中actin mRNA的表达;B2. 半定量RT-PCR检测对照组中鲮各组织中IGF-ⅠmRNA的表达;C1. 半定量RT-PCR检测处理组中鲮各组织中actin mRNA的表达;C2. 半定量RT-PCR检测处理组中鲮各组织中IGF-ⅠmRNA的表达;D. 处理前后鲮组织IGF-ⅠmRNA的相对表达;M. 100 bp DNA分子量标准;NC. 负对照;1~10. 肝、脑、肌肉、肾、肠、鳃、脾、性腺、心脏、皮肤
Figure 3. Semi-quantitative RT-PCR analysis of expression of Actin and IGF-Ⅰ mRNA in various tissues in mud carp
B1. Actin mRNA was detected in various tissues by semi-quantitative RT-PCR in control group; B2. IGF-ⅠmRNA was detected in various tissues by semi-quantitative RT-PCR in control group; C1. Actin mRNA was detected in various tissues by semi-quantitative RT-PCR in rmcGH in treated group; C2. IGF-Ⅰ mRNA was detected in various tissues by semi-quantitative RT-PCR in rmcGH in treated group; D. relative quantity of IGF-ⅠmRNA in various tissues in mud carp; M.100 bp DNA molecular weight marker; NC. a negative control (no template); 1~10. brain, liver, muscle, kidney, intestine, gill, spleen, gonad, heart, skin
表 1 扩增IGF-Ⅰ、Actin的引物序列
Table 1 Oligonucleotide primers used to amplify cDNA for mud carp IGF-Ⅰand Actin
引物 primer 序列 sequence Actin-F 5′-GTGTTGGCG/ATACAGGTCCTTACG-3′ Actin-R 5′-CAGACTACCTC/GATGAAGATCCTGAC-3′ IGF-Ⅰ-F 5′-ATGGAAAACCAGCGCCTCTTC-3′ IGF-Ⅰ-R 5′-TGCATGTCCTTCTTGAAGCAAG-3′ 表 2 对照组和重组鲮IGF-Ⅰ处理组鲮血清中GH和IGF-Ⅰ浓度
Table 2 The GH and IGF-Ⅰconcentration in sera in control and rmc IGF-Ⅰtreated fish
浓度±S.E.(n=3)/ng·mL-1 concentration±S.E. 对照组
control重组鲮IGF-Ⅰ处理组
rmcIGF-Ⅰtreated groupP值 胰岛素样生长因子-Ⅰ浓度
IGF-Ⅰconcentration145.59±21.84 247.71±2.83 P=0.043<0.05 生长激素浓度
GH concentration0.037±0.0067 0.053±0.0067 P=0.508>0.05 -
[1] LI Wensheng, LIN Haoran, WONG A O L. Effects of gonadotropin-releasing hormone on growth hormone secretion and gene expression in common carp pituitary[J]. Comp Biochem Physiol: Part B, 2002, 132(2): 335-341. doi: 10.1016/S1096-4959(02)00039-8
[2] LI Yinghua, BAI Junjie, JIAN Qing, et al. Expression of common carp growth hormone in the yeast Pichia pastoris and growth stimulation of juvenile tilapia (Oreochromis niloticus)[J]. Aquac, 2003, 216(13): 329-341. doi: 10.1016/S0044-8486(02)00406-4
[3] 江世贵, 张殿昌, 苏天凤, 等. 鲮生长激素cDNA的分子克隆和序列分析[J]. 中国水产科学, 2003, 10(2): 97-101. doi: 10.3321/j.issn:1005-8737.2003.02.003 [4] KOJI Inoue, HOZI Iwatani, YOSHIO Takei. Growth hormone and insulin-like growth factorⅠof a Euryhaline fish Cottus kazika: cDNA cloning and expression after seawater acclimation[J]. Gen Comp Endocrinol, 2003, 131(1): 77-84. doi: 10.1016/S0016-6480(02)00650-0
[5] BIGA P R, PETERSon B C, SCHELLING G T, et al. Bovine growth hormone treatment increased IGF-Ⅰin circulation and induced the production of a specific immune response in rainbow trout (Oncorhynchus mykiss)[J]. Aquac, 2005, 246(1/4): 437-445. doi: 10.1016/j.aquaculture.2005.01.019
[6] 张殿昌, 江世贵, 苏天凤, 等. 鲮胰岛素生长因子Ⅰ(IGF-Ⅰ)cDNA的分子克隆和序列分析[J]. 上海水产大学学报, 2002, 11(2): 97-101. doi: 10.3969/j.issn.1004-7271.2002.02.001 [7] 黄燕琴, 张殿昌, 苏天凤, 等. 重组鲮IGF-Ⅰ对鲮GH表达的影响[J]. 南方水产, 2006, 2(5): 19-24. doi: 10.3969/j.issn.2095-0780.2006.05.004 [8] ZHANG Dianchang, HUANG Yanqin, SHAO Yanqing, et al. Molecular cloning, recombinant expression and growth-promoting effect of mud carp (Cirrhinus molitorella) insulin-like growth factor-Ⅰ[J]. Gen Comp Endocrinol, 2006, 148(2): 203-212. doi: 10.1016/j.ygcen.2006.03.014
[9] SHINGO Kajimura, KATSUHISA Uchida, TAKASHI Yada, et al. Effects of insulin-like growth factors (IGF-Ⅰand-Ⅱ)on growth hormone and prolactin release and gene expression in euryhaline tilapia, Oreochromis mossambicus[J]. Gen Comp Endocrinol, 2002, 127(3): 223-231. doi: 10.1016/s0016-6480(02)00055-2
[10] BIGA P R, GERALD T, SCHELLINGA R, et al. The effects of recombinant bovine somatotropin (rbST)on tissue IGF-Ⅰ, IGF-Ⅰreceptor, and GH mRNA levels in rainbow trout, Oncorhynchus mykiss[J]. Gen Comp Endocrinol, 2004, 135(3): 324-333. doi: 10.1016/j.ygcen.2003.10.014
[11] VONG Q P, CHAN K M, CHENG C H K. Quantification of recombinant of mud carp IGF-Ⅰand IGF-ⅡmRNA by realtime PCR: differential regulation of expression by GH[J]. J Endocrinol, 2003, 17(8): 513-521. doi: 10.1677/joe.0.1780513
[12] KELLEY K M, DESAI P, ROTH J T, et al. Evolution of endocrine growth regulation: the insulin like growth factors (IGFs), their regulatory binding proteins (IGFBPs), and IGF receptors in fishes and other ectothermic vertebrates[M]//FINGERMAN M, THOMPSON M F, NAGABHUSHANAM R. Recent advances in marine biotechnology. New Delhi: Oxford and IBH Publishing, 2000: 189-228. https://www.semanticscholar.org/paper/Evolution-of-endocrine-growth-regulation%3A-the-like-Kelley-Desai/66de760e9df4bc320b7df3b39e8bc4c24dc1dfed
[13] MORIYAMA S, AYSon F G, KAWAUCHI H. Growth regulation by insulin-like growth factor-Ⅰin fish[J]. Biosci Biotechnol Biochem Rev, 2000, 64(11): 1 553-1 562. doi: 10.1271/bbb.64.1553
[14] PEREZ-SANCHEZ J. The involvement of growth hormone in growth regulation, energy homeostasis and immune function in the gilthead sea bream (Sparus aurata): a short review[J] Fish Physiol Biochem, 2000, 22(10): 135-144. doi: 10.1023/A:1007816015345
[15] THISSEN J P, UNDERWOOD L E, KETELSLEGERS J M. Regulation of insulin-like growth factor-Ⅰin starvation and injury[J]. Nutr Rev, 1999, 57(6): 167-176. doi: 10.1111/j.1753-4887.1999.tb06939.x
[16] HASHIMOTO H, MIKAWA S, TAKAYAMA E, et al. Molecular cloning and growth hormone-regulated gene expression of carp insulin-like growth factor-Ⅰ[J]. Biochem Mol Biol Int, 1997, 41(5): 877-886. doi: 10.1080/15216549700201921
[17] FUNKENSTEIN B, SILBERGELD A, CAVARI B, et al. Growth hormone increases plasma levels of insulin-like growth factor-Ⅰ(IGF-Ⅰ) in a teleost, the gilthead seabream (Sparus aurata)[J]. J Endocrinol, 1989, 120(7): 19-21. doi: 10.1677/joe.0.120r019
[18] MORIYAMA S. Increased plasma insulin-like growth hormone factor-Ⅰ (IGF-Ⅰ) following oral and intraperitoneal administration of growth hormone to raimbow trout, Oncorhynchus mykiss[J]. Growth Regul, 1995, 53(3): 164-167. https://pubmed.ncbi.nlm.nih.gov/7580868/
[19] CAO Q P. Nucleotide sequence and growth hormone regulated expression of salmon insulin-like growth factor Ⅰ mRNA[J]. Mol Endocrinol, 1989, 3(3): 2 006-2 010. doi: 10.1210/mend-3-12-2005
[20] SCHMID A C, REINECKE M, KLOAS W. Primary cultured hepatocytes of the bony fish, Oreochromis mossambicus, the tilapia: a valid tool for physiological studieson IGF-Ⅰexpression in liver[J]. J Endocrinol, 2000, 166(2): 265-273. doi: 10.1677/joe.0.1660265
[21] DUAN C, DUGUAY S J, PLISETSKAYA E M. Hormonal regulation of insulin-like growth factorⅠ(IGF-Ⅰ) mRNA expression in coho salmon[J]. Am Zool, 1992, 32: 13-20.
[22] TSE M C L, VONG Q P, CHENG C H K, et al. PCR cloning and gene expression studies in common carp (Cyprinus carpio) insulin-like growthfactor-Ⅱ[J]. Biochimica Biophysical Acta, 2002, 1 575(1/3): 63-74. doi: 10.1016/s0167-4781(02)00244-0
[23] PETEZ-SANCHEZ J, WEIL C, LE-BAI P Y. Effects of human insulin-like growth hormone factor-Ⅰon release of growth hormone by rainbow trout (Oncorhynchus mykiss) pituitary cells[J]. J Exp Zool, 1992, 262(3): 287-290. doi: 10.1002/jez.1402620308
[24] LEEDOM T A, UCHIDA K, YADA T, et al. Recombinant bovine growth hormone treatment of tilapia: growth response, metabolic clearance, receptor binding and immunoglobulin production[J]. Aquac, 2002, 207(3/4): 359-380. doi: 10.1016/S0044-8486(01)00767-0
[25] KAJIMURA S, UCHIDA K, YADA T, et al. Stimulation of insulin-like growth factor-Ⅰproduction by recombinant bovine growth hormone in Mozambique tilapia, Oreochromis mossambicus[J]. Fish Physiol Biochem, 2001, 25(3): 221-230. doi: 10.1023/A:1022268811599
[26] SILVERSTEIN J T, WOLTERS W R, SHIMIZU M, et al. Bovine growth hormone treatment of channel catfish: strain and temperature effectson growth, plasma IGF-Ⅰlevels, feed intake and efficiency, and body composition[J]. Aquac, 2000, 190(1): 77-88. doi: 10.1016/S0044-8486(00)00387-2
-
期刊类型引用(2)
1. 鲁泉,李楠,方舟,张忠. 基于优势分析法的西印度洋捕捞国和地区渔获量差异初步分析. 上海海洋大学学报. 2022(03): 821-830 .  百度学术
百度学术
2. 史登福,许友伟,孙铭帅,黄梓荣,陈作志,张魁. 广东海洋渔业资源可捕量评估. 海洋渔业. 2021(05): 521-531 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载:






 粤公网安备 44010502001741号
粤公网安备 44010502001741号
