Effects of nitrogen, phosphorus and carbon on growth of seven marine microalgae
-
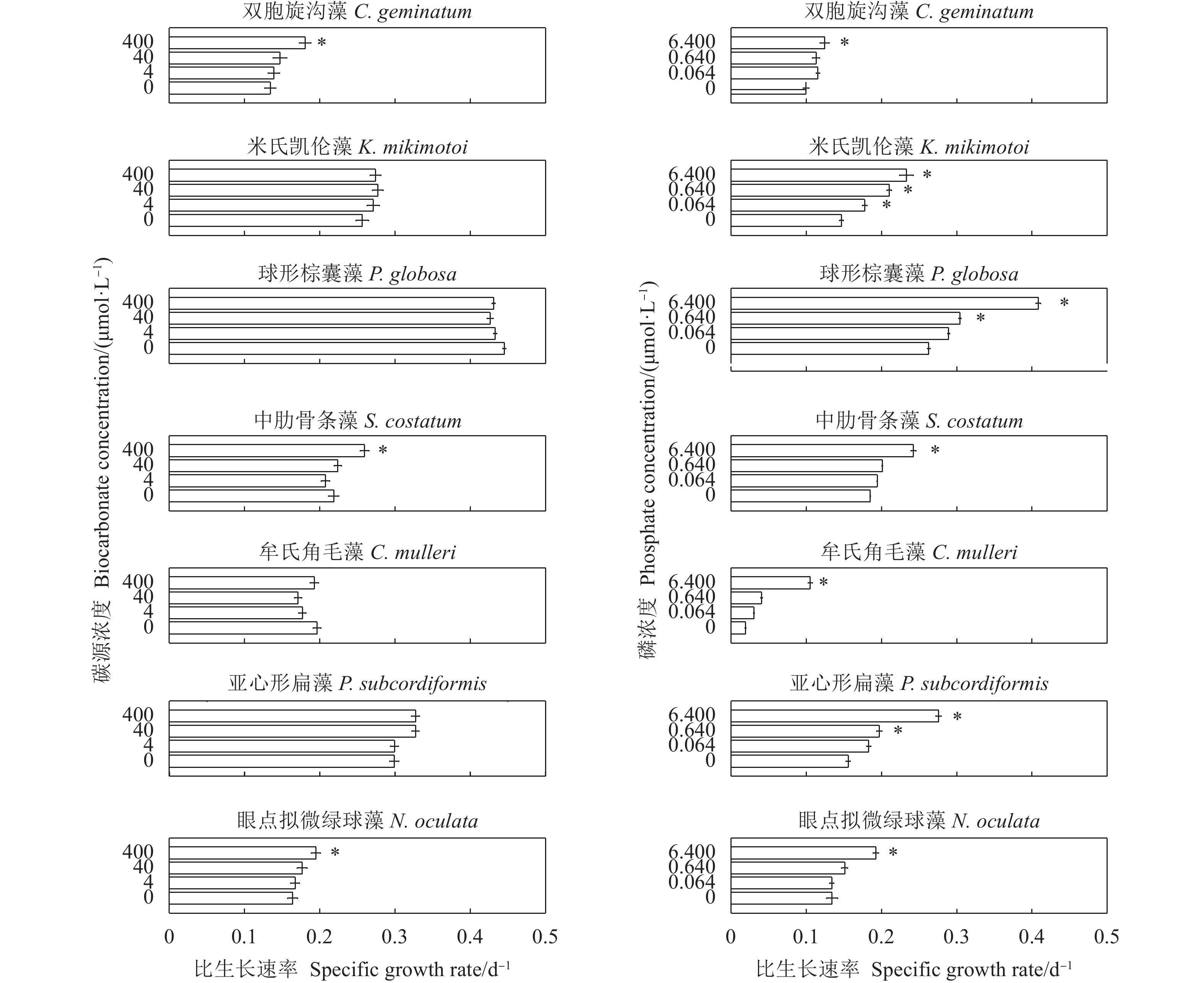
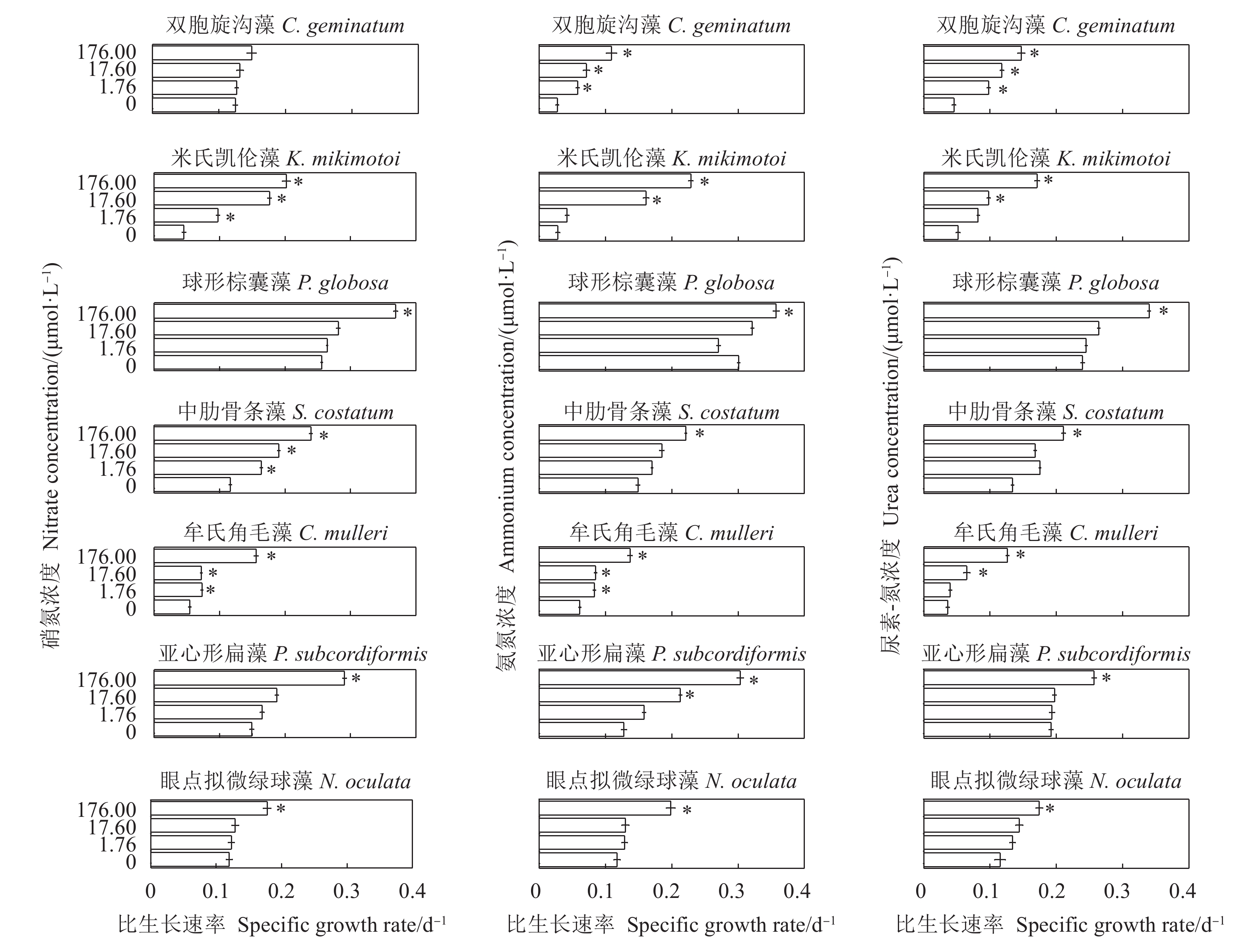
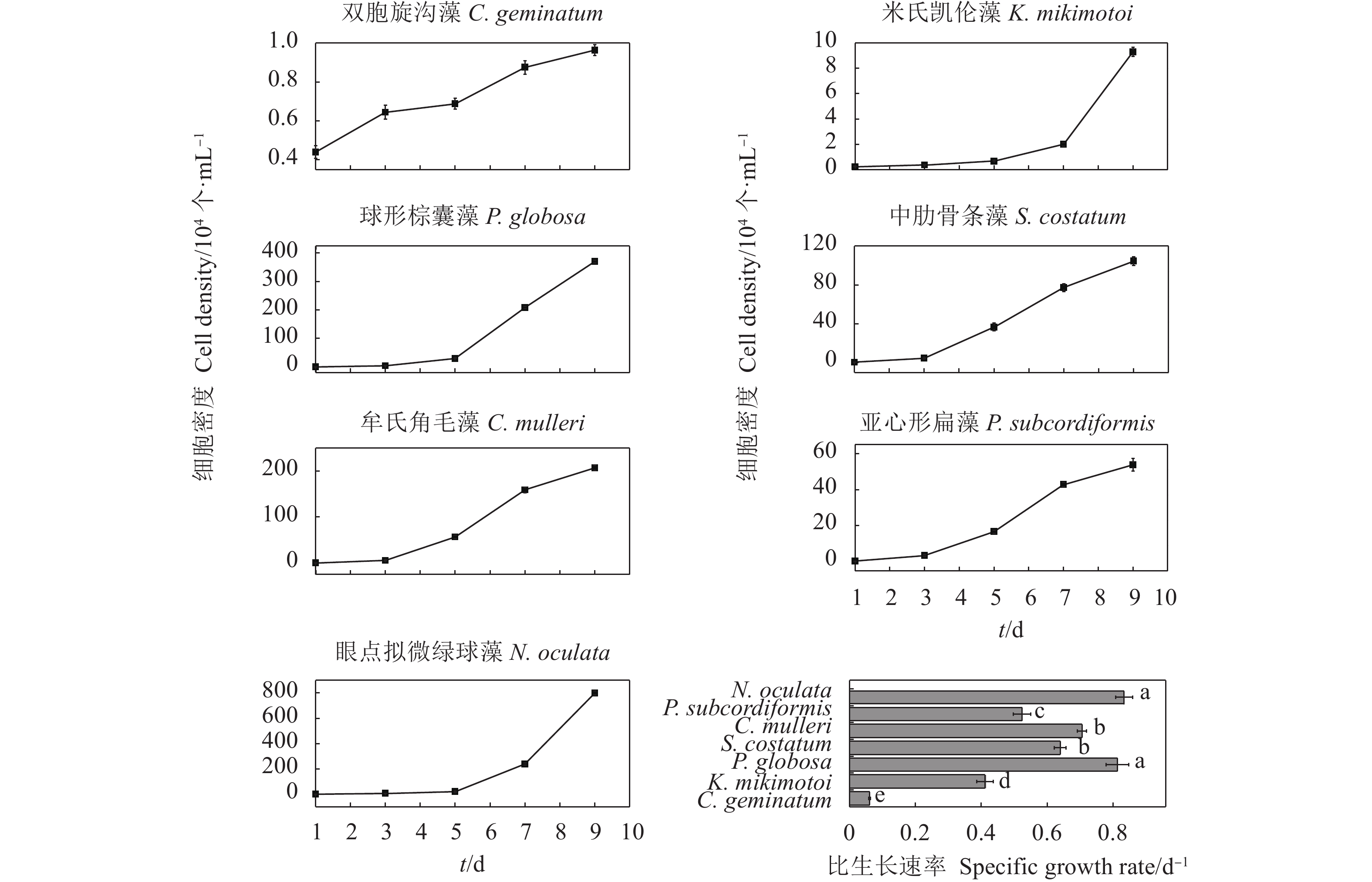
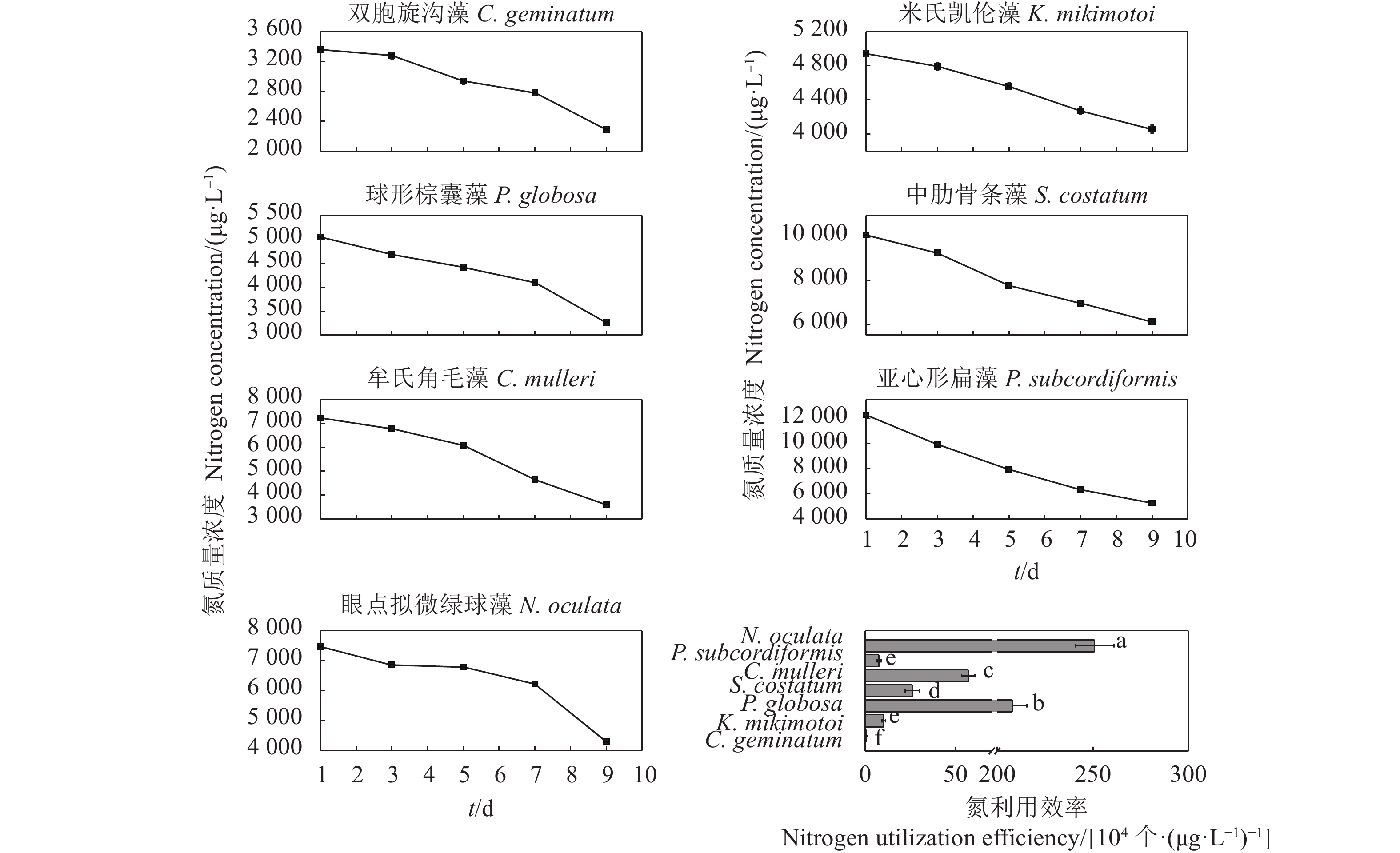
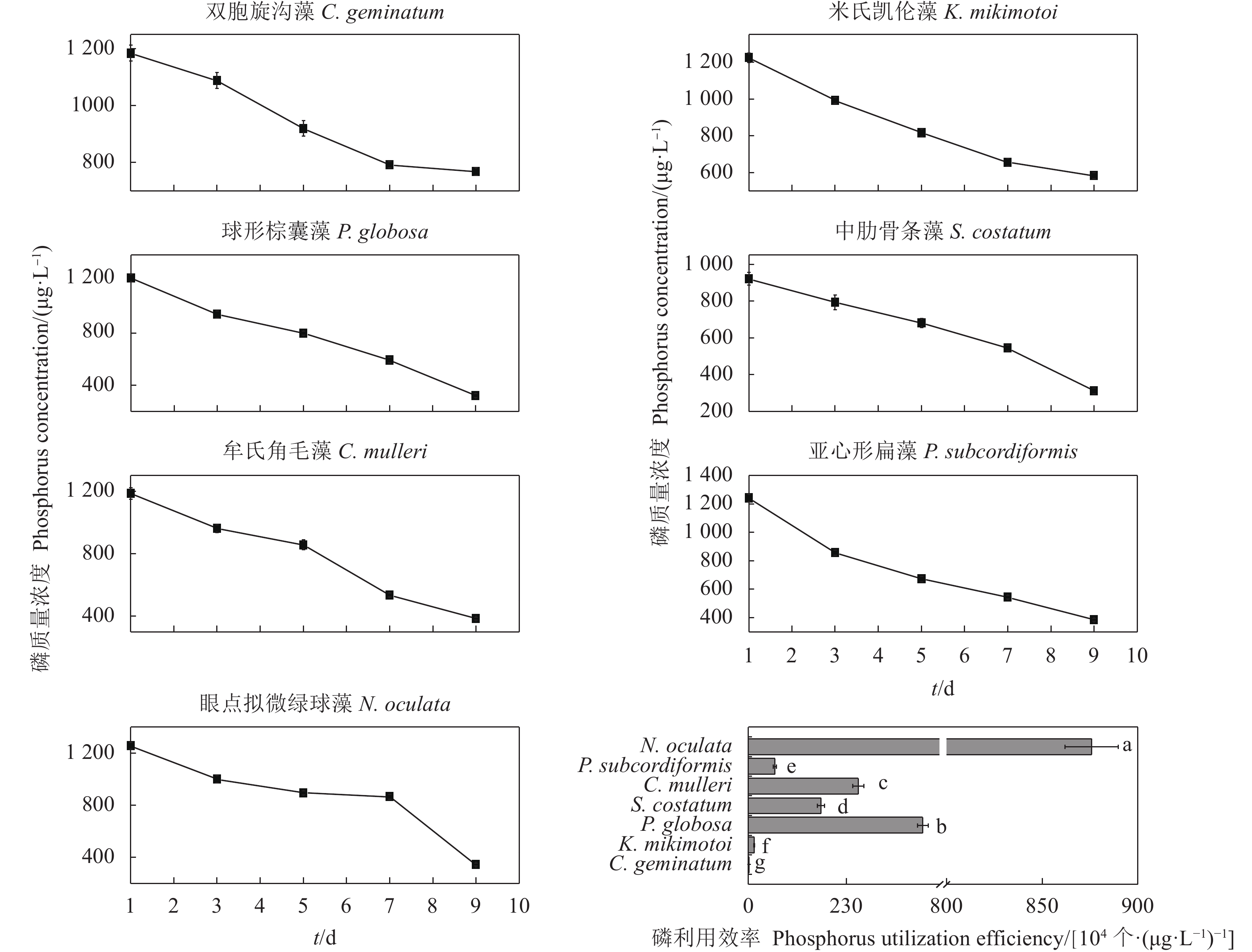
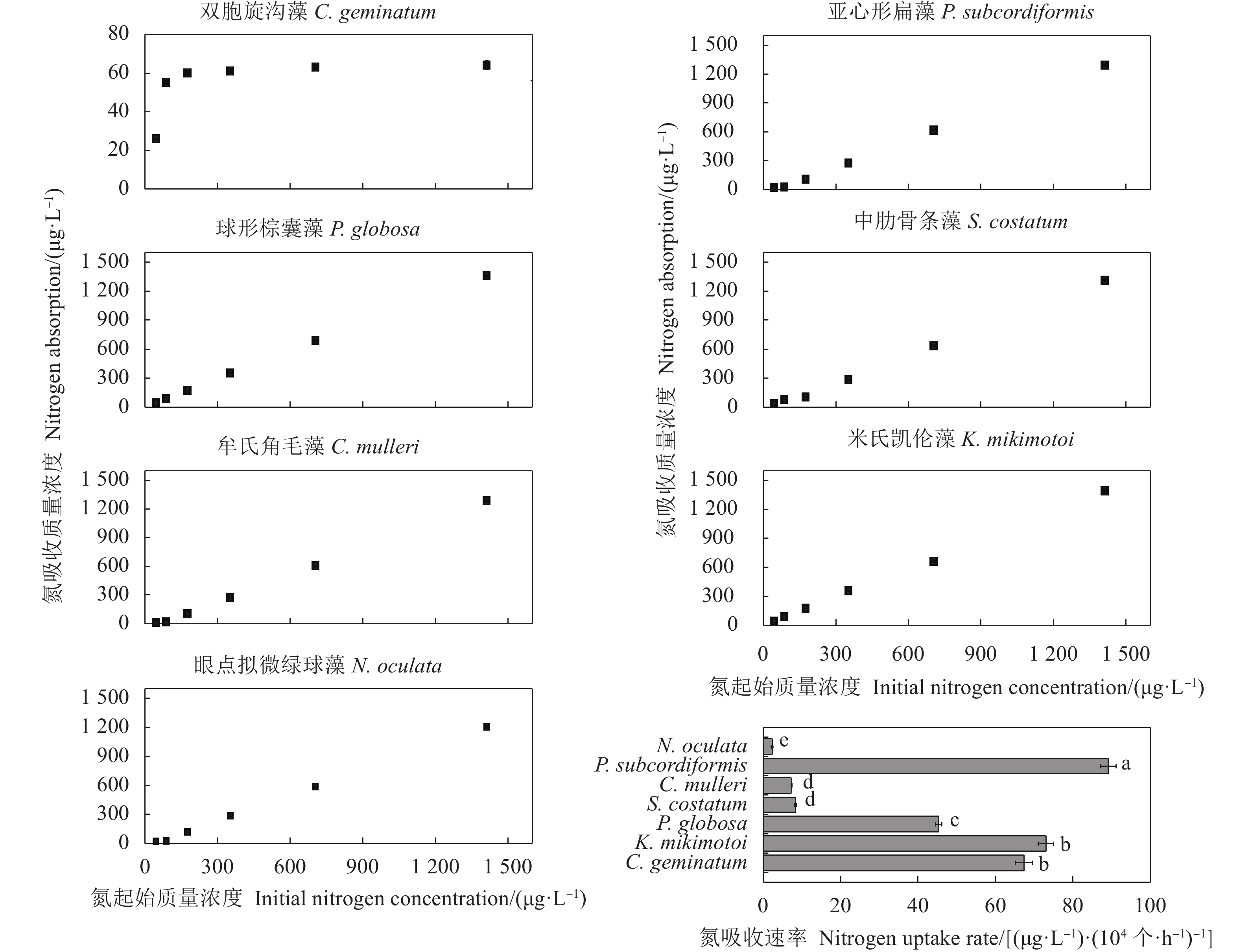
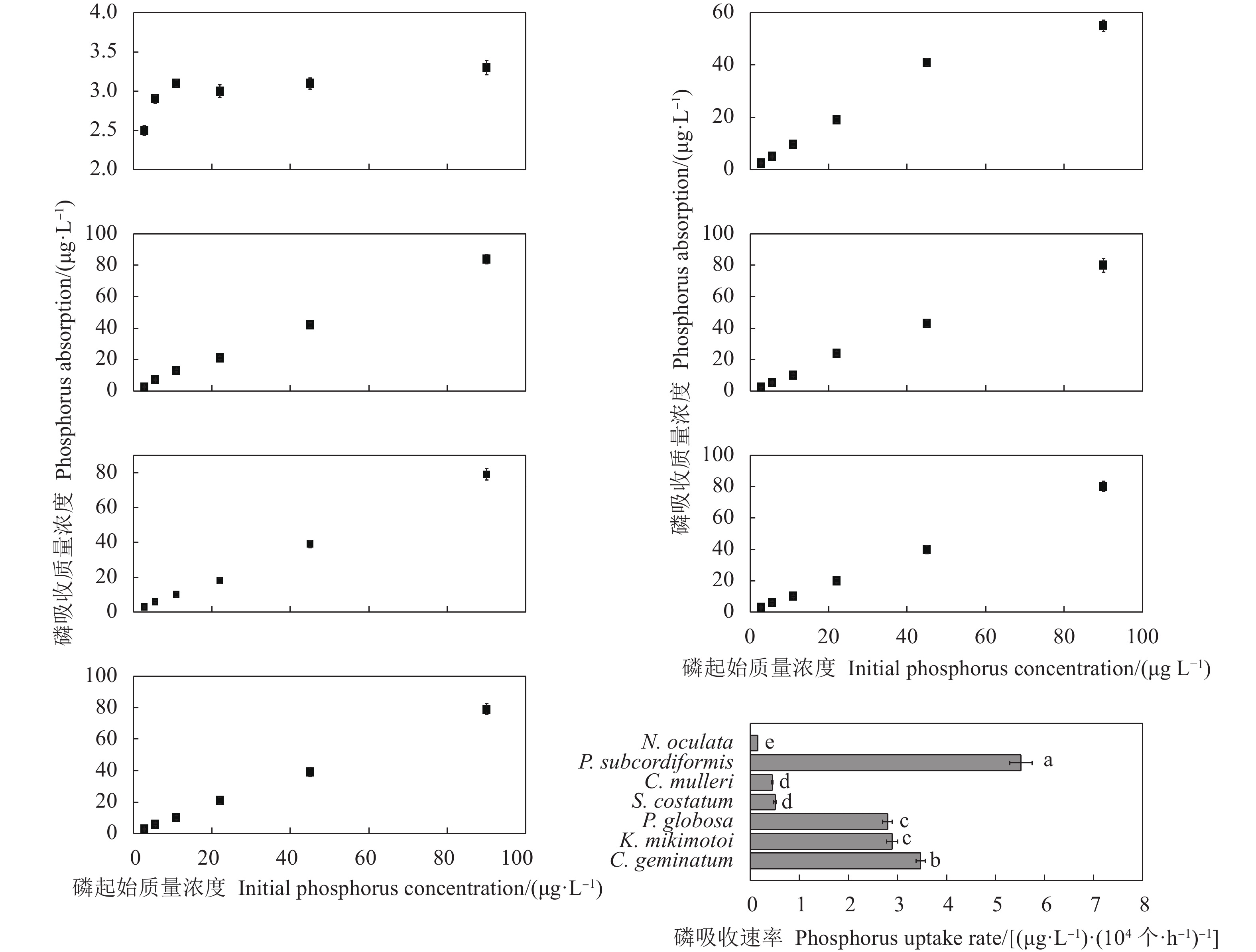
摘要: 文章采用批次培养方式研究双胞旋沟藻 (Cochlodinium geminatum)、米氏凯伦藻 (Karenia mikimotoi)、中肋骨条藻 (Skeletonema costatum)、牟氏角毛藻 (Chaetoceros muelleri)、球形棕囊藻 (Phaeocystis globosa)、亚心形扁藻 (Platymonas subcordiformis)和眼点拟微绿球藻 (Nannochloropsis oculata) 在不同碳 (C)、氮 (N)、磷 (P)条件下的生长特性,以期为养殖尾水的原位处理筛选优良藻种 (株)。结果表明,这7种微藻的比生长速率与C、N、P浓度总体呈正相关。相较对照组,C对旋沟藻、骨条藻和拟微绿球藻比生长速率的促进作用分别为35%、19%和19%,P对比生长速率的最大促进作用介于25.01%~446.60%,硝酸盐为16.54%~77.52%,铵盐为15.79%~88.82%,尿素为25.16%~71.43%。7种微藻的最大比生长速率与细胞体积总体呈负相关,棕囊藻的比生长速率最高,拟微绿球藻和扁藻最大比生长速率与其他藻华种相比无显著差别。微藻的氮磷吸收速率随细胞体积增加呈升高趋势,单位氮磷利用效率随细胞体积增加呈降低趋势。培养液中P吸收速率显著高于N,氮磷比均呈升高趋势。眼点拟微绿球藻和亚心形扁藻可用于养殖尾水氮磷的快速去除。Abstract: In order to screen fine algae species (strains) for in situ treatment of aquaculture tail water, we investigated the effects of nitrogen (nitrate, ammonium and urea), phosphorus (phosphate) and carbon (carbonate) on the growth of seven marine microalgae (Cochlodinium geminatum, Karenia mikimotoi, Skeletonema costatum, Chaetoceros muelleri, Phaeocystis globosa, Platymonas subcordiformis, Nannochloropsis oculata) in batch cultures. The results reaveal that the growth rates of microalgae were positively correlated with nutrients concentration. Compared with the control, the enhancements on the specific growth rate were 35%, 19% and 19% in C. geminatum, S. costatum and N. oculata under carbonate treatments. The enchancements on the specific growth rate under phosphate, nitrate, ammonium and urea were 25.01%−446.60%, 16.54%−77.52%, 15.79%−88.82% and 25.16%−71.43%, respectively. In general, the maximal specific growth rates (highest in P. globosa) of seven marine algae under carbon, nitrogen and phosphorus were negatively correlated with cell size, while those of P. subcordiformis and N. oculata were not significantly different with red tide microalgae except P. globosa. The nitrate and phosphate uptake rates were positively correlated with cell size, but the utilization efficiency of nitrogen/phosphorus per cell was negatively correlated with cell size. The N/P ratios in all culture medium increased. The phosphorus uptake rates were higher than nitrogen uptake rates. P. subcordiformis and N. oculata can be used in algal absorption of nitrogen and phosphorus in aquaculture tail water.
-
Keywords:
- Red tide algae /
- Bait algae /
- Nutrient /
- Nitrogen/phosphorus uptake /
- Specific growth rate
-
建立海洋生态系统模型为评估水生生态系统不同环境、管理方案以及相关渔业信息提供了更好的解决途径[1]。目前,许多生态学家将Ecopath模型作为研究新一代海洋生态系统的核心工具,Ecopath模型是Ecopath with Ecosim(EwE)食物网分析软件中的一部分,是用于分析食物网和定量组之间营养相互作用最常见的质量平衡模型[2]。国外学者运用此模型研究了多个水生生态系统的结构和功能[3-4],中国学者在莱州湾[5]、荣成俚岛[6]、东海[7]、象山港[8]、长江口[9]、北部湾[10]、南海北部[11]以及湖泊水库[12-14]等多个区域开展了不同生态系统能量流动和生态系统结构研究。
大亚湾位于珠江口的东北部,是中国南海沿岸规模最大、最重要的半封闭海湾之一[15]。由于良好的地貌和气候条件,已成为中国南海水产种质资源的重要保护区[16]。王雪辉等[17]运用Ecopath模型对20世纪80年代大亚湾能量流动做了初步研究,但是受到大规模开发利用(如大亚湾核电站的新建、石油化工、印刷和港口运输)等影响,导致大亚湾海域生态系统结构和生态环境发生了很大改变[18-21]。为了更好地描述大亚湾营养结构、生态系统性能和关键种,科学评估人为活动的影响,文章运用Ecopath with Ecosim 6.4(EwE)软件构建了大亚湾海域生态通道模型,对大亚湾生态系统能量流动关系、食物网结构和总体特征进行分析,为合理建设大亚湾,促进大亚湾渔业可持续发展提供理论依据。
1. 材料与方法
1.1 数据来源
该研究数据来源于2012年中国水产科学研究院南海水产研究所在大亚湾海域资源调查数据,调查时间为2012年3月、5月、8月和11月共4个航次,调查内容主要包括浮游植物、浮游动物、底栖生物、渔业资源以及环境要素等。其中渔业资源调查只在3月[22]。渔业资源调查共布设12个拖网调查站位S1~S12,雇用拖网渔船进行游泳生物调查,调查站位布置见图 1。采样及调查分析均按《海洋监测规范》(GB 17378—2007)、《海洋调查规范-海洋生物调查》(GB 12763.6—2007)、《近岸海域环境监测规范》(HJ 442—2008)、《海水水质标准》(GB 3097—1997)中规定的方法进行。
1.2 研究方法
1.2.1 Ecopath模型
Ecopath模型指生态系统由一系列生态关联的功能组(Group)构成,这些功能组基本涵盖了大亚湾生态系统中营养级结构和能量流动途径,大亚湾生态系统各功能组包括有机碎屑、浮游生物、底栖生物、1组规格和生态特性相同的鱼种等。根据能量守恒原理,每个功能组(i)的能量输出和输入保持相对平衡,用公式Pi=Yi+Bi×M2i+Ei+BAi+MOi计算,其中Pi是功能组i的总生产量; Yi是总捕捞量; Bi是生物量; M2i是捕食死亡率; Ei是净迁移(迁出-迁入); BAi是生物量积累; MOi是其他死亡; EEi是生态营养效率。
通过进一步计算可以得出
${B_i} \times {(P/B)_i} \times E{E_i} - \mathop \sum \limits_{j = 1}^n {B_j} \times {\left( {Q/B} \right)_j} \times D{C_{ij}} - E{X_i} = 0$ ,构建Ecopath模型需要输入前4个基本参数B、P/B、Q/B(Q代表消耗量)、EE中的任意3个,食物组成矩阵DCij和产出EXi则必须要求输入。生态营养转换效率EE是一个较难获取的参数,所以在Ecopath模型输入参数中,一般将其设为未知数,通过调试模型让所有EE均保证小于1。1.2.2 功能组划分
主要根据各生物种类食性特点、栖息地特点、生物量、个体大小和分类类群等特性划分功能组,将大亚湾生态系统定义为19个功能组,基本涵盖了该生态系统能量流动全过程。19个功能组分别为碎屑、浮游植物、浮游动物、紫海胆(Anthocidaris crassispina)、小型底栖生物、大型底栖生物、头足类、蟹类、虾类、虾蛄类、二长棘鲷(Parargyrops edita)、平鲷(Rhabdosargus sarba)、石首鱼科、虎鱼科、鲽形目、鲱形目、底层鲈形目、中上层鲈形目和其他鱼类(表 1)。
表 1 大亚湾生态系统Ecopath模型功能组及其主要种类Table 1. Functional groups and main species in Daya Bay ecosystem based on Ecopath model序号
No.功能组
functional group功能组描述
group′s description拉丁名
Latin name1 二长棘鲷 二长棘鲷 Parargyrops edita Tanaka 2 平鲷 平鲷 Rhabdosargus sarba 3 石首鱼科 白姑鱼 Argyrosomus argentatus 皮氏叫姑鱼 Johnius belengeri 勒氏短须石首鱼 Umbrina russelli Cuvier et Valenciennes 杜氏叫姑鱼 Johnius dussumieri 4 虎鱼科 绿斑细棘虎鱼 Acentrogobius chlorostigmatoides 矛尾虎鱼 Chaeturichthys stigmatias Richardson 巴布亚沟虎鱼 Oxyurichthys papuensis 拟矛尾虎鱼 Parachaeturichthys polynema 长丝虎鱼 Cryptocentrus filifer 5 鲽形目 卵鳎 Solea ovata Richardson 青缨鲆 Crossorhombus azureus 大鳞舌鳎 Cynoglossus macrolepidotus 6 鲱形目 斑 Clupanodon punctatus 康氏小公鱼 Anchoviella commerson 7 底层鲈形目 黑鲷 Sparus macrocephalus 短尾大眼鲷 Priacanthus macracanthus Cuvier et Valenciennes 李氏 Callionymus richardsoni Bleeker 黄斑蓝子鱼 Siganus oramin 列牙 Pelates quadrilineatus 六指马鲅 Polynemus sextarius Bloch et Schneider 丽叶鲹 Caranx kalla Cuvier et Valencienne 黄带鲱鲤 Upeneus sulphureus Cuvier et Valenciennes 印度无齿鲳 Ariomma indica 眶棘双边鱼 Ambassis gymnocephalus 长棘银鲈 Gerres filamentosus Cuvier 少鳞 Sillago japonica 黑鳃天竺鱼 Apogonichthys arafurae 中线天竺鲷 Apogon kiensis Jordan et Snyder 四线天竺鲷 Apogon quadrifasciatus Cuvier et Valenciennes 8 中上层鲈形目 圆鳞发光鲷 Acropoma hanedai Matsubara 短吻鲾 Leiognathus brevirostris 四指马鲅 Eleutheronema tetradactylum 短棘银鲈 Gerres lucidus Cuvier 鹿斑鲾 Leiognathus ruconius 蓝圆鲹 Decapterus maruadsi 9 其他 前鳞骨鲻 Osteomugil ophuyseni 月腹刺鲀 Gastrophysus lunaris 长蛇鲻 Saurida elongata 鲬 Platycephalus indicus 大鳞鳞鲬 Onigocia macrolepis 艾氏蛇鳗 Ophichthus evermanni Jordan et Richardson 10 虾类 宽突赤虾 Metapenaeopsis palmensis 刀额新对虾 Metapenaeus ensis 近缘新对虾 Metapenaeus affinis 鹰爪虾 Trachypenaeus curvirostris 11 虾蛄类 口虾蛄 Oratosquilla oratoria 断脊口虾蛄 Oratosquilla interrupa 条尾近虾蛄 Anchisquilla fasciata 棘突猛虾蛄 Harpiosquilla raphidea 长叉口虾蛄 Oratosquilla nepa 短沟对虾 Penaeus semisulcatus 12 蟹类 矛形梭子蟹 Portunus pelagicus 隆线强蟹 Eucrate crenata 直额 Charybdis truncata 伪装关公蟹 Dorippe facchino 锐齿 Charybdis hellerii 疾进 Charybdis vadorum Alcock 美人 Charybdis callianassa 太阳强蟹 Eucrate solaris Yang et Sun 远海梭子蟹 Portunus pelagicus 秀丽长方蟹 Metaplax elegans 锈斑 Charybdis feriatus 变态 Charybdis variegata 13 头足类 短蛸 Octopus ocellatus Gray 杜氏枪乌贼 Loligo duvaucelii Orbigny 中国枪乌贼 Loligo chinensis Gray 针乌贼 Sepia andreana Steenstrup 田乡枪乌贼 Loligo duvaucelii Orbigny 柏氏四盘耳乌贼 Euprymna berryi Sasaki 14 小型底栖生物 多毛类等 Polychaeta 15 大型底栖生物 覆瓦牡蛎 Parahyotissa imbricate 条蜒螺等 Nerita striata 16 紫海胆 紫海胆 Anthocidaris crassispina 17 浮游动物 桡足类 Copepoda 浮游幼虫等 larval plankton 18 浮游植物 中肋骨条藻 Skeletonema costatum 尖刺菱形藻 Nitzschia pungens Grunow 密聚角毛藻 Chaetoceros coarctatus Lauder 中华盒形藻 Biddulphia sinensis Greville 奇异棍形藻等 Bacillaria paradoxa Gmelin 19 碎屑 有机物 1.2.3 功能组生物学参数来源
文章所使用Ecopath模型用湿质量(t·km-2)表示其能量流动,时间限定为1年。渔业资源生物量通过扫海面积法进行估算,浮游植物生物量由浮游植物碳单位转换为湿质量单位,取比值1:10[23],浮游植物碳质量又通过叶绿素a的水柱积分,取比值50[24]。紫海胆生物量通过潜水员在海底进行采样; 底栖生物生物量使用漏斗式采泥器采集; 浮游动物使用浮游动物网采集并结合相关文献[25-26]。
当生态系统平衡时,鱼类P/B值等于瞬时死亡率Z,总死亡率Z等于自然死亡率M与开发捕捞死亡率的累加,鱼类Q/B值一般根据PALOMARES和PAULP[27]、PAULY[28]使用的尾鳍外形比多元回归模型来计算。文章中P/B比值和Q/B比值参考与文章纬度接近且生态系统相似功能组[29-31],并结合渔业数据库网站[32](www.fishbase.org )来确定模型参数。碎屑数量采用碎屑和初级生产碳经验公式计算[33]。食物组成矩阵数据参考渔业数据库网站和已有食性研究结果[34-35]。
2. 结果
大亚湾生态系统Ecopath模型基本输入和输出情况见表 2。在模型运行前,运用Pedigree对模型和数据质量进行评估。从表 2可以看出模型中所有功能组EE值均小于1,且鱼类与虾蟹类功能组EE值相对较高,大亚湾生态系统营养级范围在1~3.29级之间。
表 2 大亚湾生态系统Ecopath模型功能组基本参数(粗体为计算参数)Table 2. Basic parameters of functional groups in Daya Bay based on Ecopath model (calculating parameters are in bold)序号
No.功能组
functional group营养级
trophicB/t·km-2 (P/B)/年-1 (Q/B)/年-1 EE P/Q 1 二长棘鲷 3.24 0.012 8 2.825 13.5 0.99 0.21 2 平鲷 3.29 0.016 9 1.76 4.8 0.99 0.36 3 石首鱼科 3.17 0.006 1.85 10.4 0.99 0.18 4 虎鱼科 3.20 0.12 2.66 7.71 0.96 0.35 5 鲽形目 3.06 0.007 3.09 13.61 0.99 0.23 6 鲱形目 2.67 0.02 5.54 29.3 0.99 0.19 7 底层鲈形目 3.19 0.075 3.91 19.4 0.95 0.20 8 中上层鲈形目 2.96 0.014 1.91 10.2 0.99 0.19 9 其他鱼类 3.34 0.07 3.4 14 0.96 0.24 10 虾类 2.67 1.83 6.5 16.35 0.99 0.40 11 虾蛄类 2.88 0.814 5 6 20.3 0.99 0.30 12 蟹类 2.87 1.042 3 5.65 26.9 0.99 0.21 13 头足类 3.18 0.032 3.1 12.8 0.98 0.24 14 大型底栖生物 2.24 10.15 3 12.5 0.71 0.24 15 小型底栖生物 2.14 14.5 6.57 27.4 0.38 0.24 16 紫海胆 2.13 0.011 4.2 16.7 0.16 0.25 17 浮游动物 2.00 6.55 32 192 0.38 0.17 18 浮游植物 1.00 10.732 230 0.44 19 碎屑 1.00 129 0.54 2.1 功能组间营养级结构
营养级聚合是指将不同功能组的营养流合并为数个营养级,大亚湾生态系统营养级结构(表 3)共有6个层次,由于营养级Ⅴ和Ⅵ生物量和生产量都很低,所以基本忽略不计,能量主要在营养级Ⅰ~Ⅳ中流动和传递,且能量流动、生物量、生产量分布呈现金字塔形,即底层营养级流量较大,且逐级递减,营养级结构符合金字塔规律。
表 3 大亚湾生态系统总能量分布Table 3. Distribution of total throughput in Daya Bay ecosystemt·(km2·年)-1 营养级
trophic level被摄食量
consumption by predation输出量
export流向碎屑量
flow to detritus呼吸量
respiration总流量
throughputⅣ 0.641 0 2.225 5.146 8.012 Ⅲ 9.946 0 35.54 69.23 114.7 Ⅱ 127.6 0 533.1 1 055 1 716 Ⅰ 1 723 1 316 1 371 0 4 410 合计total 1 861 1 316 1 942 1 130 6 249 营养级Ⅰ包括浮游植物和碎屑,其为系统能量的主要来源,从表 3可以看出营养级Ⅰ被摄食量为1 723 t·(km2·年)-1,占总被摄食量的92.6%。其中来自于浮游植物被摄食量为1 097 t·(km2·年)-1,占63.7%,碎屑被摄食量为625.6 t·(km2·年)-1,占36.3%。营养级Ⅰ和Ⅱ在能流中占了绝大部分,分别为4 410 t·(km2·年)-1和1 716 t·(km2·年)-1,占比分别为70.8%和27.5%。整个生态系统流向碎屑总量为1 942 t·(km2·年)-1,其中营养级Ⅰ和Ⅱ也占了绝大多数,分别为1 371 t·(km2·年)-1和533.1 t·(km2·年)-1,占比分别为70.6%和27.5%。通过营养级Ⅱ可知系统对此利用率较低,而往上面的营养级利用率较高。由此可知大亚湾生态系统能量主要来自于营养级Ⅰ中的初级生产者。
能量主要在Ⅰ、Ⅱ中流动(图 2),营养级Ⅰ传输效率为39.5%,营养级Ⅱ传输效率为27.46%,营养级Ⅱ(无脊椎动物)消耗的大部分碎屑来自于中大型食肉动物捕食活动中产生的碎屑。
2.2 大亚湾生态系统食物网结构
从图 3可以看出大亚湾生态系统营养流动由2条途径组成:一条是牧食食物链,浮游植物→浮游动物→虾蟹类等小型生物→渔业捕获物; 另一条是碎屑食物链,碎屑→浮游动物及底栖生物→虾蟹类等小型生物→渔业捕获物。2条食物链在大亚湾生态系统中扮演了重要的地位,系统能量均由浮游植物和碎屑所提供。
2.3 大亚湾生态系统营养级能量转换效率
大亚湾生态系统各营养级之间能量转换效率较低,而营养级之间能量转换效率则体现了该营养级被该生态系统利用效率,即输出与被摄食之和与总流量的比值。通过不同营养级之间能量转换效率(表 4)可知,由初级生产者营养级Ⅰ到Ⅱ的转换效率为6.7%,碎屑有机物营养级Ⅰ到Ⅱ的转换效率为8.7%。能流来源于初级生产者的营养级Ⅲ到Ⅳ的转换效率最高(9.9%),能流来源于碎屑有机物的营养级Ⅲ到Ⅳ的转换效率最低(5.2%)。初级生产者营养级Ⅱ到Ⅲ转化效率为9.1%。大亚湾生态体系中生态系统总转换效率为8%,其中初级生产者转化效率和碎屑转化率分别为8.2%和7.4%。转换效率在低等级食物链较大是由于在不同层次食物网中生物代谢水平差异所造成。
表 4 大亚湾各营养级间转换效率Table 4. Transfer efficiency among trophic levels in Daya Bay来源source 营养级trophic level Ⅱ Ⅲ Ⅳ Ⅴ 生产者producer 6.7 8.4 9.9 2.5 碎屑detritus 8.7 9.1 5.2 2.9 总能流all flow 7.4 8.7 8 2.6 碎屑所占能流比值proportion of total flow originating from detritus:0.4 转化效率transfer efficiency 初级生产者转化效率from primary producers:8.2% 碎屑转化效率from detritus:7.4% 总转化效率total:8% 2.4 大亚湾生态系统总体特征
在Ecopath模型中,总流量用来表示生态系统规模大小,其由总消耗量、总输出量、总呼吸量和总流入碎屑量组成,这些指标可以反映出生态系统的规模和稳定性。大亚湾生态系统系统总流量为6 249.573 t·(km2·年)-1,总消耗量为1 861.424 t·(km2·年)-1,占比29.8%;总输出量为1 316.293 t·(km2·年)-1,占比21%;总呼吸量为1 129.915 t·(km2·年)-1,占比18%;流向碎屑总量为1 941.941 t·(km2·年)-1,占比31%。系统总生产量为2 827.584 t·(km2·年)-1,总净初级生产量为2 468.36 t·(km2·年)-1,总初级生产量/总呼吸量为2.18,系统净生产量为1 338.445 t·(km2·年)-1,总生物量为46 t·(km2·年)-1,总初级生产量/总生物量为53.65,总生物量/总流量为0.007。
3. 讨论
3.1 营养级和转换效率
综合性功能组中生物种类较为复杂,不能简单将其与其他功能组营养级进行对比,可以将单一种类单独归类进行比较分析。通过Ecopath模型估算大亚湾生态系统,结果显示二长棘鲷和平鲷营养级分别为3.24和3.29,通过渔业数据库网站[32]中生态系统查询,中国南海Ecopath参数中二长棘鲷和平鲷营养级为3.44和3.25,与计算结果基本一致,而代春桃[36]和杨国欢等[37]在北部湾、徐闻利用稳定同位素测定的营养级分别为3.05和1.87,平鲷营养级差距较大,这可能与所选取平鲷的氮富集度较小、个体大小不同有关。海洋生态系统是一个动态过程,而生态演替过程一般由r-对策转变为k-对策。随着演替的不断进行初级生产量与呼吸量比值由大于1逐级接近于1,在能流方面由线性流通转变为网状流通,群落净生产流逐渐降低。在这个缓慢过程中,人类的活动在很大程度上能改变演替进程。王雪辉等[17]用20世纪80年代数据建立的大亚湾能量流动模型中初级生产者、碎屑、总转换效率均大于2012年,主要在营养级Ⅱ、Ⅲ转换效率上大于2012年,而在营养级Ⅰ转换效率上却小于2012年,这可能是由于大亚湾内生态环境受到了一定破坏,海水富营养化,导致初级生产者大量繁殖而未被充分利用[38]。又由于捕捞过度导致渔业资源衰退,致使渔业生物个体和年龄降低,可利用生物大量减少。
3.2 大亚湾生态系统稳定性
Ecopath模型可以用来评估生态系统成熟与稳定性,总初级生产量/总呼吸量(TPP/TR)是系统成熟与否的关键指标,当TPP/TR接近于1时,生态系统接近于成熟。CHRISTENSEN和PAULY[39]认为TPP/TR通常在0.8~3.3内,大亚湾为2.18,总初级生产量/总生物量为53.65,表明该生态系统属于初级阶段,生产量大于呼吸量,系统处于积蓄能量阶段。由河流流入也是导致TPP/TR偏高[40]的一个重要因素。Finn循环指数(FCI)和平均能流路径(MPL)也是系统成熟与否的关键指标,系统越成熟,营养流所流经食物链更长,物质再循环比例更高。在大亚湾生态系统中FCI和MPL分别为4.8%和3.53,表明该生态系统结构较为单一,成熟度较低,远低于其他海域生态系统[41]。联结指数(CI)和系统杂食性指数(SOI)是表示系统内部联系复杂程度指标,系统成熟程度取决于其复杂程度,即各生物群落联系更加密切,生态系统稳定性更强,其数值越接近1成熟度越高。大亚湾生态系统CI和SOI分别为0.324和0.174,表明食物网简化且系统不成熟,杂食性程度低。均低于ULLAH等[42]对孟加拉海岸带研究指数0.42、0.224和RUIZ-CAUICH等[43]在翁河流域研究指数0.367、0.208。这些参数有力地结合了该模型,从而修正了被忽略的其他功能组对模型拓扑依赖性指标。
3.3 总体特征比较与捕捞限制
南海北部包括了大亚湾以外大部分海域,其总生物量远远高于大亚湾海域生物量水平,这可能是由于外海海域环境较好,捕捞压力较低所致(表 5)。大亚湾和莱州湾研究数据均是距离内陆较近,受内陆环境和人类活动影响较大的海域,其总生物量差距不大,但是大亚湾系统总流量远远大于莱州湾,且主要在总输出量和流向碎屑总量上差距明显,说明大亚湾初级生产力对生态系统支撑较大,高营养级鱼类量比莱州湾多,生态系统整体水平好于莱州湾。
表 5 大亚湾生态系统与其他海域生态系统参数比较Table 5. Comparison of parameters of Daya Bay ecosystem with those of the other sea areas参数parameter 莱州湾[5]
Laizhou Bay大亚湾
Daya Bay南海北部[11]
northern South China Sea总消耗量/t·(km2·年)-1 sum of all consumption 1 314.32 1 861.424 3 324.185 总输出量/t·(km2·年)-1 sum of all exports 434.41 1 316.293 3 236.992 总呼吸量/t·(km2·年)-1 sum of all respiratory flows 826.97 1 129.915 2 027.59 流向碎屑总量/t·(km2·年)-1 sum of all flows into detritus 1 042.24 1 941.941 4 448.65 系统总流量/t·(km2·年)-1 total system throughput 3 618 6 249.573 13 037 系统总生产量/t·(km2·年)-1 sum of all production 1 549 2 827.584 5 895 总净初级生产量/t·(km2·年)-1 calculated total net primary production 1 261.38 2 468.36 5 264.58 总初级生产量/总呼吸量total primary production/total respiration 1.53 2.185 2.596 系统净生产量/t·(km2·年)-1 net system production 434.41 1 338.445 3 236.99 总初级生产量/总生物量total primary production/total biomass 25.54 53.655 92 25 总生物量/总流量total biomass/total throughput - 0.007 0.016 总生物量/t·(km2·年)-1 total biomass 51.39 46.0035 212.761 近年来,渔政管理部门已先后启动了包括休渔期、禁止使用破坏性捕捞工具、限制捕捞量、进行渔业资源养护和维持生物多样性等一系列渔业管理政策[44],广东珠江口海域在采取休渔期政策后15年内渔业资源状况得到了一定保护,但在高捕捞强度下,对于恢复资源量的作用并不显著[31]。采用Ecopath模型对大亚湾生态系统结构和功能研究较少,但由于文章调查数据和站位有限,其结论尚需进一步验证。时空变化显著影响渔业资源变动,文章所研究数据的时间序列有待补充,同时,今后需要在Ecopath模型中加入管理策略变量、空间变量和环境变量对大亚湾生态系统结构和功能影响的分析,并以此制定和完善渔业管理策略和保护措施,为进一步保护和促进海洋生物资源的可持续利用提供重要参考。
-
表 1 微藻培养液中氮磷比变化
Table 1 Variations of N/P ratio in culture medium
培养时间/d
Culture time双胞旋沟藻
C. geminatum米氏凯伦藻
K. mikimotoi球形棕囊藻
P. globosa中肋骨条藻
S. costatum牟氏角毛藻
C. mulleri亚心形扁藻
P. subcordiformis眼点拟微绿球藻
N. oculata0 1.10 1.10 1.10 1.10 1.10 1.10 1.10 1 2.84 4.04 4.12 10.98 6.09 9.88 5.95 3 3.01 4.83 4.97 11.72 7.07 11.60 6.86 5 3.19 5.59 5.52 11.45 7.11 11.81 7.58 7 3.52 6.51 6.92 12.81 8.69 11.68 7.20 9 2.98 6.95 10.20 19.56 9.35 13.73 12.47 -
[1] 张景平, 黄小平, 江志坚, 等. 珠江口海域污染的水质综合污染指数和生物多样性指数评价[J]. 热带海洋学报, 2010, 29(1): 69-76. doi: 10.3969/j.issn.1009-5470.2010.01.011 [2] SHI X Y, LI H M, WANG H. Nutrient structure of the Taiwan Warm Current and estimation of vertical nutrient fluxes in upwelling areas in the East China Sea in summer[J]. J Ocean Univ China, 2014, 13(4): 613-620. doi: 10.1007/s11802-014-2481-0
[3] HUNG J J, HUANG W C, YU C S. Environmental and biogeochemical changes following a decade's reclamation in the Dapeng (Tapong) Bay, southwestern Taiwan[J]. Est Coast Shelf Sci, 2013, 130(SI): 9-20.
[4] 李仕平, 李仙, 张光磊, 等. 东寨港海水增养殖区水质状况及变化趋势研究[J]. 海南师范大学学报(自然科学版), 2017, 30(4): 430-435. [5] HERATH S S, SATOH S. Environmental impact of phosphorus and nitrogen from aquaculture[M]. England: Woodhead Publishing, 2015: 369-386.
[6] EDWARDS P. Aquaculture environment interactions: past, present and likely future trends[J]. Aquaculture, 2015, 447: 2-14. doi: 10.1016/j.aquaculture.2015.02.001
[7] 蒋增杰, 方建光, 毛玉泽, 等. 海水鱼类网箱养殖水域沉积物有机质的来源甄别[J]. 中国水产科学, 2012, 19(2): 348-354. [8] 韩芳, 霍元子, 杜霞, 等. 象山港网箱养殖对水域环境的影响[J]. 上海海洋大学学报, 2012, 21(5): 825-830. [9] 陈一波, 宋国宝, 赵文星, 等. 中国海水养殖污染负荷估算[J]. 海洋环境科学, 2016, 35(1): 1-6, 12. [10] 王申, 高珊珊, 蒋力, 等. 水产养殖系统氮磷营养盐收支及其生态影响研究[J]. 水产学杂志, 2018, 31(5): 50-57. doi: 10.3969/j.issn.1005-3832.2018.05.011 [11] 李金亮, 陈雪芬, 赖秋明, 等. 凡纳滨对虾高位池养殖氮、磷收支研究及养殖效果分析[J]. 南方水产, 2010, 6(5): 13-20. doi: 10.3969/j.issn.1673-2227.2010.05.003 [12] 刘永士, 臧维玲, 侯文杰, 等. 凡纳滨对虾生长及养殖池氮、磷收支随养殖时间的变化[J]. 大连海洋大学学报, 2013, 28(2): 143-147. doi: 10.3969/j.issn.2095-1388.2013.02.006 [13] 夏丽华, 徐珊, 陈智斌, 等. 广东省海岸带海水养殖业污染贡献率研究[J]. 广州大学学报(自然科学版), 2013, 12(5): 80-86. [14] XIE B, YU K J. Shrimp farming in China: operating characteristics, environmental impact and perspectives[J]. Ocean Coast Manage, 2007, 50(7): 538-550. doi: 10.1016/j.ocecoaman.2007.02.006
[15] 朱蓉, 张洪海, 张婧, 等. 不同氮磷比和铁浓度对两种海洋微藻生产二甲基硫和二甲巯基丙酸内盐的实验研究[J]. 中国海洋大学学报 (自然科学版), 2018, 48(12): 62-70. [16] 唐启升, 丁晓明, 刘世禄, 等. 我国水产养殖业绿色、可持续发展保障措施与政策建议[J]. 中国渔业经济, 2014, 32(2): 5-11. doi: 10.3969/j.issn.1009-590X.2014.02.001 [17] MARTINEZ-CORDOVA L R, LÓPEZ-ELÍAS J A, LEYVA-MIRANDA G, et al. Bioremediation and reuse of shrimp aquaculture effluents to farm whiteleg shrimp, Litopenaeus vannamei: a first approach[J]. Aquacult Res, 2011, 42(10): 1415-1423. doi: 10.1111/j.1365-2109.2010.02730.x
[18] AL-HAFEDH Y S, ALAM A, BUSCHMANN A H. Experiments on an integrated aquaculture system (seaweeds and marine fish) on the Red Sea coast of Saudi Arabia: efficiency comparison of two local seaweed species for nutrient biofiltration and production[J]. Rev Aquacult, 2012, 4(1): 21-31. doi: 10.1111/j.1753-5131.2012.01057.x
[19] 刘梅, 原居林, 何海生, 等. 微藻在南美白对虾养殖废水中的生长及净化效果[J]. 应用与环境生物学报, 2018, 249(4): 866-872. [20] 田立丹, 王素英. 常见废水与螺旋藻生长的适配性研究[J]. 水产科学, 2011, 30(6): 325-330. doi: 10.3969/j.issn.1003-1111.2011.06.004 [21] GUILLARD R R L. Culture of phytoplankton for feeding marine invertebrates[M]//SMITH W L, CHANLEY M H. Culture of marine invertebrate animals. New York: Plenum Press, 1975: 26-60.
[22] GUILLARD R L, RYTHER J H. Studies of marine planktonic diatoms. I. Cyclotella nana Hustedt and Detonula confervacea (Cleve) Gran[J]. Can J Microbiol, 1962, 8: 229-239. doi: 10.1139/m62-029
[23] 梁英, 李泽邦, 刘春强, 等. 不同磷源对3种海洋微藻生长和种间竞争的影响[J]. 海洋湖沼通报, 2017(5): 132-140. [24] 俞群娣, 王亚军, 余新威, 等. 微小亚历山大藻(Alexandrium minutum)的氮磷吸收, 生长, 产毒动态变化[J]. 海洋与湖沼, 2018, 49(2): 346-351. [25] 韦桂秋, 王华, 蔡伟叙, 等. 近10年珠江口海域赤潮发生特征及原因初探[J]. 海洋通报, 2012, 31(4): 466-474. [26] 王朝晖, 林朗聪, 康伟, 等. 有毒有害赤潮藻类旋沟藻(Cochlodinium schütt)研究进展[J]. 暨南大学学报(自然科学与医学版), 2011, 32(1): 109-114. doi: 10.3969/j.issn.1000-9965.2011.01.023 [27] WANG B, XIN M, WEI Q, et al. A historical overview of coastal eutrophication in the China Seas[J]. Mar Pollut Bull, 2018, 136: 394-400. doi: 10.1016/j.marpolbul.2018.09.044
[28] RAVEN J A, GIORDANO M, BEARDALL J. Insights into the evolution of CCMs from comparisons with other resource acquisition and assimilation processes[J]. Physiol Plantarum, 2008, 133(1): 4-14. doi: 10.1111/j.1399-3054.2007.01024.x
[29] BENSCHOP J J, BADGER M R, PRICE G D. Characterisation of CO2 and HCO3 − uptake in the cyanobacterium Synechocystis sp. PCC6803[J]. Photosynth Res, 2003, 77(2/3): 117-126. doi: 10.1023/A:1025850230977
[30] FU M Z, WANG Z L, LI Y, et al. Phytoplankton biomass size structure and its regulation in the Southern Yellow Sea (China): seasonal variability[J]. Cont Shelf Res, 2016, 29(18): 2178-2194.
[31] 赵艳芳, 俞志明, 宋秀贤, 等. 不同磷源形态对中肋骨条藻和东海原甲藻生长及磷酸酶活性的影响[J]. 环境科学, 2009, 30(3): 693-699. doi: 10.3321/j.issn:0250-3301.2009.03.012 [32] YAMAGUCHI H, SAKAMOTO S, YAMAGUCHI M. Nutrition and growth kinetics in nitrogen-and phosphorus-limited cultures of the novel red tide flagellate Chattonella ovata (Raphidophyceae)[J]. Harmful Algae, 2008, 7(1): 26-32. doi: 10.1016/j.hal.2007.05.011
[33] 王小冬, 王艳. 赤潮异弯藻和海洋卡盾藻抗氧化酶活性对氮磷比失衡的响应[J]. 海洋环境科学, 2012, 31(3): 337-340. doi: 10.3969/j.issn.1007-6336.2012.03.007 [34] 康燕玉, 梁君荣, 高亚辉, 等. 氮、磷比对两种赤潮藻生长特性的影响及藻间竞争作用[J]. 海洋学报(中文版), 2006, 28(5): 117-122. doi: 10.3321/j.issn:0253-4193.2006.05.015 -
期刊类型引用(10)
1. 宋广军,宋伦,刘印,王昆,李楠. 滤食性贝类对饵料微藻摄食选择性研究进展. 水产科学. 2025(02): 320-326 .  百度学术
百度学术
2. 张聪颖,薛瑞萍,彭瑞冰,韩庆喜,蒋霞敏. 4株微藻悬浮和固定培养生长和氮磷去除效果的比较. 生态科学. 2023(01): 76-82 .  百度学术
百度学术
3. 阮烨烨,林雄平,翁晴,何子泓,林浩,张芷滢. 不同氮磷浓度对莱布新月藻生长与脂溶性物质含量的影响. 亚热带植物科学. 2023(01): 18-22 .  百度学术
百度学术
4. 马东怡,郭永军,李永仁,石八军,张中华. 盐田虾蛤混养模式下硬壳蛤的生长、水质及浮游植物特征分析. 天津农林科技. 2023(06): 6-12 .  百度学术
百度学术
5. 朱昔恩,林原有,项桂德,熊建华,陈田聪,陈晓汉,张彬. 盐度、温度和光照对广西沿海牟氏角毛藻生长的影响. 广东农业科学. 2022(01): 136-141 .  百度学术
百度学术
6. 叶舟,姚有智. 水体表层沉积物对磷的吸收及释放研究进展. 河北环境工程学院学报. 2021(01): 60-64 .  百度学术
百度学术
7. 赵东会,赵丽达,尤宏,秦松,王寅初,焦绪栋. 耐高温球等鞭金藻(Isochrysis galbana)藻种的选育与饵料特性初步分析. 海洋与湖沼. 2021(01): 206-212 .  百度学术
百度学术
8. 叶舟,吕丹亚,姚有智,吴康,华飞,靳维维. 河流表层沉积物磷的生物吸收、吸附机制及影响因素. 西昌学院学报(自然科学版). 2021(01): 70-74 .  百度学术
百度学术
9. 曾茹,李亚军,何金曼,黄晓晴,邓晓东. 清澜港近岸海湾春秋两季浮游植物群落结构特征及其与环境因子的关系. 安徽农业科学. 2021(10): 77-82+100 .  百度学术
百度学术
10. 宋高飞,朱宇轩,Anila P.Ajayan,杨丽华,贾云璐,姜传奇,毕永红. 重金属污染区秋季浮游植物群落特征及其与环境因子的关系. 水生生物学报. 2021(05): 1082-1092 .  百度学术
百度学术
其他类型引用(12)




 下载:
下载:


 粤公网安备 44010502001741号
粤公网安备 44010502001741号
