Extraction optimization and physicochemical properties of gelatin from demineralized scale of Oreochromis nilotica
-
摘要:
文章以罗非鱼(Oreochromis nilotica)鱼鳞为原料,经乙二胺四乙酸二钠(EDTA-Na2)脱钙处理后采用酸法提取明胶。根据中心组合试验设计(center combination of experimental design,CCD)原理展开试验,考察提取时间(h,X1)、提取温度(℃,X2)、浸酸时间(h,X3)和柠檬酸质量浓度(g·L-1,X4)对明胶得率(%,Y)的影响,并对所得明胶的理化性质与牛骨明胶进行比较。响应面分析结果表明,提取温度、提取时间和浸酸时间与明胶得率之间具有显著相关性;优化的提取条件为提取温度65 ℃、提取时间3.6 h、柠檬酸质量浓度200 g·L-1、浸酸时间11.3 h。在此条件下的明胶得率为28.4%,与预测值30.1%相近。制得的鱼鳞明胶粗蛋白含量为89.9%,氨基酸组成中每1 000总氨基酸残基中甘氨酸为352个,亚氨基酸(脯氨酸和羟脯氨酸)173个;凝胶强度高达245 Bloom(g),熔点为27.0 ℃,而比浓对数粘度及成胶质量浓度分别为0.030 L·g-1和8.0 g·L-1。
Abstract:According to the center combination of experimental design, we extracted the gelatin from Oreochromis nilotica scale after decalcification by acid extraction with EDTA-Na2 to study the effects of extracted time (h, X1), extracted temperature (℃, X2), acid treated time (h, X3) and citric acid concentration (g·L-1, X4) on the yield (%, Y) of gelatin, and compared the physicochemical properties of the gelatin with bovine bone gelatin.The results of response surface methodology (RSM) indicate that the extracted temperature, extracted time and acid treated time affect significantly the yield of gelatin.The optimum conditions are 200 g·L-1 citric acid concentration, 11.3 h treated time, 65 ℃ extraction temperature and 3.6 h extraction time.Under these conditions, the measured yield of gelatin is 28.4%, which is close to 30.1% of the predicted value.The content of crude protein, gel strength, melting point, logarithmic viscosity and the least concentration of the gelatin are 89.9%, 245 Bloom (g), 27.0 ℃, 0.030 L·g-1 and 8.0 g·L-1, respectively.The contents of glycine and imino acids (proline and hydroxyproline) are 352 and 173 per 1 000 total amino acids, respectively.
-
罗非鱼(Oreochromis nilotica)属鲈形目,丽鱼科,是热带性鱼类,具有生长快、肉质好和产量高等优点。中国是罗非鱼养殖规模最大的国家,2009年的总产量达125.7×104 t,其中广东省约占50%。目前,罗非鱼除部分鲜销外,主要用于加工成冻鱼片出口,产生50%~60%的下脚料,其中鱼鳞、鱼皮约占5%~6%[1]。鱼鳞中约含20%~35%粗蛋白,主要是胶原蛋白[2]。可见鱼鳞是制备明胶既丰富又经济的原料来源。
明胶是胶原蛋白局部降解产物,广泛应用于食品、化妆品及医药工业等领域。通常明胶以陆上动物的猪皮、牛皮或牛骨为提取原料。近年来由于口蹄疫和疯牛病等疾病的爆发,哺乳动物明胶的安全性备受人们的关注。目前从水产动物组织中提取明胶已成为该领域的研究热点。ZENG等[3]以罗非鱼皮为原料,采用响应面分析优化明胶提取条件对其理化性质进行分析;位绍红等[4]和张丰香等[5]也对罗非鱼鱼鳞、草鱼(Ctenopharyngodon idellus)鱼鳞明胶提取工艺进行了探讨;WANGTUEAI和NOOMHORM[6]对蜥鱼(Saurida spp.)鱼鳞明胶提取条件及性能进行了研究。然而,鱼类明胶的生产仍处于初级阶段,年产量仅占世界明胶年产量的1%[7],原料来源不足、流变性差及制备成本高是制约其大规模生产的主要因素。笔者以明胶得率为指标,通过响应面分析法优化脱钙鱼鳞明胶提取工艺,对所得明胶的理化性质与商业牛骨明胶进行比较,旨在为罗非鱼鳞高值化利用提供有效的途径。
1. 材料与方法
1.1 材料
新鲜罗非鱼鱼鳞由湛江环球水产有限公司提供,经清洗和除杂后沥干,冷冻备用。
1.2 仪器
TMS-pro质构仪[Food Technology Corperation(USA)产品],日立835-50氨基酸分析仪(日本HITACHI公司出品)。
1.3 方法
1.3.1 明胶的提取
将干净鱼鳞按料液比1:15(g·mL-1)浸泡于1.03 mol·L-1的氯化钠(NaCl)溶液中24 h,以除去非胶原成分,然后采用曾少葵等[2]的方法脱钙。鱼鳞与0.15 mol·L-1的乙二胺四乙酸二钠(EDTA-Na2)按1:15(g·mL-1)混合后浸泡6 h,用蒸馏水洗涤至pH 5~6,沥干,浸于柠檬酸溶液(料液比1:10,g·mL-1),再用蒸馏水洗涤至中性,添加5倍鱼鳞质量的蒸馏水熬胶,胶液经200目滤布过滤、60 ℃真空浓缩至10 brix后进行真空干燥(60 ℃,24 h),所得样品粉碎后即为罗非鱼鱼鳞明胶。明胶得率以蛋白质得率表示。
蛋白质得率Y(%)=m/M×100
式中M为罗非鱼鳞原料质量(g);m为明胶液蛋白质质量(g)。其中m=明胶溶液体积×溶液中蛋白质质量浓度,蛋白质测定采用考马斯亮蓝法测定[8]。
1.3.2 试验设计
1) 响应面优化设计
在单因素试验基础上,以明胶得率为响应值(Y),选取提取时间(X1)、提取温度(X2)、浸酸时间(X3)、柠檬酸浓度(X4)进行响应面优化设计,因素水平见表 1。
表 1 因素水平表Table 1. Factors and levels变量 independent variable 代号 code 水平 level -2 -1 0 1 2 提取时间/h extraction time X1 1 2 3 4 5 提取温度/℃ extraction temperature X2 45 55 65 75 85 酸处理时间/h acid treated time X3 4 8 12 16 20 柠檬酸质量浓度/g·L-1 citric acid concentration X4 5.0 100 150 200 250 2) 数据分析
采用Design Expert软件(Trail Version 7.0,Stat-Ease Inc)对试验数据进行拟合分析,其线性回归方程模型为一个描述响应量(明胶得率)与自变量关系(工艺条件)的二阶经验模型:
$$ Y=\mathtt{β}_0+\sum\limits_{i=1}^4 \mathtt{β}_i X_i+\sum\limits_{i=1}^4 \mathtt{β}_{i i} X_i^2+\sum\limits_{i=1}^3 \sum\limits_{j=i+1}^4 \mathtt{β}_{i j} X_i X_j $$ (1) 式中Y为预测的明胶得率;β0为常数项;βi,βii及βij分别为一次项、二次项和交互项的系数;Xi为自变量的编码水平,它与自变量的真实值xi的关系为:
$$ X_i=\left(X_i-X_{i 0}\right) / \Delta X_i $$ (2) 式中xi0为试验中心点处自变量真实值,Δxi为自变量的变化步长。
1.3.3 基本成分测定
水分、灰分测定参照文献[9]进行,粗蛋白测定采用凯氏定氮法[10]。所有试验均重复3次。
1.3.4 凝胶强度测定
将明胶于60 ℃水中溶解成66.7 g·L-1溶液,室温放置15 min后转入直径为4.2 cm、高为5.2 cm的称量瓶中,在8~9 ℃放置16~18 h,用TMS-Pro质构仪进行测定,采样及测定速度均为30 mm·min-1。直径为1.27 cm圆柱形探头插入明胶表面4 mm处所承受的最大力(g)为凝胶强度[11],重复测定3次。
1.3.5 比浓对数粘度测定
将50 mL、66.7 g·L-1的明胶溶液倒入乌氏粘度计(内径为0.8~0.9 mm),60 ℃水浴20 min后测定明胶溶液的流出时间,同样方法测定溶剂水的流出时间,按式(3)计算:
$$ \text { 粘度 }(\mathtt{η})=\ln \left(t_1 / t_0\right) / c $$ (3) 其中t1为明胶溶液流出时间(s),t0为溶剂流出时间(s);c为明胶溶液质量浓度(g·L-1)。
1.3.6 熔点测定
将66.7 g·L-1明胶溶液倒入15 mL试管约半管,于10 ℃中放置17~18 h,形成凝胶后加入2~3滴溴甲酚绿,并在其顶部放入一个直径为5 mm的玻璃球,然后以0.5 ℃·min-1水浴升温,当玻璃球下降到凝胶高度一半的温度即为凝胶熔点[11]。
1.3.7 成胶质量浓度测定
将明胶溶解于60 ℃蒸馏水中配成3~20 g·L-1溶液,倒入15 mL试管约半管,冰水浴(4~5℃)6 h后取出,倒置10 s而不掉下的最低质量浓度为明胶的成胶质量浓度[11]。
1.3.8 透明度测定
利用分光光度计测定66.7 g·L-1明胶溶液在630 nm处的透射比为透明度[12]。
1.3.9 氨基酸组成分析
明胶经6 mol·L-1盐酸(HCl)110 ℃水解24 h,水解液真空浓缩蒸干后溶于0.02 mol·L-1 HCl,定容后过滤,取一定量用日立835-50型高速氨基酸分析仪测定16种氨基酸,羟脯氨酸测定采用分光光度法[13]。
1.3.10 十二烷基磺酸钠聚丙烯酰胺(SDS-PAGE)电泳分析
采用LAEMMLI[14]的方法对明胶进行SDS-PAGE电泳分析。明胶溶解于60 ℃蒸馏水配成2 mg·mL-1溶液,与样品缓冲液(0.5 mol·L-1 Tris-HCl,pH 6.8,含40 g·L-1 SDS和200 g·L-1甘油)按1:1混合,100 ℃水浴3~5 min,冷却离心(10 000 g,10 min),取上清液电泳。电泳后采用含有2.5 g·L-1考马斯亮蓝R-250的甲醇-乙酸溶液染色1 h,用甲醇-乙酸溶液[V(甲醇): V(乙酸): V(水)=227:37:236]脱色,不定时更换脱色液,直至蛋白质区带清晰为止。凝胶成像系统成像。
2. 结果与讨论
2.1 回归模型的建立及显著性检验
以明胶得率为响应值(Y),试验方案及结果见表 2。运用Design-Expert 7.0软件对表 2中明胶得率试验数据进行多元回归拟合,建立提取得率与柠檬酸质量浓度、酸处理时间、提取温度及提取时间4个因子的二次多项回归方程。用t-统计量分析一次项、二次项及交互项的显著性,略去不显著项,得到回归模型:
$$ \begin{aligned} & Y=28.36+2.09 X_1-2.13 X_1 X_2-2.57 X_1^2- \\ & 2.80 X_2^2-1.15 X_3^2 \end{aligned} $$ (4) 表 2 响应面试验结果Table 2. Results of response surface experiment序号
No.变量编码 coded levels of variable 响应值 response (Y) X1 X2 X3 X4 试验值
measured value预测值
predicted value1 -1 -1 -1 -1 17.92 18.07 2 1 -1 -1 -1 25.22 27.62 3 -1 1 -1 -1 19.44 18.65 4 1 1 -1 -1 18.71 19.83 5 -1 -1 1 -1 15.81 15.17 6 1 -1 1 -1 22.75 21.34 7 -1 1 1 -1 25.79 22.09 8 1 1 1 -1 22.06 19.89 9 -1 -1 -1 1 17.08 17.21 10 1 -1 -1 1 25.89 27.66 11 -1 1 -1 1 20.93 22.20 12 1 1 -1 1 25.48 24.28 13 -1 -1 1 1 17.44 16.09 14 1 -1 1 1 25.84 23.16 15 -1 1 1 1 26.86 27.42 16 1 1 1 1 24.12 26.12 17 -2 0 0 0 12.72 14.05 18 2 0 0 0 23.35 22.30 19 0 -2 0 0 16.51 15.48 20 0 2 0 0 17.71 19.02 21 0 0 -2 0 25.92 22.89 22 0 0 2 0 21.52 21.83 23 0 0 0 -2 27.09 26.21 24 0 0 0 2 30.42 31.58 25 0 0 0 0 28.70 28.36 26 0 0 0 0 26.66 28.36 27 0 0 0 0 29.27 28.36 28 0 0 0 0 28.33 28.36 29 0 0 0 0 27.61 28.36 30 0 0 0 0 29.17 28.36 31 0 0 0 0 27.50 28.36 32 0 0 0 0 30.21 28.36 33 0 0 0 0 30.12 28.36 34 0 0 0 0 28.94 28.36 35 0 0 0 0 26.33 28.36 36 0 0 0 0 29.41 28.36 对响应面模型进行方差分析,结果见表 3。回归方程系数R2=0.847 3,失拟项不显著,表明该模型拟合程度较好[15-16],自变量与响应值之间线性关系显著,该模型可用来分析和预测罗非鱼鱼鳞提取明胶试验工艺条件。
表 3 回归模型方差分析Table 3. Analysis of variance (ANOVA) for response surface model变异来源
source of variance自由度
DF平方和
SS均方和
MSProb>F 显著性
significance回归模型 regression 14 756.20 50.01 <0.000 1 ** 残差 residual 21 141.17 6.72 失拟项 lack of fit 10 42.32 4.23 0.877 00 净误差 pure error 11 98.86 8.99 总变异 total 35 897.37 ** 注:*.差异显著(P < 0.05);**.差异极显著(P < 0.01)
Note: *.significant difference(P < 0.05); **.very significant difference (P < 0.01)2.2 响应面分析
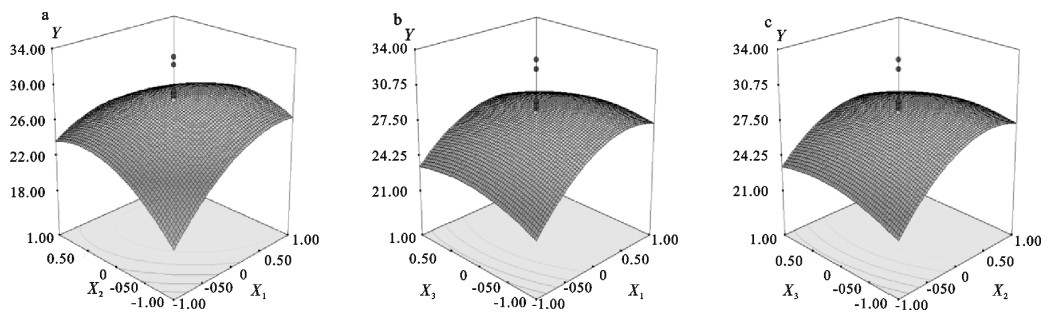
图 1反映响应函数与变量间的影响效应。在一定的因素水平范围内,明胶提取得率随着酸处理时间、提取温度及时间水平的增加而增大;但随着因素水平的进一步增大,得率反而降低。适当的酸处理有助于进一步脱钙及交联的断裂,利于胶原转化为明胶,从而获取较高的得率;但提取温度过高、酸处理过长会导致大分子蛋白质降解为小分子片段,从而在随后过滤等一系列工序中流失,使得率降低。
用回归模型优化的适宜条件X1,X2,X3及X4编码值分别为0.56,-0.04,-0.17和1.00,即提取时间为3.6 h,提取温度为65 ℃,酸处理时间为11.3 h及柠檬酸浓度为200 g·L-1,预测的明胶最大得率为30.1%。
2.3 验证试验
上述条件下的罗非鱼鱼鳞明胶得率为(28.4±1.8)%,与预测值接近。该值远高于WANGTUEAI和NOOMHORM[6]采用碱法提取的蜥鱼鱼鳞明胶得率(10.6%)、莫桑比克罗非鱼(O.mossambicus)及红罗非鱼(O.nilotica)鱼皮明胶得率(7.8%和5.4%)[17],但低于张丰香等[5]报道的混合鱼鳞得率(58%)。这与不同的鱼鳞种类、前处理及提取条件有关。
IKOMA等[18]认为,鱼鳞中的磷灰石晶格与胶原纤维平行排列存在于纤维质层中,只有经过脱钙处理才能使胶原脱离磷灰石晶格的束缚,在后续的熬胶过程中溶出并局部降解成明胶,从而提高明胶得率。因此此研究方法更具应用前景。
2.4 氨基酸组成
将所得罗非鱼鱼鳞明胶的氨基酸组成与牛骨明胶进行比较,结果见表 4。鱼鳞明胶组成中甘氨酸约占总氨基酸含量的1/3,每1 000个总氨基酸残基含173个亚氨基酸(脯氨酸和羟脯氨酸)。明胶中的甘氨酸、脯氨酸和羟脯氨酸含量是影响其凝胶强度的重要因素,尤其是亚氨基酸含量直接影响凝胶性能。通常哺乳动物明胶这3种氨基酸含量较水生动物高。笔者研究的罗非鱼鱼鳞明胶含量与牛骨明胶相似,这可能与罗非鱼是热带鱼、生活在气温较高的环境有关。FOEGEDING等[19]研究结果表明,胶原蛋白亚氨酸含量与其种类及生活习性有关,明胶的亚氨基酸含量影响其功能特性。
表 4 鱼鳞及牛骨明胶氨基酸组成(每1 000个总氨基酸残基中的残基数)Table 4. Amino acid composition of gelatins of scale and bovine bone氨基酸
amino acid鱼鳞明胶
tilapia scale gelatin牛骨明胶
bovine bone gelatin天冬氨酸 Asp 46 48 苏氨酸 Thr 21 18 丝氨酸 Ser 25 34 谷氨酸 Glu 72 82 甘氨酸 Gly 352 352 丙氨酸 Ala 132 121 缬氨酸 Val 23 26 甲硫氨酸 Met 15 3 异亮氨酸 Ile 12 12 亮氨酸 Leu 25 28 酪氨酸 Tyr 5 1 苯丙氨酸 Phe 16 14 赖氨酸 Lys 27 33 组氨酸 His 2 5 精氨酸 Arg 54 51 脯氨酸 Pro 118 99 羟脯氨酸 Hyp 55 73 氨基酸总量 total 1 000 1 000 亚氨基酸 imino acid 173 172 2.5 电泳图谱
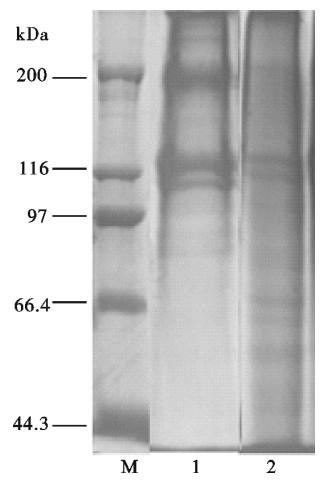
除了氨基酸组成影响明胶的功能特性外,分子量分布也是其中重要因素之一。罗非鱼鱼鳞明胶及牛骨明胶的电泳图谱见图 2。鱼鳞明胶及牛骨明胶均含有较多α链(约107 kDa),与牛骨明胶相比,鱼鳞明胶还含有β组分(200 kDa)及许多分子量﹤100 kDa的小分子片段。β组分的存在影响明胶的理化性质,因而鱼鳞明胶的凝胶强度、熔点及粘度均低于牛骨明胶。鱼鳞明胶的小分子片段可能是原料前处理时及提胶过程中胶原分子的α、β及γ组分降解产物[20-21]。这些小分子物质的存在会改变明胶的性质,如凝胶强度、熔点和凝固点等。低分子肽与明胶的低粘度、低熔点、低凝固点及凝固时间较长关系密切[22]。
2.6 明胶理化性质
比较鱼鳞明胶与牛骨明胶的理化性质,结果见表 5。除灰分外,鱼鳞明胶各项指标均优于国家标准A型骨食用明胶A级,灰分符合B级指标[9]。罗非鱼鱼鳞明胶灰分高于其鱼皮明胶(0.6%)[3],与原料中的矿质元素高(19.31%)[4]有关。笔者研究的罗非鱼鱼鳞在提取明胶前经过脱钙处理,因而灰分较蜥鱼鱼鳞明胶(2.33%)低[6]。明胶的灰分含量与原料种类、加工工艺参数有关。灰分含量的高低会影响其功能特性,低灰分含量赋予明胶更好的品质。
表 5 鱼鳞及牛骨明胶的理化性质Table 5. Physicochemical properties of gelatins of tilapia scale and bovine bone明胶
gelatin水分/%
moisture粗蛋白/%
crude protein灰分/%
ash凝胶强度/g
strength熔点/℃
melting point成胶质量浓度/g·L-1
concentration粘度/L·g-1
viscosity透明度/%
transparency鱼鳞 tilapia scale 8.4±0.3 89.9±0.2 1.7 245±2 27.0 8.0 0.030 74.9 牛骨 bovine bone 10.7±0.2 88.6±0.1 0.7 332±5 33.0 6.0 0.046 93.5 注:凝胶强度折合为含水量12%的值
Note: The gel strength is converted into value of gelatin with 12% moisture.凝胶强度、熔点及成胶质量浓度是反映明胶质量的重要指标。鱼鳞明胶的凝胶强度与蜥鱼鱼鳞明胶(240 g)[6]基本一致,却低于混合鱼鳞明胶(290 g)[5]。但后者的高强度是因为其测定时凝胶温度较低的缘故。通常鱼类明胶流变性能较哺乳动物明胶差。罗非鱼鱼鳞明胶的成胶能力、熔点及凝胶强度较牛骨明胶低,与文献报道结果一致。不仅与其灰分含量较高有关,而且受分子量的大小、氨基酸组成及分子中α/β链比例影响。一般而言,明胶氨基酸组成中的亚氨基酸含量与其凝胶强度、热稳定性及形成凝胶的能力呈正相关。由于亚氨基酸分子的吡咯烷环及氨基酸残基间的氢键限制了凝胶空间,使其结构更趋稳定。此外,脯氨酸的羟基化程度也会影响其性能。RIGBY[23]研究结果表明,胶原蛋白亚氨基酸含量相同的情况下,脯氨酸羟基化程度越高,变性温度及凝胶强度越高。显然,罗非鱼鱼鳞明胶凝胶强度低而成胶浓度高于牛骨明胶,与其羟脯氨酸含量较低有关。
比浓对数粘度也是明胶的一个重要参数。罗非鱼鱼鳞明胶的粘度比牛骨明胶要低,但高于同样温度下提取的尼罗鲈(Lates niloticus)鱼皮和鱼骨明胶(21.4 mL·g-1和24.8 mL·g-1)[11]。MUYONGA等[11]认为鱼明胶的粘度与其相对分子质量及结构有关,分子中β,γ组分含量越高,明胶的粘度越小。
罗非鱼鱼鳞明胶透明度比牛骨明胶差与其提取工艺有关。研究表明,生产过程可通过活性炭吸附法改善透明度[12],这还有待于进一步深入研究。
3. 结论
1) 响应面优化的明胶提取工艺为脱钙罗非鱼鱼鳞经200 g·L-1柠檬酸溶液浸泡3.6 h后,在65 ℃提取3.6 h,其得率高达28%。
2) 所得明胶符合国家标准,蛋白质含量、凝胶强度较高,灰分含量低,质量好。与商业牛骨明胶相比,其凝胶强度、熔点及粘度略低,可通过化学或酶法改性进一步改善其理化性质,从而达到替代哺乳动物明胶应用于食品行业的目的。
3) 罗非鱼鳞功能特性如乳化性、保湿性等还有待于进一步研究。
-
表 1 因素水平表
Table 1 Factors and levels
变量 independent variable 代号 code 水平 level -2 -1 0 1 2 提取时间/h extraction time X1 1 2 3 4 5 提取温度/℃ extraction temperature X2 45 55 65 75 85 酸处理时间/h acid treated time X3 4 8 12 16 20 柠檬酸质量浓度/g·L-1 citric acid concentration X4 5.0 100 150 200 250 表 2 响应面试验结果
Table 2 Results of response surface experiment
序号
No.变量编码 coded levels of variable 响应值 response (Y) X1 X2 X3 X4 试验值
measured value预测值
predicted value1 -1 -1 -1 -1 17.92 18.07 2 1 -1 -1 -1 25.22 27.62 3 -1 1 -1 -1 19.44 18.65 4 1 1 -1 -1 18.71 19.83 5 -1 -1 1 -1 15.81 15.17 6 1 -1 1 -1 22.75 21.34 7 -1 1 1 -1 25.79 22.09 8 1 1 1 -1 22.06 19.89 9 -1 -1 -1 1 17.08 17.21 10 1 -1 -1 1 25.89 27.66 11 -1 1 -1 1 20.93 22.20 12 1 1 -1 1 25.48 24.28 13 -1 -1 1 1 17.44 16.09 14 1 -1 1 1 25.84 23.16 15 -1 1 1 1 26.86 27.42 16 1 1 1 1 24.12 26.12 17 -2 0 0 0 12.72 14.05 18 2 0 0 0 23.35 22.30 19 0 -2 0 0 16.51 15.48 20 0 2 0 0 17.71 19.02 21 0 0 -2 0 25.92 22.89 22 0 0 2 0 21.52 21.83 23 0 0 0 -2 27.09 26.21 24 0 0 0 2 30.42 31.58 25 0 0 0 0 28.70 28.36 26 0 0 0 0 26.66 28.36 27 0 0 0 0 29.27 28.36 28 0 0 0 0 28.33 28.36 29 0 0 0 0 27.61 28.36 30 0 0 0 0 29.17 28.36 31 0 0 0 0 27.50 28.36 32 0 0 0 0 30.21 28.36 33 0 0 0 0 30.12 28.36 34 0 0 0 0 28.94 28.36 35 0 0 0 0 26.33 28.36 36 0 0 0 0 29.41 28.36 表 3 回归模型方差分析
Table 3 Analysis of variance (ANOVA) for response surface model
变异来源
source of variance自由度
DF平方和
SS均方和
MSProb>F 显著性
significance回归模型 regression 14 756.20 50.01 <0.000 1 ** 残差 residual 21 141.17 6.72 失拟项 lack of fit 10 42.32 4.23 0.877 00 净误差 pure error 11 98.86 8.99 总变异 total 35 897.37 ** 注:*.差异显著(P < 0.05);**.差异极显著(P < 0.01)
Note: *.significant difference(P < 0.05); **.very significant difference (P < 0.01)表 4 鱼鳞及牛骨明胶氨基酸组成(每1 000个总氨基酸残基中的残基数)
Table 4 Amino acid composition of gelatins of scale and bovine bone
氨基酸
amino acid鱼鳞明胶
tilapia scale gelatin牛骨明胶
bovine bone gelatin天冬氨酸 Asp 46 48 苏氨酸 Thr 21 18 丝氨酸 Ser 25 34 谷氨酸 Glu 72 82 甘氨酸 Gly 352 352 丙氨酸 Ala 132 121 缬氨酸 Val 23 26 甲硫氨酸 Met 15 3 异亮氨酸 Ile 12 12 亮氨酸 Leu 25 28 酪氨酸 Tyr 5 1 苯丙氨酸 Phe 16 14 赖氨酸 Lys 27 33 组氨酸 His 2 5 精氨酸 Arg 54 51 脯氨酸 Pro 118 99 羟脯氨酸 Hyp 55 73 氨基酸总量 total 1 000 1 000 亚氨基酸 imino acid 173 172 表 5 鱼鳞及牛骨明胶的理化性质
Table 5 Physicochemical properties of gelatins of tilapia scale and bovine bone
明胶
gelatin水分/%
moisture粗蛋白/%
crude protein灰分/%
ash凝胶强度/g
strength熔点/℃
melting point成胶质量浓度/g·L-1
concentration粘度/L·g-1
viscosity透明度/%
transparency鱼鳞 tilapia scale 8.4±0.3 89.9±0.2 1.7 245±2 27.0 8.0 0.030 74.9 牛骨 bovine bone 10.7±0.2 88.6±0.1 0.7 332±5 33.0 6.0 0.046 93.5 注:凝胶强度折合为含水量12%的值
Note: The gel strength is converted into value of gelatin with 12% moisture. -
[1] 陈胜军, 李来好, 杨贤庆, 等. 罗非鱼综合加工利用与质量安全控制技术研究进展[J]. 南方水产科学, 2011, 7(4): 85-90. doi: 10.3969/j.issn.2095-0780.2011.04.013 [2] 曾少葵, 蓝海明, 章超桦, 等. 罗非鱼鳞胶原蛋白的提取及其酶解产物抗氧化性研究[J]. 上海海洋大学学报, 2009, 18(5): 599-603. [3] ZENG S K, YAN X Y, CAO W H, et al. Optimization of extraction conditions and characteristics of skin gelatin from Nile tilapia (Oreochromis niloticus)[J]. Int J Food Sci Technol, 2010, 45(9): 1807-1813. doi: 10.1111/j.1365-2621.2010.02332.x
[4] 位绍红, 许永安, 吴靖娜. 罗非鱼鱼鳞提取明胶的工艺研究[J]. 渔业科学进展, 2010, 31(3): 66-76. doi: 10.3969/j.issn.1000-7075.2010.03.010 [5] 张丰香, 王璋, 许时婴. 鱼鳞明胶提取工艺[J]. 食品与发酵工业, 2008, 34(9): 96-100. https://www.cnki.com.cn/Article/CJFDTotal-SPFX200809030.htm [6] WANGTUEAI S, NOOMHORM A. Processing optimization and characterization of gelatin from lizard fish (Saurida spp. ) scales[J]. LWT, 2009, 42(4): 825-834. doi: 10.1016/j.lwt.2008.11.014
[7] ARNESEN J A, GILDBERG A. Extraction of muscle proteins and gelatin from cod head[J]. Process Biochem, 2006, 41(3): 697-700. doi: 10.1016/j.procbio.2005.09.001
[8] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72(1/2): 248- 254. doi: 10.1016/0003-2697(76)90527-3
[9] 曾国爱, 刘维树, 夏志远, 等. 中华人民共和国国家标准GB 6783-1994食品添加剂明胶[S]. 北京: 中国标准出版社, 1995: 1-13. [10] 中国标准出版社. 食品安全国家标准GB 5009.5-2010食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2010: 1-9. https://www.doc88.com/p-7905821558162.html?r=1 [11] MUYONGA J H, COLE C G B, DUODU K G. Extraction and physicochemical characterisation of Nile perch (Lates niloticus) skin and bone gelatin[J]. Food Hydrocolloid, 2004, 18(4): 581-592. doi: 10.1016/j.foodhyd.2003.08.009
[12] 曾少葵, 杨萍, 邓楚津, 等. 罗非鱼皮明胶的脱腥方法及理化性质[J]. 水产学报, 2010, 34(3): 349-356. https://lib.cqvip.com/Qikan/Article/Detail?id=33513358&from=Qikan_Article_Detail [13] IGNAT'EVA N Y U, DANILOV N A, AVERKIEV S V, et al. Determination of hydroxyproline in tissues and the evaluation of the collagen content of the tissues[J]. J Anal Chem, 2007, 62(1): 51-57. doi: 10.1134/S106193480701011X
[14] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227(5259): 680-685. https://www.nature.com/articles/227680a0
[15] HABER A, RUNYOU R. General statistics[M]. 3rd ed. Henika: Addison-Wesley, Reading, 1977: 25, 41, 94.
[16] KONG Q, HE G Q, CHEN Q H, et al. Optimization of medium composition for cultivating clostridium butyricum with response surface methodology[J]. J Food Sci, 2004, 69(7): 163-168. doi: 10.1111/j.1365-2621.2004.tb13614.x
[17] JAMILAH B, HARVINDER K G. Properties of gelatins from skins of fish-black tilapia (Oreochromis mossambicus) and red tilapia (Oreochromis nilotica)[J]. Food Chem, 2002, 77(1): 81-84. https://www.sciencedirect.com/science/article/abs/pii/S0308814601003284
[18] IKOMA T, KOBAYASHI H, TANAKA J, et al. Microstructure, mechanical and biomimetic properties of fish scales from Pagrus major[J]. J Struct Biol, 2003, 142(3): 327-333. doi: 10.1016/s1047-8477(03)00053-4
[19] FOEGEDING E, LANIER T C, HULTIN H O. Characteristics of edible muscle tissue[M]// FENNEMA O R. Food chemistry (3rd ed). New York: Marcel Dekker, 1996: 879-942. doi: 10.1016/S0268-005X(01)00035-2
[20] GÓMEZ-GUILLÉN M C, TURNAY J, FERNÁNDEZ-DÍAZ M D, et al. Structural and physical properties of gelatin extracted from different marine species: a comparative study[J]. Food Hydrocolloid, 2002, 16(1): 25-34. doi: 10.1016/S0268-005X(01)00035-2
[21] GIMéNEZA B, TURNAYB J, LIZARBEB, M A, et al. Use of lactic acid for extraction of fish skin gelatin[J]. Food Hydrocolloid, 2005, 19(6): 941-950. doi: 10.1016/j.foodhyd.2004.09.011
[22] ZHOU P, MULVANEY S J, REGENSTEIN J M. Properties of Alaska pollock skin gelatin: a comparison with tilapia and pork skin gelatins[J]. J Food Sci, 2006, 71(6) : C313-C321. doi: 10.1111/j.1750-3841.2006.00065.x
[23] RIGBY B J. Amino acid composition and thermal stability of the skin collagen of the Antarctic ice-fish[J]. Nature, 1968, 219(5150): 166-167. https://www.nature.com/articles/219166a0



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
