Research progress in detection and preparation methods for tetrodotoxin
-
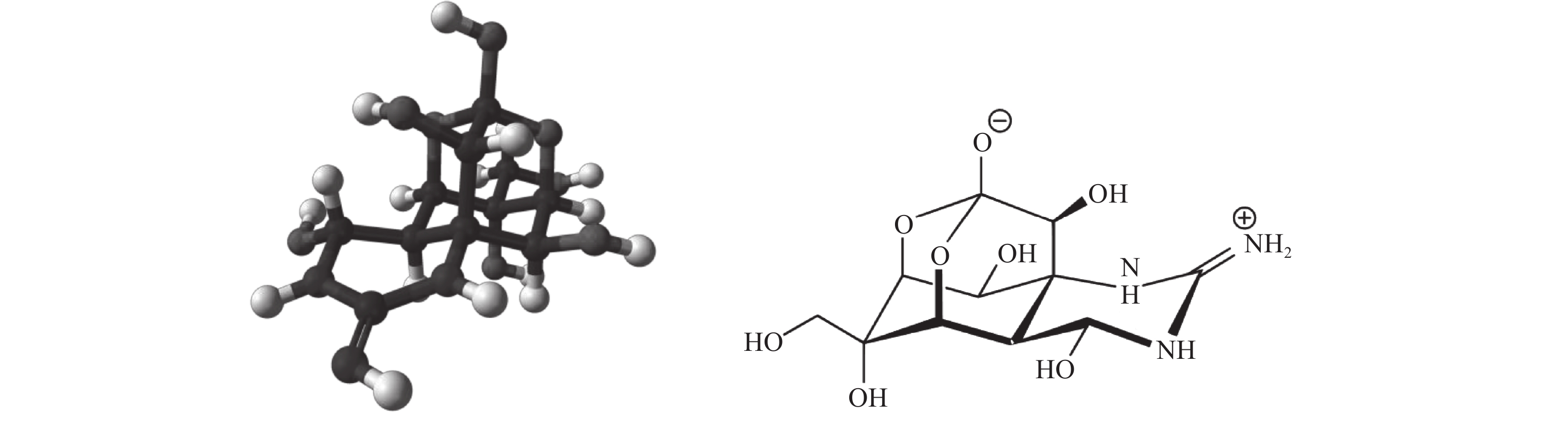
摘要: 河豚毒素为一类自然界广泛分布的神经性毒素,毒性极强,可通过阻碍钠离子通道而抑制神经传导,使神经麻痹而导致死亡,成为威胁水产品质量安全的重要风险隐患之一,受到国际社会重点关注而被严格管控。同时,河豚毒素具有镇静、镇痛和麻醉等药理作用,在临床医疗方面应用前景广泛。河豚毒素的检测方法主要有生物法、免疫法和仪器分析法等3大类。但由于缺乏高获得率、高分离度的纯化工艺和制备技术,难以大批量生产高纯度的河豚毒素,成为临床应用和安全管控的难点。文章概述了河豚毒素检测和制备方法的研究进展,并对各种方法的适用性及存在的问题进行了综述。Abstract: Tetrodotoxin is a widely distributed neurogenic toxin with severe toxicity which can lead to nerve paralysis and cause death by blocking sodium channels and nerve conduction. As one of the most critical risks that threaten the safety of aquatic products, it is strictly controlled by international community. Meanwhile, tetrodotoxin can be used in clinical practice for sedation, analgesia and anesthesia, and has comprehensive application foreground. There are three main methods to detect tetrodotoxin (bioassay, immunoassay and instrumental method). However, it is difficult to produce high-purity tetrodotoxin in enormous quantity because of lack of purification and preparation technology with high separation efficiency and high yield. The paper reviews the research progress in the determination and preparation of tetrodotoxin method, and summerizes the applicability and problem of each method, which provides references for further study.
-
Keywords:
- tetrodotoxin /
- detection method /
- preparation /
- purification
-
长心卡帕藻(Kappaphycus alvarezii)隶属于红藻门、红藻纲、杉藻目、红翎菜科、卡帕藻属[1],主要分布在热带和亚热带海区,因富含κ-卡拉胶,是国际主要栽培经济红藻之一,也是提取卡拉胶的主要原料。根据FAO统计,2010年全球长心卡帕藻(包括麒麟菜)养殖产量达到560×104 t[26],是产量最高的养殖种类。
长心卡帕藻的苗种繁育和生长主要通过营养繁殖进行。因此,国内外学者已在长心卡帕藻外植体消毒[2]、生态型差异[3-6]、光合作用与生态效应[7-8]、原生质体与组织培养[9-12]、海区栽培[13-17]等方面开展了大量的研究工作。作为营养繁殖种类,长心卡帕藻的生长主要依赖于芽发生和分枝的生长,但在其生长方式方面,学者间存在着不同的认识。POLNE-FULLER和GIBOR[9]认为长心卡帕藻的类愈伤组织源于皮层细胞;DAWES和KOCH[10]则认为类愈伤组织可能起源于髓部细胞;ROBAINA等[11]重点研究了不同培养液与类愈伤组织形成及芽生长的影响;HAYASHI等[12]详细探讨了不同培养液以及不同植物生长调节剂对微繁殖体生长的影响。但迄今为止,在切段方式及培养条件对长心卡帕藻芽分生及生长状况方面尚未见报道。
中国海南岛海区出现了栽培的异枝卡帕藻(K.striatum)大规模死亡事件以来,自2008年起先后从菲律宾、越南、印度尼西亚等国家新引进长心卡帕藻(绿色株型为主)进行试养,但苗种扩繁及度夏技术仍不成熟,养殖业仍然无法得到有效恢复。文章研究了长心卡帕藻外植体组织培养生长适宜温度,并且比较了温度条件、切段长度、切段方式等对再生芽生长的影响,以期为长心卡帕藻的种质保存及苗种快繁提供技术支持。
1. 材料与方法
1.1 材料来源
长心卡帕藻由中国海洋大学大型海藻种质资源库提供(种质编号201103140),2011年3月采集于海南省陵水县黎安港(18.38°N,110.46°E)。
1.2 试验材料预处理方法
选择颜色正常、无腐烂、生长旺盛的植株,清理藻体表面污泥及杂藻,经0.01%氯化汞(HgCl2)处理15 s,无菌海水冲洗干净;在生物安全柜中进行无菌切段处理。
1.3 最适生长温度筛选
选取5 cm切段放置于500 mL锥形瓶中培养,加入500 mL培养液。培养液为煮沸消毒的天然海水,硝酸钠(NaNO3)24.3 mg · L-1,磷酸二氧钾(KH2PO4)1.75 mg · L-1。光照强度62.5 μmol·(m2 · s)-1,光照周期12 h∶ 12 h。培养温度设置为(10±1)℃、(15±1)℃、(20±1)℃、(25±1)℃和(30±1)℃ 5组,每组设置5个平行。分别称量培养前和培养后(10 d后)切段鲜质量。
1.4 芽诱导条件
分别以1 cm、3 cm和5 cm作为切段长度,芽诱导温度设置为(20±1)℃和(25±1)℃;分别沿藻体纵轴进行横切(90°)和斜切(45°);对5 cm切段,增设剥除3 mm×5 mm大小的2片皮层试验组。
每试验组切段为20株,培养条件同1.3。每7 d更换培养液,每2 d观察并记录出芽位置及数量。
1.5 数据处理与分析
增重率(%)=(最终鲜质量-初始鲜质量)/初始鲜质量×100
个体平均出芽数(个)=出芽总数/切段总数
出芽率(%)=100×已出芽个体数/总个体数
试验数据利用SPSS 13.0软件进行均值计算和方差分析。
2. 结果
2.1 最适生长温度
试验范围内,长心卡帕藻外植体切段生长适温为15~25 ℃,平均增重率为2.48 %~14.90 %;外植体切段最适生长温度为20 ℃,平均增重率为14.90%,且与其余各试验组差异极其显著(表 1),鲜质量倍增时间约为47 d[log(1+0.0149)2=46.9]。
表 1 长心卡帕藻切段在不同温度下培养10 d后的鲜质量增长变化Table 1. Weight gain of K.alvarezii cultured for 10 d at different temperatures温度/℃ temperature 初始鲜质量/g initial weight 最终鲜质量/g final weight 平均增重率/% average weight gain rate 10 0.35±0.26 0.34±0.25 -1.88±1.43 15 0.42±0.15 0.43±0.15 2.48±0.94 20 0.40±0.02 0.46±0.03 14.90±1.12b 25 0.43±0.02 0.48±0.03 10.83±0.71a 30 0.23±0.03 0.20±0.02 -9.44±1.33a 注:a. 差异显著(P < 0.05);b. 差异极显著(P < 0.01);后表同此
Note:a. significant difference (P < 0.05);b. very significant difference(P < 0.01). The same case in the following tables.2.2 芽诱导条件
诱导温度、切段长度和切段方式对长心卡帕藻外植体切段的出芽均存在着显著影响,且各因素交互影响极其显著(P < 0.01)(表 2)。培养27 d后,25 ℃下的各试验组出芽数量均显著高于20 ℃试验组(P < 0.01)(图 1-a),较高的培养温度对于长心卡帕藻外植体切段出芽具有明显的促进作用。试验范围内,25 ℃、1 cm、横切试验组个体平均出芽数最高(1.50个),为长心卡帕藻最优的出芽诱导条件。
表 2 长心卡帕藻培养27 d发芽情况统计Table 2. Statistics of germination of K.alvarezii cultured for 27 d编号 No. 温度/℃ temperature 切段方式 cutting way 切段长度/cm cutting length 个体数/个 number of individuals 发芽率/%g ermination rate 个体平均出芽数/个 average number of buddings 1 25 横切 1.0 20 100 1.50±0.05 b 2 25 横切 3.0 20 100 1.40±0.04 b 3 25 横切 5.0 20 100 1.10±0.04 b 4 25 斜切 1.0 20 100 1.35±0.05 b 5 25 斜切 3.0 20 50 0.50±0.05 6 25 斜切 5.0 20 40 0.90±0.10 b 7 20 横切 1.0 20 85 1.30±0.06 b 8 20 横切 3.0 20 30 0.30±0.04 b 9 20 横切 5.0 20 40 1.00±0.12 b 10 20 斜切 1.0 20 40 0.40±0.04 b 11 20 斜切 3.0 20 20 0.20±0.03 b 12 20 斜切 5.0 20 40 0.50±0.06 13 25 横切去皮层 5.0 20 30 0.80±0.11 b 14 20 横切去皮层 5.0 20 30 0.50±0.07 25℃下不同切段方式的出芽率和出芽数量结果见表 2。横切试验组发芽率均为100%,个体平均出芽数为1.10~1.50个;而斜切试验组中1 cm切段发芽率和个体平均出芽数最高,分别为100%和1.35个。试验结果显示,25 ℃培养、相同切段长度的横切试验组平均个体出芽数均大于斜切试验组(P < 0.01),表明横切方式有利于促进长心卡帕藻外植体切段出芽(图 1-b)。
在相同的切段方式下,1 cm切段组个体平均出芽数极其显著优于3 cm组和5 cm组(P < 0.01),表明短切段有助于提高长心卡帕藻外植体出芽的数量。
2.3 切段出芽过程
25 ℃、1 cm的横切试验组(图 2),培养第15天开始出芽,第23天发芽率已经达到100%;个体平均出芽数于培养第29天达到最大值(1.60个),但在培养第23天时出现了缓慢增长趋势;相对而言,略低于YUNQUE等[2]的研究结果,其认为25 ℃、pH=8.7出芽数量最多,个体平均出芽数约为1.80个,并且在培养第19天开始出芽。
2.4 出芽方式
长心卡帕藻外植体切段出芽方式主要包括了2种方式:1)位于切面的再生芽; 2)非切面发生的新生芽(图 3)。试验结果显示,切段长度是影响出芽方式的主要因素(表 3),1 cm和3 cm切段组均为切面的再生芽,而5 cm切段组则包括了再生芽和新生芽。
表 3 横切处理组再生芽与新生芽数比较Table 3. Comparison of regeneration bud and newborn bud in transection group切段长度/cm cutting length 再生芽/个 regeneration bud 新生芽/个 newborn bud 1 27.0±1.4 a 0 3 14.5±12.0 0 5 1.5±0.7 11.0±8.5 去皮层(5 cm)decortication 1.0±0.0 12.0±4.2 ![]() 图 3 长心卡帕藻切段培养试验结果(27 d)a. 25 ℃, 1 cm横切;b. 25 ℃,1 cm斜切;c. 25 ℃,3 cm横切;d. 25 ℃,3 cm斜切;e. 20 ℃,5 cm横切;f. 25 ℃,去皮层处理Figure 3. Results of segment culture of K.alvarezii (27 d)a. 25 ℃, 1 cm transected cutting; b. 25 ℃, 1 cm inclined cutting; c. 25 ℃, 3 cm transected cutting; d. 25 ℃, 3 cm inclined cutting; e.20 ℃, 5 cm transected cutting; f. 25 ℃, cortex cutting
图 3 长心卡帕藻切段培养试验结果(27 d)a. 25 ℃, 1 cm横切;b. 25 ℃,1 cm斜切;c. 25 ℃,3 cm横切;d. 25 ℃,3 cm斜切;e. 20 ℃,5 cm横切;f. 25 ℃,去皮层处理Figure 3. Results of segment culture of K.alvarezii (27 d)a. 25 ℃, 1 cm transected cutting; b. 25 ℃, 1 cm inclined cutting; c. 25 ℃, 3 cm transected cutting; d. 25 ℃, 3 cm inclined cutting; e.20 ℃, 5 cm transected cutting; f. 25 ℃, cortex cutting对比5 cm切段试验组中剥除部分皮层对切段出芽的影响(表 2),其明显抑制了切段的总体出芽数量(P < 0.01)。因此,保留皮层有助于提高出芽数量。在出芽方式上,剥除部分皮层则有助于促进新生芽的发生(表 3)。但是剥除部分皮层明显阻碍了个体出芽,未去皮层组的个体平均出芽数远高于去皮层组(图 4)。
3. 讨论
长心卡帕藻的温度生长表现出明显的热带海藻的生物学特性。在笔者试验范围内,其生长适宜温度为15~25 ℃。不同的环境条件对长心卡帕藻的生长具有明显的影响。长心卡帕藻的营养生长包括了出芽和芽的生长、分枝直径的增长。而环境决定了长心卡帕藻生长速度,尤其是室外培养生长率远高于室内培养,在之前的研究中,紫外线过滤、中盐[19]、高温、短的培养周期、浅水海域及低密度栽植等条件可显著促进长心卡帕藻生长,最高日生长速率可达7.27% ·d-1[14-5, 17, 20-21]。相对而言,在室内培养中,出芽数量和芽的生长是决定长心卡帕藻生长的主要因素。在笔者试验中,20 ℃培养长心卡帕藻切段10 d的增重率最高(达14.90%),远高于赵素芬和何培民[18]的1.05% · d-1的试验结果,显示出此试验建立的切段培养体系对外植体切段营养繁殖具有良好的促进作用。
此试验条件下,长心卡帕藻外植体切段培养最适出芽温度为25 ℃,其中1 cm、横切试验组个体平均出芽数最高(1.50个),为最优的出芽诱导条件。在对比温度、切段长度以及横切和斜切2种切段方式等不同条件来看,诱导温度、切段长度和切段方式均对出芽存在着显著影响。25 ℃较20 ℃可促进切段的出芽,与YUNQUE等[2]的研究结果一致。相对而言,切段长度较切段方式对出芽率和出芽数量的影响更为明显,短的切段(1 cm)以及横切(与藻体纵轴呈90°)有助于芽的发生。较长的切段(5 cm)抑制了横切面的再生芽发生数量,出芽部位主要集中在非切面的围周部皮层,并且显著促进了新生芽的发生。剥除部分皮层组织切段的培养结果显示,新生芽的比例远高于再生芽,而再生芽的发生可能主要源于髓部组织的分化,这与DAWES和KOCH[10]的观点相同,但其再生能力弱于皮层分生的新生芽。长心卡帕藻养殖主要是利用其良好的营养繁殖能力,以分枝方式进行吊养。因此,其生长方式主要是依靠新生芽的分化和生长来实现。而对于组织快繁苗种培养而言,根据笔者试验的结果,则应选择较短的组织切段来实现,提高其髓部再生芽的分生。在试验中增加髓部切面面积(斜切)并未明显的增加再生芽的数量,主要的原因可能在于切面细胞整体分化能力,而并非是由于切面细胞数量变化引起。关于再生芽的发生,有学者认为是由于皮层细胞或者是髓部细胞发生的类愈伤组织进一步分化[9-10],而类愈伤组织分化部位的不同可能是培养基渗透压和琼脂含量的差异导致;但同时也有学者认为与琼脂含量无关[22];在类愈伤组织分化包括了纤维状类愈伤组织或致密型类愈伤组织2种类型[9, 23-25],而精胺处理则可提高类愈伤组织诱导效率。普遍认为纤维状类愈伤组织与再生芽的发生具有密切的联系,而笔者试验条件中再生芽发生试验结果显示,长心卡帕藻外植体切段大小及方式也与类愈伤组织分化具有明显的关系,进一步优化培养条件、促进再生芽的发生效率将对于长心卡帕藻组织快繁具有重要的现实意义。
最近的5年中,长心卡帕藻养殖业在亚洲东南部国家以及非洲坦桑尼亚的蓬勃发展,使之包括麒麟菜在内的养殖产量已超过了海带,成为全球最大宗的水生植物种类[26]。其产品除了可以作为海洋蔬菜食品外,还可以作为鲍养殖饵料,尤其是作为卡拉胶提取原料得到了广泛应用。依赖于营养繁殖进行种苗繁育,毫无疑问将占据大量的养殖环境,尤其是对于中国而言,适宜进行苗种繁育度夏的海域仍主要集中在海南三亚周边,受到养殖环境空间、蓝子鱼害以及多数海域夏季台风影响强烈等限制,最近5年中国长心卡帕藻养殖苗种完全依赖于海南省陵水县黎安港海域,苗种繁育规模十分有限。如何快速获得大量长心卡帕藻苗种,将是中国当前和未来长心卡帕藻养殖业发展的主要技术瓶颈。笔者通过试验研究,揭示了长心卡帕藻切段生长的环境及藻体处理方法等主要影响因素。在培养过程中,控制培养温度和切段长度可有效地促进再生芽的发生,以提高长心卡帕藻的营养繁殖效率,从而快速获得大量长心卡帕藻苗种。
-
表 1 不同TTX检测方法的原理及优缺点比较
Table 1 Comparison of principles, advantages and disadvantages of different TTX detection methods
检测方法
detection method类型
type原理
principle优点
advantage缺点
disadvantage生物法
bioassay小鼠生物法、离体组织法、组织培养法、生物检测器法 基于TTX阻断Na+通道的特性 操作简便,无需特殊设备 重现性差,结果不稳定 免疫法
immunoassay酶联免疫吸附法、免疫层
析法利用抗原、抗体的高度特异性结合反应 简单快捷,单次检测成
本低抗体制备困难,易出现假
阳性仪器分析法 instrumental method 荧光分光光度法、色谱法
色谱-质谱联用法基于TTX的理化性质 灵敏度高、特异性强、重现性好 检测成本高、耗时长,对设备要求高 -
[1] 方国锋, 王锡昌, 陶宁萍, 等. 河豚毒素的样品前处理与快速检测技术研究进展[J]. 分析测试学报, 2014, 33(12): 1447-1452. [2] 郭瑞霞, 李力更, 王磊, 等. 天然药物化学史话: 河豚毒素[J]. 中草药, 2014, 45(9): 1330-1335. [3] FUHRMAN F A. Tetrodotoxin, tarichatoxin, and chiriquitoxin: historical perspectives[J]. Ann New York Acad Sci, 1986, 479: 1-14.
[4] TAHARA Y. Uber das tetrodongift[J]. Biochem Z, 1910, 30: 255-275.
[5] MIYAZAWA K, NOGUCHI T. Distribution and origin of tetrodotoxin[J]. J Toxicol: Toxin Rev, 2001, 20(1): 11-33.
[6] YASUMOTO T, NAGAI H, YASUMURA D, et al. Interspecies distribution and possible origin of tetrodotoxin[J]. Ann New York Acad Sci, 1986, 479: 44-51.
[7] 王丽雅, 陶宁萍, 龚玺. 河豚的食用安全性及营养价值研究进展[J]. 上海农业学报, 2012, 28(2): 123-128. [8] 代秀梅, 庾莉菊, 张启明, 等. 河豚毒素的医药开发前景[J]. 药品评价, 2008, 5(5): 230-232. [9] HAGEN N A, SOUICH P D, LAPOINTE B, et al. Tetrodotoxin for moderate to severe cancer pain: a randomized, double blind, parallel design multicenter study[J]. J Pain Symptom Manage, 2008, 35(4): 420-429.
[10] 王冠男, 谢丽萍, 张荣庆. 河豚毒素的分布及动物对它的拮抗作用[J]. 海洋通报, 2007, 26(1): 107-113. [11] 王静, 杨丽君, 李兆杰, 等. 昆明系小鼠生物法定量测定水产品中河豚毒素[J]. 食品科学, 2011, 32(4): 181-184. [12] 殷芹. 小鼠法和高效液相色谱法测定野生河鲀不同组织内河豚毒素的含量[D]. 青岛: 中国海洋大学, 2009: 10-25. [13] OGURA Y, MORI Y. Mechanism of local anesthetic action of crystalline tetrodotoxin and its derivatives[J]. Eur J Pharmacol, 1968, 3(1): 58-67.
[14] VIEYTES M R, CABADO A G, ALFONSO A, et al. Solid-phase radioreceptor assay for paralytic shellfish toxins[J]. Anal Biochem, 1993, 211(1): 87-93.
[15] DAVIO S R, FONTELO P A. A competitive displacement assay to detect saxitoxin and tetrodotoxin[J]. Anal Biochem, 1984, 141(1): 199-204.
[16] GALLACHER S, BIRKBECK T H. A tissue culture assay for direct detection of sodium channel blocking toxins in bacterial culture supernates[J]. Fems Microbiol Lett, 1992, 71(1): 101-107.
[17] 丛蕾. 河豚毒素特异性单克隆抗体的制备[D]. 上海: 上海海洋大学, 2010: 9-11. [18] WATABE S, SATO Y, NAKAYA M, et al. Monoclonal antibody raised against tetrodonic acid, a derivative of tetrodotoxin[J]. Toxicon, 1989, 27(2): 265-268.
[19] REVERTÉ L, RAMBLA-ALEGRE M, LEONARDO S, et al. Development and validation of a maleimide-based enzyme-linked immunosorbent assay for the detection of tetrodotoxin in oysters and mussels[J]. Talanta, 2018, 176: 659-666.
[20] KAWATSU K, SHIBATA T, HAMANO E. Application of immunoaffinity chromatography for detection of tetrodotoxin from urine samples of poisoned patients[J]. Toxicon, 1999, 37(2): 325-333.
[21] DZANTIEV B B, BYZOVA N A, URUSOV A E, et al. Immunochromatographic methods in food analysis[J]. TrAC-Trend Anal Chem, 2014, 55: 81-93.
[22] ZHOU Y, LI Y S, LU S Y, et al. Gold nanoparticle probe-based immunoassay as a new tool for tetrodotoxin detection in puffer fish tissues[J]. Sens Actuators B Chem, 2010, 146(1): 368-372.
[23] LING S M, CHEN Q A, ZHANG Y M, et al. Development of ELISA and colloidal gold immunoassay for tetrodotoxin detetcion based on monoclonal antibody[J]. Biosens Bioelectron, 2015, 71: 256-260.
[24] SHEN H C, ZHANG S W, FU Q Q, et al. A membrane-based fluorescence-quenching immunochromatographic sensor for the rapid detection of tetrodotoxin[J]. Food Control, 2017, 81: 101-106.
[25] NUÑEZ M T, FISCHER S, JAIMOVICH E. A fluorimetric method to determine tetrodotoxin[J]. Anal Biochem, 1976, 72(1): 320.
[26] NAKAYAMA T, TERAKAWA S. A rapid purification procedure for tetrodotoxin derivatives by high-performance liquid chromatography[J]. Anal Biochem, 1982, 126(1): 153-155.
[27] BONTEMPS J, GRANDFILS C, DANDRIFOSSE G, et al. Binding of [3H]ethylenediamine di-tetrodotoxin to its solubilized receptor from excitable tissues. Binding measurements by rapid gel-filtration and receptor stabilization by phosphatidylcholine[J]. Arch Int Physiol Biochimie, 1984, 92(1): 39-45.
[28] 岑剑伟, 李来好, 杨贤庆, 等. 水产品中河鲀毒素的高效液相紫外测定法[J]. 中国水产科学, 2010, 17(5): 1036-1044. [29] 郑雍怡, 王彦, 张计, 等. 反相离子对高效液相色谱法测定SD大鼠血浆中河豚毒素的含量[J]. 分析化学, 2008, 36(5): 588-592. [30] 刘海新, 张农, 董黎明, 等. 柱后衍生高效液相色谱法测定水产品中河豚毒素含量[J]. 水产学报, 2006, 30(6): 812-817. [31] ONOUE Y, NOGUCHI T, NAGASHIMA Y, et al. Separation of tetrodotoxin and paralytic shellfish poisons by high-performance liquid chromatography with a fluorometric detection using o-phthalaldehyde[J]. J Chromatogr, 1983, 257(2): 373.
[32] TANIS D, VARELTZIS P, NIKOLAIDES G A, et al. Evaluation of helically coiled and knitted open tubular reactors for the efficient post-column determination of tetrodotoxin by high-performance liquid chromatography[J]. Anal Lett, 2017, 50(2): 271-293.
[33] SUENAGA K, KOTOKU S. Detection of tetrodotoxin in autopsy material by gas chromatography[J]. Arch Toxicol, 1980, 44(4): 291-297.
[34] MAN C N, NOOR N M, HARN G L, et al. Screening of tetrodotoxin in puffers using gas chromatography-mass spectrometry[J]. J Chromatogr A, 2010, 1217(47): 7455-7459.
[35] STAN'KOV I N, KONDRAT'EV V B, DEREVYAGINA I D, et al. Gas-chromatographic determination of trace amounts of tetrodotoxin in water, drugs, and blood plasma[J]. J Anal Chem, 2016, 71(3): 289-296.
[36] 黄清发, 孙振中, 戚隽渊, 等. 河鲀毒素固相萃取-气相色谱-质谱法研究[J]. 上海海洋大学学报, 2012, 21(6): 1058-1063. [37] TSAI Y H, HWANG D F, CHENG C, et al. Determination of tetrodotoxin in human urine and blood using C18 cartridge column, ultrafiltration and LC-MS[J]. J Chromatogr B, 2006, 832(1): 75-80.
[38] BANE V, HUTCHINSON S, SHEEHAN A, et al. LC-MS/MS method for the determination of tetrodotoxin (TTX) on a triple quadruple mass spectrometer[J]. Food Addit Contam A, 2016, 33(11): 1728-1740.
[39] SHALABAI V V, TARANCHENKO V F, RYBAL'CHENKO I V, et al. Use of high-performance liquid chromatography coupled with high-resolution mass spectrometry for the identification and quantitative determination of tetrodotoxin in pharmaceuticals[J]. J Anal Chem, 2017, 72(6): 632-638.
[40] JEN H, NGUYEN T A, WU Y, et al. Tetrodotoxin and paralytic shellfish poisons in gastropod species from Vietnam analyzed by high-performance liquid chromatography and liquid chromatography-tandem mass spectrometry[J]. J Food Drug Anal, 2014, 22(2): 178-188.
[41] 骆和东, 贾玉珠, 朱宝平. 固相萃取-超过滤-液相色谱/质谱联用法测定织纹螺中的河豚毒素[J]. 色谱, 2007, 25(6): 917-921. [42] 吴佳俊, 黄文雯, 肖陈贵, 等. 高效液相色谱-串联质谱法检测河豚毒素的方法研究[J]. 食品安全质量检测学报, 2014, 5(11): 3529-3536. [43] 严忠雍, 张小军, 李奇富, 等. 免疫亲和柱净化-液相色谱-串联质谱法测定海洋生物中河豚毒素[J]. 分析化学, 2015, 43(2): 277-281. [44] GUO M M, WU H Y, JIANG T, et al. Simultaneous identification and quantification of tetrodotoxin in fresh pufferfish and pufferfish-based products using immunoaffinity columns and liquid chromatography/quadrupole-linear ion trap mass spectrometry[J]. Chin J Oceanol Limn, 2017, 35(4): 883-893.
[45] KISHI Y, FUKUYAMA T, ARATANI M, et al. Synthetic studies on tetrodotoxin and related compounds. Ⅳ. Stereospecific total syntheses of dl-tetrodotoxin[J]. J Am Chem Soc, 1972, 94(26): 9219-9221.
[46] SATO K I, AKAI S, SHOJI H, et al. Stereoselective and efficient total synthesis of optically active tetrodotoxin from D-glucose[J]. J Org Chem, 2008, 73(4): 1234-1242.
[47] KOERT U. Syntheses of tetrodotoxin[J]. Angew Chem Int Ed Engl, 2004, 43(42): 5572-5576.
[48] TSUDA K, KAWAMURA M. The constituents of the ovaries of globefish. Ⅶ: purification of tetrodotoxin by chromatography. (2)[J]. Yakugaku Zasshi J Pharmaceut Soc Jap, 1952, 72(6): 771-773.
[49] 李晓川, 林美娇. 河豚鱼及其加工利用[M]. 北京: 中国农业出版社, 1998: 13-15. [50] 崔建洲, 宫庆礼, 顾谦群, 等. 一种高效制备河豚毒素(TTX)方法的研究[J]. 高技术通讯, 2005, 15(4): 89-94. [51] 易瑞灶, 许晨, 洪专, 等. 河豚毒素高纯单体规模化制备方法: 02121463.8[P]. 2002-12-18. [52] 陈伟珠, 谢全灵, 张怡评, 等. 4,9-脱水河豚毒素国家标准样品的研制[J]. 化学分析计量, 2014, 23(3): 1-4. [53] 李爱峰. 液-质联用技术分析海洋生物毒素的研究[D]. 青岛: 中国科学院海洋研究所, 2005: 71-84. [54] 吴韶菊. 海藻希瓦氏菌(Shewanella alga)产河豚毒素(Tetrodotoxin)初步研究[D]. 青岛: 中国海洋大学, 2005: 15-20. [55] 岳田芳, 刘岩, 邓志科, 等. 海藻希瓦氏菌(Shewanella alga)发酵培养基条件优化的研究[J]. 生物技术, 2007, 17(6): 63-66. -
期刊类型引用(5)
1. 童立豪,黄良夫,吴翔宇,石耀华,唐贤明. 切段部位、长度和培养温度对琼枝藻繁殖的影响. 热带生物学报. 2024(03): 361-367 .  百度学术
百度学术
2. 吴翔宇,邢诒炫,曾俊,陈明兴,杨守国. 长心卡帕藻两种颜色藻株的生长差异研究. 河北渔业. 2020(11): 20-22 .  百度学术
百度学术
3. 邢诒炫,曾俊,吴翔宇,杨守国,黄敏,唐贤明. 三种热带经济海藻养殖现状与应用前景. 海洋湖沼通报. 2019(06): 112-120 .  百度学术
百度学术
4. 陈海红,陈伟洲. 异枝江蓠切段培养的初步研究. 海洋湖沼通报. 2017(06): 146-152 .  百度学术
百度学术
5. 陈素文,郭永坚,李俊伟,颉晓勇,朱长波. 海萝(Gloiopeltis furcata)藻体保存和容器内的培养方法. 渔业科学进展. 2016(03): 108-113 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载:




 粤公网安备 44010502001741号
粤公网安备 44010502001741号
