Optimization for determining derivative conditions of biogenic amines by HPLC
-
摘要:
利用荧光检测器(FLD),采用柱前衍生高效液相色谱法(HPLC)对组胺(HIS)、色胺(TRP)、2-苯乙胺(2-PHE)、腐胺(PUT)、尸胺(CAD)、酪胺(TYR)、亚精胺(SPD)和精胺(SPM)8种生物胺(BA)进行测定分析。通过探究丹酰氯(Dns-Cl)质量浓度、反应体系的pH、衍生时间及衍生温度对生物胺衍生反应的影响,确定最优的衍生条件。结果显示,当Dns-Cl的质量浓度为BA质量浓度的10倍、pH 11.0、40 ℃下避光反应45 min,所有BA均能有效分离。BA的相对标准偏差(RSD)在3%以内,能够满足分析要求。
Abstract:Using high performance liquid chromatography with fluorescence detector and pre-column derivatization, we determined 8 biogenic amines(histamine, trptamine, 2-phenylethylamine, putrescine, cadaverine, tyramine, spermidine and spermine).The optimal derivative conditions are determined by investigating the effects of dansyl chloride concentration, pH, reaction time and reaction temperature on the derivatization of biogenic amines. The result shows that all amines are well resolved with dansyl chloride whose concentration is 10 times of that of biogenic amines at pH 11.0 and 40 ℃ in darkness for 45 min. The good repeatability of all biogenic amines with relative standard deviation ≤3% is considered acceptable.
-
Keywords:
- biogenic amines /
- dansyl chloride /
- pre-column derivatization /
- HPLC
-
生物胺(BA)是一类具有生物活性的低分子量碱性化合物,主要是由相应的氨基酸通过微生物的脱羧作用形成或由醛、酮类物质在氨基酸转氨酶作用下产生[1]。BA具有重要的生理功能,如促进机体生长,增强代谢活力与肠道免疫能力,促进DNA、RNA和蛋白质的合成,在消除自由基方面也有一定的作用[2]。但过量摄入BA可引起食物中毒,其主要症状为恶心、呼吸困难、发热、头痛、皮疹及血压发生变化等。此外,如果体系中存在亚硝酸盐,则有可能生成亚硝胺,而亚硝胺已经被证实可引发肝癌[3]。BA按其结构主要分为3大类:脂肪族、芳香族和杂环族。BA中的组胺(HIS)对人类健康的影响最大,其次是酪胺(TYR),而其他BA的存在会增强HIS和TYR的不良作用。目前很多国家对食品中的BA做了限量要求[4],因此,对BA的研究对提高和改善食品的质量及安全性有着重要意义。
目前,BA的测定方法有离子色谱法(IC)[5-6]、高效液相色谱法(HPLC)[7-8]、薄层色谱法(TLC)[9]和毛细管电泳法(CE)[10]等。随着填料技术的发展,HPLC在检测方面显示了其特有的优越性,是目前食品中BA含量分析测定的主要手段。BA与氨基酸类似,本身无紫外吸收和荧光发射特性,因此需要衍生化处理。常用的衍生试剂有丹酰氯(Dns-Cl)、邻苯二甲醛(OPA)、苯甲酰氯和荧光胺(FA)等。Dns-Cl作为目前使用最广泛的液相色谱柱前衍生试剂,具有衍生操作简单、衍生物稳定性好、较强的紫外和荧光吸收等优点。Dns-Cl与单胺和二胺都可以发生反应,脱掉一分子的HCl,生成具有荧光和紫外光的衍生物,反应式为[11]:

该反应过程中起重要作用的有4个因素:衍生剂质量浓度、缓冲液pH、衍生时间和衍生温度。该研究以Dns-Cl为BA的衍生试剂,以荧光检测器(FLD)为检测手段,利用反相高效液相色谱法(RP-HPLC)对常见的8种BA进行分离分析,探讨了Dns-Cl质量浓度等4个因素对衍生反应程度的影响,确定最佳的衍生条件。
1. 材料与方法
1.1 材料与仪器
BA标准品。组胺(HIS,97%;CAS 51-46-5)、色胺(TRP,98%;CAS 61-54-1)、2-苯乙胺(2-PHE,99.5%;CAS 64-04-0)、腐胺盐酸盐(PUT,99%;CAS 333-93-7)、尸胺(CAD,97%;CAS 462-94-2)、亚精胺盐酸盐(SPD,98%;CAS 334-50-9)、精胺(SPE,97%;CAS 71-44-3)和酪胺(TYR,99%;CAS 51-67-2)均购自Sigma公司。
试剂。乙腈(色谱纯)、Dns-Cl(99%,CAS 605-65-2)、107二氨基庚烷(98%,CAS 646-19-51)购自Sigma公司;甲醇(色谱纯)和丙酮(色谱纯)购自Burdick&Jackson公司;盐酸(HCl)、氢氧化钠(NaOH)、乙酸铵、碳酸氢钠(NaHCO3)和氨水均为国产分析纯试剂;水为超纯水。
Agilent 1100高效液相色谱仪,配有G1311A四元泵、G1313A自动进样器、G1316A柱温箱、G1315B荧光检测器、G1322A真空脱气机、HP化学工作站(美国Agilent公司出品);Milli-Q Biocel超纯水机(美国Millipore公司出品);DKN612C恒温干燥箱(日本Yamato公司出品);3K30冷冻离心机(德国Sigma公司出品);GB204电子分析天平(瑞士Mettler Toledo公司出品);PB-10酸度计(德国Sartorius公司出品);TI-H10超声波清洗机(德国Elma公司出品);MM-2微量漩涡振荡器(江苏省沈高康健生化器具厂出品)。
1.2 试验方法
1.2.1 BA标准溶液及内标的配制
1) BA单标储备液。精确称取HIS、TRP、2-PHE、TYR、CAD和SPM各100 mg,PUT 182.72 mg,SPD 175.30 mg分别置于10 mL容量瓶,用0.01 mol · L-1HCl定容至刻度,配制成质量浓度为10 mg · mL-1的标准储备液,置4 ℃冰箱储存,保存期限为3个月。2)BA混标工作液。分别吸取1.00 mL各BA单组分标准储备液,置于10 mL容量瓶中,用0.01 mol · L-1HCl定容至刻度,配制成BA混标工作液(1 mg · mL-1),置4 ℃冰箱储存,保存期限为3个月。3)内标(IS)储备液。精确称取107二氨基庚烷100 mg置于100 mL容量瓶,用0.1 mol · L-1HCl定容至刻度,配制成质量浓度为1 mg · mL-1的内标使用液。
1.2.2 色谱条件
Grace Smart RP-18色谱柱(5 μm,250 mm×4.6 mm);柱温40 ℃;流速1.0 mL · min-1;进样量10 μL;荧光激发波长为350 nm,发射波长为520 nm。流动相A为0.1 mol · L-1乙酸铵溶液,流动相B为乙腈,流动相C为超纯水。梯度洗脱程序见表 1。
表 1 梯度洗脱程序表Table 1 HPLC gradient elution program for biogenic amines时间/min
time流动相/% mobile phase A B C 0.00 15 50 35 6.00 20 65 15 15.00 17 68 15 25.00 10 90 0 25.10 15 50 35 30.00 15 50 35 1.2.3 BA标准溶液的衍生化
用移液枪吸取1 mL BA混标工作液于10 mL容量瓶,加入内标使用液0.1 mL、2 mol · L-1的NaOH溶液0.2 mL、饱和NaHCO3溶液0.3 mL、1 mL Dns-Cl溶液(溶于丙酮)避光反应45 min后,加入0.1 mL氨水(25%)避光静置以终止衍生反应,30 min后用乙腈定容至刻度,于4 ℃,3 000 r · min-1下离心5 min,取上清液过0.22 μm滤膜,供液相色谱测定。
2. 结果与分析
2.1 BA检测方法的适用性分析
采用乙酸铵、乙腈、超纯水为流动相,通过对色谱分离条件的优化,确立了如表 1所示的梯度。结果显示,8种BA能在30 min内得到有效的分离,且峰形对称无拖尾现象。对于BA,在选定的衍生条件下进行2次平行衍生,每次衍生收集色谱数据3次,得到的6组色谱峰面积数据重复性较好,BA的相对标准偏差(RSD)在3%以内,结果见表 2。
表 2 生物胺衍生物峰面积的相对标准偏差Table 2 RSD of peak area of derivatized biogenic amines生物胺
BA相对标准偏差/%
RSD色胺TRP 1.33 2-苯乙胺2-PHE 0.93 腐胺PUT 1.22 尸胺CAD 0.54 组胺HIS 2.96 酪胺TYR 2.74 亚精胺SPD 0.97 精胺SPM 0.73 2.2 Dns-Cl质量浓度对衍生反应的影响
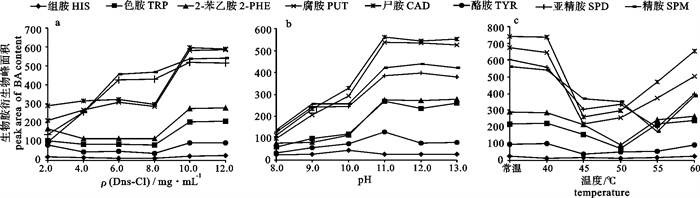
Dns-Cl用量是影响衍生反应的重要因素。用量过少不能保证整个衍生反应的进行,用量过多造成试剂浪费并且增加杂峰,影响图谱的质量。为了寻找合适的Dns-Cl质量浓度,该试验测定了当添加1 mL Dns-Cl溶液,质量浓度分别为2 mg · mL-1、4 mg · mL-1、6 mg · mL-1、8 mg · mL-1、10 mg · mL-1和12 mg · mL-1时,与1 mL BA混标液(1 mg ·mL-1)衍生反应的完全程度。每组做3次平行试验,取3次测量的平均值。图 1-a显示BA衍生物的峰面积Ai随着Dns-Cl用量的改变而变化的情况。
Dns-Cl对HIS的衍生物生成量影响并不明显,TRP、2-PHE、TYR和CAD衍生物随着Dns-Cl用量的增加而增加,在Dns-Cl质量浓度为10 mg ·mL-1时,8种BA衍生物的生成量均达到最大,继续增加Dns-Cl的量,衍生物生成量趋于平缓且无明显变化。因此,当添加的ρ(Dns-Cl)为10 mg ·mL-1,即添加的ρ(Dns-Cl)为ρ(BA)的10倍时,可以保证衍生反应的完全进行。
2.3 反应体系的pH对衍生反应的影响
Dns-Cl与BA的衍生反应需在碱性条件下进行,反应体系的pH也是影响衍生反应完全程度的一个重要因素。在目前的研究中,有采用NaOH和碱性缓冲溶液[12]调节反应体系的pH,也有采用NaOH和饱和NaHCO3溶液[13-15]调节反应体系的pH。笔者对2种方法做了对比试验发现,在衍生反应结束后加入缓冲溶液的衍生反应体系,其pH变化不大,仍维持在反应前的碱性,加入饱和NaHCO3溶液的衍生反应体系,其pH降低至中性或微碱性,为保护反相色谱柱的需要,该试验选择添加NaOH和NaHCO3来控制衍生反应体系的pH。调整碱液的添加量,将衍生体系的pH分别调整到8.0、9.0、10.0、11.0、12.0和13.0。每组做3次平行试验,取3次测量的平均值。图 1-b显示BA衍生物的峰面积Ai随着衍生体系pH的改变而变化的情况。
碱性条件下大部分BA衍生物随着pH的增加而增加,当pH增加到11.0时,所有BA衍生物基本都达到最大值。随着pH的继续增加,PUT、CAD和2-PHE的衍生物基本上没有变化,SPD和SPM的衍生物略有增加,考虑到HIS在pH 10.0的时候衍生物略高,衍生条件的最佳pH定为11.0。
2.4 衍生温度与衍生时间对衍生反应的影响
关于衍生温度和衍生时间,很多研究者进行试验研究时选取的条件不统一[16-17]。一些研究人员倾向于采用较高的温度,温度越高,衍生反应所需的时间越短。DUGO等[18]使用的衍生条件是55 ℃下反应1 h,还有学者[19-20]设定65 ℃反应25 min。高温虽然能够缩短衍生时间,但是过高的温度会造成衍生产物的分解从而导致峰形塌陷。为了选择合适的衍生温度和时间,该研究在以往试验的基础上设计了6种温度条件,分别为常温反应24 h,40 ℃反应45 min,45 ℃反应40 min,50 ℃反应30 min,55 ℃反应30 min,60 ℃反应20 min。所得BA衍生物的结果见图 1-c。
大部分BA在常温反应24 h及在40 ℃反应45 min都可以得到最大程度的衍生化,在60 ℃时也能得到较好的衍生,但是HIS的衍生物已经受到高温的影响,峰形出现拖尾及对称性降低。根据试验的实际进行,该试验确定衍生反应的最佳温度和时间组合为40 ℃下衍生45 min。
2.5 最佳衍生条件的确定
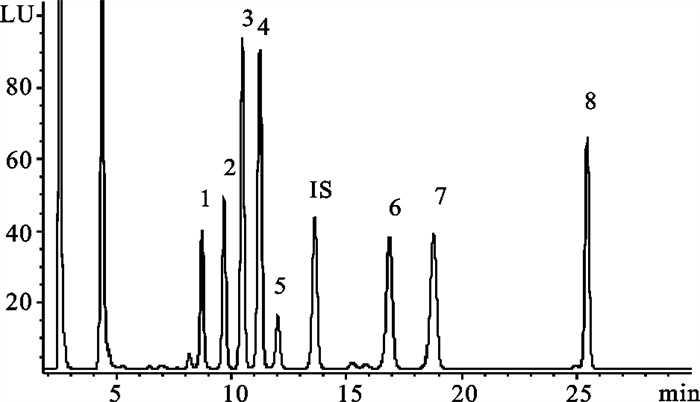
优化的衍生条件为ρ(Dns-Cl)10 mg ·mL-1、pH 11.0、衍生温度40 ℃和衍生时间45 min。图 2为最佳衍生条件下的8种BA及IS的色谱图。
2.6 样品测定
采用确定的最佳衍生条件对鲜活淡水鱼(金昌鱼、桂花鱼)、罐头鱼制品(凤尾鱼罐头)及发酵鱼制品(梅香马鲛、腊草鱼)5个样品衍生处理后进行色谱分析,所有生物胺都能得到有效分离(表 3)。所测定样品的组胺质量分数均未超出50 mg · kg-1,其中梅香马鲛样品中生物胺质量分数偏高。
表 3 几种鱼和鱼制品中的生物胺质量分数(n=3)Table 3 Biogenic amine contents in fish and fish product samplesmg · kg-1 样品
samplew(色胺)
TRPw(2-苯乙胺)
2-PHEw(腐胺)
PUTw(尸胺)
CADw(组胺)
HISw(酪胺)
TYRw(亚精胺)
SPDw(精胺)
SPM金昌鱼golden pompano 0.30±0.25 ND 1.21±0.49 1.04±0.24 ND ND 2.46±0.33 6.01±0.40 桂花鱼Chinese perch ND ND 21.25±2.68 6.63±0.50 ND ND 0.49±0.36 0.49±0.36 凤尾鱼罐头canned anchovy ND 1.32±1.12 2.80±0.78 23.89±6.90 19.79±6.68 3.03±1.38 2.00±1.02 1.22±0.88 梅香马鲛light cured spanish mackerel 15.41±1.03 57.61±3.71 64.53±4.07 244.41±14.95 21.31±6.67 62.85±3.35 0.22±0.19 ND 腊草鱼fermented grass carp ND 0.20±0.11 11.38±1.96 88.27±7.58 2.63±1.45 ND 3.77±0.72 10.45±1.01 注:ND. 未检测到
Note:ND. not detected3. 结论
该研究对影响BA衍生反应的4个重要因素进行了研究,从而优化出BA衍生化的最佳条件,分别为Dns-Cl的质量浓度为所测BA质量浓度的10倍,pH 11.0,衍生温度为40 ℃,衍生时间为45 min。BA在此条件下得到最大程度的衍生化。选用FLD为检测手段,8种BA均能在30 min内得到有效分离且峰形良好。
-
表 1 梯度洗脱程序表
Table 1 HPLC gradient elution program for biogenic amines
时间/min
time流动相/% mobile phase A B C 0.00 15 50 35 6.00 20 65 15 15.00 17 68 15 25.00 10 90 0 25.10 15 50 35 30.00 15 50 35 表 2 生物胺衍生物峰面积的相对标准偏差
Table 2 RSD of peak area of derivatized biogenic amines
生物胺
BA相对标准偏差/%
RSD色胺TRP 1.33 2-苯乙胺2-PHE 0.93 腐胺PUT 1.22 尸胺CAD 0.54 组胺HIS 2.96 酪胺TYR 2.74 亚精胺SPD 0.97 精胺SPM 0.73 表 3 几种鱼和鱼制品中的生物胺质量分数(n=3)
Table 3 Biogenic amine contents in fish and fish product samples
mg · kg-1 样品
samplew(色胺)
TRPw(2-苯乙胺)
2-PHEw(腐胺)
PUTw(尸胺)
CADw(组胺)
HISw(酪胺)
TYRw(亚精胺)
SPDw(精胺)
SPM金昌鱼golden pompano 0.30±0.25 ND 1.21±0.49 1.04±0.24 ND ND 2.46±0.33 6.01±0.40 桂花鱼Chinese perch ND ND 21.25±2.68 6.63±0.50 ND ND 0.49±0.36 0.49±0.36 凤尾鱼罐头canned anchovy ND 1.32±1.12 2.80±0.78 23.89±6.90 19.79±6.68 3.03±1.38 2.00±1.02 1.22±0.88 梅香马鲛light cured spanish mackerel 15.41±1.03 57.61±3.71 64.53±4.07 244.41±14.95 21.31±6.67 62.85±3.35 0.22±0.19 ND 腊草鱼fermented grass carp ND 0.20±0.11 11.38±1.96 88.27±7.58 2.63±1.45 ND 3.77±0.72 10.45±1.01 注:ND. 未检测到
Note:ND. not detected -
[1] SHALABY A R. Significance of biogenic amines to food safety and human health[J]. Food Res Int, 1996, 29(7): 675-690. doi: 10.1016/S0963-9969(96)00066-X
[2] KLAUSEN N K, HUSS H H. Rapid method for detection of histamine-producing bacteria[J]. Int J Food Microbiol, 1987, 5(2): 137-146. doi: 10.1016/0168-1605(87)90031-6
[3] SILLA SANTOS M H. Biogenic amines: their importance in foods[J]. Int J Food Microbiol, 1996, 29(2): 213-231. https://xueshu.baidu.com/usercenter/paper/show?paperid=b61eb738f08f71f2e94276265db04c15&site=xueshu_se&hitarticle=1
[4] 李志军, 吴永宁, 薛长湖. 生物胺与食品安全[J]. 食品与发酵工业, 2004, 30(10): 84-91. LI Zhijun, WU Yongning, XUE Changhu. Biogenic amines and food safety[J]. Food Ferment Ind, 2004, 30(10): 84-91. (in Chinese)
[5] FAVARO G, PASTORE P, SACCANI G, et al. Determination of biogenic amines in fresh and processed meat by ion chromatography and integrated pulsed amperometric detection on Au electrode[J]. Food Chem, 2007, 105(4): 1652-1658. doi: 10.1016/j.foodchem.2007.04.071
[6] De BORBA B M, ROHRER J S. Determination of biogenic amines in alcoholic beverages by ion chromatography with suppressed conductivity detection and integrated pulsed amperometric detection[J]. J Chromatogr A, 2007, 1155(1): 22-30. doi: 10.1016/j.chroma.2007.01.114
[7] PROESTOS C, LOUKATOS P, KOMAITIS M. Determination of biogenic amines in wines by HPLC with precolumn dansylation and fluorimetric detection[J]. Food Chem, 2008, 106(3): 1218-1224. doi: 10.1016/j.foodchem.2007.06.048
[8] KELLY M T, BLAISE A, LARROQUE M. Rapid automated high performance liquid chromatography method for simultaneous determination of amino acids and biogenic amines in wine, fruit and honey[J]. J Chromatogr A, 2010, 1217(47): 7385-7392. doi: 10.1016/j.chroma.2010.09.047
[9] CELANO G V, CAFARCHIA C, BUJA F, et al. Biogenic amines determination in cheese[J]. Industrie Alimentari, 1992, 31(3): 764-768.
[10] SWANN L M, FORBES S L, LEWIS S W. A capillary electrophoresis method for the determination of selected biogenic amines and amino acids in mammalian decomposition fluid[J]. Talanta, 2010, 81(4): 1697-1702. https://pubmed.ncbi.nlm.nih.gov/20441960/
[11] PALEOL GOS E K. On-line SPE with surfactant accelerated on-column derivatization and MLC separation as a tool for the determination of biogenic amines in various food substrates[J]. Anal Chem, 2004, 76(5): 1289-1294. doi: 10.1021/ac030355b
[12] 董伟峰, 林维宣, 田苗, 等. 固相萃取-高效液相色谱法测定七种痕量生物胺[J]. 食品研究与开发, 2006, 127(1): 107-111. doi: 10.3969/j.issn.1005-6521.2006.01.036 DONG Weifeng, LIN Weixuan, TIAN Miao, et al. Determination of seven minim biogenic amines by solid phase extraction-high performance liquid chromatography[J]. Food Res Exploitat, 2006, 127(1): 107-111. (in Chinese) doi: 10.3969/j.issn.1005-6521.2006.01.036
[13] PARK J S, LEE C H, KWON E Y, et al. Monitoring the contents of biogenic amines in fish and fish products consumed in Korea[J]. Food Control, 2010, 21(9): 1219-1226. doi: 10.1016/j.foodcont.2010.02.001
[14] KIM M K, MAH J H, HWANG H J. Biogenic amine formation and bacterial contribution in fish, squid and shellfish[J]. Food Chem, 2009, 116(1): 87-95. doi: 10.1016/j.foodchem.2009.02.010
[15] 蔡秋杏, 李来好, 陈胜军, 等. 液熏罗非鱼片在25 ℃贮藏过程中生物胺的变化[J]. 南方水产, 2010, 6(5): 1-6. doi: 10.3969/j.issn.1673-2227.2010.05.001 CAI Qiuxing, LI Laihao, CHEN Shengjun, et al. Changes of biogenic amines in liquid-smoked tilapia stored at 25 ℃[J]. South China Fish Sci, 2010, 6(5): 1-6. (in Chinese) doi: 10.3969/j.issn.1673-2227.2010.05.001
[16] CHEN H C, HUANG Y R, HSU H H, et al. Determination of histamine and biogenic amines in fish cubes (Tetrapturus angustirostris) implicated in a food-borne poisoning[J]. Food Control, 2010, 21(1): 13-18. doi: 10.1016/j.foodcont.2009.03.014
[17] ANLI R E, VURAL N, YILMAZ S, et al. The determination of biogenic amines in Tuikish red wines[J]. J Food Compos Anal, 2004, 17(1): 53-62. doi: 10.1016/S0889-1575(03)00104-2
[18] DUGO G, VILASI F, TORRE L. Reverse phase HPLC/DAD determination of biogenic amines as dansyl derivatives in experimental red wines[J]. Food Chem, 2006, 95(4): 672-676. doi: 10.1016/j.foodchem.2005.07.001
[19] HERNANDEZ-BORGES J, D'ORAZIO G, ATURKI Z, et al. Nano-liquid chromatography analysis of dansylated biogenic amines in wines[J]. J Chromatogr A, 2007, 1147(2): 192-199. doi: 10.1016/j.chroma.2007.02.072
[20] YEGIN S, UREN A. Biogenic amine content of boza: a traditional cereal-based, fermented Turkish beverage[J]. Food Chem, 2008, 111(4): 983-987. doi: 10.1016/j.foodchem.2008.05.020
-
期刊类型引用(19)
1. 卢竹阳,邵彪,王琳琳,许晶晶,张霞,李玲玉,沈蕾. 冷藏时间对大黄鱼、鲳鱼中生物胺含量变化的影响. 肉类研究. 2024(11): 41-46 .  百度学术
百度学术
2. 吴丽婷,林靖莹,刘士祺,沈晓娜,陈慧斌. 不同热加工方式对鱿鱼片风味品质影响研究. 渔业研究. 2024(06): 615-625 .  百度学术
百度学术
3. 田颖,张丽英,陈义强,杨文军. 高效液相色谱法同时测定动物源性饲料中9种生物胺. 中国畜牧杂志. 2023(09): 337-342 .  百度学术
百度学术
4. 任梦雅,冯潇慧,解竞静,文晓宾,孟庆石,刘丽莉. 食糜样本中11种生物胺同步检测方法的建立. 畜牧兽医学报. 2020(06): 1320-1331 .  百度学术
百度学术
5. 高慧,汪洋,邢燕,逄岳,王勤,王敏,刘婷婷,袁月. 分散固相萃取-柱前衍生-高效液相色谱法测定人体尿样中6种生物胺. 现代预防医学. 2020(20): 3797-3801+3830 .  百度学术
百度学术
6. 梁梦洁,黄丽佳,刘欣,李晶,宋春满,张建铎. 响应面法优化高效液相色谱分析蜂蜜中5种生物胺的衍生条件. 食品工业科技. 2020(23): 253-259 .  百度学术
百度学术
7. 赵玲玲,杜冰,曹炜,张中印. 超高效液相色谱-串联质谱法同时测定蜂蜜中8种生物胺. 食品工业科技. 2018(04): 228-234 .  百度学术
百度学术
8. 赵庆志,邓建朝,杨贤庆,李来好,胡晓,王锦旭,吴燕燕,魏涯. 不同贮藏温度下鲐鱼生物胺变化的研究. 食品工业科技. 2018(04): 260-267+279 .  百度学术
百度学术
9. 李大伟,李丹丹,梁静静,史瑞琴,马艳莉. 高效液相色谱法测定市售腐乳中生物胺的含量. 食品研究与开发. 2018(16): 120-124+129 .  百度学术
百度学术
10. 钱茜茜,吴燕燕,魏涯,林婉玲,戚勃,荣辉. 海鲈鱼腌制过程中产胺菌的分离筛选与生物学特性研究. 食品与发酵工业. 2016(01): 70-75 .  百度学术
百度学术
11. 程卫,王艳伟,陈培云,吴广臣,赵志磊. HPLC测定虾皮中不同类型的生物胺. 食品工业. 2016(02): 293-296 .  百度学术
百度学术
12. 吴燕燕,钱茜茜,陈玉峰,杨贤庆,邓建朝. 咸鱼中生物胺降解菌的筛选与降解特性研究. 食品工业科技. 2016(18): 173-179 .  百度学术
百度学术
13. 吴燕燕,钱茜茜,李来好,邓建朝,杨贤庆,陈胜军,林婉玲. 3种添加物对咸鱼加工贮藏过程中生物胺的抑制效果. 食品科学. 2016(18): 190-196 .  百度学术
百度学术
14. 郝淑贤,魏涯,周婉君,杨贤庆,李来好,胡晓,林婉玲,邓建朝. 鲭鱼生物胺生成菌的分离与鉴定. 食品科学. 2015(07): 97-100 .  百度学术
百度学术
15. 孟祥平,张普查. 食品中生物胺检测方法及控制技术的研究进展. 食品研究与开发. 2014(05): 133-136 .  百度学术
百度学术
16. 华永有,周芬霞,林宏琳,王伟均,郑奎城. HPLC-FLD法检测黄酒中9种生物胺. 中国卫生检验杂志. 2014(06): 761-764 .  百度学术
百度学术
17. 王新星,于朝磊,马静,常青. 高效液相色谱法测定卤虫无节幼体中精胺含量. 渔业科学进展. 2013(06): 112-117 .  百度学术
百度学术
18. 吴云辉,周爽,徐敦明. 非衍生化液相色谱-串联质谱法测定动物源性食品中8种生物胺. 色谱. 2013(02): 111-116 .  百度学术
百度学术
19. 徐琦,杨洪生,吴光红,张美琴. 超高效液相色谱-电喷雾串联质谱法同时测定鱼类加工品中12种杂环胺类化合物. 南方水产科学. 2012(04): 7-15 .  本站查看
本站查看
其他类型引用(8)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
