Preparation of anti-Vibrio parahaemolyticus IgY and its cross-reaction with different serotype strains
-
摘要:
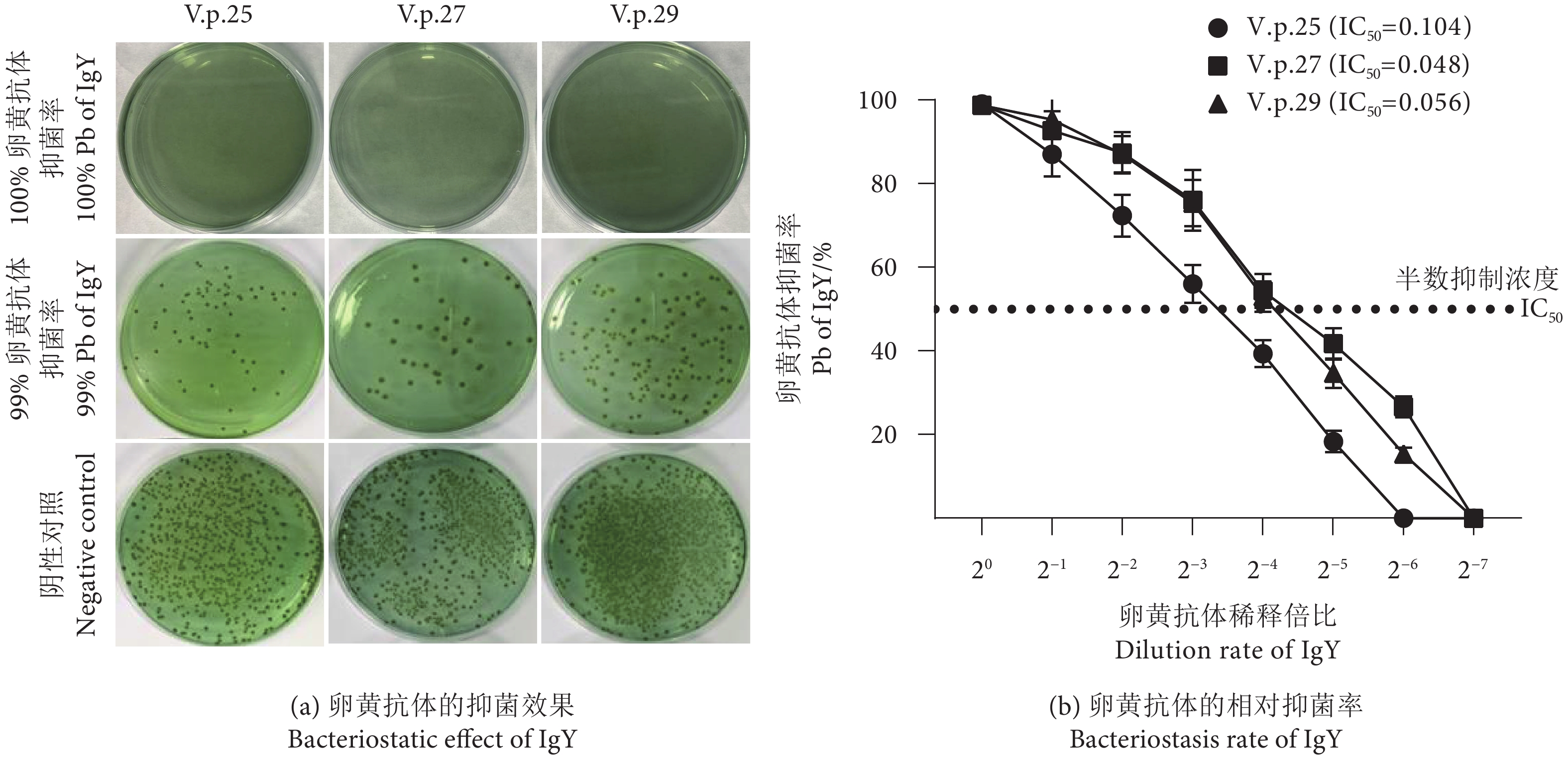
为探索卵黄抗体对防控凡纳滨对虾 (Litopenaeus vannamei) 养殖中副溶血弧菌 (Vibrio parahaemolyticus) 病的潜在作用,将2种血清型 (O1:KUT和OUT:KUT) 的3株副溶血弧菌制备成灭活疫苗,分别免疫产蛋鸡制备卵黄抗体。通过ELISA实验和试管凝集实验,评估了卵黄抗体的效价消长规律、抑菌效果和交叉反应情况。结果显示:3株副溶血弧菌均能诱导高特异性水平的卵黄抗体,抗体凝集效价和ELISA效价的消长趋势相近,均在4免后10~60 d达到卵黄抗体的效价平台期,凝集效价在1∶8以上,ELISA效价在1∶6 400以上;卵黄抗体与血清型相同的其他副溶血弧菌发生强烈的交叉ELISA和交叉凝集反应,但与血清型不同的副溶血弧菌有较低的交叉ELISA反应,无交叉凝集反应。研究表明副溶血弧菌能刺激蛋鸡产生高特异性水平的卵黄抗体,对不同血清型菌株不具有交叉保护效果,可为抗副溶血弧菌卵黄抗体产品的开发与应用提供参考。
Abstract:In order to investigate the potential role of immunoglobulin of egg yolk (IgY) in the prevention and control of Vibrio parahaemolyticus in Litopenaeus vannamei culture, we prepared three V. parahaemolyticus strains from serotypes (O1: KUT and OUT: KUT) as inactivated vaccines and immunized against laying hens to prepare IgY, respectively. Then we evaluated the titer, inhibitory effect and cross reaction of anti-V. parahaemolyticus IgY by ELISA and tube agglutination tests. The results show that all the three strains induced high specific level of IgY. The trends of antibody agglutination titer and ELISA titer were similar, both reaching the plateau of antibody titer from 10 to 60 d after the fourth immunization, with agglutination titer above 1∶8 and ELISA titer above 1∶6 400. The prepared IgY showed strong cross-ELISA and cross-agglutination reaction with other V. parahaemolyticus for the same serotype, but had lower cross-ELISA reaction and no cross-agglutination reaction with other serotype strains. This study clarifies that V. parahaemolyticus can stimulate the production of high specific level of IgY in laying hens, but does not have cross-protective potency against different serotypes of strains, which provides references for the development and application of anti-V. parahaemolyticus IgY products.
-
水通道蛋白家族(aquaporin,AQPs)是由相对较小的疏水性内在膜蛋白组成的超家族,在生物体内的一系列生理过程中起着重要的作用[1-2]。迄今为止,在原核生物和真核生物中均发现多种水通道蛋白基因[3]。在真核生物中已经发现了17类水通道蛋白(AQP0~AQP16),这些蛋白主要分成4类:1)经典的水通道蛋白(AQP0、1、2、4、5、5L、6、14和15),对水的通过具有高度选择性;2) AQP8型的水氨通道蛋白(AQP8和16),能够通过水和氨等;3) 水甘油通道蛋白(AQP3、7、9、10和13),允许甘油和尿素等溶质通过;4)非正统的水通道蛋白(AQP11和12),这类研究较少,与其他水通道蛋白同源性较低[4]。虽然大多数水通道蛋白的研究都以哺乳动物为模型,但硬骨鱼类由于对维持离子和水相对平衡的持续需求,也常作为水通道蛋白表达调控研究的优秀动物模型。
鱼类AQP1最先在红细胞的细胞膜上被发现[5],是由6个跨膜结构域组成的2个疏水环连接形成经典的沙漏形结构。目前,AQP1在黑鲷(Acanthopagrus schlegeli)、日本鳗鲡(Anguilla japonica)、欧洲鳗鲡(A.anguilla)、金头鲷(Sparus aurata)、斑马鱼(Danio rerio)、半滑舌鳎(Cynoglossus semilaevis)和大西洋鲑(Salmo salar)等硬骨鱼类中[1, 6-11]均进行了报道,证实了其表达调控在鱼体水分运输调节中起到重要作用。AQP1有AQP1a和AQP1b两种亚型,同时各亚型在不同鱼类海淡水适应方面的表达调控机制有所差异。研究表明,大西洋鲑在淡水适应中鳃的AQP1a转录水平最高,而在海水适应中肾和肠的AQP1a
转录水平高[10]。在急性盐度胁迫下,直接将大西洋鲑从淡水转移到海水,AQP1a在肠和肾中的表达水平升高,AQP1b的表达水平在肠和鳃中升高但在肾中降低。黑鲷在慢性淡水适应中鳃和肠中的AQP1表达水平显著升高[1]。暗纹东方鲀(Takifugu obscurus)和青鳉(Oryzais dancena)鳃中AQP1在淡水中比在海水中的表达水平要高[12-13],但在慢性海水适应中攀鲈[14] (Anabas testudineus)和舌齿鲈[15] (Dicentrarchus labrax)鳃中的AQP1a的表达水平没有显著的变化。由此可见,AQP1的功能在物种间具有显著的特异性。 卵形鲳鲹 (Trachinotus ovatus)是一种中上层暖水性鱼类,生长速度快,肉质鲜美,营养价值高,适合在网箱和池塘中养殖,已成为亚太地区最重要的海水养殖品种之一[16]。卵形鲳鲹在中国南方主要采用池塘和海上网箱养殖,暴雨和台风等极端天气经常导致池塘和海湾中的盐度急剧下降,严重影响卵形鲳鲹的生长和生存。因此,为了探讨卵形鲳鲹对急性盐度胁迫的渗透压调节机制,本研究克隆了AQP1a基因,对AQP1a进行了生物信息学分析,利用实时荧光定量RT-PCR分析AQP1a mRNA组织表达分布及其在急性盐度胁迫下的表达调控规律,以期为解析卵形鲳鲹盐度应激调节机制奠定基础。
1. 材料与方法
1.1 材料和实验设计
1 000尾健康的卵形鲳鲹幼鱼 [体质量 (35±3) g]从海南省陵水自治县中国水产科学研究院南海水产研究所海南热带水产研究开发中心获得。实验前将鱼放入3 000 L循环海水玻璃纤维缸中,养殖温度为 (29±1) ℃,每个玻璃纤维缸中使用2块气石以保持溶解氧接近饱和(6.5~7.0 mg·L–1),暂养1周。随机挑选3尾鱼,分别采集脾、肾、胃、肌肉、皮肤、性腺、鳃、脑、心、肝和肠等11个组织,并立即放入液氮中保存备用。
急性盐度胁迫实验设置淡水、盐度10、盐度20、盐度30 (对照组)和盐度40共5个实验组,每组设置3个重复。将暂养的鱼随机挑选50尾分别直接转移到各实验组中,观察鱼的行为和存活状况,如有沉底翻肚则捞出并记录。在第0、第2、第4、第8、第12、第24、第48和第96小时随机挑选3条鱼采集鳃、肠和肾组织,并立即保存于液氮中备用。
RNA提取试剂盒购自广州美基生物科技有限公司;DNA胶回收试剂盒购自生工生物工程(上海)股份有限公司;SYBR Green PCR Master Mix、PrimeScriptTM、PrimeScript RT reagent Kit、pMD18-T载体和DH5α感受态细胞均购自TaKaRa公司。
1.2 总RNA提取和cDNA合成
利用总RNA提取试剂盒提取总RNA,用DNaseⅠ去除所提取总RNA中基因组DNA,保证总RNA的纯度,实验操作根据说明书来进行;利用1.2%琼脂糖凝胶电泳和NanoDrop 2000分别检测提取的RNA质量和浓度。利用PrimeScriptTM Ⅱ试剂盒对选择合格的RNA样品进行逆转录,逆转录完的RNA样品和cDNA样品放入 – 80 ℃冰箱中进行保存。
1.3 AQP1a基因克隆
本实验室通过卵形鲳鲹全基因组测序技术获得AQP1a序列,通过对比GenBank数据库,发现其与其他鱼类的AQP1a具有较高的同源性。利用Primer Premier 5.0设计引物(表1)对其开放阅读框(ORF)进行验证。以cDNA为模板进行PCR,反应总体系20 μL,内含引物各0.8 μL,cDNA模板1 μL,反应程序为94 ℃ 3 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 30s,32个循环;72 ℃ 10 min。把目的片段进行胶回收(上海生工),用pMDTM18-T (TaKaRa)克隆试剂盒进行连接,转化进DH5α和挑取单克隆。菌液PCR筛选出阳性克隆并送至广州睿博生物有限公司测序。
表 1 实验所用引物Table 1. Primer sequences used in this study引物
primer引物序列 (5′–3′)
primer sequence用途
applicationAQP1a-F
AQP1a-RAAACCCAGACCAAGAGGTGAAG
TGCTGCTACACCACCGCACATT验证开放阅读框 AQP1a-qF
AQP1a-qRAGTTACCCTCGGGATGCTTGC
GCTGCTACACCACCGCACATT实时荧光定量 PCR EF-1α-F
EF-1α-RCCCCTTGGTCGTTTTGCC
GCCTTGGTTGTCTTTCCGCTA内参基因 1.4 AQP1a 基因生物信息学分析
利用DNAman软件拼接测序片段;利用ExPASy软件预测AQP1a的功能域、分子量、信号肽和等电点(http://smart.embl-heidelberg.de/smart/set_mode);糖基化预测使用NetNGlyc程序 (http://www.cbs.dtu.dk/services/NetNGylc/);使用BioEdit软件进行多序列比对;利用InterPro程序来分析蛋白结构域(http://www.ebi.ac.uk/interpro/);利用SWISS-MODEL软件和PyMOL软件对氨基酸序列的三级结构进行预测;使用MEGA 6.06和Clustal软件构建系统进化树。
1.5 实时荧光定量PCR
利用Primer Premier 5.0设计AQP1a荧光定量特异性引物 (表1)。内参基因选择和设计参考于文博等[16]。用正常海水下健康的卵形鲳鲹脾、肾、胃、肌肉、皮肤、性腺、鳃、脑、心、肝和肠等11个组织进行组织表达分析,每个组织设3个重复。急性盐度胁迫下,利用qPCR检测鳃、肠和肾3个组织在第0、第2、第4、第8、第12、第24、第48和第96小时下AQP1a基因的表达水平。
各组织和各时间点样品的cDNA模板浓度稀释成 (50±5) ng·μL–1作为荧光定量的模板。qPCR反应根据荧光定量PCR试剂盒(TaKaRa)的说明书在Roche LightCycler® 480 II荧光定量PCR仪上进行。qPCR的反应体系为(12.5 μL) 1 μL模板cDNA,6.25 μL SYBR Pre-mix ExTaq,上下游引物各0.5 μL,4.25 μL ddH2O;扩增的反应程序为94 ℃ 30 s,95 ℃ 15 s,53 ℃ 15 s,68 ℃ 20 s,40个循环。每个样品3个重复,每个重复3个点样孔。实时荧光定量PCR数据使用△CT法(2–△△CT)进行分析,数据统计分析采用SPSS 23.0软件。
2. 结果
2.1 AQP1a生物信息学分析
利用卵形鲳鲹全基因组中的AQP1a序列设计特异性引物进行扩增、克隆和验证获得AQP1a基因的全长,GenBank登录号为MH005789。AQP1a基因cDNA全长1 078 bp,其中ORF为786 bp,编码261个氨基酸,理论分子量约为27.49 kD,理论等电点为6.41。功能基序位点包括4个蛋白激酶C (PKC),4个蛋白激酶A (PKA),2个细胞周期蛋白依赖性激酶(cdc2)和1个胰岛素受体C (INSR)。在多肽中发现2个糖基化位点(图1)。AQP1a蛋白结构分析显示,卵形鲳鲹AQP1a含有6个跨膜结构域(分别位于13~32 aa、47~69 aa、89~111 aa、126~148 aa、161~183 aa和203~225 aa),2个高度保守的天冬酰胺–脯氨酸–丙氨酸(NPA)蛋白基序,以及MIP家族特有的保守序列HINPAVTLG。AQP1a二级结构分析表明其蛋白结构是由53.6%的α螺旋、4.2%的β折叠和42.2%的无规则卷曲组成。其三级结构分析显示AQP1a单体是由6个跨膜结构域组成的蛋白,由2个部分组成,呈180°中心对称,构成了“沙漏”型结构(图2-a)。而在质膜上,它是由4个单体组成的四聚体,每个单体的中空部分都有一个独立的孔道(图2-b)。
![]() 图 1 AQP1a的cDNA序列及预测的氨基酸序列起始密码子ATG在细线方框内,终止密码子以*表示;糖基化位点用灰色阴影表示;蛋白激酶A用直线下划线表示;蛋白激酶C加波浪线表示;胰岛素受体用间断下划线表示;细胞周期蛋白依赖性激酶用双下划线表示Figure 1. Full cDNA sequence and predicted amino acid sequence of AQP1aThe start codon (ATG) is marked with box, and the stop codon is marked with an asterisk. The glycosylation sites are shown in shadow. The protein kinase A is underlined. The protein kinase C is wavy underlined. The insulin receptor is discontinuous underlined. The cyclin-dependent kinases is double underlined.
图 1 AQP1a的cDNA序列及预测的氨基酸序列起始密码子ATG在细线方框内,终止密码子以*表示;糖基化位点用灰色阴影表示;蛋白激酶A用直线下划线表示;蛋白激酶C加波浪线表示;胰岛素受体用间断下划线表示;细胞周期蛋白依赖性激酶用双下划线表示Figure 1. Full cDNA sequence and predicted amino acid sequence of AQP1aThe start codon (ATG) is marked with box, and the stop codon is marked with an asterisk. The glycosylation sites are shown in shadow. The protein kinase A is underlined. The protein kinase C is wavy underlined. The insulin receptor is discontinuous underlined. The cyclin-dependent kinases is double underlined.利用Clustal X 2.1进行氨基酸序列比对,结果表明卵形鲳鲹AQP1a氨基酸与高体(Seriola dumerili)的同源性高达到95.7%;其次与舌齿鲈的同源性也达到93.1%;与斑马鱼、非洲爪蟾(Xenopus laevis)、小鼠(Mus musculus)和人(Homo sapiens)的同源性分别为76.7%、56.8%、60.2%和59.1% (表2)。
表 2 卵形鲳鲹AQP1a氨基酸与其他物种的同源性Table 2. Homology of AQP1a amino acids of T.ovatus to other species1 2 3 4 5 6 7 1 卵形鲳鲹 T.ovatus 100 2 高体 S.dumerili 95.7 100 3舌齿鲈 D.labrax 93.1 93.1 100 4 斑马鱼 D.rerio 76.7 75.9 75.1 100 5 人 H.sapiens 59.1 58.3 56.8 57.6 100 6 小鼠 M.musculus 60.2 58.7 57.2 58.3 94.0 100 7 非洲爪蟾 X.laevis 56.8 56.1 56.1 56.5 73.5 74.2 100 利用MEGA 6.06使用邻近法构建系统进化树。结果表明,卵形鲳鲹与攀鲈聚为一支,然后再与邻近鲈形目的黑鲷、金头鲷和平鲷 (Rhabdosargus sarba)等聚在一起,之后与胡瓜鱼(Osmerus mordax)、舌齿鲈和暗纹东方鲀等硬骨鱼类聚在一支(图4)。哺乳动物人和小鼠聚在一支,亲缘关系较远。
![]() 图 3 卵形鲳鲹AQP1a氨基酸序列与其他物种氨基酸对比下横线为6个跨膜结构域(TMD1~6);红框为天冬酰胺–脯氨酸–丙氨酸(NPA)基序;黑框为MIP家族特有的保守序列HINPAVTLG;各物种AQP1a的序列号:高体 (XP_022613743.1);舌齿鲈(ABI95464.2);斑马鱼(NP_996942.1);非洲爪蟾(NP_001085391.1);小鼠(EDK98728.1);人(CAQ51480.2)Figure 3. Alignment of amino acid sequence of T.ovatus AQP1a in comparison with those of other speciesHorizontal lines indicate six predicted transmembrane helical structure (TMD1–6); red box indicates the structural characteristics of asparagine-proline-alanine (NPA) motifs; black box indicates the unique conserved sequence of the MIP family: HINPAVTLG; the AQP1a sequence No. of each species: S. dumerili (XP_022613743.1) ; D.labrax (ABI95464.2); D.rerio (NP_996942.1); X.laevis (NP_001085391.1); M.musculus (EDK98728.1); H.sapiens (CAQ51480.2)表 3 构建系统进化树的物种Table 3. Species used in phylogenetic tree
图 3 卵形鲳鲹AQP1a氨基酸序列与其他物种氨基酸对比下横线为6个跨膜结构域(TMD1~6);红框为天冬酰胺–脯氨酸–丙氨酸(NPA)基序;黑框为MIP家族特有的保守序列HINPAVTLG;各物种AQP1a的序列号:高体 (XP_022613743.1);舌齿鲈(ABI95464.2);斑马鱼(NP_996942.1);非洲爪蟾(NP_001085391.1);小鼠(EDK98728.1);人(CAQ51480.2)Figure 3. Alignment of amino acid sequence of T.ovatus AQP1a in comparison with those of other speciesHorizontal lines indicate six predicted transmembrane helical structure (TMD1–6); red box indicates the structural characteristics of asparagine-proline-alanine (NPA) motifs; black box indicates the unique conserved sequence of the MIP family: HINPAVTLG; the AQP1a sequence No. of each species: S. dumerili (XP_022613743.1) ; D.labrax (ABI95464.2); D.rerio (NP_996942.1); X.laevis (NP_001085391.1); M.musculus (EDK98728.1); H.sapiens (CAQ51480.2)表 3 构建系统进化树的物种Table 3. Species used in phylogenetic tree物种
species基因
gene登录号
accession No.舌齿鲈 D.labrax AQP1 ABI95464.2 攀鲈 A.testudineus AQP1a AGF30363.1 欧洲鳗鲡 A.anguilla AQP1a CAD92027.1 欧洲鳗鲡 A.anguilla AQP1b ABM26906.1 暗纹东方鲀 T.obscurus AQP1 ADG86337.1 大西洋鲑 S.salar AQP1b NP_001133472.1 黄尾 S. dorsalis AQP1 XP_023259499.1 日本鳗鲡 A.japonica AQP1a BAC82109.1 日本鳗鲡 A.japonica AQP1b BAK53383.1 青鳉 O.dancena AQP1 BAN17349.1 金头鲷 S.aurata AQP1a ABM26907.1 金头鲷 S.aurata AQP1b ABM26908.1 鲤 Cyprinus carpio AQP1 BAS18938.1 平鲷 R.sarba AQP1 AEG78286.1 胡瓜鱼 O.mordax AQP1 ACO09149.1 黑鲷 A.schlegelii AQP1 ABO38816.1 人 H.sapiens AQP1 CAQ51480.2 小鼠 M.musculus AQP1 EDK98728.1 2.2 卵形鲳鲹AQP1a组织表达分析
利用实时荧光定量PCR分析卵形鲳鲹AQP1a基因在不同组织中的表达水平,结果显示, AQP1a在11个被测组织中均有表达,在性腺中的表达量最高,在鳃、肠和肝中的表达量相对较高,在肌肉中的表达量最低(图5)。
实验水体的渗透压 (y) 与水体盐度 (x) 呈极显著正相关 (y = 28.08x + 35,R= 0.990 4),渗透压随着盐度的升高而增加(图6)。在急性盐度胁迫后,选取鳃、肾和肠3个渗透调节器官来研究AQP1a表达量的变化。结果显示,当直接转入淡水后,卵形鲳鲹幼鱼2 h后开始陆续出现浮头和沉底的现象,5 h后转入淡水的幼鱼全部沉底死亡。因此,在淡水组中,笔者选取了第0、第2和第4小时这3个时间点来研究。当转入其余盐度组时,幼鱼没有出现死亡。当转入淡水时,鳃中AQP1a表达量在第4小时上升(P<0.05),而在肾和肠中,AQP1a的表达量没有显著变化;当转入盐度10和20海水之后,鳃中AQP1a的表达量在第2和第4小时这2个时间点明显升高(P<0.05),随后下降并趋于稳定;转入盐度10海水时,在第24、第48和第96小时这3个时间点,肠中AQP1a的表达量都较高(P<0.01),肾中AQP1a的表达量呈先上升后下降趋势,最高表达量出现在第12小时(P<0.01);转入盐度20海水时,肠中AQP1a的表达量变化不大,仅在第4、第8和第48小时这3个时间点显著上升(P<0.05),肾中AQP1a的表达量在第12小时达到最大(P<0.01),其次是在第24和第48小时这2个时间点(P<0.01);当转入盐度40海水中,鳃中AQP1a的表达量明显下降,且最低点出现在第2小时(P<0.01),相反,肾和肠中AQP1a的表达量均明显上调,分别在第8和第96小时达到最高(P<0.01)。
![]() 图 7 鳃、肾和肠中AQP1a在急性盐度胁迫后时空表达EF-1α为内参基因;*. 差异显著(P<0.05);**. 差异极显著(P<0.01);0 h为空白对照Figure 7. Spatiotemporal expression of AQP1ɑ in gill, kidney and intestine after acute salinity stressEF-1α expression was used as an internal control for real-time PCR; *. significant difference at P<0.05; **. very significant difference at P<0.01. The untreated (0 h) group was used as the control.
图 7 鳃、肾和肠中AQP1a在急性盐度胁迫后时空表达EF-1α为内参基因;*. 差异显著(P<0.05);**. 差异极显著(P<0.01);0 h为空白对照Figure 7. Spatiotemporal expression of AQP1ɑ in gill, kidney and intestine after acute salinity stressEF-1α expression was used as an internal control for real-time PCR; *. significant difference at P<0.05; **. very significant difference at P<0.01. The untreated (0 h) group was used as the control.3. 讨论
水通道蛋白调控着水分的跨膜运输,它是一类特异性的通道蛋白,允许在渗透或存在浓度梯度的条件下运输水和其他溶质(如甘油、尿素等),在维持渗透压调节水分平衡中起到了重要的作用[17-18]。本研究首次获得了卵形鲳鲹AQP1a的基因序列,全长1 078 bp,其中ORF 786 bp编码261个氨基酸。经氨基酸序列比对分析发现,AQP1a氨基酸序列含有6个跨膜结构域,并且具有一段MIP家族特有的序列(HINPAVTLG)。此外,分析显示氨基酸序列还包含着2个NPA重复基序。NPA是水通道蛋白家族共有的特征结构,在水分运输中具有关键作用。已有研究表明,在AQP1分子动态模型中,NPA和Ar/R (芳香族/精氨酸区域)是2个重要的结构区域。由苯丙氨酸56 (Phe 56)、组氨酸180 (His 180)和带正电荷的精氨酸95 (Arg 95)形成了孔隙最窄的Ar/R区域,是质子和其他正离子(包括水合氢离子)的主要过滤器[19-21]。Beitz等[22]利用甘氨酸代替His,为相邻的酪氨酸或Phe的芳香族侧链留出空间,从而导致Ar/R区域收缩,使得甘油和尿素可通过,但同时损害透水性。在缺失NPA或Ar/R结构时,水分子的运输效率就会降低,但水分运输的功能并没有丧失,这说明了NPA和Ar/R结构在AQP1基因功能上的重要性,同时也表明AQP1其他结构可能也对水分运输起重要作用,这需要进一步研究验证[23]。对AQP1a三级结构预测显示,AQP1a单体含有6个跨膜结构,组成“沙漏”型结构,2个同向的序列折叠成只容许单一水分子通过的通道。且在通道上还含有蛋白激酶磷酸化位点,参与水通道分子的功能调控[24]。在细胞质膜上,AQP1a是以四聚体的形式存在的,但4个单体在功能上却是单独作用的,通过孔道中间形成的定向局部电场,使得水分子能够定向运输,且能阻止其他的溶质进入,从而形成高度的选择特异性。
水通道蛋白家族广泛地分布在脊椎动物、植物和微生物中,在整个进化史中显示出高度的保守性[4]。氨基酸同源性分析显示,卵形鲳鲹的AQP1a与高体和舌齿鲈的同源性高达95.7%和93.1%。系统进化树结果也显示,卵形鲳鲹AQP1a与攀鲈聚为一支,并与黑鲷和金头鲷等鲈形目鱼类聚为一支。综上所述,卵形鲳鲹AQP1a与其他物种的AQP1a 有高度一致性。进化树分析暗示卵形鲳鲹AQP1a 是AQPs家族的一个新的成员。
卵形鲳鲹AQP1a组织表达分析显示,AQP1a在所测的11个组织中都有不同程度的表达,在性腺的表达量最高,其次是鳃、肠和肝。研究表明,AQP1在不同的鱼类组织中的表达分布不同。AQP1在金头鲷和黄鳝(Monopterus albus)的卵巢中高度表达,其高表达可能和卵母细胞吸水膨胀有密切的关系,而且AQP1还受性激素的调节[25-27]。大西洋鲑AQP1a在测定的各组织中表达量都接近,但在脑中的表达量最高[10]。Madsen等[28]研究日本鳗鲡在淡水和海水适应中发现,AQP1a在各组织中也是广泛分布,但在肠、脾和肾中高表达。相反,黄锡鲷(Sparus sarba)的AQP1a在鳃、肠、肾和血中高度表达,但在脑中不表达[8]。类似的发现在黄鳝[29]中也有报道,AQP1a只在卵巢中高度表达,而在其他组织没有表达。有趣的是,有些鱼类在非渗透调节器官中的AQP1a的表达量反而更高,如泥鳅(Misgurnus mizolepis)[30]。此外,AQP1a在半滑舌鳎[9]雌雄个体组织中的表达量也不同。这充分显示AQP1a基因水分运输功能因鱼的种类和性别不同而有差异,体现了其组织分布的特异性。这一特性可能导致在盐度胁迫下雌雄生长的差异性,这将为鱼类的遗传育种提供有利的理论基础,也是今后研究的方向。
对于水生生物来说,环境盐度的变化影响着其体内的稳态,从而对生长发育和生存等一系列生理生化过程产生不利影响。对于广盐性硬骨鱼类来说,凭借着高效的渗透调节机制,在鳃、肾和肠渗透调节器官的作用下,维持体内的渗透压平衡,从而保障着体内生理生化过程的稳态。荧光实时定量PCR分析结果显示,当转入淡水中,AQP1a的表达量在肾和肠中没有显著变化,而在鳃中第4小时表达量上升。鳃作为与水环境直接接触的渗透调节器官,在急性低渗环境下,为了维持体内渗透平衡,最先响应盐度胁迫进行渗透调节。肾和肠表达量变化不大的原因可能跟其器官的特性和响应时间有关,这需要进一步研究验证。当转入盐度10和20海水实验组后,AQP1a在鳃的表达量只在第2和第4小时这2个时间点出现上升随后下降并趋于平稳,而在肾和肠中AQP1a的表达量均上升。原因可能为当鱼体从高盐转入低盐后,体内的渗透调节平衡出现失调,渗透调节器官(鳃、肠和肾)为了防止水分通过渗透作用过多的进入体内,器官离子的转换受到抑制,从而促进体内水分的排出,导致AQP1a的表达量上升。当转入盐度40海水中,AQP1a在鳃中的表达量下降,但在肾和肠中却升高,与暗纹东方鲀[12]、日本鳗鲡[28]和刀鲚(Coilia nasus)[31]中的AQP1a表达模式一致。与水环境的直接接触,使得鳃上皮和肾、肠上皮有所不同,它需要接触更多的环境介质,从而在盐度改变产生较大的渗透梯度时,面临着的水分子流增大的风险。从生物进化的角度来说,当周围水环境变化时,鱼类将鳃上皮的通透性降低或升高,以维持体内渗透平衡,这是一种自我保护的科学模式。所以,高渗条件下卵形鲳鲹鳃组织AQP1a表达水平下降,通过降低水分等运输来维持体内稳态,以适应盐度变化的不利影响。而在肾和肠中,AQP1a表达量均上升。在高渗环境下,鱼类吞咽高渗水溶液,通过肠对高渗液的吸收以及肾对高渗液的吸收和对尿液的重吸收,然后经过鳃将盐分排出体外。利用这样的渗透调节方式来维持体内渗透平衡,这一过程是主动的,因此,需要Na+/K+-ATP酶来提供能量及Na+-K+-Cl–等共转运体来共同合作完成。
本研究克隆了卵形鲳鲹AQP1a基因序列的全长,分析AQP1a基因的分子特征,其氨基酸序列跟其他鲈形目鱼类具有高度的同源性。通过急性盐度胁迫实验研究AQP1a基因在卵形鲳鲹渗透调节中的作用,结果表明在急性盐度胁迫下,当从对照组转移到淡水、盐度10和盐度20实验组时,AQP1a在鳃、肾和肠中表达水平不同,反映了AQP1a在不同组织中的功能特异性;在转入盐度40海水实验组时,AQP1a在鳃中的表达量下降,但在肾和肠中的表达量却升高。通过降低水分子的流出和水分子的重吸收来调节体内稳态,这也显示了AQP1a在卵形鲳鲹盐度适应中的重要作用。
-
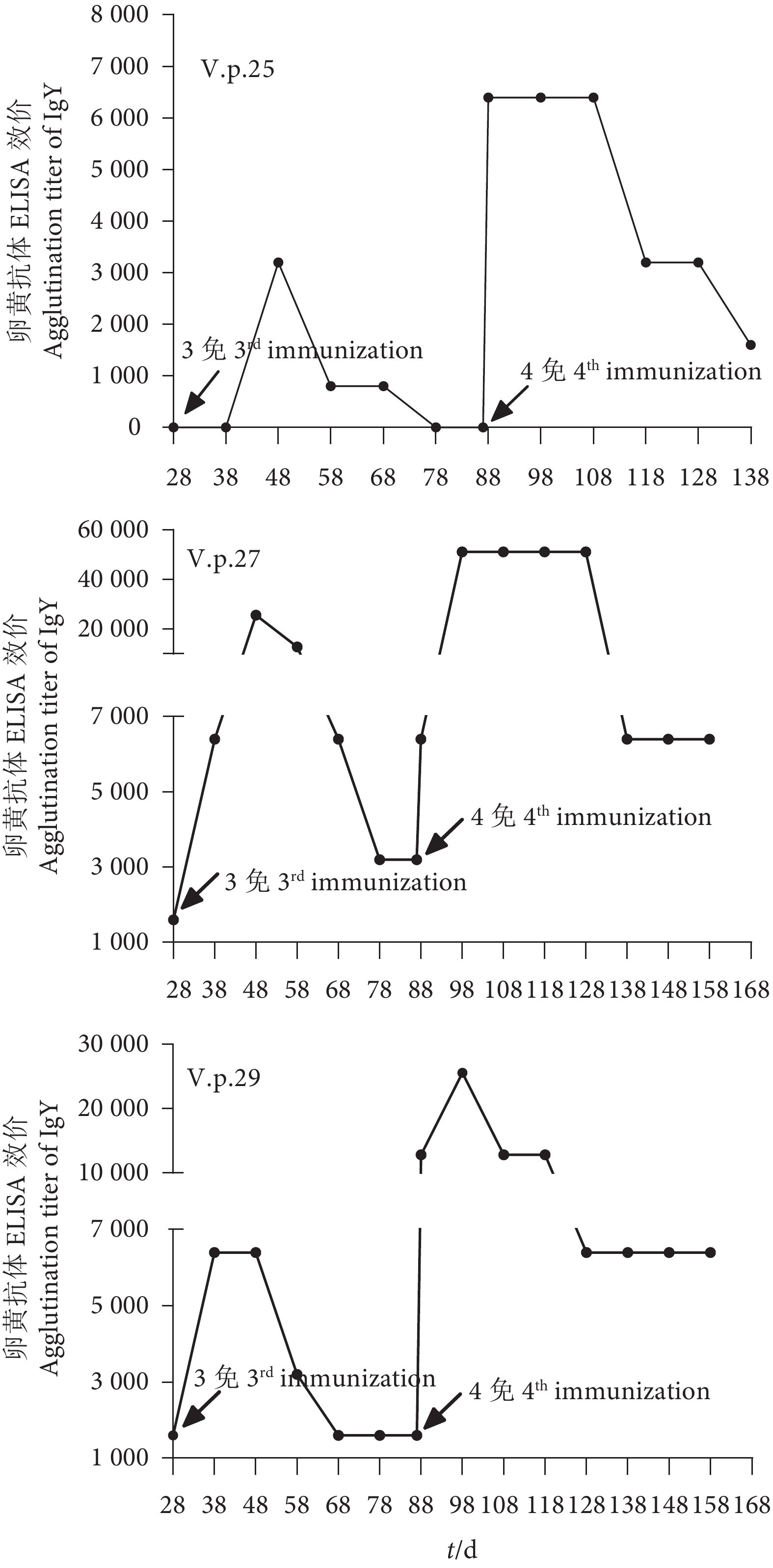
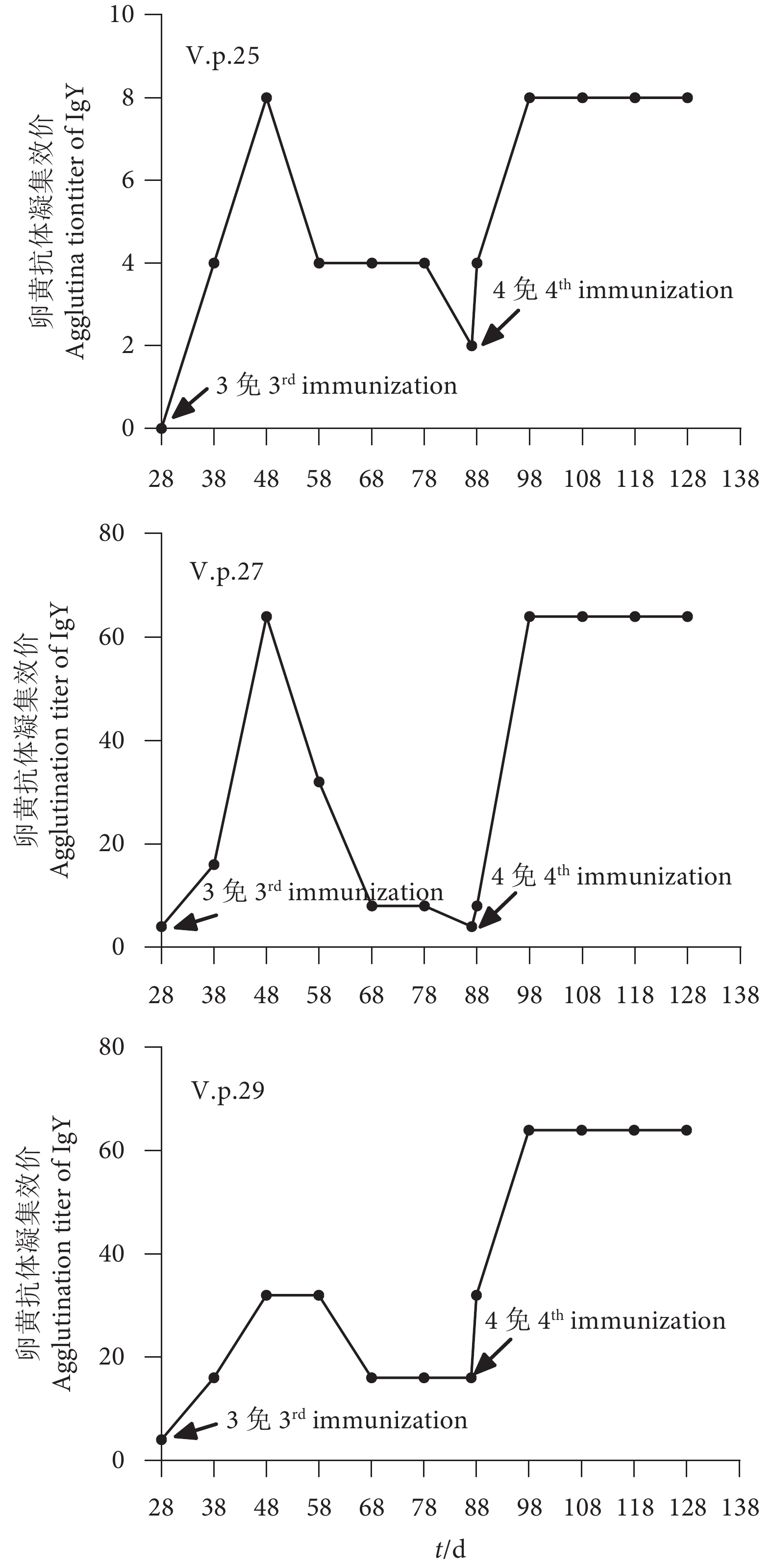
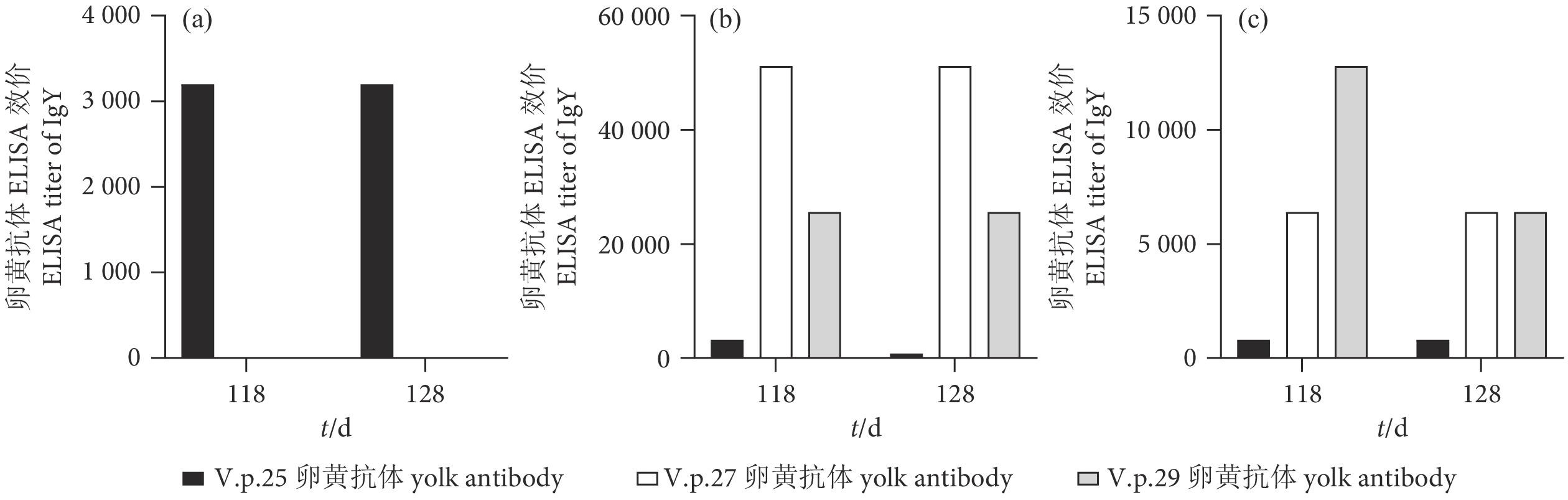
图 4 卵黄抗体与非免疫菌株的ELISA交叉效价
注:a. V.p.25菌株与3种卵黄抗体的ELISA反应;b. V.p.27菌株与3种卵黄抗体的ELISA反应;c. V.p.29菌株与3种卵黄抗体的ELISA反应。
Figure 4. Cross titer of IgY and non-immune strains by ELISA
Note: a. ELISA reaction between V.p.25 strain and three kinds of IgY; b. ELISA reaction between strain V.p.27 and three kinds of IgY; c. ELISA reaction of between V.p.29 strain with three kinds of IgY.
表 1 副溶血弧菌菌株信息
Table 1 V. parahaemolyticus strain information
菌株编号
Strain
No.菌种来源
Source of
strain分离时间 (年份)
Isolation time
(Year)分离地点
Isolation
location血清型
SerotypeV.p.20 凡纳滨对虾 2020 珠海 O1:K25 V.p.24 凡纳滨对虾 2020 珠海 O1:K33 V.p.25 凡纳滨对虾 2020 珠海 OUT:KUT V.p.26 凡纳滨对虾 2021 珠海 O1:K36 V.p.27 凡纳滨对虾 2021 珠海 O1:KUT V.p.28 凡纳滨对虾 2021 珠海 O1:K68 V.p.29 凡纳滨对虾 2021 珠海 O1:KUT 表 2 相同血清型副溶血弧菌的交叉凝集
Table 2 Cross-agglutination of same serotype of V. parahaemolyticus
卵黄抗体/血清型
IgY /SerotypeV.p.27 V.p.29 O1:KUT O1:KUT V.p.27 4免30 d
30 d V.p.27 4th immunization1∶64 1∶64 对照4免30 d
30 d control 4th immunization− − V.p.29 4免30 d
30 d V.p.29 4th immunization1∶64 1∶64 对照4免30 d
30 d control 4th immunization− − 注:“−”表示无凝集现象。 Note: "−" represents no agglutination. 表 3 抗V.p.25卵黄抗体对不同血清型副溶血弧菌的交叉凝集
Table 3 Cross-agglutination of anti-V.p.25 IgY to different serotypes of V. parahaemolyticus
卵黄抗体/血清型
IgY /SerotypeV.p.25 V.p.20 V.p.24 V.p.26 V.p.27 V.p.28 V.p.29 OUT:KUT O1:K25 O1:K33 O1:K36 O1:KUT O1:K68 O1:KUT V.p.25 4免10 d
10 d V.p.25 4th immunization1∶4 − − − − − − 对照 4免10 d
10 d control 4th immunization− − − − − − − V.p.25 4免20 d
20 d V.p.25 4th immunization1∶8 − − − − − − 对照 4免20 d
20 d control 4th immunization− − − − − − − 注:“−”表示无凝集现象。 Note: "−" represents no agglutination. 表 4 抗V.p.27卵黄抗体对不同血清型副溶血弧菌的交叉凝集
Table 4 Cross-agglutination of anti-V.p.27 IgY to different serotypes of V. parahaemolyticus
卵黄抗体/血清型
IgY /SerotypeV.p.27 V.p.20 V.p.24 V.p.25 V.p.26 V.p.28 O1:KUT O1:K25 O1:K33 OUT:KUT O1:K36 O1:K68 V.p.27 4免10 d
10 d V.p.27 4th immunization1∶8 − − − − − 对照 4免10 d
10 d control 4th immunization− − − − − − V.p.27 4免20 d
20 d V.p.27 4th immunization1∶64 − − − − − 对照 4免20 d
20 d control 4th immunization− − − − − − 注:“−”表示无凝集现象。 Note: "−" represents no agglutination. 表 5 抗V.p.29卵黄抗体对不同血清型副溶血弧菌的交叉凝集
Table 5 Cross-agglutination of anti-V.p.29 IgY to different serotypes of V. parahaemolyticus
卵黄抗体/血清型
IgY /SerotypeV.p.29 V.p.20 V.p.24 V.p.25 V.p.26 V.p.28 O1:KUT O1:K25 O1:K33 OUT:KUT O1:K36 O1:K68 V.p.29 4免10 d
10 d V.p.29 4th immunization1∶32 − − − − − 对照 4免10 d
10 d control 4th immunization− − − − − − V.p.29 4免20 d
20 d V.p.29 4th immunization1∶64 − − − − − 对照 4免20 d
20 d control 4th immunization− − − − − − 注:“−”表示无凝集现象。 Note: "−" represents no agglutination. -
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2023中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2023: 22-24. [2] 张晓君, 陈翠珍, 阎斌伦, 等. 凡纳滨对虾 (Litopenaeus vannamei) 病原副溶血弧菌 (Vibrio parahaemolyticus) 的表型及分子特征[J]. 海洋与湖沼, 2009, 40(5): 654-662. doi: 10.3321/j.issn:0029-814X.2009.05.021 [3] 高晓华, 张海强, 安伟. 凡纳滨对虾急性肝胰腺坏死病致病菌的分离鉴定、药敏特性及其组织病理学观察[J]. 淡水渔业, 2022, 52(3): 82-90. doi: 10.3969/j.issn.1000-6907.2022.03.011 [4] 李吉云, 沈辉, 孟庆国, 等. 急性肝胰腺坏死病病原菌毒力的初步研究[J]. 水产科学, 2022, 41(5): 868-875. [5] GONZÁLEZ-ESCALONA N, MARTINEZ-URTAZA J, ROMERO J, et al. Determination of molecular phylogenetics of Vibrio parahaemolyticus strains by multilocus sequence typing[J]. J Bacteriol, 2008, 190(8): 2831-2840. doi: 10.1128/JB.01808-07
[6] ESPEJO R T, GARCÍA K, PLAZA N. Insight into the origin and evolution of the Vibrio parahaemolyticus pandemic strain[J]. Front Microbiol, 2017, 8: 1397. doi: 10.3389/fmicb.2017.01397
[7] CHEN X, LI Y, YAO W, et al. A new emerging serotype of Vibrio parahaemolyticus in China is rapidly becoming the main epidemic strain[J]. Clin Microbiol Infec, 2020, 26(5): 644. e1-644. e7.
[8] 魏大伟. 中国沿海地区副溶血弧菌流行病学调查及遗传多样性分析[D]. 杨凌: 西北农林科技大学, 2018: 7-8. [9] CHONSIN K, SUPHA N, NAKAJIMA C, et al. Characterization of Vibrio parahaemolyticus strains isolated from clinically asymptomatic seafood workers[J]. FEMS Microbiol Lett, 2020, 1: 368.
[10] AHSAN C R, FERDOUS T. Characterization of Vibrio parahaemolyticus organisms isolated from shrimps and shrimp fields located in the coastal areas of Bangladesh[J]. Int J Infect Dis, 2020, 101: 150.
[11] CHEN X, ZHU Q Y, LIU Y C, et al. Pathogenic Characteristics of and variation in Vibrio parahaemolyticus isolated from acute diarrhoeal patients in southeastern China from 2013 to 2017[J]. DOAJ, 2020, 3: 1307-1318.
[12] ZHONG Y, CHEN J N, HUANG C P, et al. Isolation, identification, and pathogenicity of pathogens from Litopenaeus vannamei with acute hepatopancreatic necrosis disease[J]. Pakistan J Zool, 2024, 56(5): 2339-2350. ZHONG Y, CHEN J N, HUANG C P, et al. Isolation, identification, and pathogenicity of pathogens from Litopenaeus vannamei with acute hepatopancreatic necrosis disease[J]. Pakistan J Zool, 2024, 56(5): 2339-2350.
[13] 魏文娟, 赵姝, 王元, 等. 副溶血弧菌养殖对虾分离株耐药性及耐药基因分析[J]. 南方水产科学, 2020, 16(1): 9-16. doi: 10.12131/20190165 [14] 徐永平, 徐乐, 李纪彬, 等. 卵黄抗体饲料添加剂在畜牧及水产养殖病害防控中的研究进展[J]. 饲料工业, 2021, 42(18): 1-11. [15] PENG B, YE J Z, HAN Y, et al. Identification of polyvalent protective immunogens from outer membrane proteins in Vibrio parahaemolyticus to protect fish against bacterial infection[J]. Fish Shellfish Immunol, 2016, 54: 204-210. doi: 10.1016/j.fsi.2016.04.012
[16] 刘钢, 胡晓娟, 苏浩昌, 等. 嗜酸乳杆菌对3种弧菌的拮抗效果及对凡纳滨对虾肠道菌群结构的影响[J]. 南方水产科学, 2024, 20(2): 83-91. doi: 10.12131/20230191 [17] XIA H, YANG H J, YAN N, et al. Bacteriostatic effects of phage F23s1 and its endolysin on Vibrio parahaemolyticus[J]. J Basic Microbiol, 2022, 62(8): 963-974. doi: 10.1002/jobm.202200056
[18] CLEM L W, SMALL P A. Phylogeny of immunoglobulin structure and function: I. immunoglobulins of the lemon shark[J]. J Exp Med, 1967, 125(5): 893-920. doi: 10.1084/jem.125.5.893
[19] KUMARAN T, THIRUMALAIKUMAR E, LELIN C, et al. Physicochemical properties of anti Vibrio harveyi egg yolk antibody (IgY) and its immunological influence in Indian white shrimp Fen neropenaeus indicus[J]. Fish Shellfish Immunol, 2018, 74: 349-362. doi: 10.1016/j.fsi.2017.12.062
[20] GAO X J, ZHANG X J, SUN J J, et al. Passive protection effect of anti-Vibrio anguillarum IgY-encapsulated feed on half-smooth tongue sole (Cynoglossus semilaevi) against V. anguillarum[J]. Fish Shellfish Immunol, 2016, 56: 483-488. doi: 10.1016/j.fsi.2016.07.041
[21] XU L, XU Y P, HE L Y, et al. Immunomodulatory effects of chicken egg yolk antibodies (IgY) against experimental Shewanella marisflavi AP629 infections in sea cucumbers (Apostichopus japonicus)[J]. Fish Shellfish Immunol, 2019, 84: 108-119. doi: 10.1016/j.fsi.2018.09.073
[22] 闫茂仓, 王瑶华, 胡利华, 等. 副溶血弧菌特异性卵黄抗体(AHPND-VpIgY)对凡纳滨对虾幼体被动免疫和育苗成活率的影响[J]. 海洋与湖沼, 2019, 50(2): 443-448. doi: 10.11693/hyhz20181200303 [23] NAKAMURA R, PEDROSA-GERASMIO I R, ALENTON R R R, et al. Anti-PirA-like toxin immunoglobulin (IgY) in feeds passively immunizes shrimp against acute hepatopancreatic necrosis disease[J]. J Fish Dis, 2019, 42(8): 1125-1132. doi: 10.1111/jfd.13024
[24] 陶家发, 赖迎迢, 任燕, 等. 弧菌福尔马林灭活条件的初步研究[J]. 中国生物制品学杂志, 2011, 24(1): 64-66. [25] 李硕, 陈静妮, 赵立宁, 等. 抗大口黑鲈蛙虹彩病毒卵黄抗体的制备及其间接ELISA检测方法的建立[J]. 南方水产科学, 2024, 20(2): 129-139. doi: 10.12131/20230148 [26] TRAN L, NUNAN L, REDMAN R M, et al. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp[J]. Dis Aquat Org, 2013, 105(1): 45-55. doi: 10.3354/dao02621
[27] LETCHUMANAN V, CHAN K G, LEE L H. Vibrio parahaemolyticus: a review on the pathogenesis, prevalence, and advance molecular identification techniques[J]. Front Microbiol, 2014, 5: 705.
[28] LU Y N, LIU J J, JIN L J, et al. Passive protection of shrimp against white spot syndrome virus (WSSV) using specific antibody from egg yolk of chickens immunized with inactivated virus or a WSSV-DNA vaccine[J]. Fish Shellfish Immunol, 2008, 25(5): 604-610. doi: 10.1016/j.fsi.2008.08.010
[29] SCHADE R, HLINAK A. Egg yolk antibodies, state of the art and future prospects[J]. ALTEX, 1996, 13(5): 5-9.
[30] GAO X J, ZHANG X J, LIN L, et al. Passive immune-protection of litopenaeus vannamei against Vibrio harveyi and Vibrio parahaemolyticus infections with anti-Vibrio egg yolk (IgY)-encapsulated feed[J]. Int J Mol Sci, 2016, 17(5): 723. doi: 10.3390/ijms17050723
[31] LI X Y, LIU H, XU Y P, et al. Chicken egg yolk antibody (IgY) controls Solobacterium moorei under in vitro and in vivo conditions[J]. Appl Biochem Biotechnol, 2012, 168(6): 1448-1458. doi: 10.1007/s12010-012-9869-3
[32] IBRAHIM E S M, RAHMAN A K M S, ISODA R, et al. In vitro and in vivo effectiveness of egg yolk antibody against Candida albicans (anti-CA IgY)[J]. Vaccine, 2008, 26(17): 2073-2780. doi: 10.1016/j.vaccine.2008.02.046
[33] 陆田甜. 成都市犬细小病毒的检测和分离鉴定及精制卵黄抗体的研制[D]. 成都: 西南民族大学, 2021: 41-42. [34] 李思泉, 李娜, 罗玉双, 等. 草鱼细菌性烂鳃病病原菌的分离及其特异性卵黄抗体的初步研究[J]. 贵州畜牧兽医, 2019, 43(3): 37-42. doi: 10.3969/j.issn.1007-1474.2019.03.010 [35] 刘婷. 鸭疫里默氏杆菌几种蛋白免疫保护性初步研究[D]. 重庆: 西南大学, 2021: 14-17. -
期刊类型引用(9)
1. 姚紫荆,杨晓明,吴峰,田思泉. 基于参数最优地理探测器的南太平洋长鳍金枪鱼渔业资源分布驱动力研究. 海洋渔业. 2025(02): 153-162 .  百度学术
百度学术
2. 张鸿霖,马有成,宋厚成,张健,曾志坚. 基于结构方程模型研究环境因子对毛里塔尼亚双拖鲣CPUE的影响. 中国水产科学. 2024(04): 465-475 .  百度学术
百度学术
3. 王月,杨晓明,朱江峰. 中西太平洋自由群鲣资源丰度序列的振荡模态分析. 海洋渔业. 2024(03): 266-274 .  百度学术
百度学术
4. 刘志强,郭绍健,王禹程,周成,吴峰,万荣. 中西太平洋金枪鱼延绳钓钓钩深度分布及其影响因素. 上海海洋大学学报. 2024(04): 1020-1030 .  百度学术
百度学术
5. 范江涛,冯志萍,余为,马胜伟,陈新军. 南海鸢乌贼栖息地模型优化及季节性差异分析. 海洋湖沼通报(中英文). 2024(05): 111-120 .  百度学术
百度学术
6. 杨诗玉,冯佶,李亚楠,朱江峰. 基于气候变化因子的印度洋长鳍金枪鱼资源评估. 南方水产科学. 2024(06): 84-94 .  本站查看
本站查看
7. 何露雪,付东洋,李忠炉,王焕,孙琰,刘贝,余果. 南海西北部蓝圆鲹时空分布及其与环境因子的关系. 渔业科学进展. 2023(01): 24-34 .  百度学术
百度学术
8. 王啸,刘文俊,张健. 基于ARIMA的海洋尼诺指数对中西太平洋黄鳍金枪鱼年际CPUE的影响. 南方水产科学. 2023(04): 10-20 .  本站查看
本站查看
9. 郑好好,杨晓明,朱江峰. 基于多尺度地理加权回归模型的中西太平洋围网鲣渔获率环境影响机制研究. 南方水产科学. 2023(05): 1-10 .  本站查看
本站查看
其他类型引用(3)



 下载:
下载:







 粤公网安备 44010502001741号
粤公网安备 44010502001741号
