Effects of glucose glycation on structural and functional properties of limited enzymatic hydrolysates from brown-striped mackerel scad (Decapterus maruadsi) protein isolate
-
摘要:
为拓展蓝圆鲹 (Decapterus maruadsi) 分离蛋白的应用范围,促进其高值化利用,以蓝圆鲹分离蛋白限制性酶解产物 (Brown-striped mackerel scad protein isolate limited enzymatic hydrolysate, BPILH) 为原料,采用葡萄糖对其进行糖基化反应,考察不同反应时间对BPILH结构与功能特性的影响。结果表明,葡萄糖与BPILH的糖基化反应程度与反应时间和色度呈正相关。结构表征结果显示,糖基化反应使α螺旋和无规则卷曲含量减少,并降低糖基化产物的内源荧光强度。此外,长时间的高温使蛋白质分子内部的疏水基团暴露,使其表面疏水性增加。溶解度在酸性、碱性条件下随着反应时间的延长呈现先升高后降低的趋势,其中,第8小时糖基化产物的溶解度在pH 10时达到最高值 (90.49±0.01)%。乳化性随着反应时间的延长而增加,与第0小时相比,第12小时糖基化产物的乳化性提升了24.28%,乳化稳定性和持油性均随着反应时间的延长呈现先增加后减少的趋势,在第1小时乳化稳定性达到最高值(17.51±0.13) min,在第2小时持油性达到最高值(2.19±0.21) g·g−1。因此,反应时间过长会对功能特性产生一定的负面影响,研究结果可为蓝圆鲹分离蛋白在食品配料蛋白中的应用提供一定的理论参考。
Abstract:In order to explore the extended application of fish proteins and promote the high value utilization of brown-striped mackerel scad (Decapterus maruadsi), taking the brown-striped mackerel scad protein isolate limited enzymatic hydrolysate (BPILH) as raw material, we used glucose to conduct a glycation reaction to investigate the effects of different reaction time on the structural and functional properties of BPILH. The results show that glucose underwent glycation reaction with BPILH, and the degree of glycation reaction was positively correlated with reaction time and chromaticity. Structural properties results show that the glycation reaction reduced the α-helix and irregular coil content of BPILH and decreased its endogenous fluorescence intensity. In addition, high temperature treatment with long time during glycation reaction exposed the hydrophobic groups inside the protein molecules and increased their surface hydrophobicity. The solubility of glycation BPILH firstly increased and then decreased with the reaction time under acidic and alkaline conditions, in which the glycation solubility of product reached the highest value of (90.49±0.01)% at pH of 10 after 8-hour reaction. The emulsification of glycosylated BPILH increased with the reaction time. Comparied with the original mixture before reaction, the emulsification of the glycation product after 12-hour reaction increased by 24.28%, and both emulsification stability and oil-holding capacity showed an increase-decrease tendency with the reaction time, with the highest value of emulsification stability of (17.51±0.13) min at 1st hour and oil-holding capacity of (2.19±0.21) g·g−1 at 2nd hour. The emulsification stability of glycation product increased by 24.28% with the reaction time. Therefore, long reaction time may have some negative effects on the functional properties, and this study provides theoretical references for the application of brown-striped mackerel scad protein isolate in food industry.
-
蓝圆鲹 (Decapterus maruadsi) 又称巴浪鱼,是我国主要的经济鱼类之一。2022年,我国蓝圆鲹的捕捞量高达39.58 万吨,其中福建省居首位,达18.9 万吨[1]。海洋鱼类是人类重要的优质食物来源,其营养丰富,蛋白质占肌肉质量的15%~22%,且氨基酸配比合理,消化率高达97%~99%,是儿童和老人的理想蛋白质来源[2]。将鱼类蛋白质作为原辅料添加到食品中,不仅能够有效提高食品的营养价值,还能赋予食品特定的风味特征。为进一步扩展鱼类蛋白质的应用范围、提高其可利用率,等电点沉淀法被用于鱼肉分离蛋白的提取,该法不仅能显著提高鱼类蛋白质的提取率,还可有效去除脂肪、骨刺等杂质[3]。然而这类分离蛋白的溶解度较低,一定程度限制了鱼类蛋白质在食品中的应用。因此,许多方法被运用于改善分离蛋白的功能特性,其中限制性酶解是一种重要的蛋白质改性方法,不仅可显著提高蛋白质的溶解性,还能改善蛋白质的乳化性、分散性及起泡性、消化特性等功能特性。目前限制性酶解主要用于植物分离蛋白的改性,在鱼类分离蛋白中鲜有报道。Klost等[4]利用胰蛋白酶限制性酶解豌豆 (Pisum sativum) 分离蛋白,当水解度为2%和4%时,豌豆分离蛋白在pH介于 3~7时溶解度从30%显著提升至60%。Nisov等[5]用酸性和中性内切蛋白酶对水稻 (Oryza sativa) 胚乳分离蛋白进行限制性酶解,蛋白质溶解度随着水解程度的提高而增加,保水性、起泡性和凝胶性仅在水解度为1.5% (中性蛋白酶) 和1.9% (酸性蛋白酶) 之前得到改善。前期研究发现,利用碱性蛋白酶对蓝圆鲹分离蛋白进行限制性酶解改性,可在一定程度上提升分离蛋白酶解产物的溶解度、起泡性、乳化性和乳化稳定性等功能特性[6],然而仍需进一步改进。
蛋白质/多肽和糖类物质是食品原料中两种重要的食源性生物大分子,在加工过程中糖和蛋白质/多肽会受温度影响相互作用发生糖基化反应。糖基化反应是美拉德反应的前期阶段,蛋白质中氨基酸侧链的ε-氨基与碳水化合物的羰基共价连接形成糖蛋白[7]。在食品蛋白改性方面,糖基化反应不仅可用于改善大分子蛋白质的功能特性,如热稳定性[8]、溶解度[9]、乳化性[10]、抗过敏原性[11]、抗氧化活性[12]等,还可以显著提高蛋白质水解物以及限制性酶解物的抗氧化活性[13]、乳化特性[14],减少水解物的苦味[15]。董烨等[16]利用葡萄糖、木糖、核糖对鳙 (Hypophthalmichthys nobilis) 鱼皮水解物进行糖基化改性,发现其水解物的抗氧化活性得到了显著提升,同时苦腥味也有所改善。
加热是促进糖基化反应的常用手段,主要分为干法加热和湿法加热。干法加热的反应时间较长,不适合工业生产应用。相比之下,湿法加热具有成本低、反应时间短、反应条件易操作等优点,应用前景广阔。马露燕[17]采用湿法糖基化制备豌豆分离蛋白糖基化复合物,研究了不同反应时间对糖基化复合物乳化特性的影响,发现随着反应时间的延长,乳化活性和稳定性均呈现先升后降的趋势。Wang等[18]利用果糖对大豆 (Glycine max) 分离蛋白进行糖基化改性,溶解度随着反应时间的延长呈现先增加后减少的趋势,在反应第6 小时,大豆分离蛋白的溶解度达到最高(8.60 mg·mL−1)。由此可见,糖基化反应受时间的影响,其反应产物的结构与功能特性亦会随原料蛋白质的种类不同而存在较大差异。本研究以蓝圆鲹分离蛋白限制性酶解产物 (Brown-striped mackerel scad protein isolate limited enzymatic hydrolysate, BPILH) 为对象,利用葡萄糖对BPILH进行湿法糖基化处理,研究不同反应时间对糖基化产物结构和功能特性的影响,旨在拓展食品配料蛋白种类,并为蓝圆鲹的高值化利用提供一定的理论参考。
1. 材料与方法
1.1 材料与试剂
冰鲜蓝圆鲹 (每尾质量约150 g),购于厦门市高崎水产批发市场;菜籽油,购于厦门市生鲜超市。
碱性蛋白酶 (广西南宁庞博生物工程有限公司);葡萄糖 (国产分析纯);邻苯二甲醛 (阿拉丁);溴化钾 (国产光谱纯);1-苯胺基-8-萘磺酸 (1-anilinonaphthalene-8-sulfonic acid ammonium salt, ANS) (阿拉丁);十二烷基磺酸钠 (Sodium dodecyl sulfonate, SDS) (美国Sigma公司);邻苯二甲醛 (o-Phthaldialdehyde, OPA) (美国Agilent公司);色谱级乙腈 (美国Fisher chemical公司)。
1.2 仪器与设备
Avanti J-26S XP大型台式高速冷冻离心机 (美国Beckman公司);759 s紫外可见分光光度计 (上海棱光技术有限公司);Mini-PROTEAN 蛋白质电泳装置 (美国Bio-Rad公司);Alpha 1-4 LDplus冷冻干燥机 (德国Christ公司);Phenom Pro台式扫描电子显微镜 (荷兰Phenom-World Pr公司);GF-1260高效液相色谱仪 (美国Agilent公司);Mini-PROTEAN蛋白质电泳装置 (美国Bio-Rad公司);G: BOX凝胶成像 (英国 Syngene公司);FR-8200 荧光分光光度计 (日本JASCO公司);色度仪 (广东三恩时科技有限公司)。
1.3 方法
1.3.1 BPILH的制备
参考孙乐常等[19]的方法,将蓝圆鲹肌肉与水以1∶8的质量比混合均质,用1 mol·L−1 NaOH将匀浆pH调至11,搅拌10 min使蛋白质充分溶解后8 000 ×g离心取上清,再用1 mol·L−1 HCl调上清pH至5.5后搅拌10 min,使蛋白质沉淀后离心取沉淀,以上操作均在4 ℃条件下进行。用0.1 mol·L−1 PBS (pH 8.0) 配制成0.25 g·mL−1 分离蛋白溶液,加入25 U·g−1碱性蛋白酶 (计蛋白质质量),50 ℃反应3 min后,100 ℃灭酶10 min,8 000 ×g离心10 min取上清置 −70 ℃下冷冻干燥。
1.3.2 糖基化产物制备
参考Zhang等[20]的方法并做适当修改,用20 mmol·L−1 PBS (pH 7.5) 将1.3.1的BPILH配制成20 mg·mL−1溶液,加入等量的葡萄糖 (蛋白质量比),80 ℃反应0、1、2、4、6、8、10、12 h,将溶液在冰水浴中冷却以终止糖基化反应,冷冻干燥在−20 ℃下保存,以反应0 h作对照。
1.3.3 糖基化改性程度
通过测定接枝率与褐变性对反应的改性程度进行评价,褐变性采用紫外可见分光光度计测定溶液在美拉德反应过程中的吸光度 (294 和420 nm),用于分析美拉德反应的中间产物和最终产物[21]。糖的消耗是评价糖基化反应中糖反应活性的一个关键指标。利用3,5-二硝基水杨酸法[22]测定反应体系中的葡萄糖,通过制作标准曲线,计算葡萄糖质量浓度。
接枝度由邻苯二甲醛法[23]测定反应溶液中的游离氨基含量来确定,取4 mL OPA试剂到试管中,然后添加200 μL的10 mg·mL−1反应液,涡旋混合后35 ℃水浴2 min,在340 nm波长处测定吸光度,用超纯水作为空白对照。接枝度计算公式如下:
$$ 接枝度{\text{=}}\frac{A_0{\text{−}}A_\text{t}}{A_0}\times 100 {\text{%}}$$ (1) 式中:A0和At分别为糖基化反应前后的吸光度。
1.3.4 色度测定
使用色度仪测量样品粉末颜色的变化以监测棕色色素的形成。L* 表示亮度 (%),a* 是红色 (正) 到绿色 (负),b* 是黄色 (正) 到蓝色 (负),色差 (ΔE) 的计算公式如下:
$$ \Delta E {\text{=}} \sqrt {\Delta {L^{{\text{*2}}}} {\text{+}} \Delta {a^{{\text{*2}}}} {\text{+}} \Delta {b^{{\text{*2}}}}} $$ (2) 1.3.5 粒径和电位
用0.02 mol·L−1 PBS (pH 7.5) 将样品稀释至0.1 mg·mL−1,测定粒径大小 (nm) 和ζ电位 (mV) ,测量前,样品在25 ℃下平衡120 s,所有样品均测量3次。
1.3.6 分子质量
利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (SDS-PAGE) 技术和液相色谱分析糖基化产物分子质量的大小和分布,凝胶采用Laemmli[24]的方法,配制为15% (w) 分离胶、5% (w) 浓缩胶,蛋白质量浓度为2 mg·mL−1,上样量10 μL。电泳过程结束后,凝胶用染色液处理3 h,脱色处理12 h。
液相色谱法参考Wu等[25]的方法,用超纯水将样品配制为5 mg·mL−1,溶液经过0.22 μm滤膜过滤,使用TSKgel G2000SWXL色谱柱测定分子质量分布。用Tyr (181.19 D)、Gly-Gly-Arg-Tyr (451.48 D)、杆菌肽 (
1422.69 D)、50肽 (5617.97 D)、鱼小清蛋白II (11950 D) 为标准品制作标准曲线,流动相为乙腈、水和三氟乙酸分别以40∶60∶0.05的体积比配置的混合液,进样量为20 μL,流速为0.5 mL·min−1。采用GPC Offline软件对结果进行分析,根据峰面积和保留时间计算分子质量分布比例。1.3.7 傅立叶红外光谱
采用傅立叶变换红外光谱仪对冻干样品进行分析。以光谱纯溴化钾作为背景,扫描分辨率为1 cm−1。波数范围为4 000~400 cm−1,扫描频率为64次。
1.3.8 内源荧光
内源荧光参考Wang等[26]的方法并适当修改,用10 mmol·L−1 PBS (pH 7.0) 配制2 mL 0.1 mg·mL−1样品溶液。设定激发波长295 nm,发射波长300~500 nm,狭缝宽5.0 nm,扫描间隔0.5 nm,扫描速率100 nm·min−1对样品溶液依次进行扫描。
1.3.9 表面疏水性
表面疏水性参考Cao等[27]的方法,用0.1 mol·L−1 PBS (pH 7.0) 分别配制2 mL 0.025、0.05、0.1 mg·mL−1的样品溶液,加入20 μL 8 mmol·L−1 ANS,避光静置反应20 min,用相同体积的缓冲液作为空白,所有样品均测量3次。用荧光分光光度计设定激发波长390 nm、发射波长470 nm、狭缝10 nm,测定荧光强度。以荧光强度为纵坐标,样品浓度梯度作为横坐标绘制曲线,通过线性回归分析计算曲线初始斜率即为表面疏水性 (H0)。
1.3.10 紫外光谱
将样品用0.02 mol·L−1 PBS (pH 7.5) 配制成10 mg·mL−1的溶液,以相同体积的缓冲液作为空白,通过扫描200~900 nm范围内的紫外可见光吸收强度,分析二者的相互作用,扫描次数为3次。
1.3.11 圆二色谱
用0.02 mol·L−1 PBS (pH 7.5) 将样品溶液稀释至2 mg·mL−1,用此缓冲液作为空白,扫描范围为190~260 nm,扫描速度为100 nm·min−1。
1.3.12 溶解度
参照陈思如[28]的方法略有修改,将样品粉末用超纯水配制成50 mg·mL−1的溶液,用0.1 mol·L−1的NaOH和HCl溶液调节pH至2、4、6、8、10。7 500 ×g离心15 min后,用BCA法测定离心前后的蛋白质含量。溶解度的计算公式如下:
$$ 溶解度{\text{=}}\frac{上清蛋白质质量\;}{离心前蛋白质质量\;}\times 100 {\text{%}} $$ (3) 1.3.13 乳化性 (EAI) 和乳化稳定性 (ESI)
参照Gong等[29]的方法并作适当修改,取9 mL 0.01 g·mL−1样品溶液与3 mL菜籽油混合在离心管中,用高压均质机以21 200 r·min−1乳化1 min。将乳化液静置0、10 min后分别从离心管底部取50 μL,加入5 mL 1 mg·L−1 SDS溶液中,漩涡振荡5 s后测定500 nm波长下的吸光度。EAI (m2·g−1)和ESI (min)的计算公式为:
$$ {\rm{EAI}}{\text{=}}\frac{2\times 2.303}{C\times {\minifont{φ}}\times 10\;000}\times {A}_{0}\times N $$ (4) $$ {\rm{ESI}}{\text{=}}\frac{{A}_{10}\times \Delta {t}}{{A}_{0}{\text{−}}{A}_{10}} $$ (5) 式中:A0、A10分别为均质后0、10 min测得的吸光度;N为稀释系数 (100);φ为油脂体积分数 (0.25);C为单位体积蛋白质质量浓度 (g·mL−1); Δt为时间间隔 (10 min)。
1.3.14 持油性
参照Tan等[30]的方法,称取样品粉末0.2 g至离心管,离心管和样品的总质量记为m1。向离心管中加入4 mL菜籽油,涡旋 5 min 使其混合均匀,静置30 min。 4 000 r·min−1离心20 min后,除去上清油相,记录离心管及样品的总质量m2,重复测量3次,样品的持油性(g·g−1)计算公式为
$$ 持油性{\text{=}}\frac{{{{{m}}}}_{2}{\text{−}}{{{{m}}}}_{1}}{0.2} $$ 1.3.15 扫描电子显微镜
将不同反应时间的样品进行冷冻干燥,冻干样品粉末固定在导电胶上,喷金后在加速电压为5 kV、放大倍数为2 000× 条件下观察样品的微观结构。
1.4 数据处理与分析
采用Excel 2021和Origin 2021软件绘图,通过SPSS 17.0软件的Duncan's检验进行差异显著性分析 (显著性水平α为0.05)。实验数据均重复3次,数据以“平均值±标准差 (${\overline{x}} \pm s$)”表示。
2. 结果与分析
2.1 接枝率和褐变性
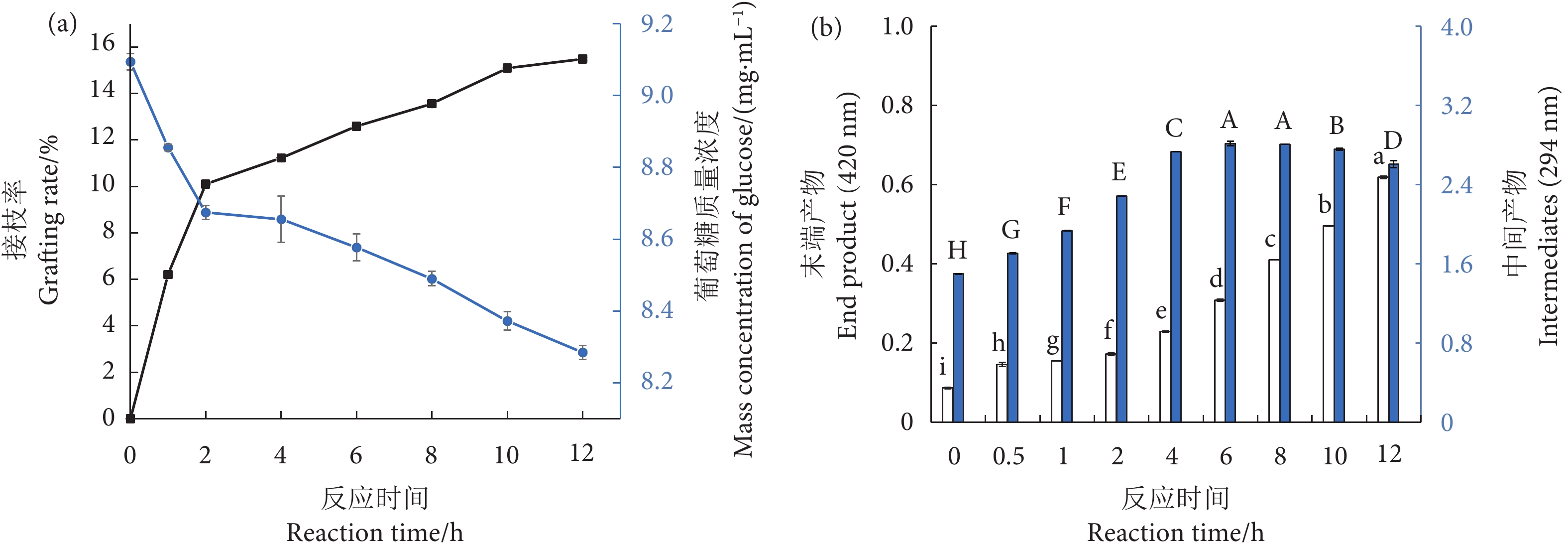
通过测定接枝率和褐变性来表征糖基化反应程度。如图1-a所示,蛋白质糖基化程度随着反应时间的延长而增加,反应速率在开始的2 h内较快,葡萄糖也相应消耗较快。当反应时间达到第2 小时,接枝率为 (10.10±0.03)%,之后反应速率减缓,第12 小时接枝率为 (15.48±0.06)%,表明反应过程中糖基化产物不断形成,且随着葡萄糖不断的共价接入,蛋白质的游离氨基与葡萄糖的羰基碰撞频率降低,从而导致反应速率逐渐减缓[31]。
如图1-b所示,吸光度大小反映了不同反应时间糖基化末端和中间产物的含量变化,末端产物含量随着反应时间的延长而持续上升,中间产物含量先上升后下降,在第6 小时达到最高,在第10 小时后有下降的趋势。糖基化反应前期会产生大量的中间产物,使其吸光度增加,但这些产物在中后期经过缩合和聚合反应,会生成成色和成香的末端产物[28]。因此,在反应8 h后,中间产物的吸光度逐渐减小,表明部分中间产物转变成了末端产物,反应进程到中后期。
2.2 色度
如表1所示,随着反应时间的延长,糖基化产物的L* 降低,a*、b* 和色差显著增加 (P<0.05)。当反应时间达到12 h时,糖基化产物的L* 从112.76±0.21减小至80.69±0.51;a* 从 −0.65±0.02增加至6.33±0.40;b*从8.85±0.32增加至27.44±0.59;色差增加至37.72±0.67。a* 和b* 的增加可能是由于葡萄糖裂解产生无色的非荧光小分子中间体,如酮和醛等,中间体受温度影响与蛋白质发生了环化、脱水、异构化等化学反应,进而产生褐色的含氮聚合物和共聚物[32]。随着反应时间的延长,反应体系中的有色物质逐渐增多,溶液颜色逐渐加深 (图2)。本研究的褐变现象与DL-甘油醛和D-赤藓糖改性明胶[33]一致。
表 1 反应时间对糖基化产物色度的影响Table 1 Effect of reaction time on chromaticity of glycation products反应时间
Reaction time/h亮度
L*红绿色度
a*黄蓝色度
b*色差
ΔE0 112.76±0.21 −0.65±0.02 8.85±0.32 1 112.25±0.12a 0.32±0.09g 11.96±0.04f 3.30±0.31g 2 112.23±0.15a 1.36±0.06f 13.32±0.11e 4.94±0.24f 4 106.68±0.08b 2.38±0.05e 18.24±0.13d 11.59±0.26e 6 102.78±0.12c 3.36±0.10d 21.82±0.11c 16.85±0.29d 8 97.83±1.15d 4.01±0.04c 22.33±0.33c 20.65±1.01c 10 94.83±1.15e 5.36±0.10b 23.88±0.31b 24.16±0.95b 12 80.69±0.51f 6.33±0.40a 27.44±0.59a 37.72±0.67a 注:同列中不同字母表示存在显著性差异 (P<0.05)。 Note: Values with different letters within the same column are significantly different (P<0.05). 2.3 粒径和电位
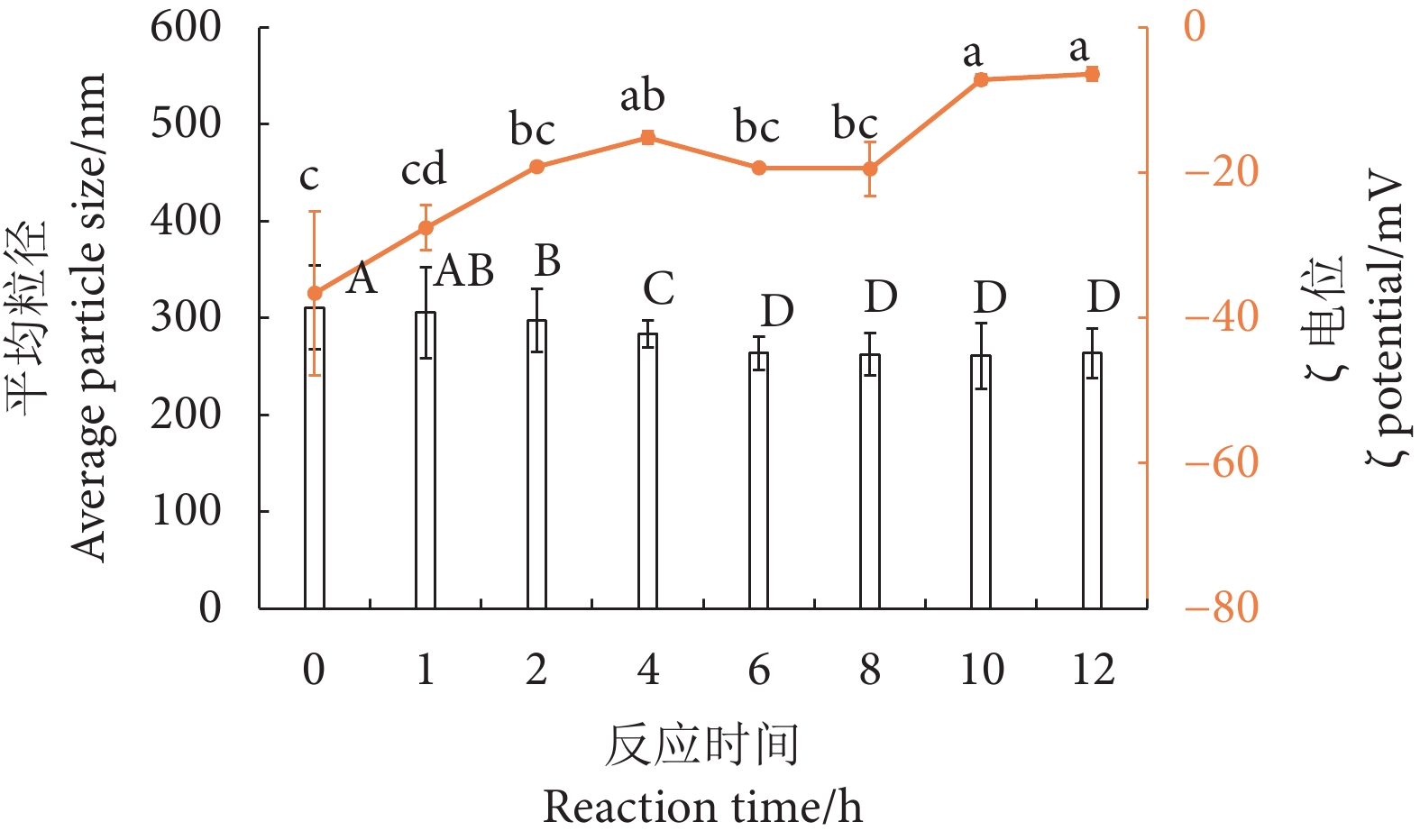
粒径和ζ电位结果如图3所示,随着糖基化反应时间的延长,糖基化产物的粒径先逐渐减小,而后趋于稳定,糖基化产物粒径从第0 小时的(310.9±10.26) nm减小至第6 小时的(263.6±6.39) nm,当反应超过6 h后无明显变化 (P>0.05)。王可[34]认为蛋白质和糖的结合可以提供更大的空间斥力,防止加热过程中蛋白质分子的聚集,从而导致蛋白质在溶液中更加均匀地分散,粒径显著减小。还可能因为较多的葡萄糖亲水基团接枝到蛋白质上,亲水基团的存在会减少蛋白质分子内的疏水作用,从而抑制蛋白质分子的聚集[35]。
ζ电位是蛋白质表面电荷密度的量度,而表面电荷影响着蛋白质稳定性和乳液的形成和稳定[36]。随着反应时间的延长,ζ电位绝对值逐渐减小,从第0 小时的(−36.56±11.28) mV 减小至第12 小时的(−6.39±0.95) mV。限制性酶解产物表现出较高的ζ负电位,表明其分子间存在强烈的表面静电斥力[37]。而糖基化反应会使蛋白质分子间的静电排斥作用减小,蛋白质更容易受到长时间高温或者葡萄糖接枝的影响,分子构象发生改变,进而使糖基化产物的电位绝对值降低,其稳定性也随之减弱。类似的,李琳[38]认为共价结合的葡聚糖可以覆盖在蛋白质表面,并且提供使蛋白质电荷远离水相的静电屏蔽效应,减少带电蛋白质与周围液体之间的静电相互作用,降低了糖基化产物表面的电荷数量,从而使ζ电位绝对值逐渐减小,与本研究结果一致。
2.4 分子质量
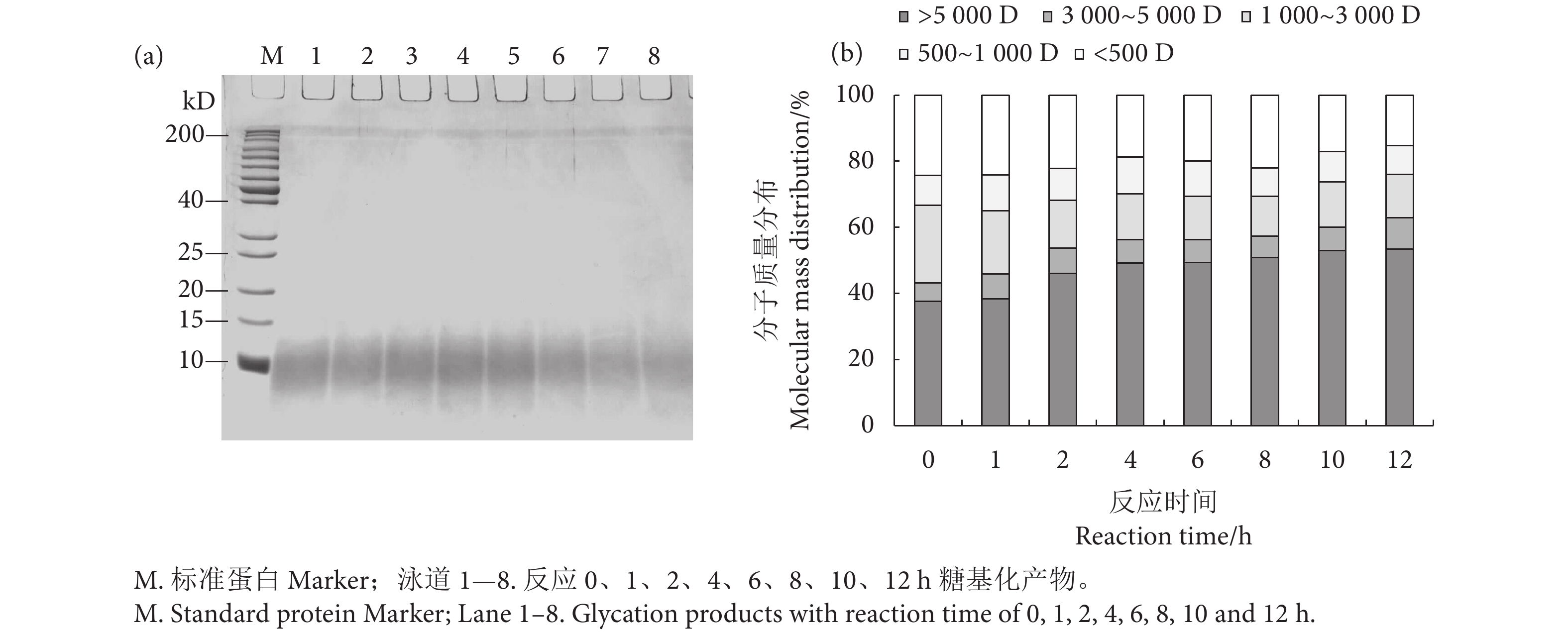
如图4-a所示,蓝圆鲹分离蛋白经过限制性酶解后,分离胶底部出现10 kD左右的扩散条带,随着糖基化反应时间的延长,扩散条带逐渐上移且颜色变浅。这可能是因为蛋白质氨基酸残基侧链共价结合葡萄糖基团,使蛋白质分子质量增大。游离氨基的数量减少同时也影响了与考马斯亮蓝的结合,从而导致凝胶条带颜色变浅[39]。
进一步用液相色谱法测定其分子质量分布,结果如图4-b所示,糖基化产物分子质量主要分布在5 000 D以上,随着反应时间的延长,1 000~3 000 D和500 D以下范围内的蛋白质含量逐渐减少,500~1 000 D和3 000~5 000 D的蛋白质含量不变,5 000 D以上的蛋白质逐渐增多。这是因为一方面小分子蛋白质/肽具有更高的反应活性,更容易与葡萄糖接枝[40]。另一方面,糖基化反应后期生成的类黑素是一种大分子物质,也可能引起大分子组分的增加[41]。
2.5 傅立叶红外光谱
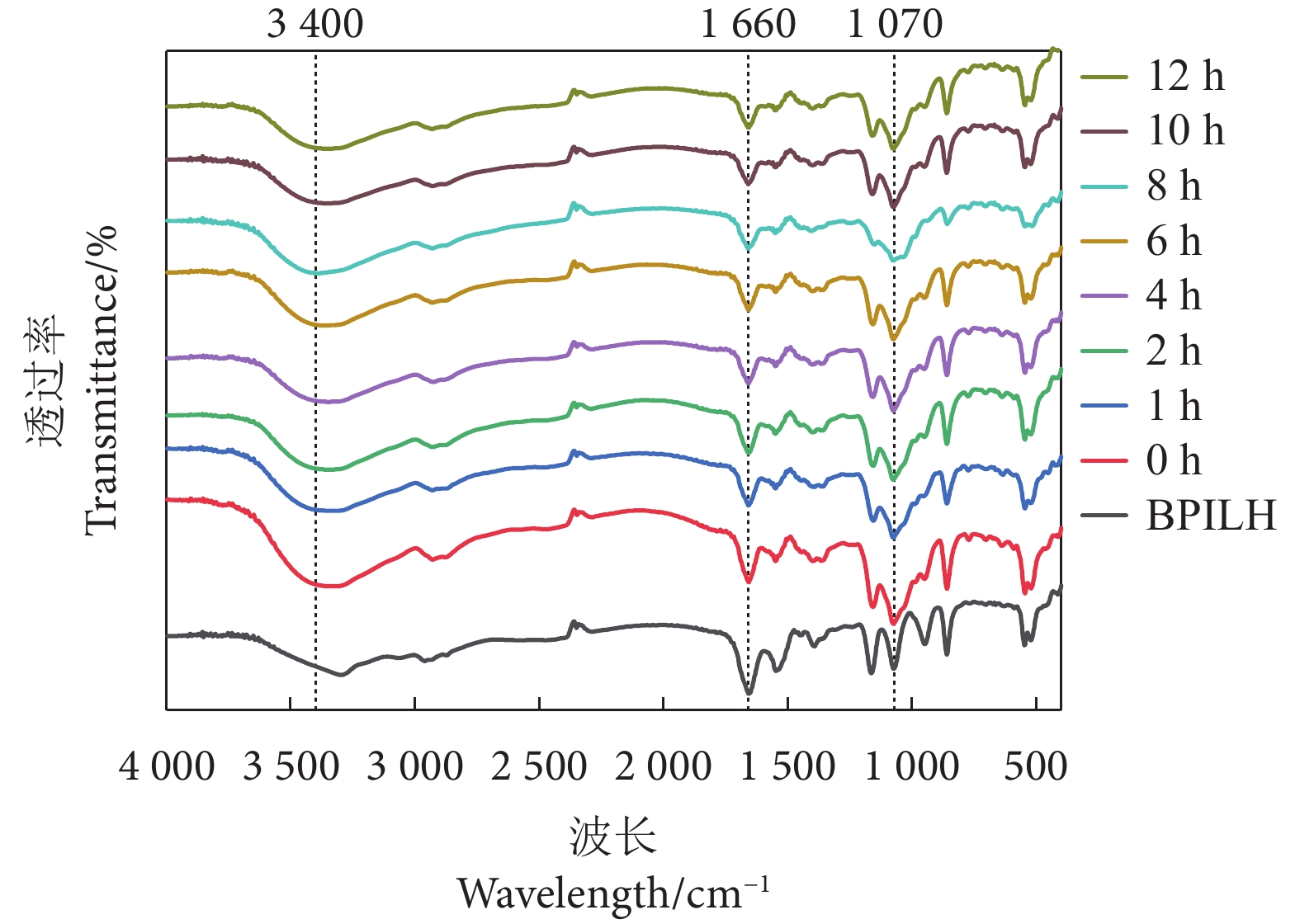
利用傅立叶红外光谱的吸收峰位置和大小变化,对糖基化产物结构进行表征。常用的化学键和官能团的特征范围主要有:3 600~3 100 cm−1为O-H伸缩振动,1 700~1 600 cm−1为C=O伸缩、N-H伸缩,1 450~1 200 cm−1为C-N伸展、N-H卷曲的酰胺II带,1 220~1 010 cm−1为C-N非对称伸展,1 100~1 000 cm−1为C-H、C-C、C=O弯曲振动[42]。对比0~12 h糖基化产物各组分发现,在1 660 cm−1处的吸收峰强度随着反应时间的延长而减弱,而1 100~900 cm−1范围的吸收峰强度则无明显变化,但均大于BPILH (图5)。此类现象可能原因有:1)由于葡萄糖成功接枝到蛋白质上,游离氨基减少,由此引起蛋白质结构发生了改变;2)糖类的特征吸收峰在1 100~900 cm−1,糖基化产物中的游离糖可能会影响该范围的峰值强度[16]。
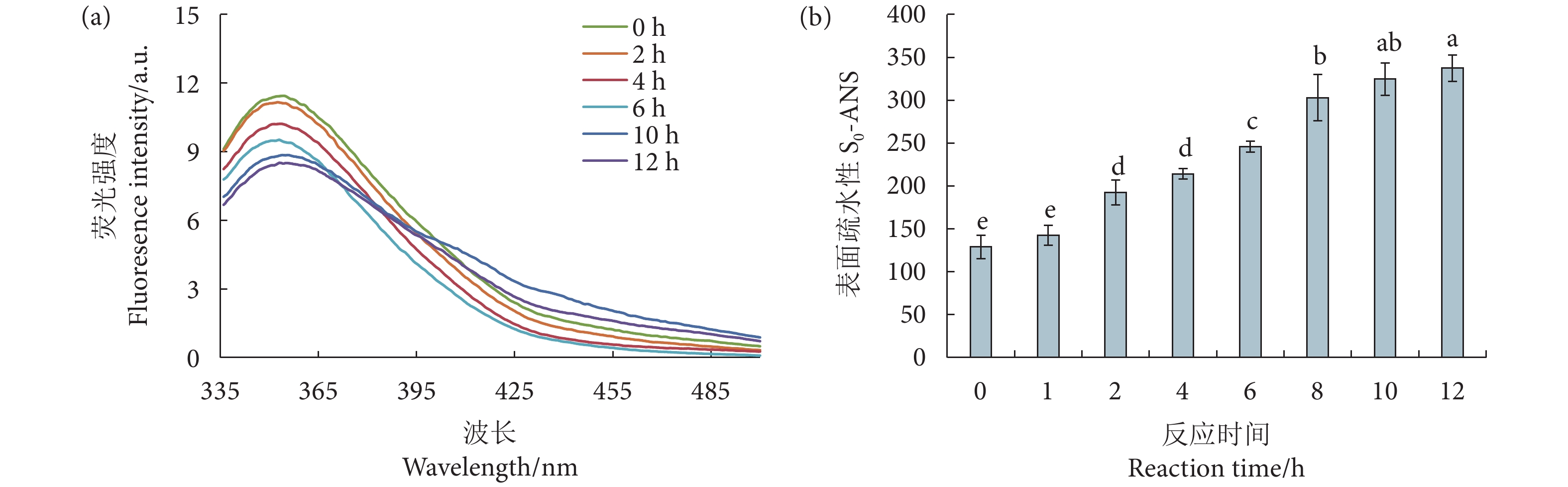
2.6 内源荧光和表面疏水性
利用内源荧光强度和峰位移来评估复合物中蛋白质的三级结构和疏水残基附近微环境的变化[43]。内源荧光结果如图6-a所示,随着糖基化反应时间的延长,糖基化产物的内源荧光强度逐渐降低,且第10 和第12 小时的糖基化产物的最大吸收波长 (λmax) 发生了红移。这可能是因为葡萄糖接枝到氨基上,引入了较多的亲水基团,掩盖了色氨酸残基,从而导致λmax红移。同时,长时间的高温导致蛋白质分子内部的疏水基团暴露在蛋白质表面,从而改变蛋白质构象,影响局部极性环境[44]。Stanic-Vucinic等[45]在研究β-乳球蛋白糖基化产物结构特性时也发现了单糖基团接入会屏蔽残基的荧光信号。这也表明内源荧光强度会随着糖基化程度的增加而降低。
表面疏水性结果如图6-b所示,随着反应时间的延长,糖基化产物的表面疏水性逐渐增加。这可能是因为长时间的高温环境容易破坏蛋白质的构象和结构,从而使蛋白质内部的疏水基团暴露在表面[46]。另外,当蛋白质分子之间形成的聚集体较少时,蛋白质粒径分布较小,也会导致较多的疏水基团暴露在蛋白质表面[47],本研究图3的粒径结果与此观点相印证。
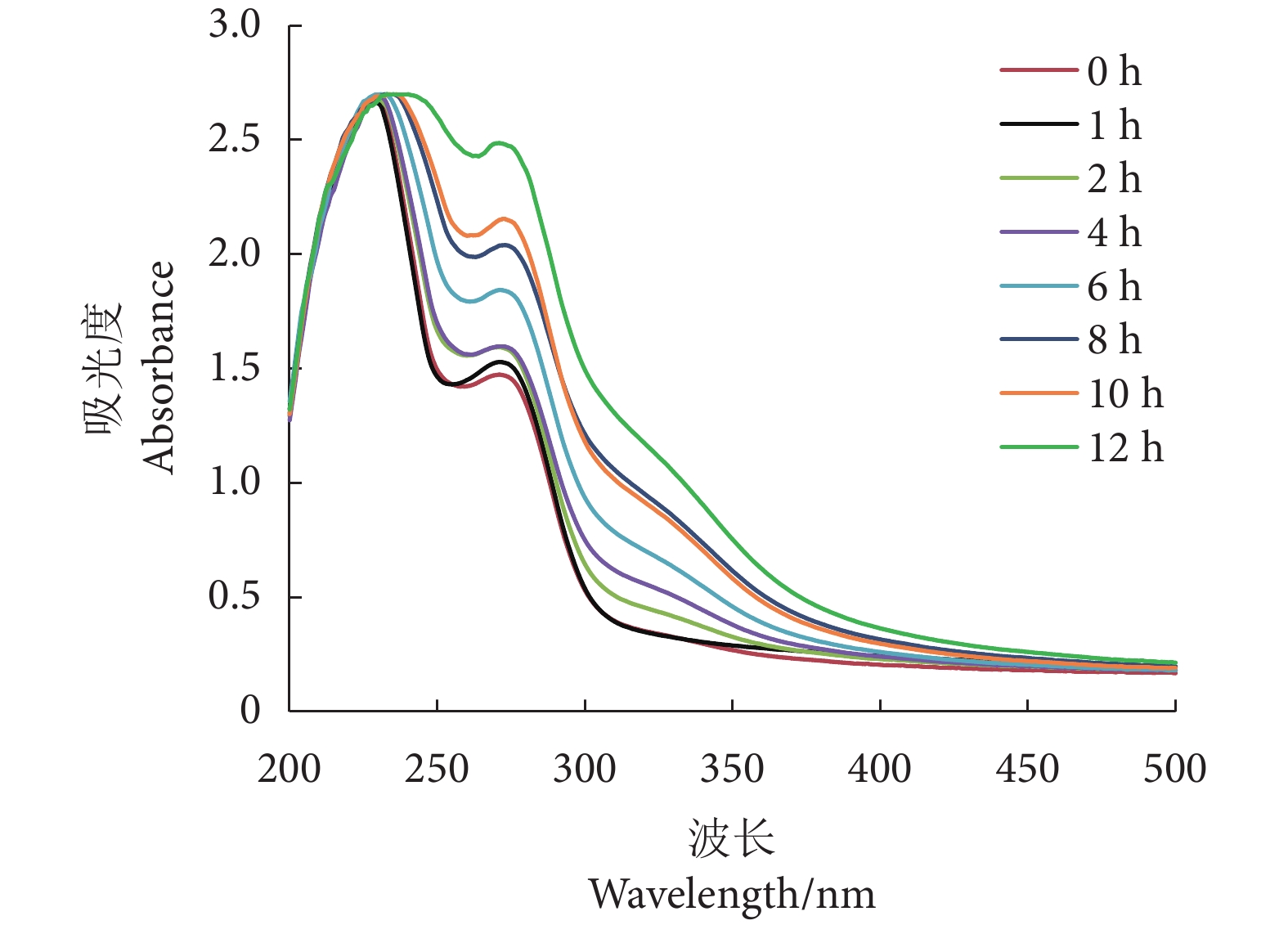
2.7 紫外光谱
紫外吸收光谱通过新形成的发色基团和吸收强度变化而被用于评估构象变化[48]。如图7所示,糖基化产物的λmax分别出现在235 和277 nm处,随着反应时间的延长,235 nm处的峰值强度无明显变化,277 nm处的峰值强度逐渐增加。235 和277 nm处的吸收峰分别与肽键变化和呈色基团有关[49],235 nm处吸收峰强度不变说明糖基化反应对蛋白质的一级结构未产生影响,肽键数量未发生改变。本研究277 nm处吸收峰的变化与葡聚糖改性卵清蛋白[16]类似,这可能是因为糖基化反应使蛋白质结构展开,导致蛋白质三级结构发生改变,从而引起微环境的极性变化,分子内部更多疏水性助色基团暴露。另外,270~292 nm范围为类黑素的表征区域[50],糖基化终端产物类黑素,也会引起此范围吸光度的增加。
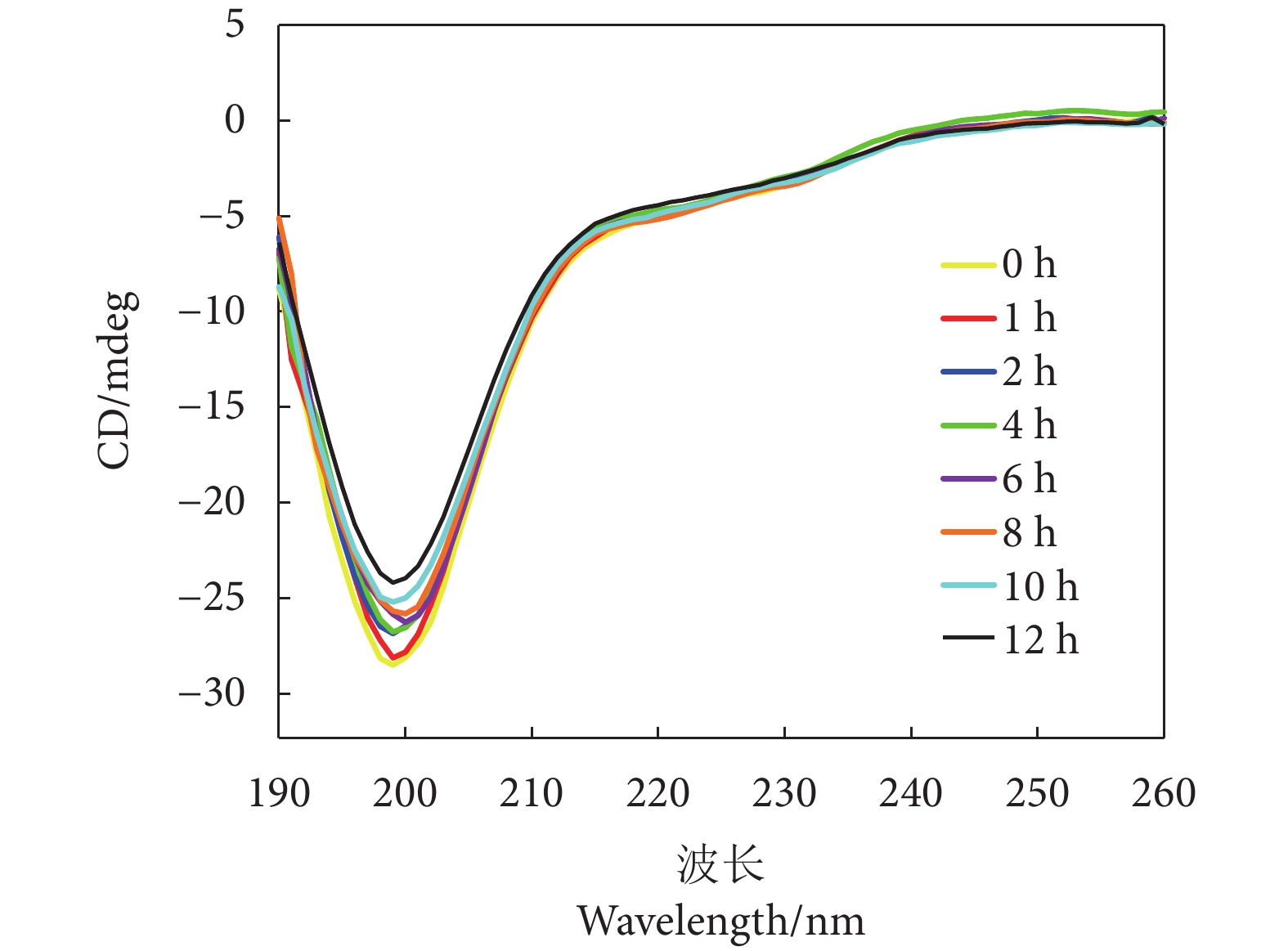
2.8 圆二色谱
如图8所示,经糖基化修饰后,产物在190~230 nm均出现负峰值,随着反应时间的延长,光谱呈现负峰逐渐减小的趋势。典型的α螺旋在209 和222 nm左右有特征负峰出现,β折叠的典型特征负峰出现在215 nm左右,无规则卷曲出现在196 nm左右[51]。195~209 nm负峰的强度明显降低,表明α螺旋和无规则卷曲含量减少。可能是因为长时间加热和单糖糖基化会影响蛋白质的二级结构,随着糖基化程度的增加,糖的还原性端羰基与蛋白质α螺旋区域的ε-氨基形成键,从而导致α螺旋含量降低,蛋白质结构向无序状态转变[52]。
2.9 溶解度
表2是不同反应时间50 mg·mL−1糖基化产物在pH 为2、4、6、8、10条件下的溶解度。随着反应时间的延长,糖基化产物的溶解度均有所升高,但第10 小时之后,溶解度有下降的趋势,第8 小时糖基化产物在所有pH范围的溶解度最高,且糖基化产物在酸性条件下的溶解度显著低于碱性条件下 (P<0.05),本研究5 mg·mL−1第8小时糖基化产物在pH 10时达到最高值 (90.49±0.01)%。相比之下,1 mg·mL−1糖基化改性苦杏仁粕谷蛋白在pH 9的条件下溶解度达到最高值91.15%[53],这说明糖基化对BPILH溶解度改善效果较好。溶解度的提升主要是因为亲水性的葡萄糖基团接枝到蛋白质的氨基上,使蛋白质具有更好的亲水性,进而呈现出较好的pH稳定性。而反应后期溶解度降低的原因可能包含以下两个方面:1) 由表面疏水性结果可知,糖基化反应会改变蛋白质的构象,随着反应时间的延长,更多的疏水基团暴露在蛋白质表面,进而影响蛋白质的溶解度;2) 糖基化反应后期会产生不溶于水的类黑素聚合体,也会影响产物溶解度。而张玥等[53]还发现糖基化反应时间过长会使原本断裂的肽键重新聚合,蛋白质的疏水基团增多,从而导致产物溶解度下降。因此,过长的反应时间可能不利于溶解度的改善。
表 2 不同反应时间糖基化产物的溶解度Table 2 Solubility of glycation products at different reaction time% 反应时间
Reaction time/hpH 2 4 6 8 10 0 46.97±0.07eG 55.96±0.07dE 59.17±0.07cH 80.71±0.03aE 77.94±0.04bG 1 51.22±0.02eD 52.78±0.03dH 63.94±0.07cG 80.67±0.04aE 76.70±0.04bH 2 49.56±0.05eE 53.26±0.06dG 66.22±0.04cF 81.29±0.06aD 80.50±0.04bE 4 48.19±0.02eF 54.20±0.06dF 74.38±0.04cB 84.20±0.05aC 78.25±0.04bF 6 52.16±0.01eC 57.03±0.04dC 71.06±0.01cD 85.72±0.01aB 81.71±0.03bD 8 51.15±0.04eD 60.66±0.06dA 75.73±0.04cA 87.03±0.03bA 90.49±0.01aA 10 52.31±0.01eB 59.25±0.03dB 73.15±0.09cC 73.81±0.08bG 86.96±0.04aB 12 48.58±0.12eA 56.31±0.01dD 68.74±0.10cE 75.13±0.03bF 85.42±0.02aC 注:同行不同小写字母表示相同反应时间在不同pH条件下存在显著性差异 (P<0.05),同列不同大写字母表示不同反应时间在相同pH条件下存在显著性差异 (P<0.05)。 Note: Different lowercase letters within the same row represent significant differences of the same reaction time under different pH conditions (P<0.05), while different uppercase letters within the same column represent significant differences of different reaction time under the same pH condition (P<0.05). 2.10 乳化性和乳化稳定性
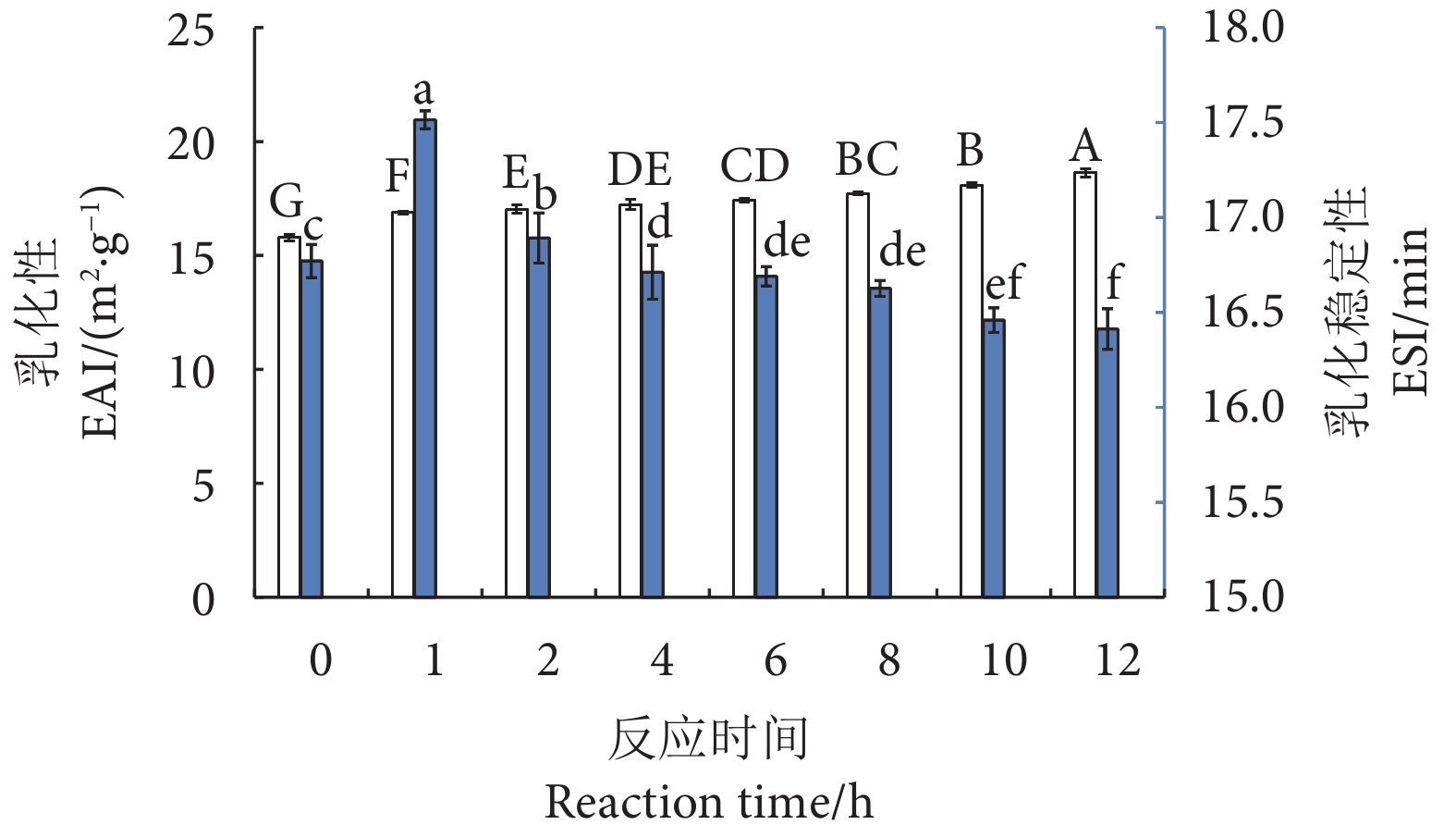
乳化性和乳化稳定性是蛋白质的重要功能特性之一,能够表征蛋白质分子间以及蛋白质与脂肪的结合能力。如图9所示,随着反应时间延长,乳化性逐渐增加,在第12小时达到(18.63±0.08) m2·g−1,与第0小时相比提升了24.28%。乳化稳定性呈现先升后降的趋势,并在反应第1 小时达到最高值 (17.51±0.13) min,与第0 小时相比提升了11.03%,在第12小时下降至(16.41±0.04) min。乳化性和乳化稳定性的增加可能是因为糖基化修饰后的蛋白质具有更高的表面疏水性,而连接的糖基具有较好的亲水性,从而使糖基化产物兼具亲水与亲油特性[54],糖基化产物能够迅速扩散,吸附到油滴表面,并形成大分子稳定层[41]。然而,随着反应时间的延长,糖基化产物分子间的静电排斥作用逐渐减小,吸附油滴的稳定性降低,乳化稳定性也随之降低,这与本研究ζ电位结果相一致。此外,随着更多的葡萄糖被接枝在蛋白质的氨基上,蛋白质的两亲性发生了改变,油相平衡的位点减少,也可能导致乳化稳定性的降低。另外,长时间的糖基化处理可能会使蛋白质热变性缩合,导致其溶解度降低,进而影响乳化性能[55]。
2.11 持油性
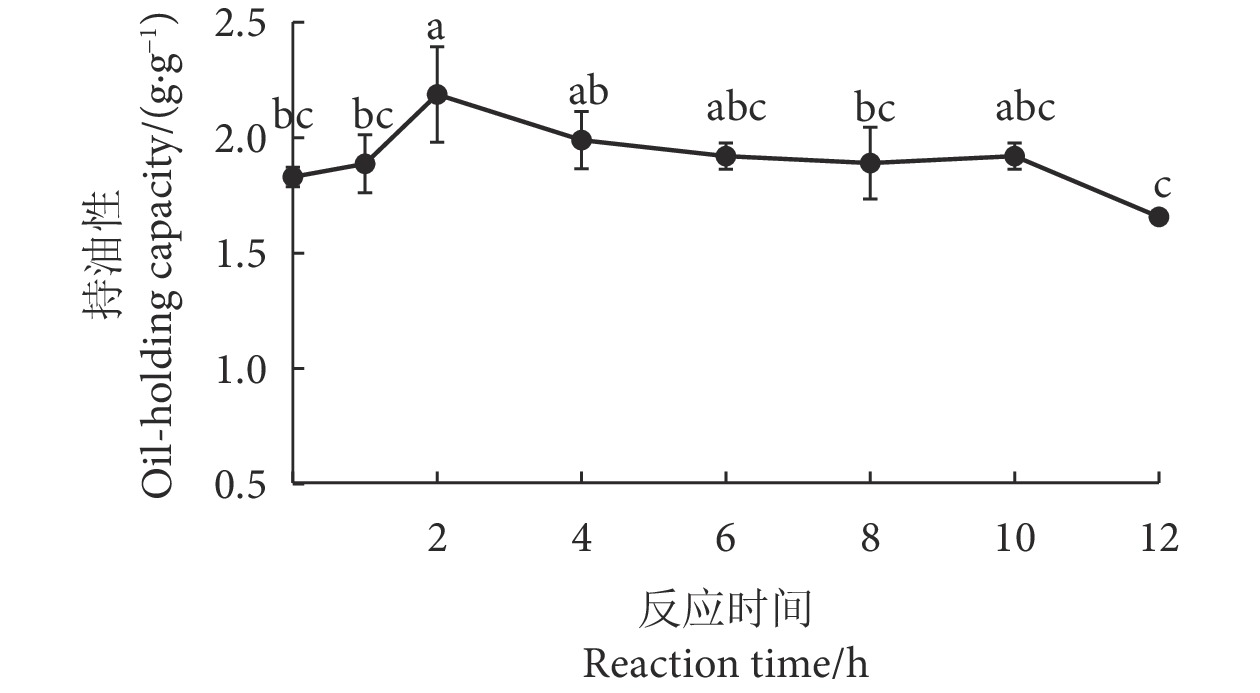
蛋白质较好的持油性可赋予食品更佳的口感与质构。如图10所示,糖基化产物的持油性随着反应时间的延长呈现先升后降的趋势,并在反应第2小时达到最大值 (2.19±0.21) g·g−1,比第0 小时对照组提升了19.67%,而常雨晴[41]利用木糖糖基化改性带鱼 (Trichiurus haumela) 多肽的持油性达0.927 mL·g−1。持油性的增加可归因于蛋白质本身的结构构象和糖基化反应的影响,糖基化修饰后的蛋白质具有更松散的空间结构和更高的表面疏水性,使其对油脂具有较强的吸附能力[56]。但随着反应时间的延长,糖基化产物的持油性逐渐降低,这种现象可能是由于蛋白质分子间的静电排斥作用因葡萄糖接枝程度的增加而逐渐减小,从而导致结构稳定性降低。此外,过多的亲水基团接枝在蛋白质的氨基上,也会使蛋白质油相平衡的位点减少,最终导致持油性减弱[28]。
2.12 SEM
扫描电镜结果如图11所示,由于限制性酶解作用,BPILH (图11-a) 呈现不规则碎片状,从图11-b可以看出,葡萄糖附着在碎片状的蛋白质上,随着反应时间的延长,附着在蛋白质表面的葡萄糖出现细条纹 (图11-d),且与碎片状蛋白质逐渐开始融合,表观形态逐渐从碎片状变为有孔隙的块状,孔隙数量随着反应时间的延长逐渐减少。刘鑫慧[57]也发现了面筋蛋白酶解物糖基化反应后蛋白质体积增大的现象。产生这一现象的原因可能是糖基化反应使葡萄糖接枝在蛋白质氨基上,形成了分子质量更大的共价化合物,从而使蛋白质从碎片状趋向于孔隙较少的块状。
3. 结论
本研究探讨了葡萄糖糖基化对蓝圆鲹限制性酶解改性分离蛋白产物结构和功能特性的影响。结果表明,糖基化反应主要作用在分子质量小于500 D和介于1 000~3 000 D的蛋白质上,中后期会产生褐色的含氮聚合物从而改变蛋白质的色度。糖基化反应过程中蛋白质侧链共价结合葡萄糖亲水基团和长时间的高温环境会使蛋白质表面电荷数发生改变,ζ电位绝对值下降,粒径逐渐减小后趋于稳定。从构象上看,一方面糖基化过程中糖的还原性羰基与蛋白质的共价结合会促使蛋白质的二级结构向无序状态转变,另一方面葡萄糖基团的接入会掩盖色氨酸残基,从而降低糖基化产物的内源荧光强度。此外,糖基化过程中的高温促使蛋白质疏水基团暴露,表面疏水性增加。疏水基团的暴露还可以促进蛋白质对油脂的吸附,进一步改善了糖基化产物的持油力、乳化性和乳化稳定性,而亲水基团的接入提高了糖基化产物的溶解度,但接入过多的亲水基团会对其功能特性产生一定的负面影响。因此,糖基化反应有助于对蛋白质的定向改性,改善其功能性质。
-
表 1 反应时间对糖基化产物色度的影响
Table 1 Effect of reaction time on chromaticity of glycation products
反应时间
Reaction time/h亮度
L*红绿色度
a*黄蓝色度
b*色差
ΔE0 112.76±0.21 −0.65±0.02 8.85±0.32 1 112.25±0.12a 0.32±0.09g 11.96±0.04f 3.30±0.31g 2 112.23±0.15a 1.36±0.06f 13.32±0.11e 4.94±0.24f 4 106.68±0.08b 2.38±0.05e 18.24±0.13d 11.59±0.26e 6 102.78±0.12c 3.36±0.10d 21.82±0.11c 16.85±0.29d 8 97.83±1.15d 4.01±0.04c 22.33±0.33c 20.65±1.01c 10 94.83±1.15e 5.36±0.10b 23.88±0.31b 24.16±0.95b 12 80.69±0.51f 6.33±0.40a 27.44±0.59a 37.72±0.67a 注:同列中不同字母表示存在显著性差异 (P<0.05)。 Note: Values with different letters within the same column are significantly different (P<0.05). 表 2 不同反应时间糖基化产物的溶解度
Table 2 Solubility of glycation products at different reaction time
% 反应时间
Reaction time/hpH 2 4 6 8 10 0 46.97±0.07eG 55.96±0.07dE 59.17±0.07cH 80.71±0.03aE 77.94±0.04bG 1 51.22±0.02eD 52.78±0.03dH 63.94±0.07cG 80.67±0.04aE 76.70±0.04bH 2 49.56±0.05eE 53.26±0.06dG 66.22±0.04cF 81.29±0.06aD 80.50±0.04bE 4 48.19±0.02eF 54.20±0.06dF 74.38±0.04cB 84.20±0.05aC 78.25±0.04bF 6 52.16±0.01eC 57.03±0.04dC 71.06±0.01cD 85.72±0.01aB 81.71±0.03bD 8 51.15±0.04eD 60.66±0.06dA 75.73±0.04cA 87.03±0.03bA 90.49±0.01aA 10 52.31±0.01eB 59.25±0.03dB 73.15±0.09cC 73.81±0.08bG 86.96±0.04aB 12 48.58±0.12eA 56.31±0.01dD 68.74±0.10cE 75.13±0.03bF 85.42±0.02aC 注:同行不同小写字母表示相同反应时间在不同pH条件下存在显著性差异 (P<0.05),同列不同大写字母表示不同反应时间在相同pH条件下存在显著性差异 (P<0.05)。 Note: Different lowercase letters within the same row represent significant differences of the same reaction time under different pH conditions (P<0.05), while different uppercase letters within the same column represent significant differences of different reaction time under the same pH condition (P<0.05). -
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2023中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2023: 39-41. [2] 沈月新. 水产食品学[M]. 北京: 中国农业出版社, 2001: 21. [3] 王伟, 刘俊荣, 马永生, 等. 等电点沉淀法鱼分离蛋白结构与功能变化研究进展[J]. 食品科学, 2015, 36(1): 250-255. [4] KLOST M, DRUSCH S. Functionalisation of pea protein by tryptic hydrolysis: characterisation of interfacial and functional properties[J]. Food Hydrocoll, 2019, 86(1): 134-140.
[5] NISOV A, ERCILI-CURA D, NORDLUND E. Limited hydrolysis of rice endosperm protein for improved techno-functional properties[J]. Food Chem, 2020, 302: 125274. doi: 10.1016/j.foodchem.2019.125274
[6] 刘伟峰. 限制性酶解对蓝圆鲹分离蛋白功能特性的影响[D]. 厦门: 集美大学, 2020: 19. [7] YUAN F Z, AHMED I, LV L T, et al. Impacts of glycation and transglutaminase-catalyzed glycosylation with glucosamine on the conformational structure and allergenicity of bovine β-lactoglobulin[J]. Food Funct, 2018, 9(7): 3944-3955. doi: 10.1039/C8FO00909K
[8] KATO A, SASAKI Y, FURUTA R, et al. Functional protein- polysaccharide conjugate prepared by controlled dry-heating of ovalbumin-dextran mixtures[J]. Agric Biol Chem, 1990, 54(1): 107-112.
[9] LI Y L, HOU F, YANG Z T, et al. The growth of N-doped carbon nanotube arrays on sintered Al2O3 substrates[J]. Mater Sci Eng B, 2009, 158(1/2/3): 69-74.
[10] ZHU D, DAMODARAN S, LUCEY J A. Physicochemical and emulsifying properties of whey protein isolate (WPI)-dextran conjugates produced in aqueous solution[J]. J Agric Food Chem, 2010, 58(5): 2988-2994. doi: 10.1021/jf903643p
[11] MU L X, ZHAO M M, YANG B, et al. Effect of ultrasonic treatment on the graft reaction between soy protein isolate and gum acacia and on the physicochemical properties of conjugates[J]. J Agric Food Chem, 2010, 58(7): 4494-4499. doi: 10.1021/jf904109d
[12] JIANG Z, BRODKORB A. Structure and antioxidant activity of Maillard reaction products from α-lactalbumin and β-lactoglobulin with ribose in an aqueous model system[J]. Food Chem, 2012, 133(3): 960-968. doi: 10.1016/j.foodchem.2012.02.016
[13] YANG S, LEE S, PYO M C, et al. Improved physicochemical properties and hepatic protection of Maillard reaction products derived from fish protein hydrolysates and ribose[J]. Food Chem, 2017, 221: 1979-1988. doi: 10.1016/j.foodchem.2016.11.145
[14] DECOURCELLE N, SABOURIN C, DAUER G, et al. Effect of the Maillard reaction with xylose on the emulsifying properties of a shrimp hydrolysate (Pandalus borealis)[J]. Food Res Int, 2010, 43(8): 2155-2160. doi: 10.1016/j.foodres.2010.07.026
[15] DONG S Y, WEI B B, CHEN B C, et al. Chemical and antioxidant properties of casein peptide and its glucose Maillard reaction products in fish oil-in- water emulsions[J]. J Agric Food Chem, 2011, 59(24): 13311-13317. doi: 10.1021/jf203778z
[16] 董烨, 张益奇, 张晓頔, 等. 鳙鱼皮水解物美拉德反应产物抗氧化活性研究[J]. 核农学报, 2022, 36(11): 2199-2209. [17] 马露燕. 低聚木糖糖基化豌豆蛋白构建微囊体系及其性能研究[D]. 郑州: 河南工业大学, 2023: 26. [18] WANG L H, SUN X, HUANG G Q, et al. Conjugation of soybean protein isolate with xylose/fructose through wet-heating Maillard reaction[J]. J Food Meas Charact, 2018, 12(4): 2718-2724. doi: 10.1007/s11694-018-9889-y
[19] 孙乐常, 刘伟峰, 林怡晨, 等. 碱性蛋白酶限制性酶解对蓝圆鲹分离蛋白功能特性的影响[J]. 食品科学, 2021, 42 (2): 23-29. [20] ZHANG Y Y, XU J M, ZHANG T, et al. Effect of carbon numbers and structures of monosaccharides on the glycosylation and emulsion stabilization ability of gelatin[J]. Food Chem, 2022, 389: 133128. doi: 10.1016/j.foodchem.2022.133128
[21] WANG W L, ZHANG L, WANG Z Q, et al. Physicochemical and sensory variables of Maillard reaction products obtained from Takifugu obscurus muscle hydrolysates[J]. Food Chem, 2019, 290: 40-46. doi: 10.1016/j.foodchem.2019.03.065
[22] 詹梦涛, 娄水珠, 刘仙花, 等. 3, 5-二硝基水杨酸法测定液体糖中总糖含量[J]. 云南民族大学学报(自然科学版), 2020, 29(4): 317-321. [23] LIU C, WANG Z J, JIN H, et al. Effect of enzymolysis and glycosylation on the curcumin nanoemulsions stabilized by β-conglycinin: formation, stability and in vitro digestion[J]. Int J Biol Macromol, 2020, 142: 658-667.
[24] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227(5259): 680-685. doi: 10.1038/227680a0
[25] WU Q, CAI Q F, TAO Z P, et al. Purification and characterization of a novel angiotensin I-converting enzyme inhibitory peptide derived from abalone (Haliotis discus hannai Ino) gonads[J]. Eur Food Res Technol, 2015, 240(1): 137-145. doi: 10.1007/s00217-014-2315-8
[26] WANG Y, ZHOU Y, WANG X X, et al. Origin of high-pressure induced changes in the properties of reduced-sodium chicken myofibrillar protein gels containing CaCl2: physicochemical and molecular modification perspectives[J]. Food Chem, 2020, 319: 126535. doi: 10.1016/j.foodchem.2020.126535
[27] CAO L, SU S, REGENSTEIN J M, et al. Ca2+-induced conformational changes of myosin from silver carp (Hypophthalmichthys molitrix) in Gelation[J]. Food Biophys, 2015, 10(4): 447-455. doi: 10.1007/s11483-015-9408-1
[28] 陈思如. 低聚木糖糖基化改性酪蛋白的功能特性及应用[D]. 长春: 吉林大学, 2022: 38-39. [29] GONG K J, SHI A M, LIU H Z, et al. Emulsifying properties and structure changes of spray and freeze-dried peanut protein isolate[J]. J Food Eng, 2016, 170: 33-40. doi: 10.1016/j.jfoodeng.2015.09.011
[30] TAN E S, NGOH Y Y, GAN C Y. A comparative study of physicochemical characteristics and functionalities of pinto bean protein isolate (PBPI) against the soybean protein isolate (SPI) after the extraction optimisation[J]. Food Chem, 2014, 152: 447-455.
[31] 冷雪冬. 稻米米糠蛋白复合多糖脂肪替代物制备及应用研究[D]. 大庆: 黑龙江八一农垦大学, 2023: 5-6. [32] MARKOWICZ B D. Maillard reaction products in processed food: pros and cons[M]. London: IntechOpen, 2012: 281-299.
[33] 张杨翌. 糖基化改性对明胶结构和乳化性的影响研究[D]. 上海: 上海海洋大学, 2022: 16. [34] 王可. 木质化鸡胸肉分级模型构建与过氧化氢体外氧化肌原纤维蛋白劣变机制及功能特性改善[D]. 泰安: 山东农业大学, 2023: 59-60. [35] XU Y J, ZHAO Y Q, WEI Z X, et al. Modification of myofibrillar protein via glycation: physicochemical characterization, rheological behavior and solubility property[J]. Food Hydrocoll, 2020, 105(7): 105852.
[36] SHANMUGAM A, ASHOKKUMAR M. Ultrasonic preparation of stable flax seed oil emulsions in dairy systems: physicochemical characterization[J]. Food Hydrocoll, 2014, 39: 151-162. doi: 10.1016/j.foodhyd.2014.01.006
[37] WONG B T, DAY L, AUGUSTIN M A. Deamidated wheat protein-dextran Maillard conjugates: effect of size and location of polysaccharide conjugated on steric stabilization of emulsions at acidic pH[J]. Food Hydrocoll, 2011, 25(6): 1424-1432. doi: 10.1016/j.foodhyd.2011.01.017
[38] 李琳. 限制性酶解结合糖基化处理对大豆分离蛋白结构与加工特性的影响[D]. 雅安: 四川农业大学, 2021: 36-37. [39] LIU G, LI W R, QIN X G, et al. Pickering emulsions stabilized by amphiphilic anisotropic nanofibrils of glycated whey proteins[J]. Food Hydrocoll, 2020, 101(4): 105503.
[40] 丁俭, 黄祯秀, 杨梦竹, 等. 食源蛋白水解物/多肽与糖类物质美拉德反应产物在食品应用中的研究进展[J]. 食品科学, 2023, 44(1): 305-318. [41] 常雨晴. 带鱼多肽制备及美拉德反应对其性质影响研究[D]. 大连: 大连海洋大学, 2023: 25-26. [42] JACKSON M, MANTSCH H H. The use and misuse of FTIR spectroscopy in the determination of protein structure[J]. Crit Rev Biochem Mol Biol, 1995, 30(2): 95-120. doi: 10.3109/10409239509085140
[43] LIU J H, FANG C H, XU X, et al. Structural changes of silver carp myosin glycated with konjac oligo- glucomannan: effects of deacetylation[J]. Food Hydrocoll, 2019, 91: 275-282. doi: 10.1016/j.foodhyd.2019.01.038
[44] 王秋野. 豌豆蛋白基植物肉的研制及特性分析[D]. 哈尔滨: 东北农业大学, 2021: 44-45. [45] STANIC-VUCINIC D, PRODIC I, APOSTOLOVIC D, et al. Structure and antioxidant activity of β-lactoglobulin-glycoconjugates obtained by high-intensity-ultrasound-induced Maillard reaction in aqueous model systems under neutral conditions[J]. Food Chem, 2013, 138(1): 590-599. doi: 10.1016/j.foodchem.2012.10.087
[46] 张燕鹏, 张曼君, 齐玉堂, 等. 微波-超声波协同影响菜籽蛋白糖基化改性[J]. 食品科学, 2017, 38(17): 114-119. [47] 齐宝坤, 李杨, 王中江, 等. 不同品种大豆分离蛋白Zeta电位和粒径分布与表面疏水性的关系[J]. 食品科学, 2017, 38(3): 114-118. [48] LILIENTHAL S, DROTLEFF A M, TERNES W. Changes in the protein secondary structure of hen's egg yolk determined by Fourier transform infrared spectroscopy during the first eight days of incubation[J]. Poultry Sci, 2015, 94(1): 68-79. doi: 10.3382/ps/peu051
[49] KUCHLYAN J, KUNDU N, BANIK D, et al. Spectroscopy and fluorescence lifetime imaging microscopy to probe the interaction of bovine serum albumin with graphene oxide[J]. Langmuir, 2015, 31(51): 13793-13801. doi: 10.1021/acs.langmuir.5b03648
[50] KIM J, LEE Y. Effect of reaction pH on enolization and racemization reactions of glucose and fructose on heating with amino acid enantiomers and formation of melanoidins as result of the Maillard reaction[J]. Food Chem, 2008, 108(2): 582-592. doi: 10.1016/j.foodchem.2007.11.014
[51] 赵新淮等. 食品蛋白质[M]. 北京: 科学出版社, 2009: 138-139. [52] 闫雨洁. 超声结合糖基化反应改性卵白蛋白及其理化性质与乳化性能研究[D]. 南宁: 广西大学, 2021: 19-20. [53] 张玥, 李芳, 李菊梅, 等. 葡萄糖修饰苦杏仁粕谷蛋白糖基化反应条件的优化[J]. 食品研究与开发, 2022, 43(3): 94-101. [54] XUE F, LI C, ZHU X W, et al. Comparative studies on the physicochemical properties of soy protein isolate-maltodextrin and soy protein isolate-gum acacia conjugate prepared through Maillard reaction[J]. Food Res Int, 2013, 51(2): 490-495. doi: 10.1016/j.foodres.2013.01.012
[55] 刘杰. 糖基化明胶的制备及其在藻油微胶囊中的应用[D]. 重庆: 西南大学, 2023: 24-25. [56] WANG Y Y, ZHANG A Q, WANG Y X, et al. Effects of irradiation on the structure and properties of glycosylated soybean proteins[J]. Food Funct, 2020, 11(2): 1635-1646. doi: 10.1039/C9FO01879D
[57] 刘鑫慧. 蛋白酶对面筋蛋白糖基化产物特性及饼干品质的影响[D]. 郑州: 河南工业大学, 2023: 26-28.



 下载:
下载:


 粤公网安备 44010502001741号
粤公网安备 44010502001741号
