Trophic niche partitioning of pelagic shark of tropical Atlantic based on muscle and liver fatty acid profile analysis
-
摘要:
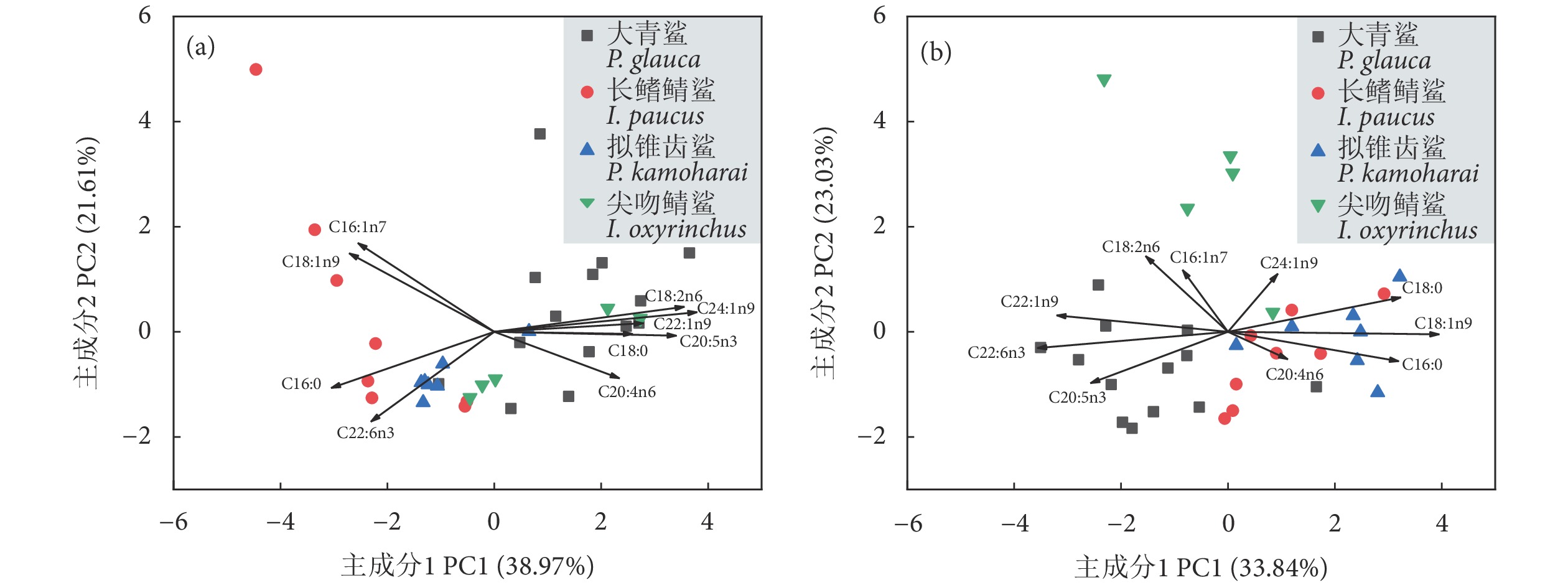
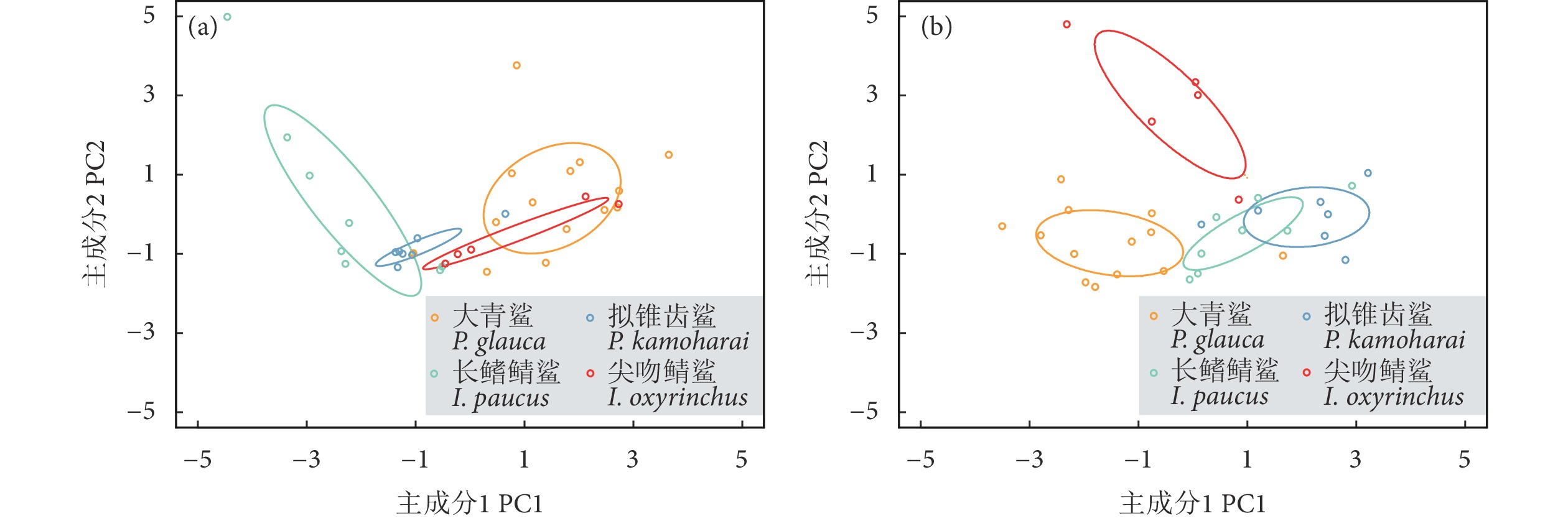
多组织脂肪酸组成分析可反映生物不同时间尺度的摄食信息,对探讨大型顶级捕食者群落内物种间的营养生态位分化具有重要指示作用。通过测定热带大西洋中上层鲨鱼——大青鲨 (Prionace glauca)、长鳍鲭鲨 (Isurus paucus)、拟锥齿鲨 (Pseudocarcharias kamoharai) 和尖吻鲭鲨 (I. oxyrinchus) 肝脏和肌肉的脂肪酸组成,探究4种鲨鱼短期 (肝脏) 和长期 (肌肉) 摄食策略及营养关系的变化情况。结果显示,4种鲨鱼存在不同程度的食性或栖息地差异,长鳍鲭鲨与拟锥齿鲨营养生态位重叠度较高,两者存在激烈的摄食与栖息地竞争;而长鳍鲭鲨与尖吻鲭鲨生态位分离,两者存在摄食隔离。大青鲨营养生态位宽度较大,表明其对环境的适应性较强,而拟锥齿鲨营养生态位宽度较小,表现为食性特化。比较肝脏和肌肉脂肪酸组成发现,鲨鱼在不同时期的资源分配模式不同,尖吻鲭鲨与大青鲨肌肉的营养生态位重叠最高,而肝脏却分离,说明二者在较长的时间尺度上存在摄食竞争。该研究结果有助于揭示大洋性鲨鱼的共存机制。
Abstract:Multi-tissue fatty acid profile analysis reflects dietary information of organisms at different time scales, which plays an important indicative role in exploring trophic niche partitioning among large apex predators. In this study, we investigated the trophic niche partitioning of four shark species in the upper middle layer of tropical Atlantic Ocean (Prionace glauca, Isurus paucus, Pseudocarcharias kamoharai, I. oxyrinchus) by measuring the fatty acid profiles of their muscle and liver, to reveal the short-term and long-term feeding strategies and nutritional relationships. The results show that the four shark species had diverse degrees of dietary or habitat variation, and high trophic niche overlap was found between I. paucus and P. kamoharai, with intense dietary and habitat competition. However, there was trophic niche partitioning between I. paucus and I. oxyrinchus, indicating their dietary separation. P. glauca had relatively longer trophic niche width, indicating greater environmental plasticity, while the smaller one of P. kamoharai indicates dietary specialization. Comparison of liver and muscle fatty acid profiles reveals variable resource allocation patterns among sharks over time, with the highest overlap of trophic niche between the muscle of I. oxyrinchus and P. glauca, but separation of livers suggests intense competition for long-term feeding. The results help to understand the coexistence mechanisms of pelagic sharks.
-
Keywords:
- Pelagic shark /
- Fatty acids /
- Feeding ecology /
- Trophic niche /
- Multiple tissues
-
我国罗非鱼产量居世界首位,广东省罗非鱼产量占全国的一半。由于罗非鱼品质优异,肉质鲜美,骨刺少,深受消费者欢迎,国内外对其需求量越来越大。罗非鱼在加工过程会产生大量的加工下脚料——鱼皮、鱼骨、鱼头、内脏等,目前这部分加工下脚料主要用于加工成饲料鱼粉,或将鱼头、鱼骨加工成鱼骨粉等,而对鱼皮的利用却较少。随着我国经济的发展和人们生活水平的提高,目前休闲食品已成为市场消费的热点之一。罗非鱼综合利用的首选思路是将鱼片加工后的下脚料加工成休闲食品,这是最具市场前景和经济效益前景的研发方向。
罗非鱼的商品规格为每尾约0.50~0.55 kg,其中鱼皮占整条鱼重量的5%~6%。鱼皮中含水分68.5%,蛋白质27.5%,脂肪3.6%,灰分0.2%,并含有大量的胶原蛋白(约占鱼的10%)。鱼皮中的氨基酸主要为甘氨酸、亮氨酸等,因此,罗非鱼鱼皮具有营养价值高、成本低的特点,研发的市场前景关键在于加工工艺,能否在色、香、味上加工成为受人们欢迎的产品。
本文研究了利用罗非鱼鱼皮加工“油炸鱼皮”即食型休闲食品的加工工艺,通过多种调料配方、沸油温度和时间等参数的调整对比、成品样品的感官评定和常温贮藏期的质量测定,以及试验工艺分析,从中筛选出罗非鱼即食型“油炸鱼皮”加工的相对最佳工艺条件。
1. 材料与方法
1.1 材料
1.1.1 原料
新鲜罗非鱼鱼皮,由广东省中山市食品水产进出口集团公司提供。
1.1.2 辅助材料
(1) 混合调味料:砂糖、精盐、味精、胡椒粉、辣椒油、白酒、面粉、酵母粉、水等,均符合食品卫生标准。(2)特级食用花生油:符合食品卫生标准。
1.2 检测方法
1.2.1 菌落总数
GB/T4789.2-2003[1]
1.2.2 大肠菌群
GB/T4789.3-2003[1]
1.2.3 蛋白质
GB/T5009.5-2003[2]
1.2.4 脂肪
GB/T5009.6-2003[2]
1.2.5 水分
GB/T5009.3-2003[2]
1.2.6 灰分
GB/T5009.4-2003[2]
1.2.7 过氧化值的测定
参考文献[3]
1.3 油炸鱼皮工艺
即食型休闲食品“油炸鱼皮”加工工艺流程见图 1。
(1) 原料处理:对罗非鱼鱼皮原料进行整理,将鱼皮边上残留的鱼鳞、残留鱼肉刮掉,然后将鱼皮表面的粘液、血渍等清洗干净。取出后置阴凉处沥水[4]。
(2) 把沥干水的鱼皮切块,每块大小规格约为5 cm×8 cm的小段。
(3) 把鱼皮分成3组,每组约重0.25 kg,分别添加3种糊状混合调味料,然后浸泡。
(4) 把浸泡后的鱼皮放进沸油中,炸至鱼皮呈金黄色,出锅沥油,在常温下自然冷却。
(5) 将冷却后的鱼皮秤重,每袋为50 g,装入复合薄膜袋,用0.08~0.010 MPa真空封口机封口,即为成品。放在常温下保藏。
1.4 混合调味料配方[5]
根据各种原料成分的不同,制定了多组混合调味料配方。经过初步试验,最后筛选出效果最好的3组,分别命名为A、B、C组。3组调味料配方的具体组分见表 1。
表 1 3组调味料配方的组分Table 1 Components of three groups seasoning prescriptions% 编号
no.糖
sugar盐
NaCl味精
monosodium glutamate胡椒粉
pepper辣椒油
cayenne oil白酒
wine面粉
wheat flour酵母粉
yeast powder清水
waterA 16 7 6 4 3 12 40 4 适量 B 15 8 5 3 2 10 50 5 适量 C 12 3 3 5 5 10 60 5 适量 1.5 感官评价[6]
对于即食型休闲食品,其味道以及外观、口感是关键的产品评定因素之一,因此采用了感官评价方法:由5位专业人员组成感官品尝鉴定小组,现场分别品尝了A、B、C 3种混合调味料调味的“油炸鱼皮”,主要从味道给予评价,标准分为不足、一般、适中、偏浓4档,同时对产品外观、口感等进行综合评价。
2. 结果与分析
由于成品是即食型休闲食品,在保证质量安全的前提下,其外观、味道、口感是品质评定的关键因素,因此,品质评定方法以感官品尝鉴定为主,分别对成品进行了调味配方的选择、外观评价和口感评价的评定;同时,为了了解鱼皮加工后的营养成分变化情况,分别测定了新鲜鱼皮和成品的蛋白质、脂肪、水分含量;另外,为了保证即食型食品的卫生安全,并掌握成品在常温中的有效贮存期,对成品进行了有效贮存期的微生物检验。
2.1 品质评价
2.1.1 调味配方的选择
即食型休闲食品“油炸鱼皮”对混合调味料配方的选择非常重要,它直接影响到产品的色、香、味。本工艺试验按照表 1列出的3组调味料配方对鱼皮进行调味,在同样的条件下加工成品,由品评小组进行现场评定。根据品评小组对产品质量和味觉的评定结果,确定其最佳调味料配方,综合结果列于表 2。由表可见,3组调味料配方中,C组的综合评价最好。
表 2 即食型“油炸鱼皮”调味料配方的选择Table 2 The sensory evaluation results of instant fried fish skin品评项目
evaluation itemsA B C 鲜味delicious - + ++ 甜味sweet +++ +++ ++ 咸味salted +++ + ++ 辣味feppery - - ++ 综合评定total 一般 较好 最好 注:“-”不足,“+”一般,“++”适中,“+++”偏浓
Note: “-“ denotes insufficient, “+” commonly, “++” moderated, “+++” to the strong taste.2.1.2 外观与口感评价
品评小组现场检查小包装成品,认定“油炸鱼皮”外观色泽呈金黄色,具有即食型休闲食品的特色。同时,品评小组现场分别打开3组调味料配方的成品包装,经品尝,认定均具有口感爽、香脆、鱼香味浓的特点。
2.1.3 试验结果综合分析
(1) 调味料的原料成分和各种原料的具体用量,是影响成品风味的一个重要因素。在原料成分中,胡椒粉和黄酒对消除罗非鱼鱼皮的腥味有特效,而砂糖、精盐、辣椒油的具体用量,则直接影响到成品的风味。本试验几种配组的成品,经多位专业人员感官评价,以第三组的综合评价最好。(2)由于我国各地人们的食用习惯不同,根据各地口味要求的不同,可适当调整其中的一些成分用量,也可以研发不同口味的系列食品。(3)鱼皮在调味料里的浸泡时间,是影响成品风味的另一个重要因素。混合调味料制成糊状,加入到鱼皮中拌匀,调味料掺入到鱼皮中,时间太短,成品的味道偏淡,时间过长味道偏咸,人们难以接受。因此,要使鱼皮的味道恰当,就要掌握好适当的浸泡时间。经过对比试验,得出浸泡时间为30 min最合适。(4)沸油温度主要影响成品的外观和口感,油温过低,加工时间长,而且香脆度稍差,但温度过高,鱼皮容易过火,色泽变黑,味道苦涩,影响外观和口感。因此要控制好沸油的温度,实验结果表明油炸的最佳温度为160~180℃,油炸时间为2~4 min最佳。
2.2 产品的贮藏期研究
为了保证产品的食用安全,对产品进行了相关微生物检测和脂肪氧化检测,将产品在37℃贮存,分别于1、30、90、180 d抽样进行菌落总数、过氧化值的检测,结果见表 3。成品在37℃的环境下,经180 d贮存,其细菌总数未因贮存期延长而增加,远远低于国家食品卫生标准规定指标。而采用真空包装, 产品在贮藏过程并未出现氧化变质现象, 通过测定产品的过氧化值含量, 表明在180 d内油炸鱼皮的过氧化值含量略有上升, 但与鱼油的过氧化值标准指标(< 10 meq · kg-1)相比, 则产品的过氧化值含量极低。
表 3 37℃下不同贮存期的微生物和过氧化值Table 3 Analysis results of bacteria clone formula number and oxidation value at 37℃检测项目
analysis item贮存期/d storage 1 30 90 180 菌落总数/ind·g-1
total bacterium无 < 30 < 50 < 100 大肠菌群/ind·100 g-1
coliform group未检出 未检出 未检出 未检出 过氧化值/meq·kg-1
oxidation value0 0.5 1.4 2.2 3. 小结
(1) 为了进一步提高罗非鱼产业的综合效益,根据市场前景需求,进行了罗非鱼加工后的剩余物——鱼皮的即食型休闲食品加工工艺的研究。经过多次工艺试验、感官鉴定和分析,筛选出效果最好的调味料配方及加工工艺。
(2) 即食型“油炸鱼皮”是休闲营养食品,产品在常温下可保存半年。产品在油炸后,含水量低,且真空包装,在贮藏中脂肪氧化相对较慢。在工业化生产中,也可以考虑采用充氮包装。
(3) 对低值水产品及水产品加工下脚料进行深度开发,以及具有特色的水产即食食品、方便食品的开发,都是当前水产加工食品研发的热点。由于即食型休闲食品“油炸鱼皮”的生产工艺较简单、原料成本较低,附加值较高,预期将具有较好的市场前景和经济效益。
-
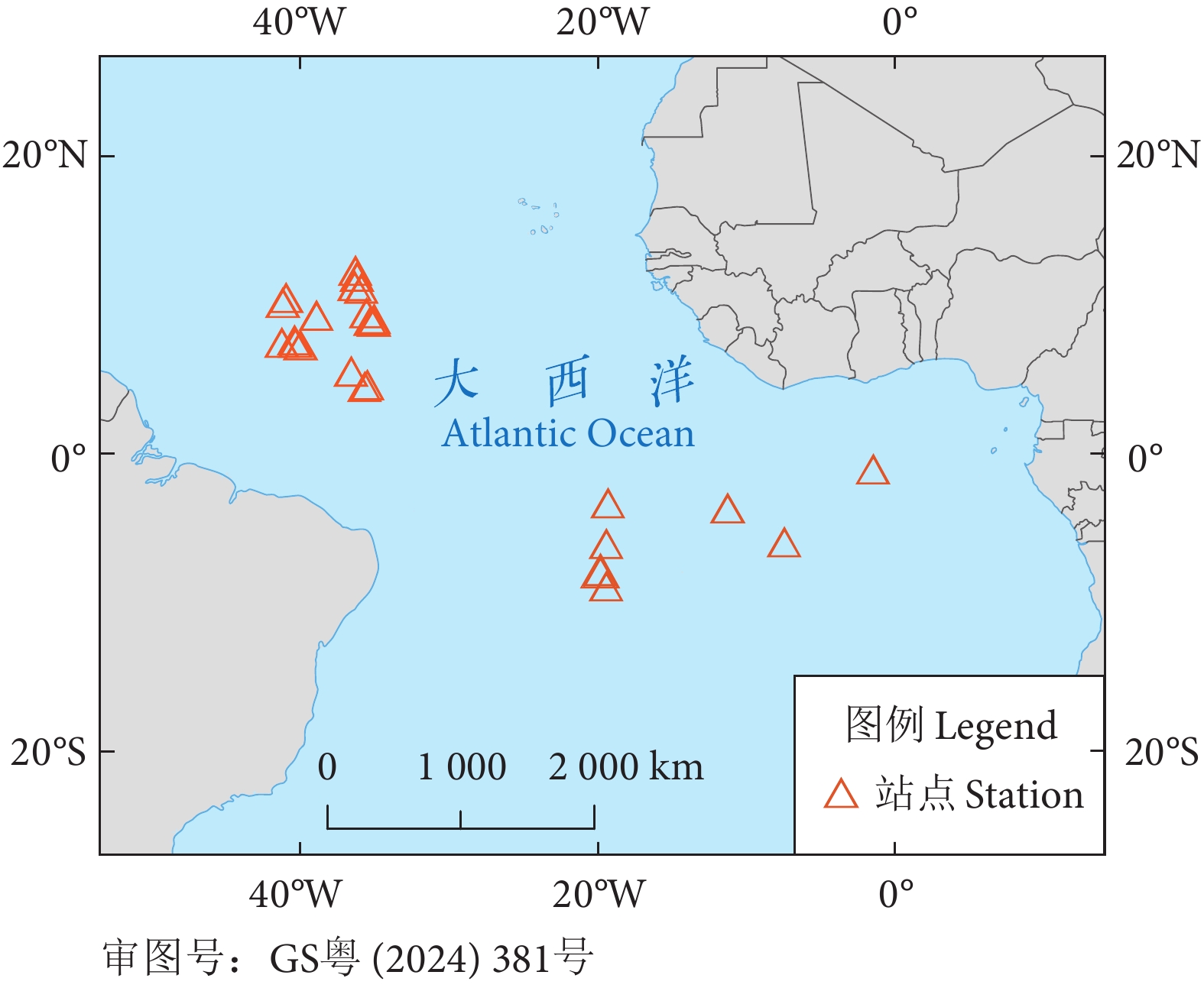
表 1 鲨鱼样本信息
Table 1 Sample information of sharks
种名 Species样本 Sample 叉长 Fork length/mm 体质量 Body mass/kg 雄性
Male雌性
Female范围
Range$ \overline { x}\pm s$ 范围
Range$ \overline { x}\pm s$ 大青鲨
P. glauca5 9 790~2 360 1 994.30±374.90 6~80 53.50±18.57 长鳍鲭鲨
I. paucus2 5 1 100~1 970 1 522.70±271.70 13~68 37.80±18.82 拟锥齿鲨
P. kamoharai6 2 780~980 902.90±69.00 3~7 4.91±1.36 尖吻鲭鲨
I. oxyrinchus1 4 1 540~3 150 2 056.00±633.00 34~88 64.20±19.33 表 2 鲨鱼肌肉脂肪酸组成
Table 2 Fatty acid profiles of muscle tissue of sharks
% 脂肪酸
Fatty acid大青鲨
P. glauca长鳍鲭鲨
I. paucus拟锥齿鲨
P. kamoharai尖吻鲭鲨
I. oxyrinchus肉豆蔻酸 C14:0 0.97±0.25 0.97±0.29 0.78 ±0.04 1.04±0.17 十五碳酸 C15:0 0.92±031a 0.44±0.16b 0.71±0.03ab 0.96±0.27a 棕榈酸 C16:0 17.07±3.73ac 21.71±2.17b 21.16±1.23b 17.61±4.12bc 十七碳酸 C17:0 1.10±0.33a 0.69±0.20b 0.88±0.05ab 1.19±0.32a 硬脂酸 C18:0 12.95±2.64a 8.57±2.25c 9.85±2.27bc 12.84±2.01ab 花生酸 C20:0 0.95±0.32a 0.40±0.17b 0.71±0.05ab 0.99±0.31a 二十一碳酸 C21:0 1.00±0.36a 0.39±0.20b 0.74±0.05ab 1.03±0.33a 二十二碳酸 C22:0 1.03±0.36a 0.40±0.20b 0.76±0.05ab 1.06±0.34a 二十三碳酸 C23:0 0.99±0.47a 0.42±0.21b 0.78±0.05ab 1.10±0.36a 二十四碳酸 C24:0 1.18±0.42ab 0.46±0.24c 0.75±0.33bc 1.22±0.39a 饱和脂肪酸 ∑SFA 40.99±2.02a 35.55±4.61b 39.22±1.64ab 41.97±4.15a 十六碳一烯酸 C16:1n7 1.89±1.22 4.70±4.74 1.80±0.81 1.70±0.38 十七碳一烯酸 C17:1n7 0.97±0.32a 0.55±0.16b 0.74±0.04ab 1.01±0.30a 油酸 C18:1n9 12.49±3.84b 17.87±6.30a 10.68±2.16b 9.88±1.90b 二十碳一烯酸 C20:1 1.72±0.60 2.27±1.32 1.39±0.21 1.63±0.19 芥酸 C22:1n9 1.70±0.78 0.93±0.73 0.98±0.30 0.95±0.62 二十四碳一烯酸 C24:1n9 1.11±0.37ab 0.48±0.19c 0.81±0.05bc 1.33±0.65a 单不饱和脂肪酸 ∑MUFA 21.33±5.14ab 27.40±11.10a 17.50±2.01b 17.01±1.96b 亚油酸 C18:2n6 2.34±1.36a 0.72±0.25b 1.39±0.83ab 1.70±1.51ab 二十碳二烯酸 C20:2 1.12±0.33a 0.60±0.15b 0.84±0.07ab 1.13±0.30a 十八碳三烯酸 C18:3n3 1.11±0.39a 0.45±0.22b 0.82±0.06ab 1.15±0.37a γ-亚麻酸 C18:3n6 0.90±0.48 0.38±0.20 0.61±0.27 0.83±0.57 二十碳三烯酸 C20:3n6 1.12±0.35a 0.44±0.20b 0.79±0.08ab 1.12±0.33a 花生四烯酸 C20:4n6 (ARA) 4.82±0.91a 4.18±1.18ab 3.61±0.85b 5.01±0.60a 二十碳五烯酸 C20:5n3 (EPA) 3.20±1.30a 0.82±0.32b 1.75±0.57b 1.70±0.32b 二十二碳二烯酸 C22:2n6 0.71±0.64ab 0.44±0.22b 0.69±0.31ab 1.14±0.37a 二十二碳六烯酸 C22:6n3 (DHA) 22.30±5.71b 28.98±6.56ab 32.70±4.30a 27.18±6.29ab 多不饱和脂肪酸 ∑PUFA 37.68±5.41a 37.05±8.29ab 43.28±3.22b 41.02±4.42ab 二十二碳酸和二十四碳酸 C22:0+C24:0 2.20±0.78a 0.86±0.44b 1.50±0.35c 2.27±0.73a 二十二碳六烯酸/二十碳五烯酸 DHA/EPA 8.31±5.21c 39.75±14.58a 20.94±8.44b 16.52±5.11bc 总脂 Total lipid/(mg·g−1) 129.84±61.97 181.50±92.48 151.89±55.95 190.20±40.39 注:同一行不同上标字母代表差异显著 (P<0.05)。 Note: Different superscript letters within the same row represent significant differences (P<0.05). 表 3 鲨鱼肝脏脂肪酸组成
Table 3 Fatty acid profiles of liver tissue of sharks
% 脂肪酸
Fatty acid大青鲨
P. glauca长鳍鲭鲨
I. paucus拟锥齿鲨
P. kamoharai尖吻鲭鲨
I. oxyrinchus肉豆蔻酸 C14:0 4.23±1.32a 1.30±0.45b 1.82±0.65b 5.18±1.82a 十五碳酸 C15:0 0.93±0.24b 0.66±0.18bc 0.51±0.07c 1.32±0.33a 棕榈酸 C16:0 20.48±3.52bc 22.55±3.09ab 25.75±2.72a 17.24±2.52c 十七碳酸 C17:0 1.22±0.35b 1.49±0.33ab 1.17±0.31b 1.89±0.40a 硬脂酸 C18:0 8.28±1.32b 11.86±1.59a 12.01±2.36a 12.38±1.32a 饱和脂肪酸 ∑SFA 34.46±5.69b 38.87±5.12ab 42.45±5.22a 39.17±1.94ab 十六碳一烯酸 C16:1n7 5.94±2.17b 3.55±1.04b 5.74±2.18b 11.22±3.85a 十七碳一烯酸 C17:1n7 0.49±0.20a 0.58±0.18b 0.65±0.07b 1.24±0.46b 油酸 C18:1n9 12.07±7.77b 17.98±3.42b 25.81±2.75a 14.39±6.13b 二十碳一烯酸 C20:1 2.95±2.69 1.24±1.56 1.00±1.47 1.97±2.53 芥酸 C22:1n9 3.91±3.30 1.76±1.13 1.22±0.88 2.78±2.94 二十四碳一烯酸 C24:1n9 0.61±0.55b 1.22±0.70ab 0.99±0.78ab 1.58±1.08a 单不饱和脂肪酸 ∑MUFA 26.16±7.15b 26.42±4.21b 35.57±3.74a 34.01±2.49a 亚油酸 C18:2n6 1.24±0.52b 1.03±0.33b 1.00±0.20b 2.07±0.67a 二十碳二烯酸 C20:2 0.90±0.28a 0.51±0.09b 0.49±0.13b 0.68±0.10ab 二十碳三烯酸 C20:3n3 0.86±1.12b 3.24±2.79a 0.62±0.76b 0.26±0.06b 花生四烯酸 C20:4n6 (ARA) 0.85±1.05b 3.62±2.45a 0.80±0.77b 0.27±0.05b 二十碳五烯酸 C20:5n3 (EPA) 6.01±2.77a 3.04±1.84ab 3.06±2.66ab 1.99±0.56b 二十二碳二烯酸 C22:2n6 2.73±1.37ab 1.29±0.85ab 4.35±5.17a 0.58±0.59b 二十二碳六烯酸 C22:6n3 (DHA) 26.21±4.47a 21.64±5.51a 11.31±6.15b 20.31±2.66a 多不饱和脂肪酸 ∑PUFA 39.38±6.68a 34.71±7.45ab 21.98±6.57bc 26.82±2.68c 二十二碳酸和二十四碳酸 C22:0+C24:0 0.19±0.11b 0.40±0.15a 0.38±0.10a 0.38±0.14a 二十二碳六烯酸/二十碳五烯酸 DHA/EPA 5.12±2.00 17.08±27.79 36.89±63.68 11.26±5.34 总脂 Total lipid/(mg·g−1) 332.10±99.59 295.95±66.59 321.03±83.73 273.33±25.39 注:同一行不同上标字母代表差异显著(P<0.05)。 Note: Different superscript letters within the same row represent significant differences (P<0.05). -
[1] 李云凯, 高小迪, 王琳禹, 等. 东太平洋中部中上层鲨鱼群落营养生态位分化[J]. 应用生态学报, 2018, 29(1): 309-313. [2] BAUM J K, MYERS R A, KEHLER D G, et al. Collapse and conservation of shark populations in the northwest Atlantic[J]. Science, 2003, 299(5605): 389-392. doi: 10.1126/science.1079777
[3] MYERS R A, BAUM J K, SHEPHERD T D, et al. Cascading effects of the loss of apex predatory sharks from a coastal ocean[J]. Science, 2007, 315(5820): 1846-1850. doi: 10.1126/science.1138657
[4] 戴小杰. 东太平洋主要几种中上层鲨鱼生物学和生态学研究[D]. 上海: 华东师范大学, 2004: 11-12. [5] 沙永翠, 张培育, 张欢, 等. 栖息地环境对种群营养生态位的影响: 以黄颡鱼为例[J]. 生态学报, 2015, 35(5): 1321-1328. [6] SCHAUFLFLER L, HEINTZ R, SIGLER M, et al. Fatty acid composition of sleeper shark (Somniosus pacifificus) liver and muscle reveals nutritional dependence on planktivores[J]. ICES CM, 2005, 5: 1-19.
[7] 李云凯, 徐敏, 贡艺. 应用脂肪酸组成研究热带东太平洋同域中上层鲨鱼营养生态位分化[J]. 生态学报, 2022, 42(13): 5295-5302. [8] 贡艺. 基于生物化学示踪物的东太平洋茎柔鱼摄食生态学研究[D]. 上海: 上海海洋大学, 2018: 10. [9] DALSGAARD J, JOHN M S, KATTNER G, et al. Fatty acid trophic markers in the pelagic marine environment[J]. Adv Mar Biol, 2003, 46(6): 225-340.
[10] XU M, PETHYBRDGE H R, LI Y K. Trophic niche partitioning of five sympatric shark species in the tropical eastern Pacific Ocean revealed by multi-tissue fatty acid analysis[J]. Environ Res, 2022, 214: 113828. doi: 10.1016/j.envres.2022.113828
[11] MCMEANS B C, ARTS M T, FISK A T. Similarity between predator and prey fatty acid profiles is tissue dependent in Greenland sharks (Somniosus microcephalus): implications for diet reconstruction[J]. J Exp Mar Biol Ecol, 2012, 429: 55-63. doi: 10.1016/j.jembe.2012.06.017
[12] PETHYBRIDGE H R, PARRISH C C, BRUCE B D, et al. Lipid, fatty acid and energy density profiles of white sharks: insights into the feeding ecology and ecophysiology of a complex top predator[J]. PLoS One, 2014, 9(5): 1-10.
[13] EDUARDO S, JOANNA A, JEFFREY M, et al. Stable isotope and fatty acid analyses reveal significant differences in trophic niches of smooth hammerhead Sphyrna zygaena (Carcharhiniformes) among three nursery areas in northern Humboldt Current System[J]. PeerJ, 2021, 9: e11283. doi: 10.7717/peerj.11283
[14] FOLCH J, LEES M, SLOANE STANLEY G H. A simple method for the isolation and purification of total lipids from animal tissues[J]. J Biol Chem, 1957, 226(1): 497-509. doi: 10.1016/S0021-9258(18)64849-5
[15] EVERY S L, PETHYBRIDGE H R, CROOK D A, et al. Comparison of fin and muscle tissues for analysis of signature fatty acids in tropical euryhaline sharks[J]. J Exp Mar Biol Ecol, 2016, 479: 46-53. doi: 10.1016/j.jembe.2016.02.011
[16] MEYER L, PETHYBRIDGE H, NICHOLS P D, et al. Abiotic and biotic drivers of fatty acid tracers in ecology: a global analysis of chondrichthyan profiles[J]. Funct Ecol, 2019, 33(7): 1243-1255. doi: 10.1111/1365-2435.13328
[17] PEDRO S, FISK A T, FERGUSON S H, et al. Broad feeding niches of capelin and sand lance may overlap those of polar cod and other native fish in the eastern Canadian Arctic[J]. Polar Biol, 2020, 43(11): 1707-1724. doi: 10.1007/s00300-020-02738-8
[18] TOCHER D R. Fatty acid requirements in ontogeny of marine and freshwater fish[J]. Aquac Res, 2010, 41(5): 717-732. doi: 10.1111/j.1365-2109.2008.02150.x
[19] IZQUIERDO M S, FERNANDE-PALACIOS H, TACON A G J. Effect of broodstock nutrition on reproductive performance of fish[J]. Aquaculture, 2001, 197(1/2/3/4): 25-42. doi: 10.1016/S0044-8486(01)00581-6
[20] PARRISH C C, ABRAJANO T A, BUDGE S M, et al. Lipid and phenolic biomarkers in marine ecosystems: analysis and applications[J]. Mar Chem, 2000: 193-223.
[21] 赵峰, 庄平, 章龙珍, 等. 雌性成体点篮子鱼不同组织的脂肪酸组成分析[J]. 海洋渔业, 2009, 31(3): 288-292. [22] MEJRI S, LUCK C, TREMBLAY R, et al. Bonefish (Albula vulpes) oocyte lipid class and fatty acid composition related to their development[J]. Environ Biol Fish, 2019, 102(2): 221-232. doi: 10.1007/s10641-018-0825-0
[23] KELLY J R, SCHEIBLING R E. Fatty acids as dietary tracers in benthic food web[J]. Mar Ecol Prog Ser, 2012, 446: 1-22. doi: 10.3354/meps09559
[24] GALVAN-MAGANA F, POLO-SILVA C, HERNANDEZ-AGUILAR S B, et al. Shark predation on cephalopods in the Mexican and Ecuadorian Pacific Ocean[J]. Deep Sea Res II: Top Stud Oceanogr, 2013, 95: 52-62. doi: 10.1016/j.dsr2.2013.04.002
[25] KELLY J R, SCHEIBLING R E, IVERSON S J. Fatty acids tracers for native and invasive macroalgae in an experimental food web[J]. Mar Ecol Prog Ser, 2009, 391: 53-63. doi: 10.3354/meps08234
[26] HUETER R E, TYMINSKI J P, MORRIS J J, et al. Horizontal and vertical movements of longfin makos (Isurus paucus) tracked with satellitelinked tags in the Northwestern Atlantic Ocean[J]. Fish B-NOAA, 2016, 115(1): 101-116.
[27] 叶振江, 彭玉强, 何天庆, 等. 黄海近岸潮汐锋海域蟹类幼体日间垂直迁移特征[J]. 中国海洋大学学报 (自然科学版), 2022, 52(9): 35-42. [28] COELHO R, MACIAS D, de URBINA J O, et al. Local indicators for global species: pelagic sharks in the tropical northeast Atlantic, Cabo Verde islands region[J]. Ecol Indic, 2020, 110: 105942. doi: 10.1016/j.ecolind.2019.105942
[29] MACNEIL M A, SKOMAL G B, FISK A T. Stable isotopes from multiple tissues reveal diet switching in sharks[J]. Mar Ecol Prog Ser, 2005, 302: 199-206. doi: 10.3354/meps302199
[30] DAVID E, da SILEIRA, TORRES-ROJAS Y E, et al. Trophic interactions between shark species on the western coast of Baja California Sur: inferences from stable isotopes[J]. Reg Stud Mar Sci, 2020, 39: 101463.
[31] HAZEL J R, WILLIAMS E E. The role of alternations in membrane lipid composition in enabling physiological adaptation of organisms to their physical environment[J]. Prog Lipid Res, 1990, 29(3): 167-227. doi: 10.1016/0163-7827(90)90002-3
[32] 徐敏. 基于脂肪酸组成分析热带东太平洋中上层鲨鱼营养生态位分化[D]. 上海: 上海海洋大学, 2022: 17-19. [33] BUDGE S M, PARRISH C C, MCKENZIE C H. Fatty acid composition of phytoplankton, settling particulate matter and sediments at a sheltered bivalve aquaculture site[J]. Mar Chem, 2001, 76(4): 285-303. doi: 10.1016/S0304-4203(01)00068-8
[34] TAMBURIN E, KIM S L, ELORRIAGA-VERPLANCKEN F R, et al. Isotopic niche and resource sharing among young sharks (Carcharodon carcharias and Isurus oxyrinchus) in Baja California, Mexico[J]. Mar Ecol Prog Ser, 2019, 613: 107-124. doi: 10.3354/meps12884
[35] ROGERS P J, HUVENEERS C, PAGE B, et al. Living on the continental shelf edge: habitat use of juvenile shortfin makos Isurus oxyrinchus in the Great Australian Bight, southern Australia[J]. Fish Oceanogr, 2015, 24(3): 205-218. doi: 10.1111/fog.12103
[36] 李云凯, 陈子昂, 贡艺, 等. 海洋动物营养生态位研究方法及其应用[J]. 热带海洋学报, 2021, 40(4): 143-156. doi: 10.11978/2020071 [37] 李永东, 杨旭, 贾国清, 等. 四川贡嘎山国家级自然保护区白马鸡与血雉的时空生态位分化[J]. 四川林业科技, 2022, 43(2): 47-55. doi: 10.12172/202107310001 [38] ESTUPINAN-MONTANO C, GALVAN-MAGANA F. First insight into the biological aspects of the crocodile shark Pseudocarcharias kamoharai in the eastern Pacific Ocean[J]. Thalassas: An Int J Mar Sci, 2020, 37(1): 229-233.
[39] ESTUPINAN-MONTANO C, DELGADO H A. Longfin mako shark, Isurus paucus, in the eastern tropical Pacific: first evidence of trophic ontogeny based on the isotopic analysis of long-term tissues[J]. Thalassas: An Int J Mar Sci, 2022, 38(1): 49-55. doi: 10.1007/s41208-022-00404-w
[40] LI Y K, ZHANG Y Y, DAI X J. Trophic interactions among pelagic sharks and large predatory teleosts in the northeast central Pacific[J]. J Exp Mar Biol Ecol, 2016, 483: 97-103. doi: 10.1016/j.jembe.2016.04.013
[41] SEPULVEDA C A, KOHIN S, CHAN C, et al. Movement patterns, depth preferences, and stomach temperatures of free-swimming juvenile mako sharks, Isurus oxyrinchus in the Southern California Bight[J]. Mar Biol, 2004, 145(1): 191-199.
[42] KLARIAN S A, CANALES-CERRO C, BARRIA P, et al. New insights on the trophic ecology of blue (Prionace glauca) and shortfin mako sharks (Isurus oxyrinchus) from the oceanic eastern South Pacific[J]. Mar Biol Res, 2018, 14(2): 173-182. doi: 10.1080/17451000.2017.1396344
[43] TREBERG J R, SPEERS-ROESCH B. Does the physiology of chondrichthyan fishes constrain their distribution in the deep sea?[J]. J Exp Biol, 2016, 219(5): 615-625. doi: 10.1242/jeb.128108
[44] 陈子昂, 吴峰, 戴小杰, 等. 基于多组织稳定同位素比值的热带大西洋4种鲨鱼营养生态位分化[J]. 应用生态学报, 2021, 32(6): 2014-2020. [45] MAIA A, QUEIROZ N, CORREIA J P, et al. Food habits of the shortfin mako, Isurus oxyrinchus, off the southwest coast of Portugal[J]. Environ Biol Fish, 2006, 77(2): 157-167. doi: 10.1007/s10641-006-9067-7
[46] ESPINOZA M, MUNROE S E M, CLARKE T M, et al. Feeding ecology of common demersal elasmobranch species in the Pacific coast of Costa Rica inferred from stable isotope and stomach content analyses[J]. J Exp Mar Biol Ecol, 2015, 470: 12-25. doi: 10.1016/j.jembe.2015.04.021
[47] WATANABE Y Y, GOLDMAN K J, CASELLE J E, et al. Comparative analyses of animal-tracking data reveal ecological significance of endothermy in fishes[J]. PNAS, 2015, 112(19): 6104-6109. doi: 10.1073/pnas.1500316112




 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
