Preparation, in vitro activity and physicochemical properties of collagenase inhibitory peptide from tilapia skin
-
摘要:
罗非鱼皮富含胶原蛋白,是一种制备生物活性肽的理想原料。以罗非鱼皮为原料,采用酶解法制备罗非鱼皮胶原酶抑制肽 (Tilapia skin collagenase inhibitory peptide, TSCIP),并对其胶原酶抑制活性与金属离子结合活性的相关性进行研究,以期为罗非鱼加工副产物的高值化利用与食物蛋白源胶原酶抑制剂的研发提供参考。结果表明,罗非鱼皮经碱性蛋白酶酶解4 h后的产物具有最高的胶原酶抑制活性和锌离子 (Zn2+)、镁离子 (Mg2+) 结合活性,并探明其主要由小分子肽 (<1 000 D占85.65%) 组成。紫外、傅里叶变换红外光谱以及圆二色谱分析显示,TSCIP与Zn2+、Mg2+以及胶原酶结合后其二级结构发生了变化,β-折叠含量明显增加;Zn2+、Mg2+ 主要通过羧基氧、氨基氮原子以及羰基与TSCIP结合,胶原酶主要通过氨基氮原子以及羰基与TSCIP结合。
Abstract:Tilapia skin, rich in collagen, is an ideal raw material for preparation of bioactive peptides. To provide references for the high-value utilization of tilapia processing by-products and the development of food protein-derived collagenase inhibitors, we prepared tilapia skin collagenase inhibitory peptide (TSCIP) from tilapia skin by enzymatic hydrolysis, and studied the correlation between its collagenase inhibitory activity and metal ion binding activity. The results show that the tilapia skin product hydrolyzed by alkaline protease for 4 h had the highest collagenase inhibition activity, as well as Zn2+ and Mg2+ binding activity, and it was mainly composed of small molecular peptides (<1 000 D accounting for 85.65%). Ultraviolet (UV), Fourier transform infrared (FTIR) and circular dichroism (CD) analysis show that the secondary structure of TSCIP changed after binding with Zn2+, Mg2+ and collagenase, and the β-sheet content of TSCIP increased significantly. Zn2+ and Mg2+ bind to TSCIP mainly through carboxyl oxygen, amino nitrogen atoms and carbonyl groups, while collagenase binds to TSCIP mainly through amino nitrogen atoms and carbonyl groups.
-
Keywords:
- Tilapia skin /
- Peptides /
- Collagenase inhititory /
- Physicochemical properties
-
中国是世界上最大的水产品生产国,鱼类养殖年总产量已达2 900多万吨,资源极为丰富[1]。鱼类在加工过程中,会产生鱼皮等副产物,若处理不当会对环境造成污染,同时也会造成资源浪费[2]。罗非鱼 (Oreochromis),俗称非洲鲫,是我国主要的养殖鱼类,产量居世界首位,被誉为未来动物性蛋白质的主要来源之一[3]。罗非鱼皮富含胶原蛋白,其酶解产物具有抗菌[4]、抗氧化[5]、酪氨酸酶抑制[6]、抗炎以及免疫调节[7]等多种生物活性,是制备生物活性肽的理想原料。
皮肤作为人体的最外层,易受到微生物感染和辐射损伤等生物和非生物侵害[8]。研究表明,当人类皮肤长期暴露在紫外线辐射下,皮肤细胞外基质 (Extracellular matrix, ECM) 的结构会被破坏,从而导致皮肤松弛、皱纹、癌变等[9]。ECM是一种富含胶原和弹性蛋白等结构蛋白的网络结构,可以维持皮肤的弹性和水合能力。皮肤中的胶原蛋白结构相对复杂、稳定性良好且不易受到普通蛋白酶的降解破坏,然而胶原酶能够在体温附近有效解旋胶原蛋白,并参与ECM重塑与降解从而维持细胞外环境稳态[10]。胶原酶来源于动物、植物或微生物中,目前研究最多的胶原酶为微生物胶原酶 (Collagenase) 和基质金属蛋白酶 (Matrix metalloproteinase, MMP)。微生物胶原酶主要来源于溶组织梭菌 (Clostridium histolyticumi);而MMP是一种内源性胶原酶,主要由脊椎动物本身基质分泌。相比MMP型胶原酶,微生物胶原酶因具有更多的蛋白切割位点而备受关注[11]。胶原酶的催化域存在一个激活酶活性的锌离子 (Zn2+),其酶原是通过含有半胱氨酸 (Cys) 的前肽蛋白水解性裂解或其二级结构发生改变导致水分子和底物能够自由进入催化域的Zn2+活性中心而被激活[12]。紫外辐射下,MMPs过度表达降解皮肤真皮胶原基质是光老化的主要原因,因此研究胶原酶抑制肽对抗皮肤光老化具有重要意义。艾丽奇[13]通过测定体外胶原酶抑制活性来筛选鳕鱼皮水解物中具有抗光老化活性的肽段,并通过测定细胞内MMP-1的含量和活性来评估其肽段对光损伤成纤维细胞的修复情况。有研究表明,胶原酶抑制肽可通过阻断胶原酶的作用来防止ECM的降解[14]。Chen等[15]从太平洋鳕 (Gadus macrocephalus) 鱼皮明胶水解物中获得的提取物可通过抑制MMPs的表达和活性来有效对抗紫外线照射所致的皮肤光老化。
目前,国内外关于罗非鱼皮胶原酶抑制肽的制备及其金属离子结合活性与胶原酶抑制活性之间的相关性研究鲜见报道。本研究以罗非鱼皮为原料制备胶原酶抑制肽 (Tilapia skin collagenase inhibitor peptide, TSCIP),研究其分子质量分布与氨基酸组成,并探讨其金属离子结合活性与胶原酶抑制活性的关系,以期为罗非鱼加工副产物的高值化利用与食物蛋白源胶原酶抑制剂的研发提供参考。
1. 材料与方法
1.1 材料与试剂
罗非鱼皮购自广东百维生物科技有限公司;胶原酶 (Type IA,来源于溶组织梭菌) 购自美国Sigma公司;木瓜蛋白酶、糜蛋白酶、碱性蛋白酶购自上海吉至生化科技有限公司;N-(3-[2-呋喃基] 丙烯酰基)-亮氨酸-甘氨酸-脯氨酸-丙氨酸 (FALGPA)、还原型谷胱甘肽 (307.32 D)、氧化型谷胱甘肽 (612.63 D)、细胞色素C (12 400 D) 购自上海源叶生物科技有限公司;抑肽酶 (6 511.44 D)、杆菌肽 (1 422.69 D)、氯化镁、氯化锌、三羟甲基氨基甲烷 (Tris) 购自上海麦克林生化科技有限公司;溴化钾购自上海阿拉丁生化科技股份有限公司;乙腈、三氟乙酸购自上海安谱实验科技股份有限公司;氯化钙 (CaCl2)、氯化钠 (NaCl) 购自北京兰博利德商贸有限公司。
1.2 仪器与设备
SHZ-82A型水浴恒温振荡器;Titrando-809型自动电位滴定仪;RE-52C型旋转蒸发仪;H1750R型高速台式冷冻离心机;KjeltecTM 2300型凯氏定氮仪;Opti-Dry 2013.1型冷冻干燥机;Acouity UPLC H-Class型超高效液相色谱仪;Agilent 7900型电感耦合等离子质谱;Sunrise-basic Tacan型吸光酶标仪;UV 2550型紫外可见分光光度计;Jasco J-1500型圆二色谱;IRAffinity-1型傅里叶变换红外光谱仪。
1.3 方法
1.3.1 罗非鱼皮酶解物的制备
罗非鱼皮洗净后去除鱼鳞等杂质,参照前期研究方法[6]并稍作修改。先将鱼皮与0.05 mol·L−1的氢氧化钠 (NaOH) 溶液按1∶10 (m∶V) 混合,搅拌30 min后用超纯水洗至中性以去除可溶性杂蛋白;再用0.5 mol·L−1 乙酸 (CH3COOH) 溶液 (1∶10, m∶V) 使其发生溶胀,搅拌浸泡15 min后用超纯水冲洗至中性以去除脂肪、色素等杂质;将处理后的鱼皮沥干匀浆后于65 ℃恒温水浴锅振荡5 h,10 000 r·min−1、4 ℃离心15 min,取上清液即为罗非鱼皮胶原蛋白溶液。
将胶液与蛋白酶在最适酶解条件下 (表1) 混合,加酶量为1% (m∶m,基于胶液蛋白质量分数),置于恒温振荡水浴锅中反应1~8 h,期间维持pH稳定。酶解结束后于100 ℃水浴加热灭酶15 min,冷却后抽滤,10 000 r·min−1、4 ℃离心10 min,取上清液冷冻干燥即得罗非鱼皮酶解产物。
表 1 不同蛋白酶的最适酶解条件Table 1. Optimal enzymatic conditions for different proteases蛋白酶
Protease酶解条件 Hydrolysis condition 加酶量
Enzyme content/%温度
Temperature/℃pH 酶活性
Enzymatic activity/(U·mg−1)酶解时间
Hydrolysis time/h碱性蛋白酶 Alkaline protease 1 50 9.0 200 1、2、4、6、8 糜蛋白酶Chymotrypsin 1 37 7.5 10 000 1、2、4、6、8 木瓜蛋白酶 Papain 1 50 6.0 800 1、2、4、6、8 1.3.2 水解度测定
凯氏定氮法测定鱼皮总氮含量参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》;酶解液中氨基态氮的检验采用甲醛自动电位滴定法。水解度 (Degree of hydrolysis, DH) 计算公式为:
$$ \mathrm{DH}{\text{=}}\frac{M_1}{M_0} \times 100 {\text{%}} $$ (1) 式中:M0表示鱼皮总氮质量 (g);M1表示酶解液中氨基态氮质量 (g)。
1.3.3 胶原酶抑制率测定
胶原酶抑制试验按照Thring等[16]的方法稍作修改,配制含有0.01 mol·L−1 CaCl2和0.4 mol·L−1 NaCl的Tricine缓冲液 (0.05 mol·L−1, pH 7.5),用Tricine缓冲液配制1 mmol·L−1的FALGPA溶液,用冷的 (2~8 ℃) 超纯水制备含2 U·mL−1的胶原酶溶液。将50 μL的样品溶液与50 μL的胶原酶溶液混匀后于25 ℃恒温孵育15 min,再加入200 μL的FALGPA溶液,立即颠倒混匀并记录溶液在345 nm下连续5 min内的吸光值 (A345),每隔10 s测定一次。采用至少1 min的间隔以及至少4个数据点来获得进行样品检测的最大线性率 (ΔA345·min−1)。本研究选取第1分钟来获得进行样品检测的最大吸光度变化值。
$$\begin{split} & \;\\ & \qquad \quad R_{\mathrm{o}}{\text{=}}1{\text{−}}\frac{A{{{\text{'}}}}_2{ }{\text{−}}A_2}{A{{{\text{'}}}}_1{ }{\text{−}}A_1} \times 100 {\text{%}} \end{split} $$ (2) 式中:Ro为胶原酶抑制率 (%);A1为不加酶解物组的初始吸光值;
$ {{A{{{\text{'}}}}_{1}}} $ 为不加酶解物组反应后的吸光值;A2为加酶解物组的初始吸光值;$ {{A{{{\text{'}}}}_{2}}} $ 为加酶解物组反应后的吸光值。1.3.4 金属离子结合活性测定
参照张金杨等[17]的方法并略作修改,将罗非鱼皮不同酶解时间的酶解产物分别与Zn2+、镁离子 (Mg2+) 进行结合。用超纯水分别配制2 mg·mL−1 氯化锌 (ZnCl2)、氯化镁 (MgCl2) 溶液和酶解物溶液 (20 mg·mL−1),将酶解物与金属盐溶液按20∶1 (m∶m) 混合后于37 ℃水浴90 min使其结合。用分子质量100 D的透析袋去除游离的金属离子,透析48 h,记录透析后溶液的总体积。取1 mL透析液于消化管中,加入5 mL浓硝酸进行微波消解,将消解后的液体定容至50 mL,最后用ICP-MS测定消解液中Zn2+、Mg2+ 的质量浓度,将剩余的透析液冷冻干燥备用。Zn2+、Mg2+ 结合率计算公式为:
$$ R_{\mathrm{T}}{\text{=}}\frac{c \times V \times n}{m} \times 100{\text{%}} $$ (3) 式中:RT表示金属离子结合率 (%);m表示加入金属的总质量 (mg);c表示透析后金属离子的质量浓度 (μg·mL−1);V表示总膨胀体积 (mL);n表示稀释倍数。
1.3.5 分子质量分布测定
参照Sun等[18]的方法并稍作修改,采用超高效体积排阻色谱法测定肽的分子质量分布。色谱柱TSK-GEL G2000SWxL (7.8 mm×300 mm, 5 μm),紫外检测波长214 nm,进样体积10 μL,流速0.5 mL·min−1;流动相A [含0.1% (φ)三氟乙酸的超纯水]∶流动相B [含0.1% (φ)三氟乙酸的乙腈] = 50∶50 (V∶V)。将样品配制成2 mg·mL−1,0.22 μm微孔滤膜过滤后上样;用流动相将不同分子质量的标准品 (细胞色素C、杆菌肽、抑肽酶、氧化型谷胱甘肽、还原型谷胱甘肽) 配制成2 mg·mL−1的混合溶液,0.22 μm微孔滤膜过滤后上样,以保留时间为x轴,lg(分子质量) 为y轴制作标准曲线。
1.3.6 氨基酸测定
根据GB 5009.124—2016《食品安全国家标准食品中氨基酸的测定》对罗非鱼皮以及TSCIP样品中的氨基酸含量进行检测。
1.3.7 紫外光谱扫描 (UV)
分别对TSCIP、TSCIP-Zn2+、TSCIP-Mg2+、TSCIP-胶原酶 (TSCIP-Collagenase) 以及胶原酶进行紫外光谱扫描,扫描范围200~500 nm。制备TSCIP-胶原酶的冻干样品时,将TSCIP与胶原酶溶液按1∶1 (V∶V) 混合静置90 min后冻干;最后分别将样品配制成5 mg·mL−1进行扫描。
1.3.8 傅里叶变换红外光谱扫描(FTIR)
分别取TSCIP、TSCIP-Zn2+、TSCIP-Mg2+、TSCIP-胶原酶的冻干样品以及胶原酶1 mg与100 mg干燥后的溴化钾进行混合。在干燥状态下,将样品充分研磨后进行压片以获得透明薄片进行红外光谱扫描。光谱扫描条件为:分辨率4 cm−1,扫描范围4 000~400 cm−1,扫描32次,并与室温下的背景光谱进行比对。
1.3.9 圆二色谱扫描 (Circular dichroism, CD)
采用Chirascan圆二色谱仪分别对TSCIP、TSCIP-Zn2+、TSCIP-Mg2+、TSCIP-胶原酶以及胶原酶进行二级结构的检测。将样品配制成0.25 mg·mL−1放入10 mm宽的石英比色皿中,以190~260 nm的扫描范围、2 nm缝宽、0.2 nm步长及50 nm·min−1的扫描速度进行测量。用CDNN 2.1软件计算5种样品二级结构中不同构象的占比。
1.4 数据统计与分析
用Excel 2021软件对实验数据进行整理与统计、Origin 2021软件作图、SPSS 25.0软件对组间数据进行单因素分析,结果以“平均值±标准差 (
$\overline { x}\pm s $ )”表示,随后进行多重比较,显著性水平α为0.05。2. 结果与分析
2.1 水解度
罗非鱼皮胶原蛋白在3种蛋白酶的作用下,水解度呈递增趋势,但随着时间的推移,这种趋势趋于平缓 (图1)。可能是由于酶解时间较短时的蛋白酶活性较高且酶切割位点较多;随着酶解时间延长,酶切位点减少导致水解度变化趋势减缓。由于每种蛋白酶的切割特异性不同,肽键受损程度不同,因此水解程度差异很大。研究表明,3种蛋白酶对罗非鱼皮胶原蛋白的水解程度存在明显差异,碱性蛋白酶对蛋白的水解程度最强,而木瓜蛋白酶和糜蛋白酶对蛋白的水解程度相对较弱,其中水解8 h后的碱性蛋白酶酶解产物水解度最高,这可能是因为碱性蛋白酶作为一种由地衣芽孢杆菌 (Bacillus licheniformis) 发酵而来的丝氨酸型内切蛋白酶对蛋白的水解效果显著[19]。
![]() 图 1 不同蛋白酶的水解度随时间的变化注:不同小写字母表示在不同酶解时间下同种蛋白酶酶解产物的蛋白质水解程度具有显著性差异 (P<0.05)。Figure 1. Change in hydrolysis degree of different proteases over timeNote:Different lowercase letters represent significant differences in the degree of proteolysis of enzymatic products of the same protease at different enzymatic hydrolysis time (P<0.05).
图 1 不同蛋白酶的水解度随时间的变化注:不同小写字母表示在不同酶解时间下同种蛋白酶酶解产物的蛋白质水解程度具有显著性差异 (P<0.05)。Figure 1. Change in hydrolysis degree of different proteases over timeNote:Different lowercase letters represent significant differences in the degree of proteolysis of enzymatic products of the same protease at different enzymatic hydrolysis time (P<0.05).2.2 不同酶解物的胶原酶抑制率、金属离子结合率及相关性分析
微生物胶原酶与MMP型胶原酶均可水解原生胶原蛋白。MMP型胶原酶存在于皮肤本身,可以分解胶原蛋白并加速成纤维细胞中ECM的降解。过量的紫外辐射会刺激细胞分泌更多的胶原酶,从而刺激细胞内其他型的MMPs或炎性因子的产生,引起弹性纤维的降解及炎症反应,加速皮肤光老化[13]。由图2-a可知,3种蛋白酶的酶解产物都表现出体外胶原酶抑制活性。碱性蛋白酶酶解产物的胶原酶抑制率明显高于糜蛋白酶与木瓜蛋白酶的酶解产物,同时发现罗非鱼皮碱性蛋白酶4 h酶解产物对胶原酶的抑制率最高 (56.25%),继续延长酶解时间所得产物的胶原酶抑制率无显著性提升。综合考虑,罗非鱼皮经碱性蛋白酶酶解4 h为制备胶原酶抑制肽的最适酶解时间。
![]() 图 2 不同蛋白酶酶解产物的胶原酶抑制率 (a)、碱性蛋白酶酶解产物的金属离子结合率 (b) 及其相关性分析 (c—d)注:不同小写字母表示在不同酶解时间下同种蛋白酶酶解产物的胶原酶抑制率或金属离子结合率具有显著性差异 (P<0.05)。Figure 2. Collagenase inhibition rate of different hydrolysates (a) and metal ion binding rate of alkaline protease hydrolysate (b) and correlation analysis (c−d)Note: Different lowercase letters represent that the collagenase inhibition rate or metal ion binding rate of enzymatic products of the same protease at different enzymatic hydrolysis time are significantly different (P<0.05).
图 2 不同蛋白酶酶解产物的胶原酶抑制率 (a)、碱性蛋白酶酶解产物的金属离子结合率 (b) 及其相关性分析 (c—d)注:不同小写字母表示在不同酶解时间下同种蛋白酶酶解产物的胶原酶抑制率或金属离子结合率具有显著性差异 (P<0.05)。Figure 2. Collagenase inhibition rate of different hydrolysates (a) and metal ion binding rate of alkaline protease hydrolysate (b) and correlation analysis (c−d)Note: Different lowercase letters represent that the collagenase inhibition rate or metal ion binding rate of enzymatic products of the same protease at different enzymatic hydrolysis time are significantly different (P<0.05).胶原酶结构域活性中心为Zn2+,而Mg2+是一种促进人体能量代谢和许多酶反应的激活剂,低浓度的Mg2+会增加体内细胞溶血的脆弱性从而导致人体新陈代谢紊乱[20]。因此通过测定罗非鱼皮碱性蛋白酶酶解产物对金属离子 (Zn2+、Mg2+) 的结合活性来探究胶原酶抑制活性与金属离子 (Zn2+、Mg2+) 结合活性之间的相关性。罗非鱼皮碱性蛋白酶酶解产物的Zn2+、Mg2+结合活性如图2-b所示,在相同条件下,酶解产物对Zn2+的结合率大于Mg2+,其中碱性蛋白酶4 h的酶解产物与金属离子 (Zn2+、Mg2+) 结合能力最高。将碱性蛋白酶酶解产物的胶原酶抑制率分别与Zn2+、Mg2+ 结合率进行相关性分析发现,两者具有较高的正相关性,相关系数分别为0.876 (P<0.05,图2-c)、0.832 (P<0.05,图2-d)。有研究报道胶原酶抑制肽与Zn2+ 形成静电相互作用从而抑制胶原酶活性[21-22]。综上,罗非鱼皮碱性蛋白酶酶解产物可能通过结合胶原酶中的Zn2+活性中心来抑制胶原酶活性。
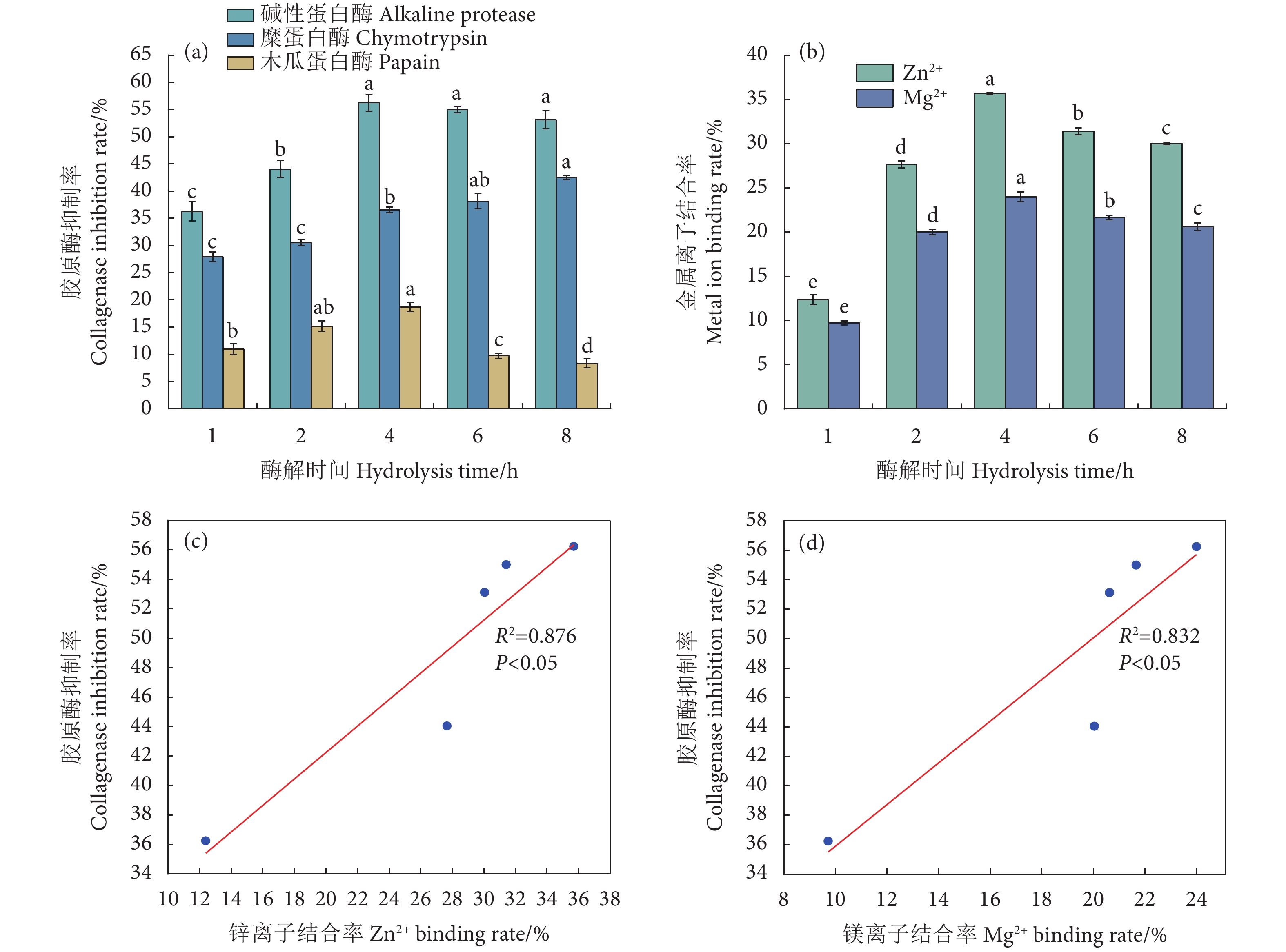
2.3 分子质量分布
罗非鱼皮经碱性蛋白酶酶解不同时间 (1~8 h) 后其组分的分子质量分布如图3所示。罗非鱼皮酶解1~4 h其组分的分子质量分布变化明显,酶解4~8 h的组分分子质量分布基本保持不变,这与前文水解度的测定结果一致。从图中可知罗非鱼皮碱性蛋白酶酶解产物分子质量主要分布在<3 000 D的肽段,随着酶解时间的延长,产物中小分子质量肽段 (<1 000 D) 逐渐增多,大分子质量肽段 (>3 000 D) 逐渐减少。酶解物<500 D的组分占比从37.56%增至60.64%,而1 000~3 000 D的组分明显减少,从30.54%降至11.51%。具有最高胶原酶抑制活性的罗非鱼皮碱性蛋白酶4 h的酶解产物中<1 000 D的组分占85.65%,显著高于1、2 h的酶解产物 (P<0.05),且相较于6、8 h的酶解产物无显著性差异 (P>0.05)。大量研究表明分子质量在3 000 D以下的肽段具有较强的胶原酶抑制活性[23]。肽的分子质量大小对其与金属离子螯合也有较大影响,研究显示低分子质量肽段具有更高的螯合能力[24]。Chen等[25]研究了罗非鱼皮胶原蛋白肽组分分子质量对其锌螯合能力和锌配合物生物利用度的影响,结果显示分子质量<1 000 D的肽段表现出较高的锌螯合能力。综合胶原酶抑制活性、金属离子结合活性以及分子质量分布等结果,选取罗非鱼皮碱性蛋白酶4 h酶解产物 (TSCIP) 进行后续氨基酸含量测定,并对其进行理化特性研究。
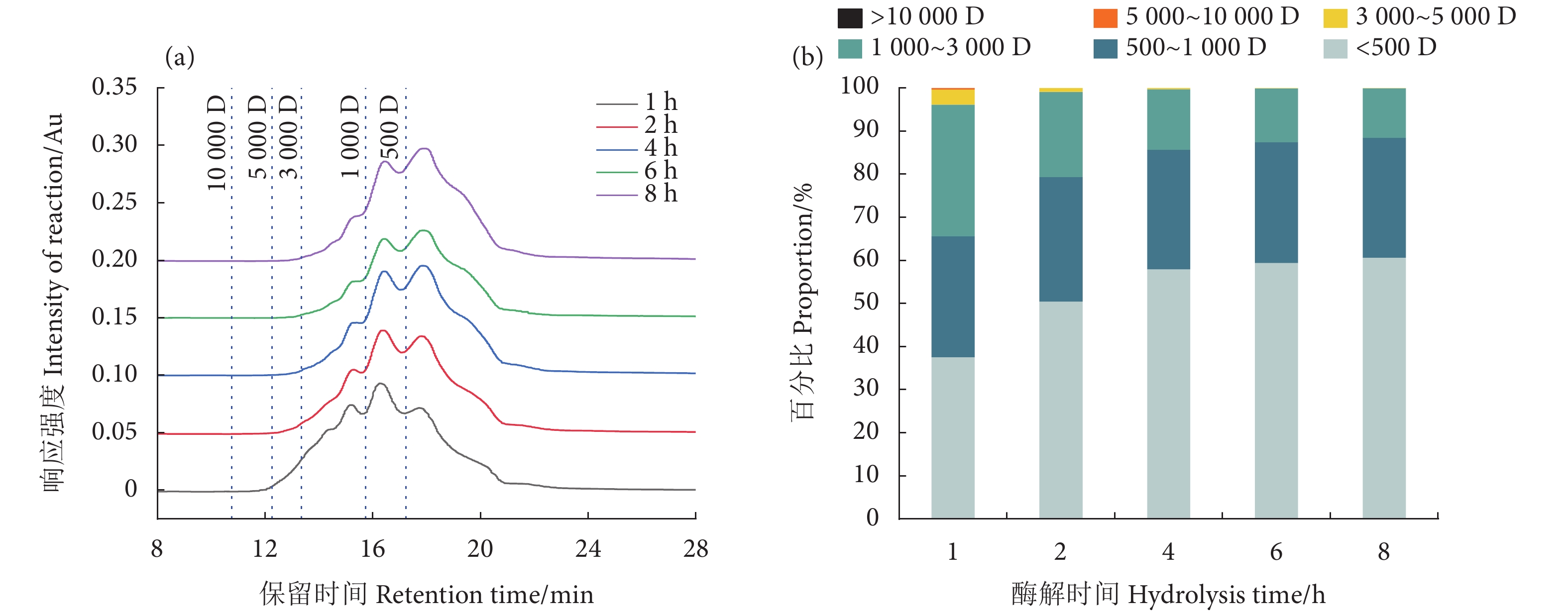
2.4 氨基酸含量分析
不同蛋白酶对氨基酸序列的识别位点不同,酶切蛋白得到的肽段可以产生特定的氨基酸组成和序列,表现出特殊的生物活性。肽的结构性质如分子质量和氨基酸残基与它们的金属螯合活性有关,这会影响金属的生物可及性。肽段中的组氨酸 (His)、谷氨酸 (Glu)、Cys和天冬氨酸 (Asp) 有助于金属螯合活性[26]。由图4可知,罗非鱼皮胶原蛋白以及TSCIP中Asp、Glu、甘氨酸 (Gly)、丙氨酸 (Ala)、精氨酸 (Arg)、脯氨酸 (Pro) 含量均较高,而Gly、Pro、亮氨酸 (Leu)、Ala是合成胶原蛋白所必需的氨基酸。在TSCIP氨基酸组分中,蛋氨酸 (Met) 占比显著增加。Met是一种参与蛋白质合成的含硫氨基酸,具有重要的生理作用,也是构成人体的必需氨基酸之一,其无法通过人体本身的代谢途径产生,必须依赖环境条件才能被摄取。在胶原酶活性研究中,His、Glu、Met、Cys以及芳香族氨基酸具有重要作用[22,27]。有研究报道胶原酶抑制肽序列中的Cys能与酶中的Zn2+发生相互作用形成氢键[27]。
2.5 紫外光谱分析
肽与金属离子在紫外或可见光区均有最强吸收峰。肽在与金属离子的结合过程中充当配位体,离子和配位体之间发生的反应改变了反应所得物质产生跃迁所需的能量,从而影响其最大吸收波长[28]。通过紫外光谱扫描分析可以初步判定是否有新物质生成。
图5表明TSCIP在250~290 nm处形成芳香族氨基酸的特征吸收带。当TSCIP与Zn2+、Mg2+发生结合反应后,其特征性吸收峰红移,这可能由配体N−C−O中π→π*电子跃迁所致[29]。由此可知TSCIP与Zn2+、Mg2+ 之间发生了相互作用,并生成了一种新化合物。TSCIP与胶原酶结合后,其特征性吸收峰稍红移,显著降低了胶原酶的紫外吸收强度,表明TSCIP改变了胶原酶结构。
2.6 红外光谱分析
通过红外吸收光谱分析蛋白质与金属离子结合时其相关基团参与配位及其侧链情况是检验肽螯合特性的重要方法[30]。肽中含有较多氨基酸残基之间的酰胺键,以及少量末端或侧链的氨基 (−NH) 和羧基 (−COOH),因此金属离子可与肽中的氨基、羧基、肽键等其他位置以共价键的形式配位,而侧链中的氧和硫原子可以提供孤对电子与金属离子结合[24,31]。肽链中羧基、羰基 (C=O)、氨基的特征性吸收峰分别在1 500~1 400 cm−1、1 700~1 600 cm−1、3 600~3 300 cm−1左右,酰胺I带是由C=O键伸展以及N−H弯曲和C−N伸展的混合物而产生,酰胺II带是由C−N和N−H在1 600~1 500 cm−1伸展而产生,酰胺III带的N−H键位于1 300~1 200 cm−1[32]。
TSCIP、TSCIP-Zn2+、TSCIP-Mg2+、TSCIP-胶原酶在4 000~400 cm−1波长处的红外光谱如图6所示。TSCIP在与Zn2+、Mg2+及胶原酶结合后,其吸收峰的位置和强度均发生了一定变化。TSCIP在3 448.72 cm−1处出现了由−NH伸缩振动引起的谱带 (酰胺A带);TSCIP与金属离子结合后形成的TSCIP-Zn2+、TSCIP-Mg2+ 则偏移至3 327.21 cm−1;其与胶原酶结合后,该吸收峰移动至3 446.79 cm−1,表明−NH参与了结合物的形成,Zn2+、Mg2+取代了氢键,生成N−Zn、N−Mg[33]。TSCIP在2 372.44 cm−1处的吸收带为酰胺B带,其与Zn2+、Mg2+、胶原酶结合后,该特征峰移至 2 362.80、2 368.59、2 376.30 cm−1,表明 CH2发生了非对称伸缩振动。TSCIP在1 672.28 cm−1处的吸收带为酰胺I带,由于C=O伸缩振动和弯曲振动,与Zn2+、Mg2+ 和胶原酶作用后向更低的频率1 647.21 cm−1移动,且吸收峰强度明显增大。TSCIP在1 408.04 cm−1处的吸收带表征为−COOH,在与Zn2+ 结合后吸收峰转移至1 402.25 cm−1,与Mg2+ 结合后转移至1 406.11 cm−1。此外,TSCIP与Zn2+、Mg2+ 结合后,由O=C−N键面内振动产生的653.87 cm−1处的特征峰分别移至663.51、659.66 cm−1,这可能是由于O=C−NH2中−C=O附近的电子云密度减少所致[34],而TSCIP与胶原酶结合后,该特征峰移至646.15 cm−1。FTIR结果表明,Zn2+、Mg2+主要通过与羧基氧、氨基氮原子以及羰基相互作用生成肽-金属离子结合物,这与邹文昊天[35]通过红外光谱发现在大豆肽、肽-锌螯合物、肽-亚铁螯合物中羟基氧、羧基氧和氨基氮是Zn2+ 和Fe2+ 的主要结合位点的结果相似。胶原酶主要通过氨基氮原子以及羰基与TSCIP 结合,从而进一步验证了TSCIP能够结合胶原酶的Zn2+活性中心,进而抑制胶原酶活性。有研究报道在基质金属蛋白酶-3 (MMP-3) 和金属蛋白酶的组织抑制剂-1 (TIMP-1) 催化结构域的复合体中,催化中心的锌原子被TIMP-1中Cys1的N-末端氨基和羰基双配位络合,从而排出与锌原子结合的水分子,抑制酶活性[36]。
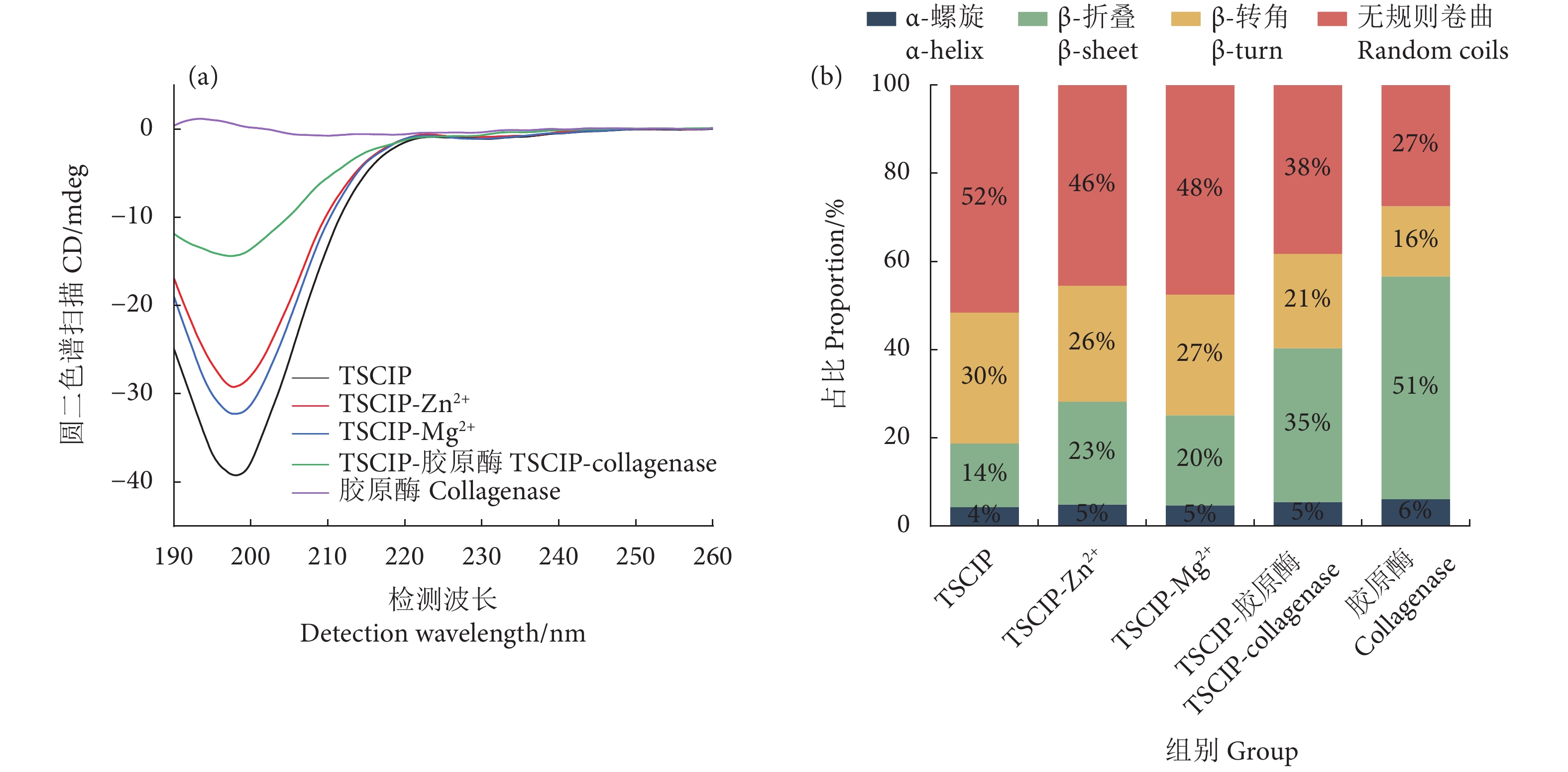
2.7 圆二色谱分析
圆二色谱是研究蛋白质或肽主链在远紫外光谱区 (190~260 nm) 构象变化的一种快速有效的方法[37]。图7-a显示,TSCIP分别结合Zn2+、Mg2+ 以及胶原酶后,其在190~200 nm处的单负峰出现上移,说明β-折叠含量增加。在金属离子的作用下部分β-转角与无规则卷曲转化为β-折叠,金属离子的加入有利于诱导多肽与金属离子螯合物折叠结构的形成[38]。由图7-b可见,TSCIP的二级结构有4种不同构象:α-螺旋、β-折叠、β-转角和无规则卷曲,其中β-转角和无规则卷曲含量最高,占比分别为30%和52%;胶原酶的二级结构以β-折叠为主,占比为51%。胶原酶与TSCIP结合后其β-折叠显著减少 (P<0.05),从51%降至35%,胶原酶的构象变化有利于TSCIP与胶原酶中Zn2+ 活性中心的结合。TSCIP二级结构中β-折叠含量占比为14%;TSCIP-胶原酶、TSCIP-Zn2+、TSCIP-Mg2+ 的β-折叠含量均显著高于TSCIP (P<0.05),分别为35%、23%、20%,表明金属离子以及胶原酶与TSCIP的结合诱导了TSCIP的折叠并形成了更加紧密的结构。
3. 结论
本研究采用碱性蛋白酶、木瓜蛋白酶、糜蛋白酶对罗非鱼皮进行酶解,以蛋白质水解度、胶原酶抑制活性为指标筛选胶原酶抑制肽的最佳制备条件,并对TSCIP与Zn2+、Mg2+、胶原酶结合后的结构进行表征。结果表明,罗非鱼皮经碱性蛋白酶酶解4 h的产物 (TSCIP) 具有更好的胶原酶抑制活性和金属离子结合活性。该产物Asp、Glu、Gly、Ala、Arg、Pro含量较高,且分子质量<1 000 D的组分占85.65%。紫外、傅里叶变换红外光谱以及圆二色谱分析显示,TSCIP结合胶原酶产生的结构变化与结合金属离子相似,胶原酶构象变化有利于TSCIP作用于胶原酶中的Zn2+。后续研究将对TSCIP进行分离纯化和结构鉴定,明确其氨基酸序列,并通过细胞与动物实验对其抗光老化特性进行研究。
-
图 1 不同蛋白酶的水解度随时间的变化
注:不同小写字母表示在不同酶解时间下同种蛋白酶酶解产物的蛋白质水解程度具有显著性差异 (P<0.05)。
Figure 1. Change in hydrolysis degree of different proteases over time
Note:Different lowercase letters represent significant differences in the degree of proteolysis of enzymatic products of the same protease at different enzymatic hydrolysis time (P<0.05).
图 2 不同蛋白酶酶解产物的胶原酶抑制率 (a)、碱性蛋白酶酶解产物的金属离子结合率 (b) 及其相关性分析 (c—d)
注:不同小写字母表示在不同酶解时间下同种蛋白酶酶解产物的胶原酶抑制率或金属离子结合率具有显著性差异 (P<0.05)。
Figure 2. Collagenase inhibition rate of different hydrolysates (a) and metal ion binding rate of alkaline protease hydrolysate (b) and correlation analysis (c−d)
Note: Different lowercase letters represent that the collagenase inhibition rate or metal ion binding rate of enzymatic products of the same protease at different enzymatic hydrolysis time are significantly different (P<0.05).
表 1 不同蛋白酶的最适酶解条件
Table 1 Optimal enzymatic conditions for different proteases
蛋白酶
Protease酶解条件 Hydrolysis condition 加酶量
Enzyme content/%温度
Temperature/℃pH 酶活性
Enzymatic activity/(U·mg−1)酶解时间
Hydrolysis time/h碱性蛋白酶 Alkaline protease 1 50 9.0 200 1、2、4、6、8 糜蛋白酶Chymotrypsin 1 37 7.5 10 000 1、2、4、6、8 木瓜蛋白酶 Papain 1 50 6.0 800 1、2、4、6、8 -
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2023中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2023: 17-18. [2] 韩梦瑶, 李新月, 王晓梅, 等. 大口黑鲈鱼皮胶原蛋白肽的制备及抗氧化活性研究[J]. 食品与机械, 2022, 38(4): 175-182, 194. [3] 黄丽萍. 浅谈罗非鱼科学养殖技术[J]. 水产养殖, 2022, 43(8): 69-71. doi: 10.3969/j.issn.1004-2091.2022.08.019 [4] 宋宗元. 罗非鱼鱼皮胶原肽的制备与生物活性研究[D]. 厦门: 集美大学, 2014: 1-2. [5] 李瑞杰, 胡晓, 李来好, 等. 罗非鱼皮酶解物钙离子结合能力及其结合物的抗氧化活性[J]. 南方水产科学, 2019, 15(6): 106-111. [6] 宋玉琼, 胡晓, 相欢, 等. 罗非鱼皮胶原肽的酪氨酸酶抑制活性与铜离子结合活性研究[J]. 南方水产科学, 2023, 19(1): 155-164. [7] 陈慕雪. 三文鱼皮和罗非鱼皮胶原蛋白肽调控皮肤胶原合成和微生物定殖促进创伤愈合的作用研究[D]. 海口: 海南大学, 2021: 10-11. [8] FENG G Z, WEI L, CHE H L, et al. A frog peptide ameliorates skin photoaging through scavenging reactive oxygen species[J]. Front Pharmacol, 2021, 12: 761011.
[9] NAGASE H, VISSE R, MURPHY G. Structure and function of matrix metalloproteinases and TIMPs[J]. Cardiovasc Res, 2006, 69(3): 562-573. doi: 10.1016/j.cardiores.2005.12.002
[10] SILVA R, ALVES C P, BARBOSA F C, et al. Antioxidant, antitumoral, antimetastatic effect and inhibition of collagenase enzyme activity of Eleutherine bulbosa (Dayak onion) extract: in vitro, in vivo and in silico approaches[J]. J Ethnopharmacol, 2023, 318(Pt B): 117005.
[11] 肖寒, 刘秀妨, 郑淋, 等. 溶组织梭状芽孢杆菌胶原蛋白酶的研究进展[J]. 食品科学, 2022, 43(17): 316-325. [12] SARDY M. Role of matrix metalloproteinases in skin ageing[J]. Connect Tissue Res, 2009, 50(2): 132-138. doi: 10.1080/03008200802585622
[13] 艾丽奇. 鳕鱼皮胶原蛋白肽的抗皮肤光老化功效及其作用机制研究[D]. 广州: 华南理工大学, 2020: 24-25. [14] PIENTAWEERATCH S, PANAPISAL V, TANSIRIKONGKOL A. Antioxidant, anti-collagenase and anti-elastase activities of Phyllanthus emblica, Manilkara zapota and silymarin: an in vitro comparative study for anti-aging applications[J]. Pharm Biol, 2016, 54(9): 1865-1872. doi: 10.3109/13880209.2015.1133658
[15] CHEN T J, HOU H, FAN Y, et al. Protective effect of gelatin peptides from Pacific cod skin against photoaging by inhibiting the expression of MMPs via MAPK signaling pathway[J]. J Photochem Photobiol B, 2016, 165: 34-41. doi: 10.1016/j.jphotobiol.2016.10.015
[16] THRING T S, HILI P, NAUGHTON D P. Anti-collagenase, anti-elastase and anti-oxidant activities of extracts from 21 plants[J]. BMC Complement Altern Med, 2009, 9: 27. doi: 10.1186/1472-6882-9-27
[17] 张金杨, 胡晓, 李来好, 等. 罗非鱼酶解物矿物离子结合能力及其结合物抗氧化活性[J]. 食品与发酵工业, 2018, 44(5): 76-81. [18] SUN L P, LIU Q M, FAN J, et al. Purification and characterization of peptides inhibiting MMP-1 activity with C terminate of Gly-Leu from simulated gastrointestinal digestion hydrolysates of tilapia (Oreochromis niloticus) skin gelatin[J]. J Agric Food Chem, 2018, 66(3): 593-601. doi: 10.1021/acs.jafc.7b04196
[19] LI C Y, FU Y, DAI H J, et al. Recent progress in preventive effect of collagen peptides on photoaging skin and action mechanism[J]. Food Sci Human Wellness, 2022, 11(2): 218-229. doi: 10.1016/j.fshw.2021.11.003
[20] 崔潇, 江虹锐, 刘小玲, 等. 响应面法优化罗非鱼鱼皮胶原多肽螯合镁的工艺条件的研究[J]. 食品工业科技, 2013, 34(15): 238-241, 245. [21] KANG Y A, KIM Y J, JIN S K, et al. Antioxidant, collagenase inhibitory, and antibacterial effects of bioactive peptides derived from enzymatic hydrolysate of Ulva australis[J]. Mar Drugs, 2023, 21(9): 469. doi: 10.3390/md21090469
[22] NITULESCU G, MIHAI D P, ZANFIRESCU A, et al. Discovery of new microbial collagenase inhibitors[J]. Life (Basel), 2022, 12(12): 2114.
[23] AGUILAR-TOALA J E, LICEAGA A M. Identification of chia seed (Salvia hispanica L.) peptides with enzyme inhibition activity towards skin-aging enzymes[J]. Amino Acids, 2020, 52(8): 1149-1159. doi: 10.1007/s00726-020-02879-4
[24] 乔虹, 黎松松, 周南希, 等. 海洋来源金属离子螯合肽研究进展[J]. 食品工业科技, 2024, 45(1): 368-377. [25] CHEN L, SHEN X R, XIA G H. Effect of molecular weight of tilapia (Oreochromis niloticus) skin collagen peptide fractions on zinc-chelating capacity and bioaccessibility of the zinc-peptide fractions complexes in vitro digestion[J]. Appl Sci-Basel, 2020, 10(6): 2041. doi: 10.3390/app10062041
[26] GUO L D, HARNEDY P A, O'KEEFFE M B, et al. Fractionation and identification of Alaska pollock skin collagen-derived mineral chelating peptides[J]. Food Chem, 2015, 173: 536-542. doi: 10.1016/j.foodchem.2014.10.055
[27] 宋易航, 王楚浩, 方柏山. 胶原酶研究进展与应用[J]. 化工学报, 2019, 70(9): 3213-3227. [28] 汪婧瑜. 乌鳢短肽螯合物的结构分析及其生物活性的研究[D]. 湛江: 广东海洋大学, 2016: 28-29. [29] 冯思敏, 王晶, 王羽莹, 等. 珍珠肽螯合钙的制备与性质表征[J]. 食品工业科技, 2022, 43(1): 119-126. [30] NARA M, MORII H, TANOKURA M. Coordination to divalent cations by calcium-binding proteins studied by FTIR spectroscopy[J]. Biochim Biophys Acta-Biomembr, 2013, 1828(10): 2319-2327. doi: 10.1016/j.bbamem.2012.11.025
[31] 陆剑锋, 孟昌伟, 李进, 等. 斑点叉尾鮰骨胶原多肽螯合钙的制备及其特征[J]. 水产学报, 2012, 36(2): 314-320. [32] MALISON A, ARPANUTUD P, KEERATIPIBUL S. Chicken foot broth byproduct: a new source for highly effective peptide-calcium chelate[J]. Food Chem, 2021, 345: 128713. doi: 10.1016/j.foodchem.2020.128713
[33] HUANG S L, ZHAO L N, CAI X X, et al. Purification and characterisation of a glutamic acid-containing peptide with calcium-binding capacity from whey protein hydrolysate[J]. J Dairy Res, 2015, 82(1): 29-35. doi: 10.1017/S0022029914000715
[34] ZHANG C, DU B W, SONG Z H, et al. Antioxidant activity analysis of collagen peptide-magnesium chelate[J]. Polym Test, 2023, 117: 107822. doi: 10.1016/j.polymertesting.2022.107822
[35] 邹文昊天. 大豆肽锌和大豆肽亚铁螯合物的制备及其特性研究[D]. 南昌: 南昌大学, 2022: 43-44. [36] de ALMEIDA L G N, THODE H, ESLAMBOLCHI Y, et al. Matrix metalloproteinases: from molecular mechanisms to physiology, pathophysiology, and pharmacology[J]. Pharmacol Rev, 2022, 74(3): 712-768.
[37] PRIBIC R, VANSTOKKUM I H M, CHAPMAN D, et al. Protein secondary structure from fourier transform infrared and/or circular dichroism spectra[J]. Anal Biochem, 1993, 214(2): 366-378. doi: 10.1006/abio.1993.1511
[38] KRISHNA S S, MAJUMDAR I, GRISHIN N V. Structural classification of zinc fingers: survey and summary[J]. Nucleic Acids Res, 2003, 31(2): 532-550. doi: 10.1093/nar/gkg161
-
期刊类型引用(1)
1. 贺玉珊,刘爱国,丛海花,吴琼,徐亦涌. 海洋副产物来源生物肽提取、纯化及生物利用度研究进展. 保鲜与加工. 2025(04): 144-156 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载:
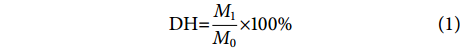
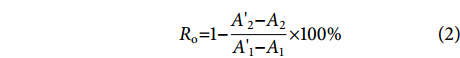

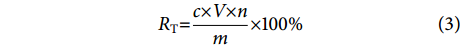
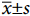



 粤公网安备 44010502001741号
粤公网安备 44010502001741号
