Variation and accumulation characteristics of diazepam in simulated culture environment
-
摘要:
为探究地西泮 (Diazepam, DZP) 在模拟养殖环境中的降解特点及累积特征,设置2个浓度胁迫组 (A、C组),并在2个浓度下添加蜈蚣草 (Pteris vittata) 作对照组 (B、D组),共4个试验组;分析水体、底泥和蜈蚣草中DZP浓度随时间的变化特点,探讨蜈蚣草和底泥对水体中DZP的累积特征。结果表明,给药后4组水体中DZP的初始质量浓度分别为A:(0.118±0.002) μg·L−1、B:(0.117±0.004) μg·L−1、C:(1.141±0.078) μg·L−1和D:(1.142±0.039) μg·L−1,给药后第768小时水体中DZP质量浓度下降了29.71%~40.17%;DZP降解半衰期介于65.29~139.11 d。4组底泥中DZP质量分数随时间变化逐渐上升,给药768 h后4组底泥中DZP质量分数分别达到初始质量分数的17.99倍(1.384 μg·kg−1)、14.81倍(0.918 μg·kg−1)、4.77倍 (7.848 μg·kg−1)和5.30倍 (7.763 μg·kg−1),富集系数介于9.79~18.80;B、D组蜈蚣草中DZP浓度峰值出现在给药后第216小时。蜈蚣草和底泥对水体中的DZP具有一定的吸附和富集作用,可明显缩短高浓度DZP在水中降解的半衰期,在低浓度DZP水体中添加蜈蚣草可抑制底泥对DZP的富集。
Abstract:In order to explore the degradation and accumulation characteristics of diazepam (DZP) in simulated culture environment, we set up four experimental groups including two different concentration stress groups (Group A and Group C) and two control groups (Group B and Group D) with addition of Pteris vittata to analyze the changes of DZP content in water, sediment and P. vittata with time, and to investigate the accumulation characteristics of DZP in water by P. vittata and sediment. The results show that the initial DZP mass concentrations in Group A, Group B, Group C and Group D were (0.118±0.002) μg·L−1, (0.117±0.004) μg·L−1, (1.141±0.078) μg·L−1 and (1.142±0.039) μg·L−1, respectively. The DZP concentration had decreased by 29.71%–40.17% after 768 h, and the degradation half-life period of DZP ranged from 65.29 d to 139.11 d. The DZP concentration in the sediment in the four groups increased gradually with time, reaching 17.99 times (1.384 μg·kg−1, dry mass), 14.81 times (0.918 μg·kg−1, dry mass), 4.77 times (7.848 μg·kg−1, dry mass) and 5.30 times (7.763 μg·kg−1, dry mass) of the initial concentration after 768 h of administration, respectively. The enrichment coefficients were 9.79–18.80. The peak concentration of DZP in Group B and Group D appeared after 216 h after administration. The adsorption and enrichment of DZP in water by P. vittata and the sediment can obviously shorten the degradation half-life period of high concentration DZP in water, and addition of P. vittata to low concentration DZP can inhibit the enrichment of DZP in sediment.
-
地西泮 (Diazepam, DZP) 别名安定 (Valium),为白色或类白色的结晶性粉末,无臭、味苦,易溶于乙醇与甲醇等有机溶剂,是苯二氮卓类 (Benzodiazepines, BZDs) 药物之一;能够作用于大脑皮层中的γ-氨基丁酸受体 (Gamma-aminobutyric acid receptor, GABA),抑制中枢神经系统活动,具有抗惊厥、抗焦虑、松弛骨骼肌及消除记忆的作用[1]。BZDs类药物在动物体内的脑、肝脏和肌肉等器官和组织中的富集浓度远高于环境浓度[2-4]。Laura等[5]研究表明,DZP在生物体内被代谢酶生物转化为奥沙西泮、去甲地西泮和替马西泮等,其性质稳定,能够在水环境及水底泥沙中持久存在,传统污水处理厂的工艺并不能完全清除BZDs,因此其会随出水进入到自然环境中造成水体污染[6]。奥沙西泮作为DZP的一种主要代谢产物,在污水中的检出质量浓度可达7.4 µg·L−1[2]。DZP作为BZDs中常用的一种药物,临床中常用作镇静剂[5]。液质法 (HPLC-MS/MS)[7-10]被广泛用于DZP的定性和定量分析,主要集中在血液[11-12]、尿液[7]、直肠[13-14]、水产品[8-9,15-16]和水体[17]中。2021年10月农业农村部开展了农产品质量安全专项监督抽查,摸排市场流通环节鲜活水产品中DZP的残留情况,发现有16批次水产品中有DZP检出[18];另外,2022年至今农业农村部在全国范围内定期开展的养殖环节DZP监督抽查工作中,也发现在养殖水体、底泥和鱼体内均有DZP检出。DZP会被违法使用在水产养殖和运输过程中,以便于管理和降低鱼类对环境的感知能力及新陈代谢,提高鱼体成活率[19-20]。因此,养殖环境中的DZP残留受到业内关注,但关于DZP在养殖环境中残留情况和消除方法的研究却较为缺乏。
目前,多数学者采用植物修复技术对养殖水体进行水质净化及药物消除,通常利用绿狐尾藻 (Myriophyllum elatinoides)[21]与蕹菜 (Ipomoea aquatic)[21-22]等净化养殖池塘水质。黄晓丽等[23]研究发现,蕹菜能够促进水溶液中丙草胺和丁草胺的去除,刘抗旱[24]采用蜈蚣草 (Pteris vittata) 修复砷(As)污染土壤。蜈蚣草隶属于凤尾蕨科、凤尾蕨属,是已发现的第一种超富集As植物[25],但有关其对养殖水体中镇静剂类药物残留的去除作用的研究较少。研究表明,养殖水体残留的DZP会影响斑马鱼(Danio rerio)和鳗的胚胎基因表达[26],影响野生鲈鱼的摄食行为[2]等;同时,DZP及其代谢产物在环境中性质稳定,可以抵抗光降解,在水体中稳定存在,并发生复杂的迁移转化过程[27],对水生生物造成潜在危害。因此,对养殖环境中DZP的变化趋势和消除方法的研究具有重要的理论和现实意义。
本研究以添加DZP的静态水−底泥−蜈蚣草为研究对象,采用HPLC-MS/MS法分析不同作用时间DZP在环境介质中的浓度变化,探究底泥和蜈蚣草对DZP的富集特征,以期为水产品养殖和运输过程中DZP的监管提供参考依据和技术支撑。
1. 材料与方法
1.1 试剂与仪器
复方地西泮片:每片含DZP 1.25 mg (济宁市安康制药有限责任公司);供试底泥:采自哈尔滨市宾县 (127°05'08''E, 46°03'22''N) 的养殖池塘,采集后风干并粉碎混合均匀;细叶蜈蚣草 (以下称“蜈蚣草”):购自哈尔滨市大发国际花鸟鱼市场;C18柱 (2.1 mm×50 mm, 1.7 μm Waters)、DZP标准溶液 (100 mg·L−1)、DZP-D5标准溶液 (10 mg·L−1),甲酸、乙腈均为质谱纯,二氯甲烷为色谱纯,氯化钠 (分析纯)、乙二胺-N-丙基硅烷化硅胶 (PSA)、玻璃纤维滤膜 (GF/F)、离心管、Envi-Carb柱 [250 mg·(3 mL)−1]、0.22 μm有机相滤膜均购自上海安谱实验科技有限公司;霍格兰氏营养液配制所用的试剂均为分析纯,购自国药化学试剂有限公司;试验用水为超纯水,自备;氮气 (N2,纯度>99.9%,哈尔滨卿华气体工业有限公司)。
1290-6470液相色谱串联三重四级杆质谱联用仪 (美国安捷伦公司);KQ-700E型超声波清洗机 (昆山超声仪器有限公司);AllegraX-30R高速离心机 (贝克曼库尔特公司);MS1涡旋混匀器 (德国IKA公司);A10纯水器 (美国Millipore公司);XS205Du电子天平 (精度0.000 01 g,瑞士梅特勒-托利多有限公司);N-EVAP 112氮吹仪 (路易企业有限公司)。
1.2 方法
1.2.1 试验方案设计
试验采用长65 cm、宽47 cm、高35.5 cm的PP整理箱,每箱中水的体积为60 L (水温19 ℃),底层铺设5 cm左右的底泥。试验包括5个处理组:空白对照 (CK),低浓度组 [0.1 μg·L−1 DZP水−底泥 (A)、0.1 μg·L−1 DZP水−底泥−蜈蚣草 (B)],高浓度组 [1.0 μg·L−1 DZP水−底泥 (C)、1.0 μg·L−1 DZP水−底泥−蜈蚣草 (D)],每个处理组设置3个平行。将复方DZP片溶解于乙醇中,配制成质量浓度为125 mg·L−1的DZP储备溶液,添加到霍格兰氏水培营养液中,使营养液中DZP质量浓度分别为0.1和1.0 μg·L−1,同时在B和D两组中均添加等量的蜈蚣草,在室内自然光条件下培养。给药后第0、第24、第48、第72、第96、第216、第264、第360、第600和第768小时取水、底泥与蜈蚣草样本,每次取水样200 mL,底泥200 g,蜈蚣草100 g。
1.2.2 试验材料预处理
供试土壤采集后摊成2~3 cm薄层于白色搪瓷盘中,置于土壤干燥机下吹干水分,用玛瑙研钵研磨,过80目筛,于棕色具塞磨口玻璃瓶中存放;选择生长良好的蜈蚣草植株,洗净根部,移入霍格兰氏营养液进行预培养,以适应水培条件,取样后蜈蚣草用清水洗净、晾干,粉碎。
1.2.3 标准曲线配制
将80% (φ) 乙腈溶液稀释成质量浓度分别为0.1、0.2、0.5、1、2、5、10、20、50、100、125、200 μg·L−1的DZP系列标准溶液,其中内标溶液质量浓度均为5.0 μg·L−1,以测得特征离子质量色谱峰,外标和内标峰面积比值为纵坐标,对应的标准溶液浓度为横坐标,绘制标准曲线,得到回归方程和相关系数。
1.2.4 DZP的提取和净化
水中DZP的提取:取200 mL经GF/F过滤后的水体样品于500 mL分液漏斗中,加入100 μg·L−1DZP-D5内标工作液50 μL,再加入20 mL 10% (w) 氯化钠溶液,30 mL二氯甲烷,经过振荡提取后,收集二氯甲烷层于100 mL鸡心瓶中,再加入20 mL二氯甲烷二次提取,合并二氯甲烷层,40 ℃下氮气吹至近干,准确加入1 mL 80% (φ) 乙腈溶液溶解残留物,再将溶液转移至1.5 mL离心管中,加入100 mg PSA,涡旋混合1 min,以12 000 r·min−1离心10 min,过0.22 μm有机微孔滤膜供测定。
底泥/蜈蚣草中DZP的提取及净化:称取研磨好的蜈蚣草干粉和底泥干粉末样品2 g (精确到0.01 g) 于50 mL离心管中,准确加入50 μL DZP-D5内标工作液 (100 μg·L−1),10 mL水,于涡旋混合器上混合30 s,放置10 min。加入10 mL乙腈,5 g氯化钠,涡旋提取1 min,超声提取10 min,以4 000 r·min−1离心5 min。收集上清液于另一干净的50 mL离心管中。在剩余混合物中再加入5 mL乙腈,重复提取一次,合并两次上清液,备用。
对底泥和蜈蚣草提取液进行净化,Envi-Carb柱提前用5 mL乙腈活化,将上述备用液过柱,用5 mL乙腈洗脱,收集合并过柱液和洗脱液,于40 ℃下氮气吹至近干。准确加入1.0 mL80% (φ) 乙腈溶液溶解残渣,涡旋混合1 min,过0.22 µm有机微孔滤膜。
液相色谱−串联质谱测定,DZP含量计算公式为:
$$ C=\dfrac{({C}_{\mathrm{i}}-{C}_{0)})\times V}{m}\times {1\;000} /{\text{‰}}$$ (1) 式中:C为试样中DZP质量分数或质量浓度 (μg·kg−1或μg·L−1);Ci为试样溶液中DZP质量浓度 (μg·L−1);C0为空白样液中DZP质量浓度 (μg·L−1);V为定容体积 (mL);m为试样的量 (g或mL)。
1.2.5 质量控制
为消除基质对测试结果的影响,向空白水体、底泥和蜈蚣草中分别添加3水平DZP,所有样品平行测定3次,要求水体、底泥和蜈蚣草基质加标的准确度 (回收率) 介于70%~120%、精密度 (Relative standard deviations, RSDs)<10%。
1.3 仪器条件
1.3.1 色谱条件
色谱柱:C18柱 (2.1 mm×50 mm, 1.7 μm);流速:0.30 mL·min−1;柱温:30 ℃;进样量:5 µL;流动相:A为0.1% (φ) 甲酸水溶液,B为乙腈。梯度洗脱程序见表1。
表 1 流动相梯度洗脱程序Table 1 Mobile phase gradient elution procedure时间 t/min A/% B/% 0 95.00 5.00 1.00 95.00 5.00 2.50 5.00 95.00 3.90 5.00 95.00 3.91 95.00 5.00 5.00 95.00 5.00 1.3.2 质谱条件
离子源:电喷雾 (ESI) 离子源;扫描方式:正离子扫描 (ESI+);监测方式:多反应监测 (MRM);喷雾电压毛细管电压3 000 V;离子传输管温度:350 ℃;鞘气流量:11.0 L·min−1;辅助气流量:5 L·min−1;碰撞气:氩气;定性离子对、定量离子对和碰撞能量见表2。
表 2 地西泮及内标物的质谱参数Table 2 Mass spectrum parameters of diazepam and internal standard化合物
Compound定性离子对
Qualitative
ion pair/
(m·z−1)定量离子对
Quantitative
ion pair/
(m·z−1)碰撞能量
Collision
energy/
(eV)地西泮
Diazepam285.2>193.1 285.2>193.1 35 285.2>154.1 37 地西泮-D5
Diazepam-D5290.2>154.1 290.2>154.1 37 1.4 数据统计与分析
DZP在水体中降解零级、一级、二级反应动力学方程分别按公式(2)、(3)和(4)计算[28]:
$$ {y}_{0}={C}_{0}-{C}_{t}=kt+{b} $$ (2) $$ {y}_{1}=\mathrm{ln}\left(\dfrac{{C}_{t}}{{C}_{0}}\right)=kt+{b} $$ (3) $$ {y}_{2}=\dfrac{1}{{C}_{t}}-\dfrac{1}{{C}_{0}}=kt+{b} $$ (4) $$ {T}_{1/2}=\dfrac{1}{{k}{\times C}_{0}} $$ (5) 式中:T1/2为光解半衰期 (d);k为光降解速率常数;C0为DZP的初始质量浓度 (μg·L−1);Ct为t时刻DZP的残存质量浓度 (μg·L−1);b为常数。
采用富集系数 (Bioconcentration factors, BCF) 评价蜈蚣草和底泥对DZP的富集能力[29],计算公式为:
$$ {E}_{{\rm{BCF}}}=\dfrac{{C}_{\mathrm{A}}}{{C}_{\mathrm{B}}}\times 100{\text{%}} $$ (6) 式中:EBCF为富集系数;CA为蜈蚣草或底泥中DZP质量分数 (μg·kg−1);CB为水体中DZP质量浓度 (μg·L−1)。
数据采用不同时间点的“平均值±标准差 (
$\overline { x}\pm s $ )”表示,采用单因素方差分析法判断不同时间点DZP浓度的差异显著性 (P<0.05),利用Excel 2010和SPSS Statistics 22.0软件进行数据处理,用Visio 2016和Origin 2018软件绘图。2. 结果
2.1 DZP质量控制结果
DZP线性方程和相关系数为y=0.364 777 x−0.442 913,R2=0.999 6 (P<0.05),向空白水体、底泥和蜈蚣草中分别添加3水平的DZP目标物 (表3),所有样品平行测定3次,水体、底泥和蜈蚣草的基质加标回收率介于86.2%~108.4%、RSDs介于1.059%~4.028%。方法准确度 (回收率70%~120%) 和精密度 (RSDs<10%) 满足检测要求。
表 3 不同基质中地西泮加标回收率和相对标准偏差Table 3 Adding standard recovery and relative standard deviation of diazepam in different substrates基质
Substrate加标水平
Spiked level实测结果
Measurement result回收率
Recovery rate/%相对标准偏差
RSDs/%水体 Water 0.100 μg·L−1 0.092 μg·L−1 92.0 3.831 0.600 μg·L−1 0.527 μg·L−1 87.8 3.542 1.000 μg·L−1 0.954 μg·L−1 95.4 1.555 底泥 Sediment 0.500 μg·kg−1 0.484 μg·kg−1 96.8 1.614 2.000 μg·kg−1 1.909 μg·kg−1 95.5 1.059 4.000 μg·kg−1 4.335 μg·kg−1 108.4 2.967 蜈蚣草 P. vittata 0.100 μg·kg−1 0.092 μg·kg−1 92.0 3.262 0.500 μg·kg−1 0.431 μg·kg−1 86.2 4.028 0.900 μg·kg−1 0.894 μg·kg−1 99.3 1.468 2.2 DZP在水体中的浓度变化
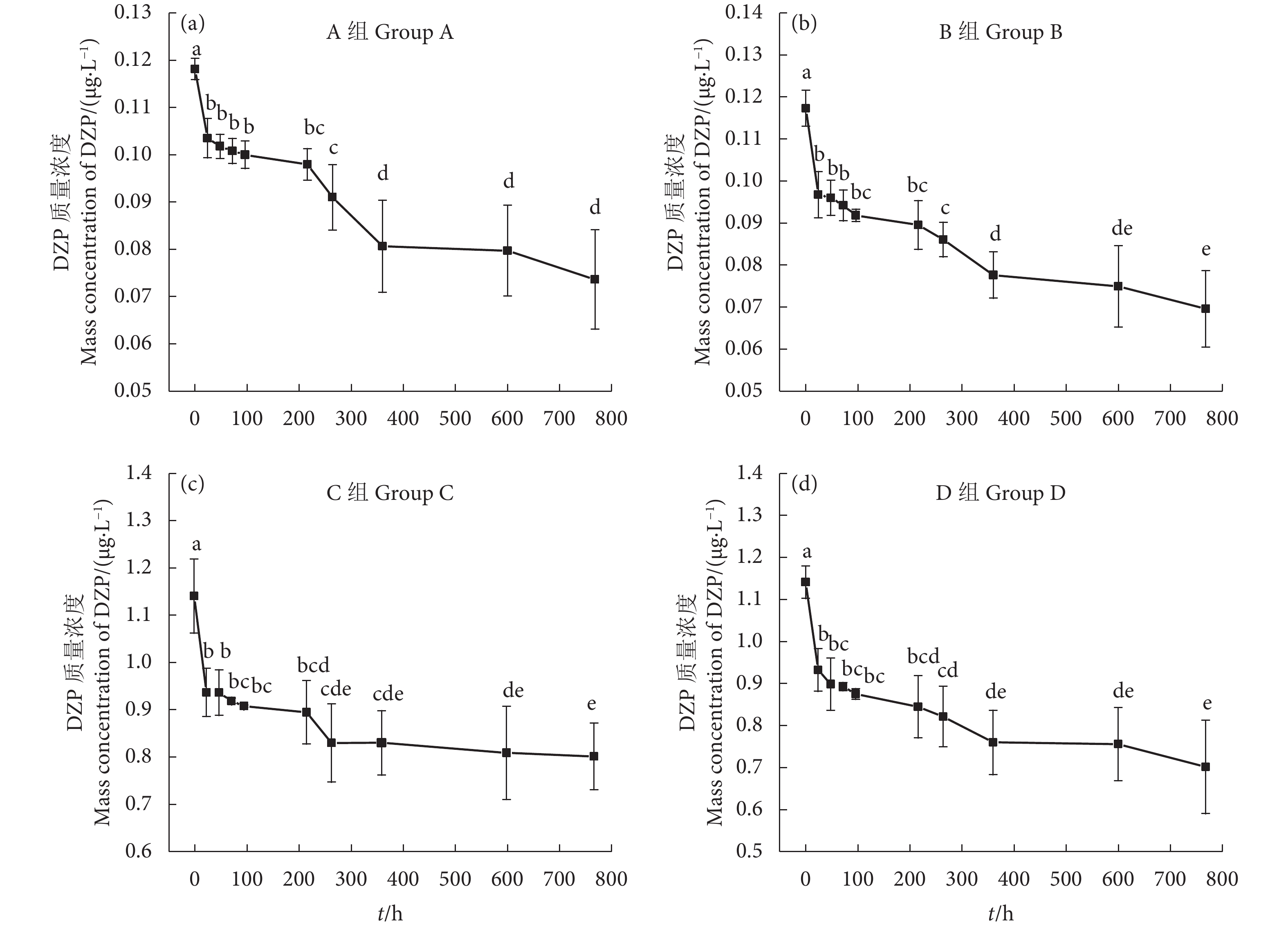
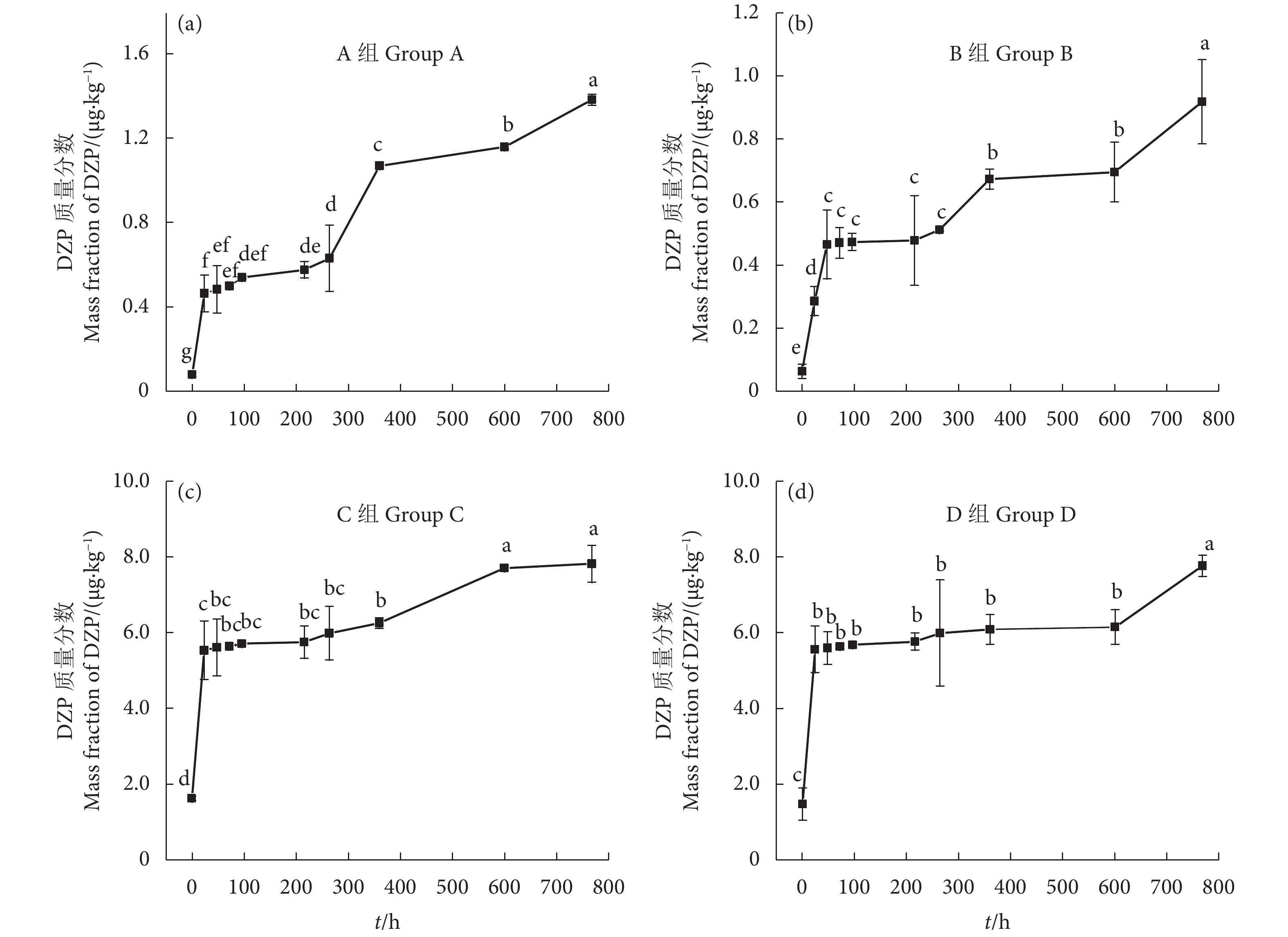
不同给药浓度下,水体中的DZP浓度均呈下降趋势 (图1):给药0.1 μg·L−1后,A、B组水体中DZP初始质量浓度接近,分别为(0.118±0.002)、(0.117±0.004) μg·L−1;给药第24小时,水体中DZP质量浓度分别降低了11.86%、17.09%;给药第48—第96小时,A、B组水体中DZP质量浓度随着取样时间延长,浓度变化无显著性差异 (P>0.05);第768 小时,A、B组水体中DZP浓度分别降低了37.28%、40.17%,较给药第24—第264小时有显著性差异 (P<0.05,图1-a—b)。给药1.0 μg·L−1后,C、D组水体中DZP初始质量浓度接近,分别为 (1.141±0.078)、(1.142±0.039) μg·L−1;给药第24小时,水体中DZP质量浓度分别下降了17.88%、18.30%;第768 小时,C、D组水体DZP质量浓度分别降低了29.71%、38.44%,较给药第24—第216小时有显著性差异 (P<0.05,图1-c—d)。
2.3 DZP在底泥中的浓度变化
由图2可见,底泥中DZP浓度随时间延长不断增加,分别给药0.1和1.0 μg·L−1后,A、B组底泥中DZP初始质量分数分别为 (0.077±0.012)、(0.062±0.022) μg·kg−1 (图2-a—b),C、D组底泥中DZP初始质量分数分别为 (1.645±0.059)、(1.466±0.427) μg·kg−1 (图2-c—d);给药第24小时,4组底泥中DZP浓度增加了2.38%~5.00%;给药第48—第96小时,DZP浓度随着取样时间延长无显著性差异 (P>0.05);给药第768 小时,4组底泥中DZP浓度较第24—第360小时均有显著性增加 (P<0.05),A、B、C和D组底泥中DZP质量分数分别达到初始时的17.99倍 (1.384 μg·kg−1)、14.81倍 (0.918 μg·kg−1)、4.77倍 (7.848 μg·kg−1) 和5.30倍 (7.763 μg·kg−1)。
2.4 DZP在蜈蚣草中浓度变化
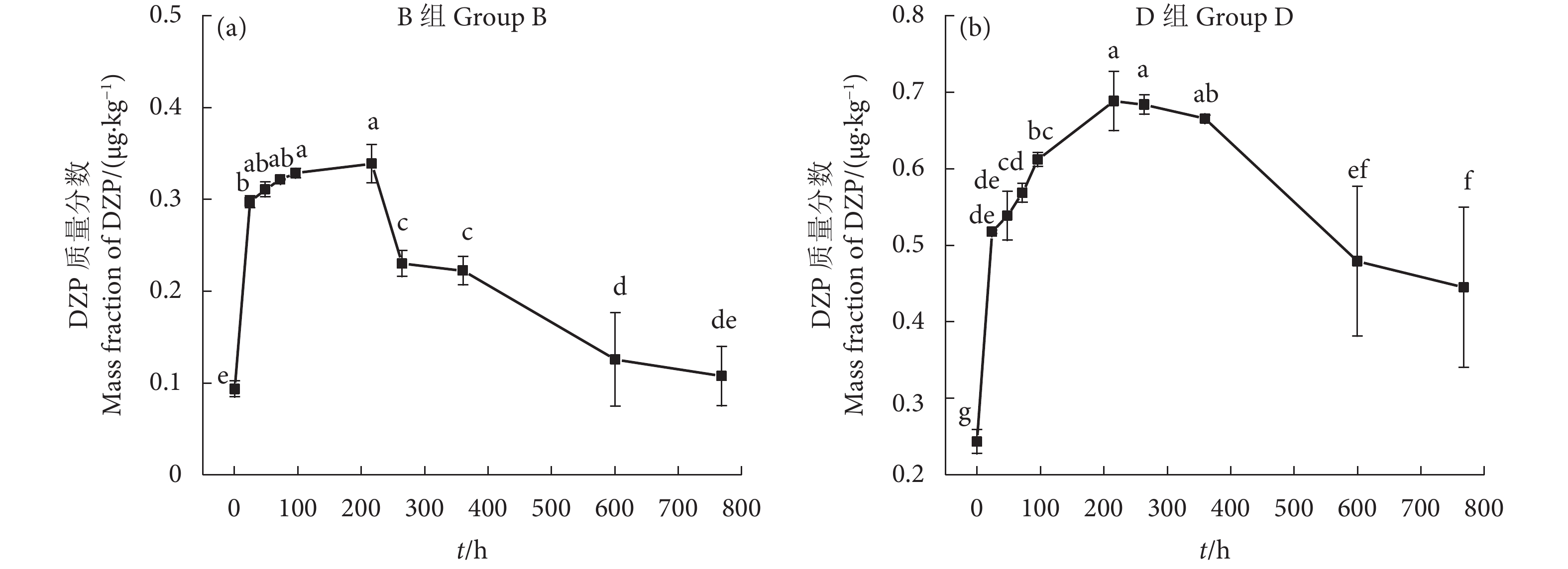
B、D组蜈蚣草中DZP浓度随着时间延长先升后降。0.1 μg·L−1 组 (B组,图3-a)和1.0 μg·L−1 组 (D组,图3-b),给药后蜈蚣草中DZP质量分数变化范围分别为0.093~0.338 μg·kg−1和0.243~0.687 μg·kg−1;给药第216小时时,B、D组蜈蚣草中DZP质量分数均达到峰值,分别为 (0.338±0.021)、(0.687±0.039) μg·kg−1;给药第216小时,B组蜈蚣草中DZP质量分数与给药第24小时和第264—第768小时有显著性变化 (P<0.05),D组蜈蚣草中DZP质量分数与给药第24—第96小时有显著性变化 (P<0.05);给药第768 小时,B、D组蜈蚣草中DZP质量分数下降至初始质量分数的1.15倍 (0.107 μg·kg−1) 和1.83倍 (0.444 μg·kg−1),与给药第24—第360小时有显著性差异 (P<0.05)。
3. 讨论
3.1 水体中DZP降解特征
水体中DZP降解半衰期主要与生物降解过程有关[30],参照1.4中方法对1~32 d水体中DZP浓度变化规律进行零级、一级、二级反应动力学方程拟和。不同浓度和不同模拟养殖环境中DZP拟和降解动力学方程见表4。4组水体中DZP降解动力学拟和方程的
$ {R}_{{\mathrm{y}}_{0}}^{2} $ <$ {R}_{{\mathrm{y}}_{1}}^{2} $ <$ {R}_{{\mathrm{y}}_{2}}^{2} $ ,二级动力学拟和R2均为最大,更符合二级反应动力学模型。依据二级反应动力学方程分别得到k和T1/2等动力学参数(表4),A、B组水体中DZP降解半衰期相近 [T1/2(A)≈T1/2(B)],高浓度组中添加蜈蚣草的DZP降解半衰期小于不添加蜈蚣草的 [T1/2(C)>T1/2(D)],DZP浓度越高在水体中的降解半衰期越长 [T1/2(A)<T1/2(C), T1/2(B) <T1/2(D)],这说明DZP浓度越低越容易在水体中发生降解、底泥富集、植物吸附等现象。磺胺类药物磺胺甲恶唑也是水产养殖过程中的常用药物,方龙香等[31]研究发现温度、pH和光照会影响水体中磺胺甲恶唑的降解,给药500 μg·L−1,降解半衰期在4.88~12.89 d,显然比本研究中DZP (65.29~139.11 d) 易降解 (表4) 与磺胺类抗生素相比,DZP不易在水中降解,而Charles和Steven [32]研究发现DZP光解半衰期为200 h,显然光照对DZP降解有影响,Liu等[33]认为抗癫痫类药物在水体中光解是水解主要过程。为深入了解水中DZP降解的影响因素,可在此基础上选择物理条件,为消除水中DZP污染提供基础技术支撑。表 4 水体中地西泮降解动力学拟和参数Table 4 Fitting parameters of degradation kinetics of diazepam in water理论浓度
Theoretical concentration/
(μg·L−1)模拟养殖环境
Simulated culture
environment方程式
EquationR2 C0/
(μg·L−1)k T1/2/d 反应级数
Order of reaction0.1 μg·L−1 底泥
Sedimenty=0.001 0x+0.014 7 0.918 8 0.118 — — 零级 y=−0.011 3x−0.127 8 0.926 3 — — 一级 y=0.129 0x+1.085 8 0.932 0 0.129 0 65.69 二级 底泥-蜈蚣草
Sediment-P. vittatay=0.009 0x+0.020 9 0.950 4 0.117 — — 零级 y=−0.010 8x−0.191 5 0.959 3 — — 一级 y=0.130 9x+1.729 9 0.965 5 0.130 9 65.29 二级 1.0 μg·L−1 底泥
Sedimenty=0.004 7x+0.213 7 0.835 3 1.141 — — 零级 y=−0.0054x−0.2069 0.842 9 — — 一级 y=0.006 3x+0.200 8 0.850 3 0.006 3 139.11 二级 底泥-蜈蚣草
Sediment-P. vittatay=0.006 9x+0.231 9 0.922 5 1.142 — — 零级 y=−0.008 5x−0.224 2 0.933 7 — — 一级 y=0.010 5x+0.216 2 0.942 2 0.010 5 83.40 二级 3.2 DZP在底泥中富集特点
DZP在底泥中的富集是与底泥和植物相互作用的复杂过程,有研究表明零价铁通过电子转移形成过氧化氢 (H2O2) 可有效降解DZP[34],而水体和底泥中的铁以多种形态存在,好氧条件下促进二价铁离子 (Fe2+) 氧化形成铁氧化物进而促进DZP的降解,水体和底泥中铁的释放受pH、溶解氧和温度的影响[35]。本研究结果表明底泥对水体中DZP具有一定的富集作用,且随着时间延长富集能力逐渐增强,有无蜈蚣草,从初始给药至第264小时整体上底泥对高浓度DZP富集能力强 (A<C和B<D);第360—第768小时,底泥对水体中低浓度DZP富集能力均强于高浓度组 (A>C和B>D,表5)。土壤生态是一个复杂的生物、化学和物理过程,底泥中DZP降解可能受底泥微生物的影响[36];另外,张淑琴[37]研究发现月季 (Rosa chinensis Jacq.) 提升土壤中有机氯降解的主要原因在于其根系分泌物,本研究表明在低浓度DZP水体中添加蜈蚣草可减弱底泥对DZP的富集能力 (A>B),这可能与蜈蚣草根系分泌物的作用有关;蜈蚣草与底泥协同富集水体中的DZP,同时加快底泥对DZP的降解,DZP在底泥中的迁移转化过程是多因素综合作用的结果,其主导因素有待进一步验证。
表 5 底泥对不同浓度地西泮的富集系数Table 5 Bioconcentration factors of diazepan at different concentrations in sediment组别
Group给药时间 Time of administration/h 0 24 48 72 96 216 264 360 600 768 A组 Group A 0.65 4.46 4.73 4.93 5.38 5.87 6.92 13.26 14.54 18.80 B组 Group B 0.53 2.95 4.85 4.99 5.15 5.34 5.95 8.66 9.28 13.19 C组 Group C 1.44 5.93 6.02 6.17 6.32 6.46 7.25 7.56 9.56 9.79 D组 Group D 1.28 5.95 6.22 6.30 6.48 6.81 7.28 7.99 8.12 11.05 3.3 DZP在蜈蚣草中富集特点
细叶蜈蚣草属于多年生湿地沉水草本植物,喜温暖、潮润和半阴环境,生于山坡、路旁草丛中,常地生和附生于溪边林下的石缝中和树干上,全年均可繁殖,沉水植物根、茎、叶不易区分。研究表明蜈蚣草对土壤中镉 (Cd)[38]、As [38-39]、锑 (Sb)[40]等重金属具有超富集能力,根部吸收高效,根到茎的转运高效,植物细胞对高浓度重金属有抗性。马生健等[41]研究发现0.1% (w) 草丁膦使假俭草 [Eremochloa ophiuroides (Munro) Hack] 1/3叶片发黄,而0.5% (w) 草丁膦使其全部叶片发黄,认为禾本科假俭草对草丁膦具有低浓度抗性,而本研究发现两个DZP浓度未使蜈蚣草叶片变黄,并表现出对DZP具有一定的富集能力 (表6)。蜈蚣草更易富集低浓度DZP,在第216小时对低浓度DZP (B组)的富集能力达到最强 (3.78),在第360小时高浓度DZP (D组) 的富集能力达到最强 (0.87),可能由于DZP具有镇静作用,高浓度DZP抑制了植物细胞的生理活性;禾本科皇竹草 (Pennisetum sinese) 对100 μg·L−1氟苯尼考和阿莫西林胁迫14 d的去除率达到53.5%~56.2%[42];本研究在1.0 μg·L−1 DZP胁迫下,第15天时的去除率达到33.4%,去除效果显著优于皇竹草;郭金鹏等[43]研究发现禾本科茭白 (Zizania latifolia) 对多环芳烃具有累积富集作用,但是单纯靠植物吸收和蒸腾作用的去除贡献率很小。蜈蚣草对DZP的富集能力有限,在第768 小时蜈蚣草对低浓度DZP (B组) 的富集能力低于给药24 h,对高浓度DZP (D组) 的富集能力下降至与给药72 h相近,可能因为蜈蚣草达到对DZP忍耐和超量累积的限值后发生了降解等过程。结合本研究结果,以净化养殖水体和底泥为目的,从富集能力角度看,当养殖水体中DZP质量浓度低于1.0 μg·L−1时可以考虑使用蜈蚣草对水体进行净化。
表 6 蜈蚣草对不同浓度地西泮的富集系数Table 6 Bioconcentration factors of diazepan at different concentrations in P. vittata组别
Group给药时间 Time of administration/h 0 24 48 72 96 216 264 360 600 768 B组 Group B 0.79 3.07 3.23 3.41 3.57 3.78 2.67 2.86 1.67 1.54 D组 Group D 0.21 0.55 0.60 0.63 0.70 0.81 0.83 0.87 0.63 0.63 4. 结论
在模拟养殖环境 (底泥、底泥/蜈蚣草) 中加入DZP后,水中DZP浓度逐渐降低,底泥中逐渐增加,蜈蚣草中随时间先增加后减小。DZP在模拟养殖环境中发生降解,在水体中的降解符合二级反应动力学模型,降解半衰期为65.29~139.11 d。蜈蚣草和底泥对DZP的累积达到2.83~3.63倍和4.77~17.99倍,蜈蚣草对水体中低浓度DZP富集能力强,并且可以缩短高浓度DZP的水解半衰期;给药第32 天时,低浓度和高浓度DZP在水体中可分别降解40.17%和38.44%。如果以净化养殖水体和底泥为目的,可在DZP质量浓度小于1.0 μg·L−1的环境水体中添加一定量的蜈蚣草以实现对养殖环境中DZP的降解,但DZP在养殖环境中的降解代谢产物及迁移转化规律仍有待进一步研究。
-
表 1 流动相梯度洗脱程序
Table 1 Mobile phase gradient elution procedure
时间 t/min A/% B/% 0 95.00 5.00 1.00 95.00 5.00 2.50 5.00 95.00 3.90 5.00 95.00 3.91 95.00 5.00 5.00 95.00 5.00 表 2 地西泮及内标物的质谱参数
Table 2 Mass spectrum parameters of diazepam and internal standard
化合物
Compound定性离子对
Qualitative
ion pair/
(m·z−1)定量离子对
Quantitative
ion pair/
(m·z−1)碰撞能量
Collision
energy/
(eV)地西泮
Diazepam285.2>193.1 285.2>193.1 35 285.2>154.1 37 地西泮-D5
Diazepam-D5290.2>154.1 290.2>154.1 37 表 3 不同基质中地西泮加标回收率和相对标准偏差
Table 3 Adding standard recovery and relative standard deviation of diazepam in different substrates
基质
Substrate加标水平
Spiked level实测结果
Measurement result回收率
Recovery rate/%相对标准偏差
RSDs/%水体 Water 0.100 μg·L−1 0.092 μg·L−1 92.0 3.831 0.600 μg·L−1 0.527 μg·L−1 87.8 3.542 1.000 μg·L−1 0.954 μg·L−1 95.4 1.555 底泥 Sediment 0.500 μg·kg−1 0.484 μg·kg−1 96.8 1.614 2.000 μg·kg−1 1.909 μg·kg−1 95.5 1.059 4.000 μg·kg−1 4.335 μg·kg−1 108.4 2.967 蜈蚣草 P. vittata 0.100 μg·kg−1 0.092 μg·kg−1 92.0 3.262 0.500 μg·kg−1 0.431 μg·kg−1 86.2 4.028 0.900 μg·kg−1 0.894 μg·kg−1 99.3 1.468 表 4 水体中地西泮降解动力学拟和参数
Table 4 Fitting parameters of degradation kinetics of diazepam in water
理论浓度
Theoretical concentration/
(μg·L−1)模拟养殖环境
Simulated culture
environment方程式
EquationR2 C0/
(μg·L−1)k T1/2/d 反应级数
Order of reaction0.1 μg·L−1 底泥
Sedimenty=0.001 0x+0.014 7 0.918 8 0.118 — — 零级 y=−0.011 3x−0.127 8 0.926 3 — — 一级 y=0.129 0x+1.085 8 0.932 0 0.129 0 65.69 二级 底泥-蜈蚣草
Sediment-P. vittatay=0.009 0x+0.020 9 0.950 4 0.117 — — 零级 y=−0.010 8x−0.191 5 0.959 3 — — 一级 y=0.130 9x+1.729 9 0.965 5 0.130 9 65.29 二级 1.0 μg·L−1 底泥
Sedimenty=0.004 7x+0.213 7 0.835 3 1.141 — — 零级 y=−0.0054x−0.2069 0.842 9 — — 一级 y=0.006 3x+0.200 8 0.850 3 0.006 3 139.11 二级 底泥-蜈蚣草
Sediment-P. vittatay=0.006 9x+0.231 9 0.922 5 1.142 — — 零级 y=−0.008 5x−0.224 2 0.933 7 — — 一级 y=0.010 5x+0.216 2 0.942 2 0.010 5 83.40 二级 表 5 底泥对不同浓度地西泮的富集系数
Table 5 Bioconcentration factors of diazepan at different concentrations in sediment
组别
Group给药时间 Time of administration/h 0 24 48 72 96 216 264 360 600 768 A组 Group A 0.65 4.46 4.73 4.93 5.38 5.87 6.92 13.26 14.54 18.80 B组 Group B 0.53 2.95 4.85 4.99 5.15 5.34 5.95 8.66 9.28 13.19 C组 Group C 1.44 5.93 6.02 6.17 6.32 6.46 7.25 7.56 9.56 9.79 D组 Group D 1.28 5.95 6.22 6.30 6.48 6.81 7.28 7.99 8.12 11.05 表 6 蜈蚣草对不同浓度地西泮的富集系数
Table 6 Bioconcentration factors of diazepan at different concentrations in P. vittata
组别
Group给药时间 Time of administration/h 0 24 48 72 96 216 264 360 600 768 B组 Group B 0.79 3.07 3.23 3.41 3.57 3.78 2.67 2.86 1.67 1.54 D组 Group D 0.21 0.55 0.60 0.63 0.70 0.81 0.83 0.87 0.63 0.63 -
[1] WANG L L, WANG R L, ZHENG Q, et al. Simulating dynamic interaction between diazepam and ethanol targeting the GABAA receptor via in silico model[J]. Neurotoxicology, 2023, 95(1): 136-143.
[2] BRODIN T, FICK J, JONSSON M, et al. Dilute concentrations of a psychiatric drug alter behavior of fish from natural populations[J]. Science, 2013, 339(6121): 814-815. doi: 10.1126/science.1226850
[3] BROOKS B W, CHAMBLISS C K, STANLEY J K, et al. Determinations of select antidepressant in fish from an effuent-dominated stream[J]. Environ Toxicol Chem, 2005, 24: 464-469. doi: 10.1897/04-081R.1
[4] JAMES S, JENNIFER J D, CUNNINGHAM C S, et al. Zebrafish behavior in novel environments effects of acute exposure to anxiolytic compounds and choice of Danio rerio line[J]. Int J Comp Psychol, 2010, 23(1): 43-61.
[5] LAURA M, ROBERTO M, CARMELINA I, et al. Simultaneous analysis of diazepam and its metabolites in rat plasma and brain tissue by HPLC-UV and SPE[J]. Talanta, 2009, 80(1): 279-285. doi: 10.1016/j.talanta.2009.06.074
[6] 吴敏. 地西泮药物污染对斑马鱼神经行为毒性及机制研究[D]. 镇江: 江苏大学, 2021: 2-4. [7] 易小翠, 易伟, 雷霖, 等. 液质联用同时测定大鼠尿液中6种苯二氮卓类药物[J]. 应用化学, 2022, 39(2): 340-348. [8] 何连军, 王鼎南, 张宜明, 等. 通过型固相萃取-高效液相色谱-串联质谱法同时测定水产品中的5种硝基咪唑和地西泮[J]. 核农学报, 2021, 35(8): 1865-1874. [9] 张璇, 杨光昕, 孔聪, 等. 高效液相色谱-串联质谱法测定水产品中镇静剂及其代谢物残留[J]. 分析化学, 2021, 49(3): 460-469. [10] 原帅, 于治国, 王海峰, 等. 城市生活污水中阿片类、苯丙胺类以及苯二氮卓类滥用物质的高分辨质谱筛选及确证[J]. 质谱学报, 2021, 42(6): 1080-1090. [11] 张彪, 敖沛尧, 靳浩然, 等. SPE−UPLC测定血液中苯二氮卓类药物[J]. 锦州医科大学学报, 2019, 40(5): 15-17, 116-117. [12] 徐越, 吴永富, 邹波, 等. 自动固相萃取-气相色谱-串联质谱法分析血液中的2'-氯地西泮[J]. 刑事技术, 2021, 46(3): 269-272. [13] 刘燕, 李蒙, 高静, 等. HPLC法测定地西泮直肠凝胶剂的药物含量及有关物质[J]. 国际药学研究杂志, 2020, 47(4): 312-317, 322. [14] 徐佳雯, 李尚, 张彦卓, 等. HPLC法同时测定地西泮直肠凝胶中地西泮、苯甲酸、苯甲醇含量[J]. 药学与临床研究, 2020, 28(2): 97-100. [15] 桑丽雅, 陈笑笑, 王扬, 等. 基于免疫磁珠的胶体金免疫层析法快速检测水产品中地西泮残留[J]. 食品工业科技, 2020, 41(20): 255-260, 284. [16] 沈可伊, 邹晓霜, 王军. 高效液相色谱−串联质谱测定虾肉中四种兽药残留及其热稳定性分析[J]. 食品与发酵工业, 2022, 48(22): 263-268. [17] AITOR S S, ALBERT E T F, ARMENTA S, et al. Molecularly imprinted polymerstir bar sorptive extraction of diazepam from natural water[J]. Microchem J, 2023, 186: 108354. doi: 10.1016/j.microc.2022.108354
[18] 中华人民共和国农业农村部. 农业农村部关于监督抽查发现的27批次问题农产品情况的通告(2022年3号)[EB/OL]. [2022-07-13]. http://www.moa.gov.cn/xw/bmdt/202207/t20220713_6404619.Htm. [19] LAGESSON A, BRODIN T, FAHLMAN J, et al. No evidence of increased growth or mortality in fish exposed to oxazepam in semi-natural ecosystems[J]. Sci Total Environ, 2018, 615: 608-614. doi: 10.1016/j.scitotenv.2017.09.070
[20] KE C L, LIU Q, LI L, et al. Residual levels and risk assessment of eugenol and its isomers in fish from China markets[J]. Aquaculture, 2018, 484: 338-342. doi: 10.1016/j.aquaculture.2017.07.034
[21] 徐鹏, 张紫英, 李文红, 等. 绿狐尾藻和空心菜对模拟池塘养殖尾水的净化效果分析[J]. 南方农业学报, 2022, 53(10): 2812-2820. [22] 黄晓丽, 白淑艳, 黄丽, 等. 空心菜浮床栽培对寒冷地区养殖水体的净化效果[J]. 贵州农业科学, 2021, 49(1): 83-87. [23] 黄晓丽, 黄丽, 高磊, 等. 空心菜对水中3种除草剂的去除作用[J]. 生态毒理学报, 2020, 15(6): 334-343. [24] 刘抗旱, 郑刘根, 张理群, 等. 复合型植物源活化剂强化蜈蚣草修复砷污染土壤的效应研究[J]. 生态环境学报, 2023, 32(3): 635-642. [25] MA L Q, KOMAR K M, TU C, et al. A fern that hyperaccumulates arsenic[J]. Nature, 2001, 409(6820): 579. doi: 10.1038/35054664
[26] OGGIER D M, WEISBROD C J, STOLLER A M, et al. Effects of diazepam on gene expression and link to physiological effects in different life stages in zebrafish Danio rerio[J]. Environ Sci Technol, 2010, 44(19): 7685-7691. doi: 10.1021/es100980r
[27] 孙翔. 六种水生植物对水体重金属的净化能力研究[D]. 淮南: 安徽理工大学, 2020: 6-8. [28] 孙世东, 赵文红, 任顺成. 直链淀粉-番茄红素复合物的光稳定性及降解动力学研究[J]. 河南工业大学学报(自然科学版), 2023, 44(4): 26-34. [29] 宋延斌, 王喜宽, 夏炎, 等. 河南洛阳市土壤和农作物中硒分布及富集特征[J]. 岩矿测试, 2022, 41(4): 652-662. [30] 丁洋. 青藏高原东缘土壤中典型持久性有机污染物的来源与迁移转化机制[D]. 武汉: 中国地质大学, 2021: 4. [31] 方龙香, 宋超, 范立民, 等. 基于正交实验设计的磺胺甲恶唑在渔业水体中的消解动态规律[J]. 中国农学通报, 2019, 35(27): 146-152. [32] CHARLES E W, STEVEN J R. Aqueous photo transformation of diazepam and related human metabolites under simulated sunlight[J]. Environ Sci Technol, 2012, 46(9): 4749-4756. doi: 10.1021/es203529z
[33] LIU Q Z, WANG L, XU X, et al. Antiepileptic drugs in aquatic environments: occurrence, toxicity, transformation mechanisms and fate. [J] Crit Rev Env Sci Tec, 2023, 407: 1-25.
[34] ROSSI I B, ADRIANA C V, PUPO R F N. Zero valent iron mediated degradation of the pharmaceutical diazepam[J]. Chemosphere, 2012, 88(6): 688-692. doi: 10.1016/j.chemosphere.2012.03.077
[35] 张超莹, 郑西来, 陈蕾, 等. 水库沉积物中铁、锰季节性释放的实验研究[J]. 水资源保护, 2013, 29(3): 79-82, 86. [36] 孙楠, 蔡振兴, 祁博伟, 等. 稻蟹共作模式下生物对多环芳烃的富集机制[J]. 东北农业大学学报, 2022, 53(9): 80-89. [37] 张淑琴. 月季根系分泌物促进根际土壤有机氯农药降解研究[J]. 环境科学与技术, 2022, 45(1): 145-153. [38] 郭思宇. 蜈蚣草、龙葵与玉米不同间作距离对镉砷复合污染农田土壤修复的影响[D]. 昆明: 昆明理工大学, 2021: 25-63. [39] 陈同斌, 韦朝阳, 黄泽春, 等. 砷超富集植物蜈蚣草及其对砷的富集特征[J]. 科学通报, 2002(3): 207-210. [40] 刘吉. 锑胁迫下蜈蚣草根系分泌物对其吸收累积锑的影响研究[D]. 贵阳: 贵州大学, 2021: 12-48. [41] 马生健, 宗久明, 曾富华, 等. 高羊茅、假俭草对除草剂与真菌病抗性研究[J]. 湛江师范学院学报, 2006(3): 78-82. [42] 周品成, 刘希强, 康兴生, 等. 4种水生植物对兽用抗生素去除效果比较[J]. 华南农业大学学报, 2019, 40(6): 67-73. [43] 郭金鹏, 卢少勇, 杨海燕, 等. 不同湿地植物多环芳烃含量及其对湿地多环芳烃去除量的贡献研究[J]. 环境工程, 2023, 41(S1): 503-508. -
期刊类型引用(3)
1. 杨光昕,张骏宇,夏薇,汪珑珑,沈晓盛,樊成奇,田晓清,孔聪. 垂钓饵料中地西泮在鲫鱼体内代谢及组织分布研究. 食品安全质量检测学报. 2025(01): 119-126 .  百度学术
百度学术
2. 王威利,林雪贤,刘振妮,林奕云,崔泽锋,丁晨红,万凯. 液相色谱-串联质谱法同时测定饲料中6种镇静剂的含量. 分析测试学报. 2025(04): 652-659 .  百度学术
百度学术
3. 徐小栋,杨臻,李英,贾芳慧,乔璐,胡鑫,徐锦华,孙慧武,穆迎春. 水体地西泮暴露对草鱼肌肉中地西泮及其代谢物残留的影响及膳食摄入风险评估. 中国渔业质量与标准. 2024(06): 38-48 .  百度学术
百度学术
其他类型引用(0)



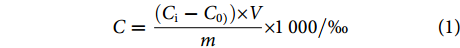
 下载:
下载:
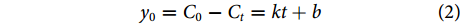
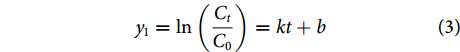
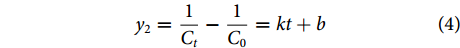
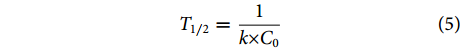
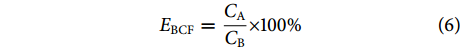
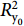
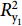
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
