Effects of egg product on growth performance, muscle nutrients, and intestinal microflora of Procambarus clarkii
-
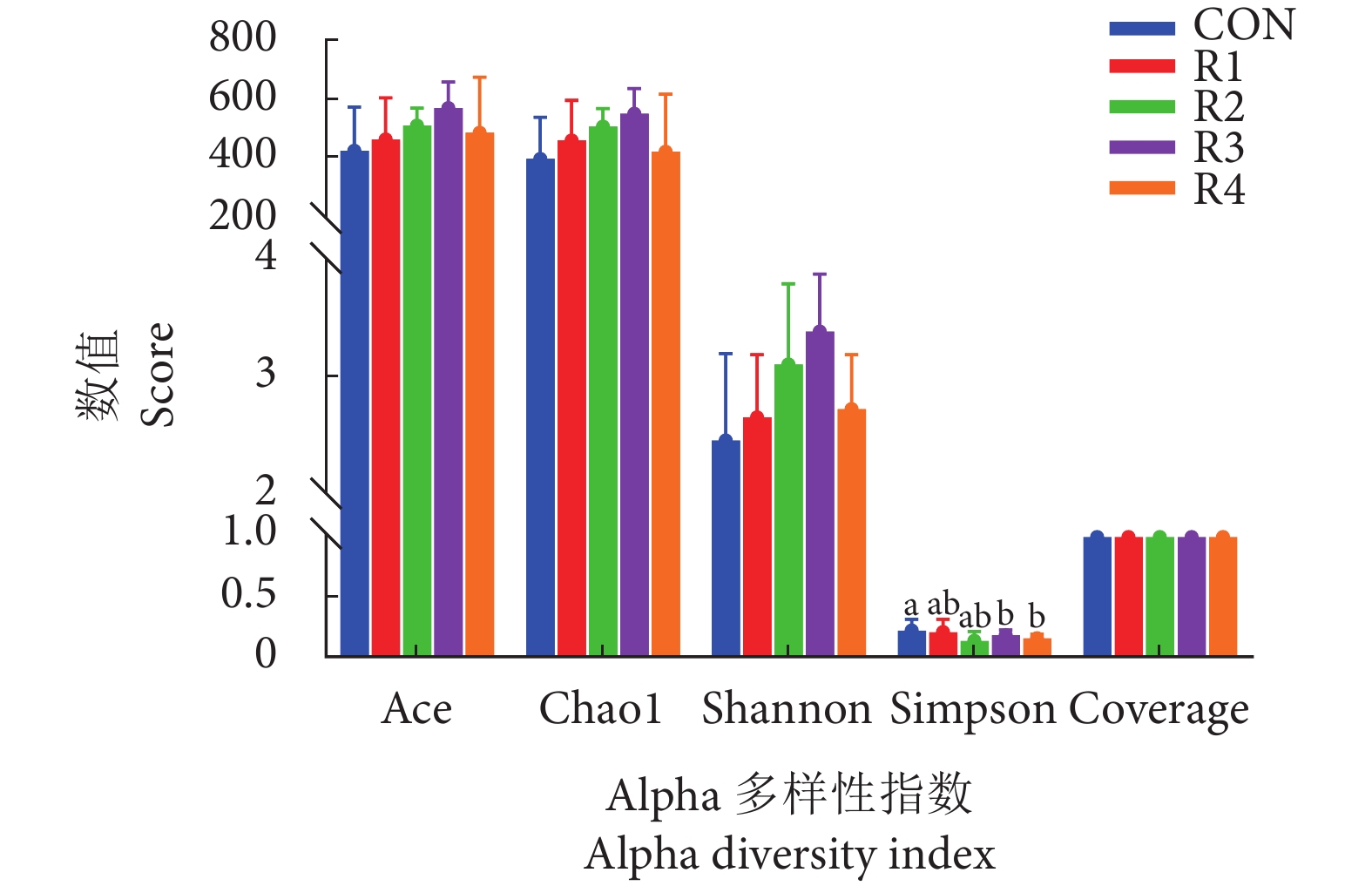
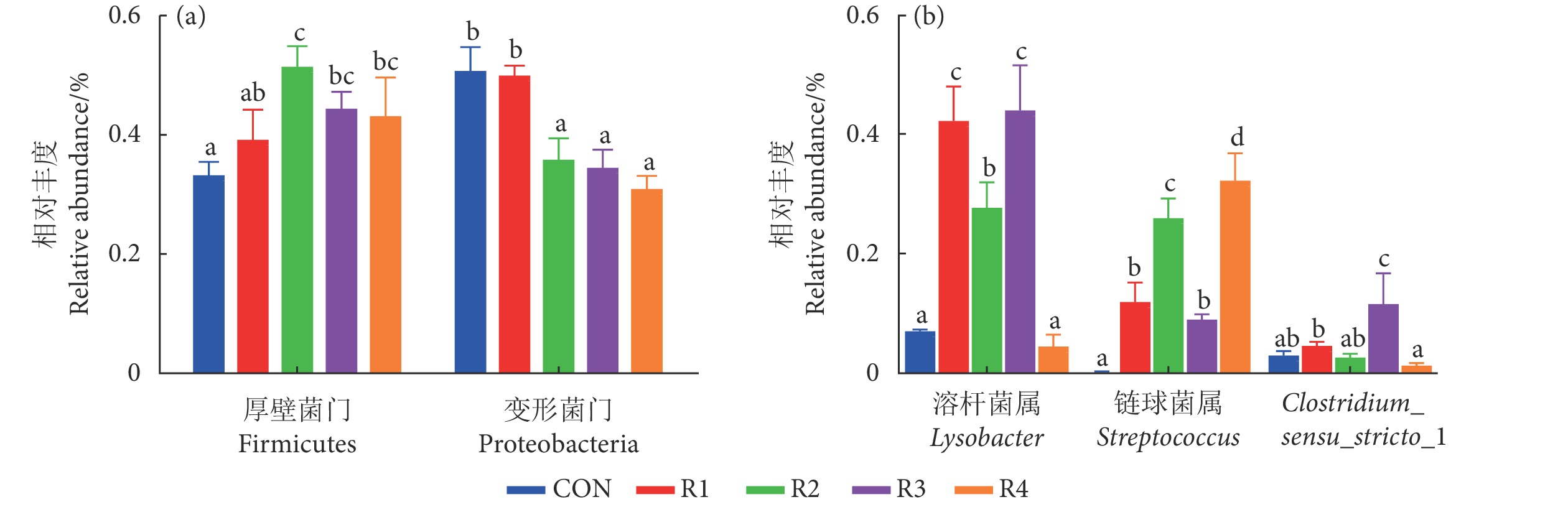
摘要: 为评估蛋粉在克氏原螯虾 (Procambarus clarkii) 饲料中的应用效果,使用喷雾干燥蛋粉等蛋白替代0% (CON)、25% (R1)、50% (R2)、75% (R3) 和100% (R4) 鱼粉,饲喂幼虾 [初始平均体质量 (9.02±0.12) g] 6周。结果显示,各组间特定生长率、饲料系数、摄食率、成活率和肝体比均无显著性差异 (P>0.05),R4组体质量增长率较CON组显著降低 (P<0.05)。R4组肌肉粗蛋白、必需氨基酸和总氨基酸含量显著升高 (P<0.05),R2、R3和R4组肌肉粗脂肪和灰分含量显著升高 (P<0.05),各组肌肉中水解氨基酸含量无显著性差异 (P>0.05)。蛋粉添加组肠道蛋白酶活性显著升高,淀粉酶活性显著降低,R3和R4组肠道脂肪酶活性显著升高 (P<0.05)。R2、R3和R4组血清碱性磷酸酶活性以及总蛋白含量显著升高 (P<0.05)。R3组肠道梭状芽孢杆菌属 (Clostridium) 和溶杆菌属 (Lysobacter) 细菌丰度显著升高,R4组链球菌属 (Streptococcus) 丰度显著升高 (P<0.05)。综上,当克氏原螯虾饲料含6%鱼粉时,蛋粉可替代75%鱼粉。Abstract: To evaluate the application effect of spray-dried egg product in the diet of Procambarus clarkii, we formulated five isonitrogenous and isoenergetic diets containing 0% (Control group), 2.0%, 4.0%, 6.0% and 8.0% spray-dried egg product, which replaced 0% (CON), 25% (R1), 50% (R2), 75% (R3) and 100% (R4) fishmeal, respectively, to feed the shrimps [Initial body mass (9.02±0.12) g] for six weeks. The results show that there were no significant differences in the specific growth rate, feed conversion ratio, feeding rate, survival rate and hepatosomatic index among all the groups (P>0.05). The weight gain rate in R4 group decreased significantly compared with the CON group (P<0.05). The contents of crude protein, essential amino acid and total amino acid in abdominal muscle in R4 group increased significantly compared with the CON group (P<0.05). The contents of crude fat and ash in muscle in R2, R3 and R4 groups were significantly higher than those in the CON group (P<0.05). There were no significant differences in the contents of 17 hydrolyzed amino acids in muscle among all the groups (P>0.05). Compared with the CON group, the intestinal protease activities increased significantly but the amylase activities decreased significantly in egg product supplementation groups, and the intestinal lipase activity increased significantly in R3 and R4 groups (P<0.05). The serum alkaline phosphatase activity and total protein content in R2, R3 and R4 groups increased significantly than those in the CON group (P<0.05). The bacterial abundances of Clostridium sensu stricto and Lysobacter in R3 group were significantly higher than those of the other groups, while the bacterial abundance of Streptococcus in R4 group was significantly higher than that of the other groups (P<0.05). In conclusion, when the diet of P. clarkii contains 6% fishmeal, the spray-dried egg product can replace 75% fishmeal.
-
Keywords:
- Procambarus clarkii /
- Spray-dried egg product /
- Intestinal microbiome /
- Immunity /
- Growth
-
舌状蜈蚣藻(Grateloupia livida)隶属于红藻门、隐丝藻目、海膜科、蜈蚣藻属,是暖温带性海藻。主要生长在高潮带附近的岩礁、低潮带的石沼及海水养殖时的筏架和绠绳上。主要分布于东亚、东南亚及印度洋国家,在中国北方及南方都有分布[1]。舌状蜈蚣藻具有重要的药用、食用及生态学价值,在中国一直被作为中药材之一。舌状蜈蚣藻中含有糖类、脂类、多萜类、舌状蜈蚣藻氨酸、蜈蚣藻氨酸、牛磺酸、维生素及微量元素等多种化学成分,在抗病毒、抗炎、抗癌、抗凝血等多方面都具有重要作用[2-7]。舌状蜈蚣藻既是喂养鲍鱼的替用饵料,也是提取卡拉胶的原料[8-9]。研究表明,同一属的蜈蚣藻(G.filicina)可以明显吸收海水中的氮(N)、磷(P)[10],而舌状蜈蚣藻的藻体和生物量较大,广泛分布于中国等国家的沿海地区,其资源值得进一步开发利用。舌状蜈蚣藻的生活史属于同形世代交替,果孢子的发育属于有性生殖的重要部分。且由于果孢子囊相比于四分孢子囊在形态上更容易观察,可以通过采集果孢子进行苗种培养。目前中国尚未见舌状蜈蚣藻苗种的早期发育研究报道,笔者通过研究温度与光照强度等培养条件对舌状蜈蚣藻早期发育的影响,确定其盘状体发育的适合条件,以为舌状蜈蚣藻的繁育生物学和人工育苗技术研究提供科学依据。
1. 材料与方法
1.1 材料来源
舌状蜈蚣藻采自广东省汕头市南澳岛深澳湾养殖筏架的绠绳上,采取表面具有明显囊果的成熟藻体作为试验材料。采回后用软毛刷轻轻刷去表面的污渍及杂藻,用消毒海水冲刷数次后暂养于消毒海水中。
1.2 果孢子采苗与培养
舌状蜈蚣藻成熟藻体暂养3~5 d后进行果孢子采苗,采苗前需先对载玻片、玻璃染色缸进行灭菌,对采苗所用的器械进行消毒。试验中佩戴一次性手套进行操作。采苗前再次洗刷舌状蜈蚣藻藻体表面,阴干2~3 h,然后加入灭菌海水,每隔10 min在显微镜的10×10视野下计数一次,待每个视野中果孢子数量在10个以上后进行载玻片采苗。将孢子水倒入灭菌好的载玻片上,再将其置于培养箱与20 ℃、5 000 lx下进行果孢子附着,附着4~6 h后进行镜检观察,用水轻轻冲刷载玻片表面,确认为有效附着后将载玻片置于玻璃染色缸中培养,培养条件为温度18 ℃,光照强度2 500 lx,光周期为光(H) : 暗(D)=12 : 12。
1.3 试验设计及方法
温度和光照强度试验和培养条件的设置:1)温度组试验为光照强度2 500 lx,光周期H : D=12 : 12,温度梯度设置为15 ℃、20 ℃、25 ℃和30 ℃。2)光照组试验为温度20 ℃,光周期H : D=12 : 12,光照强度梯度设置为500 lx、2 500 lx、5 000 lx和10 000 lx。光照强度的测量使用照度计TES-1330A(台湾泰仕TES公司出品)。将采好果孢子的载玻片置于设置好条件的培养箱中进行培养,每天对载玻片进行观察,每隔1周对果孢子的发育情况进行拍照记录一次,并测量果孢子发育成盘状体后的直径。每个实验组设置3个平行,测量时每个平行组随机取10个盘状体进行直径的测量。
盘状体的相对生长速率(RGR)计算公式为:$ \operatorname{RGR}(\%)=\left[\left(\ln N_t-\ln N_0\right) / t\right] \times 100$
式中N0为盘状体初始直径,t为培养天数,Nt为培养t天后盘状体直径。
1.4 数据处理与分析
使用统计分析软件SPSS 19.0处理各组之间盘状体直径的平均数及标准差,并采用单因素方差分析及Tukey多重检验进行差异显著性分析,以分析在不同的温度及光照条件下盘状体直径的变化情况。
2. 结果
2.1 温度对早期发育的影响
通过对附着后的果孢子进行观察,发现不同的温度条件下果孢子发育的速度也不相同。舌状蜈蚣藻早期发育过程主要经过分裂期、盘状体和直立枝3个阶段。在高温条件下易较早形成盘状体和直立枝,随着温度的降低直立枝形成的天数逐渐延长(表 1)。在25~30 ℃培养条件下果孢子经过3~4 d即可形成盘状体,而盘状体在25 ℃下最先发出直立枝,在第23天时即可看到直立枝的出现。在试验的4个温度梯度下,舌状蜈蚣藻的盘状体均可以发出直立枝,在低温及高温下盘状体长出直立枝的天数均有所延长。
表 1 不同温度条件下盘状体形成及长出直立枝的天数Table 1 Early development of seedings cultured from carpospores at different temperatures温度/℃ temperature 15 20 25 30 盘状体形成的天数/d days of discoid crust formation 4~7 4~6 3~4 3~4 盘状体长出直立枝的天数/d days of seedings curtured from discoid crusts 32 27 23 36 舌状蜈蚣藻果孢子在不同温度条件下培养5周的盘状体直径变化及差异性分析结果见图 1。25 ℃培养条件下盘状体直径增长最快。第4周时盘状体直径达(353.22±23.19)μm,20 ℃时发育也较快,第4周时盘状体直径达(307.85±45.31)μm,第5周时20 ℃下的盘状体直径与25 ℃下所测到的直径已无明显差异。25 ℃培养条件下第4周直径达到350 μm时舌状蜈蚣藻盘状体的直径增长速度开始放缓,这一现象也出现在其他温度培养条件下。适合舌状蜈蚣藻盘状体发育的温度为25 ℃,在低温下盘状体直径的增长速度显著降低,高温也可抑制舌状蜈蚣藻盘状体的生长。
由于第4周至第5周时在25 ℃条件下盘状体直径生长放缓,取前4周的盘状体直径计算盘状体的相对生长速率(图 2-a)。25 ℃时舌状蜈蚣藻盘状体的相对生长速率达到最大(2.47%),其次为20 ℃条件下的2.34%,15 ℃条件下的1.97%,30 ℃条件下的1.65%。25~30 ℃时盘状体的相对生长速率呈现明显下降。
2.2 光照对早期发育的影响
舌状蜈蚣藻果孢子发育形成盘状体的速度受到光照强度的影响(表 2)。随着光照强度的增加,果孢子的发育速率也相应加快。5 000~10 000 lx培养条件下果孢子在3~4 d即可发育成盘状体,而在低光照的500 lx条件下6~10 d盘状体才可以形成。10 000 lx培养条件下盘状体在第21天即可长出直立枝。5 000 lx的培养条件下24 d后盘状体可以长出直立枝,500 lx条件下盘状体发育的异常缓慢,80 d后才见到盘状体的生成。
表 2 不同光照强度条件下盘状体长出直立枝的天数Table 2 Days of seedings cultured from discoid crusts at different light intensities光照强度/lx light intensity 500 2 500 5 000 10 000 盘状体形成的天数/d days of discoid crust formation 6~10 4~6 3~4 3~4 盘状体发育出直立枝的天数/d days of seedings curtured from discoid crusts 80 27 24 21 不同光照条件下舌状蜈蚣藻盘状体的直径变化情况见图 3。盘状体在低光照500 lx下发育缓慢,5周后盘状体直径平均仅仅增长了23.14 μm,而其他3个光照条件都有>250 μm的增长,最大增长值在5 000 lx条件下,盘状体直径5周后平均增长了322 μm。前3周时经观察在10 000 lx条件下盘状体发育最快并长出直立枝,此时的盘状体直径为(296.13±49.48)μm,其次是5 000 lx,盘状体直径为(261.67±24.13)μm,而2 500 lx培养条件下盘状体直径为(237.74±25.01)μm,Tukey分析比较3组之间存在显著性差异(F=20.828,P < 0.01)。5周后观察测量5 000 lx条件下的盘状体直径为最大值,其次为10 000 lx,但这两者之间没有显著性差异,其次是2 500 lx条件下,5周后盘状体直径为(332±63.32)μm,而生长最为缓慢的是在500 lx培养下的盘状体,此时其直径只有(83±10.63)μm。
舌状蜈蚣藻盘状体在不同光照强度条件下的相对生长速率见图 2-b。舌状蜈蚣藻盘状体直径在5 000 lx条件下相对生长速率最大(2.53%),其次为10 000 lx条件下(2.43%),2 500 lx条件下相对生长速率为2.39%,500 lx条件下相对生长速率最低(0.56%)。在低光照下盘状体的相对生长速率明显放缓,虽然在高光强下盘状体的生长速率有所提高,但升高幅度并不大,只是缓慢上升。虽然盘状体的生长速率在低光强下受到显著抑制,但并不随着光照强度的提高直线上升,其相对生长速率在500~2 500 lx呈直线式升高,之后则平缓地提升。
3. 讨论
研究结果表明,温度和光照强度对舌状蜈蚣藻的早期生长发育有显著影响,在由分裂期向盘状体时期发育的过程中,高温、高光强的培养条件较低温、低光强条件下发育的更快;在早期发育中同时显示出果孢子对温度及光照强度有较宽广的耐受性,在2 500~10 000 lx及15~30 ℃下果孢子都可以长成盘状体进而萌发出直立枝,最适宜果孢子发育盘状体及萌发出直立枝的条件为温度25 ℃、光照强度5 000 lx。舌状蜈蚣藻在自然生境中发生、生长和消退规律与笔者的试验结果有较好的相符性。汕头南澳岛海区舌状蜈蚣藻在每年12月份开始出现,至第二年3~4月份形成很大的个体和生物量,在5~6月份藻体成熟并放散出果孢子或者四分孢子后逐渐腐烂消失。舌状蜈蚣藻适合果孢子发育为盘状体的条件为温度25 ℃、光照强度5 000 lx。海区舌状蜈蚣藻成熟繁殖的时间为每年5月~6月,符合这一条件的要求。盘状体在30 ℃时生长受到抑制,缓慢生长,温度下降到25 ℃以下盘状体长出直立枝的时间缩短,随着水温的下降,直立枝的生长加快。南澳岛夏季水温为30 ℃以上的时间长达40多天,舌状蜈蚣藻的盘状体发育受到明显的抑制,到12月份海区水温下降至20 ℃以下才能肉眼见到舌状蜈蚣藻的幼苗,这一现象与笔者的试验结果相一致。马凌波等[11]的研究也证实蜈蚣藻和带形蜈蚣藻(G.turuturu)的盘状体生长的适宜温度在20 ℃之上,15 ℃时生长变缓慢。
试验中发现舌状蜈蚣藻盘状体的直径并不能一直增大,在盘状体平均直径达到350 μm时生长开始变缓慢,此后虽也有生长但增长明显减缓。这可能是在室内培养下盘状体直径的生长极限,也可能与直立枝的生长有关。试验观察到舌状蜈蚣藻的直立枝一般在盘状体的直径为250~300 μm时长出,以后营养物质可能转向供应直立枝的生长,导致盘状体的生长减缓。研究报道显示,不同的藻类萌发出直立枝时盘状体的直径大小也不同,带形蜈蚣藻(G.turuturu)与舌状蜈蚣藻类似,直立枝都是在盘状体在200~300 μm左右时长出[12],角叉菜(Chondrus ocellatus)在200~320 μm时可以长出直立枝[13],金膜藻(Chrysymenia wrightii)盘状体发出直立枝也需在200 μm以上[14],隅江蓠(Gracilaria cornea)的直立枝在盘状体300 μm左右时长出[15],石斑藻属(Petrocelis)的直立枝在盘状体发育至200 μm后开始发育[16]。由此可推测,虽然各个物种在发出直立枝时盘状体的直径不同,但考虑到环境因素对直立枝生成的影响,200~300 μm可能是大部分红藻物种由盘状体发育转至直立枝发育时的直径。
在舌状蜈蚣藻早期发育中可以经常观察到盘状体愈合(coalescence)现象。盘状体愈合现象不仅出现在蜈蚣藻属中,在江蓠属(Gracilaria)和角叉菜属(Chondrus)的果孢子与四分孢子早期发育中也可观察到[13, 17-21]。因此盘状体愈合现象不能做为鉴别种类的标准。值得注意的是,有研究指出不同种类的海藻之间也可以发生盘状体愈合现象[19]。由于海区中舌状蜈蚣藻的四分孢子体及果孢子体是同时存在的,而且蜈蚣藻或者带形蜈蚣藻的生活环境与舌状蜈蚣藻较为类似,在繁殖时两者有可能同时释放出大量的果孢子与四分孢子,如果发生相互愈合现象,有可能会形成具有共同基部的植株,这也可以解释在海区能够采集到有共同固着器的舌状蜈蚣藻和带形蜈蚣藻或者蜈蚣藻的个体。另一个盘状体愈合的问题是,愈合之后不同的盘状体是否还能够分别发育出直立枝。笔者在试验中也观察发现,舌状蜈蚣藻的盘状体相互愈合之后,不同个体的盘状体能够各自长出直立枝,出现多个直立枝,但是也有一些盘状体愈合之后只发育出一个直立枝,这可能与盘状体愈合的时期有关。至于两者之间在愈合后是否有遗传物质的交换则需要进一步研究。舌状蜈蚣藻等海藻盘状体的融愈合有可能是对海洋环境适应性的体现,当不同个体的盘状体愈合之后使其附着面积增大,更有利于其在具有强烈流动性的海水环境下生存[22]。
4. 结论
研究表明,温度及光照强度对舌状蜈蚣藻的早期发育均有影响。在由分裂期向盘状体时期发育的过程中,高温(25~30 ℃)、高光照强度(5 000~10 000 lx)可以促进分裂期的发育,低温(15 ℃)、低光照强度(500 lx)下分裂期向盘状体的发育则受到抑制。而在盘状体时期向直立枝时期发育的过程中最适条件为温度25 ℃及光照强度5 000 lx,低温(15 ℃)及高温(30 ℃)均显著抑制盘状体,低光照强度(500 lx)也显著抑制盘状体的发育,但是高光强下(10 000 lx)盘状体的发育并未受到抑制。
-
表 1 蛋粉和鱼粉的营养组成成分 (干物质基础)
Table 1 Nutritional components of egg product and fishmeal (Dry matter basis)
% 营养组成 Nutritional composition 蛋粉Egg product m (氨基酸)∶m (总蛋白)Amino acid : Total protein 鱼粉Fishmeal m (氨基酸)∶m (总蛋白)Amino acid : Total protein 干物质 Dry matter 95.32 91.46 粗蛋白质 Crude protein 50.23 67.04 粗脂肪 Crude lipid 34.98 7.54 灰分 Ash 4.88 15.37 无氮浸出物 Carbohydrates 6.34 0.46 可溶性寡肽① Soluble peptides 5.25 7.34 精氨酸 Arginine 3.01 5.99 3.76 5.61 组氨酸 Histidine 1.09 2.17 1.44 2.15 异亮氨酸 Isoleucine 2.43 4.84 2.50 3.73 亮氨酸 Leucine 4.34 8.64 4.39 6.55 赖氨酸 Lysine 3.37 6.71 4.75 7.09 蛋氨酸 Methionine 1.72 3.42 1.63 2.43 胱氨酸 Cystine 1.36 2.71 0.49 0.73 苯丙氨酸 Phenylalanine 2.59 5.16 2.55 3.80 苏氨酸 Threonine 2.26 4.50 2.39 3.57 色氨酸 Tryptophan 0.50 1.00 0.65 0.97 缬氨酸 Valine 3.21 6.39 2.94 4.39 酪氨酸 Tyrosine 1.84 3.66 1.97 2.94 总必需氨基酸 ΣEAA 24.52 48.82 27.00 40.27 注:①. 可溶性寡肽指可溶于水的易被吸收的小肽。 Note: ①. Soluble oligopeptides are small peptides which are soluble in water and can be directly absorbed. 表 2 实验饲料基础配方 (干物质基础)
Table 2 Ingredients of experimental diets (Dry matter basis)
% 原料 Ingredient 替代鱼粉水平 Substitution levels of fishmeal 0% (CON) 25% (R1) 50% (R2) 75% (R3) 100% (R4) 鱼粉 Fishmeal 6.00 4.50 3.00 1.50 0.00 蛋粉 Spray-dried egg product 0.00 2.00 4.00 6.00 8.00 小麦蛋白粉 Wheat gluten 8.00 8.00 8.00 8.00 8.00 豆粕 Soybean meal 20.00 20.00 20.00 20.00 20.00 菜粕 Rapeseed meal 6.00 6.00 6.00 6.00 6.00 棉粕 Cotton meal 11.00 11.00 11.00 11.00 11.00 面粉 Flour 25.00 25.00 25.00 25.00 25.00 鱼油 Fish oil 2.00 2.00 2.00 2.00 2.00 大豆油 Soybean oil 2.00 1.60 1.20 0.80 0.40 大豆磷脂油 Soybean phospholipid oil 1.00 0.90 0.80 0.70 0.60 胆固醇 Cholesterol 0.50 0.40 0.30 0.20 0.10 酵母膏 Yeast extract 2.00 2.00 2.00 2.00 2.00 磷酸二氢钙 Ca(H2PO4)2 2.30 2.30 2.30 2.30 2.30 维生素预混料① Vitamin premix 1.00 1.00 1.00 1.00 1.00 无机盐预混料① Mineral premix 1.00 1.00 1.00 1.00 1.00 褐藻酸钠 Sodium alginate 2.00 2.00 2.00 2.00 2.00 氯化胆碱 Choline chloride 0.20 0.20 0.20 0.20 0.20 虾青素 Astaxanthin 0.04 0.04 0.04 0.04 0.04 壳聚糖 Chitosan 0.10 0.10 0.10 0.10 0.10 赖氨酸 Lysine 0.40 0.40 0.40 0.40 0.40 苏氨酸 Threonine 0.38 0.38 0.38 0.38 0.38 微晶纤维素 Cellulose 6.78 6.88 6.98 7.08 7.18 膨润土 Amargosite 2.30 2.30 2.30 2.30 2.30 总计 Total 100 100 100 100 100 注:①. 维生素和矿物元素预混料的配制参照本研究室杨文秀等[12]。 Note: ①. The preparation of the vitamin and mineral element premix is referred to the previous report of this laboratory[12]. 表 3 实验饲料营养组成 (干物质基础)
Table 3 Nutritional composition of experimental diets (Dry matter basis)
% 营养组成 Nutritional composition 替代鱼粉水平 Substitution level of fishmeal 0% (CON) 25% (R1) 50% (R2) 75% (R3) 100% (R4) 干物质 Dry matter 88.74 90.10 89.83 89.97 89.70 粗蛋白质 Crude protein 35.27 35.34 35.22 34.94 35.27 粗脂肪 Crude fate 5.92 5.68 6.03 6.08 6.14 灰分 Ash 8.21 8.31 8.35 8.19 8.29 总能 Gross energy/(kJ·g−1) 19.87 19.56 19.65 19.77 19.78 必需氨基酸 EAA 精氨酸 Arginine 1.38 1.48 1.49 1.43 1.43 组氨酸 Histidine 0.55 0.54 0.56 0.53 0.54 异亮氨酸 Isoleucine 0.87 0.82 0.85 0.81 0.81 亮氨酸 Leucine 0.61 0.62 0.63 0.61 0.62 赖氨酸 Lysine 2.62 2.51 2.55 2.58 2.59 蛋氨酸 Methionine 0.26 0.29 0.29 0.26 0.25 苯丙氨酸 Phenylalanine 1.19 1.20 1.25 1.28 1.19 苏氨酸 Threonine 1.77 1.75 1.79 1.77 1.74 缬氨酸 Valine 1.36 1.38 1.49 1.46 1.48 非必需氨基酸 NEAA 丙氨酸 Alanine 1.02 0.98 0.99 0.94 0.93 天冬氨酸 Aspartic acid 3.27 3.34 3.36 3.33 3.32 胱氨酸 Cysteine 0.25 0.29 0.29 0.28 0.30 甘氨酸 Glycine 1.53 1.40 1.30 1.17 1.11 谷氨酸 Glutamate 7.67 7.50 7.52 7.49 7.49 脯氨酸 Proline 3.51 2.75 2.90 2.82 2.81 丝氨酸 Serine 1.85 1.88 1.97 1.98 1.96 酪氨酸 Tyrosine 1.62 1.59 1.63 1.54 1.64 总必需氨基酸 ΣEAA 10.61 10.61 10.89 10.73 10.44 总非必需氨基酸 ΣNEAA 20.70 19.72 19.96 19.55 19.57 总氨基酸 ΣTAA 31.31 30.33 30.85 30.28 30.21 表 4 饲料蛋粉替代鱼粉对克氏原螯虾生长性能的影响
Table 4 Effect of fishmeal replaced with spray-dried egg product on growth performance of P. clarkii
项目 Item 替代鱼粉水平 Substitution level of fishmeal 0% (CON) 25% (R1) 50% (R2) 75% (R3) 100% (R4) 初始体质量 IBW/g 9.31±0.22 9.34±0.20 9.34±0.43 9.12±0.20 9.25±0.37 终末体质量 FBW/g 23.70±0.56b 23.76±0.78b 23.40±0.99b 21.93±0.49ab 21.63±0.63a 体质量增长率 WGR/% 154.39±2.35b 154.26±6.24b 150.51±4.61b 137.35±8.59ab 137.13±8.57a 成活率 SR/% 77.78±5.56 77.79±5.55 83.33±5.56 85.18±3.20 79.63±3.20 饲料系数 FCR 1.35±0.05 1.37±0.08 1.39±0.04 1.31±0.04 1.35±0.04 摄食率 FR/% 3.36±0.14 3.39±0.26 3.46±0.16 3.23±0.29 3.30±0.04 肝体比 HSI/% 5.44±0.56 5.82±0.23 5.77±0.63 5.36±0.91 5.74±1.39 腹部含肉率 FC/% 11.78±1.76c 11.40±1.32bc 10.44±1.91abc 9.85±1.47ab 9.28±0.39a 注:同行数据中上标字母不同表示差异显著 (P<0.05),下同。 Note: The values with different superscript letters within the same line are significantly different (P<0.05). The same below. 表 5 饲料蛋粉替代鱼粉对克氏原螯虾腹部肌肉基本成分及水解氨基酸含量的影响
Table 5 Effect of fishmeal replaced with spray-dried egg product on abdominal muscle composition of P. clarkii
% 项目Item 替代鱼粉水平 Substitution level of fishmeal 0% (CON) 25% (R1) 50% (R2) 75% (R3) 100% (R4) 基本成分 Basic ingredient 水分 Moisture 77.67±0.82 77.38±1.44 78.21±2.55 76.97±0.81 76.14±0.62 粗蛋白质 Crude protein 18.60±0.15a 18.83±0.11a 18.71±0.12a 18.69±0.13a 19.06±0.21b 粗脂肪 Crude fat 0.20±0.006a 0.24±0.007ab 0.31±0.004c 0.40±0.006d 0.44±0.005d 灰分 Ash 1.21±0.07a 1.24±0.05ab 1.28±0.02bc 1.30±0.03c 1.32±0.06c 水解氨基酸 Hydrolyzed amino acid 必需氨基酸 EAA 精氨酸 Arginine 1.83±0.04 1.83±0.02 1.78±0.16 1.77±0.13 1.79±0.10 组氨酸 Histidine 0.38±0.04 0.38±0.02 0.35±0.05 0.33±0.05 0.38±0.05 异亮氨酸 Isoleucine 0.73±0.05 0.76±0.01 0.75±0.08 0.70±0.10 0.77±0.11 亮氨酸 Leucine 1.26±0.04 1.30±0.05 1.26±0.04 1.24±0.08 1.32±0.08 赖氨酸 Lysine 1.32±0.03 1.32±0.07 1.28±0.04 1.30±0.05 1.34±0.05 蛋氨酸 Methionine 0.28±0.02 0.29±0.02 0.30±0.03 0.32±0.03 0.32±0.03 苯丙氨酸 Phenylalanine 0.80±0.02 0.83±0.04 0.80±0.04 0.82±0.05 0.83±0.03 苏氨酸 Threonine 0.71±0.03 0.74±0.02 0.70±0.07 0.69±0.07 0.74±0.06 缬氨酸 Valine 0.77±0.04 0.79±0.03 0.77±0.05 0.75±0.06 0.79±0.06 非必需氨基酸 NEAA 丙氨酸 Alanine 0.86±0.02 0.90±0.04 0.86±0.06 0.85±0.05 0.91±0.04 天冬氨酸 Aspartic acid 1.43±0.04 1.44±0.06 1.39±0.06 1.40±0.10 1.46±0.08 半胱氨酸 Cysteine 0.10±0.006 0.11±0.002 0.11±0.008 0.11±0.003 0.10±0.004 谷氨酸 Glutamic acid 2.06±0.06 2.03±0.06 1.94±0.20 1.96±0.13 1.93±0.10 甘氨酸 Glycine 0.74±0.01 0.73±0.03 0.75±0.07 0.71±0.05 0.73±0.06 脯氨酸 Proline 0.60±0.04 0.55±0.03 0.55±0.06 0.52±0.03 0.56±0.03 丝氨酸 Serine 0.74±0.02 0.74±0.03 0.71±0.03 0.70±0.04 0.74±0.05 酪氨酸 Tyrosine 0.74±0.04 0.77±0.04 0.74±0.05 0.74±0.06 0.77±0.06 总必需氨基酸 ΣEAA 5.87±0.21a 6.03±0.23a 5.84±0.24a 5.87±0.28a 6.60±0.23b 总非必需氨基酸 ΣNEAA 9.48±0.24 9.48±0.29 9.54±0.62 9.57±0.67 9.48±0.53 总氨基酸 ΣTAA 15.35±0.44a 15.51±0.52a 15.38±0.56a 15.44±0.65a 16.08±0.46b 表 6 饲料蛋粉替代鱼粉对克氏原螯虾肠道消化酶活性的影响
Table 6 Effect of fishmeal replaced with spray-dried egg product on intestine digestive enzymes activities of P. clarkii
项目 Item 替代鱼粉水平 Substitution level of fishmeal 0% (CON) 25% (R1) 50% (R2) 75% (R3) 100% (R4) 蛋白酶活性 Protease/(U·g−1) 4.61±0.28a 5.26±0.14bc 5.41±0.28c 5.01±0.27b 5.23±0.16bc 淀粉酶活性 Amylase/(U·mg−1) 2.36±0.14d 2.01±0.06c 1.89±0.03b 1.83±0.07ab 1.79±0.03a 脂肪酶活性 Lipase/(U·g−1) 14.77±0.96a 15.49±0.87a 16.80±0.47ab 17.81±0.87b 18.63±0.71c 表 7 饲料蛋粉替代鱼粉对克氏原螯虾血清生化指标的影响
Table 7 Effect of fishmeal replaced with spray-dried egg product on hemolymph biochemical indexes of P. clarkii
项目 Item 替代鱼粉水平 Substitution level of fishmeal 0% (CON) 25% (R1) 50% (R2) 75% (R3) 100% (R4) 谷草转氨酶活性 GOT/(U·L−1) 17.75±1.02 18.25±1.67 17.75±1.95 20.00±1.83 18.50±1.45 谷丙转氨酶活性 GPT/(U·L−1) 24.75±1.93 23.00±1.49 26.75±1.97 24.25±2.90 24.75±1.18 碱性磷酸酶活性 ALP/(U·L−1) 19.00±1.35a 21.25±1.59a 22.00±1.29b 27.00±2.02b 28.50±1.11b 总蛋白质量浓度 TP/(g·L−1) 54.27±1.94a 60.31±2.62a 63.54±2.13b 81.07±4.49b 69.89±2.83b 白蛋白质量浓度 ALB/(g·L−1) 0.42±0.02 0.46±0.02 0.42±0.03 0.51±0.04 0.46±0.02 总胆固醇浓度 T-CHO/(mmol·L−1) 0.12±0.01 0.12±0.03 0.10±0.02 0.11±0.03 0.13±0.01 甘油三酯浓度 TG/(mmol·L−1) 0.45±0.05b 0.30±0.07a 0.30±0.03a 0.39±0.09ab 0.45±0.06b 葡萄糖浓度 GLU/(nmol·mL−1) 0.34±0.04 0.43±0.08 0.39±0.05 0.39±0.05 0.39±0.06 -
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2021中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2021: 34. [2] 徐滨, 魏开金, 马宝珊, 等. 不同克氏原螯虾养殖模式下幼虾生长、体成分和血淋巴生化指标的比较[J]. 淡水渔业, 2021, 51(5): 84-90. doi: 10.3969/j.issn.1000-6907.2021.05.011 [3] 王松刚, 周日东. 淡水小龙虾发病原因及病害防治[J]. 科学养鱼, 2016(8): 92. doi: 10.14184/j.cnki.issn1004-843x.2016.08.059 [4] CARTER C G, MENTE E. Protein synthesis in crustaceans: a review focused on feeding and nutrition[J]. Cent Eur J Biol, 2014, 9(1): 1-10.
[5] 刘琛, 陈继兰. 鸡蛋中蕴藏的生物活性物质及其应用[J]. 中国畜牧兽医, 2009, 36(4): 186-190. [6] LI P, WU G. Composition of amino acids and related nitrogenous nutrients in feedstuffs for animal diets[J]. Amino Acids, 2020, 52(4): 523-542. doi: 10.1007/s00726-020-02833-4
[7] OPRIESSNIG T, XIAO C T, GERBER P F, et al. Porcine epidemic diarrhea virus RNA present in commercial spray-dried porcine plasma is not infectious to naïve pigs[J]. PLoS One, 2014, 9(8): e104766.
[8] LLATA M, GOODBAND R, TOKACH M, et al. Effects of spray-dried egg albumin on growth performance of early-weaned pigs[J]. Kansas Agric Exp Sta Res Rep, 1998(10): 38-40.
[9] CZARNECKI-MAULDEN G L, RUDNICK R C. Development of a successful spray-dried egg white-based experimental diet for dogs: effect of heat treatment on diet utilization[J]. Nutr Res, 1990, 10(1): 109-115. doi: 10.1016/S0271-5317(05)80771-7
[10] 彭迪, 陈效儒, 文华, 等. 饲料脂肪水平对克氏原螯虾亲虾生长性能、肌肉成分、繁殖性能以及血淋巴生化指标的影响[J]. 水产学报, 2019, 43(10): 2175-2185. [11] LU X, PENG D, CHEN X, et al. Effects of dietary protein levels on growth, muscle composition, digestive enzymes activities, hemolymph biochemical indices and ovary development of pre-adult red swamp crayfish (Procambarus clarkii)[J]. Aquac Rep, 2020, 18: 100542.DOI. doi: 10.1016/j.aqrep.2020.100542
[12] 杨文秀, 陈效儒, 文华, 等. 高植物蛋白饲料中添加蛋白酶对克氏原螯虾生长、免疫力及消化力的影响[J]. 水产学报, 2022, 46(6): 1-10. [13] YU L, WEN H, JIANG M, et al. Effects of ferulic acid on intestinal enzyme activities, morphology, microbiome composition of genetically improved farmed tilapia (Oreochromis niloticus) fed oxidized fish oil[J]. Aquaculture, 2020, 528: 735543. doi: 10.1016/j.aquaculture.2020.735543
[14] SONG M, CHE T M, LIU Y, et al. Effects of dietary spray-dried egg on growth performance and health of weaned pigs[J]. J Anim Sci, 2012, 90(9): 3080-3087. doi: 10.2527/jas.2011-4305
[15] 詹黎明, 吴德, 李勇, 等. 饲粮蛋白质来源对仔猪生长性能、肠道形态、血清激素和免疫指标的影响[J]. 动物营养学报, 2010, 22(5): 1192-1199. doi: 10.3969/j.issn.1006-267x.2010.05.011 [16] ZHANG S, PIAO X, MA X, et al. Comparison of spray-dried egg and albumen powder with conventional animal protein sources as feed ingredients in diets fed to weaned pigs[J]. Anim Sci J, 2015, 86(8): 772-781. doi: 10.1111/asj.12359
[17] KUMAR V, SINHA A K, ROMANO N, et al. Metabolism and nutritive role of cholesterol in the growth, gonadal development, and reproduction of crustaceans[J]. Rev Fish Sci Aquac, 2018, 26(2): 254-273. doi: 10.1080/23308249.2018.1429384
[18] 甘信辉, 李伟微, 李嘉尧, 等. 饲料中胆固醇含量对雄性红螯光壳螯虾生长及生殖的影响[J]. 动物学杂志, 2011, 46(1): 86-92. [19] TIAN H, YANG C, YU Y, et al. Dietary cholesterol level affects growth, molting performance and ecdysteroid signal transduction in Procambarus clarkii[J]. Aquaculture, 2020, 523: 735198. doi: 10.1016/j.aquaculture.2020.735198
[20] HAN T, WANG J, LI X, et al. Effects of dietary cholesterol levels on the growth, molt performance, and immunity of juvenile swimming crab, Portunus trituberculatus[J]. Isr J Aquac-Bamidgeh, 2015, 67: 20696.
[21] YUN B, AI Q, MAI K, et al. Synergistic effects of dietary cholesterol and taurine on growth performance and cholesterol metabolism in juvenile turbot (Scophthalmus maximus L. ) fed high plant protein diets[J]. Aquaculture, 2012, 324: 85-91.
[22] DENG J, KANG B, TAO L, et al. Effects of dietary cholesterol on antioxidant capacity, non-specific immune response, and resistance to Aeromonas hydrophila in rainbow trout (Oncorhynchus mykiss) fed soybean meal-based diets[J]. Fish Shellfish Immunol, 2013, 34(1): 324-331. doi: 10.1016/j.fsi.2012.11.008
[23] BHAT Z F, KUMAR S, BHAT H F. Bioactive peptides of animal origin: a review[J]. J Food Sci Technol, 2015, 52(9): 5377-5392. doi: 10.1007/s13197-015-1731-5
[24] 朱青, 徐奇友, 王长安, 等. 丙氨酰-谷氨酰胺对德国镜鲤幼鱼(Cyprinus carpio L. )血清生化指标及体组成的影响[J]. 水产学杂志, 2009, 22(4): 12-15. doi: 10.3969/j.issn.1005-3832.2009.04.003 [25] 许培玉, 周洪琪. 小肽制品对南美白对虾蛋白酶和淀粉酶活力的影响[J]. 中国饲料, 2004(23): 30-31. doi: 10.3969/j.issn.1004-3314.2004.23.013 [26] ZHANG W, YANG Q, TAN B, et al. Study of the requirements of dietary cholesterol at two different growth stages of Pacific white shrimps, Litopenaeus vannamei[J]. Aquac Int, 2019, 27(6): 1583-1597. doi: 10.1007/s10499-019-00411-4
[27] 荣华, 夏优, 王晓雯, 等. 饲料中添加脯氨酸对浅色黄姑鱼生长、体组成及抗氧化能力的影响[J]. 上海海洋大学学报, 2023, 32(1): 89-97. [28] 冯光志, 邹颜霓, 王月琳, 等. 小龙虾肠道产木聚糖酶细菌的分离与鉴定[J]. 微生物学通报, 2019, 46(6): 1364-1370. doi: 10.13344/j.microbiol.china.180699 [29] ZHANG Y, LI Z, KHOLODKEVICH S, et al. Effects of cadmium on intestinal histology and microbiota in freshwater crayfish (Procambarus clarkii)[J]. Chemosphere, 2020, 242: 125105. doi: 10.1016/j.chemosphere.2019.125105
[30] 韩岗, 马婧, 陶士珩, 等. 厚壁菌门细菌及其祖先蛋白的氨基酸偏好性研究[J]. 安徽农业科学, 2011, 39(30): 18408-18410. doi: 10.3969/j.issn.0517-6611.2011.30.009 [31] TAYLOR J A, SICHEL S R, SALAMA N R. Bent bacteria: a comparison of cell shape mechanisms in proteobacteria[J]. Annu Rev Microbiol, 2019, 73(1): 457-480. doi: 10.1146/annurev-micro-020518-115919
[32] LI H D, TIAN X L, DONG S L. Growth performance, non-specific immunity, intestinal histology and disease resistance of Litopenaeus vannamei fed on a diet supplemented with live cells of Clostridium butyricum[J]. Aquaculture, 2019, 498: 470-481. doi: 10.1016/j.aquaculture.2018.09.003
[33] 陈志红, 王明兹, 陈必链, 等. 溶杆菌属及其活性物质研究与应用进展[J]. 农产品加工: 创新版(中), 2013, 304(1): 5-10. [34] 陆德胜. 链球菌属的特性及其检验[J]. 中国当代医药, 2010, 17(31): 80-81. doi: 10.3969/j.issn.1674-4721.2010.31.049 [35] 祝璟琳, 李大宇, 邹芝英, 等. 奥尼罗非鱼及其亲本感染无乳链球菌后生理响应变化[J]. 水生生物学报, 2021, 45(6): 1190-1200. [36] 赵卫红, 张凤英, 於叶兵, 等. 停乳链球菌对日本沼虾总超氧化物歧化酶活性的影响[J]. 生物技术通报, 2015, 31(1): 209-213. [37] YEH S P, CHEN Y N, HSIEH S L, et al. Immune response of white shrimp, Litopenaeus vannamei, after a concurrent infection with white spot syndrome virus and infectious hypodermal and hematopoietic necrosis virus[J]. Fish Shellfish Immunol, 2009, 26(4): 582-588. doi: 10.1016/j.fsi.2008.09.010
[38] FEDDE K N, BLAIR L, SILVERSTEIN J, et al. Alkaline phosphatase knock-out mice recapitulate the metabolic and skeletal defects of infantile hypophosphatasia[J]. J Bone Miner Res, 2010, 14(12): 2015-2026.
[39] ROZGA J, PIĄTEK T, MAŁKOWSKI P. Human albumin: old, new, and emerging applications[J]. Ann Transpl, 2013, 18(20): 205-217.
[40] KUMARAN T, THIRUMALAIKUMAR E, LELIN C, et al. Physicochemical properties of anti Vibrio harveyi egg yolk antibody (IgY) and its immunological influence in Indian white shrimp Fenneropenaeus indicus[J]. Fish Shellfish Immunol, 2018, 74: 349-362. doi: 10.1016/j.fsi.2017.12.062
[41] 王坛, 华雪铭, 朱伟星, 等. 饲料中添加溶菌酶对吉富罗非鱼生长, 免疫-抗氧化功能及血清抗菌性能的影响[J]. 水生生物学报, 2016, 40(4): 663-671. doi: 10.7541/2016.89 [42] 李岳华. RANTES基因多态性与中国汉族人群大动脉炎的关联研究及鱼类食用与心衰发生率, 鸡蛋的食用与心血管病、糖尿病风险的荟萃分析[D]. 北京: 北京协和医学院, 2013: 63-84. -
期刊类型引用(11)
1. 唐海梦,赵露,王昊林,方鵾鹏,王宏伟. 外来入侵海洋红藻——具孔斯帕林藻的早期发育、生活史及环境因子对其生长发育的影响. 水生生物学报. 2025(03): 67-74 .  百度学术
百度学术
2. 陈胜军,刘欢,杨少玲,杨贤庆,戚勃,胡晓. 舌状蜈蚣藻多糖提取工艺及抗氧化活性分析. 上海海洋大学学报. 2020(01): 153-160 .  百度学术
百度学术
3. 陈素文,冯彬,李婷,张博,朱长波,杨贤庆. 蜈蚣藻属生物学与养殖研究进展. 南方水产科学. 2019(01): 119-123 .  本站查看
本站查看
4. 冯彬,李婷,张博,朱长波,苏家齐,陈素文,杨贤庆. 广东汕头南澳和福建东山浮筏的蜈蚣藻属调查. 南方水产科学. 2019(05): 48-54 .  本站查看
本站查看
5. 马欠,邓春暖,郭锋锋. 温度对小球藻和铜绿微囊藻生长及叶绿素荧光特性的影响. 中州大学学报. 2018(04): 108-112 .  百度学术
百度学术
6. 刘欢,陈胜军,杨贤庆,戚勃,李春生. 舌状蜈蚣藻营养成分分析与品质评价. 南方水产科学. 2018(06): 99-104 .  本站查看
本站查看
7. 陈素文,张文文,郭永坚,朱长波,李俊伟,颉晓勇,陈利雄. 水流和光照条件对舌状蜈蚣藻Grateloupia livida(Harv)Yamad果孢子萌发生长的影响. 渔业科学进展. 2017(06): 112-118 .  百度学术
百度学术
8. 姜朋,赵树雨,李芳,王宏伟. 单条胶黏藻(Dumontia simplex Cotton)孢子早期发育及其生活史的研究. 海洋与湖沼. 2016(01): 151-157 .  百度学术
百度学术
9. 贾潇博,姜朋,周汝金,关云,王宏伟. 大连蜈蚣藻孢子发育及生活史的研究. 海洋科学. 2016(10): 25-32 .  百度学术
百度学术
10. 曹翠翠,赵凤琴,郭少茹,王宏伟. 主要环境因子对细弱蜈蚣藻(Grateloupia tenuis)孢子发育的影响及生活史的研究. 海洋与湖沼. 2015(02): 298-304 .  百度学术
百度学术
11. 王宏伟,李雅卓,曹翠翠,邓璐. 亚洲蜈蚣藻(Grateloupia asiatica Kawaguchi et Wang)孢子发育及生活史的研究. 辽宁师范大学学报(自然科学版). 2014(02): 246-251 .  百度学术
百度学术
其他类型引用(5)



 下载:
下载:





 粤公网安备 44010502001741号
粤公网安备 44010502001741号
