Effects of acidification stress on antioxidant and immunity in juvenile yellowfin tuna (Thunnus albacares)
-
摘要:
大气中过多的二氧化碳 (CO2) 被海水吸收后形成碳酸,增加了海水的酸度。探究海水酸化对黄鳍金枪鱼 (Thunnus albacares) 幼鱼抗氧化和免疫能力的影响,以为海洋生态环境和金枪鱼野生种群保护提供参考。以平均体长 (18.21±1.09) cm、平均体质量 (354.98±149.77) g的黄鳍金枪鱼幼鱼为研究对象,设定pH梯度为8.1、7.6、7.1和6.6,采用静水停食法,测定肝、鳃、红肌和皮肤中的丙二醛 (MDA) 含量以及超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)、谷胱甘肽过氧化物酶 (GSH-Px)、过氧化物酶 (POD)、酸性磷酸酶 (ACP)、碱性磷酸酶 (AKP) 和溶菌酶 (LZM) 的活性。结果显示:48 h后,pH 6.6处理组的幼鱼出现死亡。除对照组外,鳃中SOD、CAT、POD和LZM的活性均高于其他组织 (P<0.05),SOD、CAT、POD的活性在pH 7.1时达到峰值,LZM的活性在pH 6.6时达到峰值;皮肤的GSH-Px活性高于其他组织 (P<0.05),在pH 7.1时达到峰值;肝的MDA含量累积最多,ACP活性最高 (P<0.05),前者在pH 6.6时达到峰值,后者在pH 8.1时达到峰值;红肌的AKP活性显著低于其他组织 (P<0.05),且在pH 7.1时达到最低。综上所述,黄鳍金枪鱼幼鱼在海水pH大于7.1时,免疫功能和抗氧化防御系统存在一定的抵抗力,pH小于7.1之后,部分免疫功能出现紊乱。
Abstract:Excess carbon dioxide in atmosphere is absorbed by seawater and then form carbonic acid, which increases seawater acidity. To investigate the effects of seawater acidification on antioxidant and immunity in juvenile yellowfin tuna (Thunnus albacares), and to provide references for the protection of marine ecosystems and wild stocks of tuna, we took juvenile yellowfin tuna [Average body length of (18.21±1.09) cm and average body mass of (354.98±149.77) g] as research subjects, and set the pH gradients of 8.1, 7.6, 7.1 and 6.6 to determine the malondialdehyde (MDA), superoxide dismutase (SOD), catalase (CAT), glutathione peroxidase (GSH-Px), peroxidase (POD), acid phosphatase (ACP), alkaline phosphatase (AKP) and lysozyme (LZM) activities. The results show that after 48 h, the juveniles in pH 6.6 group showed mortality. Except for the control group, the activities of SOD, CAT, POD and LZM in gills were higher (P<0.05) than those of the other tissues, with the activities of SOD, CAT and POD peaking at pH 7.1, and the LZM activity peaking at pH 6.6; the GSH-Px activity in skin was higher than that in the other tissues (P<0.05), peaking at pH 7.1. In the liver, the MDA content was the most accumulated and the ACP activity was the highest (P<0.05), with the former peaking at pH 6.6 and the latter peaking at pH 8.1; the AKP activity in red muscle was significantly lower than that in the other tissues (P<0.05), reaching its lowest level at pH 7.1. The results show that there is some resistance of immune function and antioxidant defense system in juvenile yellowfin tuna when seawater pH is above 7.1, but has partial immune dysfunction when pH is lower than 7.1.
-
Keywords:
- Thunnus albacares /
- pH /
- Seawater acidification /
- Immune function /
- Antioxidant defense system
-
黄鳍金枪鱼 (Thunnus albacares) 隶属于鲭科、金枪鱼属,是一种喜集群的大洋性洄游鱼类,因背鳍、臀鳍及小鳍同为橘黄色,又名黄鳍鲔[1]。广泛分布于太平洋、大西洋、印度洋的热带和亚热带海域[2]。众所周知,金枪鱼具有生长速度快、粗蛋白和不饱和脂肪酸含量高的特点,深受消费者喜爱[3]。金枪鱼的丰度还可以支持珊瑚礁、沿海渔业和海水养殖等产业的可持续开发和利用[4]。其种群是组成远洋生态系统的关键部分,也是世界上最大和最有价值的渔业之一[5]。
对水生动物来说,pH是一个重要的环境因子,其极细微的变化也会产生深远影响[6];从而引起生态系统内一系列的化学变化,影响大多数水产生物的生长、繁殖、代谢与生存[7]。当水体pH下降到一定程度,超过机体的最大调控范围,就会出现细胞内酸中毒和环境高碳酸血症[8]。二氧化碳 (CO2)排放过量引起的海洋酸化改变了海洋环境,扰乱了海洋动物机体的新陈代谢、酸碱平衡和生物体内多种酶的活性[9]。有研究表明,水体酸化会使金头鲷 (Sparus aurata) 的抗氧化能力受到抑制[10];过酸的养殖水体会显著影响脊尾白虾 (Exopalaemon carinicauda) 的非特异性免疫力[11];酸化导致了青鳉 (Oryzias melastigm) 幼鱼脂质代谢紊乱[12];严重的酸化条件与舌齿鲈 (Dicentrarchus labrax) 显著升高的最大代谢率有关[13];海洋酸化会导致金枪鱼的生物量减少[14]。
大气中过多的CO2被海水吸收后形成碳酸,增加了海水酸度,然而少有酸化胁迫对黄鳍金枪鱼幼鱼生理特性影响的报道。随着捕捞量的增加,金枪鱼的资源量急剧下降,无法满足市场需求。本研究通过测定相关酶活性,评估海水酸化胁迫对黄鳍金枪鱼幼鱼抗氧化防御系统和免疫功能的影响,为海洋生态环境和金枪鱼野生种群的保护提供参考。
1. 材料与方法
1.1 实验材料
黄鳍金枪鱼幼鱼平均体长为 (18.21±1.09) cm、平均体质量为 (354.98±149.77) g,由中国水产科学研究院南海水产研究所热带水产研究开发中心提供。实验用水为砂滤后的自然海水,水温 (22.5±1.0) ℃,溶解氧质量浓度 (7.5±0.5) mg·L−1,盐度 (33.00±0.80)‰,氨氮质量浓度 <0.05 mg·L−1,亚硝酸盐质量浓度 <0.05 mg·L−1。
1.2 实验设计
正式实验开始前,先将金枪鱼幼鱼在驯养池中暂养7 d,期间投喂冰鲜杂鱼。随机挑选72尾行为活泼、体表健康的幼鱼,在直径和水深均为1.5 m的圆形钢化桶中进行48 h的酸化胁迫实验,暂养期间与正式实验期间水质保持一致。实验共设置4组,以自然海水pH 8.1为对照组,pH 7.6、7.1、6.6为实验组,每组设3个重复,每个重复6尾鱼。实验期间金枪鱼幼鱼处于停食状态。并通过1.0 mmol·L−1的氢氧化钠 (NaOH) 溶液或1.0 mmol·L−1的盐酸 (HCl) 溶液调节海水pH。使用pH分析仪 (PH848) 测定海水酸度,每2 h矫正1次,使pH变化幅度保持在 ±0.1。实验至第48小时,统计死亡的幼鱼数量 (以鱼体侧躺、沉入水底不再游动为准),计算成活率。
1.3 样品采集与处理
实验结束后每组随机选取6尾黄鳍金枪鱼幼鱼,经丁香酚麻醉后进行解剖,解剖全程在冰盒上进行。分别采集肝、鳃、红肌、皮肤组织于2 mL无菌冻存管中,置于液氮中冷冻,之后保存在−80 ℃冰箱中用于后续免疫和代谢酶的测定。准确称取组织0.1~0.2 g,加入9倍体积的0.9% (w) 盐水,冰水浴条件下机械匀浆后,3 000 r·min−1离心10 min,取上清液测定相关酶活性和总蛋白含量。选取丙二醛 (MDA) 为抗氧化物质的标志物;超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)、谷胱甘肽过氧化物酶 (GSH-Px) 和过氧化物酶 (POD) 作为抗氧化防御系统的标志物;酸性磷酸酶 (ACP)、碱性磷酸酶 (AKP)、溶菌酶 (LZM) 作为免疫系统的标志物。上述所有检测均使用南京建成生物工程研究所试剂盒,所有指标的测定严格按照说明书进行操作。采用酶标仪 (SYNERGY-HT) 或分光光度计 (UV-1800BPC) 测定各项指标。
1.4 数据处理
采用Excel 2010软件整理数据,以“平均值±标准差 ($\overline { x}\pm s $) ”表示 (n=3)。实验结果通过SPSS 25.0软件进行单因素方差分析 (One-way ANOVA),并用邓肯检验法分析组间差异性,显著性水平α为0.05。使用Origin 2022软件作图。
2. 结果
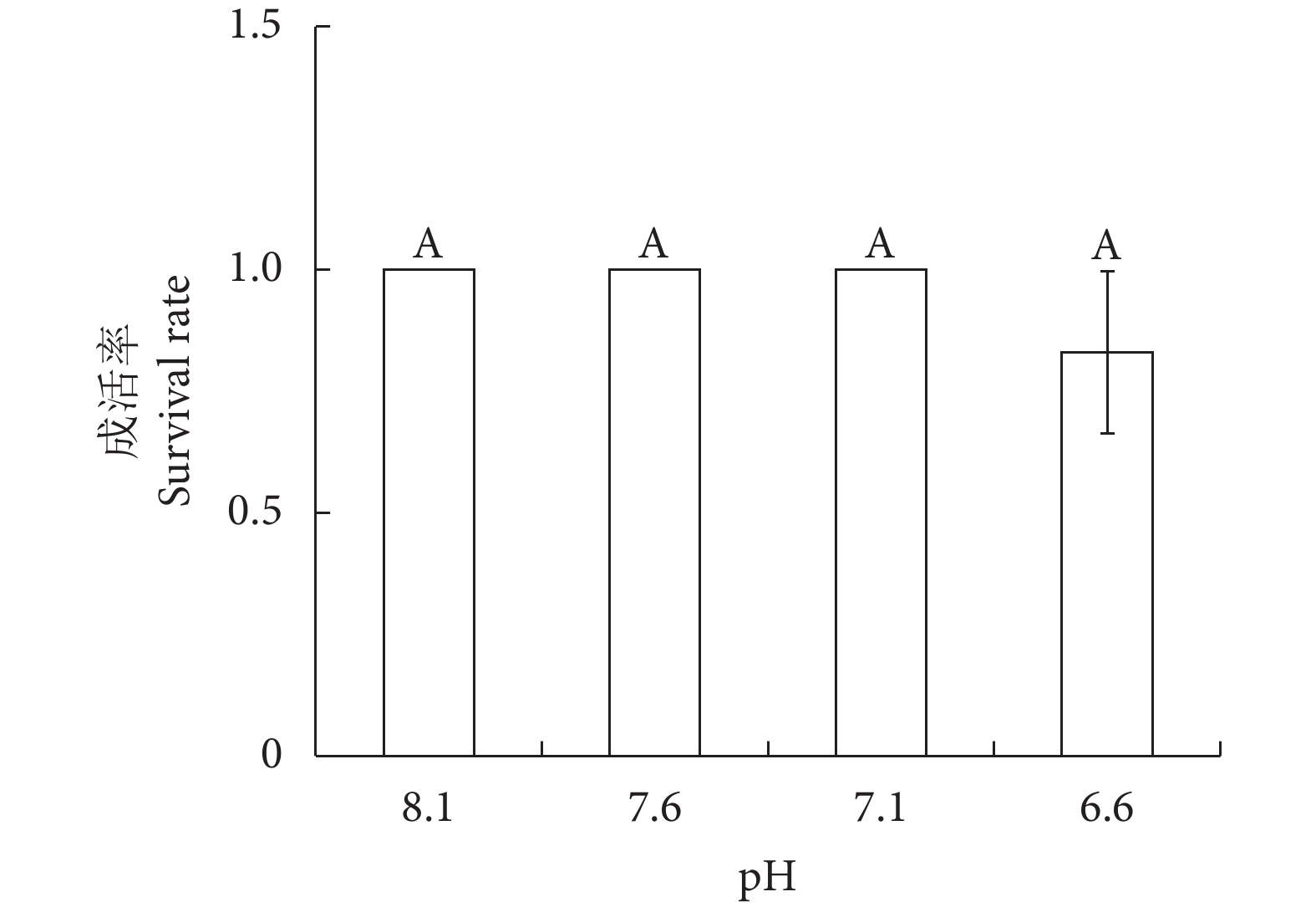
实验至第48小时,仅pH 6.6处理组的幼鱼出现死亡,成活率为83%。各组之间无显著性差异 (P>0.05,图1)。
2.1 酸化胁迫对黄鳍金枪鱼幼鱼抗氧化能力的影响
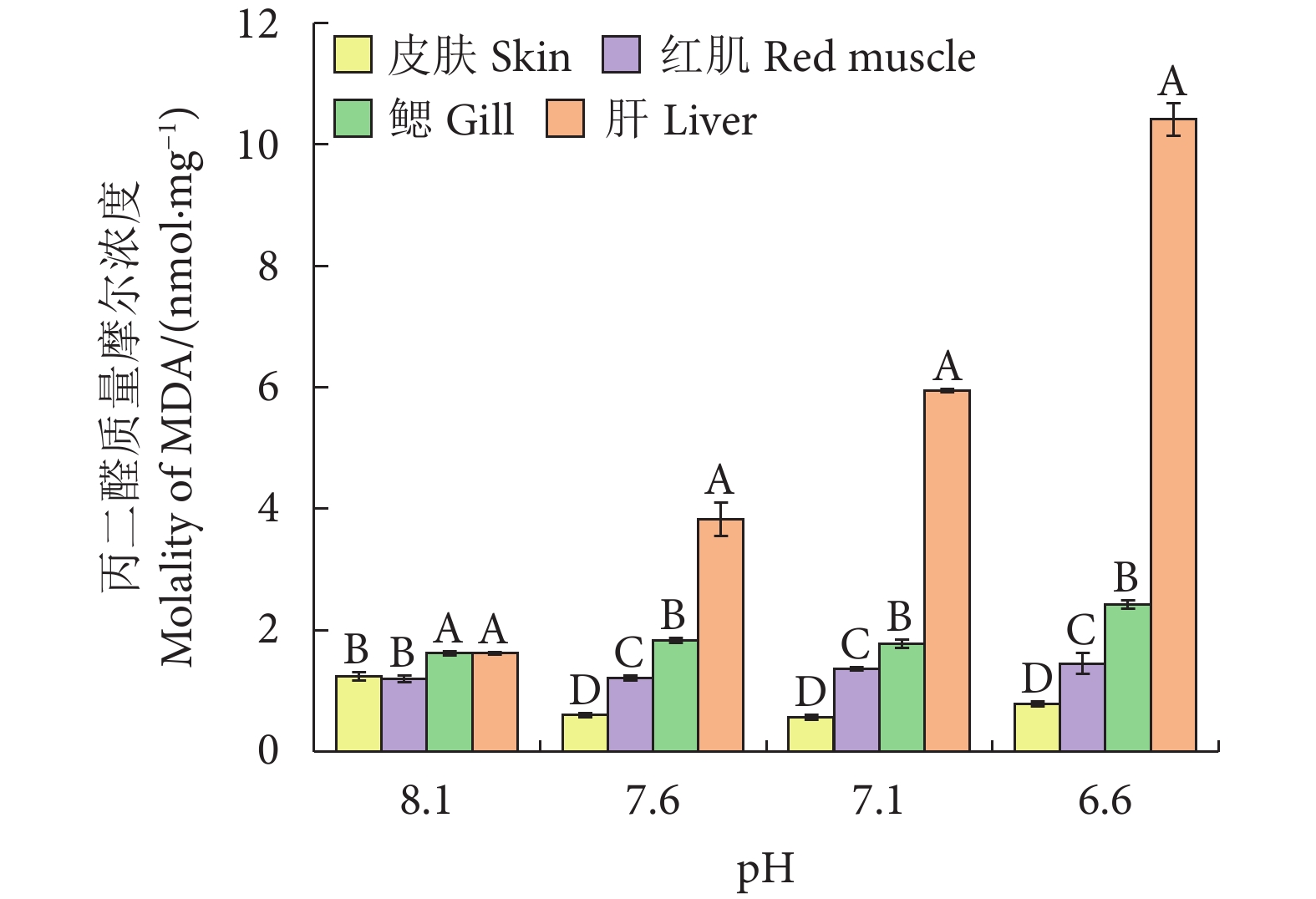
与对照组相比,各实验组皮肤的MDA含量均有所下降,红肌和鳃的MDA含量均有所上升。除对照组外,相同pH下肝脏中的MDA含量均显著高于其他组织 (P<0.05),且随着pH的降低呈上升趋势,在pH 6.6时含量最高 (图2)。
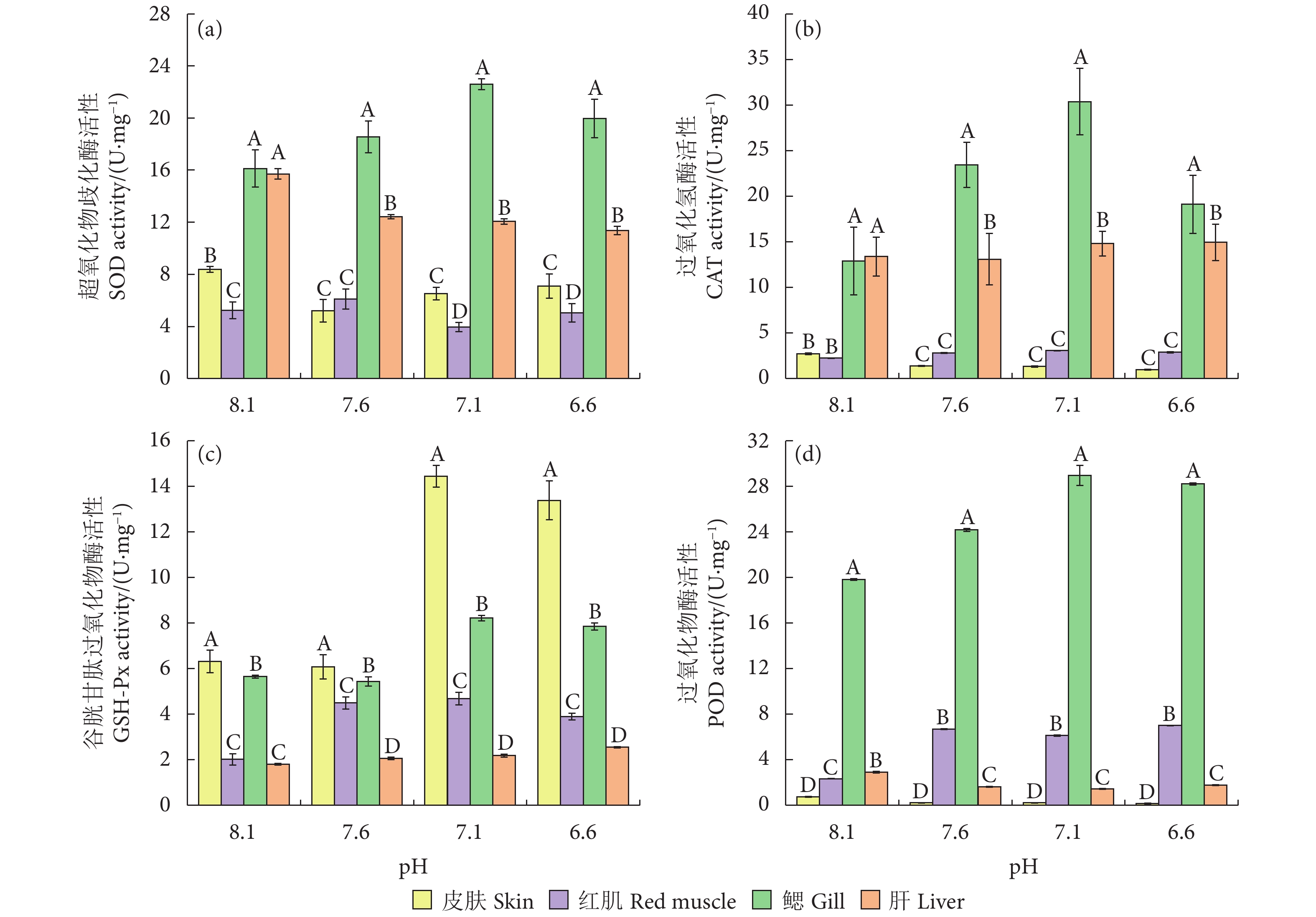
随着pH的降低,皮肤中的SOD活性呈先下降再上升的趋势,肝中的SOD活性呈下降趋势,二者均在pH 8.1时达到最高。红肌中的SOD活性在pH 7.6时最高。鳃中的SOD活性在pH 7.1时达到最高,且随着pH的降低呈先上升后下降的趋势;除对照组外,相同pH下鳃中的SOD活性均显著高于其他组织 (P<0.05,图3-a)。
![]() 图 3 酸化胁迫对黄鳍金枪鱼幼鱼超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和过氧化物酶活性的影响注:相同pH下不同字母表示不同组织间差异显著 (P<0.05)。Figure 3. Effects of acidification stress on SOD, CAT, GSH-Px and POD activities of juvenile yellowfin tunaNote: Different letters represent significant differences among different tissues with the same pH (P<0.05).
图 3 酸化胁迫对黄鳍金枪鱼幼鱼超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和过氧化物酶活性的影响注:相同pH下不同字母表示不同组织间差异显著 (P<0.05)。Figure 3. Effects of acidification stress on SOD, CAT, GSH-Px and POD activities of juvenile yellowfin tunaNote: Different letters represent significant differences among different tissues with the same pH (P<0.05).随着pH的降低,皮肤中的CAT活性呈下降趋势,在pH 8.1时活性最高。鳃和红肌中的CAT活性呈先上升再下降的趋势,在pH 7.1时达到最高;除对照组外,相同pH下鳃中的CAT活性均显著高于其他组织 (P<0.05)。肝中的CAT活性变化平稳,在pH 6.6时达到最高。相同pH下,肝和鳃中的CAT活性均显著高于皮肤和红肌 (P<0.05,图3-b)。
随着pH的降低,皮肤、红肌和鳃中的GSH-Px活性变化相似,均呈先上升后下降的趋势,且均在pH 7.1时达到最高,此时皮肤中的GSH-Px活性显著高于其他组织 (P<0.05)。肝中的GSH-Px活性呈上升趋势,在pH 6.6时达到最高 (图3-c)。
随着pH的降低,皮肤中的POD活性呈下降趋势,在pH 8.1时活性最高。红肌中各实验组的POD活性均高于对照组,在pH 6.6时达到最高。鳃中的POD活性呈先上升后下降的趋势,在pH 7.1时达到最高;相同pH下鳃中的POD活性均显著高于其他组织 (P<0.05)。肝中的POD活性呈先下降再上升的趋势,在pH 8.1时活性最高。除对照组外,相同pH下红肌和鳃中的POD活性均显著高于皮肤和肝 (P<0.05,图3-d)。
2.2 酸化胁迫对黄鳍金枪鱼幼鱼免疫酶活性的影响
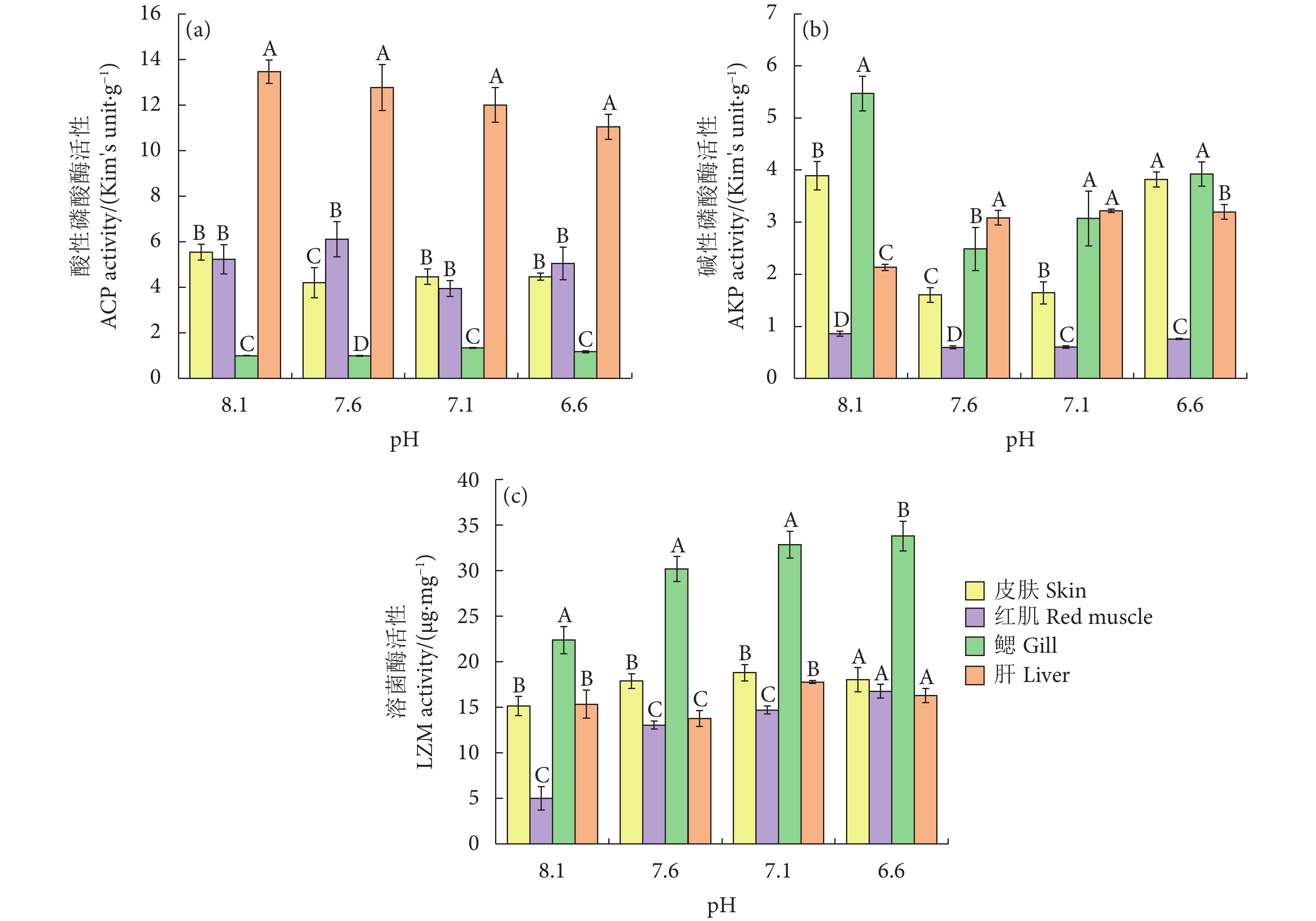
随着pH的降低,肝和皮肤各实验组的ACP活性与对照组相比均有所下降;相同pH下肝中的ACP活性均显著高于其他组织 (P<0.05)。红肌中的ACP活性呈先上升后下降再上升的趋势,在pH 7.6时达到最高;鳃中的ACP活性呈先上升后下降的趋势,在pH 7.1时达到最高。相同pH下鳃中的ACP活性均显著低于其他组织 (P<0.05,图4-a)。
随着pH的降低,鳃、红肌和皮肤中的AKP活性呈先下降后上升的趋势,均在pH 8.1时最高。肝中的AKP活性呈上升趋势,在pH 7.1时达到最高。相同pH下红肌中的AKP活性均显著低于其他组织 (P<0.05,图4-b)。
随着pH的降低,皮肤中的LZM活性呈先上升后下降的趋势,在pH 7.1时达到最高。鳃和红肌中的LZM活性呈上升趋势,均在pH 6.6时达到最高;相同pH下鳃中的LZM活性均显著高于其他组织 (P<0.05)。肝中的LZM活性在pH 7.1时达到最高 (图4-c)。
3. 讨论
3.1 环境胁迫对水产动物不同组织抗氧化能力的影响
MDA是脂质过氧化的重要产物[15],反映机体受氧化损伤的程度[16],其含量随着机体氧化应激水平升高而增加,含量越高表明鱼体所受的压力越大[17]。肝脏有排泄、解毒等多种功能,可清除外来有害物质和机体产生的有害废物[18];且含有大量与免疫相关的细胞,具有重要的免疫调节功能,在机体的免疫应答中发挥重要作用[19]。本研究中肝脏的MDA含量随海水酸度升高呈上升趋势,且累积含量显著高于其他组织。可能是由于金枪鱼处于应激状态,体内产生大量的活性氧自由基,脂质过氧化水平升高,机体出现了氧化损伤,与克氏原螯虾 (Procambarus clarkii)[20]的结果相似。
SOD和CAT活性的变化可在一定程度上反映出机体受环境胁迫时免疫机能的变化[21]。GSH-Px在清除过氧化氢 (H2O2)、把脂质过氧化物还原成无毒产物方面起着至关重要的作用[22],其与CAT在清除自由基方面既是互补也是竞争关系[23]。SOD、CAT和GSH-Px协同作用,是抗氧化系统的重要组成部分[24]。POD和生物应激相关,可水解H2O2,对细胞起保护作用[25]。
鳃是鱼类主要的呼吸和免疫器官,表面积大且与水体直接接触,易受有害物质伤害[26];其黏膜中含有丰富的免疫分子,在抵御外界侵袭中发挥重要作用[27]。本研究中,各处理组鳃中的SOD、CAT和POD活性显著高于其他组织,且在pH 7.1时达到最高。说明酸性胁迫下金枪鱼组织中的活性氧自由基含量升高,诱导SOD、CAT和POD的活性升高,鱼体通过激活抗氧化酶系统促进蛋白质合成,改善代谢产物,保护细胞不受损伤,从而使鱼体能够适应低pH环境,达到新的动态平衡。但水体酸度过高时,鱼体会产生过量的氧自由基 (·O2−),机体无法产生足够的SOD和CAT来清除 ·O2−,且动物机体在受到环境胁迫时,SOD和CAT可能会发生抑制的应激变化[28],因此本研究鳃中的CAT活性在pH 6.6时有所回落。与沙塘鳢 (Odontobutis potamophila)[29]、瓦氏黄颡鱼 (Pelteobagrus vachelli)[30]和方斑东风螺 (Babylonia areolata)[31]的研究结果相似。
鱼类皮肤的腺层内含有丰富的腺细胞,分泌的黏液中含有丰富的免疫因子,如溶菌酶、补体类物质等[32],构成了机体的第一道防线[33]。本研究中,皮肤的GSH-Px活性在pH 7.1时达到最高,显著高于其他组织,而CAT活性低于其他组织,可能是由于H2O2没有被CAT及时分解,诱导机体生成更多的GSH-Px来清除多余的H2O2。GSH-Px的活性升高,谷胱甘肽 (GSH) 等抗氧化物质就会消耗过大,可能导致机体受到损伤[34]。本研究中皮肤的GSH-Px活性在pH 7.1时大幅上升,推测此时鱼体无法适应过酸的海水,机体出现了损伤。与尖吻鲈 (Lates calcarifer) 幼鱼[35]和点篮子鱼 (Siganus guttatus) 幼鱼[36]的表现类似。
3.2 环境胁迫对水产动物不同组织免疫酶的影响
磷酸酶又称正磷酸单酯水解酶,可以催化各种含磷化合物的水解,根据他们的特性 (即起催化作用的最适pH),可分为ACP和AKP两类[37],前者主要起催化效果,后者主要起调理和调节的作用[38]。当水体中溶解氧含量低于正常水平时,鱼体发生应激反应,并通过提高AKP和ACP的活性来增强非特异性免疫力[39]。
本研究中,肝脏的ACP活性显著高于其他组织,且随着pH的降低呈下降趋势;但AKP活性呈上升趋势,可能因为二者在肝脏中的作用不同。分析出现上述结果的原因,可能是海水酸度过高,机体为了维持酸碱和离子平衡而采取的一种调节措施,是生物体主动防御的表现。类似的报道还有脊尾白虾[11]和栉孔扇贝 (Chlamys farreri)[21]。鳃中的ACP和AKP变化不一致,可能是此时的环境pH影响了鳃细胞参与免疫的水解酶活性。类似的结果还见于翘嘴鳜 (Siniperca chuatsi) 幼鱼[40]和缢蛏 (Sinonovacula constricta) 成贝[41]。
LZM是衡量鱼类非特异性免疫的指标之一[42],在面对外界环境胁迫时,其活性会升高[43],活性越强,机体的非特异性免疫力就越强[44]。鳃中的LZM活性显著高于其他组织,且随海水酸度的升高呈上升趋势。可能是由于海水酸度的增加使金枪鱼处于应激状态,鱼体通过增加LZM的活性以抵抗外源环境的压力,属于自身的应急保护反应。
4. 结论
本研究通过设置4组酸化梯度 (pH 8.1、7.6、7.1、6.6) 对黄鳍金枪鱼幼鱼进行48 h的环境胁迫,结果显示,酸化胁迫对黄鳍金枪鱼幼鱼的免疫功能和抗氧化防御系统影响显著。抗氧化物质在pH 6.6时达到最高;抗氧化酶的活性多数在pH 7.1时达到最高;非特异性免疫酶变化不一,不同酶的活性因组织不同而呈类似或不同的变化趋势。提示黄鳍金枪鱼幼鱼在pH大于7.1的酸化环境中有一定的调节能力,pH小于7.1时免疫系统发生紊乱。整体而言,肝脏和鳃中的酶活性高于红肌和皮肤,这表明在面对海水酸度升高时,肝脏和鳃中的抗氧化酶和免疫酶能更好地表达,二者抗氧化酶和免疫酶的变化可以代表黄鳍金枪鱼幼鱼机体免疫功能和抗氧化防御系统的变化。
-
图 3 酸化胁迫对黄鳍金枪鱼幼鱼超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和过氧化物酶活性的影响
注:相同pH下不同字母表示不同组织间差异显著 (P<0.05)。
Figure 3. Effects of acidification stress on SOD, CAT, GSH-Px and POD activities of juvenile yellowfin tuna
Note: Different letters represent significant differences among different tissues with the same pH (P<0.05).
-
[1] 张勇, 石琼, 范明君, 等. 中国经济鱼类志[M]. 武汉: 华中科技大学出版社, 2015: 384-368. [2] 吴洽儿, 马振华, 于刚, 等. 金枪鱼人工养殖与加工[M]. 北京: 中国农业出版社, 2022: 10-15. [3] 周胜杰, 杨蕊, 于刚, 等. 美济礁附近海域3种金枪鱼肌肉成分检测与营养评价[J]. 南方水产科学, 2021, 17(2): 51-59. doi: 10.12131/20200229 [4] BELL J D, GANACHAUD A, GEHRKE P C, et al. Mixed responses of tropical Pacific fisheries and aquaculture to climate change[J]. Nat Clim Change, 2013, 3(6): 1-8.
[5] HAVICE E. The structure of tuna access agreements in the Western and Central Pacific Ocean: lessons for vessel day scheme planning[J]. Mar Policy, 2010, 34(5): 979-987.
[6] ORR J C, FABRY V J, AUMONT O, et al. Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms[J]. Nature, 2005, 437(7059): 681-686.
[7] 唐启升, 陈镇东, 余克服, 等. 海洋酸化及其与海洋生物及生态系统的关系[J]. 科学通报, 2013, 58(14): 1307-1314. [8] 丁兆坤, 王福平, 许友卿. 海水酸化对海洋生物代谢的影响及机理[J]. 水产科学, 2015, 34(5): 331-334. [9] 许友卿, 唐旎, 丁兆坤. 海水酸化对水生动物主要抗氧化酶的影响及机理[J]. 水产科学, 2016, 35(4): 453-458. [10] FEIDANTSIS K, PÖRTNER H O, ANTONOPOULOU E, et al. Synergistic effects of acute warming and low pH on cellular stress responses of the gilthead seabream Sparus aurata[J]. J Comp Physiol B, 2015, 185(2): 197-202.
[11] 李玉全. pH胁迫对脊尾白虾代谢酶活力的影响[J]. 南方农业学报, 2014, 45(6): 1098-1101. doi: 10.3969/j:issn.2095-1191.2014.6.1098 [12] SUN L B, RUAN J P, LU M C, et al. Combined effects of ocean acidification and crude oil pollution on tissue damage and lipid metabolism in embryo-larval development of marine medaka (Oryzias melastigma)[J]. Environ Geochem Health, 2019, 41(4): 1847-1860.
[13] CRESPEL A, ANTTILA K, LELIÈVRE P, et al. Long-term effects of ocean acidification upon energetics and oxygen transport in the European sea bass (Dicentrarchus labrax, Linnaeus)[J]. Mar Biol, 2019, 166(9): 116.
[14] SIMON N, PATRICK L, INNA S, et al. Ocean futures for the world's largest yellowfin tuna population under the combined effects of ocean warming and acidification[J]. Front Mar Sci, 2022, 9: 816722.
[15] 彭士明, 施兆鸿, 高权新, 等. 增加饲料中VC质量分数对银鲳血清溶菌酶活性及组织抗氧化能力的影响[J]. 南方水产科学, 2013, 9(4): 16-21. doi: 10.3969/j.issn.2095-0780.2013.04.003 [16] 武阳, 常青, 杨旭. 不同浓度甲醛致大鼠肝细胞DNA氧化损伤作用[J]. 环境科学学报, 2009, 29(11): 2415-2419. [17] 丁小, 赵云龙, 李艳娇, 等. 急性温度胁迫对花鳅抗氧化酶活性及丙二醛含量的影响[J]. 江西水产科技, 2021(6): 14-17. [18] 罗智文, 董志祥, 林连兵, 等. 鱼类重要免疫器官抗菌机制的研究进展[J]. 水产科学, 2021, 40(4): 624-634. [19] 朱晓闻. 虾青素和维生素C改善豹纹鳃棘鲈生长及免疫应激的调控机制[D]. 湛江: 广东海洋大学, 2022: 8-13. [20] 王海锋, 成永旭, 李京昊, 等. 干露和再入水对克氏原螯虾抗氧化应激能力的影响[J]. 南方水产科学, 2019, 15(5): 69-76. doi: 10.12131/20190059 [21] 樊甄姣, 杨爱国, 刘志鸿, 等. pH对栉孔扇贝体内几种免疫因子的影响[J]. 中国水产科学, 2006, 13(4): 650-654. doi: 10.3321/j.issn:1005-8737.2006.04.022 [22] 崔雯婷. 海水酸化和镉复合胁迫下褐牙鲆 (Paralichthys olivaceus) 仔幼鱼抗氧化防御响应和免疫应答[D]. 北京: 中国科学院大学 (中国科学院海洋研究所), 2020: 68-70. [23] CHATTERJEE N, PAL A K, MANUSH S M, et al. Thermal tolerance and oxygen consumption of Labeo rohita and Cyprinus carpio early fingerlings acclimated to three different temperatures[J]. J Therm Biol, 2004, 29(6): 265-270.
[24] 谢晓泽. 大黄鱼谷胱甘肽过氧化物酶GPx1和GPx4的鉴定及其体外表达研究[D]. 舟山: 浙江海洋大学, 2018: 2-5. [25] 王文配, 韩泠姝, 张向磊, 等. 热胁迫对中间球海胆抗氧化酶活性及线粒体结构与功能的影响[J]. 广东海洋大学学报, 2022, 42(4): 42-48. doi: 10.3969/j.issn.1673-9159.2022.04.005 [26] 吴玲玲, 陈玲, 张亚雷, 等. 菲对斑马鱼鳃和肝组织结构的影响[J]. 生态学杂志, 2007, 26(5): 688-692. doi: 10.3321/j.issn:1000-4890.2007.05.014 [27] 李肖霞, 齐志涛, 迟爽, 等. 硬骨鱼类鳃黏膜免疫相关分子的研究进展[J]. 水产学报, 2023, 47(4): 049401. [28] 文春根, 张丽红, 胡宝庆, 等. pH对背角无齿蚌 (Anodonta woodiana) 5种免疫因子的影响[J]. 南昌大学学报 (理科版), 2009, 33(2): 172-176. [29] 贾秀琪, 张宏叶, 王丽, 等. 低氧胁迫对河川沙塘鳢抗氧化酶及ATP酶活性的影响[J]. 海洋渔业, 2017, 39(3): 307-309. [30] 崔平, 强俊. pH与氨氮对黄颡鱼幼鱼生长与肝脏超氧化物歧化酶的影响[J]. 淡水渔业, 2018, 48(4): 39-44. doi: 10.3969/j.issn.1000-6907.2018.04.006 [31] 丁瑞霞, 黄星美, 赵旺, 等. pH急性胁迫对方斑东风螺行为及免疫酶活性的影响[J]. 渔业现代化, 2022, 49(6): 84-90. doi: 10.3969/j.issn.1007-9580.2022.06.011 [32] 施郁松. 鳜皮肤黏膜免疫系统对环境温度和嗜水气单胞菌灭活疫苗的免疫应答[D]. 上海: 上海海洋大学, 2022: 2-12. [33] 蒋鑫, 潘连德, 马召腾. 松江鲈鱼皮肤的显微和亚显微结构[J]. 动物学杂志, 2012, 47(4): 96-103. [34] 张晨捷, 张艳亮, 高权新, 等. 低盐胁迫对黄姑鱼幼鱼肝脏抗氧化功能的影响[J]. 南方水产科学, 2015, 11(4): 59-64. [35] 陈旭, 左涛, 周胜杰, 等. 饲喂甘草后低盐胁迫对尖吻鲈相关酶活性的影响[J]. 水产科学, 2023, 42(3): 404-412. [36] 宋志明, 刘鉴毅, 庄平, 等. 低温胁迫对点篮子鱼幼鱼肝脏抗氧化酶活性及丙二醛含量的影响[J]. 海洋渔业, 2015, 37(2): 142-150. [37] 厉小波. 铜对瘤背石磺 (Onchidium struma) 成体的毒理学研究[D]. 上海: 华东师范大学, 2008: 41-44. [38] 刘世良, 麦康森. 贝类免疫系统和机理的研究进展[J]. 海洋学报 (中文版), 2003, 25(2): 95-105. [39] 曹新宇, 高铭鸿, 杨旭, 等. 急性低氧胁迫对黄条鰤抗氧化酶和磷酸酶活性的影响[J]. 安徽农业科学, 2022, 50(3): 88-91. [40] 谷心池. 翅嘴鳜 (Siniperca chuatsi) 幼鱼氧化应激和非特异性免疫指标对养殖环境中低氧的响应[D]. 南京: 南京农业大学, 2022: 31-34. [41] CHEN Y H, YE B, NIU D H, et al. Changes in metabolism and immunity in response to acute salinity stress in Chinese razor clams from different regions[J]. Aquac Rep, 2021, 19: 100624.
[42] 张振国, 钱红, 刘克明, 等. 复合免疫增强剂对金鳟非特异性免疫力的影响[J]. 水产学杂志, 2020, 33(1): 10-12. [43] 王艳玲, 赵金良, 赵岩. 环境胁迫对鱼类免疫机制影响的研究进展[J]. 河北渔业, 2020(5): 46-50, 62. doi: 10.3969/j.issn.1004-6755.2020.05.014 [44] 张惠, 曾霖, 熊逸飞, 等. 盐度驯化改善大黄鱼盐度胁迫耐受性的作用机制[J]. 中国水产科学, 2023, 30(3): 334-343.



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
